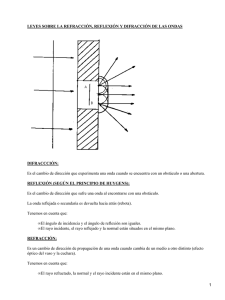
UNIVERSIDAD DE EL SALVADOR FACULTAD DE QUIMICA Y FARMACIA QUIMICA INORGANICA Licenciatura en Química y Farmacia UNIDAD I INTRODUCCION A LA TEORIA CUANTICA OBJETIVO GENERAL: Dominar y diferenciar, matemáticamente las ecuaciones que sustentan la Teoría Cuántica y que las aplique en otras asignaturas de la carrera de Química y Farmacia OBJETIVO ESPECIFICOS: Aplicar la teoría cuántica y su comportamiento químico en el área farmacéutica. Calcular la energía radiante, longitud de onda y frecuencia a partir de los problemas de vida diaria. Explicar la importancia que tiene la unidad en el que hacer farmacéutico. CONTENIDOS TEMATICOS. Teoría Cuántica: Teoría de Bohr. Teoría de Planck. Ecuación de Broglie y su importancia. Ecuación de Schrödinger, expresar el significado de sus partes y su relación con los números cuánticos. Naturaleza de la luz. Efecto fotoeléctrico y los espectros de líneas ACTIVIDADES ACADEMICAS DE LA PRIMERA UNIDAD Actividades Semana Fecha Clases MARTES 1 18-22/feb 2 25/feb-1°/Marzo 3 04-08/marzo Otras actividades JUEVES Bienvenida Unidad I Unidad I Unidad I Discusión Unidad II 1 Jueves examen corto de teoría (20%) Clase 1 LIC. WALTER EDWIN RECINOS RIVERA Químico Farmacéutico [email protected] Modelos atómicos La materia esta compuesta de partículas indivisible llamadas ÁTOMOS Introducción La teoría o mecánica cuántica es una de las ramas principales de la Física y uno de los más grandes avances del siglo XX en el conocimiento humano. Explica el comportamiento de la materia y de la energía. Es todo lo que tiene masa y ocupa un lugar en el espacio. Temperatura Presión Depende Existen en estado Energía La capacidad para realizar trabajo o transferir calor Puede ser E. Cinética E. Potencial La energía que posee un cuerpo debido a su movimiento La energía que posee un objeto debido a su posición, condición o composición Manifestándose en forma de E. Mecánica E. Calórica E. Eléctrica E. Química Aplicaciones A lo largo del año 1900 logró deducir dicha ley de los principios fundamentales de la termodinámica, para lo cual partió de dos suposiciones: La teoría de Ludwig Boltzmann, según la cual el segundo principio de la termodinámica tiene carácter estadístico. Colaboró con Joseph Stefan <<ayudantía docente (entre 1867 y 1869)>> en las investigaciones que llevaba a cabo sobre las pérdidas de energía sufridas por los cuerpos muy calientes. (Viena, 1844 - Decino, 1906) Años después, en 1884, Boltzmann dedujo, a partir de los principios de la termodinámica, la ley empírica de Stefan, formulada en 1879, según la cual la pérdida de energía de un cuerpo radiante es proporcional a la cuarta potencia de su temperatura superficial, y demostró que ésta sólo se cumplía si el cuerpo radiante era un cuerpo negro. Por otro, que el cuerpo negro absorbe la energía electromagnética en cantidades indivisibles elementales, a las que dio el nombre de quanta (cuantos). A un quantun de energía mas tarde se le llamo FOTÓN y Planck encontró que la energía de un fotón es directamente proporcional a la frecuencia de la luz, 𝐄𝐟𝐨𝐭ó𝐧 = 𝒉𝒗 De donde la velocidad de la luz viene dada por: 𝐂 = 𝒗𝝀 Ahora podemos tener la expresión matemática de Energía en termino de la velocidad de la luz. 𝐄𝐟𝐨𝐭ó𝐧 𝒉𝒄 = 𝝀 En 1887, el físico alemán Heinrich Hertz descubrió accidentalmente que la luz ultravioleta modificaba el voltaje al que se producían chispas entre los electrodos metálicos. El alemán Philipp Lenard describió este fenómeno, llamado efecto fotoeléctrico, llegó a dos conclusiones básicas: 1. La energía cinética máxima que pueden alcanzar los electrones emitidos no depende de la intensidad de la radiación incidente. 2. En el efecto fotoeléctrico, la emisión de electrones es instantánea Albert Einstein Albert Einstein (1879-1955) Teoría de la Relatividad Al incidir la onda (radiación) sobre la superficie metálica (limpia), un electrón en reposo absorbe un fotón de energía. 𝐄𝐟𝐨𝐭ó𝐧 = 𝒉𝒗 siendo “𝒗” la frecuencia de la onda y “h” la constante de Planck. Si W es la energía necesaria para extraer al electrón de la superficie metálica, este escaparía de la misma con una energía cinética: 𝟏 𝐄𝒄 = 𝐦𝒗𝟐 = 𝒉𝒗 − 𝒘 𝟐 De esta forma se explican satisfactoriamente las propiedades del efecto fotoeléctrico: I. La energía cinética máxima obtenida depende solo de la frecuencia de la radiación incidente, pero no de su intensidad. En cambio, el número de electrones emitidos es función de la cantidad de fotones incidentes (es decir, de la intensidad de la radiación). II. La emisión de electrones es instantánea, como la transferencia de energía fotón-electrón. Einstein estableció que para que se produzca el efecto fotoeléctrico es necesario superar un valor umbral de frecuencia de la radiación, sea cual sea su intensidad: 𝑾 𝒗𝒖𝒎𝒃𝒓𝒂𝒍 = 𝒉 El efecto fotoeléctrico consiste en la emisión de electrones por un material cuando se lo ilumina con radiación electromagnética (luz visible o ultravioleta, en general). Unidades comunes de longitud de onda para la radiación electromagnética 5ª Conferencia Solvay, Octubre de 1927, sobre mecánica cuántica. (Niels Henrik David Bohr; Copenhague, 1885 - 1962) Físico danés. Considerado como una de las figuras más deslumbrantes de la física contemporánea y por sus aportaciones teóricas y sus trabajos prácticos, como uno de los padres de la bomba atómica. fue galardonado en 1922 con el Premio Nobel de Física "por su investigación acerca de la estructura de los átomos y la radiación que emana de ellos". Cuando el electrón pasa del nivel de energía 2 al nivel 1, se desprende la cantidad de energía que había absorbido, como un solo fotón. La energía de este fotón puede calcularse por la ecuación de Bohr: 𝐄𝐟𝐨𝐭𝐨𝐧 𝟐. 𝟏𝟖𝐱𝟏𝟎−𝟏𝟖 𝐉 𝟐. 𝟏𝟖𝐱𝟏𝟎−𝟏𝟖 𝐉 = 𝐄𝟐 − 𝐄𝟏 = − − − 𝟐 𝐧𝟐 𝐧𝟐𝟏 Sacando factor común y reordenado 𝐄𝟐 − 𝐄𝟏 = 𝑬𝒇𝒐𝒕𝒐𝒏 = 𝟐. 𝟏𝟖𝐱𝟏𝟎−𝟏𝟖 𝐉 𝟏 𝟏 − 𝒏𝟐𝟏 𝒏𝟐𝟐 Aciertos del modelo de BOHR • Permite explicar porque un átomo emite luz de colores específicos o radiaciones electromagnéticas con longitudes de onda especificas • En el átomo la energía esta cuantizada, es decir esta restringida a ciertos valores Fallas del modelo de BOHR • Solo explica el comportamiento para el átomo de hidrogeno o átomos que poseen un solo electrón • Es incorrecto afirmar que los electrones se muevan en orbitas circulares con radios fijos alrededor del núcleo EFECTO FOTOELÉCTRICO Y LOS ESPECTROS DE LINEAS El trabajo de extracción de los electrones en un metal es de 5x10-19 J . Una luz de longitud de onda 375 nm, incide sobre el metal. Calcular: a) La frecuencia umbral b) La Energía Cinética de los electrones extraídos. Datos: h = 6.63 x 10-34 J-s C = 3 x 108 m/s 1nm = 10-9 m 𝝀 = 𝟑𝟕𝟓 nm 𝐖 = 𝟓𝐱𝟏𝟎−𝟏𝟗 𝑱 DATOS a) La frecuencia umbral 𝒗𝒖𝒎𝒃𝒓𝒂𝒍 = 𝑬𝒇 = 𝒉𝒗 𝑾 𝒉 b) La Energía Cinética de los electrones extraídos 𝑬𝑪 = 𝒉𝒗 − 𝒘 𝑬𝒇 = 𝒉𝒄 𝝀 𝐑/= 𝟖𝐱𝟏𝟎𝟏𝟒 𝒔−𝟏 ≡ 𝑯𝒛 𝐄𝐟 = 𝒉𝒗 𝑬𝑪 = 𝑬𝒇 − 𝒘 𝐑/= 𝟑𝐱𝟏𝟎−𝟐𝟎 𝑱 Clase 2 LIC. WALTER EDWIN RECINOS RIVERA Profesor Universitario – Químico Farmacéutico REPASO CLASE 1 Mecánica cuántica Mecánica clásica El efecto fotoeléctrico consiste en la emisión de electrones por un material cuando se lo ilumina con radiación electromagnética (luz visible o ultravioleta, en general). Espectro de absorción y emisión del Sodio Espectro de absorción y emisión del Hidrogeno Sobre una superficie de potasio situada en el vacío incide luz amarilla (λ = 5.89 x10-7 m) produciendo emisión fotoeléctrica. a) ¿Que trabajo se requiere para arrancar un electrón de la capa mas externa? b) ¿Qué energía cinética tiene los electrones expulsados de la superficie del metal? c) ¿Cual será su velocidad? Dato: λ umbral para el potasio = 7100 𝐴 𝑬𝑪 = 𝑬𝒇 − 𝒘 𝒘 =? 𝑬𝒇 = 𝒘 𝐖 = 𝟐. 𝟖𝐱𝟏𝟎−𝟏𝟗 𝐽 𝑬𝒇(𝒖𝒎𝒃𝒓𝒂𝒍) = 𝒉𝒄 λ𝒖𝒎𝒃𝒓𝒂𝒍 𝑬𝑪 = 𝑬𝒇 − 𝒘 𝝀 = 𝟓. 𝟖𝟗 𝐱 𝟏𝟎 −𝟕 𝐦 𝛌𝐮𝐦𝐛𝐫𝐚𝐥 = 𝟕𝟏𝟎𝟎 𝐀 𝑬𝑪 =? 𝒗 =? 𝑬𝒇 = 𝒉𝒄 λ𝒂𝒎𝒂𝒓𝒊𝒍𝒍𝒂 𝑬𝑪 = 𝟎. 𝟓𝟕𝐱𝟏𝟎−𝟏𝟗 𝐽 𝟏 𝑬𝑪 = 𝒎𝒗𝟐 2 𝒗 = 𝟑. 𝟓𝟔𝒙𝟏𝟎𝟓 𝒎 𝒔 𝒎𝒆 = 𝟗. 𝟏𝟏𝐱𝟏𝟎−𝟐𝟖 𝒈 Superficie de potasio (Louis-Victor Broglie, príncipe de Broglie; Dieppe, Francia, 1892 - París, 1987). Físico francés que formuló la teoría de la dualidad onda-corpúsculo. Miembro de una familia perteneciente a la más distinguida nobleza de Francia, sus parientes destacaron en un amplio rango de actividades, desde la carrera militar hasta la política y la diplomacia, como fue el caso de su abuelo Albert de Broglie. Su hermano Maurice de Broglie, de quien Louis-Victor de Broglie heredó el título de duque tras su fallecimiento, destacó también en el campo de la física experimental concerniente al estudio del átomo. Sugiere que las ondas electromagnéticas muestran características corpusculares y que el electrón gira en forma de onda alrededor del núcleo por lo tanto el electrón se comporta como ONDA –PARTICULA. Louis Víctor De Broglie (1924) •Propiedades de la partícula y onda se relacionan así: 𝒉 λ= 𝒎𝒗 Albert Einstein Ernst Planck Uno de los grandes logros de la teoría de De Broglie fue el explicar de un modo simple las extrañas reglas de cuantización del átomo de Bohr. Las ondas pueden ser divididas en: Viajera es la que podríamos observar al arrojar una piedra a una lago, una perturbación que se va expandiendo en la superficie del agua. Estacionaria es la que veríamos en una cuerda de guitarra. De Broglie estableció que un electrón enlazado a un núcleo se comporta como una onda estacionaria. Argumentó que si el electrón se comporta como una onda estacionaria en el átomo de hidrogeno, entonces la longitud de onda debe caber exactamente en la circunferencia de la órbita. Esto da como consecuencia la relación siguiente: 2πr = nλ Dónde: r = radio de la órbita; λ = longitud de onda de la onda del electrón; n = 1, 2, 3, … Dado que n es entero, r sólo puede tener ciertos valores cuando n aumenta de 1 a 2 a 3, etc. Amplitud Característica de la onda A diferencia de las ondas mecánicas, las ONDAS ELECTROMAGNÉTICAS no necesitan de un medio material para propagarse; es decir, pueden desplazarse por el vacío Campo Eléctrico Campo Magnético En el proceso de fotosíntesis, la clorofila absorbe radiación de 670 nm. Calcular: a) La energía de un fotón de dicha radiación a) La energía de un mol de estos fotones. La clorofila absorbe radiación λ= 670 nm. a) Energía de un fotón 𝑬𝒇 = 𝒉𝒄 𝝀 (𝟔. 𝟔𝟑𝒙𝟏𝟎−𝟑𝟒 𝑱 − 𝒔)(𝟑. 𝟎𝒙𝟏𝟎𝟖 𝒎 𝒔 𝑬𝒇 = 𝟔. 𝟕𝟎𝒙𝟏𝟎−𝟕 𝒎 𝑬𝒇 = 𝟐. 𝟗𝟕𝐱𝟏𝟎−𝟏𝟗 𝑱/𝒇𝒐𝒕𝒐𝒏 La clorofila absorbe radiación λ= 670 nm. b) La energía de un mol de estos fotones 𝑬𝒇 = 𝟐. 𝟗𝟕𝐱𝟏𝟎−𝟏𝟗 𝑱 𝟔. 𝟎𝟐𝟐𝒙𝟏𝟎𝟐𝟑 𝒇𝒐𝒕𝒐𝒏 𝑱 ∗ = 𝟏. 𝟕𝟗𝒙𝟏𝟎𝟓 𝒎𝒐𝒍 𝒇𝒐𝒕𝒐𝒏 𝟏 𝒎𝒐𝒍 Un electrón promociona de un nivel energético fundamental al segundo nivel energético excitado. ¿absorbería o emitirá radiación? . Calcular: a) La frecuencia de la radiación b) La zona del espectro en que se encuentra dicha radiación a) La frecuencia de la radiación 𝑬𝒇𝒐𝒕𝒐𝒏 = 𝟐. 𝟏𝟖𝐱𝟏𝟎−𝟏𝟖 𝐉 𝑬𝒇𝒐𝒕𝒐𝒏 = ¿absorbería o emitirá radiación? 𝟐. 𝟏𝟖𝐱𝟏𝟎−𝟏𝟖 𝐉 𝟏 𝟏 − 𝒏𝟐𝟏 𝒏𝟐𝟐 𝟏 𝟏 − 𝟐 𝟐 𝟏 𝟑 𝑬𝒇𝒐𝒕𝒐𝒏 = 𝟏. 𝟗𝟒𝐱𝟏𝟎−𝟏𝟖 𝐉 𝑬𝒇 = 𝒉𝒗 𝑬𝒇 𝟏. 𝟗𝟒𝒙𝟏𝟎−𝟏𝟖 𝑱 𝟏𝟓 𝐇𝐳 𝒗= = = 𝟐. 𝟗𝟐𝐱𝟏𝟎 𝒉 𝟔. 𝟔𝟑𝒙𝟏𝟎−𝟑𝟒 𝑱 − 𝒔 b) La zona del espectro en que se encuentra dicha radiación 𝒗 = 𝟐. 𝟗𝟐𝐱𝟏𝟎𝟏𝟓 𝐇𝐳 Calcular la velocidad de un electrón cuya onda asociada tiene una longitud de 1500 nm. 𝒉 λ= 𝒎𝒗 𝒉 𝒗= 𝒎λ 𝟔. 𝟔𝟑𝒙𝟏𝟎−𝟑𝟒 𝑱 − 𝒔 𝒗= 𝟗. 𝟏𝟏𝒙𝟏𝟎−𝟑𝟏 𝒌𝒈 𝟏. 𝟓𝟎𝒙𝟏𝟎−𝟔 𝒗 = 𝟒𝟖𝟓 𝒎/𝒔 Calcular la longitud de onda asociada a: a) Una pelota de 300 g de peso que se mueve a la velocidad de 210 km/h b) Un electrón que se mueve a 17000 km/h c) Realice un análisis de ambas respuestas WERNER KARL HEISENBERG Wurzburgo, Alemania, 1901 - Munich, 1976. Físico alemán que formuló el principio de incertidumbre o de indeterminación que lleva su nombre, una aportación decisiva para el desarrollo de la mecánica cuántica. Durante su formación fue compañero de Wolfgang Pauli tanto en Munich como en Gotinga. Más adelante trabajó con Niels Bohr en Copenhague (1924-1927) y desempeñó, sucesivamente, los cargos de profesor de la Universidad de Leipzig (1927), director del Instituto Káiser Wilhelm de Berlín (1942) y del Max Planck de Gotinga (1946), así como del de Munich (1958). Principio de incertidumbre (Heisenberg1927) En 1923 fue ayudante del físico alemán Max Born en la Universidad de Gotinga, y desde 1924 a 1927 obtuvo una beca de la Fundación Rockefeller para trabajar con el físico danés Niels Bohr en la Universidad de Copenhague. Si se conoce la velocidad de la partícula con bastante precisión seguro se perderá información sobre la posición; en cambio, si se conoce bastante bien la posición de la partícula, entonces renunciemos a conocer la velocidad. El PRINCIPIO DE INCERTIDUMBRE afirma que es imposible medir al mismo tiempo de forma precisa la posición y el momento lineal de una partícula. En 1932, Werner Heisenberg recibió EL PREMIO NOBEL DE FÍSICA por sus teorías sobre mecánica cuántica, aunque la gente suele recordarlo como el descubridor del principio de incertidumbre que lleva su nombre. (Viena, 1887 - id., 1961) Físico austriaco que compartió el Premio Nobel de Física del año 1933 con Paul Dirac por su contribución al desarrollo de la mecánica cuántica. Ingresó en 1906 en la Universidad de Viena, en cuyo claustro permaneció, con breves interrupciones, hasta 1920. Sirvió a su patria durante la Primera Guerra Mundial, y luego, en 1921, se trasladó a Zurich, donde residió los seis años siguientes. “ECUACIÓN DE ONDA” Esta es una ecuación matemática que tiene en consideración varios aspectos: • La existencia de un núcleo atómico, donde se concentra la gran cantidad del volumen del átomo. • Los niveles energéticos donde se distribuyen los electrones según su energía. • La dualidad onda-partícula • La probabilidad de encontrar al electrón El cuadrado de la función de onda, Ψ2, define la distribución de densidad electrónica alrededor del núcleo. Este concepto de densidad electrónica da la probabilidad de encontrar un electrón en una cierta región del átomo, llamada orbital atómico, concepto análogo al de órbita en el modelo de Bohr. TEORIA CUANTICA Clase 3 NATURALEZA DE LA LUZ Espectro Electromagnético ¿Qué es la luz? La luz es una onda de tipo transversal que se puede propagar en el vacío, donde alcanza una velocidad máxima aproximada de 3 x108 m/s. En otros medios diferentes al vacío, la velocidad de la luz es siempre menor. En el agua es de 225.000 km/s, y en el vidrio, de 200.000 km/s. LOS MEDIOS QUE SON ATRAVESADOS POR LA LUZ Los medios que se pueden ver a través de ellos se denominan transparentes (aire, agua, vidrio). Los medios que dejan pasar solo una parte de la luz que reciben se denominan translúcidos (papel cebolla, vidrio esmerilado). Los que no dejan pasar la luz son los cuerpos opacos (madera, metal, agua a más de 100 m de profundidad...). NATURALEZA DUAL DE LA LUZ Cuál es la naturaleza de la luz Algunas veces la luz se manifiesta como onda. Otras veces se manifiesta como partícula. Todo depende de las circunstancias. Propiedades de la Luz Reflexión y Refracción de la luz Cuando un haz de luz atraviesa un medio material, se redirecciona de acuerdo con las características particulares del medio, en la mayoría de los casos diversificándose en haces secundarios. Las operaciones más comunes son: • Reflexión • Dispersión • Difusión • Interferencia • Refracción • Absorción • Difracción • Polarización Propiedades de la Luz: Reflexión Los estudios experimentales de las direcciones de los rayos incidentes, reflejados y refractados en una interfaz lisa entre dos materiales ópticos condujeron a las siguientes conclusiones: I. II. Los rayos incidente, reflejado y refractado, así como la normal a la superficie, yacen todos en el mismo plano. El ángulo de reflexión 𝜽𝒓 es igual al ángulo de incidencia 𝜽𝒊 para todas las longitudes de onda y para cualquier par de materiales 𝜃1 = 𝜃2 Ley de la Reflexión 𝜃1 𝜃2 Propiedades de la Luz: III. Refracción Para la luz monocromática y para un par dado de materiales, a y b, en lados opuestos de la interfaz, la razón de los senos de los ángulos 𝜃1 y 𝜃2 , donde los dos ángulos están medidos a partir de la normal a la superficie, es igual al inverso de la razón de los dos índices de refracción: 𝑛1 𝑠𝑒𝑛 𝜃1 = 𝑛2 𝑠𝑒𝑛𝜃2 n1 𝜃1 > 𝜃2 𝜃1 Aire n2 Ley de la Refracción En honor del científico holandés Willebrord Snell (1591-1626). Agua 𝜃2 𝒔𝒆𝒏𝒐𝜽𝟏 𝒏𝟐 𝒗𝟏 λ𝟏 = = = 𝒔𝒆𝒏𝒐𝜽𝟐 𝒏𝟏 𝒗𝟐 λ𝟐 Refracción Es el cambio de dirección que experimenta una onda al pasar de un medio material a otro. Sólo se produce si la onda incide oblicuamente sobre la superficie de separación de los dos medios y si estos tienen índices de refracción distintos. La refracción se origina en el cambio de velocidad de propagación de la onda, cuando pasa de un medio a otro. Propiedades de la Luz: Tres casos de Refracción Aire Vidrio Un has de luz entra a un material con mayor índice de refracción se desvía hacia la normal Un has de luz entra a un material con menor índice de refracción se desvía alejándose de la normal Un rayo orientado a lo largo dela normal no se desvía sin importar cuales sean los materiales Propiedades de la Luz Índice de Refracción El índice de refracción de un material óptico, denotado por n, desempeña un papel central en la óptica geométrica. Es la razón entre la rapidez de la luz c en el vacío y la rapidez de la luz v en el material: 𝑐 𝑛= v La luz siempre viaja con más lentitud en un material que en el vacío, por lo que el valor de n en cualquier material que no sea el vacío siempre es mayor que la unidad. Para el vacío, n =1. Como n es una razón entre dos valores de rapidez, es un número SIN UNIDADES Reflexión y Refracción de la luz Propiedades de la Luz Índice de Refracción Propiedades de la Luz Índice de Refracción El índice de refracción no sólo depende de la sustancia, sino también de la longitud de onda de la luz. La dependencia de la longitud de onda se llama DISPERSIÓN. El índice de refracción del aire a temperatura y presión estándar es alrededor de 1.0003 y, por lo general, lo tomaremos como si fuera exactamente igual a 1. Propiedades de la Luz Índice de Refracción El índice de refracción de un gas se incrementa conforme su densidad aumenta. La mayor parte de los vidrios que se utilizan en los instrumentos ópticos tienen índices de refracción entre 1.5 y 2.0. Unas cuantas sustancias tienen índices más grandes; un ejemplo de esto es el diamante, con 2.417. Propiedades de la Luz Índice de Refracción Relativo Se obtiene como la relación de velocidades entre dos medios cualesquiera n12 v1 n12 v2 Propiedades de la Luz Índice de Refracción La luz pasa del agua al aire con un ángulo de incidencia de 35°. ¿Cuál será el ángulo de refracción si el índice de refracción del agua es 1.33? ¿Cuál será el ángulo de refracción? 𝒔𝒆𝒏𝒐𝜽𝟏 𝒏𝟐 = 𝒔𝒆𝒏𝒐𝜽𝟐 𝒏𝟏 Aire: 1 n2 n1 𝒔𝒆𝒏𝒐𝜽𝟏 (𝒏𝟏 ) 𝒔𝒆𝒏𝒐𝜽𝟐 = 𝒏𝟐 𝜽𝟐 ? 𝜃1 = 35° Agua: 1.33 𝒔𝒆𝒏𝒐𝟑𝟓° (𝟏. 𝟑𝟑) 𝒔𝒆𝒏𝒐𝜽𝟐 = 𝟏 𝜽𝟐 = 49.7° Un rayo de luz monocromático cuya longitud de onda es de 400 nm en el medio A entra con un ángulo de 30° respecto a la frontera de otro medio B. si el rayo se refracta en un ángulo de 50°,¿Cuál es la longitud de onda en el medio? ¿Cuál es la longitud de onda en el medio? Medio A λ1=400 nm 𝜽𝟏 = 30° λ2= ? Medio B 𝜽𝟐 = 50° 𝒔𝒆𝒏𝒐𝜽𝟏 λ𝟏 = 𝒔𝒆𝒏𝒐𝜽𝟐 λ𝟐 𝛌𝟏 𝐬𝐞𝐧𝐨𝛉𝟐 λ𝟐 = 𝐬𝐞𝐧𝐨𝛉𝟏 𝟒𝟎𝟎 𝐧𝐦 (𝐬𝐞𝐧𝐨𝟓𝟎°) λ𝟐 = 𝐬𝐞𝐧𝐨𝟑𝟎° 𝛌𝟐 = 𝟔𝟏𝟐. 𝟖𝟑 𝐧𝐦 EL ÍNDICE DE REFRACCIÓN Es una propiedad física de las sustancias Tiene como propiedad la DISPERSION de ahí que el índice de refracción varia según la ʎ de la luz que pasa a través del material. Ejemplo: el arco Iris IMPORTANCIA Es útil para la identificación de las sustancias Para conocer su pureza. DISPERSION La dispersión de la luz consiste en la separación de un rayo de luz blanca en diferentes colores. Es decir, la luz visible está formada por ondas electromagnéticas, de diferente longitud de onda y frecuencia, que son percibidas por la vista RADIACIONES RADIACION NO IONIZANTE: Infrarrojo Microondas Ondas de radio Radiación de frecuencias extremadamente bajas RADIACION IONIZANTE: • Rayos Cósmicos • Rayos Gamma • Rayos X