PDF (Grupo funcional) - Universidad Nacional de Colombia
Anuncio

UNIVERSIDAD NACIONAL DE COLOMBIA
Sede de Medellín
FACULTAD DE CIENCIAS
DEPARTAMENTO DE QUÍMICA
NOMENCLATURA DE QUÍMICA INORGÁNICA
INTRODUCCIÓN:
P o r petición de todos los p r o f e s o r e s del Departainento se c o n s i d e r ó y
aprobó la inclusión de e s t e capítulo en las Q u í m i c a s G e n e r a l e s ya que
h a s t a el monnento se había supuesto del dominio del e s t u d i a n t e .
No s a b e m o s aue p a s a , s e r á que falta m o t i v a c i ó n ? Se olvida al p a s a r de
Quinto a Sexto? O s e n c i l l a m e n t e no se les enseña en b a c h i l l e r a t o . En
ffn, sobran i n t e r r o g a n t e s , que llevan consigo a n u e s t r o s e s t u d i a n t e s al
fracaso en la solución de problennas, por no saber leer ni e s c r i b i r co rrectannente las fórnnulas b á s i c a s .
Ahora es el nnomento de a p r e n d e r . La e x p e r i e n c i a a s í nos lo indica, ya
tenemos conocimientos de e s t r u c t u r a a t ó m i c a , tabla p e r i ó d i c a , enlace
O u í m l c o , notación e s p e c t r a l , c a r g a f o r m a l , n ú m e r o de oxidación y v a l e n c i a , temas que e v i t a r á n en p a r t e la mennorización y ayudarán a que
e s t e capítulo sea m á s deductivo.
n.
CUADRO FUNDAMENTALJMo. 1.
Sal
III,
GRUPO FUNCIONAL:
Átomo o agrupación a t ó m i c a que c a r a c t e r i z a n a una función Quínnica
Ejennplo :
-QH
H l d r o x l l o , c a r a c t e r i z a en Quínnica Inorgánica a los Hldróxldos
o b a s e s en Química O r g á n i c a c a r a c t e r i z a los A l c o h o l e s .
-CII
O
Carbonilo, c a r a c t e r í z a l a s
cetonas.
..—^,ii•.lnw^)|ljg¡l^,n^^ln^^^lnp^^l^^y^nn»^l^.l)^[^ » M J Í . > , I . . J H I mm
•»í9^fT»:7
-O-
O x i , c a r a c t e r i z a los é t e r e s .
-COQH
Carboxilo, c a r a c t e r i z a los ácidos o r g á n i c o s .
En g e n e r a l los grupos funcionales s e r á n de gran utilidad en Ouímlca Qr
gánlca.
Función Q u í m i c a :
Conjunto de s u s t a n c i a s c a r a c t e r i z a d o s por un grupo
funcional y que tienen propiedades s e m e j a n t e s Ejemplo
Hldróxldos,
Aldehidos, c e t o n a s , á c i d o s , é t e r e s , a l c o h o l e s , n i t r a t o s , s u l f a t o s , c l o r a t o s , sulfitos, n i t r i t o s , d i c r o m a t o s , hipoclorItos .
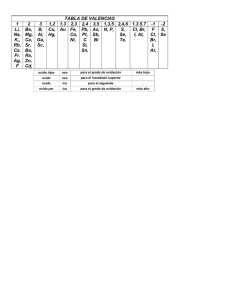
Cuadro N o . 2 .
Valencia
Valencia
Fija
Metales
No
Alcalinos IA (Ll, N a , K, R b ,
C s , F r ) Ag
Metales
H,
Alcalino T e r r e o s IIA (Be, Mg,
Ca, S r , B a , Ra) Cd, Zn
F
O
B
Al
C. Si
Valencias
Valencia
1,
1,
2,
2,
3,
2,
1,
1,
2,
2,
1.
2
3
3
4
5
4. 6
3, 5
3, 5. 7
3, 6
3 , 4 , 6, 7
2 , 3 , 4 , 5, 6. 7
Variables
Metal
No
Metal
Cu , Hg
_
Au
-
F e , C o , Ni
Pt, P b , Sn
Sb
_
_
-
P , As
S, Se
Br
Cl,
Cr
Mn
N
I
Valencia:
E s l a capacidad de combinación de un e l e m e n t o , se puede
r e p r e s e n t a r como n ú m e r o de e n l a c e s s i m p l e s , no confundirlo con nú m e r o de oxidación.
Ejepnplos:
H -r^ p .
Valencia del H = 1 (1 enlace simple)
"
Valencia del O = 2 (2 e n l a c e s s i m p l e s )
* El núnnero de oxidación del oxígeno es -2
H H H
H - C - C - C - H
H H H
Valencia del C = 4 (4 e n l a c e s s i m p l e s )
-8+8
X
f/
= O
La e s t r u c t u r a a n t e r i o r es C3H0
El número de oxidación del C se c a l c u l a 3 x = - S
que es muy diferente de 4 e n l a c e s s i m p l e s que es su
.
x = -^/Z
valencia,
. \
Niámero de Oxidación :
Es la carga e l é c t r i c a que p a r e c e tener el átomo
ó a grupaclón a t ó m i c a en los c o m p u e s t o s .
Número oxidación = ey -(e;l + e;P)
e,v = e l e c t r o n e s de valencia
el = e l e c t r o n e s U b r e s
e,a = e l e c t r o n e s asignados de acuerdo a la e l e c t r o n e g a t i v i d a d , los e l e c t r o n e s se asignan al elemento nnás e l e c t r o n e g a t i v o , si la e l e c t r o n e g a t i vidad es igual se asigna por igual.
Ejemplos:
H -
Ó.
'
H = IA
Q = VIA
H
N ú m e r o de oxidación H = I - (Q+Q) = + 1
N ú m e r o de oxidación O = 6- (4+4) = -2
Al
N ú m e r o de oxidación
Al = 3-(Q+Q) = +3
O
/
AlssO
De a c u e r d o a lo a n t e r i o r g e n e r a l i z a m o s :
1,
a.
La suma de los n ú m e r o s de oxidación en m o l é c u l a s n e u t r a s
es = O,
b.
En e l e m e n t o s l i b r e s = O,
c.
El n ú m e r o d e o x i d a c i ó n de un lón e s la c a r g a d e l lón
2,
M e t a l e s a l c a l i n o s , Ag en c o m p u e s t o s +1
3,
M e t a l e s a l c a l l n o t é r r e o s , Z n , Cd t r a b a j a n en c o m p u e s t o s +2
4.
E l Al en c o m p u e s t o s +3
5.
Sis t a n d a s d e l a f o r m a H X , M e X
g e n o t r a b a j a con -1
6.
E l " H " e n h l d r ó x l d o s , á c i d o s t r a b a j a con +1 ( v a l e n c i a 1)
d o n d e X = F , C l , B r , I el h a l ó -
E x c e p c i ó n = Son los h i d r u r o s (Me Hx) x = v a l e n c i a d e l m e t a l el H
t r a b a j a con - 1 s u n o m e n c l a t u r a u s a : I . H i d r u r o , 2 . N o m b r e d e l
m e t a l según la valencia.
7.
E l " O " en ó x i d o s : H i d r ó x i d o s , á c i d o s , t r a b a j a con -2 e x c e p c i ó n :
L o s p e r ó x i d o s q u e s o n ó x i d o s q u e t i e n e n un o x í g e n o m a s q u e e l
* nornnal. - 1 ,
Ejemplo;
Na2 O
Oxido S ó d i c o
( - 0 - Q - ) P e r ó x i d o Na2Q2
p e r ó x i d o de s o d i o ( o x i l i t a )
Ejemplos:
+2
+1
Na2
,.-2
O
A12 {SO4 )3
H
O
//
C - H
+¿
H2 S
+6 + IS
i- í ^
•f-C
+3
AI2 S3 0 1 2
=o
•1-2
H
Ho
Nota:
+1
= O
•2
o
C
=o
O
+]
K
±1.
+3
Cr
-8
O
Q4
-1
H
-i.
I-í
O
En lo q u e s e va a t r a t a r a c o n t i n u a c i ó n no se p r e t e n d e h a c e r
un t r a t a d o de r e a c c i o n e s Q u í n n l c a s ; s i n o , un e s b o z o en fornna c l a r a y
r á p i d a de f ó r m u l a s y n o m b r e s Q u í n n l c o s p a r a l a s s u s t a n c i a s que m á s
s e m e n c i o n a n y de m á s u s o ; e s de a n o t a r q u e s e d e b e t e n e r en c u e n t a
los c u a d r o s fundamentales hechos a n t e r i o r m e n t e .
Óxidos B á s i c o s :
Son el p r o d u c t o de la r e a c c i ó n e n t r e M e t a l y O x í g e n o ,
la f ó r m u l a g e n e r a l e s :
•%.
.¥
d o n d e x e s l a v a l e n c i a d e l o x í g e n o , y e s la v a l e n c i a d e l M e t a l .
H« - HíTfl¿.
No Mí r
k»o M É T r t l .
r
i
X, y e s t á n en f o r m a c r u z a d a , s e p u e d e n o b s e r v a r en el c u a d r o de v a l e n
c í a s , s i X, y son I g u a l e s ó nnúltlplos d e b e n s i m p l i f i c a r s e .
N o n n e n c l a t u r a : SI el m e t a l e s de v a l e n c i a f i j a , s e u s a
1.
2.
3.
Oxido
de
Nonnbre d e l M e t a l
1.
Oxido
2.
N o n n b r e l a t i n o con e l sufijo
"Ico"
L a n o n n e n c l a t u r a S t o c k tannbién e s m u y u t i l i z a d a p o r lo s e n c i l l a :
1.
2.
3,
Oxido
de
N o n n b r e d e l e l e m e n t o y e n t r e p a r é n t e s i s la v a d\
l e n c i a en n ú m e r o s r o m a n o s .
Si el m e t a l e s de v a l e n c i a v a r i a b l e g e n e r a l m e n t e 2 v a l e n c i a s p a r a 2 c o m puestos diferentes se u s a :
1.
2.
Oxido
N o m b r e l a t i n o c o n e l sufijo " o s o " p a r a l a nnen o r v a l e n c i a o e l sufijo Ico si e s la m a y o r v a lencia.
A q u í e s de g r a n u t i l i d a d l a n o n n e n c l a t u r a S t o c k
E l Cr y el Mn m e r e c e n un e s t u d i o a p a r t e .
Ejemplos:
Alcalinos
/
Na^
( L i , N a , K, R b , C s , F r ) Ag
O.
Na2 O
y= 1
óxido
de
óxido
óxido
sódico
d e s o d i o (I)
Valencia 1
Cuadro No . 2
sodio
A l c a l l n o t é r r e o s ( B e , M g , C a , S r , B a , R a ) C d , Zn
X = y = 2 InnpUca
Cax Oy
CaO
Al
X = 2
ó x i d o de c a l c i o
óxido calcico
ó x i d o de c a l c i o (II)
Valencia 3
y = 3
Alx Oy
Valencia 2
simplificación
. AI2O3
ó x i d o de A l u m i n i o
óxido Alunnínico
ó x i d o de A l u m i n i o ( I I I )
Valencia Variable
Cobre
(Cu),
M e r c u r i o (Hg),
Valencias
1, 2
P a r a el c o b r e v a l e n c i a 1
Cu X Oy
x = 2
CU2Q
Oxido
y = 1
cuproso
O x i d o de C o b r e (I)
SI e s V a l e n c i a 2
CuO
ftxldo
x = y = 2 Implica slnnpUfIcación
cúprico
ó x i d o de c o b r e (II)
E l P l o m o con v a l e n c i a s 2 , 4 . lo . m i s n n o q u e e s t a ñ o y pía
Plomo Valencia 2
PbxOy
X = 2
y = 2
PbO
óxido plumboso
ó x i d o d e p l o m o (II)
tino
(simplificación)'
Plomo Valencia 4
PbxQy
Pb02
X = 2
y =4
(slnnpllflcaclón)
óxido plúmbico
ó x i d o d e plonno (IV)
H l d r ó x l d o s o B a s e s : C o l o r e a n de r o s a d o l a f e n o l f t a l e i n a y de a z u l
e l p a p e l de t o r n a s o l r o s a d o . Son el pe o d u c t o de l a r e a c c i ó n e n t r e
óxido básico y agua, cuya f o r m u l a g e n e r a l e s :
Me(OH)y
SI y = 1 s o b r e e l p a r é n t e s i s
l a V a l e n c i a d e l g r u p o OH ( H l d r ó x l ) s i e m p r e e s 1, x e s la V a l e n c i a
del m e t a l según el c u a d r o N o . 2 .
N o m e n c l a t u r a : B a s t a con c a m b i a r la p a l a b r a óxido por "Hidróxido"
y n o n n b r e d e l m e t a l s e g ú n la V a l e n c i a
Ejemplos:
N a (OH)y
NaOH
Ca(OH)y
Ca(OH)2
y = 1 •'•
El p a r é n t e s i s
H i d r ó x i d o de s o d i o
Hidróxido sódico
H i d r ó x i d o de s o d i o (I)
X = 2 Cuadro No. 2
Hidróxido de calcio
H i d r ó x i d o de c a l c i o (II)
Hidróxido calcico
sobra.
Al (OH),
y = 3
Al (OH)^
Hidróxido de Aluminio
Cuadro N o . 2
Hidróxido Alumínlco
Hidróxido de Aluminio (III)
/
Valencia
Variable
Cu
1. 2
Cu (OH)y
CuOH
li y = 1
si
y
= 2
Hidróxido c u p r o s o
Hidróxido de Cobre (I)
Cu(OH)2 Hidróxido c í p r l c o
Hidróxido de c o b r e (II)
Valencia Variable
Pb
2, 4
Pb(OH)si
y
= 2
Pb(OH)2
si
y
=4
Pb(QH)4
Hidróxido
Hidróxido
Hidróxido
Hidróxido
Plunnboso
de plomo (II)
plúmbico
de plomo flV)
Óxidos Á c i d o s :
.Son el producto de la reacción e n t r e No Metal o Metaloide con oxígeno, la fórmula g e n e r a l
NoMe^^
0„
X Valencia del oxígeno ^ Valencia del no m e t a l , se sigue la nnisma mecánica de fornnación que en los óxidos b á s i c o s .
N o m e n c l a t u r a : SI son de 2 valencias se u s a :
1.
2.
Oxido
Nonnbre latín del no metal con la t e r m i n a c i ó n " o s o " p a r a la men o r , " i c o " p a r a la mayor v a l e n c i a .
8
o
ó
1.
2.
Utilizar los prefijos mono, di, t r i , t e t r a , penta, h e x a , h e p ta, indicando cantidad de o x í g e n o s .
P r e p o s i c i ó n de
3.
Los m i s m o s prefijos Indicando cantidad de No Metal ,
También la n o m e n c l a t u r a de W e r n e r "Stock" p a r a el caso Cl, I,
con valencias 1, 3, 5, 7 y el " B r " 1, 3, 5 se u s a :
1.
2.
Prefijo "Hipo" Sufijo " O s o " Valencia 1
Sufijo " O s o " Valencia 3
3.
Sufijo "Ico" Valencia 5
4.
Prefijo
\
P e r Sufijo Ico Valencia 7
Ejennplos: P , A s , Sb Valencia 3, 5
PxQ|^
P2O3
X=2
S, Se
cuadro No. 2
Oxido fosforoso
Trióxido de difosforo
Oxido de fósforo (III)
si x = 2
P2Q5
K= 3
K=
=
^
Stock
5
Oxido fosfórico
Pentoxido de difósforo
Oxido de fósforo (V)
"<-
V ^:<2, 4, 6
la valencia 2 se utiliza en los hldrácidos y fornnaclón de s u l f u r o s ,
con la 4, 6 se portan como P , A s , Sb.
X = 2
SxO^
. * .
SO2
If = 4
X = 1
óxido sulfuroso
dióxido de Azufre
óxido de azufre (IV)
hay simplificación
SyPy^
. '.
O3
X=2
)( = 6
X= 1
K= 3
Hay simplificación
óxido sulfúrico
Tfióxido de azufre
Oxido de azufre (VI)
Cl
y
I
Br
1, 3 . 5, 7
1,3,5
Ejemplo :
X = 2;
Clx O ^
(c = 1, 3, 5, 7
Cl2 O
óxido Hipoclproso
CI2 O3
óxido c l o r o s o
Cl 2 O5
óxido d ó r i c o
Cl 2 O 7
óxido p e r d ó r l c o
'
El N I , 2, 3 , 4 , 5, 6, 7
N^Oj^
x =2
N2O
óxido nitroso
N O
oxido nítrico
N 2 O3
trióxido de dinitrógeno
N
dióxido de nitrógeno (óxido de Nitrógeno
OT
2 O5
El
K=l,2.3,4,
5,6
(IV) )
pentóxldo de dlnitrógeno
N O^
trióxido de
inononltrógeno
N2Q4
tetróxldo de dlnitrógeno (dínnero del óxido de Nitrógeno IVi
c r o m o y el manganeso tienen p r o p i e d a d e s de nnetales y no m e t a l e s .
Ejemplo:
Cromo 2 , 3 , 6 con la 2, 3 se porta como un m e t a l p a r e c i d o
a F e , Co , NI. Sus óxidos e hldróxldos s e r í a n
Cr^Oy
Cr O
si X = 2
óxido c r o m o s o
y = 2
(simplificación)
(óxido de c r o m o
(II) )
10
si
X= 2
y = 3
Cr203
óxido c r ó m Ico
ó x i d o de c r o m o (III)
los hidróxidos
serían:
Cr (OH)^
Hidróxido cromoso
H i d r ó x i d o de c r o m o (II)
C r (OH)^
Hidróxido crónnlco
H i d r ó x i d o de c r o m o (III)
E l c r o m o con l a v a l e n c i a 6 se p o r t a c o m o no nneta\ ( c o m o el a z u f r e , Se)
e x i s t e n l o s ó x i d o s sin s i m p l i f i c a r y s i m p l i f i c a n d o l a v a l e n c i a .
Cr^Qj^
si X = 2
0^206
ó x i d o d l c r ó m l c o ( d í m e r o d e l ó x i d o de cronno (VI) )
Cr Q3
E l Mn
K= 6
t r i ó x i d o de c r o m o (óxido de c r o m o ( V I ) )
f o r m a el á d d o c r ó m i c o
2 , 3 , 4 , 6, 7
é s t e e s el que
Con 2, 3 s e p o r t a c o m o F e , Co , Ni
Con 4 f o r m a el
b i ó x i d o de m a n g a n e s o
Con 6 s e p o r t a c o m o S, Se
Con 7 s e p o r t a c o m o C l , I
L a s de nnás uso s o n la V:4
V:4
Mn^Oi/
Mn02
si
x = 2
H = 4 s e simplifica
x = 1 K~ 2
b i ó x i d o de m a n g a n e s o
X = 2
Mn 2P7
V:7
j^ = 7
óxido p e r m a n g a n i c o , heptóxido de d l m a n g a n e s o . ó x l d o de
m a n g a n e s o (VIJ) .
11
A£i£l2^- Son de 2 t i p o s ;
a.
b.
nidrácidos
Ox ácidos
Hldrácidos :
Ácidos sin oxígeno su forma g e n e r a l e s :
Hj^NoMe
donde x es la valencia del No m e t a l , los m á s usados son los d e ;
F , Cl, B r , I
S, Se
con
con V = 1
V =2
Nomenclatura:
Depende si el ácido e s t á en fase g a s e o s a m o l e c u l a r m e n t e
ó si e s t á en solución acuosa d i s o c i a d o .
P a r a soluciones a c u o s a :
1.
Acido
2.
Nombre latín del no metal
con el sufijo " H l d r l c o "
P a r a compuesto m o l e c u l a r :
1.
F l u o r u r o , c l o r u r o . B r o m u r o , y o d u r o , s e l e n u r o , sulfuro, cianuro
2.
Preposición
3.
Hidrógeno
de
Ejemplo..
Solución Acuosa
HF
a.
F a s e G a s e o s a ( F o r m a molecular)
fluorhídrico
F l u o r u r o de Hidrógeno
HCl a.
HBr a.
HI
a.
Clorhídrico,...,..,,
Bromhídrico
Yodhídr ico
C l o r u r o de Hidrógeno
B r o m u r o de Hidrógeno
Yoduro de Hidrógeno
H 2S a.
Sulfhídrico,,.,,
Sulfuro de Hidrógeno
^ 2 ^ e ^*
Selenhídrlco
Selenuro de Hidrógeno
12
Á c i d o s Ox á c i d o s :
Son
i n c o l o r o s con la f e n o l f t a l e i n a ,
c o l o r e a n de r o s a d o
e l p a p e l de t o r n a s o l p r e v i a m e n t e a z u l a d o por l a s b a s e s .
d e l a r e a c c i ó n e n t r e óxido á c i d o y a g u a .
No l A e ^ O ^
+ H2O
Son el p r o d u c t o
H2 No M e ^ Qjj + 1
en g e n e r a l s e c o l o c a n todos l o s h i d r ó g e n o s , No M e t a l , O x í g e n o s que h a y a
en e l l a d o I z q u i e r d o s i h a y s i m p l i f i c a c i ó n se s i m p l i f i c a .
Nomenclatura:
I.
2.
A c Ido
N o m b r e d e l ó x i d o á c i d o de d o n d e p r o v i e n e
Ejemplo;
S2O4
S cuyas valencias
_
son 4 , 6 (la 2 s e u t i l i z a en h l d r á c i d o s )
SO 2
Ox.
Sulfuroso
SO 3
Ox,
Sulfúrico
los ácidos s e r í a n ;
502
+
H2Q
H2SO3 •
a.
Sulfuroso
503
+
H2Q
H2SO4
a.
Sulfúrico
N i t r ó g e n o s con v a l e n c i a s 3 , 5 f o r m a el á c i d o N i t r o s o y el ácido N í t r i c o .
N2Q3
+ H2O
H2N2O4
HNO2
a.
Nitroso
N2O5
+ H2O
1^2^206
HNO3
a.
Nítrico
Hipocloroso
y
1, 3 , 5 , 7
Cl,
Br
Yodo
CI2O
+
H2O
H2CI2O2,
HCIO
a.
CI2O3
+
H2O
H2CI2Q4.
HCIO2
a.
Cloroso
Cl^O^
+
H^O
HCIQ,,
a.
Clórlco
CI2O7
+
HpO
HCIO4
a,
Perdórlco
.
^2^^206,.
H2CI2O8.
E n el c a s o d e l Cronno e s Innfxjrtante el á c i d o c r ó m i c o y e l á c i d o d l c r ó m l c o
Cr03
+ H2O
Cr 2O 6 + H2O
H2Cr04
a.
Crómico
H2Cr207
a.
Dlcrómlco
13
En el caso de Mn e s i m p o r t a n t e el a . p e r m a n g a n i c o .
Mn207
+ H2O
^_______
H2Mn208
P a r a el caso P , A s , Sb r e s u l t a n ácidos
HMn04
trabajando con:
1 nnolécula de H2O
Prefijo
Meta
2 m o l é c u l a s de H2O
Prefijo
Piro
3 m o l é c u l a s de H2O
Prefijo
Orto
P a r a cada elenrento se f o r m a r á n 6 ácidos
P2O3
+
1 H2O
. H2P2O4
P2O3
+
2 HjO
H4PP5
P2O3
+ 9
PP5
HPO2 a.
Metafosforoso
a.
Pirofosforoso
H2O
H6P2O6.
H3P03a.
Ortofosforoso
+
1 H2O
H2P2O6.
HPO3 a.
Metafosfór ico
P2O5
+
2 H2O
H4P207_
a,
Pirofosfór ico
PP5
+
3 H2Q
H6P208_
H3P04a.
Ortofosfór ico
* P a r a la m á x i m a h l d r a t a d ó n puede o m i t i r s e el prefijo O r t o .
Iones :
En toda disociación se originan 2 tipos de i o n e s :
Iones p o s i t i v o s : denominados cationes
Iones n e g a t i v o s : denonninados aniones
Los aniones de los ácidos son de e s p e c i a l innportancia debido a que en b a s e a
ellos se fundamenta la n o m e n c l a t u r a de las s a l e s . La n o m e n c l a t u r a de los
aniones de ácidos cannbla:
T e r n n l n a d ó n Hídrlco
Oso
Ico
Por
URO
ITO
ATO
* Los prefijos e s p e c i a l e s de algunos ácidos se c o n s e r v a n
meta, piro, orto.
For m a en que a p a r e c e n los aniones :
te los hidrógenos del á c i d o .
como h i p o , per
Resultan de quitar p a r d a l o totalmen-
14
Nomenclatura:
1,
2,
3,
Anión ó s i m p l e m e n t e ion
H i d r ó g e n o , d i h i d r ó g e n o , tr I h i d r ó g e n o
N o m b r e d e l á d d o c a m b i a n d o h l d r l c o p o r u r o , o s o p o r I t o , ico p o r a t o .
N o t a : T e n i e n d o en c u e n t a que el h i d r ó g e n o de l o s á c i d o s t i e n e n n ú m e r o de
o x i d a c i ó n nnás uno (+1); el q u i t a r un h i d r ó g e n o a u n a m o l é c u l a n e u t r a de
á c i d o f o r m a r á unión de c a r g a - 1 y v a l e n c i a 1 (un e n l a c e s i m p l e ) s i s e q u i tan 2 h i d r ó g e n o s q u e d a unión de C a r g a - 2 y v a l e n c i a 2 (dos e n l a c e s s i m p l e s '
s i s e q u i t a n 3 h i d r ó g e n o s q u e d a un lón de c a r g a -3 y v a l e n c i a 3 .
De a c u e r d o a lo a n t e r i o r :
Para
HS
H2S
ácido Sulfídrlco s u m i n i s t r a r á 2 iones,
Hidrógeno Sulfuro
(Bis u'furo)'''
S>^~ Anión Sulfuro
P a r a H2SO3
Para
Para
Acido Sulfuroso s u m i n i s t r a 2 iones
HSO3
Anión H i d r ó g e n o S u l f i l o , (Anión B i s u l f i t o ) *
So2-
Anión Sulfilo
H2SO4
Acido Sulfúrico s u m i n i s t r a dos iones
HSQ
2SO4
Anión H i d r ó g e n o S u l f a t o , (Anión Bi sulfato)--
H4P2Q5
Anión Sulfato
Acido Pirofosforoso s u m i n i s t r a 4 iones
si se quita 1 H
H3P2O5
anión tri h i d r o g e n o
si se quita 2 H
H2P2O5
HP30^4
P^Os"
a n i ó n di h i d r d ' g e n o p l r o f o s f i t o
anión h i d r ó g e n o pirofosfito
si se quita 3 H
s i s e quita 4 H
Para
Para
HNO^
a. Nítrico
NO:
anión
HCIQ
CIQ-
a. Hipocloroso
anión H l p o c l o r l t o
Nitrato
anión
Pirofosfito
pirofosfilo
15
Sales:
Son el pr o d u c t o de la N e u t r a l i z a c i ó n e n t r e A c i d o y b a s e , p a r a e f e c tos de f o r m u l a c i ó n r e s u l t a n de r e m p l a z a r t o t a l o p a r c i a l m e n t e l o s " H " d e l
ácido por M e t a l .
H i d r ó x i d o + Acido
Sal + H^O
las sales pueden s e r :
Neutras:
si se r e m p l a z a n t o t a l m e n t e l o s " H " d e l á c i d o p o r m e t a l .
Me^(ANION)y
donde^X'es la v a l e n c i a d e l a n i ó n la c u a l c o i n c i d e n u m é r i c a m e n t e con e l n ú m e r o oxidación del anión,''y"es la valencia del nnetal.
Acidas :
s i se s u s t i t u y e n o a r d a l m e n t e l o s " H " d e l á c i d o p o r n n e t a l , l a s
s a l e s m o n o , d i , t r i . a c i d a s son a q u e l l a s d o n d e a p a r e c e - 1, 2, 3 , H sin r e n n plazar .
Nota:
Al r e m p l a z a r l o s H d e l á c i d o p o r m e t a l d e b e t e n e r s e en c u e n t a que
e l H i d r ó g e n o e s m o n o v a l e n t e , l u e g o e n t o n c e s un nnetal d i v a l e n t e (Al-i
c a l l n o T e r r e o s ) r e m p l a z a 2 " H " uno t r i v a l e n t e (Al) r e m p l a z a 3 .
Nomenclatura:
I.
2.
N o n n b r e del a n i ó n s e g ú n el á c i d o
N o m b r e d e l m e t a l s e g ú n la v a l e n c i a .
N o m e n c l a t u r a Stock
1.
2.
3.
Nota:
N o m b r e d e l anión s e g ú n á c i d o
de
N o t n b r e d e l m a t a l con la v a l e n c i a e n t r e p a r é n t e s i s en n ú m e r o s ronnanos .
H a y una f e l i z c o i n c i d e n c i a en l o s a n i o n e s i n o r g á r á c o s d o n d e el n ú m e r o d e o x i d a c i ó n e s n u m é r i c a m e n t e Igual a la v a l e n c i a .
Ejemplos:
L a s s a l e s d e l á c i d o s u l f í d r l c o con s o d i o s e r í a n :
H2S ácido sulfídrlco s u m i n i s t r a d o s iones
H S " h i d r ó g e n o s u l f u r o ó b i s u l f u r o c u y o n ú m e r o de o x i d a c i ó n e s 1-
16
co.lncldo n'jrr;'^'*icam'='ii:e con I3. v a l e ' ^ c i a
S - s u l f u r o n ú m e r o de o x i d a c i ó n
La sale" serían
Con H S '
Para
^^'
- 2 , valencia 2 .
\'ct(Apióp)y
Z •- •
Na HS
1
Na
y = 1
s o b r a el p a r é n t e s i s
h i d r ó g e n o s u l f u r o de s o d i o ( s a l m o n o á c i d a )
bl'^ulfuro d e s o d i o
Z. ^ Z
Na
y = 1
Na2S
s u l f u r o de s o d i o
L a « s a l e s de c a l d o ( ' a l c a U n o t é r r e o ) ^ - a l e n c i a 2 s e r í a n :
C ^
{VS\y
Z --- 1
y = 2
C'-'. (H,^)-5 hid^-ógí^no « u l f n r o de c a l c i o ( b i s u l f u r o de c a l c i o )
Ca^S^r
Ca S
X= 2
y = 2
s o b r a el p a r é n t e s i s
s u l f u r o d e c a l d o (hubo s i m p l i f i c a c i ó n )
E i á c i d o sulfuro.=!o H ^ S O ,
HSO-,
suministra:
h i d r o g e n o sulfito (bisulfito) t r a b a j a con v a l e n c i a 1
2SQ3
sulfito t r a b a i a con v a l e n c i a 2
La.« s a l e s de é s t e á c i d o con a l u m i n i o ( v a l e n c i a 3)
Al^(HSQ3)y
Z - 1
sería:
y = 3
Al(HS03)3
h i d r ó g e n o s u l f i l o de a l u m i n i o b i s u l f i t o de a l u m i n i o
A1^S03)^
2 = 2
AI2 LS03)3
sulfito de a l u m i n i o
E l á':ido fosfórico H 3 P O 4
y ^ 3
sunnlnl.=!tra
H2POI
(V = M di h i d r ó g e n o fosfato
IIPoJ"
(V = 2) h i d r ó g e n o fosfato
rol"
(V = 3) fosfato
(bifosfato)
17
Hagamos las s a l e s del acido fosfórico u ortofosfór ico con Cu(I), y Cu(II)
CujH2P04)y
CUH2PQ4
SI
1
Z= 1
y = 1
s o b r a el p a r é n t e s i s
di hidrógeno fosfato cuproso
di hidrógeno fosfato de cobre (I)
V =2
Cu (H2PQ4)2
di hidrógeno fosfato c í p r i c o
di hidrógeno fosfato de cobre (II)
a h o r a utilicemos hidrógeno fosfato o bifosfato
C u ^ H P O á ¥)
Cu2(HPQ4)
Si21=2
y
I
y = 1 elparéntesls sobra
hidrógeno fosfato cuproso
bifosfato cuproso
hidrógeno fosfato de c o b r e (1)
y = 2 s e simplifica
Cu^(HP04)y
CuHPO^
Nota:
hidrógeno fosfato cúprico
bifosfato cúprico
hidrógeno fosfato de c o b r e (II)
Todo anión con unCl^"H" en la q u í m i c a vieja antepone " B i " Ejennplo:
bisulfito, b i c a r b o n a t o , bisulfato.
2
Con el azufre se forrna el ácido Tlosulfurlco H2S2O3 que dá el ion S2Q3
Tío sulfato o hipos ulf Ito.
FORMULAS Y NOMENCLATURA EN GENERAL
C o m p r e n d e r l a s en dos f o r m a s :
a. Dada el n o m b r e h a c e r la f ó r m u l a
b . Dada la fórnnula e s c r i b i r el n o m b r e
E j : Hidrógeno Sulfuro de Aluminio
Tipo a.
P o r s e r Sulfuro p r o v i e n e del ácido sulfhídrico H2S el cual s u m i n i s t r a
HS"y S - lón Hidrógeno sulfuro y s u l f u r o .