formulación C. Binarios
Anuncio

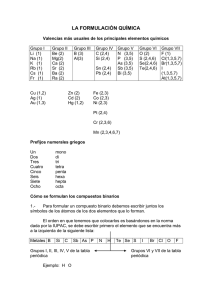
FORMULACIÓN DE COMPUESTOS INORGÁNICOS COMPUESTOS BINARIOS FÓRMULA: Ma Xb M: elemento con nº de oxidación positivo, siempre se escribe a la izquierda. X: elemento con nº de oxidación negativo, se escribe siempre a la derecha. a y b: valencias intercambiadas ( a es la valencia de X y b la valencia de M). Estos subíndices se simplifican cuando se pueda (salvo excepciones, como el H2O2). Si la valencia es 1 no se escribe. Ejemplos: C2O4= CO2 ; Cl2O7 ; MgBr2 ; LiH ; H2S NOMBRE: El nombre del compuesto se lee de derecha a izquierda a partir de la fórmula. Hay dos tipos de nomenclatura : la Sistemática y la de Stock. Clasificaremos los compuestos binarios en dos grandes grupos: a) Si el elemento de la derecha es el oxígeno, todos llevan la palabra óxido. b) Si el elemento de la derecha no es oxígeno, al nombre de dicho elemento se le añade la terminación “uro”. NOMENCLATURA SISTEMÁTICA: Utiliza prefijos (mono, di, tri, tetra, penta, hexa, hepta) para los subíndices. A) De Óxidos: Nombre del Prefijo-óxido de prefijo- elemento de la izquierda Ejemplos: Fe2O3 Trióxido de dihierro; CO2: Dióxido de carbono. El prefijo “mono”, se puede omitir a veces. B) Del resto de compuestos binarios: Nombre del Nombre del Prefijo- elemento de - URO de prefijo- elemento de la derecha la izquierda Ejemplos: PCl5 Pentacloruro de fósforo; NH3 Trihidruro de nitrógeno H2S Monosulfuro de dihidrógeno; NaCl Cloruro de sodio. NOMENCLATURA DE STOCK: No utiliza prefijos. Se indica en números romanos y entre paréntesis la valencia del elemento de la izquierda, cuando este elemento puede actuar con varias valencias. Si el elemento tiene una sola valencia no hace falta especificarla. ¡Cuidado! Hay que fijarse si los subíndices se han simplificado. A) De Óxidos: Óxido de Nombre del elemento de la izquierda Valencia del elemento de la izquierda Ejemplos: Fe2O3 Óxido de hierro (III); CO2 Óxido de carbono (IV) ; Li2O Óxido de litio ; Cu2O Óxido de cobre (I) B) Del resto de compuestos binarios: Nombre del elemento de – URO de la derecha Nombre del elemento de la izquierda Valencia del elemento de la izquierda Ejemplos: NaCl Cloruro de sodio; NH3 Hidruro de nitrógeno (III) H2S sulfuro de hidrógeno; PCl5 Cloruro de fósforo (V).