FORMULACION4ESOgascanda
Anuncio

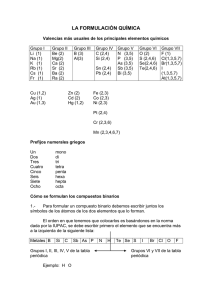
Física y química 4º ESO FORMULACIÓN Compuestos inorgánicos Na2CO3 H 2 SO4 MgF2 FORMULACIÓN Física y química 4º ESO I. Elementos. Valencias II. Sustancias simples III. Combinaciones binarias del hidrógeno A. B. C. Hidrácidos Hidrógeno con otros no metales Hidruros metálicos IV. Combinaciones binarias del oxígeno A. B. Óxidos metálicos Óxidos no metálicos V. Sales binarias VI. Hidróxidos VII. Oxoácidos VIII. Oxosales (Sales ternarias) FORMULACIÓN I. Física y química 4º ESO Elementos. Valencias Los elementos químicos se representan mediante un símbolo que consta de una o dos letras, hasta el nº 105. A partir de éste tienen tres letras. La primera letra se pone siempre en mayúscula, y las siguientes, si las hay, en minúscula. Símbolos de los alquimistas Símbolos de Dalton Los nombres tienen diversas procedencias: el país dónde se obtuvo, quién lo descubrió, la mitología, ... Los símbolos pueden derivar del nombre en latín. FORMULACIÓN I. Física y química 4º ESO Elementos. Valencias Para formular un compuesto es útil suponer que está constituido por iones. La carga imaginaria, positiva o negativa, que se asigna a cada elemento se denomina nº de oxidación o valencia. Siempre se debe cumplir que la suma de todos los números de oxidación de todos los átomos de los elementos que forman parte de un compuesto debe ser cero. Ejemplos +2 −1 MgCl2 : Mg ; Cl ⇒ ( +2 ) + 2 ⋅ ( −1) = 0 +1 +6 −2 H 2 SO4 : H ; S ; O ⇒ 2 ⋅ ( +1) + ( +6 ) + 4 ⋅ ( −2 ) = 0 FORMULACIÓN I. Física y química 4º ESO Elementos. Valencias Las valencias más usuales de los elementos son las que aparecen en la tabla: En cada tipo de compuesto se indicará qué valencias utiliza cada elemento. En las fórmulas de los compuestos, se escribirán en primer lugar los átomos de los elementos que tengan valencia positiva. FORMULACIÓN II. Física y química 4º ESO Sustancias simples Sustancias simples son aquellas que están constituidas por un solo elemento. En general, muchos elementos gaseosos suelen encontrarse en forma diatómica: O2, N2, H2, ... Ejemplos Nombre Común Nombre sistemático H2 hidrógeno dihidrógeno F2 flúor diflúor Cl2 cloro dicloro N2 nitrógeno dinitrógeno O2 oxígeno dioxígeno O3 ozono trioxígeno Fe hierro hierro Ag plata plata FORMULACIÓN III. Física y química 4º ESO Combinaciones binarias del hidrógeno El hidrógeno tiene la peculiaridad de poder ceder un electrón o ganarlo por lo que puede dar lugar a variados tipo de compuestos. En las combinaciones binarias puede ser la parte más electropositiva, la más electronegativa o presentar enlaces covalentes. A. Hidrácidos Son combinaciones del hidrógeno con F, Cl, Br, I, S, Se y Te. El hidrógeno tiene siempre valencia positiva (I). El otro elemento, la valencia negativa que posea. Fórmula general Hn X n: valencia del no metal (sin signo) FORMULACIÓN III. Física y química 4º ESO Combinaciones binarias del hidrógeno A. Hidrácidos Fórmula general: Hn X Nombre sistemático en solución acuosa HF fluoruro de hidrógeno ácido fluorhídrico HCl cloruro de hidrógeno ácido clorhídrico H2Te telururo de hidrógeno ácido telurhídrico HBr HI H2Se H2S FORMULACIÓN Física y química 4º ESO III. Combinaciones binarias del hidrógeno B. Hidrógeno con otros no metales Estos compuestos tienen enlaces covalentes y no presentan propiedades ácidas El hidrógeno se coloca en segundo lugar. Tienen nombre comunes. Fórmula general: XH n Nombre común Nombre sistemático NH3 Amoniaco trihidruro de nitrógeno PH3 Fosfina trihidruro de fósforo AsH3 Arsina trihidruro de arsénico SbH3 estibina trihidruro de antimonio CH4 metano SiH4 silano tetrahidruro de silicio FORMULACIÓN III. Física y química 4º ESO Combinaciones binarias del hidrógeno C. Hidruros metálicos Son combinaciones del hidrógeno con los metales. Fórmula general: MH n n es la valencia mayor del metal. Nombre IUPAC Nombre sistemático LiH hidruro de litio hidruro de litio MgH2 hidruro de magnesio dihidruro de magnesio AlH3 hidruro de aluminio trihidruro de aluminio GaH3 hidruro de galio trihidruro de galio SnH4 hidruro de estaño tetrahidruro de estaño FORMULACIÓN Física y química 4º ESO Prefijos y sufijos en la nomenclatura tradicional Nº de valencias 2 3 4 valencia prefijos sufijos mayor -ico menor -oso mayor -ico siguiente -oso menor hipo- -oso mayor per- -ico siguiente -ico siguiente -oso menor hipo- -oso FORMULACIÓN IV. Física y química 4º ESO Combinaciones binarias del oxígeno A. Óxidos metálicos Son combinaciones del oxígeno con los metales. El oxígeno tiene valencia –II y el metal cualquiera de sus valencias. Para formular el compuesto se intercambian las valencias y si se puede se simplifica. Fórmula general: M 2On n es la valencia del metal. Nombre sistemático Nombre Stock Nombre antiguo Na2O óxido de disodio óxido de sodio óxido sódico FeO óxido de hierro óxido de hierro (II) óxido ferroso Fe2O3 trióxido de dihierro óxido de hierro (III) óxido férrico SnO óxido de estaño óxido de estaño (II) óxido estannoso SnO2 dióxido de estaño óxido de estaño (IV) óxido estánnico FORMULACIÓN IV. Física y química 4º ESO Combinaciones binarias del oxígeno B. Óxidos no metálicos Son combinaciones del oxígeno con los no metales. El oxígeno tiene valencia –II y el no metal cualquiera de sus valencias positivas. Para formular el compuesto se intercambian las valencias y si se puede se simplifica. Fórmula general: X 2On n es la valencia del no metal. Nombre sistemático Nombre Stock Nombre antiguo* SO óxido de azufre óxido de azufre (II) óxido hiposulfuroso SO2 dióxido de azufre óxido de azufre (IV) óxido sulfuroso SO3 trióxido de azufre óxido de azufre (VI) óxido sulfúrico Br2O óxido de dibromo óxido de bromo (I) óxido hipobromoso Br2O3 trióxido de dibromo óxido de bromo (III) óxido bromoso Br2O5 pentaóxido de dibromo óxido de bromo (V) óxido brómico Br2O7 heptaóxido de dibromo óxido de bromo (VII) óxido perbrómico *En la nomenclatura tradicional, en algunos casos puede utilizarse el término anhídrido. FORMULACIÓN V. Física y química 4º ESO Sales binarias Son combinaciones de un metal y un no metal. El no metal tiene siempre la valencia negativa y el metal cualquiera de sus valencias positivas. Para formular el compuesto se intercambian las valencias y si se puede se simplifica. Fórmula general: Mn Xm n es la valencia del no metal. m es la valencia del metal. Nombre sistemático Nombre Stock Nombre antiguo NaCl cloruro de sodio cloruro de sodio cloruro sódico MgBr2 dibromuro de magnesio bromuro de magnesio bromuro magnésico Fe S sulfuro de hierro sulfuro de hierro (II) sulfuro ferroso Fe2S3 trisulfuro de dihierro sulfuro de hierro(III) sulfuro férrico CuI yoduro de cobre yoduro de cobre (I) yoduro cuproso nitruro de calcio fluoruro estannoso FORMULACIÓN VI. Física y química 4º ESO Hidróxidos Son combinaciones de un metal el ión OH- (ión/anión hidróxido). El metal tiene cualquiera de sus valencias positivas. Para formular el compuesto se intercambian las valencias. Fórmula general: M (OH )m m es la valencia del metal. Nombre sistemático Nombre Stock Nombre antiguo Ca(OH)2 dihidróxido de calcio hidróxido de calcio hidróxido cálcico Fe(OH)2 dihidróxido de hierro hidróxido de hierro (II) hidróxido ferroso Fe(OH)3 trihidróxido de hierro hidróxido de hierro (III) hidróxido férrico Sn(OH)2 Sn(OH)4 hidróxido de plomo (II) trihidróxido de cobalto FORMULACIÓN Física y química 4º ESO VII. Oxoácidos Son combinaciones de hidrógeno, oxígeno y un átomo central que generalmente es un no metal, aunque en ocasiones puede ser un metal con un número de oxidación elevado. El hidrógeno tiene siempre valencia +I, el oxígeno –II y el átomo central cualquiera de sus valencias positivas. Fórmula general: H a X bOc Para obtener la fórmula podemos hacerlo de dos formas: i. A partir del óxido correspondiente. Por ejemplo, queremos formular el ácido nítrico: Escribimos la fórmula del óxido nítrico: N2O5. Le “sumamos” una molécula de agua: N2O5 + H2O→ H2N2O6 Por último, simplificamos si es posible: HNO3 Ejercicio: formular el ácido hiposulfuroso Solución: H2SO2 FORMULACIÓN Física y química 4º ESO VII. Oxoácidos ii. Mediante determinación del número de oxidación del átomo central. Por ejemplo, queremos formular el perclórico: Del prefijo per y del sufijo ico determinamos la valencia del cloro: +VII Le añadimos los oxígenos necesarios para que la suma de las valencias del átomo central y del total de oxígenos nos de el primer valor negativo. En este caso debemos añadir 4 oxígenos: 7 (Cl) + 4 x (-2) (O) = -1 Obtenemos con ello el siguiente anión: ClO4Añadimos los hidrógenos necesarios para que el compuesto sea eléctricamente neutro: HClO4 Ejercicio: formular el ácido yodoso Solución: HIO2 FORMULACIÓN Física y química 4º ESO VII. Oxoácidos Para nombrar los ácidos primero debemos determinar la valencia del átomo central. Ejemplo: H2CO3 Aplicamos la regla de que la suma de las valencias de todos los átomos que intervienen en un compuesto debe ser 0. Como el hidrógeno tiene valencia +I, y el oxígeno –II, El hidrógeno tiene valencia +I, y el oxígeno –II; el carbono debe tener valencia 2g(+1) + x +3g(−2) = 0 ⇒ x = +4 H C O Para nombrarlo tenemos tres posibilidades. C FORMULACIÓN Física y química 4º ESO VII. Oxoácidos Nombre sistemático Nombre Stock Nombre tradicional H2CO3 ácido trioxocarbónico (IV) trioxocarbonato (IV) de h. ácido carbónico HClO2 Ácido dioxoclórico (III) dioxoclorato (III) de h. ácido cloroso H2SeO4 HIO ácido teluroso tetraoxosulfato (VI) de h. ácido trioxobrómico (V) FORMULACIÓN Física y química 4º ESO VIII. Sales ternarias Son el resultado de la sustitución del hidrógeno de los oxoácidos por un metal. Están constituidas por un anión complejo y un catión. Por ejemplo: Na2 SO4 Se obtiene por sustitución del hidrógeno de ácido sulfúrico: H 2 SO4 Al quitar los hidrógenos queda el anión SO 2− 4 Como el sodio tiene valencia +I, necesitamos dos iones Na+ para compensar la carga del anión. Para nombrarlos se obtiene la valencia del átomo central de modo similar a como hacemos en los oxoácidos. Hay dos formas de nombrarlos. FORMULACIÓN Física y química 4º ESO VIII. Sales ternarias Nombre sistemático Nombre Stock Nombre tradicional KNO2 dioxonitrato (III) de potasio nitrito de potasio Nitrito potásico CuClO4 tetraoxoclorato (VII) de cobre (I) perclorato de cobre (I) perclorato cuproso FeSO4 Al(NO3)3 yodato magnésico Sulfito de platino (IV) trioxobromato (V) de sodio