GRADO EN INGENIERÍA MECÁNICA (GR. 1, 4) CURSO 2013
Anuncio

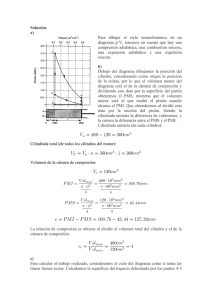
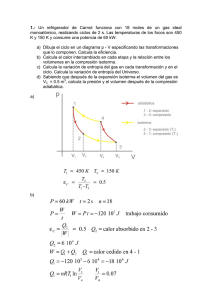
GRADO EN INGENIERÍA MECÁNICA (GR. 1, 4) Enunciados de problemas de Termodinámica Técnica CURSO 2013-2014 Primer principio de la Termodinámica: Conceptos fundamentales y sistemas cerrados 3.1.- Se comprime un gas desde V1 = 0.09 m3 y p1 = 1 bar hasta V2 = 0.03 m3 y p2 = 3 bar. La relación entre la presión y el volumen durante el proceso se puede considerar lineal. Determine el trabajo puesto en juego durante el proceso, en kJ. 3.2.- Una masa de aire sigue dos procesos consecutivos: a) Proceso 1-2: Compresión politrópica (n=1.3) desde p1 = 100 kPa y v1 = 0.04 m3/kg hasta v2 = 0.02 m3/kg. b) Proceso 2-3: Expansión a presión constante hasta el volumen inicial. Se pide representar el proceso en un diagrama p-v y calcular el trabajo específico realizado en el proceso, en kJ/kg 3.3.- Un sistema cerrado inicialmente en reposo sobre la superficie de la Tierra es sometido a un proceso en el que recibe una transferencia neta de energía en forma de trabajo igual a 200 kJ. Durante dicho proceso tiene lugar una transferencia neta de energía calorífica desde el sistema al entorno de 30 kJ. En el estado final, el sistema ha adquirido una velocidad de 60 m/s y una altura de 60 m. Considere que la masa del sistema es de 25 kg y la aceleración local de la gravedad es de 9,8 m/s2. Se pide determinar la variación de energía interna del sistema para el mencionado proceso, en kJ. 3.4.- Se tienen 5 kg de vapor de agua contenidos dentro de un dispositivo cilindro-pistón. El vapor sufre una expansión desde el estado 1, donde la energía interna específica es de 2709.9 kJ/kg hasta el estado 2 donde dicha magnitud toma un valor de 2659.6 kJ/kg. Durante el proceso, hay una transferencia de calor al vapor igual a 80 kJ. Además con una rueda de paletas se le transfiere una energía en forma de trabajo por valor de 18.5 kJ. Despreciando las variaciones de energía cinética y energía potencial del sistema, se pide calcular, en kJ, la cantidad de energía transferida por trabajo desde el vapor al pistón durante el proceso. GRADO EN INGENIERÍA MECÁNICA (GR. 1, 4) Enunciados de problemas de Termodinámica Técnica CURSO 2013-2014 3.5.- Un gas contenido se encuentra en un depósito rígido cerrado provisto de una rueda de paletas que gira durante 20 minutos con una potencia variable según W = -10·t (W en watios y t en minutos). La transferencia de calor desde el gas al entorno se realiza con un flujo constante de 50 W. Se pide determinar: a) la velocidad de cambio de la energía del gas en el instante t = 10 min, en W. b) el cambio neto de energía en el gas después de 20 minutos, en kJ 3.6.- 0.5 g de CO2 están contenido en un dispositivo cilindro-pistón como el de la figura. En el estado inicial la cara interna del pistón se encuentra en la posición x = 0 y el muelle no ejerce fuerza alguna sobre el pistón. Como resultado de la transferencia de calor el gas se expande elevando al pistón hasta que tropieza con los topes. En ese momento su cara interna se encuentra en x = 0.06 m y cesa el flujo de calor. La fuerza ejercida por el muelle varía linealmente con la posición x con una constante de propocionalidad k = 9000 N/m. Considere despreciable el rozamiento entre el pistón y la pared del cilindro, así como un valor de 9.81 m/s2 para la aceleración de la gravedad. Se pide determinar: a) La presión inicial del gas, en kPa b) El trabajo realizado por el gas sobre el pistón c) Sabiendo que el volumen inicial ocupado por el gas es de 234 cm3, calcule la temperatura final del gas y el calor transferido en J. Considere que el CO2 se comporta como un gas ideal y que su capacidad calorífica a volumen constante es de 0.64 kJ/(kg·K) 5/2 y 3/2 , cambia desde un estado inicial a p1 = 1 bar y 3.7.- Un gas ideal, 3 V1 = 10 m hasta un estado final con p2 = 10 bar v2 = 1 m3, mediante los siguientes procesos mecánicamente reversibles: a) compresión isoterma b) compresión adiabática seguida de un enfriamiento a presión constante c) compresión adiabática seguida de un enfriamiento a volumen constante d) calentamiento a volumen constante seguido de un enfriamiento a presión constante e) enfriamiento a presión constante seguido por un calentamiento a volumen constante Calcúlese Q, W, ΔU y ΔH para cada uno de estos procesos y dibújense las distintas evoluciones sobre un diagrama p-v. 3.8.- Un mol de metano a 9 atm y 27 ºC experimenta sucesivamente las siguientes transformaciones: a) 1-2 compresión adiabática según proceso cuasiestático sin rozamiento hasta reducir su volumen a la cuarta parte. b) 2-3 enfriamiento isométrico, según proceso cuasiestático hasta la temperatura inicial. c) 3-1 expansión libre y adiabática hasta el estado inicial. Suponiendo que el metano se comporta como un gas ideal, calcúlese el trabajo realizado y el calor absorbido por el gas en cada etapa y en el proceso total, así como las variaciones de 6.5 cal/mol/K) energía interna en cada etapa y en el proceso total. ( 3.9.- Un gas ideal ( 2.98 cal/mol/K), describe un ciclo de Carnot entre las temperaturas de 500 K y 300 K, siendo la mayor presión 10 atm y el volumen final de esta isoterma 5 veces el 5 ). Se pide calcular: primitivo ( GRADO EN INGENIERÍA MECÁNICA (GR. 1, 4) Enunciados de problemas de Termodinámica Técnica CURSO 2013-2014 a) Calor y trabajo puestos en juego, así como las variaciones de energía interna en cada etapa. b) Calor absorbido por el gas y el trabajo realizado por el mismo en un ciclo así como el rendimiento térmico del ciclo. NOTAS: El ciclo de Carnot está compuesto por dos procesos isotermos y dos procesos adiabáticos: 1-2 expansión isoterma a la temperatura superior, 2-3 expansión adiabática, 3-4 compresión isoterma a la temperatura inferior y 4-1 compresión adiabática. Además, el rendimiento térmico del ciclo se puede definir como la relación entre el trabajo neto obtenido y el calor absorbido por el ciclo. 3.10.- Hidrógeno a 5 atm y 400 K se expande isobáricamente hasta que su temperatura se hace doble que la inicial. A continuación se somete a un enfriamiento isométrico hasta la temperatura de 400 K. Suponiendo que el gas se comporta como ideal y sabiendo que su capacidad calorífica molar a volumen constante es de 4.98 cal/mol/K, se pide calcular la variación de energía interna así como el trabajo y el calor puestos en juego, en cada etapa del proceso y en el proceso global.