RESPUESTAS BLOQUE III Ponte en forma 1.
Anuncio
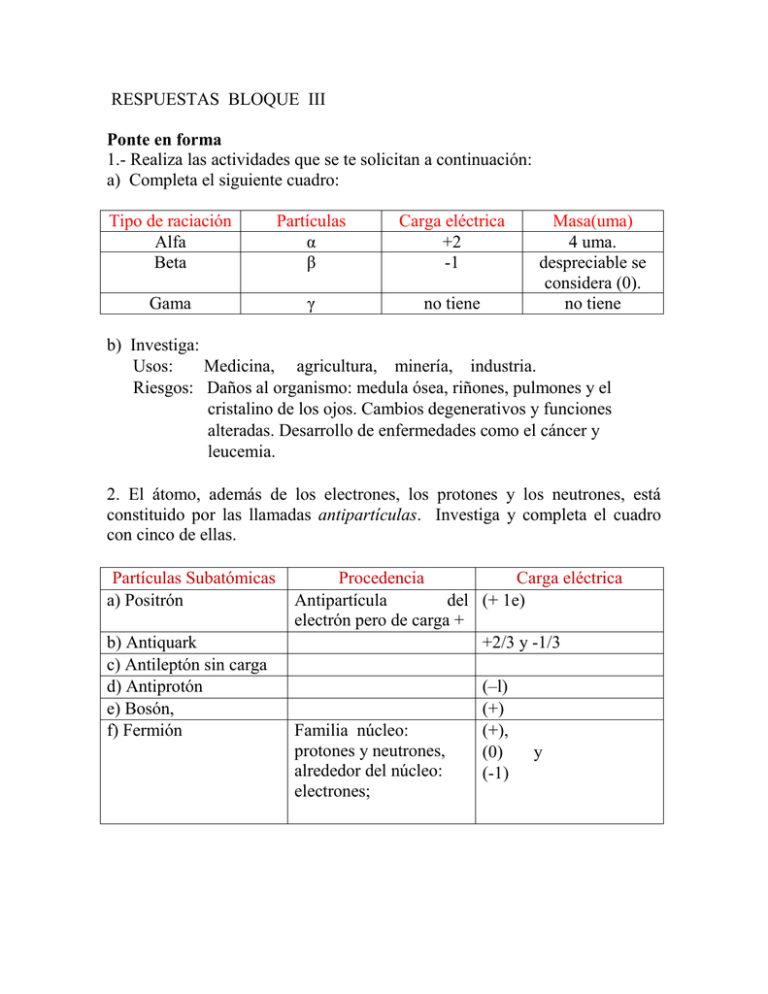
RESPUESTAS BLOQUE III Ponte en forma 1.- Realiza las actividades que se te solicitan a continuación: a) Completa el siguiente cuadro: Tipo de raciación Alfa Beta Partículas α β Carga eléctrica +2 -1 Gama γ no tiene Masa(uma) 4 uma. despreciable se considera (0). no tiene b) Investiga: Usos: Medicina, agricultura, minería, industria. Riesgos: Daños al organismo: medula ósea, riñones, pulmones y el cristalino de los ojos. Cambios degenerativos y funciones alteradas. Desarrollo de enfermedades como el cáncer y leucemia. 2. El átomo, además de los electrones, los protones y los neutrones, está constituido por las llamadas antipartículas. Investiga y completa el cuadro con cinco de ellas. Partículas Subatómicas a) Positrón b) Antiquark c) Antileptón sin carga d) Antiprotón e) Bosón, f) Fermión Procedencia Carga eléctrica Antipartícula del (+ 1e) electrón pero de carga + +2/3 y -1/3 Familia núcleo: protones y neutrones, alrededor del núcleo: electrones; (–l) (+) (+), (0) (-1) y 3.Completa la siguiente tabla: Elemento Carbono Z 6 A 12 p+ 6 e6 n0 6 Al Zn Sb 13 30 51 27 65 122, 13 30 51 13 30 51 14 35 71 4. Completa la siguiente tabla: Isótopos 39 K 40 19 Z A p+ en° K 41 19 19 39 19 19 20 K 19 19 40 19 19 21 19 41 19 19 22 a) Compara los isótopos del potasio del ejercicio anterior; identifica y anota sus diferencias. Difieren en el número de masa (A) y en el número de neutrones (n°). b) Define con tus palabras el concepto de isótopo. Son átomos del mismo elemento con diferente número de masa y diferente masa atómica. 5.- Un isótopo de cobalto (Co) es utilizado en radioterapia para combatir algunos tipos de cáncer. Escribe los símbolos nucleares de tres isótopos del cobalto (Z = 27) en los que hay 29, 31, 33 neutrones respectivamente. Primer isótopo 56 Co 27 Segundo isótopo 58 Co 27 Tercer isótopo 60 Co 27 6.- El bromo es el único no metal que es líquido a temperatura ambiente. Considera el isótopo de bromo -81. Determina el número atómico, número de neutrones y número de masa, y llena la siguiente tabla. Símbolo Nuclear Z A n° 35 81 46 81 35 Br 7.- Uno de los componentes más dañinos de los residuos nucleares es un isótopo radiactivo del estroncio, el cual puede depositarse en los huesos, donde sustituye al calcio. ¿Cuántos protones y neutrones hay en el núcleo del Sr-90? Símbolo nuclear p+ n0 38 52 90 38 Sr 8.- El I - 123 es un isótopo radiactivo que se utiliza como herramienta de diagnóstico por imágenes. ¿Cuántos neutrones hay en el I – 123? Símbolo nuclear n0 123 53 70 I 9.- Los átomos X, Y, Z y R tienen las siguientes composiciones nucleares X Z = 186, A = 410, W z = 186 A = 410, Y Z = 410 A = 186, Z Z = 412 A = 412 , R Z = 185 A 412. Identifica cuales son los isótopos y explica por qué. X, Y, Z. Porque tienen el mismo número atómico, Z = 186 10.- Determina los datos que se te piden y completa la tabla. Isótopos Ne – 20 Notación isotópica 20 21 10 Ne – 22 p+ e- n0 10 20 10 10 10 10 21 10 10 11 10 22 10 10 12 Ne 22 10 A Ne 10 Ne – 21 Z Ne 11.- Calcula el número de partículas subatómicas que constituyen a los siguientes isótopos: Isótopos Notación isotópica Z A p+ en0 O - 17 17 8 17 8 8 9 O 8 Pb - 204 204 82 U - 238 204 82 82 122 U 92 238 92 92 146 C 6 13 6 6 7 238 92 C - 13 82 Pb 13 6 12.- ¿Cuál es el número atómico del átomo con 12 protones, 14 neutrones y 12 electrones? Z = 12 13.- ¿En qué se diferencian los isótopos hierro – 54, hierro – 56 y hierro – 57? En el número de Neutrones y en el número de masa. 14.- De las siguientes expresiones, elige y encierra en un círculo la representación correcta para un átomo de cobalto que tiene 27 protones y 33 neutrones. 60 27 Co 16.- Calcula la masa atómica de los siguientes elementos y compara tu resultado con el reportado en la tabla periódica. Cálculo: K 39.3712 uma M.A. reportada en la tabla periódica; 39.10 uma Cálculo: Li 6.9258 uma M.A. reportada en la tabla periódica: 6.941 uma Cálculo: Pb 206.524 uma M.A. reportada en la tabla periódica: 207.2 uma 18.- Actualmente, el efecto fotoeléctrico tiene diferentes aplicaciones, por ejemplo, el abrir y cerrar un portón automático, las barras de seguridad en las salidas de las tiendas departamentales, entre otras. A partir de esto: a) Busca tres aplicaciones y anótalas. Detectores de movimiento, alumbrado público, regulador de toner en fotocopiadoras, celdas solares, etc . 19.- Completa el siguiente cuadro que resume los valores de los cuatro números cuánticos: n l n = 1 m y s Núm. De epor subnivel Núm. De e- por nivel. 2 2 s l=0 l=0 s 2 n=2 8 l=1 p 6 s l=0 2 p n=3 l=1 6 18 d l=2 10 s l=0 2 p l=1 n=4 6 d l=2 10 f l=3 14 32 22. Completa el siguiente cuadro de los números cuánticos. Número Cuántico n l m Indica nivel energético subnivel energético Orientación espacial del orbital atómico f= Espín Valores 0, 1, 2 ….. ∞ s = 0,p = 1, d = 2 y f = 3 s= 0 p = -1 0 +1 d = -2 -1 0 +1 +2 -3 -2 -1 0 +1 +2 giro del electrón sobre su propio eje +1/2 – l/2 21. Elabora las configuraciones electrónicas de los siguientes elementos. Elemento 56Ba Configuración electronica 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2 24Cr 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 51Sb 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p3 92U 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2, 5f4 47Ag 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d8 22. Elabora las configuraciones electrónicas de los gases nobles y explica que tienen en común. Gas Noble 2He 10Ne Configuración electrónica 1s2 1s2, 2s2, 2p6 18Ar 1s2, 2s2, 2p6, 3s2, 3p6 36Kr 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6 54Xe 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6 86Rn 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6 +3 23. Elabora las siguientes configuraciones electrónicas, utilizando la regla de Kernel. Elemento K 19 Potasio Pd 46 Paladio I 53 Iodo U 92 Uranio Pb 82 Plomo Fe 26 Hierro Configuración electrónica [18Ar] = 4s1 [36Kr] = 5s2, 4d8 [36Kr] = 5s2, 4d10, 5p5 [86Rn] = 7s2, 5f4 [54Xe] = 6s2, 4f14, 5d10, 6p2 [18Ar] = 4s2, 3d6 24. Realiza los ejercicios que se te piden en la siguiente tabla. Elemento Configuración Configuración Diagrama Electrónica Kernell Energético B 5 Boro 1s2, 2s2, 2p1 [2He] 2s2, 2p1 Ca 20 Calcio 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 [18Ar] 4s2 V 23 Vanadio 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d3 [18Ar] 4s2, 3d3 Ce 58 Cerio [ 2 He] 2 6 2 1s , 2s2, 2p , 3s , 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f2 2S 4s2 2 2 [54Xe] 6s , 4f 2p 2p 2p 3d 3d 3d 3d 3d ¿Qué dices ahora? 2.Describir a) Fluorescencia: Propiedad de ciertas sustancias de absorber energía en forma de radiación electromagnética de onda corta (ejemplo: rayos γ, rayos X, rayos UV) para posteriormente emitirla en forma de radiación electromagnética de onda más larga, generalmente del espectro visible. Fosforescencia: Propiedad de ciertas sustancias de absorber energía en forma de radiación electromagnética, almacenarla y posteriormente emitirla en forma de radiación. ¿Estás en forma? 1.- ¿Cuáles son las tres partículas fundamentales que constituyen los átomos? Menciona su carga eléctrica y su ubicación dentro del átomo. Partículas nucleares: protón (+1), neutrón (0). Girando alrededor del núcleo el electrón (-1) 2. La erupción volcánica del Monte Santa Elena, en el estado de Washington, E.U.A., produjo una sustancia pura, radiactiva, en estado gaseoso y con 86 protones en su átomo. Determina a qué elemento corresponde. 86 Rn 3.- Representa la notación isotópica de los átomos con las siguientes características. Elemento Flúor con 10 neutrones Notación isotópica 19 F 9 Cobalto con 33 neutrones 60 Co 27 Xenón con 78 neutrones 132 54 Xe 5.- Un elemento radiactivo utilizado en los detectores de humo es americio241. Completa la siguiente tabla con el número de protones, electrones y neutrones que tiene su átomo. p+ n0 e- 95 146 95 Símbolo nuclear 241 Am 95 6. a) ¿Cuántos electrones poseen los átomos de argón (Ar), de número atómico 18, en su capa o nivel de energía más externo? 8 e7.- Subraya la respuesta correcta. a) ¿Cuál de las siguientes configuraciones electrónicas corresponde al átomo de Cromo? 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 b) ¿Cuál es la localización de los electrones externos del átomo de azufre que influyen notablemente en sus propiedades químicas? Subnivel 3p c) ¿Qué tienen en común las configuraciones electrónicas de los átomos de Be, Ca y Ba? Terminan en el subnivel s d) ¿Qué tienen en común las configuraciones electrónicas de los átomos de Fe, Ni, Cu y Zn? Sus electrones ocupan el mismo número de niveles energéticos.









