UNIVERSIDAD DON BOSCO DEPTO. DE CIENCIAS BASICAS
Anuncio

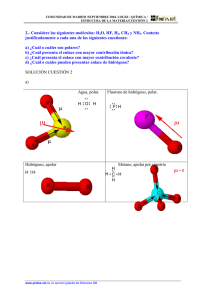
UNIVERSIDAD DON BOSCO DEPTO. DE CIENCIAS BASICAS QUIMICA GENERAL Y QUÍMICA I CICLO I-2009 DISCUSIÓN DE PROBLEMAS No. 3 UNIDAD 3: ENLACE QUÍMICO OBJETIVOS: Al resolver esta discusión de problemas, el estudiante: Diferenciarán entre los diversos tipos de enlaces interatómicos: iónico, covalente no polar, covalente polar, covalente dativo y covalente múltiple. Explicará los enlaces por medio de la estructura de Lewis. Formará compuestos ionicos binarios. Utilizando una tabla de electronegatividades, determinara el tipo de enlace interatómico presente en la molécula. En una molécula determinará el número de enlaces sigma y pi. De un listado de compuestos diferenciará los enlaces intermoleculares: puente de hidrógeno y fuerzas de Van der Waals. Diferenciará las funciones químicas inorgánicas. Escribirá la fórmula de compuestos químicos, utilizando la tabla de valencias. 1. 2. Establecer la diferencia que existe entre: a) Enlace iónico y covalente. c) Enlace simple, doble y triple. e) Molécula polar y apolar g) Enlace covalente polar y dativo i) Enlace interatómico e intermolecular k) sal oxisal y sal haloidea m) ácido oxácido y ácido hidrácido b) Orbital atómico y molecular d) Enlace polar y no polar f) Enlace sigma y pi h) Valencia y número de oxidación j) Compuesto iónico y covalente l) óxido básico y óxido ácido n) hidruro iónico e hidruro molecular Determine si cada una de las proposiciones es cierta o falsa. JUSTIFIQUE LAS FALSAS. a) Los compuestos iónicos presentan elevadas propiedades físicas como producto de elevadas fuerzas de atracción entre los iones. ______ b) En un enlace covalente se compartan electrones entre átomos de igual o cercana electronegatividad ______ c) Entre enlaces sigma y pi; los sigma se forman primero y son los que determinan la forma de la molécula. ______ d) Los enlaces Pi no son tan fuertes como los sigma, pero afectan la forma de la molécula. ______ e) Un enlace covalente triple es aquel en que los tres átomos comparten un par de electrones. ______ f) Los elementos IA y IIA pierden electrones “s” en sus reacciones para formar iones monoatómicos +1 y +2; el aluminio pierde 2 electrones “s” y un electrón “p” para formar el ión Aluminio +3. ______ g) Los enlaces múltiples son más cortos que los enlaces simples por el aumento de la densidad electrónica, razón por la cual los múltiples son menos reactivos. ______ h) Los no metales presentan número de oxidación positivo cuando se unen a elementos más electronegativos. 1 ______ i) Si al formar un enlace se transfieren tres electrones, se establece un enlace iónico múltiple. ______ j) Los metales son conductores porque poseen electrones deslocalizados ________ k) El enlace por puente de hidrógeno se da en las moléculas que contienen hidrógeno y los elementos más electronegativos. ________ l) Las fuerzas de Van der Waals son mas fuertes que los enlaces por puente de hidrógeno. _________ 3. Determinar el número de enlaces sigma y de tipo “pi” que se forman en cada una de las estructuras siguientes: a) N N b) H2C = CH2 c) O = C = O d) O – N = O e) O = O f) H – C N 4. Con base en la tabla de electronegatividades (página 83 del manual de laboratorio) y dados los siguientes enlaces: Al – S P – Cl Mg - Cl K–F H–H Na - Cl P–O Li – S Cl – Cl Na – Br S–O 4.1) Ordenarlos en forma creciente respecto a su carácter polar 4.2) En cuales prevalece el carácter iónico. 4.3) Cuáles son NO POLARES. 5. De los compuestos siguientes, clasificar como polares o no polares: a) H2O b) CF4 c) Br2 d) F2 e) CO2 K – Br f) NH3 6. Conteste en forma breve y correcta. 6.1 ¿Qué tipo de elementos participan en la formación de un enlace iónico? 6.2 ¿Qué tipo de elementos forman enlaces covalentes, preferentemente? 6.3 ¿Qué propiedad de los elementos define la polaridad de un enlace? 6.4 Escriba la capa de valencia para los elementos del grupo 1 A, grupo 2 A. y 3A 7. Escriba las estructuras de lewis de los siguientes compuestos: a) Na2O b) Ca Cl2 c) NH3 d) CO2 e) CH4 f) H2 O 8. Indicar el tipo de fuerza intermolecular que existe entre los siguientes pares de compuestos. a) HBr y H2S b) I2 y NO3c) NH3 y C6H6 9- ¿Cuáles son los elementos que pueden formar puente de hidrógeno? 10. ¿Cuáles de las siguientes especies pueden unirse entre si por puente de hidrógeno? a) C2H6 b) HI c) KF d) BeH2 e) CH3COOH 2 11. ¿Cuáles de los siguientes compuestos pueden formar puentes de hidrógeno con el agua? a) CH3OCH3 b) CH4 c) Fd) HCOOH e) Na+ 12. Escriba un concepto y dos fórmulas de compuestos, de cada función química. (Ver resumen de funciones químicas inorgánicas) 8.1 Oxido ácido 8.2 Acido oxácido 8.3 Oxido bácico 8.4 Acido hidrácido 8.5 Hidróxido 8.6 Hidruro metálico 8.7 Hidruro molecular 8.8 Hidruro iónico 8.9 Sal haloidea 8.10 Sal oxisal 13. Completar, escribiendo el compuesto formado, en el siguiente cuadro resumen METAL IA LITIO (Li) OXIDOS HIDROXIDOS HIDRUROS SODIO (Na) POTASIO (K) RUBIDIO (Rb) CESIO (Cs) 14- Completar, escribiendo el compuesto formado, en el siguiente cuadro resumen METAL 2A BERILIO (Be) OXIDOS HIDROXIDOS HIDRUROS MAGNESIO Mg) CALCIO (Ca) ESTRONCIO (Sr) BARIO (Ba) PARA LOS SGUIENTES PUNTOS, UTILICE LA TABLA DE NÚMEROS DE OXIDACIÓN (VALENCIAS) Y LA TABLA DE LOS RADICALES DE ÁCIDOS. 15. Escribir la fórmula de cada uno de los hidruros moleculares que forman los elementos siguientes: (Use tabla de números de oxidación) a) Halógenos b) Boro c) Azufre d) Fósforo III e) Arsénico f) Oxígeno g) Teluro 16. Escribir la fórmula para todos los hidróxidos posibles de: a) Hierro b) Plomo d) Cobre e) Mercurio. 3 h) Selenio. c) Estaño f) Níquel. 17. Escribir la fórmula de cada uno de los óxidos posibles de los elementos: a) Azufre b) Cobre c) Cloro d) Oro 18. Escriba la fórmula del compuesto formado a partir de cada uno de los siguientes pares de iones: a) Al+3 y N-3 b) V+5 y O-2 c) Fe+3 y (OH)- d) (NH)4+ y S-2 e) Fe+3 y (SO4)-2 f) Na+ y NO3 g) Ag+3 y (CO3)-2 h) K+ y MnO4- i) Zn+2 y PO4-3 j) H+ y SO4-2 MATERIAL DE APOYO ENLACES QUIMICOS ENLACE QUÍMICO. Es la fuerza de unión entre átomos o entre moléculas. La unión interatómica puede ser: iónica, covalente y metálica; los enlaces intermoleculares son esencialmente; puente de hidrógeno y fuerzas de Van der Waals. 1. ENLACE IONICO. Se establece por transferencia total de electrones y se da entre átomos de alejada electronegatividad (Metales y no metales). Durante este proceso de perder o ganar electrones cargados negativamente, los átomos que reaccionan forman iones. Los iones cargados de manera opuesta se atraen entre ellos a través de fuerzas electroestáticas que son la base del enlace iónico. Los compuestos que poseen enlaces iónicos generalmente tienen propiedades físicas elevadas, son solubles en agua, insolubles en solventes orgánicos, cristalinos, conducen la electricidad en estado líquido o en solución acuosa. Los enlaces iónicos más fuertes se establecen entre las familias IA, IIA con los elementos de las familias VI A y VIIA. Por ejemplo, durante la reacción del sodio con el cloro: sodio (en la izquierda) pierde su única valencia de electrones al cloro (a la derecha), resultando en un ión de sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (derecha). 4 2. ENLACE COVALENTE Este enlace se tipifica porque dos átomos comparten un par de electrones, es característico de los no metales y generalmente conlleva a la formación de moléculas. Los átomos que participan pueden ser de igual o diferente naturaleza. Se clasifica en simple, múltiple, normal, dativo, puro y polar. Enlace simple: Para cada par de electrones compartidos entre dos átomos, se forma un enlace covalente (un par de electrones) Enlace Múltiple: Algunos átomos pueden compartir múltiples pares de electrones, formando enlaces covalentes múltiples. Por ejemplo, el oxígeno (que tiene seis electrones de valencia) necesita dos electrones para completar su envoltura de valencia. Cuando dos átomos de oxígeno forman el compuesto O2, ellos comparten dos pares de electrones, formando dos enlaces covalentes Enlace covalente puro o no polar es el que se da entre átomos de igual naturaleza; La molécula H2 es un buen ejemplo del enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar; otro ejemplo es el enlace entre dos átomos de cloro para formar Cl2. Enlace covalente polar. Si los átomos que se enlazan son diferentes (electronegatividades distintas) se forma un enlace polar. La polaridad va a depender de la diferencia de las electronegatividades de cada elemento: a mayor diferencia, el enlace es más polar. Enlace covalente dativo. Es cuando el par de electrones par realizar en enlace es proporcionado por un elemento. 3. ENLACE METÁLICO. Este tipo de enlace se caracteriza porque los electrones de valencia son comunes a todos los átomos. Debido al carácter electropositivo de los metales, los electrones se hallan en completa deslocalización y movimiento infinito, por lo que los metales se caracterizan en su capacidad para conducir el calor y la electricidad; además son lustrosos, maleables, dúctiles, de carácter alcalino, reaccionan con ácidos liberando hidrógeno. En los metales los electrones de valencia envuelven a los núcleos en una nube electrónica permanentemente deslocalizada. 4. PUENTE DE HIDRÓGENO. Es un enlace intermolecular. Se establece entre moléculas que tiene en su estructura “H” y cualquiera de los átomos F-O-N. es un tipo de atracción electrostática y tiene como condición indispensable, que exista un enlace directo entre el hidrógeno y el átomo en consideración. Entre las consecuencias directas del puente de hidrógeno se pueden mencionar: polaridad molecular, formación de redes moleculares, elevación del punto de ebullición, fijación de macromoléculas y solubilidad en agua. 5. FUERZAS DE VAN DER WAALS. Es un tipo de atracción entre dipolos permanentes y/o inducidos. Es el más débil de todos y puede resultar de las siguientes interacciones: dipolo – dipolo, dipolo – dipolo inducido y dipolos inducidos. Estas interacciones no son profundas, no implican solapamientos electrónicos y se caracterizan por ser momentáneas, superficiales y de corto alcance. Las sustancias que lo poseen, generalmente tienen bajos puntos de fusión y ebullición, los líquidos son volátiles y los sólidos generalmente son blandos y de consistencia cerosa; algunos de ellos subliman. 5 CUADRO RESUMEN ENLACE QUÍMICO TIPO DE ENLACE Naturaleza del enlace Fuerte atracción electrostática entre iones Condiciones generales de formación del enlace Propiedades de las sustancias asociadas al Ejemplos tipo de enlace Puntos de fusión y ebullición elevados. Conductores en 1. IONICO estado líquido y en solución acuosa Se da por Compartimiento de Puntos de fusión Compartimien uno, dos o tres pares elevados. to de pares de electrones Cuerpos duros. de electrones formando enlaces Insolubles en sencillos, dobles o casi todos los triples. Se forma solventes. 2. COVALENTE entre átomos de no Generalmente, metales con mal conductor electronegatividades del calor y la iguales o diferentes. electricidad 3. METÁLICO 4. PUENTE DE HIDRÓGENO (Dipolo-Dipolo) 5. DIPOLODIPOLO INDUCIDO 6. FUERZAS DE DISPERSIÓN Transferencia total de electrones entre átomos metálicos y no metálicos de amplia diferencia de electronegatividad Atracciones entre iones de metal y la nube electrónica. Se unen por la atracción entre las cargas positivas de los iones metálicos y las cargas negativas de los electrones móviles. Son fuerzas electrostáticas entre moléculas Son fuerzas entre moléculas. Se da entre moléculas formadas por Hidrógeno y alguno de los elementos del grupo F. O. N. Se da entre una molécula polar y otra no polar Son fuerzas entre moléculas. Existe entre moléculas no polares. Blando a duro. Dúctiles y maleables. Punto de fusión alto o bajo. Buen conductor del calor y electricidad. Entre moléculas polares Explica la solubilidad de no polares en agua Es la fuerza de atracción más débil. 6 NaCl CaH2 SrBr2 KI, MgO C (diamante) SiO2 (cuarzo) Todos los elementos metálicos Ejemplos: Na Mg, Fe, Cu, etc H2O --- H2O HF ---- HF NH3 ----NH3 Carbohidratos y Proteínas. H2O ---- I2 I2 --- I2 O2 --- O2 Las Estructuras de Puntos de Lewis: Las estructuras de puntos de Lewis son una taquigrafía para representar los electrones de valencia de un átomo. Las estructuras están escritas como el elemento del símbolo con puntos que representan los electrones de valencia. Las estructuras de Lewis para los elementos en los dos primeros períodos de la Tabla Periódica se muestran a continuación. Las Estructuras de Puntos de Lewis Las estructuras de Lewis también pueden ser usadas para mostrar el enlace entre átomos. Los electrones que se enlazan se colocan entre los átomos y pueden ser representados por un par de puntos, o un guión (cada guión representa un par de electrones, o un enlace). Las estructuras de Lewis para el H2 y el O2 son: H2 H:H H-H or O2 7 FUNCIONES QUÍMICAS INORGÁNICAS FUNCIÓN QUÍMICA: Grupo de sustancias que poseen comportamiento físico y químico semejantes. GRUPO FUNCIONAL: Átomo o grupo de átomos responsable del comportamiento de una sustancia. ÓXIDO : Son compuestos binarios formados al combinar el oxigeno con un elemento. ÓXIDO ÁCIDO : Combinaciones binarias de un NO METAL con oxígeno. Se les conoce como anhídridos. ÓXIDO BÁSICO : Combinación de un METAL con oxigeno, forma bases al disolverse en agua. HIDRURO : Son compuestos binarios que resultan de la combinación del hidrógeno con un elemento. HIDRURO IÓNICO : Son las combinaciones del hidrogeno con los metales del grupo 1 A y 2A HIDRURO METÁLICO: Combinación del hidrógeno con los metales de transición. HIDRURO MOLECULAR: Son compuestos binários formado por hidrogeno com un no metal o semi metal. Se nombran como halogenuros de hidrogeno. BASE O HIDRÓXIDO: Son compuestos ternarios que contienen hidrógeno, oxígeno y un metal. ÁCIDO HIDRÁCIDO: Son las soluciones acuosas de hidruros moleculares. ÁCIDO OXÁCIDO : Son compuestos ternários que resultan de la combinación de un óxido ácido con agua. SALES : Son los compuestos que resultan de sustituir los hidrógenos de un ácido. Son producto de la reacción entre ácidos y bases. SAL HALOIDEA : Si proviene de un ácido hidrácido SAL OXISAL : Si se origina de un ácido oxácido. 8 SÍMBOLOS Y NUMEROS DE OXIDACION (VALENCIAS) DE LOS ELEMENTOS MÁS FRECUENTES NO METALES Elementos Hidrógeno Flúor Cloro Bromo Yodo Oxígeno Azufre Selenio Teluro Nitrógeno Fósforo Arsénico Antimonio Boro Carbono Silicio METALES Símbolos Valencias H F Cl Br I O S Se Te N P As Sb B C Si 1 Elementos Litio Sodio Potasio Rubidio Cesio Francio Plata Amonio Berilio Magnesio Calcio Estroncio Bario Radio Cinc Cadmio Cobre Mercurio Aluminio Oro Hierro Cobalto Níquel Estaño Plomo Platino Iridio Bismuto Cromo Manganeso 1,3,5,7 2 2,4,6 1,3,5 3,5 3 2,4 9 Símbolos Li Na K Rb Cs Fr Ag + NH4 Be Mg Ca Sr Ba Ra Zn Cd Cu Hg Al Au Fe Co Ni Sn Pb Pt Ir Bi Cr Mn Valencias 1 2 1,2 3 1,3 2,3 2,4 3, 5* 2,3, 6* 2,3,4, 4*,6*,7* RADICALES DE ÁCIDO FÓRMULA NOMBRE FÓRMULA NOMBRE Cromato Acetato CrO4-2 HCO3- Bicarbonato Cr2O7-2 Dicromato CO3-2 Carbonato Cl- Cloruro HCO2- Bicarbonito F- Fluoruro CO2-2 Carbonito Br- Bromuro OCN- Cianato I- Yoduro HSO4- Bisulfato ClO3- Clorato HSO3- Bisulfito ClO4- Perclorato SO4-2 Sulfato ClO2- Clorito SO3-2 Sulfito ClO- Hipoclorito PO4-3 Fosfato SO2-2 Hiposulfito HPO4-2 Bifosfato MnO4- Permanganato OH- Hidroxilo OBr- Hipodromito CN- Cianuro BrO3- Bromato C2O4-2 Oxalato IO3- Yodato SCN- Tiocianato PO3-3 Fosfito NO3- Nitrato AsO4-2 Arseniato NO2- Nitrito O-2 Óxido HC2O4- Bioxalato S2O3-2 Tiosulfato S-2 Sulfuro HS- Bisulfuro N-3 Nitruro IO- Hipoyodito CH3COO - 10