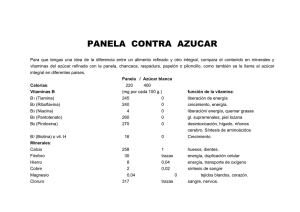
Evaluacion de la funcionalidad de panelas
Anuncio

UNIVERSIDAD SIMÓN BOLÍVAR Decanato de Estudios Profesionales Coordinación de Licenciatura en Química Evaluación de la funcionalidad de panelas artesanales como antioxidante y fuente de minerales Por: María Saray De Andrade Reyes TRABAJO ESPECIAL DE GRADO Presentado ante la ilustre Universidad Simón Bolívar como requisito parcial para optar al Título de Licenciada en Química Sartenejas, noviembre de 2008 UNIVERSIDAD SIMÓN BOLÍVAR Decanato de Estudios Profesionales Coordinación de Licenciatura en Química Evaluación de la funcionalidad de panelas artesanales como antioxidante y fuente de minerales Por: María Saray De Andrade Reyes Realizado con la Asesoría de: Dra. Marisa Guerra TRABAJO ESPECIAL DE GRADO Presentado ante la ilustre Universidad Simón Bolívar como requisito parcial para optar al Título de Licenciada en Química Sartenejas, noviembre de 2008 i UNIVERSIDAD SIMÓN BOLÍVAR Coordinación de Licenciatura en Química Evaluación de la funcionalidad de panelas artesanales como antioxidante y fuente de minerales TRABAJO ESPECIAL DE GRADO presentado por: María Saray De Andrade Reyes RESUMEN En el presente trabajo de investigación se propuso el estudio de la actividad antioxidante y contenido de calcio, hierro, fósforo, potasio, magnesio, manganeso, cobre y zinc en panelas artesanales, a fin de evaluar sus propiedades como posible alimento funcional. Se analizaron once muestras de marcas y lotes diferentes, a las que se le determinó la calidad mediante los parámetros de humedad, sólidos solubles y pH. Los resultados promedio obtenidos fueron: humedad 6,82% para panelas en bloque y 2,95% para panelas granuladas, contenido de sólidos solubles de 94,45 ºBrix y pH 5,95. Para evaluar la actividad antioxidante de las muestras se prepararon extractos metanólicos, obteniéndose un porcentaje de inhibición promedio de 89,64% y un contenido promedio de polifenoles de las muestras de 3,85g de ácido gálico por kg de muestra. Se obtuvo que el contenido promedio de cenizas es de 1,58%, con aportes de calcio, hierro, fósforo, potasio, magnesio, manganeso, cobre y zinc superiores al 5% de la Ingesta Diaria Recomendada por cada 100 gramos de panela. Se concluye que las panelas son alimentos o ingredientes funcionales, con alta actividad antioxidante y un aporte razonable de todos los minerales estudiados. PALABRAS CLAVES: Panela, alimento funcional, actividad antioxidante, porcentaje de inhibición, polifenoles, minerales. ii "A los verdaderos artífices de este logro: mi mamá y Eduardo." iii AGRADECIMIENTOS En primer lugar, gracias a Dios y a la Virgen, por el regalo de la vida y la fortaleza para vivirla. A mi mamá, sin la cual nada de esto hubiera sido posible. Gracias por creer en mí, por el inmenso cariño y por todos los pequeños detalles que me hicieron más fácil este camino. Mamá, este logro es más tuyo que mío. A Eduardo, por estar allí en todo momento, por darme todo su amor y su paciencia y por darme ánimos cuando ya no tenía más fuerzas. Gracias por ser mi refugio, mi paz, mi fortaleza y el amor de mi vida. Te amo... A mis hermanos, por estar siempre dispuestos a apoyarme. Gracias especiales a Luisa, a Marlene y a William, por estar siempre a mi lado, ayudándome, motivándome y empujándome cuando fue necesario. A la Prof. Marisa Guerra, por regalarme una parte de su valioso tiempo y enseñarme con paciencia y dedicación. Gracias por la oportunidad de trabajar con usted y por guiar mis pasos con cariño. A Suhey, por acudir en mi auxilio tantas veces y por compartir conmigo risas, llantos y sueños descabellados; amiga, ahí le dejé café. A Lorena, una de las personas más optimistas y cariñosas que he encontrado en la vida, mil gracias por todas las cosas bonitas que hemos compartido juntas. A Nelián, quien es una mujer excepcional y llena alegría, por ser una persona en la que puedo confiar plenamente y por compartir risas y música iv conmigo. A Nelly, a quien admiro muchísimo, por escucharme cuando lo necesitaba y por ayudarme siempre con una sonrisa. Que Dios las bendiga. A Yelvis y a José Gabriel, por estar allí a pesar de la distancia y por ser siempre los mejores amigos que uno pudiese pedir. A Alejandro y a Francys, por estar siempre pendientes de mí, por la amistad y por brindarme siempre una mano amiga en todo momento. Mil gracias a todos por la ayuda, por el apoyo y por mantener esta amistad a pesar de todo. A Gilberto, por ser un excelente oyente, por el apoyo en los momentos difíciles, por las risas y la confianza. A David, por su apoyo constante, su amistad y por hacerme sonreir en cualquier momento. A Andrés, por compartir con afecto risas, lágrimas, sarcasmo y café. A Ovatsug, por recordarme que todo llega a su tiempo. A Nicola, por enseñarme que esta carrera es de resistencia y no de velocidad. A Yolmar, por su cariño y su alegría. A María Virginia, por ayudarme y por permitirme usar su trabajo como referencia. A Eduardo (Malpica) por todo el apoyo y la ayuda, especialmente en estadística. Gracias también a aquellos amigos que siempre están allí: Jhoana, Rosaura, Lorena (Benavides), Ligia, Gerson, Eileen, Ana María y Jackie. Finalmente, gracias a la Prof. Elba Sangronis y a la Prof. Alexia Torres, por su orientación en este trabajo y las valiosas correcciones. Millán, por ayudarme con el análisis estadístico. Al Laboratorio de Desechos Tóxicos, por ayudarme en la determinación de minerales. flexibilidad mientras realizaba este trabajo. Al Prof. Félix A Innoval, por la v ÍNDICE GENERAL Capítulo 1. INTRODUCCIÓN..............................................................................1 1.1 LA PANELA..................................................................................................2 1.1.1 Proceso de elaboración de la panela...................................................3 1.1.2 Parámetros de calidad de las panelas.................................................4 1.2 ALIMENTO FUNCIONAL.............................................................................5 1.2.1 Importancia de los alimentos funcionales............................................6 1.2.2 La panela como alimento funcional......................................................7 1.3 ANTIOXIDANTES........................................................................................9 1.3.1 Reacciones de óxido-reducción.........................................................10 1.3.2 Importancia de los antioxidantes........................................................12 1.3.3 Fuentes de antioxidantes...................................................................13 1.3.4 Usos de los antioxidantes..................................................................13 1.3.5 Clasificación de los antioxidantes......................................................14 1.3.5.1 Antioxidantes primarios...............................................................14 1.3.5.2 Antioxidantes secundarios..........................................................14 1.4 MINERALES..............................................................................................14 1.4.1 Importancia de los minerales.............................................................15 1.4.2 Requerimientos nutricionales de minerales.......................................17 1.4.3 Fuentes de minerales.........................................................................18 Capítulo 2. OBJETIVOS...................................................................................21 2.1 OBJETIVO GENERAL...............................................................................21 2.2 OBJETIVOS ESPECÍFICOS.....................................................................21 vi Capítulo 3. SECCIÓN EXPERIMENTAL...........................................................22 3.1 REACTIVOS Y EQUIPOS.........................................................................22 3.1.1 Reactivos............................................................................................22 3.1.2 Equipos...............................................................................................22 3.2 MUESTRAS...............................................................................................23 3.2.1 Muestras analizadas..........................................................................23 3.2.2 Muestreo.............................................................................................25 3.3 MÉTODOS.................................................................................................25 3.3.1 Parámetros de calidad.......................................................................25 3.3.1.1 Humedad.....................................................................................26 3.3.1.2 Sólidos solubles..........................................................................26 3.3.1.3 pH................................................................................................26 3.3.2 Preparación de los extractos..............................................................27 3.3.2.1 Actividad antioxidante.................................................................27 3.3.2.2 Contenido de polifenoles............................................................27 3.3.3 Actividad antioxidante mediante ensayo DPPH.................................27 3.3.4 Contenido de polifenoles mediante ensayo de Folin-Ciocalteu.........28 3.3.5 Cenizas...............................................................................................29 3.3.6 Minerales............................................................................................29 3.4 ANÁLISIS ESTADÍSTICO..........................................................................30 Capítulo 4. RESULTADOS Y DISCUSIÓN........................................................31 4.1 PARÁMETROS DE CALIDAD...................................................................31 4.1.1 Humedad............................................................................................31 4.1.2 Sólidos solubles.................................................................................35 4.1.3 pH.......................................................................................................37 4.2 ACTIVIDAD ANTIOXIDANTE....................................................................39 4.3 CONTENIDO DE POLIFENOLES.............................................................41 vii 4.4 CONTENIDO DE CENIZAS......................................................................44 4.5 MINERALES..............................................................................................46 Capítulo 5. CONCLUSIONES Y RECOMENDACIONES..................................56 REFERENCIAS BIBLIOGRÁFICAS.....................................................................58 APÉNDICE............................................................................................................63 viii ÍNDICE DE FIGURAS Figura 1. Presentaciones de la panela...................................................................3 Figura 2. Contenido de humedad de las panelas.................................................31 Figura 3. Contenido de humedad de panelas granuladas...................................32 Figura 4. Contenido de humedad de panelas en bloque.....................................34 Figura 5. Contenido de sólidos solubles de las panelas analizadas....................35 Figura 6. Relación entre contenido de humedad y sólidos solubles....................36 Figura 7. pH de las panelas analizadas................................................................37 Figura 8. Actividad antioxidante de las panelas...................................................39 Figura 9. Contenido de polifenoles de las panelas...............................................42 Figura 10. Contenido de cenizas de las panelas..................................................44 Figura 11. Contenido de calcio de las panelas.....................................................46 Figura 12. Contenido de hierro de las panelas.....................................................47 Figura 13. Contenido de fósforo de las panelas...................................................48 Figura 14. Contenido de potasio de las panelas..................................................49 Figura 15. Contenido de magnesio de las panelas..............................................50 Figura 16. Contenido de manganeso de las panelas...........................................51 Figura 17. Contenido de cobre de las panelas.....................................................52 Figura 18. Contenido de zinc de las panelas.......................................................52 Figura 19. Contenido de minerales de las panelas (calculado a través de la mediana)...............................................................................................................53 Figura 20. Actividad antioxidante de la muestra Cb1 expresada como porcentaje de inhibición..........................................................................................................65 Figura 21. Curva de calibración de polifenoles (Y=1,95X-0,2).............................65 Figura 22. Contenido de potasio, calcio, magnesio y fósforo de las panelas contra el 10% IDR ................................................................................................66 Figura 23. Contenido de hierro, manganeso, zinc y cobre de las panelas contra 10% IDR................................................................................................................66 ix ÍNDICE DE TABLAS Tabla 1. Ingesta diaria recomendada de minerales (a).......................................18 Tabla 2. Reactivos utilizados en el trabajo experimental.....................................22 Tabla 3. Muestras de panelas adquiridas para realizar el trabajo experimental. 24 Tabla 4. Distribución del extracto para ensayo DPPH.........................................28 Tabla 5. Calidad de las panelas analizadas........................................................38 Tabla 6. Contenido de minerales de las panelas contra el 10% IDR...................54 Tabla 7. Parámetros de calidad de las panelas analizadas................................63 Tabla 8. Actividad antioxidante de las muestras..................................................63 Tabla 9. Contenido de cenizas y minerales de las muestras..............................64 Tabla 10. Ejemplo de cálculo de actividad antioxidante de la muestra Cb1 mediante ensayo DPPH........................................................................................64 x SÍMBOLOS Y ABREVIATURAS Ab1 Flor de caña, bloque, lote 1 Ab2 Flor de caña, bloque, lote 2 Ag1 Flor de caña, granulada, lote 1 Ag2 Flor de caña, granulada, lote 2 Bb1 Queniquea, bloque, lote 1 Bb2 Queniquea, bloque, lote 2 Bg1 Queniquea, granulada, lote 1 Bg2 Queniquea, granulada, lote 2 Bg3 Queniquea, granulada, lote 3 Cb1 Nonavana, bloque, lote 1 Cb2 Nonavana, bloque, lote 2 AG Ácido gálico DPPH· 2,2-difenil-1-picrilhidrazil FAO Food and Agriculture Organization ICP Plasma acoplado inductivamente (siglas en inglés) IDR Ingesta Diaria Recomendada WHO World Health Organization 1 Capítulo 1 INTRODUCCIÓN El azúcar es un nutriente esencial en la dieta, debido a sus propiedades nutricionales y gustativas, razón por la cual su consumo es muy elevado a nivel mundial.1 A diferencia del azúcar blanca, otros productos derivados de la caña de azúcar exhiben cualidades olfativas y gustativas únicas, además de proporcionar dulzor, como es el caso de las melazas, el azúcar morena y la panela. La panela es un producto artesanal elaborado en Venezuela, que puede ser consumido en la misma manera que el azúcar, con la ventaja adicional de tener un mayor valor nutritivo gracias a su alta proporción de azúcares y su contenido de proteínas, minerales y trazas de vitaminas.2 Considerando el valor nutritivo de la panela, existe mucho interés en promover su producción y consumo como rubro agroindustrial en Venezuela. Por este motivo, el Ministerio de Ciencia y Tecnología (MCT) creó la agenda “Caña de Azúcar”, a través de la cual el Fondo Nacional de Ciencia, Tecnología e Innovación (Fonacit) financió un proyecto titulado “Optimización del Proceso de Obtención de Panela en sus Diferentes Presentaciones y Evaluación de su Calidad”, en el que se enmarca el trabajo de investigación para caracterizar los componentes de la panela en bloque y granulada.3 Con el fin de colaborar con las investigaciones realizadas en esta área y como parte de los esfuerzos realizados para promover el consumo de panela, se realiza el presente trabajo de investigación, en el cual se estudian algunas panelas artesanales (granuladas y en bloque) producidas en el país, a fin de evaluarlas como 2 alimento o ingrediente funcional, en los aspectos de actividad antioxidante y contenido de minerales. 1.1 LA PANELA La panela es un alimento en estado sólido, obtenido de la concentración del jugo de la caña de azúcar, presentado principalmente en forma de bloques y caracterizado por su alta concentración de azúcares, por su contenido de minerales y trazas de vitaminas.4 La norma técnica colombiana NTC 1311 define la panela como un producto sólido, natural, obtenido por evaporación del jugo de caña de azúcar y elaborado en trapiches o centrales paneleros.5 La panela recibe diversas denominaciones dependiendo del país donde se consuma: “gur” y “jaggery” en la India y Pakistán, “rapadura” en Brasil, “chancaca” en Chile, Perú y Argentina, “panela” en Colombia, Ecuador, Guatemala y otros países de Centroamérica y “panela” o “piloncillo” en México. En Venezuela tradicionalmente se le llama “papelón” si el molde utilizado tiene forma de cono y se le llama “panela” si es de forma cuadrada o rectangular.2 Este producto se comercializa bajo distintas presentaciones: bloques, panelines y granulada o pulverizada. La panela en bloque a su vez se presenta en diferentes formas, dependiendo del molde utilizado en su elaboración. Así se tiene panela cuadrada, rectangular, redonda, cónica, en forma de pastilla con cresta redonda y con cresta cuadrada, entre otras.2 3 Figura 1. Presentaciones de la panela 1.1.1 Proceso de elaboración de la panela El proceso de elaboración de la panela o “beneficio de la caña panelera” consiste en una serie de etapas u operaciones tecnológicas posteriores al corte de la caña, según el orden siguiente: apronte, extracción, clarificación, evaporación, concentración, punteo, batido, moldeo, empaque y almacenamiento.4 A continuación se explican brevemente cada una de las etapas mencionadas. El apronte consiste en recoger y trasladar la caña desde el campo hasta el central panelero donde ocurre la molienda, la cual consiste en la extracción del jugo haciendo pasar la caña a través de un molino de rodillos estriados. El jugo extraído se somete a la clarificación, en donde se eliminan los sólidos en suspensión, sustancias coloidales y algunas sustancias colorantes, lo que se logra a través de la adición de ciertas sustancias como cal, hidrocoloides y otros. El jugo clarificado es evaporado a fin de eliminar cerca del 90% del agua presente, con lo cual se eleva el contenido de sólidos solubles en el jugo hasta 65 ºBrix aproximadamente.4 Al alcanzarse los 65 ºBrix se inicia la fase de concentración, en la cual se continúa con la eliminación de agua hasta alcanzar un líquido concentrado 4 denominado miel. El punto final de la miel se da en la fase de punteo y lo establece el experto operario de manera empírica. Obtenido el punto, se deposita la miel en una batea y comienza la fase de batido, donde se define la textura de la panela y se enfría. Esta masa se vierte en moldes cuadrados o redondos y se deja enfriar y solidificar completamente para proceder al empaque.4 En el caso de panela granulada, una vez alcanzado el punto se procede al batido manual y secado simultáneo con aire frío, se tamiza el producto y finalmente se empaca. Las panelas en bloque o granuladas se deben almacenar en lugares que garanticen poco riesgo de alteración de sus características organolépticas. Es recomendable que la humedad relativa del almacén sea inferior al 78% y la temperatura oscile entre 27 y 32 ºC.4 1.1.2 Parámetros de calidad de las panelas En Venezuela se conoce muy poco sobre la composición de las panelas, ya que estas son producidas en forma artesanal y son poco utilizadas industrialmente. Por este motivo, en estos momentos no existe en Venezuela una normativa que defina y controle la calidad de las panelas producidas y deben emplearse normativas internacionales como guías al momento de evaluar su calidad. Para efectos de este trabajo, las normativas a considerar son la Norma Técnica Colombiana (NTC 1311) y la Norma Técnica Ecuatoriana (NTE INEN 2 332:2002). Ambas normas especifican los valores para los parámetros físicos y químicos de importancia en la panela y clasifican el producto principalmente en base al contenido de sólidos insolubles en extra, primera y segunda.5,6 En el presente estudio, han sido seleccionados entre los distintos parámetros la determinación de humedad, sólidos solubles y pH para evaluar la calidad de las panelas analizadas. El interés en el contenido de humedad de la panela radica en que a elevados 5 valores, se favorece la inversión de los azúcares y el crecimiento de mohos, resultando en la formación de productos complejos de descomposición y cambios desfavorables en las características sensoriales.2 Para la determinación de los sólidos solubles se emplea la refractometría, que permite tener un estimado del contenido de azúcares totales de la muestra, expresado en grados Brix. Con respecto al pH, su relevancia se basa en que al igual que el contenido de cenizas, puede resultar un indicador del exceso de cal. Además, un bajo valor de pH puede relacionarse con un elevado contenido de azúcares reductores, lo cual es indeseable ya que incrementan la higroscopicidad del producto, afectando adversamente la textura y la estabilidad en el almacenamiento.2 1.2 ALIMENTO FUNCIONAL Para poder estudiar la funcionalidad de la panela, se debe comprender en primera instancia el significado de alimento funcional. A pesar de que el concepto de alimento funcional es difícil de establecer correctamente, la Junta de Alimentación y Nutrición (o Food and Nutrition Board) definió como alimento funcional a cualquier alimento o ingrediente alimentario modificado que pueda brindar un beneficio para la salud, además de los beneficios tradicionales que contenga.7 En general, un alimento puede considerarse funcional si sus componentes ejercen un efecto beneficioso sobre una o más funciones selectivas del organismo, de modo que resulte apropiado para mejorar el estado de salud, reducir el riesgo de enfermedad o ambas cosas, además de sus beneficios nutricionales. Los alimentos funcionales deben seguir siendo alimentos y deben demostrar sus efectos en las cantidades en las que normalmente se consumen.7,8 6 Desde un punto de vista práctico, un alimento funcional puede ser: un alimento en el que uno de sus componentes ha sido mejorado a través de condiciones especiales de cultivo un alimento al que se le ha añadido un componente benéfico un alimento al que se le ha eliminado un componente que perjudique la salud un alimento con biodisponibilidad aumentada de un componente beneficioso un alimento modificado químicamente para mejorar la salud cualquier combinación de estas posibilidades.8 1.2.1 Importancia de los alimentos funcionales La ciencia de los alimentos funcionales se basa en la forma en la que nutrientes y componentes alimentarios actúan de manera positiva sobre las funciones fisiológicas del organismo, como por ejemplo, la regulación de procesos metabólicos, salud física y mental, fisiología cardiovascular y gastrointestinal, crecimiento y desarrollo infantil y defensa contra el estrés oxidativo.8 Considerando que existe una relación entre el estatus de los micronutrientes y las enfermedades degenerativas, los estudios en el área de alimentos funcionales debieran enfocarse en folatos, calcio y antioxidantes.9 El oxígeno es un elemento esencial para la vida humana, pero al mismo tiempo interviene en ciertas reacciones que producen efectos potencialmente nocivos, como resultado de la formación y actividad de especies reactivas del mismo. Estas especies actúan como oxidantes y provocan el estrés oxidativo que, como se verá con detalle más adelante, es el principal causante del envejecimiento y enfermedades cardiovasculares, cáncer, enfermedades degenerativas del sistema nervioso y otras.8,10 7 El organismo humano posee varios mecanismos de respuesta para minimizar el efecto de estas especies reactivas, que podemos denominar compuestos antioxidantes. En una situación normal, se establece un equilibrio entre los oxidantes y los antioxidantes, pero un aumento en la producción de oxidantes o una deficiencia en el sistema de defensa pueden romper el equilibrio y provocar estrés oxidativo.8,10 La dieta humana contiene una gran variedad de compuestos diferentes que poseen actividad antioxidante o que son capaces de inhibir las especies reactivas del oxígeno, basado en sus propiedades estructurales. Por este motivo, la nutrición desempeña un papel clave en el mantenimiento de las defensas antioxidantes, dado que varios minerales esenciales y oligoelementos intervienen en la estructura o actividad de ciertas enzimas antioxidantes y algunos antioxidantes de bajo peso molecular pueden regenerar la capacidad amortiguadora de los sistemas antioxidantes del organismo. Entre estos compuestos de bajo peso molecular tenemos las vitaminas C y E, los carotenoides, polifenoles y flavonoides, presentes principalmente en alimentos de origen vegetal.8,11 1.2.2 La panela como alimento funcional Desde el punto de vista nutricional, la panela contiene un alto porcentaje de azúcares, además de minerales, proteínas y trazas de algunas vitaminas.4,12 Como se verá más adelante, la caña de azúcar, y por tanto sus productos, contienen ácidos fenólicos, polifenoles y flavonoides, los cuales exhiben propiedades antioxidantes.13-16 Se ha encontrado también que las panelas pueden contener cobre, hierro, magnesio, calcio, potasio, fósforo, zinc, manganeso y sodio.2,17 Productos derivados de la caña de azúcar, tales como el jugo de caña y la melaza, exhiben un amplio rango de efectos biológicos benéficos para la salud 8 debido a lo cual se emplean en tratamientos médicos alternativos. Entre algunos de estos efectos se encuentran la estimulación de la respuesta inmune, actividad antitrombótica, actividad antiinflamatoria, modulación de la liberación de la acetilcolina, aumento de la resistencia a infecciones virales y bacterianas y actividad antioxidante, entre otros.14,16 Hasta la fecha se han publicado algunos estudios con productos derivados de la caña de azúcar, a los fines de promover su uso como alimento funcional. Uno de los primeros trabajos realizados en caña de azúcar en el área de antioxidantes fue realizado por F. W. Zerban en Estados Unidos en el año 1919, en el cual se estudiaron los polifenoles presentes en el jugo de caña. En este caso, se hicieron observaciones cualitativas para determinar cuáles compuestos polifenólicos estaban presentes en el jugo, comparando los resultados con los obtenidos para otras muestras de origen vegetal.13 Estudios muchos más recientes realizados con productos derivados de la caña de azúcar incluyen el de Saska y Chou realizado también en Estados Unidos en el año 2002, en el cual se analizan cierto tipo de melazas, que son productos secundarios del procesamiento de la caña, para determinar su actividad antioxidante. En este estudió se encontró que podrían prepararse extractos naturales de caña de azúcar a partir de estas melazas, a bajo costo, para ser usados como suplementos antioxidantes.14 Payet y colaboradores presentaron en los años 2005 y 2006 estudios realizados en Francia sobre la actividad antioxidante y contenido de polifenoles en muestras de azúcar morena y productos derivados de la caña. Como conclusión de estos estudios se propone considerar el empleo de estos productos en la industria de alimentos, como alternativa a los antioxidantes sintéticos, debido a sus propiedades antioxidantes, nutricionales y gustativas.1,15 9 Entre los estudios más recientes realizados en esta área se encuentra el presentado por Kadam y colaboradores en el año 2007, realizado en la India, en el cual se evalúa la actividad antioxidante y contenido de polifenoles en el jugo de caña y se estudia el efecto protector de este jugo contra daño en ADN inducido por radiación. El estudio concluye que el jugo de caña de azúcar es una fuente de antioxidantes, que protege eficientemente el ADN y aumenta la supervivencia de cultivos celulares sometidos a radiación.16 En el área de minerales, se han realizado trabajos en Venezuela en los que se reporta que las panelas presentan cobre, hierro, magnesio y calcio y pequeñas cantidades de potasio, fósforo, zinc, manganeso y sodio.2,17 La presencia de estos minerales depende del tipo de suelo, variedad de caña y usos de fertilizantes, aunque se tiene muy poca información sobre el contenido de minerales de la caña o sus productos en el país.3 Entre los pocos estudios realizados en nuestro país sobre la biodisponibilidad de los minerales de las panelas se encuentra el de Jaffé en 1950, el cual reporta que el hierro presente en las panelas es altamente disponible.18 Ésta es una razón más para promover el consumo del papelón, ya que en Venezuela una de las mayores deficiencias alimentarias son las anemias nutricionales.19 1.3 ANTIOXIDANTES Huang y colaboradores presentan varias definiciones de antioxidantes, entre las cuales se establece que los antioxidantes son sustancias naturales o sintéticas que se añaden a los productos para prevenir o retrasar su deterioro por acción del oxígeno del aire. En el área de la ciencia de alimentos, los define como componentes que significativamente disminuyen los efectos adversos de especies 10 reactivas en la función fisiológica de los seres humanos.20 Giese a su vez define los antioxidantes como los compuestos usados en los alimentos para prevenir el deterioro, rancidez o decoloración causada por la oxidación, siendo el mecanismo de acción de algunos de estos compuestos la prevención o el retraso en la oxidación de las moléculas.10 Los antioxidantes están presentes naturalmente en casi todas las materias primas alimenticias, dándoles un valioso grado de protección en contra del ataque oxidativo. Cuando los alimentos son sujetos a procesamiento, las cantidades de estos antioxidantes naturales se reducen, por efectos físicos y/o químicos, lo que trae como consecuencia que los alimentos procesados tengan una vida útil más corta que sus materias primas. A fin de conservar estos alimentos procesados por más tiempo, se suelen incluir entre los ingredientes productos naturales ricos en antioxidantes o aditivos químicos reconocidos.21 1.3.1 Reacciones de óxido-reducción Las reacciones de óxido-reducción ocurren en los sistemas biológicos, incluyendo los alimentos, y en ellas los electrones son removidos de un átomo y son añadidos a otros átomos diferentes. Aunque las reacciones de oxidación son comunes y en algunos casos beneficiosas en los alimentos, algunas de estas reacciones pueden provocar efectos dañinos, tales como la degradación de vitaminas y lípidos, originando pérdidas nutricionales y desarrollo de sabores desagradables.22 De manera similar a lo que ocurre en los alimentos, la oxidación puede causar cambios degenerativos en el cuerpo humano, ya que la oxidación es un proceso metabólico que provee de energía vital para la actividad celular. Este proceso lleva inevitablemente a la producción de radicales libres, los cuales son moléculas 11 altamente inestables y reactivas, ya que contienen electrones desapareados.10,23 Los radicales libres tienen la capacidad de provocar efectos adversos, a través de reacciones en cadena que afectan las membranas, desnaturalizan las proteínas, oxidan los lípidos, fragmentan el ADN y participan en la muerte celular, envejecimiento y cáncer.10,16,24 Una de las reacciones en cadena producida por los radicales libres es la autoxidación de los lípidos, que involucra los pasos de iniciación, propagación y terminación. En el paso de iniciación, se generan los radicales libres cuando átomos de hidrógeno se pierden del grupo de ácidos grasos.10 Estos radicales libres reaccionan con el oxígeno para formar radicales libres peroxilo y dar inicio a los pasos de propagación.10 Los radicales peroxilo actúan como iniciadores de nuevas reacciones de oxidación, a través de la extracción de un átomo de hidrógeno de otra molécula, formando un hidroperóxido relativamente estable y un nuevo radical libre inestable.10 12 Este proceso se detiene en el paso de terminación, en el que dos radicales libres reaccionan entre sí o cuando un radical libre reacciona con un radical estable antioxidante.10 1.3.2 Importancia de los antioxidantes En la actualidad existe un creciente interés en los antioxidantes por sus beneficios en las áreas de nutrición y salud. Huang y colaboradores indican que pruebas clínicas y estudios epidemiológicos han establecido una correlación inversa entre el consumo de frutas y vegetales y la ocurrencia de enfermedades relacionadas con el envejecimiento, inflamatorias, cardiovasculares y cáncer. Se cree que los antioxidantes presentes en la dieta, entre los cuales encontramos compuestos polifenólicos, vitamina E, vitamina C y carotenoides, son nutrientes efectivos en la prevención de estas enfermedades relacionadas con el estrés oxidativo.20 Dado que el metabolismo natural del oxígeno en las células vivas produce radicales libres derivados del oxígeno, es normal tener un balance de radicales libres prooxidantes y antioxidantes en el organismo, el cual puede verse afectado por enfermedades o mala nutrición.10 Ha sido postulado que un balance oxidativo alterado puede ser un factor contribuyente en un amplio espectro de enfermedades, entre las cuales se encuentran la artritis reumatoide, infecciones virales o bacterianas, afecciones cardíacas, cáncer, Parkinson y Alzheimer, entre otras.10,25 Sabiendo además que un bajo porcentaje de la población consume los requerimientos diarios recomendados de frutas y vegetales, se cree que suplementos de antioxidantes pueden traer beneficios para la salud y la nutrición.10 13 1.3.3 Fuentes de antioxidantes De acuerdo con Prior y colaboradores, en los sistemas biológicos existen por lo menos cuatro fuentes generales de antioxidantes: Enzimas, como por ejemplo la superóxido dismutasa, glutatión peroxidasa y la catalasa. Moléculas grandes como la albúmina, ceruloplasmina, ferritina y otras proteínas. Moléculas pequeñas, como el ácido ascórbico, glutatión, ácido úrico, tocoferol, carotenoides, fenoles y polifenoles. Algunas hormonas, tales como el estrógeno, angiotensina, melatonina, etc.26 De estos antioxidantes, los no enzimáticos constituyen un aspecto importante en la compleja red de antioxidantes presentes en los organismos vivos, ya que contrarrestan las especies reactivas que pueden causar detrimento para la vida humana.27 1.3.4 Usos de los antioxidantes La reacción espontánea del oxígeno atmosférico con compuestos orgánicos conduce a un número de cambios deteriorativos que reducen la vida útil de muchos productos de interés para la industria química, así como causando el deterioro de los lípidos en los alimentos.21 Por este motivo se usan los antioxidantes, los cuales se utilizan como preservativos en productos como grasas, aceites, jabones, gasolina, goma, productos del petróleo y alimentos.20 En los alimentos, los antioxidantes utilizados deben cumplir con ciertos requerimientos esenciales: ser efectivos a bajas concentraciones, ser compatibles 14 con el sustrato, no afectar las propiedades organolépticas del producto y no ser tóxicos para el consumidor.21 Los antioxidantes más usados en la industria alimentaria son el hidroxianisol butilado (BHA), hidroxitolueno butilado (BHT), butilhidroquinona terciaria (TBHQ), derivados de ácido gálico, tocoferoles, ácido ascórbico y sus derivados, ácido eritórbico, ácido cítrico, sulfitos, fosfatos y el ácido etilendiamintetraacético (EDTA).10,21 1.3.5 Clasificación de los antioxidantes Existen varias maneras de clasificar a los antioxidantes, pero generalmente se clasifican en primarios y secundarios.20,21 1.3.5.1 Antioxidantes primarios También llamados rompe-cadena o sacrificiales, interrumpen la oxidación convirtiendo los radicales libres en radicales más estables que el producto inicial o en otros productos estables. 1.3.5.2 Antioxidantes secundarios También llamados preventivos, inhiben la formación de oxidantes reactivos a través de diversos mecanismos, como la quelación, “scavenge” del oxígeno, “quench” del oxígeno singlete, entre otros. 1.4 MINERALES Aunque existen varias definiciones de minerales en el área de alimentos y nutrición, estos podrían definirse como aquellos elementos químicos diferentes de 15 carbono, hidrógeno, oxígeno y nitrógeno presentes en los alimentos, en concentraciones relativamente bajas, que desempeñan un papel clave en los sistemas vivos.22 1.4.1 Importancia de los minerales Internacionalmente se acepta que existen al menos 15 minerales dietéticos esenciales, considerándose como esenciales aquellos elementos cuya remoción de la dieta u otra ruta de exposición resultan en un daño consistente y reproducible sobre una función fisiológica.22,28 Cuatro de los minerales esenciales más importantes mencionados en el reporte de la FAO/WHO sobre requerimientos humanos de vitaminas y minerales son el calcio, hierro, magnesio y zinc.29 El calcio es un catión divalente que constituye el 1,9% en peso del cuerpo humano. En el esqueleto humano se encuentra localizado el 99% del calcio del cuerpo, mientras que 1% se encuentra en los dientes y tejidos suaves y apenas 0,1% se encuentra presente en el fluido extracelular. El calcio es fundamental para la función neuromuscular, en muchos procesos mediados por enzimas, en la coagulación de la sangre y en la rigidez del esqueleto.29 Por su parte, el hierro tiene diversas funciones vitales en el organismo, como por ejemplo el transporte de oxígeno desde los pulmones a través de la hemoglobina, como medio de transporte de electrones dentro de las células y como parte de sistemas enzimáticos de varios tejidos. Además, el hierro forma parte de estructuras en el cerebro y el hígado, por lo que su carencia puede ocasionar daños irreversibles en estos órganos.29 Entre 30 y 40% del magnesio del cuerpo humano se encuentra en los músculos y tejidos blandos, 1% en fluido extracelular y el resto en el esqueleto. El 16 magnesio funciona como co-factor de muchas enzimas involucradas en el metabolismo energético, síntesis de proteínas, síntesis de ADN y ARN y mantenimientos del potencial eléctrico de tejidos nerviosos y membranas celulares.29 A su vez, el zinc está presente en todos los tejidos y fluidos corporales. El zinc es un componente esencial de más de 300 enzimas que participan en la síntesis y degradación de carbohidratos, lípidos, proteínas y ácidos nucleicos, así como en el metabolismo de otros micronutrientes. El zinc estabiliza la estructura molecular de los componentes y membranas celulares, contribuyendo al mantenimiento de la integridad de órganos y células. Finalmente, el zinc juega también un rol central en el sistema inmune y en la transcripción de polinucleótidos, siendo su participación en estas actividades fundamentales la razón por la que se le considere esencial para la vida.29 Por varias razones, las deficiencias de algunos minerales son comunes, mientras que para otros son raras o inexistentes. Existen datos de deficiencias dietéticas humanas para calcio, cobalto, cromo, yodo, hierro, selenio y zinc, aunque los estados de deficiencia dietética clínicamente reconocibles son extremadamente raros para la mayoría de los minerales esenciales.22,28 De acuerdo con Webb algunas de estas enfermedades de deficiencia se consideran relativamente comunes, como por ejemplo las causadas por deficiencia de yodo (bocio), deficiencia de calcio (osteoporosis) y deficiencia de hierro (anemia).28 La deficiencia de hierro es la más común de las deficiencias nutricionales en el mundo y afecta entre 20 y 50% de la población mundial, siendo la anemia el problema de nutrición más prevalente entre los niños, que surge como resultado de un pobre suministro de hierro absorbible.29-31 Algunos de los efectos de esta deficiencia involucran disminución de la capacidad de realizar esfuerzo físico, disminución de la respuesta inmunológica frente a infecciones, fatiga general, dolores de cabeza, jadeo, insomnio, pérdida de memoria y concentración y 17 problemas de atención en infantes.28,29 El principal problema asociado a la deficiencia de calcio es la osteoporosis, la cual implica mayor fragilidad de los huesos y mayor tiempo de recuperación en caso de fractura. Aunque esta deficiencia no es tan común como la del hierro, afecta principalmente a niños y adolescentes en etapa de crecimiento, mujeres embarazadas y en período de lactancia, mujeres postmenopáusicas y ancianos de ambos sexos.29 Las deficiencias de magnesio son muy poco frecuentes y suelen ocurrir debido a pérdidas muy grandes del elemento a través de la orina o por diarreas prolongadas. Entre los efectos de esta deficiencia encontramos náusea, debilidad muscular, letargo, temblores y pérdida de peso. En algunos casos extremos se pueden presentar convulsiones, arritmia cardíaca y edema pulmonar.29 En el caso del zinc, deficiencias leves tienen efectos poco claros, tales como retardo en el crecimiento y susceptibilidad a infecciones debido a impedimentos en el sistema inmune. En casos de deficiencia severa se observa además retraso en la maduración sexual y esquelética, lesiones cutáneas, diarrea, alopecia, disminución del apetito y cambios de comportamiento.29 A fin de prevenir las enfermedades asociadas con las deficiencias de estos minerales, la FAO y muchos países han elaborado recomendaciones de ingesta diaria de minerales como parte de los requerimientos nutricionales.29 Estas recomendaciones serán estudiadas a continuación. 1.4.2 Requerimientos nutricionales de minerales Los requerimientos nutricionales de los minerales para los seres humanos son variables y en algunos casos difíciles de establecer, pasando de algunos 18 microgramos por día hasta un gramo por día.22,28 Los principales minerales presentes en los alimentos incluyen el calcio, fósforo, magnesio, sodio, potasio, cloro, hierro, yodo, zinc, selenio, cromo, cobre, flúor y plomo, estando algunos de ellos sólo en calidad de trazas.22 A continuación se presenta una tabla con la ingesta recomendada de calcio, hierro, magnesio y zinc, de acuerdo con lo establecido en el informe de la FAO/WHO sobre requerimientos de vitaminas y minerales para países desarrollados.29 Tabla 1. Ingesta diaria recomendada de minerales (a) Grupos de edad y sexo (b) Hombres Mujeres (b) Embarazadas Lactancia Infantes 0-6 meses 6-12 meses Niños y Adolescentes 1-10 años 11-18 años Hombres 11-18 Mujeres Promedio ponderado / persona / día Calcio Hierro Magnesio Zinc (mg/día) 260 220 220 270 (mg/día) 7 4,9 5,5 9,5 (mg/día) (mg/día) 1000 11 1000 24 1200 100(c) 1000 12 300 400 0(d) 8 26 53 2,8 8,3 600 1300 1300 6 14 20 100 250 230 5,6 9,7 7,8 900 14 181 7 (a) Modificada de FAO/WHO (29) (b) Adultos desde 18 hasta 65 años (c) Dada la dificultad de evaluar el estatus del hierro durante el embarazo, se recomienda la ingesta diaria de 100mg de suplemento (d) Las reservas de hierro neonatales son suficientes los primeros 6 meses para bebés sanos 1.4.3 Fuentes de minerales Para satisfacer los requerimientos nutricionales es recomendable incluir en la 19 dieta el consumo de fuentes de minerales, las cuales se definen como aquellos alimentos que aportan al menos el 15% de los requerimientos diarios en cien gramos de parte comestible.32 Son consideradas fuentes de calcio aquellos alimentos que contienen más de 150mg/100g, siendo la leche y los productos lácteos las mejores fuentes, aunque los cereales, leguminosas y frutas también pueden aportar algo de calcio. En estos alimentos, el contenido de calcio depende de factores como tipo y pH del suelo, especie de la planta, estados de madurez y clima, entre otros.32 En el caso del hierro, las fuentes de hierro deben contener al menos 3mg/100g, sea en alimentos de origen animal o vegetal.32 En los alimentos de origen animal, el hierro suele estar presente como hierro hemínico o hierro Heme, mientras que en los de origen vegetal se encuentra presenta en su forma no hemínica o hierro No Heme. El hierro hemínico se encuentra en muy pequeñas cantidades en la dieta, pero tiene una mayor absorción que el hierro no hemínico y es menos afectado por inhibidores presentes en la dieta. Por su parte, el hierro no hemínico se encuentra en las plantas, productos lácteos y alimentos fortificados con hierro y representa generalmente un porcentaje mayor al 85% del hierro ingerido.29,32 Para el magnesio, un alimento que aporte al menos 36mg/100g al día puede ser considerado como fuente de magnesio, estando presente en la mayoría de los cereales y productos de origen vegetal. Entre los alimentos con alto contenido de magnesio se encuentran los cereales, leguminosas, vegetales de hojas verdes, carnes, frutas, frutas secas y chocolate. Fuentes intermedias de magnesio son los productos lácteos y fuentes pobres de magnesio son los alimentos de origen animal y los alimentos refinados.32 Finalmente, las fuentes de zinc aportan 1,75mg/100g al día y estas incluyen las leguminosas, cereales integrales, germen, afrecho, carnes y algunos alimentos 20 marinos, siendo estos últimos las mejores fuentes de zinc. La absorción de zinc se ve afectada por la presencia de ácido fítico en la dieta, así como factores fisiológicos que incluyen la edad, el crecimiento, el embarazo y la lactancia.32 21 Capítulo 2 OBJETIVOS 2.1 OBJETIVO GENERAL Seleccionar muestras de panelas artesanales en sus presentaciones de bloque y granulada, para evaluar su calidad en base a algunos parámetros fisicoquímicos y estudiar su funcionalidad como antioxidante y fuente de minerales. 2.2 OBJETIVOS ESPECÍFICOS Seleccionar muestras de panelas artesanales en sus presentaciones de bloque y granulada, disponibles en el mercado, y determinar su calidad en base a algunos parámetros fisicoquímicos. Evaluar la actividad antioxidante de las muestras mediante el ensayo 2,2difenil-1-picrilhidrazil (DPPH·) y medición del contenido de polifenoles totales mediante el método de Folin-Ciocalteu. Determinar el contenido de minerales presentes en las panelas seleccionadas, específicamente calcio, hierro, fósforo, potasio, magnesio, manganeso, cobre y zinc, a través de espectroscopía de emisión atómica de plasma acoplado inductivamente (ICP). 22 Capítulo 3 SECCIÓN EXPERIMENTAL 3.1 REACTIVOS Y EQUIPOS 3.1.1 Reactivos En la tabla 2 se presenta la lista de los reactivos empleados para el desarrollo de este trabajo de investigación. Tabla 2. Reactivos utilizados en el trabajo experimental Reactivos Proveedor 2,2-Diphenil-1-picril-hidrazilo (DPPH) Sigma Chemical Co. Reactivo fenólico Folin-Ciocalteu, 2N Sigma Chemical Co. Ácido Gálico Scharlau Chemie Metanol Riedel de Häen Carbonato de sodio anhidro Na2CO3 Riedel de Häen Ácido Clorhídrico 37% Riedel de Häen 3.1.2 Equipos Los equipos utilizados en este trabajo experimental fueron los siguientes: Espectrofotómetro UV-Visible Spectronic 20D+, Milton Roy. Agitador Vortex-Genie modelo K-550-G, Scientific Industries inc. Desintegrador de tejidos Polytron PT3100, Kinematica. 23 Centrífuga Hermle Z300, Labnet. Baño VWR modelo 1228, Sheldon Manufacturing. Estufa L-C oven, Lab-line Instruments, Inc. Estufa de vacío modelo 5831, National Appliance Co. Mufla Type 1500 Furnace, Thermolyne. Medidor de pH Ultra Basic UB-10, Denver Instrument. Balanza And HR-200. Refractómetro Abbe. 3.2 MUESTRAS Para realizar los análisis se utilizaron panelas de tres marcas comerciales y se analizaron las presentaciones de bloque y granulada, que son comercializadas en la actualidad. Se trabajó con panelas elaboradas con caña de azúcar cultivada en zonas altas y zonas bajas del país, donde zonas altas se refiere a la región andina (Estado Táchira) y zonas bajas a la región central (Estado Lara). La selección de las panelas se hizo en función de la disponibilidad de las muestras en el mercado para el momento de su adquisición. Las panelas empleadas para realizar el trabajo experimental se presentan en la tabla 3. 3.2.1 Muestras analizadas Se seleccionaron tres marcas comerciales para este trabajo, que son “Flor de Caña” y “Queniquea” de zonas altas y “Nonavana” de zonas bajas. En el caso de las panelas de zonas altas, se trabajó con las presentaciones disponibles en el mercado, en bloque y granulada. La panela marca “Nonavana” sólo está disponible para los consumidores en su presentación de bloque. 24 Para cada una de estas marcas y presentaciones, se seleccionaron dos lotes de tres unidades cada uno, excepto para el caso de “Queniquea” granulada, donde se trabajó con tres lotes. En todos los casos, los lotes fueron escogidos de acuerdo con su fecha de vencimiento, a fin de asegurar que las panelas correspondían a lotes diferentes. Las panelas correspondientes a las marcas “Flor de Caña”, “Queniquea” y “Nonavana” se identifican como “A”, “B” y “C”, respectivamente. Para identificar el tipo de presentación, se utilizó la letra “b” para bloque y la letra “g” para granulada y el lote se identificó por su número. De este modo, la muestra de marca “Flor de Caña” en presentación de bloque y lote 1 se identificó como “Ab1” y así sucesivamente. En la tabla 3 se detallan los lotes y el tamaño de las unidades de las muestras adquiridas. Tabla 3. Muestras de panelas adquiridas para realizar el trabajo experimental Marca Flor de Caña (A) Presentación Bloque (b) Granulada (g) Bloque (b) Queniquea (B) Nonavana (C) Granulada (g) Bloque (b) Fecha de Tamaño de la vencimiento unidad (kg) 1 Diciembre.2007 0,5 2 Diciembre.2008 0,5 1 Diciembre.2007 1 2 Noviembre.2008 0,5 1 Febrero.2009 0,5 2 Junio.2009 0,5 1 Junio.2008 1 2 Julio.2008 0,5 3 Diciembre.2008 1 1 Noviembre.2008 0,5 2 Mayo.2009 2 Lote 25 3.2.2 Muestreo El procedimiento de muestreo utilizado fue el del cuarteo, aplicado por Guerra y colaboradores, trabajando con tres unidades de muestra por cada lote. 33 En el caso de las panelas en bloque, su presentación es en bloques cuadrados o rectangulares entre 500 y 2000g de peso y la de las panelas granuladas son bolsas que contienen entre 500 y 1000g. Para obtener las muestras a analizar a partir del bloque, se disminuyó el tamaño de partícula hasta tener trozos de aproximadamente 3 cm de longitud, amorfos y de tamaño variable. Esto se realizó de esta manera debido a que no se puede aplicar molienda, ya que hay riesgo de caramelización. Para ambos casos, la muestra se esparció uniformemente sobre una bandeja. Luego se dividió la superficie en cuatro partes y se tomaron los cuadrantes opuestos, siguiendo con este procedimiento hasta tener una muestra de laboratorio entre 300 y 400g. 3.3 MÉTODOS En base a los objetivos específicos planteados, se siguió la metodología que se describe a continuación. Todos los análisis fueron realizados por triplicado para cada una de las muestras estudiadas, a menos que se especifique lo contrario. 3.3.1 Parámetros de calidad Los parámetros de calidad estudiados para las muestras de panela fueron humedad, sólidos solubles y pH. 26 3.3.1.1 Humedad La determinación de humedad se realizó según la metodología AOAC 925.45, cuyo fundamento es el secado de la muestra a presión de vacío.34 Se pesaron aproximadamente 3 gramos de muestra en una cápsula de aluminio tarada y se introdujeron en una estufa de vacío, a 70ºC y 16 pulgadas de Hg por 24 horas. Luego se retiró y se dejó enfriar en un desecador, se pesó y se determinó el contenido de humedad por diferencia de peso. 3.3.1.2 Sólidos solubles La determinación de los sólidos solubles se realizó por refractometría, preparando una solución al 10% p/p de panela en agua destilada. Una vez disuelta completamente la muestra, se colocó una gota de la solución a temperatura ambiente en el refractómetro y se tomó la lectura, realizando el análisis por quintuplicado. El resultado obtenido, expresado en grados Brix (ºBrix), se multiplicó por 10 para extrapolar a la muestra pura. 3.3.1.3 pH La determinación del pH se realizó según la Norma COVENIN 1315-79, preparando una solución al 10% p/p de panela en agua destilada.35 Una vez disuelta la muestra, se sumergió el electrodo en la solución a temperatura ambiente y se tomó la lectura cuando el equipo se estabilizara. Previo al análisis, es necesario asegurarse que el equipo se encuentre calibrado, para lo cual se emplean soluciones amortiguadoras de pH 7 y pH 4, de acuerdo con las indicaciones del equipo. 27 3.3.2 Preparación de los extractos Para la estudiar la actividad antioxidante de las muestras y su contenido de polifenoles, se prepararon extractos de las muestras con una solución de metanol al 80%, a fin de evitar que se oxidaran algunos de los compuestos fenólicos y que ocurrieran reacciones no deseadas.36 Los procedimientos se describen a continuación. 3.3.2.1 Actividad antioxidante El extracto para este ensayo se preparó disolviendo 100mg de muestra en 10mL de una solución de metanol al 80% con el desintegrador de tejidos, a 15000rpm durante 60 segundos a temperatura ambiente. Se centrifugó a 3500 rpm por 15 minutos y se tomó el sobrenadante.37 3.3.2.2 Contenido de polifenoles Para este ensayo se utilizó el mismo procedimiento usado para el extracto anterior, empleando ahora 1g de muestra para 10mL de metanol al 80%. El resto de los pasos se mantuvo sin cambios.37 3.3.3 Actividad antioxidante mediante ensayo DPPH Para realizar este ensayo se utilizó la metodología de Payet y colaboradores, comenzando con una solución de 100ppm de DPPH en metanol puro. 1,15 Posteriormente, se preparó un blanco con 2000 µL DPPH, 1000 µL metanol y 1000 µL agua destilada y se preparó una batería de tubos de ensayo, con diferentes concentraciones de muestra, solución de DPPH y agua destilada, de acuerdo con la tabla 4. 28 Tabla 4. Distribución del extracto para ensayo DPPH Vol extracto Vol DPPH Vol MeOH Concentración (µL) 2000 1500 1000 500 200 (µL) 2000 2000 2000 2000 2000 80% (µL) 0 500 1000 1500 1800 (mg/mL) 10,0 7,5 5,0 2,5 1,0 A B C D E Los tubos se agitaron en el Vortex-Genie y se dejaron reaccionar por 30 minutos a temperatura constante y resguardo de la luz. Transcurrido el tiempo, se midió la absorbancia a 515 nm en el espectrofotómetro y con las absorbancias leídas se determinó el porcentaje de inhibición, de acuerdo con la ecuación: Inhibición (%) = 100 – 100 (As / Ao) donde Ao es la absorción del blanco y As la absorción de la muestra. 3.3.4 Contenido de polifenoles mediante ensayo de FolinCiocalteu En este trabajo se empleó una modificación del método de Payet y colaboradores para la cuantificación de polifenoles, a partir de soluciones patrones de diferentes concentraciones de ácido gálico en agua destilada, en un rango de 0,2 a 0,8 mg/mL.1,15 En tubos de ensayo, se añadió 100µ L de la muestra o las soluciones de ácido gálico y 5 mL de una solución acuosa al 10% del reactivo de Folin-Ciocalteu. Entre 1 y 8 minutos se añadió una solución de carbonato de sodio al 11,5% p/v a cada tubo de ensayo. Los tubos se agitaron en el Vortex-Genie y se incubaron a 30 ºC por una hora, luego de lo cual se leyó la absorbancia a 765nm. Finalmente, se 29 realizó una curva de calibración con las soluciones patrón de ácido gálico y usando la ecuación de la curva se calculó el contenido de polifenoles, reportados como equivalentes de ácido gálico. 3.3.5 Cenizas Para determinar el contenido de minerales presente en las muestras, se suigió la metodología AOAC 900.02-A, pesando aproximadamente 5g de muestra en un crisol de porcelana previamente tarado e incinerado. Se agregaron unas gotas de aceite para evitar la formación de espuma y se colocaron sobre la plancha de calentamiento a mínima temperatura. Se aumentó la temperatura lentamente hasta total carbonización de las muestras, cuidando que la muestra no salpicara fuera del crisol.34 Cuando se carbonizaron las muestras, se colocó el crisol en la mufla a 525 ºC y se incineró por varias horas hasta obtener una ceniza blanca o gris pálido. Se dejó enfriar los crisoles en el desecador hasta temperatura ambiente, se humedeció la ceniza y se calientó a baja temperatura en plancha de calentamiento hasta sequedad. Se incineró de nuevo en la mufla a 525 ºC por al menos 4 horas y se colocó el crisol en un desecador, se dejó enfriar y se pesó. El porcentaje de cenizas se calculó como el peso de la ceniza en el crisol entre el peso de muestra, todo esto por cien.34 3.3.6 Minerales Una vez obtenidas las cenizas del alimento, se realizaron las determinaciones de los minerales individualmente, mediante el procedimiento de Guerra y colaboradores, agregando 5 mL de solución de HCl 1:1 al residuo de determinación de cenizas. Se calientó en plancha de calentamiento a muy baja temperatura hasta 30 sequedad (aproximadamente 2 horas) y se filtró la solución a través de papel de filtro Whatman Nº 41 (tipo "ashless") a un balón aforado de 100 mL. Se incineró el papel con la ceniza insoluble en el mismo crisol, se agregaron 5 mL de HCl 1:1 y se calientó algunos minutos en plancha eléctrica. Se filtró a través de papel Whatman Nº 41 con el mismo embudo y hacia el mismo balón aforado, incluyendo las aguas de lavado del crisol. Se enjuagó bien el papel de filtro y el tallo del embudo y se aforó el matraz con agua destilada.33 A partir de estas soluciones de cenizas se hizo la determinación de calcio, hierro, fósforo, potasio, magnesio, manganeso, cobre y zinc, mediante Espectroscopía de Emisión Atómica por Plasma Acoplado Inductivamente (ICP). La solución de cenizas se inyectó al equipo de ICP a través de una corriente de argón y se realizó una curva de calibración, inyectando también el blanco de reactivos para ajustar la respuesta. La concentración de cada mineral se expresó en función de miligramos por 100 g de muestra base seca. 3.4 ANÁLISIS ESTADÍSTICO Para comparar los resultados obtenidos se realizó un análisis estadístico utilizando el programa Statgraphics Plus 5.1, con el cual se verificó en primer lugar el supuesto de normalidad. Para los resultados que no seguían una distribución normal, se aplicó la prueba de Kruskal-Wallis, a fin de determinar si las medianas de los resultados eran iguales. Para los resultados que si seguían una distribución normal, se verificó la homocedasticidad (igualdad de varianzas) de los mismos y se aplicó un análisis de varianza (ANOVA) multifactorial, para determinar el efecto de los factores presentación, marca y lote. Cuando fue necesario se compararon las medias mediante la prueba de Duncan y se estudiaron los residuales. con un nivel de confianza de 95%. Se trabajó 31 Capítulo 4 RESULTADOS Y DISCUSIÓN A continuación se presentan los resultados obtenidos en la presente investigación, en los aspectos de parámetros de calidad, actividad antioxidante, contenido de polifenoles, contenido de cenizas y contenido de minerales. 4.1 PARÁMETROS DE CALIDAD 4.1.1 Humedad Los análisis realizados indican que el contenido de humedad promedio de las muestras analizadas es de 5,06%, abarcando un rango de humedad entre 1,93 y 8,8%. En la figura 2, se presentan los porcentajes de humedad para todas las muestras analizadas, separados por colores de acuerdo a su tipo de presentación. 9,0 8,0 Humedad (%) 7,0 6,0 5,0 4,0 Bloque Granulada 3,0 2,0 1,0 0,0 A1 A2 B1 B2 B3 C1 C2 Muestras Figura 2. Contenido de humedad de las panelas 32 Se observa que existe una gran diferencia entre el contenido de humedad de las panelas en bloque y granuladas, debido a que las diferencias en el proceso de alaboración afectan el contenido de humedad de las panelas. Tomando esto en consideración, se separan las muestras en dos conjuntos de acuerdo a su presentación y se analizan por separado. Dado que no existe una normativa venezolana, se toma como referencia la Norma Técnica Ecuatoriana, en la cual se establece un límite máximo de humedad de 3% para este tipo de presentación.6 Las panelas analizadas en presentación granulada tienen un rango de humedad comprendido entre 1,92 y 3,50%, con promedios de 3,0% para la marca A y 2,9% para la marca B. Para esta última marca, lo establecido en la Norma Técnica Ecuatoriana es sobrepasado por los lotes 1 y 2, como se observa en la figura 3. Figura 3. Contenido de humedad de panelas granuladas Para la presentación granulada se obtuvo un contenido de humedad promedio de 2,95%, lo que indica que cumple con lo establecido en la norma. Los análisis estadísticos realizados indican que existen diferencias significativas entre las muestras analizadas (representado por las letras sobre las barras). 33 De acuerdo con estos resultados estadísticos, se tiene que los contenidos de humedad de la marca B presentan variaciones entre lotes. Esto pudiera constituir un indicativo de la necesidad de establecer un control en el proceso de elaboración del producto, a fin de obtener parámetros más homogéneos y mejorar su calidad, tomando en consideración el carácter artesanal del producto. Se observa también que existe variabilidad entre las dos marcas analizadas, a pesar de que sus contenidos promedio de humedad son muy semejantes, de 3,0 y 2,9% para las marcas A y B, respectivamente. En el estudio realizado por Lira y Guerra, así como el presentado por Mujica, se indica que las panelas granuladas de marcas comerciales presentan contenidos de humedad generalmente inferiores a 4%. Sin embargo, se observó también que existe alta variabilidad entre los resultados obtenidos para diferentes lotes y diferentes marcas, debido a las deficiencias existentes en el proceso de elaboración. 2,3 Panelas granuladas elaboradas a nivel de laboratorio por Mujica presentan una menor variabilidad entre lote, pero una humedad superior a sus contrapartes comerciales, debido a una menor temperatura de punteo durante la elaboración.2 Al observar los resultados obtenidos para panelas en bloque, se encuentra que los rangos de humedad oscilan entre 5,8 y 8,8%, como se observa en la figura 4. Para este tipo de presentación se comparan dos lotes de panelas de tres marcas diferentes, A, B y C. Las panelas de la marca C tienen un mayor porcentaje promedio de humedad (8,36%), seguido de la marca B (6,25%) y de la marca A (5,86%). 34 Figura 4. Contenido de humedad de panelas en bloque A pesar de que las normas no establecen un límite superior para el contenido de humedad de las panelas en bloque, se conoce que un mayor porcentaje de humedad reduce la vida útil del producto. El contenido promedio de humedad para las muestras en bloque es de 6,82% y los análisis estadísticos revelan de nuevo variabilidad entre lotes y marcas. Al igual que en el caso anterior, la marca A no presenta variabilidad entre lotes, pero si existe variabilidad entre los lotes de las marcas B y C. Además, se observa variabilidad entre las tres marcas estudiadas. Las panelas en bloque analizadas en otros estudios presentan contenidos de humedad en un rango entre 5 y 8%.3 Considerando que altos valores de humedad pueden causar descomposición del producto, crecimiento de microorganismos y alteración de las características organolépticas del mismo, se consideran panelas de mejor calidad aquellas que presenten un menor contenido de humedad.2,38 Las muestras pertenecientes a la marca C presentan un contenido de humedad superior a 8%, lo que indica que puede deteriorarse más que las marcas A y B.2,38 Para este tipo de presentación, la marca A presenta características más favorables, con menor contenido de humedad y menor variabilidad entre lotes. 35 4.1.2 Sólidos solubles Para las muestras analizadas, se obtuvo un porcentaje de sólidos solubles promedio de 94,82%, con un rango de valores entre 90,00 y 97,50%. En la figura 5 se muestran los resultados obtenidos para todas las muestras analizadas. Figura 5. Contenido de sólidos solubles de las panelas analizadas El análisis estadístico aplicado a estos datos indica que los resultados obtenidos no se ajustan a una distribución normal y que existen diferencias significativas entre las muestras analizadas. Esto se puede observar en la figura 9, donde las panelas en bloque presentan promedios inferiores a los de las panelas granuladas y mayor variabilidad entre lotes y muestras. El promedio general de sólidos solubles de las panelas granuladas analizadas es de 97,38%, obteniéndose además que no hay diferencias significativas entre marcas y lotes, de acuerdo con el análisis estadístico realizado a estos datos. En el caso de las panelas en bloque, se tiene que el promedio general de sólidos solubles es de 92,67%, con promedios de 94,25, 91,75 y 92,00% para las marcas A, B y C, respectivamente. El análisis estadístico para este caso determinó que existe 36 variabilidad de los resultados entre marcas y variabilidad entre lotes para la marca B. El porcentaje de sólidos solubles en las soluciones de panela, expresados en grados Brix, dan una buena idea del contenido de azúcares de la muestra y son indicativos del dulzor de la panela.3 Los porcentajes más altos indican un mayor contenido de azúcares y una mejor calidad del producto, así como un menor cntenido de humedad. Dado que las panelas en bloque tienen un mayor contenido de humedad que sus contrapartes granuladas, su porcentaje de sólidos solubles es menor. En la figura 6 se observa la relación inversamente proporcional entre el contenido de humedad y el contenido de sólidos solubles. Haciendo una regresión lineal se encuentra que esta relación se puede representar mediante la ecuación Y=101,08–1,31X, con un coeficiente de determinación de 0,856. Figura 6. Relación entre contenido de humedad y sólidos solubles Considerando que esta medición permite estimar indirectamente el contenido de humedad de las panelas de una manera sencilla, se puede utilizar en los centros de producción para verificar la calidad del producto final.2 Si además se considera que el contenido de sólidos solubles predice el dulzor de la panela, este parámetro constituye un buen criterio para verificar la calidad de la panela elaborada.3 37 4.1.3 pH A continuación se presentan los valores de pH obtenidos para las muestras analizadas, representados en la figura 7. Figura 7. pH de las panelas analizadas La Norma Técnica Ecuatoriana establece el valor mínimo de pH para panelas granuladas de 5,9, el cual podemos aplicar también como criterio para evaluar la calidad de las panelas en bloque.6 El valor promedio de pH para todas las muestras es de 5,95, con promedios de 6,15 para la marca A, 6,11 para la marca B y 5,17 para la marca C. Sólo los valores correspondientes a la muestra C se encuentran por debajo del límite mínimo establecido en la normativa. El análisis estadístico para este caso revela que sólo dos de las muestras son estadísticamente iguales y todas las otras muestras son diferentes entre sí. Esta alta variabilidad entre lotes y muestras también es observada por Mujica y por Lira y Guerra, quienes presentan valores que oscilan entre 5,25 y 6,90.2,3 Las variaciones encontradas en el pH pueden deberse a diferencias en el tipo y cantidad de 38 clarificante usado durante la preparación de la panela, dado que en la elaboración de este producto no existen criterios claros para el paso de clarificación. Cuando se utiliza cal como agente clarificante, un bajo valor de pH puede indicar deficiencias en su adición durante la clarificación del jugo, lo que conduce a mayor presencia de impurezas y azúcares reductores, además de aumentar la higroscopicidad de la panela y disminuir su estabilidad en el almacenamiento.2 Por este motivo, las panelas de marca C se consideran de menor calidad, ya que tienen un valor de pH por debajo de la norma. A continuación se presenta la tabla 5, que resume los resultados obtenidos en la evaluación de la calidad de las muestras en estudio. Tabla 5. Calidad de las panelas analizadas Presentación Bloque Granulada Sólidos Marca Humedad (%) A 5,86 94,25 6,17 B 6,25 91,75 6,06 C 8,36 90,00 5,17 A 3,00 97,25 6,12 B 2,90 97,50 6,15 solubles (%) pH Se observa en la tabla que las panelas de marca A y B, en ambas presentaciones, poseen valores de humedad para la presentación granulada y pH dentro de los límites establecidos en la norma. Adicionalmente, presentan los valores más altos de sólidos solubles y la humedad más baja para las panelas en bloque. La marca C, por el contrario, presenta un contenido muy alto de humedad y un valor de pH por debajo de lo establecido en la norma, lo que indica que su calidad es inferior a la de las otras marcas estudiadas. 39 4.2 ACTIVIDAD ANTIOXIDANTE Los resultados obtenidos para la actividad antioxidante de las muestras se presentan en la figura 8 como porcentaje de inhibición de la oxidación, donde un mayor porcentaje de inhibición es indicativo de una mayor actividad antioxidante de la muestra en estudio.1,15 Figura 8. Actividad antioxidante de las panelas El porcentaje de inhibición de las muestras se encuentra en un rango entre 84 y 96%, con un valor promedio de 89,64%. Los análisis estadísticos de los datos indican que siguen una distribución normal, por lo que puede realizarse un análisis de varianza ANOVA multifactorial, utilizando presentación, marca y lote como factores, el cual se presenta en el apéndice. Dado que se trata de un diseño experimental desbalanceado, donde no se cuenta con el mismo número de muestras para los factores estudiados, no se pudo realizar un análisis estadístico de la interacción entre factores. 40 Este análisis estadístico indica que lo resultados obtenidos dependen de los factores marca y lote (para el caso de la marca B), pero no de la presentación. Específicamente, las marcas A y C son estadísticamente diferentes de la marca B, con un valor de p<0,05. Los porcentajes de inhibición para cada muestra son 87,75% para la marca A, 91,59 para la marca B y 88,00% para la marca C. Respecto a los lotes, el análisis estadístico indica diferencias significativas entre los lotes 1 y 3 de la muestra B. Esta variabilidad en los resultados obtenidos puede deberse a diversos factores, entre los cuales tenemos los inherentes a la materia prima utilizada y al proceso de elaboración del producto.16 Adicionalmente, el carácter artesanal de la panela provoca una alta variabilidad sobre la composición del producto, afectando los porcentajes de inhibición. Esto se puede observar en los gráficos de residuales presentados en el apéndice. Los resultados obtenidos para la panela son comparados principalmente con los obtenidos por Payet y colaboradores con un producto equivalente derivado de la caña de azúcar, llamado “massecuite”. Este producto se obtiene a partir de la concentración al vacío de jugo concentrado de caña, produciéndose la cristalización de la sacarosa. El porcentaje de inhibición reportado para este producto es de 93,3%, con un tiempo de incubación de una hora y realizando la extracción con acetato de etilo.15 En general, para otros productos derivados de la caña de azúcar estudiados por Payet y colaboradores, se tiene que el porcentaje de inhibición se encuentra alrededor de 94% para melazas y alrededor de 51% para jugos clarificados, usando acetato de etilo para la extracción.15 Kadam y colaboradores reportan un porcentaje de inhibición de alrededor de 12%, para soluciones de jugo de caña al 1%.16 41 Respecto al azúcar morena, también analizada por Payet y colaboradores, se encuentra que la actividad antioxidante está a un nivel intermedio entre el jugo de caña y las melazas, abarcando un rango entre 14,5 y 26,9% de inhibición para extractos acuosos al 1% p/p incubados por 30 minutos.1 Al comparar los resultados obtenidos con los de otros investigadores, se observa que como lo indica Prakash el método de extracción es un factor importante en la cuantificación de la actividad antioxidante de los alimentos.24 Aquellos análisis en los que se realizaron extracciones con agua exhibieron porcentajes de inhibición menores que en los casos en los que se utilizó otro tipo de solvente. Por este motivo, se refuerza la noción de que el metanol es un buen solvente para preparar los extractos, ya que permite una mejor extracción de los compuestos antioxidantes presentes en la muestra.34 En segundo lugar, la actividad antioxidante de las panelas es mayor que la del jugo de caña y que la del azúcar morena, por lo cual su uso puede traer grandes ventajas desde el punto de vista de la funcionalidad. Si el jugo de caña y sus productos presentan una gran cantidad de efectos biológicos benéficos en relación a la prevención del estrés oxidativo, la panela podría exhibir estas mismas propiedades, gracias a que posee una actividad antioxidante igual o mayor que los jugos y otros productos, lo cual pudiera corroborarse a través de ensayos in vivo.14,16 4.3 CONTENIDO DE POLIFENOLES El contenido de polifenoles es un buen indicativo de la actividad antioxidante de una muestra, ya que un mayor contenido de polifenoles implica una mayor concentración de antioxidantes en la muestra.16,20 contenido de polifenoles de las muestras estudiadas. En la figura 9 se muestra el 42 Figura 9. Contenido de polifenoles de las panelas El contenido de polifenoles de las muestras se encuentra en un rango entre 2,84 y 5,08 gramos de ácido gálico por kilogramo de muestra (g AG/kg muestra), con un valor promedio de 3,85 g AG/kg muestra. Al analizar estadísticamente estos resultados se obtuvo que siguen una distribución normal, por lo que se realizó un análisis de varianza ANOVA multifactorial, considerando presentación, marca y lote como factores. Este análisis indica que los resultados obtenidos dependen sólo de la marca analizada, siendo la marca C la que presenta diferencias estadísticamente significativas respecto a las otras dos marcas, con un valor de p<0,05. El contenido de polifenoles encontrado según marca es de 3,88, 3,52 y 4,58 g AG/kg muestra, para las marcas A, B y C, respectivamente. Se observa que existe una gran variabilidad entre las muestras, lo que puede explicarse considerando que muchos factores pueden influir sobre el contenido de polifenoles, tales como la variedad de la caña, la madurez de la caña al momento de la cosecha, factores ambientales y efectos de procesamiento, tales como la clarificación y la temperatura alcanzada durante la elaboración de la panela.16 Además, es importante recordar que la panela es un producto artesanal, por lo que es de esperarse una gran 43 dispersión de los datos, como se observa en los gráficos de residuales mostrados en el apéndice. La diferencia estadística presentada por la marca C puede deberse a la variedad de la caña de azúcar y otros factores de cultivo y procesamiento, ya que esta panela proviene de zonas bajas del país. Los polifenoles están fuertemente involucrados en el color de los productos derivados de la caña de azúcar y una coloración más oscura en las muestras puede sugerir un mayor contenido de polifenoles.1 Para este estudio se observa que la muestra Bg2 presenta el menor contenido de polifenoles y se observó que ella era de coloración más clara que las otras muestras en bloque. Por su parte, las panelas de la marca C presentaban las coloraciones más oscuras y los niveles más altos de polifenoles en las muestras analizadas. Estudios realizados por Payet y colaboradores con azúcar morena, presentan valores entre 0,1 y 0,4 g AG/kg muestra, los cuales son inferiores a los encontrados en panelas en el presente estudio.1 En su estudio en el año 2006, Payet y colaboradores analizaron diferentes productos derivados de la caña de azúcar y los resultados reportados por ellos indican 0,70 g AG/kg muestra para azúcar morena, 5,52 g AG/kg para jugos clarificados y diferentes valores para melazas, siendo el mayor de ellos 27,21 g AG/kg. Para el producto “massecuite”, que es el más similar a la panela entre los productos estudiados, se obtuvo un contenido de polifenoles de 6,06 g AG/kg.15 Comparando los resultados obtenidos por Payet y colaboradores con los obtenidos en el presente estudio, se observa que la panela contiene más polifenoles que el azúcar morena, pero menos que los jugos clarificados, las melazas y el “massecuite”.1,15 Es importante recordar que además de los polifenoles existen otros compuestos capaces de actuar como antioxidantes y que pudieran estar presentes en las panelas, como es el caso de algunas vitaminas y minerales como cobre y zinc. El contenido de algunos minerales presentes en la panela será 44 reportado en la sección 4.5, incluyendo aquellos minerales con propiedades antioxidantes como cobre y zinc y con propiedades prooxidantes como el hierro. 4.4 CONTENIDO DE CENIZAS Los resultados obtenidos en esta investigación arrojan contenidos de cenizas entre 0,82 y 2,48%, con un valor promedio de 1,58%. Estos resultados se presentan en la figura 10, a continuación. Figura 10. Contenido de cenizas de las panelas Los análisis estadísticos realizados a estos valores indican que no siguen una distribución normal, por lo cual no es posible realizar una análisis de varianza ANOVA multifactorial para determinar qué factores están afectando los resultados. Se observa además que las muestras son muy diferentes entre ellas y presentan mucha variabilidad. El contenido de cenizas de una muestra provee de un estimado del contenido 45 total de los minerales de un alimento, los cuales se encuentran en forma de óxidos, sulfatos, fosfatos, nitratos y halogenuros.22 En el caso de la panela, el contenido de cenizas es afectado por el porcentaje de sólidos sedimentables, los cuales permiten clasificar a las panelas según su calidad en las normas técnicas de Ecuador y Colombia.5,6 Un porcentaje de cenizas elevado puede ser un indicativo de un exceso de agente clarificante, contenido de metales pesados y otros compuestos ajenos al producto.2 La Norma Técnica Colombiana establece como requisito de la panela que su contenido de cenizas se encuentre entre 0,8 y 1,9%.5 De acuerdo con este criterio, el promedio de las muestras se encontraría dentro de lo establecido en la norma, pero cuatro de las muestras analizadas estarían fuera de ella. Estas cuatro muestras corresponden a los dos lotes de las marcas B y C, en sus presentaciones en bloque, con promedios de 2,12 y 2,31% respectivamente. En el estudio realizado por Mujica, se observa que una de las marcas comerciales analizadas se encuentra fuera de la norma, con un promedio de 2,56%, mientras que las otras dos marcas estudiadas presentan promedios dentro de la normativa.2 Esto permite deducir que existe una alta variabilidad entre las marcas presentes en el mercado, lo que evidencia diferencias en las variedades cultivadas y en los procesos de elaboración de las panelas. Durante el muestreo, se observó que las panelas que posteriormente mostraron un mayor porcentaje de cenizas presentaban una mayor cantidad de materia extraña. Teniendo esto en consideración, estos contenidos de cenizas no deben considerarse predictores fieles del contenido de minerales de la muestra, pero sí del contenido de sólidos sedimentables. De acuerdo con este criterio, las panelas en bloque de las marcas B y C son de calidad inferior que el resto de las muestras. Un mejor control de la elaboración de la panela permitiría reducir el contenido de sedimentos y mejorar la calidad del producto. 46 4.5 MINERALES El aporte de minerales de las panelas es de gran importancia para el estudio de la funcionalidad de este producto. Comenzando por el calcio, se observa que las panelas analizadas tienen un contenido de calcio de 135,6 mg/100g de muestra, calculado a través de la mediana, con valores en un rango entre 74,1 y 215,0 mg/100g de muestra. Estos resultados se presentan en la figura 11. Figura 11. Contenido de calcio de las panelas Análisis estadísticos realizados a estos resultados indican que los valores obtenidos no se ajustan a una distribución normal y que los promedios de las muestras analizadas presentan diferencias estadísticamente significativas. En general, las panelas en bloque presentan un mayor contenido de calcio que las panelas granuladas, con promedios de 164,44 y 99,07 mg/100g de muestra, respectivamente. 47 En el estudio realizado por Mujica, se obtiene un contenido de calcio para las panelas en un rango entre 104,58 y 317,99 mg/100g.2 Este rango tan amplio en los valores obtenidos por Mujica, al igual que los obtenidos en esta investigación, es un indicativo de que el contenido de calcio en las panelas es muy variable y posiblemente presente variaciones afectadas por las condiciones de cultivo de la caña y elaboración de la panela. Respecto al contenido de hierro, se observó un contenido (expresado como mediana) de 3,27 mg/100g de muestra. Las muestras analizadas presentan valores entre 1,67 y 7,71 mg de hierro por cada 100g de muestra, como se observa en la figura 12. Figura 12. Contenido de hierro de las panelas Estadísticamente, los resultados obtenidos no siguen una distribución normal, pero se observan pocas diferencias estadísticas entre los promedios de las muestras. Casi todas las muestras analizadas presentan un contenido de hierro inferior a 3,5 mg/100g de muestra. 48 Valores en un rango de 1,15 y 5,08 mg/100g son presentados por Mujica, observándose poca variabilidad entre lotes analizados, lo cual coincide con lo obtenido en esta investigación.2 Olivares y colaboradores reportan en su estudio un contenido de hierro de 4,15 mg/100g de panela, pero la publicación no indica el método utilizado para la determinación del contenido de hierro, ni el número de muestras analizadas.39 La determinación del contenido de fósforo en las muestras de panela arrojó un valor de la mediana de 50,39 mg/100g de muestra, con valores extremos en 14,23 y 88,83 mg/100g de muestra. Estos resultados se muestran en la figura 13. Figura 13. Contenido de fósforo de las panelas Los resultados obtenidos no siguen una distribución normal y se observa en la figura 13 que existen diferencias estadísticamente significativas entre los promedios de las diferentes muestras analizadas. Esta misma variabilidad se observa en los resultados de Mujica, con valores en el rango de 25,24 y 192,08 mg/100g.2 Para el caso del fósforo, la alta variabilidad entre muestras se ve afectada en gran medida por los métodos de cultivo, ya que una mayor fertilización con fósforo afecta el 49 contenido de minerales en el suelo y, por lo tanto, en la caña de azúcar. El potasio es el mineral más abundante (o en mayor cantidad) en las panelas analizadas, con un rango entre 122,75 y 649,03 mg/100g de muestra. El contenido de potasio (mediana) para todas las muestras analizadas es de 434,39 mg/100mg de muestra y los promedios individuales se muestran en la figura 14. Figura 14. Contenido de potasio de las panelas Los análisis estadísticos indican que existe mucha variabilidad entre los promedios de las muestras analizadas, lo que coincide con lo observado por Mujica en su estudio. Mujica reporta un contenido de potasio entre 29,52 y 1027,18 mg/100g de muestra, el cual es un rango bastante grande para el contenido promedio de las muestras analizadas.2 Para nuestro caso, no se puede determinar si el lote, la marca o la presentación tienen un efecto significativo sobre los resultados obtenidos, ya que los resultados no se ajustan a una distribución normal. 50 El análisis de magnesio realizado a las muestras indica que las panelas analizadas tienen un contenido de este mineral de 65,14 mg/100mg de muestra, expresado como la mediana, con valores que oscilan entre 31,61 y 148,88 mg/100g de muestra. Estos resultados se presentan gráficamente en la figura 15. Figura 15. Contenido de magnesio de las panelas Se observa que siete de las once muestras analizadas presentan promedios estadísticamente iguales, alrededor de 40 mg/100g de muestra, los cuales se encuentran ligeramente por debajo del promedio de las muestras. Estos resultados se asemejan a los presentados por Mujica, quien reporta un contenido de magnesio entre 26,69 y 125,09 mg/100g.2 A pesar de encontrarse menor variabilidad entre las distintas muestras analizadas, estos resultados tampoco se ajustaron a la distribución normal y no se pudo efectuar el análisis de varianza multifactorial para determinar qué factores influyen sobre los resultados. El contenido de manganeso en las muestras de panela es de 1,09 mg/100g de muestra (mediana), con un rango de valores entre 0,05 y 3,05 mg/100g de muestra. Estos resultados se presentan en la figura 16. 51 Figura 16. Contenido de manganeso de las panelas Se observa en la figura 20 que el contenido de manganeso de las muestras de la marca C es muy bajo, inferior a 0,15 mg/100g de muestra para ambos casos. Además, se observa una alta variabilidad entre las muestras, ya que los promedios son estadísticamente diferentes. Los resultados encontrados se asemejan a los presentados por Mujica, quien reporta contenidos de manganeso para sus muestras entre 0,23 y 1,74 mg/100g.2 El cobre fue el mineral menos abundante en las panelas analizadas, presentando un valor de 0,19 mg/100g de muestra, expresado como la mediana. Los rangos obtenidos en esta determinación oscilan entre 0,06 y 0,37 mg/100g de muestra y se observan gráficamente en la figura 17. Se observa para el cobre una menor variabilidad entre las muestras, lo que se asemeja al comportamiento encontrado por Mujica en su trabajo, quien reporta contenidos de cobre entre 0,13 y 0,81 mg/100g.2 52 Figura 17. Contenido de cobre de las panelas Finalmente, para el caso del zinc se tiene un contenido de 0,60 mg/100g (mediana), con un rango entre 0,05 y 1,11 mg/100g. Estos resultados se presentan en la figura 18. Figura 18. Contenido de zinc de las panelas 53 Para el zinc se observa una alta variabilidad entre las muestras de panelas en bloque, en un rango entre 0,05 y 1,01 mg/100g de muestra. Las panelas granuladas, en este caso, presentan menor variabilidad, con un valor promedio de 0,84 mg/100g de muestra. Los resultados presentados por Mujica indican también una alta variabilidad entre muestras analizadas, con un contenido de zinc entre 0,18 y 1,15 mg/100g.2 A continuación se presenta la figura 19, donde de manera gráfica se comparan los contenidos de minerales para las muestras estudiadas, ordenados en forma decreciente. Dado que los datos presentaban una dispersión demasiado grande, el contenido de cada mineral se determinó usando la mediana de los resultados en lugar del promedio. Se observa que, en general, las panelas presentan un alto contenido de potasio y calcio, en comparación con el resto de los minerales analizados. También se puede notar que las cantidades de zinc y cobre presentes en las muestras son bastante pequeñas, así como las de manganeso y hierro. Contenido (mg/10 0 g panela) 500 450 400 350 300 250 200 150 100 50 0 K Ca P Mg Fe Mn Zn Cu Minerales Figura 19. Contenido de minerales de las panelas (calculado a través de la mediana) A pesar de las diferencias entre los contenidos de los diferentes minerales 54 analizados, lo importante es conocer si aún con bajos contenidos de éstos, las panelas pueden contribuir con parte de los requerimientos diarios de minerales, establecidos por los organismos competentes. En la introducción se definen como fuentes de minerales aquellos alimentos que aportan al menos 15% de la ingesta diaria recomendada (IDR) en cien gramos de parte comestible.32 A fin de conocer cuáles minerales son aportados en una cantidad razonable de panela, se compara el contenido de minerales de las muestras con el valor estimado para cubrir el 10% de la IDR. En la tabla 6 se presentan los contenidos de potasio, calcio, magnesio, fósforo, hierro, manganeso, zinc y cobre de las panelas analizadas, así como la cantidad de cada uno de estos minerales que representa el 10% de la ingesta diaria recomendada (IDR). Tabla 6. Contenido de minerales de las panelas contra el 10% IDR Mineral K Ca P Mg Fe Mn Zn Cu Co nt enid o (mg / % IDR apo rt ad o Cantidad de panela que 10% IDR (mg ) apo rt a 10% IDR (g) 100g panela) po r 100 g panela 450,8 136,5 53,8 44,7 2,7 1,1 0,7 0,2 9,6 13,7 7,7 12,1 24,1 50,5 5,4 7,7 470,0 100,0 70,0 37,0 1,1 0,2 1,4 0,2 104,3 73,2 130,0 82,8 41,5 19,8 184,9 129,4 Para calcio, magnesio y fósforo, se utilizan como valores de referencia los indicados por el Instituto Nacional de Nutrición (INN) en el año 2000.40 Para el caso del potasio, el INN no reporta valores de referencia para la ingesta diaria recomendada, por lo que se toma como referencia el valor de ingesta adecuada reportado por la Junta de Alimentación y Nutrición o Food and Nutrition Board, el cual se establece en 4700 mg K/día.41 55 Para hierro, zinc y cobre, se utilizan como valores de referencia los revisados por el Instituto Nacional de Nutrición (INN) en el año 2000, para la población venezolana.40 Para el manganeso se toma como valor de referencia el establecido por la Junta de Alimentación y Nutrición, ya que el INN tampoco reporta valores de referencia para la ingesta diaria recomendada para este mineral.7 Se observa que la panela sólo puede ser considerada fuente de hierro y manganeso, ya que el aporte de estos minerales en panelas es de 24,1 y 50,5% de la IDR respectivamente, por cada 100 gramos. El contenido de calcio, magnesio y potasio en 100 gramos de panela constituye el 13,7, 12,1 y 9,6% de la IDR, respectivamente. Para el fósforo y cobre se obtuvo un aporte de 7,7% de la IDR para ambos minerales, mientras que para el zinc el aporte de la panela es el más bajo, obteniéndose 5,4% de la IDR por cada 100 gramos. En general, se puede decir que la panela contiene cantidades razonables de todos los minerales estudiados, ya que puede contribuir con más del 5% de los requerimientos diarios establecidos para estos minerales. Se debe considerar que 100 gramos de panela equivalen a aproximadamente 6 cucharadas para las panelas en bloque y 8 cucharadas para las panelas granuladas. La panela es utilizada en la cocina venezolana en bebidas y dulces tradicionales, por lo que emplearla como edulcorante en sustitución del azúcar refinada, podría ayudar a cubrir parte de las necesidades diarias de estos minerales. Si consideramos por ejemplo el papelón con limón, un vaso de 250 mL de jugo se puede preparar usando 30g de panela, lo cual aportaría 7,2 y 15,2% de la IDR para hierro y manganeso, por ejemplo. 56 Capítulo 5 CONCLUSIONES Y RECOMENDACIONES Al evaluar la calidad de las panelas, se observó una alta variabilidad en los parámetros correspondientes a humedad, pH y sólidos solubles para las muestras adquiridas. Analizando la humedad de las muestras, se encontró que las panelas en bloque presentan un contenido de humedad mayor que el de las muestras en presentación granulada. Respecto al contenido de sólidos solubles, se encontró que el promedio general para las muestras es muy elevado Para el parámetro de calidad correspondientes a pH, así como para la humedad de las panelas granuladas, se encontró que el promedio general de las muestras analizadas se encuentra dentro de los límites establecidos en las normas internacionales. La actividad antioxidante de las muestras demostró ser bastante elevada, con un porcentaje de inhibición alto. El análisis estadístico arrojó que los resultados de este ensayo dependen de la marca y del lote analizado, pero no de la presentación. Adicionalmente se encontró que las panelas analizadas contienen polifenoles, expresados en equivalentes de ácido gálico, y para este caso el análisis estadístico indicó que el contenido de los mismos depende de la marca analizada. Tomando en cuenta estos resultados, se puede concluir que las panelas analizadas presentan una alta actividad antioxidante. Al analizar el contenido de cenizas de las muestras, se halló un valor promedio dentro de los límites establecidos en las normas internacionales. valores más altos fueron presentados por panelas en bloques. Los Respecto al contenido de minerales, se encontró que calcio y potasio son los minerales más 57 abundantes en las panelas, observándose también la presencia de magnesio, hierro, fósforo, cobre, zinc y manganeso. En base a los resultados obtenidos en los análisis de minerales y tomando en cuenta la elevada actividad antioxidante de las muestras, se considera que las panelas son un alimento o ingrediente funcional. Considerando los resultados obtenidos, se sugieren las siguientes recomendaciones: Incluir un mayor número de muestras en el estudio, sobre todo muestras provenientes de zonas bajas y elaboradas con variedades de caña conocidas, a fin de mejorar los resultados estadísticos y apreciar mejor el efecto que tiene la variedad de la caña y las condiciones de cultivo en los parámetros analizados. El carácter artesanal de las panelas hace que exista una amplia variabilidad entre los resultados obtenidos para las muestras analizadas. Por este motivo, se sugiere promover la creación de una normativa para la elaboración de las panelas, a fin de obtener un producto homogéneo y de buena calidad. Para el estudio de la actividad antioxidante y el contenido de polifenoles, se sugiere ensayar la extracción de polifenoles con otros solventes, dado que el metanol tiene alta toxicidad y debe ser manipulado con altos niveles de seguridad. 58 REFERENCIAS BIBLIOGRÁFICAS 1. Payet, B.; Cheong Sing, A.; Smadja, J. Assessment of Antioxidant Activity of Cane Brown Sugars by ABTS and DPPH Radical Scavenging Assays: Determination of their Polyphenolic and Volatile Constituents. J. Agric. Food Chem. 2005. 53, 10074-10079. 2. Mujica, M.V. Evaluación de panelas artesanales y estudio de algunos factores que afectan su calidad. Trabajo de Grado para optar al título de Magister en Ciencias de los Alimentos. Universidad Simón Bolívar. Venezuela, 2007. 3. Lira, M.; Guerra, M. Optimización del Proceso de Obtención de Panela en sus Diferentes Presentaciones y Evaluación de su Calidad. Proyecto Fonacit 2000001515. Venezuela, 2000. 4. Hernández E, Amaya F. Referencia tecnológica para el proceso de obtención de panela de calidad. Instituto Nacional de Investigaciones Agrícolas. Venezuela, 2000. 5. NTC 1311. Productos agrícolas. Panela. Segunda actualización. ICONTEC. Colombia, 1996. 6. NTE INEN 2 332 (Norma Técnica Ecuatoriana 2 332). Panela Granulada. Requisitos. Primera Edición. Instituto Ecuatoriano de normalización. Ecuador, 2002. 7. Bowman, B.; Russel, R. Conocimientos actuales sobre nutrición. 8va edición. Publicación Científica y Técnica No. 592. Organización Panamericana de la Salud e Instituto Internacional de Ciencias de la Vida. USA, 2003. 8. Ashwell, M. Conceptos sobre los alimentos funcionales. IlSI Europe concise 59 monograph series. International Life Sciences Institute. Bélgica, 2004. 9. Lajolo, F.M. Functional foods: Latin American perspectives. British Journal of Nutrition. 2002. 88, Suppl. 2, S145–S150. 10. Giese, J. Antioxidants: Tools for preventing lipid oxidation. Food Technology. 1996. 50 (11), 73-81. 11. Diplock, A.T.; Charleux, J.L.; Crozier-Willi, G.; Kok, F.J.; Rice-Evans, C.; Roberfroid, M.; Stah, W.; Viña-Ribes, J. Functional food science and defence against reactive oxidative species. British Journal of Nutrition. 1998. 80, Suppl. 1, S77-S112. 12. Villamizar, C. El progreso tecnológico y la competitividad bajo el enfoque de cadena agroalimentaria. II Curso Internacional de Caña Panelera y su Agroindustria. CIMPA. Colombia, 1997. 13. Zerban, F.W. The color changes of sugar cane juice and the nature of cane tannin. Presentado en el 56º encuentro de la American Chemical Society en Cleveland, Ohio. USA, 1918. 14. Saska, M; Chi Chou, C. Antioxidant Properties of Sugarcane Extracts. Presentado en el First Biennial World Conference on Recent Development in Sugar Technologies en Florida. USA, 2002. 15. Kadam, U.S.; Ghosh, S.B.; Strayo De; Suprasanna, P.; Devasagayam, T.P.A.; Bapat, V.A. Antioxidant activity in sugarcane juice and its protective role against radiation induced DNA damage. Food Chemistry. 2008. 106, 1154– 1160. 16. Payet, B.; Cheong Sing, A.; Smadja, J. Comparison of the Concentrations of Phenolic Constituents in Cane Sugar Manufacturing Products with Their Antioxidant Activities. J. Agric. Food Chem. 2006. 54, 7270-7276. 17. Mujica, M.V.; Guerra, M. Contenido de minerales en panelas granuladas elaboradas en el país. IV Congreso Nacional de Ciencia y Tecnología de 60 Alimentos. Venezuela, 2007. 18. Jaffe, E.; Ochoa, A. El papelón como fuente de hierro en la dieta popular venezolana. Revista de la Sociedad Venezolana de Química. Editorial Ávila Gráfica. Caracas, 1950. 19. Guerra, M. Aportes tecnológicos en las intervenciones nutricionales poblacionales. An. Venez. Nutr. 2005. 18 (1), 55-63. 20. Huang, D.; Ou, B.; Prior, R.L. The Chemistry behind Antioxidant Capacity Assays. J. Agric. Food. Chem. 2005. 53, 1841-1856. 21. Hudson, B.J. Food antioxidants. Elsevier Science Publishers. Inglaterra, 1990. 22. Fennema, O. Food Chemistry. 3ra edición. Marcel Dekker, Inc. New York (USA), 1996. 23. Wade, L.G. Química Ogánica. 2da edición. Prentice-Hall Hispanoamericana. México, 1993. 24. Prakash, A. Antioxidant Activity. Analytical Progress (Medallion Laboratories). Vol 19 num 2. USA, 2001. 25. Soriano, J. Propiedades y acción antioxidante de los flavonoides. III Simposio Internacional de Ciencia y Tecnología de Alimentos, Sensiber IV Congreso Internacional de Evaluación Sensorial. México. Memorias 9-17. 2006. 26. Prior, R.L.; Wu, X.; Schaich, K. Standardized Methods for the Determination of Antioxidant Capacity and Phenolics in Food and Dietary Supplements. J. Agric. Food Chem. 2005. 53, 4290-302. 27. Prior, R.L.; Cao, G. In vivo total antioxidant capacity: comparison of different analytical methods. Free Radical Biology and Medicine. 1999. 27(11), 1173-1181. 28. Webb, G.P. Nutrición, una alternativa para promover la salud. Editorial Acribia. España, 1995. 61 29. FAO/WHO. Human vitamin and mineral requirements. Report of a joint FAO/WHO expert consultation. Information Division FAO. Roma, 2001. 30. Laparra, J.M.; Tako, E.; Glahn, R.P.; Miller, D.D. Supplemental inulin does not enhance iron bioavailability to Caco-2 cells from milk- or soy-based, probioticcontaining, yogurts but incubation at 37° does. Food Chemistry. 2008. doi: 10.10167j.foodchem.2007.12.027 (en prensa). 31. Perales S, Barberá R, Lagarda MJ, Farré R. Availability of iron from milkbased formulas and fruit juices containing milk and cereals estimated by in vitro methods (solubility, dialysability) and uptake and transport by Caco-2 cells. Food chemistry. 2007. 102, 1296-1303. 32. Guerra M. Fuentes de minerales. En: Colli C. (org) . Minerales en alimentos y dietas iberoamericanas. Red XI-G Cyted. Editora SBAN. Sao Paulo, 2008. 33. Guerra, M.; Sangronis, E.; Torres, A. Prácticas de Laboratorio Análisis de Alimentos. Universidad Simón Bolívar. Venezuela, 2007. 34. AOAC (Association of Official Analytical Chemists). Official Methods of Analysis. 15th Edition. Washington,1990. 35. COVENIN. Alimentos. Determinación del pH. (Acidez iónica). Norma 1315-79. Fondonorma. Venezuela, 1979. 36. Joslyn, M.A. Methods in food analysis. Academic Press. New York (USA), 1970. 37. Kuiters, L. Phenolic acids and plant growth in forest ecosystems. Tesis doctoral. Vrije Universiteit. Amsterdam, 1987. 38. Mujica, M.V.; Guerra, M., Soto, M. Efecto de la variedad, lavado de la caña y temperatura de punteo sobre la calidad de la panela granulada. Interciencia. 2008. 33 (8), 598-603. 39. Olivares, M.; Pizarro, F.; Hertrampf, E.; Fuenmayor, G.; Estévez, E. Iron 62 absorption from wheat flour: effects of lemonade and chamomile infusion. Nutrition. 2007. 23, 296 –300. 40. INN (Instituto Nacional de Nutrición). Valores de referencia de energía y nutrientes para la población venezolana. Ministerio de Salud y Desarrollo Social. Venezuela, 2000. 41. National Academy of Siences. Dietary Reference Intakes for Water, Potassium, Sodium, Chloride, and Sulfate. The National Academies Press. USA, 2005. 63 APÉNDICE Tabla 7. Parámetros de calidad de las panelas analizadas Muest ra Ab1 Ab2 Ag 1 Ag 2 Bb1 Bb2 Bg 1 Bg 2 Bg 2 Cb1 Cb2 Humed ad (%) 5,8 5,91 3,02 2,98 5,8 6,7 3,50 3,29 1,92 8,8 7,92 pH 6,31 6,02 6,03 6,2 5,96 6,16 6,25 5,9 6,29 5,12 5,22 Só lid o s so lubles (º Brix) 9,40 9,45 9,75 9,70 9,05 9,30 9,75 9,75 9,75 9,00 9,00 Tabla 8. Actividad antioxidante de las muestras Muest ra Ab1 Ab2 Ag 1 Ag 2 Bb1 Bb2 Bg 1 Bg 2 Bg 2 Cb1 Cb2 Po lif eno les Inhibició n (%) (mgAG/kg muest ra) 91 4,4845 90 3,4418 83 3,7658 87 3,7977 94 4,0179 89 2,8409 96 3,6230 92 3,7227 87 3,4820 90 4,0780 86 5,0820 64 Tabla 9. Contenido de cenizas y minerales de las muestras Muest ra Ab1 Ab2 Ag 1 Ag 2 Bb1 Bb2 Bg 1 Bg 2 Bg 2 Cb1 Cb2 Ceniz as (%) 1,00 0,82 1,22 1,50 1,82 2,42 1,12 1,590 1,30 2,13 2,48 Ca 167,20 74,05 95,07 83,62 136,54 184,55 137,07 104,89 84,40 209,27 215,02 Co nt enid o d e Fe P 5,23 88,83 2,65 32,41 7,71 53,83 3,34 30,53 3,04 80,30 2,27 31,65 2,57 69,60 2,34 66,32 2,19 63,56 2,93 23,06 1,67 14,23 minerales (mg /100g muest ra) K Mg Mn Cu 122,75 34,08 0,65 0,19 174,27 118,78 3,05 0,12 265,51 40,18 1,20 0,24 521,78 44,67 2,08 0,34 649,03 38,29 0,57 0,17 579,28 76,69 0,24 0,06 313,27 47,87 1,74 0,14 572,34 34,87 1,06 0,37 450,80 31,61 1,25 0,10 413,91 148,88 0,12 0,12 714,31 100,61 0,05 0,20 Zn 1,01 0,64 0,76 1,11 0,49 0,23 0,76 0,73 0,77 0,10 0,05 Tabla 10. Ejemplo de cálculo de actividad antioxidante de la muestra Cb1 mediante ensayo DPPH Co ncent ració n (mg/mL) 10 7,5 5 2,5 1 Abso rbancia (nm) Inhibició n (%) Ext ract o 1 Ext ract o 2 Ext ract o 3 0,52 0,54 0,52 90,49 0,53 0,53 0,54 89,98 0,75 0,69 0,75 73,20 1,02 0,96 1,05 49,11 1,32 1,28 1,28 24,63 65 10 0 60 40 20 0 0 2 4 6 8 10 12 Co nc e nt ra c ió n (mg/mL) Figura 20. Actividad antioxidante de la muestra Cb1 expresada como porcentaje de inhibición 1,400 1,200 Absorbancia (nm) Inhibic ió n (% ) 80 1,000 0,800 0,600 0,400 0,200 0,000 0 0,2 0,4 0,6 0,8 1 Concentración (mg AG/mL) Figura 21. Curva de calibración de polifenoles (Y=1,95X-0,2) Conte nido (mg/100g pane la) 66 500 450 400 350 300 250 C ontenido 10% IDR 200 150 100 50 0 K Ca P Mg Mine rale s Figura 22. Contenido de potasio, calcio, magnesio Contenido (mg/100g panela) y fósforo de las panelas contra el 10% IDR 3 2,5 2 1,5 Contenido 10% IDR 1 0,5 0 Fe Mn Zn Cu Minerales Figura 23. Contenido de hierro, manganeso, zinc y cobre de las panelas contra 10% IDR 67 RESULTADOS DE LOS ANÁLISIS ESTADÍSTICOS Humedad Granulada ANOVA Table for Humedad by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 4,47456 4 1,11864 260,55 0,0000 Within groups 0,0429333 10 0,00429333 ----------------------------------------------------------------------------Total (Corr.) 4,51749 14 Multiple Range Tests for Humedad by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------9 3 1,91667 X 4 3 2,97667 X 3 3 3,01667 X 8 3 3,29667 X 7 3 3,49667 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------3 - 4 0,04 3 - 7 *-0,48 3 - 8 *-0,28 3 - 9 *1,1 4 - 7 *-0,52 4 - 8 *-0,32 4 - 9 *1,06 7 - 8 *0,2 7 - 9 *1,58 8 - 9 *1,38 -------------------------------------------------------------------------------* denotes a statistically significant difference. 68 Humedad Bloque ANOVA Table for Humedad by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 24,3545 5 4,8709 188,23 0,0000 Within groups 0,310533 12 0,0258778 ----------------------------------------------------------------------------Total (Corr.) 24,665 17 Multiple Range Tests for Humedad by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------1 3 5,78333 X 5 3 5,8 X 2 3 5,91 X 6 3 6,68 X 11 3 7,91333 X 10 3 8,81 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 -0,126667 1 - 5 -0,0166667 1 - 6 *-0,896667 1 - 10 *-3,02667 1 - 11 *-2,13 2 - 5 0,11 2 - 6 *-0,77 2 - 10 *-2,9 2 - 11 *-2,00333 5 - 6 *-0,88 5 - 10 *-3,01 5 - 11 *-2,11333 6 - 10 *-2,13 6 - 11 *-1,23333 10 - 11 *0,896667 -------------------------------------------------------------------------------* denotes a statistically significant difference. 69 pH ANOVA Table for pH by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 5,03247 10 0,503247 5032,47 0,0000 Within groups 0,0022 22 0,0001 ----------------------------------------------------------------------------Total (Corr.) 5,03467 32 Multiple Range Tests for pH by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------10 3 5,12 X 11 3 5,22 X 8 3 5,9 X 5 3 5,96 X 2 3 6,02 X 3 3 6,03 X 6 3 6,16 X 4 3 6,2 X 7 3 6,25 X 9 3 6,29 X 1 3 6,31 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *0,29 1 - 3 *0,28 1 - 4 *0,11 1 - 5 *0,35 1 - 6 *0,15 1 - 7 *0,06 1 - 8 *0,41 1 - 9 *0,02 1 - 10 *1,19 1 - 11 *1,09 2 - 3 -0,01 2 - 4 *-0,18 2 - 5 *0,06 2 - 6 *-0,14 2 - 7 *-0,23 2 - 8 *0,12 2 - 9 *-0,27 2 - 10 *0,9 2 - 11 *0,8 3 - 4 *-0,17 3 - 5 *0,07 3 - 6 *-0,13 3 - 7 *-0,22 3 - 8 *0,13 3 - 9 *-0,26 3 - 10 *0,91 3 - 11 *0,81 4 - 5 *0,24 4 - 6 *0,04 70 4 - 7 *-0,05 4 - 8 *0,3 4 - 9 *-0,09 4 - 10 *1,08 4 - 11 *0,98 5 - 6 *-0,2 5 - 7 *-0,29 5 - 8 *0,06 5 - 9 *-0,33 5 - 10 *0,84 5 - 11 *0,74 6 - 7 *-0,09 6 - 8 *0,26 6 - 9 *-0,13 6 - 10 *1,04 6 - 11 *0,94 7 - 8 *0,35 7 - 9 *-0,04 7 - 10 *1,13 7 - 11 *1,03 8 - 9 *-0,39 8 - 10 *0,78 8 - 11 *0,68 9 - 10 *1,17 9 - 11 *1,07 10 - 11 *-0,1 -------------------------------------------------------------------------------* denotes a statistically significant difference. Sólidos solubles ANOVA Table for Brix by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 5,06136 10 0,506136 80,98 0,0000 Within groups 0,275 44 0,00625 ----------------------------------------------------------------------------Total (Corr.) 5,33636 54 Multiple Range Tests for Brix by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------10 5 9,0 X 11 5 9,0 X 5 5 9,05 X 6 5 9,3 X 1 5 9,4 XX 2 5 9,45 X 4 5 9,7 X 71 7 5 9,75 X 3 5 9,75 X 9 5 9,75 X 8 5 9,75 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 -0,05 1 - 3 *-0,35 1 - 4 *-0,3 1 - 5 *0,35 1 - 6 0,1 1 - 7 *-0,35 1 - 8 *-0,35 1 - 9 *-0,35 1 - 10 *0,4 1 - 11 *0,4 2 - 3 *-0,3 2 - 4 *-0,25 2 - 5 *0,4 2 - 6 *0,15 2 - 7 *-0,3 2 - 8 *-0,3 2 - 9 *-0,3 2 - 10 *0,45 2 - 11 *0,45 3 - 4 0,05 3 - 5 *0,7 3 - 6 *0,45 3 - 7 0,0 3 - 8 0,0 3 - 9 0,0 3 - 10 *0,75 3 - 11 *0,75 4 - 5 *0,65 4 - 6 *0,4 4 - 7 -0,05 4 - 8 -0,05 4 - 9 -0,05 4 - 10 *0,7 4 - 11 *0,7 5 - 6 *-0,25 5 - 7 *-0,7 5 - 8 *-0,7 5 - 9 *-0,7 5 - 10 0,05 5 - 11 0,05 6 - 7 *-0,45 6 - 8 *-0,45 6 - 9 *-0,45 6 - 10 *0,3 6 - 11 *0,3 7 - 8 0,0 7 - 9 0,0 7 - 10 *0,75 7 - 11 *0,75 8 - 9 0,0 8 - 10 *0,75 8 - 11 *0,75 9 - 10 *0,75 9 - 11 *0,75 10 - 11 0,0 -------------------------------------------------------------------------------* denotes a statistically significant difference. 72 Actividad antioxidante ANOVA Table for DPPH by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 397,313 10 39,7313 15,83 0,0000 Within groups 55,2189 22 2,50995 ----------------------------------------------------------------------------Total (Corr.) 452,532 32 Multiple Range Tests for DPPH by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------3 3 83,4839 X 11 3 85,6955 XX 4 3 87,1489 XX 9 3 87,4226 XX 6 3 88,8268 XX 2 3 89,9383 XXX 10 3 90,4926 XX 1 3 90,7317 XX 8 3 92,3555 XX 5 3 93,9528 XX 7 3 95,9023 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 0,793436 1 - 3 *7,24782 1 - 4 *3,58277 1 - 5 *-3,2211 1 - 6 1,90489 1 - 7 *-5,17058 1 - 8 -1,62383 1 - 9 *3,30915 1 - 10 0,239153 1 - 11 *5,03617 2 - 3 *6,45438 2 - 4 2,78934 2 - 5 *-4,01453 2 - 6 1,11146 2 - 7 *-5,96401 2 - 8 -2,41726 2 - 9 2,51572 2 - 10 -0,554283 2 - 11 *4,24273 3 - 4 *-3,66505 3 - 5 *-10,4689 3 - 6 *-5,34293 3 - 7 *-12,4184 3 - 8 *-8,87164 73 3 - 9 *-3,93866 3 - 10 *-7,00867 3 - 11 -2,21165 4 - 5 *-6,80387 4 - 6 -1,67788 4 - 7 *-8,75335 4 - 8 *-5,2066 4 - 9 -0,273616 4 - 10 *-3,34362 4 - 11 1,4534 5 - 6 *5,12599 5 - 7 -1,94948 5 - 8 1,59727 5 - 9 *6,53025 5 - 10 *3,46025 5 - 11 *8,25726 6 - 7 *-7,07547 6 - 8 *-3,52872 6 - 9 1,40426 6 - 10 -1,66574 6 - 11 *3,13128 7 - 8 *3,54675 7 - 9 *8,47973 7 - 10 *5,40973 7 - 11 *10,2067 8 - 9 *4,93298 8 - 10 1,86298 8 - 11 *6,65999 9 - 10 *-3,07 9 - 11 1,72701 10 - 11 *4,79702 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multifactor ANOVA - DPPH Analysis of Variance for DPPH - Type III Sums of Squares -------------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value -------------------------------------------------------------------------------MAIN EFFECTS A:Presentacion 7,79403 1 7,79403 0,93 0,3428 B:Marca 176,701 2 88,3505 10,57 0,0004 C:Lote 83,2751 2 41,6376 4,98 0,0144 RESIDUAL 225,688 27 8,35882 -------------------------------------------------------------------------------TOTAL (CORRECTED) 452,532 32 -------------------------------------------------------------------------------All F-ratios are based on the residual mean square error. Multiple Range Tests for DPPH by Lote -------------------------------------------------------------------------------Method: 95,0 percent Duncan Lote Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------3 3 84,6028 1,86624 X 74 2 15 88,3099 0,791777 X 1 15 90,4296 0,791777 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 2,11963 1 - 3 *5,82675 2 - 3 *3,70712 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multiple Range Tests for DPPH by Marca -------------------------------------------------------------------------------Method: 95,0 percent Duncan Marca Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------Nonavana 6 85,9352 1,39101 X Flor de Cana 12 86,2367 1,05936 X Queniquea 15 91,1704 0,811092 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------Flor de Cana - Nonavana 0,301524 Flor de Cana - Queniquea *-4,93366 Nonavana - Queniquea *-5,23518 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multiple Range Tests for DPPH by Presentacion -------------------------------------------------------------------------------Method: 95,0 percent Duncan Presentacion Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------Granulada 15 87,2109 0,943429 X Bloque 18 88,3506 0,943429 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------Bloque - Granulada 1,13974 -------------------------------------------------------------------------------* denotes a statistically significant difference. 75 Residual Plot f or DPPH residual 8 4 0 -4 -8 1 2 3 Lot e Residual Plot f or DPPH residual 8 4 0 -4 -8 Flor de CanaNonavana Queniquea Marca Residual Plot for DPPH residual 8 4 0 -4 -8 Bloque Granulada Presentacion 76 Contenido de polifenoles ANOVA Table for Folin by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 10,1947 10 1,01947 22,12 0,0000 Within groups 1,01379 22 0,0460813 ----------------------------------------------------------------------------Total (Corr.) 11,2084 32 Multiple Range Tests for Folin by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------6 3 2,84095 X 2 3 3,44185 X 9 3 3,48205 X 7 3 3,62305 XX 8 3 3,72269 XXX 3 3 3,7658 XXX 4 3 3,79766 XXX 5 3 4,01786 XX 10 3 4,07802 X 1 3 4,48451 X 11 3 5,08197 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *1,04266 1 - 3 *0,718711 1 - 4 *0,686847 1 - 5 *0,46665 1 - 6 *1,64356 1 - 7 *0,861461 1 - 8 *0,761818 1 - 9 *1,00247 1 - 10 *0,406488 1 - 11 *-0,59746 2 - 3 -0,323951 2 - 4 -0,355815 2 - 5 *-0,576012 2 - 6 *0,600901 2 - 7 -0,181201 2 - 8 -0,280844 2 - 9 -0,0401974 2 - 10 *-0,636174 2 - 11 *-1,64012 3 - 4 -0,031864 3 - 5 -0,252061 3 - 6 *0,924852 3 - 7 0,14275 3 - 8 0,043107 3 - 9 0,283754 3 - 10 -0,312223 3 - 11 *-1,31617 4 - 5 -0,220197 77 4 - 6 *0,956716 4 - 7 0,174614 4 - 8 0,0749711 4 - 9 0,315618 4 - 10 -0,280359 4 - 11 *-1,28431 5 - 6 *1,17691 5 - 7 0,394811 5 - 8 0,295168 5 - 9 *0,535815 5 - 10 -0,0601617 5 - 11 *-1,06411 6 - 7 *-0,782102 6 - 8 *-0,881745 6 - 9 *-0,641098 6 - 10 *-1,23707 6 - 11 *-2,24102 7 - 8 -0,0996428 7 - 9 0,141004 7 - 10 *-0,454973 7 - 11 *-1,45892 8 - 9 0,240647 8 - 10 -0,35533 8 - 11 *-1,35928 9 - 10 *-0,595977 9 - 11 *-1,59992 10 - 11 *-1,00395 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multifactor ANOVA - Folin Analysis of Variance for Folin - Type III Sums of Squares -------------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value -------------------------------------------------------------------------------MAIN EFFECTS A:Presentacion 0,00576949 1 0,00576949 0,03 0,8749 B:Marca 3,74321 2 1,8716 8,19 0,0017 C:Lote 0,36821 2 0,184105 0,81 0,4572 RESIDUAL 6,16871 27 0,228471 -------------------------------------------------------------------------------TOTAL (CORRECTED) 11,2084 32 -------------------------------------------------------------------------------All F-ratios are based on the residual mean square error. Multiple Range Tests for Folin by Lote -------------------------------------------------------------------------------Method: 95,0 percent Duncan Lote Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------2 15 3,89795 0,130902 X 3 3 3,92177 0,308539 X 1 15 4,11478 0,130902 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 0,216824 78 1 - 3 0,193009 2 - 3 -0,0238154 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multiple Range Tests for Folin by Marca -------------------------------------------------------------------------------Method: 95,0 percent Duncan Marca Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------Queniquea 15 3,52294 0,134095 X Flor de Cana 12 3,84426 0,175141 X Nonavana 6 4,5673 0,229971 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------Flor de Cana - Nonavana *-0,723046 Flor de Cana - Queniquea 0,321318 Nonavana - Queniquea *1,04436 -------------------------------------------------------------------------------* denotes a statistically significant difference. Multiple Range Tests for Folin by Presentacion -------------------------------------------------------------------------------Method: 95,0 percent Duncan Presentacion Count LS Mean LS Sigma Homogeneous Groups -------------------------------------------------------------------------------Bloque 18 3,96266 0,155974 X Granulada 15 3,99367 0,155974 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------Bloque - Granulada -0,0310094 -------------------------------------------------------------------------------* denotes a statistically significant difference. Residual Plot for Folin 0,9 residual 0,6 0,3 0 -0,3 -0,6 -0,9 1 2 Lote 3 79 Residual Plot for Folin 0,9 residual 0,6 0,3 0 - 0,3 - 0,6 - 0,9 Flor de CanaNonavana Queniquea Marca Residual Plot for Folin 0,9 residual 0,6 0,3 0 -0,3 -0,6 -0,9 Bloque Granulada Presentacion Cenizas ANOVA Table for Cenizas by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 9,48366 10 0,948366 520,77 0,0000 Within groups 0,0400636 22 0,00182107 ----------------------------------------------------------------------------Total (Corr.) 9,52373 32 80 Multiple Range Tests for Cenizas by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------2 3 0,850364 X 1 3 1,00503 X 7 3 1,12308 X 3 3 1,22238 X 9 3 1,29611 X 4 3 1,49933 X 8 3 1,5899 X 5 3 1,8213 X 10 3 2,12845 X 6 3 2,42056 X 11 3 2,47951 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *0,154668 1 - 3 *-0,217348 1 - 4 *-0,494302 1 - 5 *-0,816264 1 - 6 *-1,41553 1 - 7 *-0,118052 1 - 8 *-0,584865 1 - 9 *-0,291075 1 - 10 *-1,12342 1 - 11 *-1,47448 2 - 3 *-0,372016 2 - 4 *-0,648969 2 - 5 *-0,970931 2 - 6 *-1,5702 2 - 7 *-0,272719 2 - 8 *-0,739533 2 - 9 *-0,445743 2 - 10 *-1,27808 2 - 11 *-1,62915 3 - 4 *-0,276953 3 - 5 *-0,598915 3 - 6 *-1,19818 3 - 7 *0,0992965 3 - 8 *-0,367517 3 - 9 *-0,0737269 3 - 10 *-0,906067 3 - 11 *-1,25713 4 - 5 *-0,321962 4 - 6 *-0,921229 4 - 7 *0,37625 4 - 8 *-0,0905635 4 - 9 *0,203226 4 - 10 *-0,629114 4 - 11 *-0,980179 5 - 6 *-0,599267 5 - 7 *0,698212 5 - 8 *0,231398 5 - 9 *0,525188 5 - 10 *-0,307152 5 - 11 *-0,658217 6 - 7 *1,29748 6 - 8 *0,830665 6 - 9 *1,12446 6 - 10 *0,292115 6 - 11 -0,0589499 81 7 - 8 *-0,466813 7 - 9 *-0,173023 7 - 10 *-1,00536 7 - 11 *-1,35643 8 - 9 *0,29379 8 - 10 *-0,53855 8 - 11 *-0,889615 9 - 10 *-0,83234 9 - 11 *-1,18341 10 - 11 *-0,351065 -------------------------------------------------------------------------------* denotes a statistically significant difference. Calcio ANOVA Table for Ca by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 80490,3 10 8049,03 18,22 0,0000 Within groups 9721,4 22 441,882 ----------------------------------------------------------------------------Total (Corr.) 90211,7 32 Multiple Range Tests for Ca by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------2 3 74,0511 X 4 3 83,6175 X 9 3 84,4004 X 3 3 95,0701 X 8 3 104,887 XX 5 3 136,535 XX 7 3 137,066 XX 1 3 167,197 XX 6 3 184,554 XX 10 3 209,266 X 11 3 215,021 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *93,1459 1 - 3 *72,1269 1 - 4 *83,5796 1 - 5 30,6617 1 - 6 -17,3572 1 - 7 30,131 1 - 8 *62,3099 1 - 9 *82,7966 1 - 10 *-42,0694 1 - 11 *-47,8235 2 - 3 -21,019 2 - 4 -9,56633 2 - 5 *-62,4842 2 - 6 *-110,503 82 2 - 7 *-63,0149 2 - 8 -30,836 2 - 9 -10,3492 2 - 10 *-135,215 2 - 11 *-140,969 3 - 4 11,4527 3 - 5 *-41,4652 3 - 6 *-89,4841 3 - 7 *-41,9959 3 - 8 -9,81698 3 - 9 10,6697 3 - 10 *-114,196 3 - 11 *-119,95 4 - 5 *-52,9179 4 - 6 *-100,937 4 - 7 *-53,4486 4 - 8 -21,2696 4 - 9 -0,78292 4 - 10 *-125,649 4 - 11 *-131,403 5 - 6 *-48,0189 5 - 7 -0,530703 5 - 8 31,6482 5 - 9 *52,135 5 - 10 *-72,7311 5 - 11 *-78,4852 6 - 7 *47,4881 6 - 8 *79,6671 6 - 9 *100,154 6 - 10 -24,7123 6 - 11 -30,4664 7 - 8 32,1789 7 - 9 *52,6657 7 - 10 *-72,2004 7 - 11 *-77,9545 8 - 9 20,4867 8 - 10 *-104,379 8 - 11 *-110,133 9 - 10 *-124,866 9 - 11 *-130,62 10 - 11 -5,75412 -------------------------------------------------------------------------------* denotes a statistically significant difference. Hierro ANOVA Table for Fe by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 90,6424 10 9,06424 5,22 0,0006 Within groups 38,172 22 1,73509 ----------------------------------------------------------------------------Total (Corr.) 128,814 32 83 Multiple Range Tests for Fe by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------11 3 1,66796 X 9 3 2,19377 X 6 3 2,27027 X 8 3 2,34119 X 7 3 2,56604 X 2 3 2,65034 X 10 3 2,93223 XX 5 3 3,0436 XX 4 3 3,34484 XX 1 3 5,22948 X 3 3 7,71266 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *2,57914 1 - 3 *-2,48318 1 - 4 1,88464 1 - 5 2,18588 1 - 6 *2,9592 1 - 7 *2,66344 1 - 8 *2,88829 1 - 9 *3,03571 1 - 10 2,29725 1 - 11 *3,56151 2 - 3 *-5,06232 2 - 4 -0,6945 2 - 5 -0,393263 2 - 6 0,380063 2 - 7 0,0842967 2 - 8 0,309147 2 - 9 0,456567 2 - 10 -0,28189 2 - 11 0,982373 3 - 4 *4,36782 3 - 5 *4,66906 3 - 6 *5,44238 3 - 7 *5,14662 3 - 8 *5,37147 3 - 9 *5,51889 3 - 10 *4,78043 3 - 11 *6,04469 4 - 5 0,301237 4 - 6 1,07456 4 - 7 0,778797 4 - 8 1,00365 4 - 9 1,15107 4 - 10 0,41261 4 - 11 1,67687 5 - 6 0,773327 5 - 7 0,47756 5 - 8 0,70241 5 - 9 0,84983 5 - 10 0,111373 5 - 11 1,37564 6 - 7 -0,295767 6 - 8 -0,0709167 6 - 9 0,0765033 84 6 - 10 -0,661953 6 - 11 0,60231 7 - 8 0,22485 7 - 9 0,37227 7 - 10 -0,366187 7 - 11 0,898077 8 - 9 0,14742 8 - 10 -0,591037 8 - 11 0,673227 9 - 10 -0,738457 9 - 11 0,525807 10 - 11 1,26426 -------------------------------------------------------------------------------* denotes a statistically significant difference. Fósforo ANOVA Table for P by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 18910,7 10 1891,07 22,12 0,0000 Within groups 1880,86 22 85,4935 ----------------------------------------------------------------------------Total (Corr.) 20791,5 32 Multiple Range Tests for P by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------11 3 14,2292 X 10 3 23,0615 XX 4 3 30,5306 XX 6 3 31,6492 X 2 3 32,4086 X 3 3 53,8263 X 9 3 63,5561 XX 8 3 66,3192 XX 7 3 69,5976 XX 5 3 80,2976 XX 1 3 88,833 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *56,4244 1 - 3 *35,0067 1 - 4 *58,3024 1 - 5 8,53542 1 - 6 *57,1838 1 - 7 *19,2354 1 - 8 *22,5138 1 - 9 *25,2769 1 - 10 *65,7715 1 - 11 *74,6038 85 2 - 3 *-21,4177 2 - 4 1,87804 2 - 5 *-47,889 2 - 6 0,759383 2 - 7 *-37,189 2 - 8 *-33,9106 2 - 9 *-31,1475 2 - 10 9,34712 2 - 11 *18,1795 3 - 4 *23,2958 3 - 5 *-26,4712 3 - 6 *22,1771 3 - 7 -15,7713 3 - 8 -12,4929 3 - 9 -9,72974 3 - 10 *30,7648 3 - 11 *39,5972 4 - 5 *-49,767 4 - 6 -1,11866 4 - 7 *-39,0671 4 - 8 *-35,7887 4 - 9 *-33,0255 4 - 10 7,46908 4 - 11 16,3014 5 - 6 *48,6483 5 - 7 10,6999 5 - 8 13,9783 5 - 9 16,7415 5 - 10 *57,2361 5 - 11 *66,0684 6 - 7 *-37,9484 6 - 8 *-34,67 6 - 9 *-31,9068 6 - 10 8,58774 6 - 11 *17,4201 7 - 8 3,27839 7 - 9 6,04155 7 - 10 *46,5361 7 - 11 *55,3685 8 - 9 2,76316 8 - 10 *43,2577 8 - 11 *52,0901 9 - 10 *40,4946 9 - 11 *49,3269 10 - 11 8,83234 -------------------------------------------------------------------------------* denotes a statistically significant difference. Potasio ANOVA Table for K by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 1,14224E6 10 114224,0 17,63 0,0000 Within groups 142546,0 22 6479,37 ----------------------------------------------------------------------------Total (Corr.) 1,28479E6 32 86 Multiple Range Tests for K by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------1 3 122,751 X 2 3 174,269 XX 3 3 265,508 XX 7 3 313,273 XX 10 3 413,911 XX 9 3 450,797 XXX 4 3 521,776 XXX 8 3 572,336 XXX 6 3 579,285 XXX 5 3 649,028 XX 11 3 714,315 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 -51,5174 1 - 3 -142,757 1 - 4 *-399,025 1 - 5 *-526,276 1 - 6 *-456,533 1 - 7 *-190,521 1 - 8 *-449,585 1 - 9 *-328,046 1 - 10 *-291,16 1 - 11 *-591,563 2 - 3 -91,2396 2 - 4 *-347,507 2 - 5 *-474,759 2 - 6 *-405,016 2 - 7 -139,004 2 - 8 *-398,067 2 - 9 *-276,528 2 - 10 *-239,643 2 - 11 *-540,046 3 - 4 *-256,268 3 - 5 *-383,519 3 - 6 *-313,776 3 - 7 -47,7645 3 - 8 *-306,828 3 - 9 *-185,289 3 - 10 *-148,403 3 - 11 *-448,806 4 - 5 -127,251 4 - 6 -57,5083 4 - 7 *208,503 4 - 8 -50,56 4 - 9 70,9791 4 - 10 107,865 4 - 11 *-192,538 5 - 6 69,7431 5 - 7 *335,755 5 - 8 76,6914 5 - 9 *198,231 5 - 10 *235,116 5 - 11 -65,287 6 - 7 *266,012 6 - 8 6,94838 6 - 9 128,487 87 6 - 10 *165,373 6 - 11 -135,03 7 - 8 *-259,063 7 - 9 -137,524 7 - 10 -100,639 7 - 11 *-401,042 8 - 9 121,539 8 - 10 *158,425 8 - 11 -141,978 9 - 10 36,8857 9 - 11 *-263,518 10 - 11 *-300,403 -------------------------------------------------------------------------------* denotes a statistically significant difference. Magnesio ANOVA Table for Mg by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 49042,2 10 4904,22 28,82 0,0000 Within groups 3743,07 22 170,14 ----------------------------------------------------------------------------Total (Corr.) 52785,2 32 Multiple Range Tests for Mg by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------9 3 31,6078 X 1 3 34,0797 X 8 3 34,8714 X 5 3 38,2895 X 3 3 40,1832 X 4 3 44,6737 X 7 3 47,8735 X 6 3 76,6936 X 11 3 100,613 X 2 3 118,778 X 10 3 148,88 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *-84,6987 1 - 3 -6,10348 1 - 4 -10,594 1 - 5 -4,20975 1 - 6 *-42,6139 1 - 7 -13,7938 1 - 8 -0,79168 1 - 9 2,47188 1 - 10 *-114,8 88 1 - 11 *-66,5331 2 - 3 *78,5952 2 - 4 *74,1046 2 - 5 *80,4889 2 - 6 *42,0848 2 - 7 *70,9049 2 - 8 *83,907 2 - 9 *87,1706 2 - 10 *-30,1016 2 - 11 18,1656 3 - 4 -4,49055 3 - 5 1,89373 3 - 6 *-36,5104 3 - 7 -7,69029 3 - 8 5,3118 3 - 9 8,57536 3 - 10 *-108,697 3 - 11 *-60,4296 4 - 5 6,38428 4 - 6 *-32,0199 4 - 7 -3,19975 4 - 8 9,80235 4 - 9 13,0659 4 - 10 *-104,206 4 - 11 *-55,9391 5 - 6 *-38,4041 5 - 7 -9,58402 5 - 8 3,41807 5 - 9 6,68163 5 - 10 *-110,59 5 - 11 *-62,3234 6 - 7 *28,8201 6 - 8 *41,8222 6 - 9 *45,0858 6 - 10 *-72,1863 6 - 11 *-23,9192 7 - 8 13,0021 7 - 9 16,2657 7 - 10 *-101,006 7 - 11 *-52,7393 8 - 9 3,26356 8 - 10 *-114,009 8 - 11 *-65,7414 9 - 10 *-117,272 9 - 11 *-69,005 10 - 11 *48,2671 -------------------------------------------------------------------------------* denotes a statistically significant difference. Manganeso ANOVA Table for Mn by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 25,3871 10 2,53871 202,28 0,0000 Within groups 0,276113 22 0,0125506 ----------------------------------------------------------------------------Total (Corr.) 25,6632 32 89 Multiple Range Tests for Mn by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------11 3 0,05281 X 10 3 0,121643 X 6 3 0,242533 X 5 3 0,570517 X 1 3 0,64856 X 8 3 1,0552 X 3 3 1,20048 X 9 3 1,24654 X 7 3 1,73729 X 4 3 2,08165 X 2 3 3,04594 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *-2,39738 1 - 3 *-0,551917 1 - 4 *-1,43309 1 - 5 0,0780433 1 - 6 *0,406027 1 - 7 *-1,08873 1 - 8 *-0,406637 1 - 9 *-0,597983 1 - 10 *0,526917 1 - 11 *0,59575 2 - 3 *1,84546 2 - 4 *0,964287 2 - 5 *2,47542 2 - 6 *2,8034 2 - 7 *1,30865 2 - 8 *1,99074 2 - 9 *1,79939 2 - 10 *2,92429 2 - 11 *2,99313 3 - 4 *-0,881173 3 - 5 *0,62996 3 - 6 *0,957943 3 - 7 *-0,536813 3 - 8 0,14528 3 - 9 -0,0460667 3 - 10 *1,07883 3 - 11 *1,14767 4 - 5 *1,51113 4 - 6 *1,83912 4 - 7 *0,34436 4 - 8 *1,02645 4 - 9 *0,835107 4 - 10 *1,96001 4 - 11 *2,02884 5 - 6 *0,327983 5 - 7 *-1,16677 5 - 8 *-0,48468 5 - 9 *-0,676027 5 - 10 *0,448873 5 - 11 *0,517707 6 - 7 *-1,49476 6 - 8 *-0,812663 6 - 9 *-1,00401 90 6 - 10 0,12089 6 - 11 0,189723 7 - 8 *0,682093 7 - 9 *0,490747 7 - 10 *1,61565 7 - 11 *1,68448 8 - 9 -0,191347 8 - 10 *0,933553 8 - 11 *1,00239 9 - 10 *1,1249 9 - 11 *1,19373 10 - 11 0,0688333 -------------------------------------------------------------------------------* denotes a statistically significant difference. Cobre ANOVA Table for Cu by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 0,295664 10 0,0295664 5,22 0,0006 Within groups 0,12466 22 0,00566637 ----------------------------------------------------------------------------Total (Corr.) 0,420325 32 Multiple Range Tests for Cu by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------6 3 0,0597767 X 9 3 0,0955667 X 10 3 0,11557 XX 2 3 0,121363 XX 7 3 0,144897 XX 5 3 0,168403 XX 1 3 0,190757 XX 11 3 0,203437 XX 3 3 0,241987 XX 4 3 0,343587 X 8 3 0,373153 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 0,0693933 1 - 3 -0,05123 1 - 4 *-0,15283 1 - 5 0,0223533 1 - 6 0,13098 1 - 7 0,04586 1 - 8 *-0,182397 1 - 9 0,09519 1 - 10 0,0751867 91 1 - 11 -0,01268 2 - 3 -0,120623 2 - 4 *-0,222223 2 - 5 -0,04704 2 - 6 0,0615867 2 - 7 -0,0235333 2 - 8 *-0,25179 2 - 9 0,0257967 2 - 10 0,00579333 2 - 11 -0,0820733 3 - 4 -0,1016 3 - 5 0,0735833 3 - 6 *0,18221 3 - 7 0,09709 3 - 8 -0,131167 3 - 9 *0,14642 3 - 10 0,126417 3 - 11 0,03855 4 - 5 *0,175183 4 - 6 *0,28381 4 - 7 *0,19869 4 - 8 -0,0295667 4 - 9 *0,24802 4 - 10 *0,228017 4 - 11 *0,14015 5 - 6 0,108627 5 - 7 0,0235067 5 - 8 *-0,20475 5 - 9 0,0728367 5 - 10 0,0528333 5 - 11 -0,0350333 6 - 7 -0,08512 6 - 8 *-0,313377 6 - 9 -0,03579 6 - 10 -0,0557933 6 - 11 -0,14366 7 - 8 *-0,228257 7 - 9 0,04933 7 - 10 0,0293267 7 - 11 -0,05854 8 - 9 *0,277587 8 - 10 *0,257583 8 - 11 *0,169717 9 - 10 -0,0200033 9 - 11 -0,10787 10 - 11 -0,0878667 -------------------------------------------------------------------------------* denotes a statistically significant difference. Zinc ANOVA Table for Zn by Muestra Analysis of Variance ----------------------------------------------------------------------------Source Sum of Squares Df Mean Square F-Ratio P-Value ----------------------------------------------------------------------------Between groups 3,71402 10 0,371402 32,47 0,0000 Within groups 0,25162 22 0,0114373 ----------------------------------------------------------------------------Total (Corr.) 3,96565 32 92 Multiple Range Tests for Zn by Muestra -------------------------------------------------------------------------------Method: 95,0 percent Duncan Muestra Count Mean Homogeneous Groups -------------------------------------------------------------------------------11 3 0,0465667 X 10 3 0,0988867 X 6 3 0,230913 X 5 3 0,485317 X 2 3 0,63647 XX 8 3 0,731913 X 7 3 0,76253 X 3 3 0,764503 X 9 3 0,769553 X 1 3 1,00657 X 4 3 1,11496 X -------------------------------------------------------------------------------Contrast Difference -------------------------------------------------------------------------------1 - 2 *0,370103 1 - 3 *0,24207 1 - 4 -0,108383 1 - 5 *0,521257 1 - 6 *0,77566 1 - 7 *0,244043 1 - 8 *0,27466 1 - 9 *0,23702 1 - 10 *0,907687 1 - 11 *0,960007 2 - 3 -0,128033 2 - 4 *-0,478487 2 - 5 0,151153 2 - 6 *0,405557 2 - 7 -0,12606 2 - 8 -0,0954433 2 - 9 -0,133083 2 - 10 *0,537583 2 - 11 *0,589903 3 - 4 *-0,350453 3 - 5 *0,279187 3 - 6 *0,53359 3 - 7 0,00197333 3 - 8 0,03259 3 - 9 -0,00505 3 - 10 *0,665617 3 - 11 *0,717937 4 - 5 *0,62964 4 - 6 *0,884043 4 - 7 *0,352427 4 - 8 *0,383043 4 - 9 *0,345403 4 - 10 *1,01607 4 - 11 *1,06839 5 - 6 *0,254403 5 - 7 *-0,277213 5 - 8 *-0,246597 5 - 9 *-0,284237 5 - 10 *0,38643 5 - 11 *0,43875 6 - 7 *-0,531617 6 - 8 *-0,501 6 - 9 *-0,53864 6 - 10 0,132027 93 6 - 11 0,184347 7 - 8 0,0306167 7 - 9 -0,00702333 7 - 10 *0,663643 7 - 11 *0,715963 8 - 9 -0,03764 8 - 10 *0,633027 8 - 11 *0,685347 9 - 10 *0,670667 9 - 11 *0,722987 10 - 11 0,05232 -------------------------------------------------------------------------------* denotes a statistically significant difference.