Formulación Inorgánica_Tutorial
Anuncio
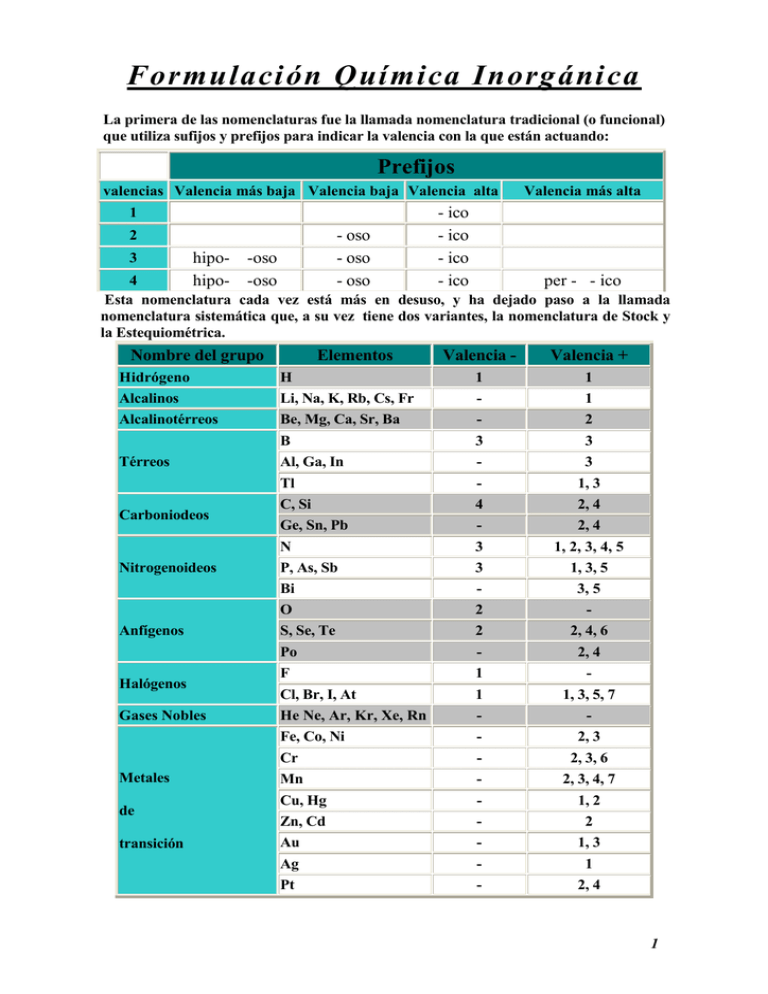
Formulación Química Inorgánica La primera de las nomenclaturas fue la llamada nomenclatura tradicional (o funcional) que utiliza sufijos y prefijos para indicar la valencia con la que están actuando: Prefijos valencias Valencia más baja Valencia baja Valencia alta 1 - oso - oso - oso 2 3 hipo- -oso hipo- -oso Valencia más alta - ico - ico - ico - ico 4 per - - ico Esta nomenclatura cada vez está más en desuso, y ha dejado paso a la llamada nomenclatura sistemática que, a su vez tiene dos variantes, la nomenclatura de Stock y la Estequiométrica. Nombre del grupo Elementos Valencia - Valencia + Hidrógeno H 1 1 Alcalinos Alcalinotérreos Li, Na, K, Rb, Cs, Fr Be, Mg, Ca, Sr, Ba - 1 2 Térreos B Al, Ga, In 3 - 3 3 Tl C, Si Ge, Sn, Pb 4 - 1, 3 2, 4 2, 4 N P, As, Sb Bi O S, Se, Te Po F Cl, Br, I, At 3 3 2 2 1 1 1, 2, 3, 4, 5 1, 3, 5 3, 5 2, 4, 6 2, 4 1, 3, 5, 7 He Ne, Ar, Kr, Xe, Rn Fe, Co, Ni - 2, 3 Cr Mn - 2, 3, 6 2, 3, 4, 7 Cu, Hg Zn, Cd Au Ag Pt - 1, 2 2 1, 3 1 2, 4 Carboniodeos Nitrogenoideos Anfígenos Halógenos Gases Nobles Metales de transición 1 Combinaciones binarias con el Hidrógeno Hidruros metálicos Hidrógeno + Metal Hidruro metálico La fórmula general es MHm (el metal siempre delante del hidrógeno) donde m es la valencia del metal. La valencia del Hidrógeno es 1. Nomenclatura tradicional: - oso (valencia menor) (nombre del metal terminado en) hidruro - ico (valencia mayor) (nombre genérico) Nomenclatura de Stock: hidruro de (nombre del metal sin variar) ( ) (valencia del metal en números romanos siempre que tenga más de una) (nombre genérico) Nomenclatura Estequiométrica: (prefijo griego) Ejemplos: Fórmula Tradicional NaH KH CaH2 Hidruro Sódico Hidruro Potásico Hidruro Cálcico Hidruro Alumínico Hidruro Ferroso Hidruro mercúrico Hidruro argéntico Hidruro Cromoso* Hidruro Crómico* AlH3 FeH2 HgH2 AgH CrH2 CrH3 Hidruro de nombre del metal sin variar Nomenclatura Stock Estequiométrica Hidruro de Sodio Hidruro de Potasio Hidruro de Calcio Hidruro de Sodio Hidruro de Potasio Dihidruro de Calcio Hidruro de Aluminio Trihidruro de Aluminio Hidruro de Hierro(II) Dihidruro de Hierro Hidruro de mercurio Dihidruro de mercurio (II) Hidruro de plata Hidruro de plata Hidruro de Cromo(II) Dihidruro de Cromo Hidruro de Cromo(III) Trihidruro de Cromo * El Cromo con valencia 6 actúa como no metal (al igual que el Bismuto con valencia 5 y el Manganeso con valencia 7) 2 Hidrácidos Resultan de la combinación del Hidrógeno con Halógenos y algunos Anfígenos. Se llaman Hidrácidos porque al disolverse en agua dan soluciones ácidas. Hidrógeno + no metal Haluro de Hidrógeno (F, Cl, Br, I, S, Se, Te) (ácido hidrácido en disolución acuosa) Su fórmula es HmX. El Hidrógeno se coloca en primer lugar por ser el elemento menos electronegativo y m es la valencia negativa del no metal. Nomenclatura tradicional: ácido nombre del no metal terminado en hídrico. Nomenclatura Sistemática: Nombre del no metal terminado en -uro de Hidrógeno Ejemplos: Nomenclaturas Tradicional Sistemática Fórmula HF HCl HBr HI H2S H2Se H2Te Ac. Fluorhídrico Ac. Clorhídrico Ac. Bromhídrico Ac. Yodhídrico Ac. Sulfhídrico Ac. Selenhídrico Ac. Telurhídrico Fluoruro de Hidrógeno Cloruro de Hidrógeno Bromuro de Hidrógeno Yoduro de Hidrógeno Sulfuro de Hidrógeno Seleniuro de Hidrógeno Telururo de Hidrógeno Hidruros no metálicos Hidrógeno + no metal (N, P, As, Sb, O, C, Si, Ge) H no metálico No presentan propiedades ácidas con el agua. Son volátiles. Su fórmula es XHm, donde m es la valencia negativa del no metal, que no hace falta especificar ya que no hay ningún no metal que tenga más de una valencia negativa. 3 Nomenclatura tradicional: Todos estos compuestos tienen nombres propios admitidos por la IUPAC, que son muy utilizados. No siguen ninguna regla. Nomenclatura Sistemática: prefijo griego nº de átomos Hidruro de nombre del no metal sin variar Ejemplos: Nomenclaturas Tradicional Sistemática Fórmula H2O NH3 PH3 AsH3 SbH3 CH4 SiH4 BH3 Agua Amoníaco Fosfina Arsina Estibina Metano Silano Borano -----Trihidruro de Nitrógeno Trihidruro de Fósforo Trihidruro de Arsénico Trihidruro de Antimonio Tetrahidruro de Carbono Tetrahidruro de Silicio Trihidruro de Boro Combinaciones binarias con el Oxígeno Desde un punto de vista electrónico, los compuestos que forma el oxígeno con la mayoría de los elementos suelen tener bastante carácter iónico, ya que el oxígeno, que es el elemento más electronegativo después del flúor, tiene una gran tendencia a tomar dos electrones para adquirir una estructura electrónica de gas noble. Sin embargo, también puede formar compuestos covalentes compartiendo electrones con otros no metales. Cabe hacer la siguiente clasificación de los compuestos binarios del oxígeno: Óxidos básicos (con metales) Su fórmula es MxOy, donde x e y son las valencias intercambiadas del oxígeno (-2) y el metal (+m), simplificadas a ser posible. Nomenclatura tradicional: - oso (valencia menor) óxido (nombre del metal terminado en) - ico (valencia mayor) y si el elemento tiene una sola valencia, también se puede nombrar: 4 óxido de nombre del metal sin variar Nomenclatura de Stock: óxido de (nombre del metal sin variar) ( ) (valencia del metal en números romanos siempre que tenga más de una) Nomenclatura Estequiométrica: prefijo griego óxido de nº de átomos de oxígeno prefijo griego nombre del metal sin variar nº de átomos del metal Ejemplos: Fórmula Tradicional Nomenclatura Stock BaO Na2O Óxido Bárico Óxido Sódico Óxido de Bario Óxido de Sodio Al2O3 Óxido Alumínico CoO CuO Cu2O FeO Fe2O3 MgO ZnO SnO2 Óxido Cobaltoso Óxido Cúprico Óxido Cuproso Óxido Ferroso Óxido Férrico Óxido Magnésico Óxido Cínquico Óxido Estánnico Estequiométrica Óxido de Bario Óxido de disodio Trióxido de Óxido de Aluminio dialuminio Óxido de Cobalto (II) Óxido de Cobalto Óxido de Cobre (II) Óxido de Cobre Óxido de Cobre (I) Óxido de dicobre Óxido de Hierro (II) Óxido de Hierro Óxido de Hierro (III) Trióxido de dihierro Óxido de Magnesio Óxido de Magnesio Óxido de Cinc Óxido de Cinc Óxido de Estaño (IV) Dióxido de Estaño Peróxidos Su fórmula es M2O2, (sin simplificar), si el metal es de valencia 1 (y también con el Hidrógeno) y MO2, si el metal tiene valencia 2. Con cualquier otra valencia, los metales no pueden formar peróxidos. 5 Nomenclatura tradicional: - oso (valencia menor) (nombre del metal terminado en) peróxido - ico (valencia mayor) Nomenclatura de Stock: Peróxido de (nombre del metal sin variar) ( ) (valencia del metal en números romanos siempre que tenga más de una) Nomenclatura Estequiométrica: Dióxido de Fórmula Li2O2 Cs2O2 Ag2O2 MgO2 SrO2 ZnO2 Cu2O2 CuO2 NiO2 H2O2 prefijo griego nº de átomos del metal Tradicional (nombre del metal sin variar) Nomenclatura Stock Estequiométrica Peróxido Lítico Peróxido de Litio Dióxido de dilitio Peróxido Césico Peróxido de Cesio Dióxido de dicesio Peróxido Argéntico Peróxido de Plata Dióxido de diplata Peróxido Dióxido de Peróxido de Magnesio Magnésico Magnesio Peróxido Estróncico Peróxido de Estroncio Dióxido de Estroncio Peróxido Cínquico Peróxido de Cinc Dióxido de Cinc Peróxido Cuproso Peróxido de Cobre (I) Dióxido de dicobre Peróxido de Cobre Peróxido Cúprico Dióxido de cobre (II) Peróxido de Níquel Peróxido Niqueloso Dióxido de Níquel (II) Peróxido de Dióxido de Agua Oxigenada Hidrógeno dihidrógeno Óxidos ácidos (con no metales) Oxígeno + no metal Óxidos ácidos (anhídridos) Su fórmula es MxOy, donde x e y son las valencias intercambiadas del oxígeno (-2) y el No metal (alguna de las positivas que posee), simplificadas a ser posible, (estos óxidos son compuestos covalentes). 6 Nomenclatura tradicional: Anhídrido (nombre del no metal terminado en) Sufijo (y a veces prefijo) indicando la valencia con la que actúa el no metal Nomenclatura de Stock: (nombre del no metal sin variar) óxido de (nombre) ( ) (valencia en números romanos) Nomenclatura Estequiométrica: prefijo griego óxido de nº de átomos de oxígeno prefijo griego nº de átomos del no metal Fórmula Tradicional Br2O Anhídrido Hipobromoso Br2O3 Anhídrido Bromoso Br2O5 Anhídrido Brómico Anhídrido Perbrómico Anhídrido Hiposelenioso Br2O7 SeO (nombre del no metal sin variar) SeO2 Anhídrido Selenioso SeO3 Anhídrido Selénico CO2 Anhídrido Carbónico N2O Anhídrido Hiponitroso N2O3 Anhídrido Nitroso N2O5 Anhídrido Nítrico TeO2 Anhídrido Teluroso Nomenclatura Stock Óxido de Bromo (I) Óxido de Bromo (III) Óxido de Bromo (V) Óxido de Bromo (VII) Óxido de Selenio (II) Óxido de Selenio (IV) Óxido de Selenio (VI) Óxido de Carbono (IV) Óxido de Nitrógeno (I) Óxido de Nitrógeno (III) Óxido de Nitrógeno (V) Óxido de Teluro (IV) Estequiométrica Óxido de dibromo Trióxido de dibromo Pentaóxido de dibromo Heptaóxido de dibromo Óxido de Selenio Dióxido de Selenio Trióxido de Selenio Dióxido de Carbono Óxido de dinitrógeno Trióxido de dinitrógeno Pentaóxido de dinitrógeno Dióxido de Teluro 7 Sales binarias Sales binarias de no metal con metal no metal + metal sal neutra. Su fórmula es MxXy donde x e y son las valencias intercambiadas entre el metal y el no metal (su valencia negativa en valor absoluto), simplificadas a ser posible. Nomenclatura tradicional: - oso (menor valencia) Nombre del no metal terminado en -uro Nombre del metal terminado en - ico (mayor valencia) Nomenclatura de Stock: Nombre del no metal terminado en -uro de Nombre del metal ( ) (sin variar) valencia del metal si tiene más de una en números romanos Nomenclatura Estequiométrica: (prefijo nº Nombre del no (prefijo nº de -uro de de átomos) metal terminado en átomos) Fórmula LiF CaF2 AlCl3 CuBr2 MnS CaTe KI FeCl2 NiS K2Se PtF2 Tradicional Nomenclatura Stock Nombre del metal Estequiométrica Fluoruro Lítico Fluoruro de Litio Fluoruro de Litio Fluoruro Cálcico Fluoruro de Calcio Difluoruro de Calcio Cloruro Tricloruro de Cloruro de Aluminio Alumínico Aluminio Bromuro Cúprico Bromuro de Cobre(II) Dibromuro de Cobre Sulfuro Sulfuro de Sulfuro de Manganeso Manganoso Manganeso(II) Telururo Cálcico Telururo de Calcio Telururo de Calcio Yoduro Potásico Yoduro de Potasio Yoduro de Potasio Cloruro Ferroso Cloruro de Hierro(II) Dicloruro de Hierro Sulfuro Niqueloso Sulfuro de Níquel(II) Sulfuro de Níquel Seleniuro Seleniuro de Potasio Seleniuro de Dipotasio Potásico Fluoruro Fluoruro de Platino(II) Difluoruro de Platino Platinoso 8 Sales binarias de no metal con no metal (volátiles) no metal + no metal sal volátil Su fórmula es MxXy donde x e y son las valencias intercambiadas entre los no metales, simplificadas a ser posible. Se coloca en primer lugar el no metal menos electronegativo. Se nombran igual que las anteriores, añadiendo la terminación -uro a la raíz del elemento más electronegativo. Nomenclatura de Stock: Nombre del no metal más electronegativo terminado en -uro de Nombre del no metal menos electronegativo ( ) (sin variar) valencia del no metal menos electronegativo si tiene más de una en números romanos Nomenclatura Estequiométrica: (prefijo Nombre del no metal (prefijo nº de Nombre del no metal nº de más electronegativo -uro de átomos) menos electronegativo átomos) terminado en Ejemplos: Nomenclatura Estequiométrica Fórmula Stock BrF3 BrCl SeI2 CCl4 CS2 BrF5 B2S3 Fluoruro de Bromo (III) Cloruro de Bromo(I) Yoduro de Selenio (II) Cloruro de Carbono (IV) Sulfuro de Carbono (IV) Fluoruro de Bromo (V) Sulfuro de Boro (III) Trifluoruro de Bromo Cloruro de Bromo Diyoduro de Selenio Tetracloruro de Carbono Disulfuro de Carbono Pentafluoruro de Bromo Trisulfuro de Diboro 9 Hidróxidos Óxidos básicos + Agua Hidróxidos Su fórmula es M(OH)m donde m es la valencia del metal. El ion OH- es un ion diatómico denominado hidróxido de carga global -1. Nomenclatura tradicional: - oso (valencia menor) (nombre del metal terminado en) hidróxido - ico (valencia mayor) y si el elemento tiene una sola valencia, también se puede nombrar: hidróxido de nombre del metal sin variar Nomenclatura de Stock: hidróxido de (nombre del metal sin variar) ( ) (valencia del metal en números romanos siempre que tenga más de una) (nombre genérico) Nomenclatura Estequiométrica: prefijo griego Ejemplos: Fórmula Fe(OH)2 NaOH Al(OH)3 Hg(OH)2 KOH Pb(OH)4 Be(OH)2 hidróxido de Tradicional nombre del metal sin variar Nomenclatura Stock Estequiométrica Hidróxido de Dihidróxido de Hierro Hierro(II) Hidróxido Sódico Hidróxido de Sodio Hidróxido de Sodio Hidróxido Hidróxido de Trihidróxido de Alumínico Aluminio Aluminio Hidróxido Hidróxido de Dihidróxido de Mercúrico Mercurio(II) Mercurio Hidróxido Potásico Hidróxido de Potasio Hidróxido de Potasio Hidróxido de Tetrahidróxido de Hidróxido Plúmbico Plomo(IV) Plomo Hidróxido Berílico Hidróxido de Berilio Dihidróxido de Berilio Hidróxido Ferroso 10 Zn(OH)2 Hidróxido Cinquico Hidróxido de Cinc CuOH Hidróxido Cuproso Hidróxido de Cobre(I) Hidróxido de Co(OH)3 Hidróxido Cobáltico Cobalto(III) Ba(OH)2 Hidróxido Bárico Hidróxido de Bario AuOH Hidróxido Auroso Hidróxido de Oro(I) Hidróxido de Pt(OH)4 Hidróxido Platínico Platino(IV) Ca(OH)2 Hidróxido Cálcico Hidróxido de Calcio Au(OH)3 Hidróxido Aúrico Hidróxido de Oro(III) Hidróxido Hidróxido de Pb(OH)2 Plumboso Plomo(II) AgOH Hidróxido argéntico Hidróxido de Plata Dihidróxido de Cinc Hidróxido de Cobre Trihidróxido de Cobalto Dihidróxido de Bario Hidróxido de Oro Tetrahidrido de Platino Dihidróxido de Calcio Trihidróxido de Oro Dihidróxido de Plomo Hidróxido de Plata Oxácidos (generalidades) Son compuestos con propiedades ácidas, formados por la combinación de Hidrógeno, Oxígeno y un no metal, aunque a veces puede ser también un metal que se encuentra en un estado de oxidación elevado (valencia muy alta, es decir, Cr con v=6, Mn con v=7 y Bi con v=5): óxidos ácidos (anhídridos) + agua ácidos oxoácidos La fórmula de un ácido oxoácido la podemos obtener a partir del anhídrido correspondiente, sumándole una molécula de agua. Su fórmula general es HxXyOz donde X representa, en la mayoría de los casos, un no metal. La IUPAC admite la nomenclatura funcional de estos compuestos. Nomenclatura tradicional: -ico Ácido (prefijo) (nombre del no metal terminado en) -oso Nomenclatura de Stock: El nombre genérico funcional es ácido, especificando el número de oxígenos con los prefijos griegos conocidos y el del elemento no metálico terminado siempre en -ico, indicando la valencia del átomo central según la notación de Stock (entre paréntesis y en números romanos en el caso de que el no metal tenga más de una valencia). 11 Nomenclatura Estequiométrica: Se considera a los oxoácidos como compuestos binarios constituidos por un anión poliatómico, que se nombra con el sufijo -ato seguido de la notación de Stock de la valencia del elemento no metálico, y la terminación de hidrógeno. Nomenclatura Stock Estequiométrica Fórmula Tradicional HClO Ác Hipocloroso Ácido Oxoclórico(I) Oxoclorato(I) de Hidrógeno HClO2 Ácido Cloroso Ácido Dioxoclórico(III) Dioxoclorato(III) de Hidrógeno HClO3 Ácido Clórico Ácido Trioxoclórico(V) Trioxoclorato(V) de Hidrógeno HClO4 Ác Perclórico Ác Tetraoxoclórico(VII) Tetraoxoclorato(VII)de Hidrógeno H2SO3 Ácido Sulfuroso Ácido Trioxosulfúrico(IV) Trioxosulfato(IV) de Hidrógeno H2SO4 Ácido Sulfúrico Ác Tetraoxosulfúrico(VI) Tetraoxosulfato(VI) de Hidrógeno H2CO3 Ácido Carbónico Ácido Trioxocarbónico(IV) Trioxocarbonato(IV) de Hidrógeno H2CO2 Ácido Carbonoso Ácido Dioxocarbónico(II) Dioxocarbonato(II) de Hidrógeno HNO3 Ácido Nítrico Ácido Trioxonítrico(V) Trioxonitrato(V) de Hidrógeno HNO2 Ácido Nitroso Ácido Dioxonítrico(III) Dioxonitrato(III) de Hidrógeno H2CrO4 Ácido Crómico Ác Tetraoxocrómico(VI) Tetraoxocromato(VI) de Hidrógeno Casos especiales Hay elementos a los que también se les puede sumar 2 ó 3 moléculas de agua al óxido. En algunos casos pueden reaccionar 2 moléculas de óxido con una de agua. Para todos ellos la nomenclatura de Stock y la estequiométrica no varían, pero la nomenclatura funcional pone un prefijo para indicar el número de moléculas de agua que se le han añadido al óxido. Dichos prefijos quedan reflejados en la siguiente tabla: META PIRO ORTO ELEMENTOS Valencia impar 1, 3, 5 1 de óxido + 1 de agua 1 de óxido + 2 de agua 1 de óxido + 3 de agua P, As, Sb Valencia par 2, 4, 6 1 de óxido + 1 de agua 2 de óxido + 1 de agua 1 de óxido + 2 de agua S, Se, Te en las situaciones de las celdas sombreadas de la tabla, el prefijo se suele suprimir. 12 Desarrollo y fórmula del ácido P2O5 Nombre en la Nom. Funcional P2O3 + 2 H2O H4P2O5 Ac. Pirofosforoso + 3 H2O H6P2O8 H3PO4 Ac. Ortofosfórico o Fosfórico SO3 + 1 H2O H2SO4 Ac. Metasulfúrico o Sulfúrico 2 SO2 + 1 H2O H2S2O5 Ac. Pirosulfuroso Como hemos comentado anteriormente, en los elementos con valencia impar, el prefijo orto se suele suprimir por ser el más estable y en los elementos con valencia par, es el prefijo meta el que se suprime como hemos podido ver en los ejemplos anteriores. Aquí tienes más ejemplos sin desarrollar: Nomenclatura Stock Fórmula Tradicional Estequiométrica HPO Ac. Metahipofosforoso Ac. Oxofosfórico(I) Oxofosfato(I) de Hidrógeno HPO2 Ac. Metafosforoso Ac. Dioxofosfórico(III) Dioxofosfato(III) de Hidrógeno HPO3 Ac. Metafosfórico Ac. Trioxofosfórico(V) Trioxofosfato(V) de Hidrógeno H4P2O3 Ac. Pirohipofosforoso Ac. Trioxodifosfórico(I) Trioxodifosfato(I) de Hidrógeno H4P2O5 Ac. Pirofosforoso Ac. Pentaoxodifosfórico (III) Pentaoxodifosfato(III) de Hidrógeno H4P2O7 Ac. Pirofosfórico Ac. Heptaoxofosfórico(V) Heptaoxodifosfato(V) de Hidrógeno H4P2O3 Ac. Pirohipofosforoso Ac. Trioxodifosfórico(I) Trioxodifosfato(I) de Hidrógeno H3PO2 Ac. Ortohipofosforoso o Hipofosforoso Ac. Dioxofosfórico(I) Dioxofosfato(I) de Hidrógeno H3PO3 Ac. Ortofosforoso o Fosforoso Ac. Trioxofosfórico(III) Trioxofosfato(III) de Hidrógeno H3PO4 Ac. Ortofosfórico o Fosfórico Ac. Tetraoxofosfórico(V) Tetraoxofosfato(V) de Hidrógeno H2SO2 Ac. Metahiposulfuroso o hiposulfuroso H2SO3 Ac. Metasulfuroso o Sulfuroso Ac. Trioxosulfúrico(IV) Trioxosulfato(IV) de Hidrógeno H2SO4 Ac. Metasulfúrico o Sulfúrico Ac. Tetraoxosulfúrico(VI) Tetraoxosulfato(VI) de Hidrógeno H2S2O3 Ac. Pirohiposulfuroso Ac. Trioxodisulfúrico(II) Trioxodisulfato(II) de Hidrógeno H2S2O5 Ac. Pirosulfuroso Ac. Pentaoxodisulfúrico(IV) Pentaoxodisulfato(IV) de Hidrógeno H2S2O7 Ac. Pirosulfúrico Ac. Heptaoxodisulfúrico(VI) Heptaoxodisulfato(VI) de Hidrógeno H4SO3 Ac. Ortohiposulfuroso Ac. Trioxosulfúrico(II) Trioxosulfato(II) de Hidrógeno H4SO4 Ac. Ortosulfuroso Ac. Tetraoxosulfúrico(IV) Tetraoxosulfato(IV) de Hidrógeno H4SO5 Ac. Ortosulfúrico Ac. Pentaoxosulfúrico(VI) Pentaoxosulfato(VI) de Hidrógeno Ac. Dioxosulfúrico(II) Dioxosulfato(II) de Hidrógeno 13 Aniones derivados de los Oxácidos Fórmula: Para formular un ion derivado de un oxoácido se escribe en primer lugar el símbolo del Hidrógeno si queda, después el no metal y por fin el Oxígeno, acompañados de sus subíndices correspondientes. A todo el conjunto se le asigna una carga negativa igual al número de hidrógenos perdidos. Nomenclatura tradicional: El nombre específico del ácido se modifica en su prefijo de la siguiente forma: Sufijo del ácido Sufijo del anión - oso - ico - ito - ato en el caso de que haya perdido todos los hidrógenos disociables. Nomenclatura Sistemática: Se nombran con el sufijo ato seguido de la notación de Stock de la valencia del elemento no metálico. Ejemplos: Nombre del ácido Fórmula Fórmula ácido anión Ac. Sulfuroso H2SO3 SO3-2 Ac. Fosfórico H3PO4 PO4-3 HIO IO- HPO2 PO2- Ac. Silícico H2SiO3 SiO3-2 Ac. Pirofosfórico H4P2O7 P2O7-4 Ac. Hipoyodoso Ac. Metafosforoso Nomenclatura Tradicional ion o anión Sulfito ion o anión Fosfato ion o anión Hipoyodito ion o anión Metafosfito ion o anión Silicato ion o anión Pirofosfato Nomenclatura sistemática ion o anión Trioxosulfato(IV) ion o anión Tetraoxofosfato(V) ion o anión Oxoyodato(I) ion o anión Dioxofosfato(III) ion o anión Trioxosilicato(IV) ion o anión Heptaoxodifosfato(V) 14 Sales Las sales son compuestos que resultan de sustituir todos o parte de los hidrógenos de un ácido por un metal. Hay dos tipos de sales atendiendo al tipo de ácido del que provienen y a si se han sustituido todos los hidrógenos del ácido o no. Estos tipos de sales son: 1. Sales ternarias: Resultan de sustituir todos los hidrógenos de un oxoácido por metal. 2. Sales ácidas: Resultan de sustituir sólo parte de los hidrógenos de cualquiera de los dos tipos de ácidos por metal. Sales ternarias Resultan de la sustitución de todos los hidrógenos de un oxoácido por un metal. oxoácido + hidróxido sal neutra + agua Su fórmula es Mx(XyOz)w , es decir, se escribe primero el catión y luego el anión y se intercambian las cargas que se simplifican de ser posible. Nomenclatura tradicional: Se cambia la terminación -oso del ácido por -ito, y la terminación -ico por -ato (al igual que los aniones derivados de los oxoácidos). Se escribe el nombre del anión y se añade detrás el del catión. Nomenclatura Sistemática: Se nombran con el sufijo -ato seguido de la notación de Stock de la valencia del elemento no metálico, y el catión correspondiente. Ejemplos: Nomenclaturas Fórmula Tradicional Sistemática NaClO NaClO2 NaClO3 NaClO4 K2SO3 K2SO4 KNO2 KNO3 CaSO4 Li2CO3 Hipoclorito sódico Clorito sódico Clorato sódico Perclorato sódico Sulfito potásico Sulfato potásico Nitrito potásico Nitrato potásico Sulfato cálcico Carbonato de Litio Oxoclorato (I) de Sodio Dioxoclorato (III) de Sodio Trioxoclorato (V) de Sodio Tetraoxoclorato (VII) de Sodio Trioxosulfato (IV) de Potasio Tetraoxosulfato (VI) de Potasio Dioxonitrato (III) de Potasio Trioxonitrato (V) de Potasio Tetraoxosulfato (VI) de Calcio Trioxocarbonato (IV) de Litio 15 Ca(IO3)2 Al2(SO4)3 Ca3(PO4)2 Ca(PO2)2 PbCO3 Cu(NO3)2 Na3AsO4 Rb4As2O5 Fe4(P2O7)3 Be3(PO3)2 Yodato de Calcio Sulfato alumínico Fosfato de Calcio Metafosfito de Calcio Carbonato plumboso Nitrato cúprico Arseniato de Sodio Piroarsenito de Rubidio Pirofosfato férrico Fosfito de Berilio Trioxoyodato (V) de Calcio Tetraoxosulfato (VI) de Aluminio Tetraoxofosfato (V) de Calcio Dioxofosfato (III) de Calcio Trioxocarbonato (IV) de Plomo (II) Trioxonitrato (V) de Cobre (II) Tetraoxoarseniato (V) de Sodio Pentaoxodiarseniato (III) de Rubidio Heptaoxodifosfato (V) de Hierro (III) Trioxofosfato (III) de Berilio Sales ácidas Son las que resultan de sustituir parte de los hidrógenos de los ácidos que tienen más de uno. Nomenclatura tradicional: Se nombran anteponiendo los prefijos bi-, dibi-, tribi-, etc. según el número de hidrógenos no sustituidos, al nombre de la sal tal y como sería si se hubiesen sustituido todos los hidrógenos. Nomenclatura Sistemática: Se designan anteponiendo al nombre del anión de la sal neutra correspondiente la palabra hidrógeno, indicando con los prefijos mono, (se omite), di, tri, etc., el número de átomos de Hidrógeno substituibles presentes en la sal. La palabra hidrógeno suele unirse directamente al nombre del anión. Ejemplos: Nomenclaturas Fórmula Tradicional NaHSO4 Bisulfato sódico K2HPO4 Bifosfato potásico KH2PO4 Dibifosfato potásico NaHCO3 Bicarbonato sódico Cr(HSO3)3 Bisulfito crómico Ba3(HP2O7)2 Bipirofosfato bárico Sistemática Hidrógenotetraoxosulfato(VI) de Sodio Hidrógenotetraoxofosfato(V) de Potasio Dihidrógenotetraoxofosfato(V) de Potasio Hidrógenotrioxocarbonato(IV) de Sodio Hidrógenotrioxosulfato(IV) de Cromo(III) Hidrógenoheptaoxodifosfato(V) de Bario 16 Al(HSO4)3 Bisulfato alumínico Ni(HSiO3)3 Bisilicato niquélico Ca(HS)2 Cd(HS)2 NaHSe Bisulfuro cálcico Bisulfuro de Cadmio Biseleniuro sódico Hidrógenotetraoxosulfato(VI) de Aluminio Hidrógenotrioxosilicato(IV) de Níquel(III) Hidrógenosulfuro de Calcio Hidrógenosulfuro de Cadmio Hidrógenoseleniuro de Sodio Sales amónicas Este tipo de sales llevan como catión el ion amonio NH4+. Algunos ejemplos de este tipo de sales se reflejan en la siguiente tabla: Nomenclaturas Fórmula Tradicional Sistemática NH4Cl (NH4)2S NH4NO3 (NH4)2SO4 (NH4)2SO3 (NH4)3PO4 Cloruro amónico Sulfuro amónico Nitrato amónico Sulfato amónico Sulfito amónico Fosfato amónico Cloruro de amonio Sulfuro de amonio Trioxonitrato (V) de amonio Tetraoxosulfato (VI) de amonio Trioxosulfato (IV) de amonio Tetraoxofosfato (V) de amonio Compuestos especiales En el nivel elemental de la Química son necesarios los nombres y las fórmulas de muchos compuestos de difícil sistematización. Su uso es constante en la teoría y en el laboratorio. En las tablas siguientes se describen los más importantes: a) Cianuros: Nomenclaturas Fórmula Tradicional Sistemática HCN Mg(CN)2 Au(CN)2 NH4CN Ácido cianhídrico Cianuro magnésico Cianuro auroso Cianuro amónico Cianuro de hidrógeno Cianuro de magnesio Cianuro de Oro (II) Cianuro de amonio 17 b) Tiosulfatos: Nomenclaturas Fórmula Funcional Sistemática H2S2O3 K2S2O3 BaS2O3 NaHS2O3 Ácido Tiosulfúrico Tiosulfato potásico Tiosulfato bárico Bitiosulfato sódico Trioxodisulfato (II) de Hidrógeno Trioxodisulfato (II) de Potasio Trioxodisulfato (II) de Bario Hidrógenotrioxodisulfato (II) de Sodio c) Dicromatos: Nomenclaturas Fórmula Funcional Sistemática H2Cr2O7 BaCr2O7 K2Cr2O7 Ácido dicrómico Dicromato bárico Dicromato potásico NaHCr2O7 Bidicromato sódico Heptaoxodicromato (VI) de Hidrógeno Heptaoxodicromato (VI) de Bario Heptaoxodicromato (VI) de Potasio Hidrógenoheptaoxodicromato(VI) de sodio 18









