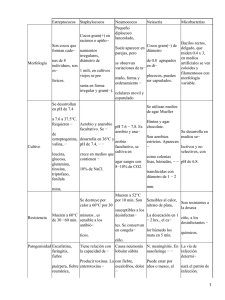
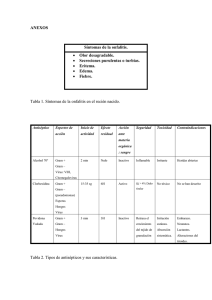
Apuntes de Laboratorio - Laboratorios Britania
Anuncio

Apuntes de Laboratorio 2 DIAGNOSTICO MICROBIOLOGICO DE LAS INFECCIONES RESPIRATORIAS BACTERIANAS Horacio Lopardo Claudia Hernández Rolando Soloaga 1999 LABORATORIOS BRITANIA s.a. Los Patos 2175 C.P. (1283) Buenos Aires - Argentina Fax 0054-11-4304-1623 Tel.Fax 0054-11-4306-0041 email: [email protected] Comité Editor Carlos Bantar Carlos A. Guardiano Horacio Lopardo Editor Responsable Ronaldo J. L. Meda Propietario Lab. Britania s.a. Diagramación y Diseño Top Laser S.R.L. Todos los derechos reservados. Prohibida la reproducción total o parcial sin autorización previa del editor. Registro de la Propiedad Intelectual Nº 744.351 DIAGNOSTICO MICROBIOLOGICO DE LAS INFECCIONES RESPIRATORIAS BACTERIANAS Horacio Lopardo: Doctor en Ciencias Bioquímicas. Bioquímico Principal del Laboratorio de Microbiología. Hospital de Pediatría SAMIC " Prof Dr J. P. Garrahan", Buenos Aires. Profesor Titular de Bacteriología Clínica. Facultad de Ciencias Exactas. Universidad Nacional de La Plata Claudia Hernández, Bioquímica. Bioquímica Asistente del Laboratorio de Microbiología. Hospital de Pediatría SAMIC " Prof Dr J. P. Garrahan", Buenos Aires Rolando Soloaga, Bioquímico. Microbiólogo de la Fundación Favaloro, Profesor Pro-titular de la Maestría en Microbiología Clínica, Universidad Católica Argentina. Profesor Asociado de la Cátedra de Microbiología. Carrera de Medicina. Universidad del Salvador INTRODUCCION GENERAL Dentro de las infecciones que afectan al género humano, las que ocurren en el tracto respiratorio son las más frecuentes y por ende, las que originan el mayor número de consultas médicas. Aún haciendo abstracción de las de origen viral, que escapan al alcance de esta publicación, las infecciones respiratorias (IR) constituyen un motivo de frecuente preocupación dentro del equipo de salud. En especial, las complicaciones y gastos generados por las IR altas y la elevada morbimortalidad de las localizadas en el tracto respiratorio inferior,son objeto de numerosas publicaciones en revistas de la especialidad. En este fascículo trataremos de describir críticamente los métodos empleados para realizar el diagnóstico microbiológico de las IR. Las dificultades , como se sabe, derivan de que las vías aéreas superiores, al ser un punto de contacto entre el ser humano y el ambiente exterior, están fuertemente colonizadas con una flora conformada por más de 200 especies. Esto conspira contra una toma de muestra libre de agentes contaminantes, más aún teniendo en cuenta que algunos de los colonizantes, en ciertas oportunidades podrían transformarse en agentes etiológicos de algunas de estas infecciones. De esta manera, los métodos empleados no dan resultados de certeza, sino que casi siempre arrojan datos indicadores de mayor o menor probabilidad de que el o los microorganismos aislados sean los verdaderos causantes de las IR. INFECCIONES RESPIRAT ORIAS ALTAS El tracto respiratorio superior está conformado por la naso y la orofaringe, las que se encuen- tran conectadas a los senos paranasales y el oído medio. De este modo, en esta sección consideraremos el diagnóstico microbiológico de las faringitis, otitis y sinusitis. FARINGITIS Aproximadamente un 70-80% de las faringoamigdalitis (sindrome inflamatorio faríngeo) son de etiología viral y por su carácter autolimitado no requieren normalmente del estudio microbiológico. El 20-30% restante es de origen bacteriano y en su gran mayoría son producidas por S. pyogenes. También éstas generalmente curan sin necesidad de tratamiento. Sin embargo, debido a las posibles complicaciones supurativas y no supurativas es esencial su diagnóstico preciso y su tratamiento. Lamentablemente, excepto en algunos casos típicos de escarlatina, el diagnóstico basado sólo en parámetros clínicos no es confiable y debe recurrirse al estudio microbiológico. Habitualmente el objetivo del cultivo de un exudado de fauces es la búsqueda de estreptococos ß-hemolíticos del grupo A. No obstante, los pertenecientes a los grupos C y G de Lancefield (colonia grande) son capaces de producir cuadros similares y algunas de las complicaciones que origina S. pyogenes. Si bien es aún controvertido su rol en la faringitis, la tendencia actual es identificarlos para diferenciarlos de cepas ß-hemolíticas de estreptococos del grupo "milleri". Estas pueden aglutinar con antisueros C y G aunque más frecuentemente lo hacen con antisueros F. Constituyen además la mayoría de las cepas no serotipificables dentro de los estreptococos ß-hemolíticos y se han detectado muy pocas cepas que pueden dar aglutinación cruzada con estreptococos del grupo A. Los estreptococos ß-hemolíticos del grupo "milleri" pertenecen BRITANIA 1 a la flora habitual de las vías aéreas superiores y hasta el momento no ha sido demostrada su participación en las faringoamigdalitis. Otros agentes etiológicos de faringitis poco frecuentes en nuestros tiempos son Arcanobacterium haemolyticum, Corynebacteriun diphteriae, Neisseria gonorrhoeae, hongos levaduriformes y la asociación fusoespirilar responsable de la angina de Vincent. En este fascículo sólo consideraremos al primero de ellos pues los otros microorganismos son responsables de entidades clínicas claramente definidas por síntomas y signos y/o por pautas epidemiológicas. De este modo la solicitud del estudio queda claramente dirigida y representa un abordaje diferente al rutinario por parte del microbiólogo. No obstante ellos son considerados en los algoritmos de trabajo. Para mayores precisiones sugerimos dirigirse a la bibliografía citada. ficie de 3 x 2 cm , cercana al borde de la placa. Con el ansa se disemina en forma de tres o cuatro estrías cruzadas y se realizan otras estrías en profundidad en la zona cercana al punto de siembra. c) EXAMEN MICROSCOPICO DIRECTO: Sólo se justifica en casos de diagnóstico presuntivo de candidiasis orofaríngea, Angina de Vincent o difteria. La coloración de Gram en forma rutinaria no debe realizarse pues puede llevar a confusiones. d) INCUBACION: La incubación debe realizarse a 35°C en atmósfera normal. Aparentemente una incubación en atmósfera enriquecida en CO2 no aportaría demasiado ni resultaría perjudicial. La incubación debe prolongarse 48 horas en caso de que a las 24 no hubiera desarrollo de estreptococos ß-hemolíticos 1) FARINGITIS ESTREPTOCOCICA a) TOMA DE MUESTRA: Se coloca la cabeza del paciente en hiperextensión y se iluminan las fauces en forma conveniente. Con hisopo estéril se frotan ambas amígdalas (o ambos pilares en pacientes amigdalectomizados) . Si existiera un exudado visible se debería tratar de tocarlo con la punta del hisopo. En cualquier caso se deberá evitar el contacto del hisopo con el paladar o la lengua, es por ello que resulta imprescindible ayudarse con un bajalenguas. El hisopo se deberá colocar en un tubo con gotas de solución fisiológica estéril o con medio de transporte (Cary Blair , Stuart o similar). Como alternativa recomendada sólo ante una emergencia se puede conservar seco en un tubo de ensayo estéril. El hisopo seco puede conservar la viabilidad de los estreptococos ß-hemolíticos en un alto porcentaje de casos. La conservación de estas muestras se deberá efectuar a temperatura ambiente durante el menor tiempo posible. b) SIEMBRA: Se utiliza una placa entera de agar tripteína de soya o agar Columbia adicionada de 5% de sangre ovina. Si la siembra se realiza con cuidado, puede utilizarse media placa para cada muestra. Se frota el hisopo en una super- e) RESULTADOS: El diagnóstico etiológico de la faringitis estreptocócica depende fundamentalmente de la observación de hemólisis en agar sangre de oveja. Las colonias ß-hemolíticas se estudian independientemente del número de ellas presentes en la placa. Las faringitis ya sea sintomáticas o subclínicas con frecuencia producen cultivos con recuentos muy altos de estreptococos ß-hemolíticos. Lo contrario sucede en cultivos faríngeos de portadores sanos. Sin embargo, estas apreciaciones no son consistentes, de modo que la cuantificación no permite discriminar en forma confiable la portación de la infección. Se deberá informar entonces sólo la presencia o la ausencia de estreptococos ß-hemolíticos. f) IDENTIFICACION DE LOS ESTREPTOCOCOS AISLADOS: Las colonias beta-hemolíticas deben ser identificadas según técnicas convencionales: coloración de Gram, pruebas de catalasa, bacitracina y PYR. Eventualmente y ante casos dudosos (ver esquema) o para trabajos epidemiológicos se puede completar la identificación con pruebas serológicas (látex, coaglutinación) , Voges-Proskauer, glucuronidasa y fermentación de azúcares. (ver tablas 1 y 2). BRITANIA 2 TABLA 1 IDENTIFICACION DE ESTREPTOCOCOS BETA-HEMOLITICOS SEROGRUPO ESPECIE BAC PYR VP GLU A S. pyogenes S. grupo milleri S R (s) + - + + B S. agalactiae R - - - C S. dysgalactiae ss. equisimilis S. equi ss. equi S. equi ss. zooepidemicus S. grupo milleri R (s) R (s) R (s) R (s) - + + G S. dysgalactiae ss. equisimilis S. grupo milleri R (s) R (s) - + + F S. grupo milleri R (s) - + + No agrupables S. grupo milleri R (s) - + + BAC= bacitracina, PYR= pirrolidonilarilamidasa, VP= Voges-Proskauer, GLU= Glucuronidasa TABLA 2 IDENTIFICACION DE LOS ESTREPTOCOCOS DEL GRUPO C (COLONIA GRANDE) ESPECIE THEHALOSA SORBITOL S. dysgalactiae ss. equisimilis S. equi ss. equi S. equi ss. zooepidemicus + - + BRITANIA 3 Algoritmo del procesamiento del exudado de fauces. EVALUACIÓN CLÍNICO/EPIDEMIOLÓGICA A B C Sospecha de Angina de Vincent* Sospecha de Candidiasis orofaríngea* Sospecha de Difteria** Hisopado de la úlcera Hisopado de los exudados blanquecinos Toma de muestra: tomar parte de la seudomembrana con pinza o instrumento "ad hoc". Si no se pudiera arrancar la seudomembrana, tomar un hisopado faríngeo y otro nasofaríngeo. Transporte: en solución fisiológica. Extendidos Coloraciones de Gram y azul de metileno (30 seg.) Observar la presencia de asociación fusoespirilar Exámen en fresco con o sin el agregado de HOK al 20% Cultivo Hisopado o muestra de seudomembrana Agar Sabouraud con o sin antibióticos Observar la presencia de células levaduriformes con o sin seudomicelios Desarrollo de hongos levaduriformes Identificación a nivel de especie (ver tratado de especialidad) Coloración de Gram Coloración de azul de metileno Bacilos gram + difteromorfos dispuestos en V, letras chinas y/o empalizada Observación de gránulos metacromáticos Cultivo A/sangre (procesar como en D) Agar sangre con cistina y telurito (ASCT) Medio de Loeffler 2 hs (sin valor diagnóstico) *** GRUPO VOGES-PROSKAUER A - Repetir PYR y BAC A + S. milleri (colonia chica)(no significativo) G - S. dysgalactiae ss. equisimilis (col.grande) G + S. milleri (col. chica) (no significativo) C - S. dysgalactiae ss. equi o S. dysgalactiae ss. zooepidemicus S. dysgalactiae ss. equisimilis (col.grande) C + S. milleri (col. chica) (no significativo) B - S. agalactiae (no significativo) F + S. milleri (col. chica) (no significativo) No aglutinable + S. milleri (col. chica) (no significativo) No aglutinable - Enviar a centro de referencia 18 hs Extendidos pase a ASCT Gram y Azul de metileno RESULTADO BRITANIA 4 Incubar 24-48 hs Informe preliminar Colonias negro-grisáceas Gram: bacilos gram + pleomórficos catalasa positivos Coloración de azul de metileno Pruebas bioquímicas Prueba de toxigenicidad (enviar a centro de referencia) D E Faringoamigdalitis con o sin rash cutáneo Sospecha de faringitis gonocócica ** Cultivo Coloración de Gram D1 A/S de oveja (búsqueda de estreptococos betahemolíticos) D2 A/S humana (búsqueda de Arcanobacterium haemolyticum) Incubar 48 hs a 35 Cº al aire (1º lectura a las 18-24 hs) Incubar 72 hs a 35ºC en 5-10% de CO2 (lecturas periódicas cada 24 hs) Observar la presencia de diplococos gram negativos intra o extracelulares (no tiene valor diagnóstico) ß-hemólisis No ß-hemólisis ß-hemólisis No ß-hemólisis Gram Flora orofaríngea habitual catalasa Flora crofaríngea habitual Cultivo A/choc. TM # o similar 72 hs en jarra c/vela o estufa con 10% de CO2 Coloración de gram de las colonias diplococos gram(-) Oxidasa Cocos gram + catalasa - Bacilos Gram + difteromorfos continuar como en C o D2 según el caso +-+ + Cocos Gram positivos Bacitracina PYR ++ Informar S. pyógenes Coloración de Gram -• Aglutinar • Voges-Proskauer *** Bacilos Gram positivos difteromorfos Se descarta Pruebas de oxidación de azúcares en medio base CTA, Nitratos (-) y DNAsa (-) (ver tratados de la especialidad) Glu+ Mal- Sac- Lac- Camp invertida + Arcanobacterium haemolyticum (confirmar con pruebas bioquímicas; ver tratados de la especialidad) Repetir ++ +-+ -- # TM= Thayer Martin. * No se recomienda efectuar esta búsqueda en forma rutinaria dado que al tratarse de microorganismos que son parte de la flora habitual orofaríngea, se corre el riesgo de sobrediagnosticar estas enfermedades. ** No se recomienda efectuar esta búsqueda en forma rutinaria por no ser costo-efectiva al tratarse de microorganismos excepcionalemente encontrados en pacientes sin factores de riesgo o clínica compatible. BRITANIA 5 PRUEBA DE LA BACITRACINA Con las colonias aisladas en el primocultivo se efectúan estrías superpuestas en tres sentidos, cubriendo una superficie aproximada de un cuarto de una placa de agar sangre. En el centro de esta superficie se coloca un disco de 0,04 U de bacitracina . Se deja incubar 18-24 horas a 35°C y se observa la formación o no de un halo de inhibición alrededor del disco. PRUEBA POSITIVA: producción de un halo de inhibición de cualquier diámetro PRUEBA NEGATIVA: ausencia de halo de inhibición PRECAUCIONES: i) Verificar que la cepa produzca beta-hemólisis en sangre ovina. ii) Verificar que se trate de un aislamiento puro. iii) Verificar que los discos contengan 0,04U pues hay discos con otras concentraciones . iv) Verificar que se logre un desarrollo confluente pues el uso de inóculos bajos puede dar lugar a la producción de resultados falsamente positivos. PRUEBA DE LA PIRROLIDONILARILAMIDASA (PYR) Sobre un portaobjetos o sobre la tapa de una placa de Petri se coloca un disco de PYR comercial. Se lo humedece y se lo frota con un palillo cargado con varias colonias del microorganismo a ensayar. Se le agrega una gota del reactivo revelador, se deja unos 5 minutos y se efectúa la lectura. PRUEBA NEGATIVA: disco incoloro PRUEBA POSITIVA: disco rojo Otras alternativas pueden encontrarse en la bibliografía o en los prospectos de los reactivos comerciales. g) METODOS RAPIDOS DE DIAGNOSTICO DE FARINGITIS POR ESTREPTOCOCOS BETA-HEMOLITICOS DEL GRUPO A Existen más de 40 productos comerciales destinados al diagnóstico rápido de la faringitis estreptocócica. Estos equipos emplean técnicas de extracción del antígeno específico de grupo y el posterior revelado por coaglutinación, aglutinación con partículas de látex o enzimoinmunoensayo. Los detalles de técnica deberán tomarse de los prospectos de cada uno de los equipos. La secuencia de operaciones es: 1) Toma de muestra para cultivo de exudado de fauces. 2) Repetir la toma utilizando uno de los hisopos provistos por el equipo. Si el equipo no incluyera hisopos deberá disponerse de un hisopo de dacrón pues libera mejor los antígenos al medio durante la extracción. 3) Extracción del antígeno (habitualmente por método enzimático). 4) Reacción de aglutinación o enzimoinmunoensayo. Si el resultado es positivo: informar Si el resultado es negativo: efectuar un cultivo convencional con el primer hisopo e informar de acuerdo a éste. NOTA: estos métodos resultan de utilidad cuando su sensibilidad es de alrededor del 90% y la comunicación médico-microbiólogo puede realizarse rápidamente h) PRUEBAS DE SENSIBILIDAD A LOS ANTIBIOTICOS PARA ESTREPTOCOCOS BETA-HEMOLITICOS AISLADOS DE FAUCES Aún no ha sido detectada la resistencia a penicilina o cefalosporinas de tercera generación en S. pyogenes por lo que no se considera necesario efectuar rutinariamente ningún tipo de ensayo que involucre a estas drogas. De todos modos, los puntos de corte para establecer su sensibilidad o resistencia fueron contemplados por la NCCLS tanto para difusión como para dilución. Por el contrario, el conocimiento de la sensibilidad a eritromicina y clindamicina ya es necesario dado que en muchos países y algunas regiones de la Argentina los niveles de resistencia a macrólidos se han elevado en forma considerable. Por otra parte el uso de nuevos macrólidos ha sufrido también un aumento importante. Por ello, para el caso de exudados de fauces se recomienda efectuar una prueba de sensibilidad de difusión en agar Mueller Hinton con sangre ovina al 5% utilizando discos de clindamicina y eritromicina separados 20 mm. De este modo se podrá apreciar el achatamiento del halo de clindamicina (mecanismo MLS inducible) o no (mecanismo de eflujo) cuando la cepa es de sensibilidad intermedia o resistente a eritromicina y sensible a clindamicina. En el primer caso se deberá informar como clindamicina resistente y en el segundo como clindamicina sensible. BRITANIA 6 2) BUSQUEDA DE ARCANOBACTERIUM HAEMOLYTICUM Esta bacteria es un agente reconocido de faringitis y se la aisla frecuentemente de exudados de fauces de adolescentes sintomáticos. Frecuentemente se acompaña de rash escarlatiniforme. Es sensible in vitro a la penicilina, pero este antibiótico suele fracasar en los tratamientos probablemente debido a la localización intracelular de estos microorganismos . Por ello el antibiótico de elección es la eritromicina u otro macrólido. Esta diferencia respecto de S. pyogenes aumenta el interés de su búsqueda en los exudados de fauces. Se trata de cocobacilos gram positivos que pueden aparecer arracimados, en V o con ramificaciones rudimentarias. Desarrollan producien- do hemólisis en sangre humana pero no tan evidente en sangre ovina. Su crecimiento se produce entre las 24 y 72 horas por lo que se sugiere incubar las placas hasta 3 días a 35°C en atmósfera con 5-10% de CO2 . Su identificación se basa en las siguientes pautas: dan negativas las pruebas de catalasa, movilidad, gelatinasa, ureasa, xilosa, manitol y esculina; dan positivas las pruebas de fermentación de glucosa y maltosa y las pruebas de reducción de nitratos y fermentación de sacarosa son variables. La prueba de CAMP se realiza del mismo modo como se efectúa para Streptococcus agalatiae. A diferencia de esta bacteria, en lugar de reforzar la hemólisis producida por la cepa ATCC 25923 de S. aureus, la anula. BIBLIOGRAFIA - Baron EJ, Peterson LR, Finegold SM. Bayley & Scott’s Diagnostic Microbiology. 9th ed. Mosby, St.Louis, EEUU, 1994. - Gerber MA. Diagnosis of group A streptococcal pharyngitis. Pediatr.Ann. 27: 269-273, 1998. - Gubbay L, Ellis A, Lopez Holtmann G, Galanternik L. Streptococcal pharyngitis in Argentina. Resumen XIIIth Lancefield Symposium on Streptococcus and Infectious Diseases , París, setiembre de 1996. - Horaud T, Bouvet A, Leclercq R, de Montclos H, Sicard M. Streptococci and the host. Plenum Press, New York, 1997. - Isenberg HD. Essential procedures for Clinical Microbiology. p.73-80 . ASM Press, Washington D.C., 1998. - Johnson DR, Kaplan EL, Sramek J, Bicova R, Havlicek J, Havlickova H, Motlova J, Kriz P. Laboratory diagnosis of group A streptococcal infections. World Health Organization, Geneva, 1996. - Kellog J. Suitability of throat cultures procedures for detection of group A streptococci and as reference standards for evaluation of streptococcal antigen detection kits. J.Clin.Microbiol. 28: 165169, 1992. - Lopardo HA, Hernández C, Morales G. Diagnóstico Microbiológico de infecciones respiratorias altas. Módulo del curso a distancia sobre Microbiología . Asociación Argentina de Microbiología y Colegio Bioquímico de Entre Ríos. 1998 - Mandell GL, Bennett JE, Dolin R. Principles and practice of infectious diseases. Churchill Livingstone, New York, 4th ed. 1995 - Romero J, Betriu C. Faringitis estreptocócica. Enferm.Infecc.Microbiol.Clín. 13: 611-627, 1995. - Ruoff K L. Streptococcus. En: Murray PR, Baron EJ, Pfaller MA, Tenover FC., Yolken RH (ed) Manual of Clinical Microbiology. p. 299-307, ASM Presss, Washington DC, 6th ed., 1995. BRITANIA 7 OTITIS MEDIA AGUDA La otitis media aguda ( OMA ) se define como un proceso inflamatorio de la mucosa de revestimiento de las cavidades que constituyen el oído medio, caja del tímpano, celdas mastoideas y membrana timpánica. La patogenia de la OMA es compleja y multifactorial. Las bacterias responsables de la OMA colonizan primero el epitelio nasofaríngeo y llegan luego al oído medio a través de las trompas de Eustaquio por aspiración o inyección directa al soplar, estornudar o bostezar. La infección ocurre cuando el inóculo alcanzado es grande o cuando los mecanismos de defensa específicos e inespecíficos están alterados. Diagnóstico microbiológico 1 ) Toma de muestra La única muestra válida para el estudio microbiológico es la punción del contenido del oído medio por tímpanocentesis. En este procedimiento se realiza una punción aspiración, con aguja, de la membrana timpánica para obtener material retenido en el oído medio. Es realizado por un otorrinolaringólogo o pediatra entrenado. Las indicaciones de tímpanocentesis son: a- OMA con retención de exudado en niños seriamente enfermos o con signos y síntomas tóxicos. b- Respuesta insatisfactoria al tratamiento antibiótico y persistencia del exudado. c- Otitis media con exudado en pacientes con síndrome meníngeo. d- Otitis media con exudado con complicaciones supurativas intrapetrosas o endocraneales. e- Otitis media con exudado en menores de tres meses, en huéspedes inmunocomprometidos y en cualquier caso que se sospeche de un microorganismo causal inusual. Técnica de la tímpanocentesis: el procedimiento puede ser realizado sin anestesia general, con adecuada inmovilización del paciente, bajo visión con otomicroscopio binocular. El instrumental utilizado ( cánulas de aspiración, espéculos óticos , etc. ) debe ser estéril. 1- La piel del conducto auditivo externo presenta microorganismos saprófitos como S. aureus y P. aeruginosa, por tal motivo es indispensable la limpieza del mismo con alcohol al 70 % boricado a saturación por más de un minuto (el alcohol crea un medio desfavorable para la proliferación bacteriana y el ácido bórico es bacteriostático para Pseudomonas). Se elimina el mismo mediante succión. 2- Punción timpánica con aguja Butterfly n° 19 a 23, sin alas, adosada a una jeringa de 5 cc. cargada con 1 cc. de solución fisiológica estéril. La punción de la membrana se realiza en el cuadrante posteroinferior ya que es la zona que presenta más declive y de esta manera se asegura el drenaje completo de la caja. 3- Aspiración de la efusión del oído medio. 4- Colocación del material en frascos de transporte adecuado para el cultivo. 5- Se envía inmediatamente al laboratorio de Microbiología. Posteriormente se indican los cuidados locales de todo tímpano que presenta perforación espontánea o provocada para evitar contaminación por gérmenes presentes en la piel del conducto. Esto consiste en a ) impedir la entrada de agua con tapón de algodón seco con una capa de vaselina sólida por fuera del mismo para impermeabilizarlo; b ) instilación de alcohol al 70 % boricado a saturación varias veces por día para limpieza de las cavidades del oído medio a través de la perforación y de la piel del conducto. 2 ) Medio de transporte El material puede ser enviado al laboratorio en la jeringa del procedimiento, en tubo seco o en frascos con atmósfera apropiada como el TAB (transporte anaeróbico) (Laboratorios Britania, Buenos Aires). Los dos primeros tienen el inconveniente de una mala preservación de los anaerobios, lo cual es importante en las OMA supuradas y en las OMC (otitis media crónica). El envío del material en la jeringa no cumple además con las normas de bioseguridad requeridas para el manipuleo de materiales biológicos. Por ésto, el medio de transporte ideal para este material es el frasco TAB. 3 ) Procesamiento Al material se le efectúa una coloración de Gram y se siembra en agar sangre , agar chocolate y caldo tioglicolato. Se incuba 48 hs. en atmósfera con un 5 % de CO2 (sistema de jarra y vela). BRITANIA 8 En el caso de OMA supurada y OMC se debe agregar medios de cultivo para el aislamiento de anaerobios como placas de agar sangre con vitamina K y caldo sellado con parafina . En el caso de pacientes HIV ( + ) con OMC se deben agregar medios para el estudio micológico como un tubo de agar Sabouraud. Si bien el tratamiento antibiótico previo inmediato o simultáneo disminuye la recuperación de los cultivos, el porcentaje de positividad en estos pacientes justifica su siembra. Pacientes con ATB. ______________________________ Positivos 71.7 % ______________________________ Negativos 28,3 % Positividad de los cultivos: La recuperación de microorganismos a partir de muestras obtenidas por timpanocentesis varía según la población incluída ( con o sin antibiótico, distintas edades, tipo de otitis: aguda, aguda supurada o crónica, tipo de huésped ) pero en general se encuentran entre un 60 – 85 %. En el Hospital Garrahan en el año 1998 se estudiaron 539 punciones de OMA provenientes de 444 pacientes y se obtuvieron los siguientes resultados Pacientes sin ATB. ______________________________ Positivos 87.6 % ______________________________ Negativos 12.4 % 4 ) Identificación bioquímica Pacientes 444 ______________________________ Los principales agentes etiológicos de las OMA son S. pneumoniae, H. influenzae, S. aureus, M. catarrhalis y estreptococos ß-hemolíticos del grupo A. Positivos 342 77 % ______________________________ Negativos 102 23 % Microorganismos aislados de OMA ( huésped normal ) Cultivos 539 ______________________________ Positivos 476 70 % ______________________________ Negativos 163 N° DE CEPAS 30 % En caso de tratarse de una otitis bilateral se debe cultivar el material obtenido de ambos oídos, ya que sólo el 64 % tendrán el mismo microorganismo. Por ejemplo, en el año 1998 se estudiaron 195 pacientes con OMA bilateral. CULTIVOS ______________________________ Pacientes 195 ______________________________ Iguales 64,6% ______________________________ Positivo/Negativo 12,8% ______________________________ Positivo/Positivo+otro 15,9% ______________________________ Distinto 6,7% BRITANIA 9 % ______________________________ S. pneumoniae 141 35.4 ______________________________ H. influenzae 194 48.6 ______________________________ M. catarrhalis 25 6.3 ______________________________ S. aureus 24 6 ______________________________ S. ß hemolítico (grupos A , C y G ) 8 2 ______________________________ P. aeruginosa 5 1.2 ______________________________ Candida sp. 2 0.5 ______________________________ Totales 399 100 A ) Streptococcus pneumoniae Los neumococos son diplococos gram positivos que pueden presentar cápsula o estar desprovistos de ella. Su forma más característica es lanceolada aunque también pueden formar cadenas cortas o estar aislados. En medios líquidos, la mayor parte de las cepas capsuladas presentan un crecimiento difuso, mientras que las no capsuladas muestran un crecimiento granular En agar sangre crecen presentando α hemólisis. Las cápsulas se observan cuando las colonias son tratadas con el anticuerpo específico de tipo, el cual, al combinarse con el polisacárido capsular, lo vuelven refráctil (reacción de Quellung). Los neumococos son gérmenes exigentes que generalmente requieren un medio enriquecido y una atmósfera de 5 % de CO2 para crecer. Se han diferenciado más de 75 tipos serológicos de neumococos, por la existencia de polisacáridos inmunológicamente diferentes en sus cápsulas. ta prueba controla la capacidad de las células bacterianas de producir lisis en presencia de sales biliares, en un tiempo y a una temperatura específica. Las sales biliares utilizadas son el desoxicolato de sodio o el taurocolato de sodio. Las sales biliares hacen descender la tensión superficial en la interfase medio-membrana, provocan una descomposición de la membrana celular y aceleran el proceso autolítico natural del neumococo activando las enzimas por combinación de las sales biliares con el neumococo. Método: Se prepara 1 ml de una suspensión densa en solución fisiológica de un cultivo puro. Se divide en dos partes iguales en tubos separados. A uno de ellos se le agregan 0,5 ml de una solución de desoxicolato de sodio al 10 % y al otro 0,5 ml de solución fisiológica. Se incuba hasta 3 hs y se observa cada 15 minutos. Interpretación: Positiva cuando se observa un aclaramiento del tubo con desoxicolato respecto al de solución fisiológica. Negativo, cuando no hay diferencia de turbidez entre ambos tubos. Diagnóstico de laboratorio: B ) Haemophilus influenzae I – Prueba de la optoquina: se usa el disco de optoquina para diferenciar entre S. pneumoniae (sensibles) y otras especies de estreptococos α hemolíticos (resistentes). La sensibilidad a la optoquina es una medida de la fragilidad de la membrana celular bacteriana. La optoquina, que es el clorhidrato de etilhidrocupreína, se utiliza en una dilución acuosa de 1 / 4000 para impregnar los discos, quedando en éstos 5 µg de la droga. Método: se toma una suspensión de colonias puras en caldo Mueller Hinton o tioglicolato y con un hisopo se estría una placa de agar sangre de carnero al 5 %. Sobre la estría se coloca el disco de optoquina. Se incuba con atmósfera de CO2 al 5 % ( jarra con vela ). durante 24 hs. a 35° C. Interpretación: Sensible, cuando hay inhibición alrededor del disco. Se considera como punto de corte 16 mm. (discos de 10 mm) o 14 mm (discos de 6 mm). Resistente, cuando el crecimiento no es inhibido alrededor del disco. Los casos de halos intermedios deben resolverse por acumulación de pruebas a favor o en contra. II – Prueba de la solubilidad en bilis: Se utiliza esta prueba para diferenciar entre S. pneumoniae, soluble, en bilis y otras especies de estreptococos alfa hemolíticos, “ insolubles ” en bilis. Es- Son bacilos pequeños gram negativos, inmóviles, no esporulados y pleomórficos, anaerobios facultativos que producen la energía ya sea por oxidación o por fermentación. Su crecimiento óptimo se obtiene incubando las placas en atmósfera de 5 % de CO2 a 35 – 37 ° C. Son bacterias fastidiosas y crecen solamente en medios enriquecidos (agar chocolate o agar chocolate suplementado) o con una fuente exógena de los nutrientes esenciales (satelitismo alrededor de una estría de S. aureus). Estos nutrientes esenciales son el factor V (NAD) y el factor X (hemina). Forman colonias pequeñas, translúcidas y ciertos biotipos presentan un olor característico por producción de indol a partir de triptofano. Estas bacterias pueden poseer cápsula (cepas serotipificables a, b, c, d, e, f) o no (cepas no serotipificables). Diagnóstico de laboratorio I – Requerimiento de los factores V y X: se basa en la necesidad de H. influenzae de requerir ambos factores para su crecimiento. Método: con ansa, se prepara una suspensión de las colonias aisladas en solución fisiológica. Se hisopa una placa de agar tripticasa soja y se colo- BRITANIA 10 can tres discos. Uno impregnado en factor V, otro en factor X y el tercero con los dos factores . Se incuba a 35-37° C en atmósfera de CO2 Se observa crecimiento alrededor de los discos. firinas. Eso indica que el microorganismo no requiere factor X. A las 24 hs. puede revelarse con reactivo de Kovacs ( rojo en fase acuosa = positivo presencia de porfirinas) . C ) Moraxella catarrhalis Identificación de Haemophilus spp.. ESPECIE PRUEBA ________________________________________ DEPENDENCIA DE FACTORES X V HEMÓLISIS LACTOSA MANOSA _____________________________________________________ H.influenzae H.haemolyticus H.parainfluenzae H.parahaemolyticus H.aphrophilus H.paraphrophilus H.segnis H.ducreyi + + + + + + + + + - + + - + + - + + + - II ) Prueba de las porfirinas: el ácido delta amino levulínico es convertido enzimáticamente a porfirinas produciendo una fluorescencia roja. Mide la independencia del factor X. La reacción bioquímica es la siguiente: Porfobilinógeno sintetasa δ amino levulínico---------------porfobilinógeno uroporfirinógeno uroporfirinógeno sintetasa I decarboxilasa -------------------uroporfirinógeno------------------coproporfirinógeno oxidasa -coproporfirinógeno-----------protoporfirina IX ferroquelatasa ----------------------hemina Fe++ Método: se prepara una suspensión bien cargada en un buffer fosfato 0.1 M ( pH 6.9 ) que contenga 2 mM de ácido δ aminolevulínico y 0.8 mM de MgSO4 . Se incuba 4 horas a 37° C. El tubo se ilumina con luz ultravioleta observando una fluorescencia roja (presencia de porfobilinógeno). Interpretación: la fluorescencia roja indica una conversión del ácido δ-aminolevulínico a por- Son diplococos gram negativos, oxidasa y catalasa positivas, inmóviles y no producen esporos . Son aeróbicos y su temperatura óptima de crecimiento es de 35 a 37 ° C , aunque crece también a menores temperaturas. (28° C). Crecen bien en agar sangre y en agar chocolate, como así también en medios líquidos. No producen oxidación de azúcares en medio CTA y dan positivas las pruebas de reducción de nitratos y DNAsa Diágnostico de laboratorio I ) Producción de ácido a partir de carbohidratos: determina la capacidad de producir ácido a partir de un hidrato de carbono específico incorporado a un medio base. Utilizando un indicador de pH puede determinarse si la bacteria ha degradado el hidrato de carbono en varios productos terminales observando un cambio de color. Los azúcares estudiados son glucosa, maltosa, sacarosa y lactosa. Método: El medio base utilizado es el CTA. Se evalúa con una concentración del 1% del carbohidrato en el medio base. Se inoculan los tubos y se incuban a 37 ° C. Interpretación: Una reacción positiva es aquella en la cual se produce un cambio de color (amarillo). Una reacción negativa es aquella en la que el medio permanece rojo rosado . II ) Reducción de nitratos: determina la capacidad del microorganismo de reducir el nitrato en nitritos. Método: Se utiliza caldo nitrato que es caldo infusión cerebro corazón (BHI) al 2.5 % y NO3K al 0.1 %. A las 24 hs. de incubación a 37 ° C los caldos inoculados se revelan con 3 gotas del reactivo A (ácido sulfanílico (0.8 g), ácido acético glaciar (30 ml) y agua destilada (100 ml) y 3 gotas del reactivo B ( dimetil α naftilamina (0.5 g) , ácido acético glaciar ( 30 ml ) y agua destilada (100 ml). Interpretación: la aparición de un color rojo fuerte vinoso indica una prueba positiva. Si no hay desarrollo de color, es negativa. BRITANIA 11 III ) Prueba de la DNAsa: determina la presencia de una enzima capaz de clivar el ADN incorporado al medio. Método: se utiliza el medio comercial. Se realiza una estría y se incuba 24 hs. a 37 ° C. Se revela con el agregado de ClH 1 N. Interpretación: es positiva cuando aparece un halo transparente alrededor del crecimiento bacteriano. En ausencia de halo se interpreta como negativa. Características diferenciales de Neisseria y Moraxella ___________________ D N G M S L _______________________________________ ESPECIE Método: con un ansa recoger una colonia de un cultivo puro de 24 hs. y colocarla sobre un portaobjetos. Agregar una gota de H2O2 al 30 %. Observar la formación inmediata de burbujas. Interpretación: una prueba positiva corresponde a la formación de burbujas bien visibles (formación de O2 ) . II ) Prueba de la coagulasa: comprueba la facultad de un microorganismo de coagular el plasma por acción de la coagulasa. coagulasa Plasma-------------------cóagulo de fibrina FORMACIÓN DE ÁCIDO N.gonorrhoeae + - N.meningitidis + + - N.lactamica + + + - N.cinerea - N.subflava + + v - N.sicca + + + - N.mucosa + + + - + M.catarrhalis + + ________________________________________ Método: incubar 0.5 ml de cultivo puro con igual volumen de plasma de conejo o humano. Observar a las 4 horas. Si al cabo de ese tiempo no hay coágulo visible, dejar incubando 24 horas. Interpretación: prueba positiva, se forman coágulos o filamentos de fibrina bien visibles. La coagulación puede ser completa o parcial. La prueba es negativa si no hay formación de coágulos y la suspensión se mantiene homogénea . D= DNasa. N= NITRATOS. G= Glucosa. M= Maltosa. S= Sacarosa L= Lactosa III ) Prueba de la DNAsa : Ver Moraxella catarrhalis . F ) Otros patógenos D ) Estreptococo ß hemolítico grupo “A” Ver sección anterior: exudado de fauces E ) Staphylococcus aureus Son cocos gram positivos que se disponen en pares, tetradas o racimos. Son microorganismos inmóviles que no forman esporos. Son catalasa positivos y la mayor parte de las cepas fermentan el manitol, producen pigmento amarillo en medios con sangre, hemolisina y coagulasa. Diagnóstico de laboratorio I ) Prueba de la catalasa: determina la presencia de la enzima catalasa. Esta enzima descompone el peróxido de hidrógeno que se forma como producto terminal oxidativo de la descomposición aeróbica de los azúcares. Otros patógenos como Chlamydia pneumoniae, Mycoplasma pneumoniae u hongos son excepcionales como causa de OMA, Sin embargo, en un estudio reciente Block y colaboradores recuperaron un 8 % de clamidias de 101 muestras de tímpanocentesis de pacientes con OMA utilizando técnicas de PCR y cultivo. Los agentes más controvertidos son los virus. Por lo general, se los acepta como agentes predisponentes de la infección bacteriana más que como agentes etiológicos. Las bacterias anaerobias se consideran que pueden ser flora de contaminación y no agentes causales de la OMA. En el Hospital Garrahan no se aislaron anaerobios de 371 muestras de OMA con tímpano conservado en 1996. Estas bacterias tienen importancia en las OMA supuradas y en OMC. BRITANIA 12 5 ) Pruebas de sensibilidad a los antibióticos A ) Streptococcus pneumoniae Se determina la sensibilidad a la penicilina , cefotaxima (o ceftriaxona), eritromicina, co-trimoxazol y opcionalmente a vancomicina, aunque no estén descriptas cepas resistentes a este antibiótico. & Penicilina a ) por difusión: I- se utiliza un método de “screening” que emplea discos de oxacilina de 1 µg. Se hisopa una placa de agar Mueller Hinton suplementado con 5 % de sangre de carnero. Se coloca el disco de oxacilina y se incuba 24 horas en atmósfera con 5 % de CO2. Interpretación: Halos > ó = a 20 mm ⇒ sensible < ó = a 19 mm ⇒ resistente o intermedio II- E–test: sobre una placa de las mismas características que en el caso anterior, se coloca una tira reactiva que está impregnada de concentraciones crecientes de penicilina. Luego de la incubación se observa la zona de inhibición que tiene forma elíptica y se determina la CIM leyendo la línea en donde esa zona de inhibición intercepta la tira reactiva . b ) por dilución: se siguen las normas para micro o macrodilución. Las cepas sensibles tienen una CIM < ó = a 0.06 µg / ml, las intermedias entre 0.12 y 1 µg / ml y las resistentes > ó = a 2 µg / ml. & Cefotaxima. ceftriaxona y cefuroxima: se determina solamente por el método de dilución en las condiciones antes descriptas para penicilina. (ver normas de NCCLS ). Pueden emplearse también las tiras de E-test en las mismas placas utilizadas para penicilina. & Eritromicina, co-trimoxazol. cloranfenicol y vancomicina: su sensibilidad está normatizada para los métodos de difusión y de dilución en las condiciones antes descriptas para penicilina. La sensibilidad y resistencia a azitromicina y claritromicina pueden ser extrapoladas de los resultados observados con eritromicina. B ) Haemophilus influenzae Se debe determinar la sensibilidad a ampicilina, ampicilina – sulbactam , cloranfenicol, co-trimoxazol, cefuroxima y cefaclor. No se han detectado aislamientos resistentes a cefotaxima, cefixima, ceftibuten, ceftriaxona , ciprofloxacina ni azitromicina. La sensibilidad a los distintos antimicrobianos puede determinarse por difusión o por dilución siguiendo las normas de la NCCLS. & Ampicilina: además del método de difusión se debe realizar una prueba rápida para detectar las ß lactamasas. Existen tres pruebas rápidas: La acidimétrica , la iodométrica y la cromogénica. Las dos primeras utilizan un indicador colorimétrico para detectar la presencia del ácido peniciloico producido como consecuencia de la hidrólisis de la penicilina por las ß lactamasas. El método acidimétrico usa como sustrato penicilina en un buffer citratado con rojo de fenol como indicador. Una disminución del pH debido a la presencia de ácido peniciloico da como resultado un cambio de color del rojo al amarillo. El sustrato en el método iodométrico es penicilina en un buffer fosfatado con el agregado de yodo y almidón. El ácido peniciloico reduce al yodo e impide que éste se una al almidón (reacción negativa , incolora). Si no se produce la hidrólisis de la penicilina el yodo y el almidón forman un complejo violáceo. (reacción positiva) . El tercer método usa nitrocefin que es una cefalosporina cromogénica que exhibe un rápido cambio de color del amarillo al rojo cuando el enlace amida del anillo beta lactámico es hidrolizado por una beta lactamasa. Método: añadir una gota de nitrocefin a un portaobjetos limpio. Utilizando un ansa estéril, tomar una colonia de la placa y emulsionarla en la gota de nitrocefin. El resultado es positivo si se produce el cambio de color a los 30 minutos (hay que proteger el portaobjetos de la desecación durante el período de espera). También se pueden usar discos comerciales. & Cloranfenicol: la resistencia a cloranfenicol puede ser mediada por una enzima, la cloranfenicol acetil transferasa. Para detectarla se hisopa media placa de agar chocolate con una suspensión de H. influenzae. Se hacen dos estrías, una sobre la media placa hisopada y otra sobre la media placa BRITANIA 13 no hisopada, con una cepa patrón de S. aureus ATCC 25923. En la mitad de dichas estrías se coloca un disco de cloranfenicol. Se incuba a 37 ° C durante 24 horas y se miden los halos de inhibición del crecimiento de la cepa de S. aureus alrededor de los discos. Una disminución de dicha zona, en la mitad de la placa hisopada con el aislamiento de H. influenzae, indica destrucción enzimática del antibiótico. Una prueba similar puede servir para determinar por método microbiológico la presencia de ß lactamasa. Para ese fin se usa la misma cepa patrón de S. aureus y un disco de ampicilina C ) Moraxella catarrhalis Para determinar la sensibilidad a penicilina, ampicilina y amoxicilina es suficiente la realización de una prueba de detección de beta lactamasa, pero sólo es aceptable el método del nitocefin. M. catarrhalis es sensible a cefalosporinas, ampicilina / sulbactam, amoxicilina / clavulánico, imipenem y eritromicina. Se han detectado cepas resistentes a cotrimoxazol por lo que su sensibilidad deberá determinarse por pruebas de difusión con discos. Se usa agar Mueller Hinton y se incuba a 35 ° C siguiendo las normas del NCCLS . D ) Streptococcus pyogenes Ver sección de exudados de fauces (CLDE) y anaerobios (placas con vitamina K y caldo anaerobio). En el caso de OMC se deberá agregar también medios para el aislamiento de hongos como agar Sabouraud. En un estudio realizado en el Hospital Garrahan en el año 1996, se cultivaron 67 materiales provenientes de oídos con otitis media crónica de huéspesdes normales. El 97 % de los mismos fueron positivos y un 41.5 % de ellos correspondieron a flora polimicrobiana. Los principales microorganismos fueron Pseudomonas aeruginosa (20.2 %), Proteus spp. (15 %), Staphylococcus aureus (8 %), anaerobios (24 %), otros bacilos gram negativos fermentadores y no fermentadores, Haemophilus influenzae (12 %), y en menor proporción S.pneumoniae y M.catarrhalis. Dentro de los anaerobios, en nuestra experiencia, los más frecuentes fueron las especies de Bacteroides del grupo “fragilis” y los cocos gram positivos (aproximadamente 30 % de cada uno). Les siguieron los bacilos gram negativos pigmentados (especialmente Porphyromonas spp. (13 %), Fusobacterium spp. (10 %), Veillonella spp. (9 %), Clostridium spp. (8 %), bacilos gram positivos no esporulados (7 %) y otros bacilos gram negativos (5 %). —————————— ________________________________________ ________________________________________ HUESPED NORMAL OMA E ) Staphylococcus aureus La sensibilidad a los distintos antimicrobianos se determina por el método de difusión siguiendo las normas de NCCLS OTITIS MEDIA AGUDA SUPURADA Y OTITIS MEDIA CRÓNICA Diagnóstico microbiológico Se debe cultivar el material obtenido por punción aspiración del mismo previa limpieza y desinfección del conducto auditivo externo con alcohol boricado al 70 %. El material se coloca en medio de transporte TAB. Además de los medios utilizados para el material proveniente de OMA, en el caso de OMA supurada se debe agregar medios para el aislamiento de bacilos gram negativos OMA supurada OMC Material de tímpanocentesis ( punción ) TAB ________________________________________ OMA OMA OMC supurada ________________________________________ Gram + + + ________________________________________ Agar sangre + + + ________________________________________ Agar chocolate + + + ________________________________________ BHI + + + ________________________________________ CLDE + + ________________________________________ Vitamina K + + ________________________________________ Caldo anaerobio + + ________________________________________ Agar Sabouraud + BRITANIA 14 Otitis externa SINUSITIS AGUDA Es la infección del conducto auditivo externo. Puede ser localizada, difusa, crónica o maligna. Los gérmenes colonizantes de la piel como Staphylococcus epidermidis, Staphylococcus aureus, Corynebacterium spp y en menor proporción, anaerobios como Propionibacterium acnes y bacilos gram negativos, principalmente Pseudomonas aeruginosa, en determinadas ocasiones de gran humedad y temperatura pueden invadir la piel y producir inflamación y / o supuración. Otitis externa localizada: se presenta como pústula o forúnculo asociada a folículo piloso. Los gérmenes responsables son Staphylococcus aureus y Streptococcus pyogenes. El tratamiento es local, drenaje y antibióticos sistémicos. Cultivo: sólo tiene valor el cultivo del material obtenido por punción del absceso. Otitis externa difusa: ocurre en ambientes húmedos y calurosos. La piel del conducto auditivo externo se edematiza e inflama. Pseudomonas aeruginosa y otros bacilos gram negativos pueden tener un papel patógeno. El tratamiento consiste en una limpieza de la zona con alcohol boricado a 70%. Cultivo: no se cultivan Otitis externa crónica: es debida a irritación local producida por el material purulento proveniente del oído medio en una otitis crónica supurada. El tratamiento está dirigido a curar la otitis media. Cultivo: sólo se debe cultivar el material obtenido de oído medio por aspiración transtimpánica. Otitis externa maligna: es una infección del conducto auditivo externo que se disemina a partes blandas adyacentes, vasos sanguíneos y hueso. Pseudomonas aeruginosa es el patógeno responsable. El tratamiento consiste en limpieza del tejido , instilación de gotas con esteroides y antibióticos antipseudomonas locales y sistémicos. Cultivo: se debe cultivar la secreción y realizar hemocultivos . La sinusitis es una afección frecuente que complica el 5 % al 10 % de las infecciones del tracto respiratorio superior , y a la cual ningún grupo de edad es inmune. Resuelve espontáneamente en más del 40 % de los casos. El revestimiento mucoso de los senos paranasales es similar al de la nariz, con el cual se continúa. El epitelio es de tipo cilíndrico con células caliciformes , y tiene una cubierta de moco , que es barrido por las cilias hacia el ostium de cada seno paranasal, y luego a la nasofaringe .La disquinesia ciliar, el edema de la mucosa y las alteraciones en la calidad y cantidad de las secreciones son las causas fundamentales de la alteración de la función normal de los senos paranasales. La infección viral y la inflamación alérgica de la mucosa son las causas más frecuentes de la obstrucción fisiológica del ostium. La presión negativa intrasinusal que sucede a la obstrucción del ostium permite la invasión bacteriana. En adultos y adolescentes, los síntomas de sinusitis incluyen obstrucción nasal, rinorrea, dolor facial, cefalea y fiebre. En los niños pequeños los síntomas son menos específicos y se superponen con los del resfrío común. En los pacientes con infección de las vías aéreas superiores debe sospecharse sinusitis cuando los síntomas perduran por más de 10 días. Diagnóstico clínico El exámen otorrinolaringológico incluye la rinoscopía anterior y la nasofibroscopía, que permite visualizar el origen de la rinorrea y descartar cuerpos extraños, alteraciones anatómicas endonasales y presencia de masas tumorales. El método convencional para el diagnóstico de sinusitis utiliza radiografías planas de los senos paranasales, en planos anteroposterior, lateral, submento - vértice y de Water. La presencia de nivel hidroaéreo o la opacificación total de un seno se correlaciona con identificación de bacterias en el 64 % al 70 %. El engrosamiento de la mucosa debe correlacionarse con la clínica para diferenciar sinusitis aguda de crónica. La tomografía computada se indica en aquellos casos que presentan complicaciones, cuando se sospecha patología tumoral o infecciones específicas y en los pacientes en los cuales se contem- BRITANIA 15 pla la posibilidad de cirugía. Los hallazgos radiológicos y tomográficos deben ser siempre correlacionados con la clínica antes de tomar decisiones. Diagnóstico microbiológico Las características bacteriológicas de las sinusitis agudas en niños son similares a las descriptas en adultos. Los patógenos de los senos paranasales son similares en tipo y frecuencia a los hallados en otitis media aguda. La mayoría de las infecciones son causadas por Strptococcus pneumoniae y Haemophilus influenzae y en menor número por Staphylococcus aureus, Streptococcus pyogenes y Moraxella catarrhalis. Son escasos los trabajos que muestran la frecuencia de los distintos agentes etiológicos de la sinusitis aguda. Yousimies-Somer y cols. en 1988, describieron 339 aislamientos bacteriológicos de senos paranasales obtenidos por punción. Los patógenos más frecuentes entre los aerobios son los enunciados más arriba. Entre los anaerobios (2 % del total), los más frecuentemente aislados fueron Propionibacterium acnes (de dudoso significado clínico), Peptostreptococcus spp. y Prevotella spp. El aislamiento de virus es bajo y no está claro si la infección viral precede a la bacteriana o si es una invasión simultánea de ambos organismos. Entre los virus los más frecuentes están Rhinovirus, Influenza, Parainfluenza y Adenovirus . El rol de Chlamydia pneumoniae como agente etiológico de sinusitis aguda no está bien documentado aunque se ha aislado de pacientes con esta patología. En el caso de sinusitis intrahospitalarias, por ejemplo las sinusitis asociadas a respirador, tienen importancia los bacilos gram negativos y anaerobios. En pacientes inmunosuprimidos se debe investigar la presencia de hongos. Toma de muestra El estudio microbiológico debe ser realizado con material obtenido por punción aspiración del contenido del seno. Los cultivos obtenidos de las fosas nasales y nasofaringe no poseen valor predictivo en las sinusitis. En los casos que se sospeche micosis debe obtenerse, ya sea por vía endoscópica o a cielo abierto, muestra de la mucosa del seno para su estudio. Punción antral: indicaciones y técnica En los niños es extremadamente rara la necesidad de indicación de punción de los senos paranasales. Al no haberse completado el desarrollo, los ostium de drenaje no son tan estrechos como en el adulto y evolucionan favorablemente con el tratamiento aún en los casos que presentan complicaciones. Por este motivo se indica punción en adultos y niños sólo cuando no hay respuesta al tratamiento médico. El seno afectado con mayor frecuencia es el maxilar en el adulto y el etmoidal en el niño. La punción del seno maxilar se realiza con aguja gruesa o trocar “ad hoc” ya en el meato inferior de la fosa nasal, donde la pared interna del seno es más delgada o en la pared anterior del mismo, por arriba de la arcada dentaria. En las punciones de senos etmoidales y senos frontales se utiliza la vía externa, previa incisión de piel. También pueden obtenerse muestras para el estudio bacteriológico por vía endoscópica siempre y cuando pueda asegurarse la obtención del material del interior del seno involucrado, habiendo sorteado el ostium. Medio de transporte y procesamiento El material obtenido es colocado en frascos TAB y remitido al laboratorio. La siembra y el procesamiento es igual que el proveniente de oído medio. BRITANIA 16 BIBLIOGRAFIA -Antila J, Suonpa J, Lehtonen O. Bacteriological Evaluation of 194 Adult Patients with Acute Frontal Sinusitis and Findings of Simultaneous Maxillary Sinusitis. Acta Otolaryngol, Suppl 529: 162 – 164, 1997. - Baron EJ, LR Peterson, SM Finegold. Bayley & Scott ¨s Diagnostic Microbiology. 9 th.ed. Mosby, St.Louis, EEUU, 1994. - Block CM. Current methods of laboratory diagnosis of Chlamydia trachomatis infections . Clin. Microbiol.Rev. 10 : 160 – 184, 1997. - Block S., M.Hammerschlag, J. Hedrich, R.Tyler, A.Smith, P.Roblin, Ch., D.Pham, T. Quinn, R. Palmer, J. Mocarty. Chlamydia pneumoniae in acute otitis media. Pediat. Infect. Dis. J. 16 : 858 – 862, 1997 - Davis, Dulbecco, Eisen, Ginsberg, Wood. Tratado de Microbiología, 1979. - Glasier L CM, GB Mallory Jr, RW Steele. Significance of opacificatio of the maxillary and ethmoid sinuses in infants. J Pediatr. 114: 45 – 50, 1989. - Gwaltney, JM JR, A Syndor JR, MA Sande. Etiology and Antimicrobial Treatment of Acute Sinusitis. Ann. Otol. Rhinol Laryngol, 90 : 68 – 71, 1981. - Isaacson G. Sinusitis in Childhood. Pediatr Otolaryngol 6: 1297- 1317, 1996. - Iwen P, Rupp P, Hinrichs S. Invasive Mold Sinusitis: 17 Cases in Inmunocompromised Patients and Review of the Literature. Clin Infect Dis. 24: 1178 – 1184, 1997. - Jousimies – Somer HR, S Savolainen, JS Ylikoski. B Bacteriological findings of acute maxillary sinusitis in young adults. J Clin Microbiol 26 : 1919 – 1925. - Keiko I, Yatsuji I, Keisuke M, Haruko O, Tomoo S, Hildeo M, Naoki T, Kunitomo W, Kasue U. State of theart “otitis media”. Clin Infect Dis . 20 ( suppl 2 : S214 – S219), 1995. - Klein J C. Bacteriology of chronic otitis media, chronic sinusitis and paranasal mucopyocele. Clin Infec Dis 19: 823 –833, 1994. - Lopardo H, Hernández C, Morales G. Módulo del curso a distancia sobre: Microbiología clínica. Infecciones de las vías respiratorias superiores, AAM – Colegio de Bioquímicos de Entre Ríos, 1998. - Mac Faddin, Ed. Panamericana Bs. As. Pruebas bioquímicas para la identificación de bacterias de importancia clínica, 1980. - Mandell GL, JE Bennett, R Dolin ( ed ) Principles and Practice of Infectious Diseases. Churchill Livingstone, New York, 4 th ed., 1995. - Paradise J, H Rockette, K Colborn, B Bernard, C Smith, M Kurslasky, J Janosky. Otitis media in 2253 Pittsburgh Area Infants: Prevalence and Risk Factors during the first two years of life. Pediatrics 99: 318 – 333, 1997. - Pichichero M, Pichichero C. Persistent acute otitis media: I.Causative pathogens. Pediatr Infect Dis J 14: 178 – 183, 1995. - Rossi A. Módulo del curso a distancia sobre. Microbiología clínica. Antimicrobianos AAM – Colegio de Bioquímicos de Entre Ríos, 1997. - Westergreen V, Lundblat L, Hellquint H, Forsum U. Ventilator – Associated Sinusitis : A Review. Clin Infect Dis 27 : 851 – 864, 1998. BRITANIA 17 INFECCIONES RESPIRAT ORIAS BAJAS NEUMONIA EXTRAHOSPITALARIA Es la sexta causa mas común de muerte en USA y la causa mas frecuente de mortalidad relacionada con infección. El desarrollo de infección pulmonar aguda indica un defecto en las defensas del huésped, ingreso de gérmenes particularmente virulentos o inóculos elevados. Los agentes infecciosos acceden al tracto respiratorio inferior a través de la aspiración de la flora residente de vías aéreas superiores (S.pneumoniae, H.influenzae, M.catarrhalis, S.aureus, anaerobios, bacilos gram negativos y S.pyogenes), inhalación de micropartículas (M. tuberculosis, H.capsulatum, P.brasiliensis, C.immitis, C.neoformans, Aspergillus spp, Brucella spp, L.pneumophila, C.psittaci, B.anthracis); con menor frecuencia puede producirse una siembra hematógena a partir de un foco a distancia (Candida spp, S. aureus) o por contiguidad (ej: absceso subdiafragmático). Los factores que interfieren con las defensas normales del huésped son alteración de la conciencia, humo de cigarrillo, hipoxemia, acidosis, alcoholismo, inhalaciones tóxicas, edema de pulmón, desnutrición, infecciones virales previas, uremia, obstrucción mecánica, utilización de agentes inmunosupresores (corticoides y drogas citotóxicas), edad avanzada. También puede asociarse con enfermedades de base como diabetes, fibrosis quística, enfermedad pulmonar obstructiva crónica, enfermedad cardíaca congestiva y enfermedades inmunosupresoras como el SIDA. Estos datos son fundamentales para orientar al laboratorio de microbiología hacia la búsqueda de determinados agentes, por ejemplo: Fibrosis quística: P. aeruginosa, S. aureus, H. influenzae y en menor medida B. cepacia y otros bacilos gram negativos. Infecciones virales previas: S.aureus Contacto con aves: C. psittaci. Viajes a áreas endémicas: C. immitis, P. brasiliensis, L. pneumophila, F. tularensis. Riesgo ocupacional y/o contacto con animales: C. burnetti, B. anthracis, Brucella spp, Y. pestis. Antecedente de macroaspiración: anaerobios Epidemias de influenza: Influenza, S.pneumoniae, S.aureus, S.pyogenes, H.influenzae. Condiciones socioeconómicas pobres: M. tuberculosis. Alcoholismo: S. pneumoniae, anaerobios, bacilos Gram negativos. Pacientes infectados con HIV: P. carinii, M. tuberculosis, S. pneumoniae, H. influenzae. EPOC/fumadores: S. pneumoniae, H. influenzae, M. catarrhalis, Legionella spp. Exposición a murciélagos o materia fecal de los mismos: H. capsulatum. Exposición a conejos: F. tularensis. También resulta crítico conocer si la neumonía es de adquisición intrahospitalaria o ambulatoria, como así también si el huésped es inmunocompetente o no. PRESENTACION CLINICA. CLASIFICACION Si bien sirve como orientación tiene ciertas limitaciones y no se puede aplicar en los extremos de la vida ni a pacientes inmunocomprometidos A) Aguda: I) Típica: S.pneumoniae, H.influenzae, M.catarrhalis, bacilos gram negativos, S. aureus, S. pyogenes. II) Atípica: IIa) Sin eosinofilia: viral, M.pneumoniae, C.burnetti, Legionella spp, Chlamydia spp IIb) Con eosinofilia: parasitaria: Ascaris lumbricoides, Strongyloides stercoralis, Toxoplasma gondii, Paragonimus westermani; drogas; idiopática. B) Crónica: M. tuberculosis y otras micobacterias, Nocardia spp, P. pseudomallei, anaerobios, Actinomyces spp, H. capsulatum, P. brasiliensis, C. immitis, B. dermatitidis, Sporothrix schenckii, C. neoformans, E. hystolítica, parásitos y causas no infecciosas (neoplasias, sarcoidosis, vasculitis, granulomatosis linfomatoidea, sustancias químicas, radiación, neumoconiosis, neumonitis por hipersensibilidad, etc.). BRITANIA 18 ETIOLOGÍA En general la incidencia de S. pneumoniae se encuentra en el rango del 15-47%, H. influenzae 6-10%, S. aureus 3-22%, M. catarrhalis 5-6%, P. aeruginosa 3-5%, otros bacilos gram negativos 4-25%, M. pneumoniae <1-6%, Legionella spp 12-23%, M. tuberculosis 4-11%, P. carinii 3-8%, virus 3-4%, anaerobios 3-8%, estreptococos del grupo viridans y beta hemolíticos 1-2% y causas desconocidas en 33-49%. Si bien S. pneumoniae es uno de los principales agentes etiológicos en la neumonía de la comunidad, puede haber ciertas variaciones de acuerdo a la población y el área geográfica consideradas. Actualmente otras causas poco frecuentes de neumonía en nuestro país son B. anthracis (exposición a animales o cueros, lanas), Pseudomonas pseudomallei (viajes al Asia, Australia), Francisella tularensis (exposición a animales infectados o a picaduras de artrópodos en áreas endémicas), Brucella spp (exposición a animales o aerosoles), Yersinia pestis (exposición a animales infectados especialmente gatos), Coxiella burnetti (exposición a ganado ovino, bovino, caprino y sus secreciones), Leptospira spp, (exposición a aguas contaminadas o animales infectados) y Hantavirus (exposición a roedores o por contagio interhumano). Los pacientes inmunocomprometidos como aquéllos con tumores sólidos y oncohematológicos que reciben quimioterapia, los que reciben tratamiento con corticoides y los que tienen inmunodeficiencias adquiridas (como por ejemplo SIDA) o congénitas, están mas predispuestos a infecciones respiratorias que los inmunocompetentes. En estos pacientes la importancia relativa de cada tipo de microorganismo depende del tipo de inmunosupresión y del grado de la misma. RELACION ENTRE TIPO DE INMUNOSUPRESION Y AGENTES ETIOLOGICOS - Neutropenia: Bacilos gram negativos: Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Enterobacter spp. Cocos gram positivos: S.aureus, S.epidermidis, Enterococcus spp, estreptococos del grupo viridans. Bacilos gram positivos: Bacillus spp, Clostridium spp. Hongos: Aspergillus spp, Fusarium spp, Zygomycetes, Trichosporon beigelii, Candida spp, Torulopsis glabrata. - Alteración en los linfocitos T Bacterias: Mycobacterium spp, Nocardia asteroides, Listeria monocytogenes, Salmonella spp, Legionella spp. Virus: citomegalovirus, varicela zoster, herpes simplex, Epstein Barr. Protozoos: Pneumocystis carinii, Toxoplasma gondii. Hongos: Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis. Helmintos: Strongyloides stercoralis. - Alteración en los linfocitos B Bacterias: S.pneumoniae, H.influenzae - Alteración en el "clearence" traqueobronquial o ruptura mecánica de las barreras epiteliales Bacterias y hongos que colonizan el tracto respiratorio. BRITANIA 19 Tabla 1 MUESTRAS PARA EL DIAGNOSTICO DE NEUMONIA EXTRAHOSPITALARIA Examen directo y cultivo Esputo; Lavado bronquial Cultivo Detección de antígenos Hemocultivo Suero, orina y líquido pleural para detección de antígeno capsular de S. pneumoniae y H. influenzae. Orina para detección de antígeno de Legionella pneumophila serogrupo 1 Detección de anticuerpos Suero para Chlamydia spp, Mycoplasma spp, C. burnetti, Legionella pneumophila Líquido pleural Punción transtraqueal y punción pulmonar percutánea Cepillo protegido y/o lavado broncoalveolar Biopsia de pulmón Diagnóstico presuntivo CRITERIOS DE JERARQUIZACIÓN DE MUESTRAS RESPIRATORIAS Diagnóstico definitivo: - Aislamiento de un patógeno bacteriano de hemocultivo, líquido pleural o biopsia de pulmón en el contexto de un cuadro clínico compatible con neumonía. - Aislamiento y/o detección de M. tuberculosis, P. carinii, H. capsulatum, C. immitis, P. brasiliensis, C.pneumoniae, L.pneumophila, C. psittaci B. dermatitidis, S. stercoralis, T. gondii, virus de influenza virus sincicial respiratorio, Hantavirus, Parainfluenzae, Coxsackievirus y Adenovirus de muestras respiratorias. - PCR positiva para C. pneumoniae, M. pneumoniae, L. pneumophila. - Aumento de 4 veces el título de anticuerpos para M. pneumoniae (Fijación de complemento), L. pneumophila (Inmunofluorescencia indirecta), influenza A, B, parainfluenza I, II, III, adenovirus, C. burnetti. - Diagnóstico histopatológico compatible, por ej. con citomegalovirus. - Coloración de Gram y crecimiento predominante de S. pneumoniae, H. influenzae, M. catarrhalis, S. aureus, S. pyogenes, bacilos gram negativos, en una muestra de esputo o de lavado bronquial de pacientes sin tratamiento antibiótico previo y clínica compatible con neumonía. - Título individual >1/256, antígeno urinario positivo o coloración fluorescente para L. pneumophila. Factores asociados al bajo diagnóstico microbiológico en neumonías extrahospitalarias - Antibióticos previos. - Muestras de esputo no representativas (>50%). - Bajo rendimiento del hemocultivo (20-30% en neumonías del adulto por S. pneumoniae y 12-15% en pediatría). - Valor nulo del esputo para aislamiento de anaerobios en la neumonía aspirativa. - Detección de antígenos capsulares es inespecífica en muestras de esputo de pacientes con BRITANIA 20 EPOC, bronquitis crónica altamente colonizados. - Baja sensibilidad de coloraciones fluorescentes en esputo para Legionella spp. - Muestras invasivas exponen al paciente a riesgos adicionales y no estan disponibles en todos los hospitales. ESPUTO Y LAVADO BRONQUIAL Utilidad del cultivo de esputo y del lavado bronquial - Neumonía extrahospitalaria. - Adultos o niños mayores que pueden expectorar. - Pacientes sin tratamiento antibiótico previo - Pacientes con fibrosis quística. - Pacientes con exacerbaciones agudas de la bronquitis crónica. - Búsqueda de M. tuberculosis, Legionella spp, H. capsulatum, C. immitis, P. brasiliensis, C. pneumoniae (patógenos indudables). - Aislamiento de S. pneumoniae, M. catarrhalis, H. influenzae, S. aureus, S. pyogenes, bacilos gram negativos, M. pneumoniae deben ser analizados en el contexto de los datos clínicos, radiología, exámen citológico y predominio de flora. Rendimiento del cultivo de esputo Aproximadamente 60-70% en personas con neumonía y sin tratamiento antibiótico previo y 30-40% en personas con tratamiento antibiótico previo. - Coloración de Gram: recuento de neutrófilos, células epiteliales escamosas, predominio de bacterias indicativo de: diplococos gram positivos lanceolados: S. pneumoniae. cocobacilos gram negativos pleomórficos: H. influenzae. diplococos gram negativos: M. catarrhalis. - Coloración de Ziehl Neelsen o de Kinyoun: visualización de bacilos ácido alcoholresistentes o ácidoresistentes. (micobacterias, Nocardia spp) - Coloración de Giemsa: celularidad, elementos micóticos. - Azul de o-toluidina, metenamina plata, Gram Weigert, coloración fluorescente con anticuerpos monoclonales: P. carinii. Cultivo a) Cultivo para gérmenes comunes - Sembrar en 4 estrías en agar sangre y agar chocolate (5-10% de CO2), McConkey o CLDE (aerobiosis) b) En pacientes fibroquísticos adicionar manitol salado (aumenta la recuperación de S. aureus) y OFB (medio selectivo con polimixina B para B. cepacia). c) Ante sospecha clínica o epidemiológica y en pacientes inmunocomprometidos Mycobacterium spp: Lowestein Jensen y Stonebrink (previa homogeneización) Hongos: Agar Sabouraud con antibióticos y agar cerebro corazón con antibióticos. Interpretación del esputo y lavado bronquial Procesamiento del esputo Exámen directo Debe procesarse dentro de los 30’-2 horas de recogido o conservarse a 4ºC para evitar el sobrecrecimiento de la flora acompañante. Es conveniente seleccionar las porciones purulentas, evitando tocar las partes salivosas, Para facilitar ésto puede volcarse la muestra en una placa de Petri vacía. Exámen directo - Muestra representativa: <10 Células escamosas, >25 leucocitos (10x), germen predominante. Este criterio de restricción no es válido para M. tuberculosis ni para hongos de micosis sistémicas. - Muestras no representativas: >10 células escamosas y/o <25 leucocitos en campo de 10x Flora polimicrobiana. - Fresco: Observación de filamentos (Aspergillus spp, Mucorales), levaduras multibrotadas (P. brasiliensis), esférulas (C. immitis). BRITANIA 21 Cultivo Jerarquizar el crecimiento de gérmenes que llegan hasta la 3-4 estría en forma desplazante, con este fin es útil aplicar los criterios de Bartlett que se presentan en la tabla 2. Creemos conveniente jerarquizar los microorganismos que llegan puros hasta la 3º estría (++++) o los predominantes que llegan hasta la 4º estría aunque presenten flora polimicrobiana en las primeras. Tabla 2. Criterios utilizados para jerarquizar el desarrollo de los gérmenes en muestras de esputo Gram 1º Estría 2º Estría 3º Estría + ++ +++ ++++ <10 >10 >10 >10 <5 <5 >5 >5 <5 >5 Tabla 3 CRITERIOS DE INFORME PARA EL ESPUTO. Coloración de Gram CEECs (10x) PMN (10x) Germen Predominante (1000x) >10 <10 <25 >25 <10 >10 >10 >25 >25 >25 X >10 <10 <10 >25 <25 <25 X FPM (1000x) Cultivo Predominante X Cultivo: FPM Informe XXX FPM Género y especie Antibiograma FPM o (1) FPM Género y especie Antibiograma FPM o (1) FPM Género y especie X X X X X X X X XXX X X X Tabla 3 (1) Tratar de aislar el morfotipo predominante visto en la coloración de Gram, tipificar y realizar pruebas de sensibilidad correspondientes; sugerir confirmación con nueva muestra Si no se puede reaislar el germen predomiante informar el exámen directo haciendo hincapié en el predominio e informar flora polimicrobiana (2) La única utilidad sería como cultivo de vigilancia para estudio de colonización. Sugerir nueva muestra CEECs: células epiteliales escamosas PMN: neutrófilos XXX: No se aconseja el cultivo, en caso de realizarse informar FPM. FPM: FLORA POLIMICROBIANA BRITANIA 22 LIQUIDOS DE PUNCION: LIQUIDO PLEURAL (PL), PUNCION TRANSTRAQUEAL(PTT) Y PUNCION PULMONAR PERCUTANEA (PPT) Se las utiliza cuando no se ha podido llegar al diagnóstico a través del esputo, no hay respuesta al tratamiento empírico, se sospecha la presencia de anaerobios y/o existe derrame pleural (PL). La PTT y la PPT estan contraindicadas cuando el paciente esta intubado, tiene hemoptisis y/o hipoxemia severa, no coopera con el procedimiento o esta bajo tratamiento antibiótico, y cuando existen transtornos de la coagulación. Se han descripto falsos positivos para la PPT en 2-20%, principalmente contaminantes de piel. Los falsos negativos pueden llegar al 20%. En la PTT la incidencia de falsos negativos es del 1%, pero son frecuentes los falsos positivos por contaminanación de piel o de la flora orofaríngea en pacientes con EPOC, neoplasias bron- cogénicas o aspiración crónica. En pacientes con neumonía y empiema pleural, los agentes más frecuentes son S. aureus, S. pneumoniae y S. pyogenes. Se ha documentado un aumento en la incidencia de anaerobios debido a la utilización de técnicas microbiológicas adecuadas. Barlettt y col aislaron bacterias aerobias en 24% de los casos, anaerobios en 35% y flora mixta en 41% de 83 pacientes del servicio médico, que no habían recibido previamente tratamiento antibiótico. El empiema secundario a enfermedad subdiafragmática con frecuencia es de causa polimicrobiana y anaerobia. En empiemas de origen postraumático u hospitalario hay una elevada frecuencia de S. aureus y bacilos gram negativos. Los receptores de transplantes de órganos y los pacientes con SIDA pueden padecer reactivaciones de focos pleurales de infecciones micobacterianas y fúngicas previas. Tabla 4 PROCESAMIENTO DE LIQUIDOS DE PUNCION EXAMEN DIRECTO CULTIVO BUSQUEDA DE ANTIGENOS CAPSULARES Fresco Agar sangre y chocolate (5-10% de CO2), CLDE (aerobiosis), agar anaerobio (anaerobiosis), caldo tioglicolato o botellas de BACTEC o Bact-Alert anae róbicas. CIEF Coaglutinación Látex ELISA Coloración de Gram Lowenstein Jensen + Stonebrink Medios líquidos de métodos automatizados como BACTEC o BACT-ALERT. Coloración de Giemsa Agar Sabouraud y agar cerebro corazón con antibióticos. Coloración de Ziehl Neelsen CIEF: contrainmuno electroforesis INFORME OTRAS MUESTRAS Debe comunicarse el aislamiento de cualquier microorganismo, aunque deben tomarse con precaución los desarrollos de germenes de piel que sólo crecen en medios líquidos puesto que probablemente representan contaminación. Los especímenes obtenidos por fibrobroncoscopía (lavado broncoalveolar y cepillo protegido) se reservan en general para pacientes con neumonía severa que requieren internación en terapia intensiva, para pacientes que no respon- BRITANIA 23 den a la terapia antibiótica, inmunocomprometidos, neumonías asociadas con cuerpos extraños, búsqueda de P. carinii y en aquéllos con sospecha de tuberculosis pero que no tienen esputo productivo. Estos serán discutidos en detalle en neumonías intrahospitalarias. La biopsia de pulmón a cielo abierto se utiliza en contados casos y tambien sera discutida más adelante. NEUMONIA NOSOCOMIAL (NP) La neumonía nosocomial representa la segunda o tercer causa más frecuente de infección intrahospitalaria y se da comunmente en pacientes que requieren ventilación mecánica (ARM) en unidades de cuidados intensivos. Algunos autores documentan incidencias del 20% en estas unidades pero los valores pueden ser superiores en pacientes con Síndrome de Distress Respiratorio (SDRA). El riesgo de desarrollar neumonía asociada a ventilador aumenta linealmente, cerca de 1% por día, y en la mayoría de los casos, en los primeros 8 días de intubación. La mortalidad cruda se encuentra en el orden de 30-50% y la mortalidad atribuible entre el 20-30%; estos valores se incrementan en el caso de P. aeruginosa y Acinetobacter spp. La morbilidad es también un factor importante a considerar puesto que en pacientes intubados incrementa la duración de la ventilación mecánica en 1822 días y el tiempo total de internación en 10-13 días. Se entiende por neumonía nosocomial aquélla que desarrolla después de las 48 horas de internación .Las principales manifestaciones clínicas son la fiebre y la leucocitosis a nivel sistémico y secreciones traqueobronquiales purulentas e infiltrados pulmonares a nivel local. Dichos hallazgos en personas previamente sanas casi siempre indican neumonía. En pacientes que estan en ARM existen causas alternativas de infiltrados como ser injuria pulmonar, atelectasias, embolia de pulmón, derrame pleural, insuficiencia cardíaca, aspiración de sangre o contenido gástrico, infiltrados neoplásicos, fibroproliferación, etc. Además la fiebre puede ser debida a otras causas infecciosas como infección de catéteres, de heridas quirúrgicas, de úlceras por decúbito, intraabdominales, sinusitis e infecciones urinarias; o bien puede relacionarse a causas no infecciosas como ser pancreatitis, fase proliferativa del SDRA, émbolos pulmonares, fiebre asociada a drogas, hipertermia maligna, reacción a transfusiones, tromboflebitis venosa, infarto de miocardio, postquirúrgica, etc. Las secreciones traqueales purulentas casi siempre están presentes en pacientes ventilados, pero pueden originarse tanto en el tracto respiratorio superior como inferior . En estos pacientes la porción de la tráquea superior entre el extremo distal del tubo endotraqueal y las cuerdas vocales actúa como reservorio de secreciones originadas en orofaringe, senos paranasales y estómago . Mínimas manipulaciones de este tubo hacen que las secreciones se introduzcan en la tráquea . Como consecuencia de ésto, el cultivo de secreciones traqueales, que si bien posee una sensibilidad aceptable, presenta una especificidad muy baja del orden del 30% cuando se compara con la biopsia de pulmón. Esto se debe a la colonización orofaríngea con flora hospitalaria gram negativa que se produce tempranamente en la mayoría de los pacientes internados. Todo lo anteriormente mencionado explica por qué los criterios clínicos y radiológicos utilizados para definir neumonía en este grupo particular son poco precisos .El lavado broncoalveolar y/o el cepillo protegido broncoscópicos o no, sembrados en forma cuantitativa, son las muestras de elección para ser analizadas junto con un score clínico y radiológico , De esta forma se puede realizar un uso racional de antibióticos, evitando sobretratamientos, acortando la duración de la terapia empírica, minimizando la emergencia de cepas resistentes y disminuyendo la morbi-mortalidad asociada . Dentro de los agentes etiológicos más frecuentes se encuentran los bacilos gram negativos, aproximadamente un 70% con respecto al total, principalmente Pseudomonas aeruginosa, seguida por Klebsiella pneumoniae, Acinetobacter baumannii, Enterobacter spp, Serratia marcescens, con un orden de frecuencia que depende de cada hospital. Staphylococcus aureus es otro importante microorganismo que se aísla entre el 10-20% de los casos. En la primer semana de internación tambien puede encontrarse aunque con menor frecuencia Streptococcus pneumoniae, Haemophilus influenzae y Moraxella BRITANIA 24 catarrhalis. Las bacterias anaeróbicas, micobacterias y hongos, en tanto, se recuperan en un porcentaje muy bajo en pacientes con neumonía asociada a respirador. Se han documentado también infecciones epidémicas por Legionella spp, virus sincicial respiratorio y parainfluenza A . Los dos últimos pueden causar hasta un 20% de los casos en unidades pediátricas. En la Fundación Favaloro sobre 241 episodios de NP diagnosticados entre 1992 y 1995, se aisló P. aeruginosa en 26% de los casos, K. pneumoniae en 12,6% y S. aureus en 10% dentro de los más importantes agentes. La presentación fué monomicrobiana en el 75% de los pacientes. En pacientes inmunocomprometidos hospitalizados deben considerarse una serie de gérmenes adicionales como Nocardia spp, Mycobacterium spp, P. carinii, T. gondii, estreptococos del grupo.viridans, R. equi, citomegalovirus, Herpes simplex, etc. cesivo retraso en el transporte podría resultar en el sobrecrecimiento de microorganismos contaminantes o colonizantes o en la disminución del recuento de patógenos "fastidiosos" como S. pneumoniae o H. influenzae. Excepcionalmente pueden conservarse a 4ºC durante 24-48 horas. C) Procesamiento SECRECIONES TRAQUEALES Coloración de Gram: Realizar en primer lugar un recuento de neutrófilos y células epiteliales escamosas, considerándose representativa una muestra con > 25 PMN y < 10 células epiteliales (10x). Búsqueda de bacterias intra y extracelulares. Diversos estudios avalan el criterio de rechazo de esta muestra en el caso de no visualizarse microorganismos. Siembra Semicuantitativa: Similar a lo descripto para esputo en lo que hace a siembra e interpretación. Diagnóstico bacteriológico A) Muestras de primera elección 1) Muestras tomadas por fibrobroncoscopía: lavado broncoalveolar (BAL), cepillo protegido (CEP). Muestras alternativas de segunda elección 2) BAL y CEP no broncoscópicos, tomados a través de distintos sistemas de doble catéter 3) Secreciones traqueales para cultivo cuantitativo. Muestras adicionales 4) Líquido pleural (en caso de derrames pleurales) 5) Biopsia de pulmón a cielo abierto, biopsia transbronquial o punción pulmonar percutánea 6) Hemocultivos 7) Muestras complementarias para excluir otros focos: catéteres, punción de senos maxilares, de heridas quirúrgicas, urocultivos, etc. B) Transporte de las muestras Deben procesarse dentro de los 30 minutos y no más allá de las 2 horas de obtenidas. Un ex- Cuantitativa: mezclar partes iguales de secreciones y de N-acetil cisteína al 1%, dejar actuar durante un minuto, luego realizar una dilución 1/100 (0,1 en 9,9 ml de solución fisiológica estéril) y sembrar 100 µl (dilución final 1/1000) en los medio citados en el punto anterior. Es conveniente el agregado de al menos 2 diluciones más: 1/10.000 y 1/100.000. Se debe considerar como representativo un punto de corte de 106 ufc/ml. En este caso la especificidad mejora considerablemente con respecto al procesamiento semicuantitativo pero se mantiene aún por debajo de los correspondientes valores de BAL o CEP. Procedimientos adicionales: tienen por objetivo aumentar la especificidad del cultivo de secreciones traqueales y ayudar a la jerarquización del microorganismo aislado. Determinación de fibras de elastina: se mezcla una ansada de secreciones traqueales con 2-3 gotas de KOH al 40%, se calienta suavemente y se observa con 10x buscando ovillados de fibras BRITANIA 25 con puntas deflecadas. Estas fibras se producen en los pacientes con neumonía necrotizante y su determinación si bien tiene una especificidad cercana al 100% (excepto en personas con Síndrome de Distress Respiratorio del Adulto), presenta una sensibilidad del 50%. Determinación de anticuerpos ligados a bacterias: los valores de sensibilidad y especificidad son comparables a la técnica anterior pero la determinación es mucho menos práctica para realizarla diariamente. MUESTRAS TOMADAS POR FIBROBRONCOSCOPÍA Debe evitarse la succión de secreciones de la vía aérea proximal a medida que avanza el fibrobroncoscopio, como así también la introducción de lidocaína a través del canal de succión. CEPILLO PROTEGIDO (CEP) Esta muestra fué desarrollada por Wimberley en 1979,. Consiste de un cepillo dentro de una doble cánula, interna y externa, con un tapón de carbowax en el extremo distal de esta última para evitar la contaminación con secreciones orofaríngeas a medida que avanza el dispositivo a través del canal de succión del fibrobroncoscopio. Una vez ubicado éste en el sitio elegido se avanza la cánula interna y por último el cepillo y se toma la muestra, luego de lo cual se invierte el proceso retrotrayendo primero el cepillo dentro de la cánula interna, después ésta dentro de la externa y por último se retira todo el dispositivo. Se recomienda que en pacientes con injuria pulmonar difusa se realice el cepillado en el sector reconocido endoscopicamente con drenaje de secreciones francamente purulentas o bien se tomen cepillados en dos o más zonas del pulmón y/o bilateralmente. Por otra parte cuando se toman BAL y CEP conviene obtener primero este último; Meduri y col. encontraron que cuando se tomaba primero el BAL, el porcentaje de falsos positivos del CEP era de 50%, en tanto que cuando se invertía el orden el porcentaje caía al 17%. Los falsos positivos también pueden producirse en pacientes con anormalidades anatómicas. Procesamiento: la muestra puede llegar al la- boratorio de Bacteriología dentro de la doble cánula o bien en 1 ml de solución fisiológica. En el primer caso, antes de extraer el cepillo debe desinfectarse la cánula externa por fuera con alcohol etílico de 70º, luego se extrae y se corta el cepillo y se coloca en 1 ml de caldo BHI (la solución fisiológica puede disminuir los recuentos de S. pneumoniae y H. influenzae e inhibir el crecimiento de L. pneumophila) y se agita con vortex durante 1 minuto. Se siembra esta dilución y una dilución 1/1000 en agar sangre, agar chocolate, CLDE o similar y agar anaerobio; este último tiene mayor importancia en el caso de pacientes en los que se produjo una franca aspiración de contenido orofaríngeo. Las placas deben ser incubadas durante 72 horas. La coloración de Gram puede realizarse del centrifugado del líquido en que se agita el cepillo o bien directamente de un segundo cepillo. La cantidad de muestra tomada por este procedimiento es muy pequeña, alrededor de 0,01 a 0,001 ml de secreciones respiratorias, lo cual indica que un recuento de 103 ufc/ml corresponde a recuentos de 105 o 106 ufc/ml en la secreción. El punto de corte de 103 ufc/ml ha sido validado por comparación con cultivos de biopsia de pulmón a cielo abierto. La sensibilidad de esta técnica se encuentra en el orden de 80% (rango 64-100%) y la especificidad en 92% (rango 69-100%). Cuando se toman dos muestras en el mismo momento, pueden haber variaciones en 1 unidad logarítmica en 13-16% de los pacientes, ésto hace que se deban analizar muy cuidadosamente los recuentos "borderline" e idealmente se repita el procedimiento dentro de las siguientes 48 horas. Como fuera demostrado por Dreyfuss y col., sólo en 35% de estos casos, la segunda muestra tenía el mismo aislamiento, con recuentos >103 ufc/ml, y fueron confirmados clínica e histológicamente como neumonías. Esta variabilidad puede deberse al pequeño volumen de muestra tomado o a la irregular distribución de gérmenes en la secreción. También debe considerarse cautelosamente un recuento de 100 ufc/ml en pacientes que están recibiendo antibióticos. Debido a la escasa cantidad de muestra obtenida, (0.01-0.001 ml) este procedimiento no es de elección para la búsqueda de M. tuberculosis, H. capsulatum, C. immitis, P. brasiliensis y C. neoformans. BRITANIA 26 LAVADO BRONCOALVEOLAR (BAL) Consiste en la instilación y aspiración secuencial de solución fisiológica a través del broncoscopio enclavado en un subsegmento pulmonar. La infusión de al menos 100-120 ml (5 alícuotas de 20 ml) es utilizada para un adecuado estudio en adultos . En pacientes pediátricos, en cambio el volumen final no supera los 10 ml (miniBAL). En los pacientes con neumonía asociada a respirador el CEP y BAL se obtienen generalmente del subsegmento afectado del pulmón, aunque la necesidad de seleccionar un subsegmento determinado ha sido cuestionada. En el caso de neumonía en pacientes no intubados, podrían obtenerse ambas muestras BAL y CEP, reservando la biopsia transbronquial para excluir causas no infecciosas. Por otra parte, el BAL bilateral en pacientes inmunocomprometidos podría incrementar la sensibilidad para detectar algunos patógenos como P. carinii y citomegalovirus. Una variante descripta por Meduri y col., utiliza un catéter balón protegido trans-broncoscopio que se insufla cuando el dispositivo está enclavado en el lugar elegido y de esta forma ocluye la vía aérea impidiendo la contaminación con secreciones de vías respiratorias superiores, aumentando la especificidad de esta muestra a valores comparables a los del CEP. Es importante que se envíen por separado las distintas fracciones que se recuperan, ya que la primera es la mas contaminada y si bien se puede utilizar para cultivo de micobacterias, Legionella spp y micosis sistémicas, tiene el mismo valor que las secreciones traqueales para los gérmenes habituales. En este último caso la segunda o tercera porción son las ideales para realizar cultivos cuantitativos . Debe remitirse una porción al laboratorio de anatomía patológica para estudios histopatológicos. Procesamiento: Se presenta en la figura 1 (pág. 32). Interpretación Con respecto al exámen directo es fundamental que el porcentaje de células epiteliales escamosas sea < 1%, contando por lo menos 200-300 elementos entre macrófagos, células epiteliales escamosas y neutrófilos; si este porcentaje se supera se estaría en presencia de una muestra contaminada con secreciones respiratorias de vías superiores, por lo tanto si bien se puede utilizar para diagnóstico de tuberculosis y micosis sistémicas, sería de pobre utilidad para el cultivo cuantitativo bacteriano. La presencia de células ciliadas bronquiales podría tambien ser tomada de acuerdo a algunos autores como otro marcador de contaminación. La observación de macrófagos es normal, si los mismos no se visualizan, en ausencia de neutrófilos, indicaría que es una muestra muy diluída o con bajo contenido de secreciones respiratorias. Los neutrófilos por otra parte constituyen la respuesta del huésped a la infección. El hecho de no observarlos hace que la neumonía sea un proceso improbable en ese momento (en pacientes no neutropénicos) o por lo menos en el lugar donde se tomó la muestra. Por otra parte la presencia de los mismos no es específica de neumonía puesto que como se mencionó anteriormente podrían existir otras múltiples causas que expliquen su presencia. También es de utilidad evidenciar la presencia de bacterias intracelulares puesto que tienen una alta correlación con infección (especificidad 95-100%, sensibilidad 75%), aunque no esta claro cual es el porcentaje de células fagocíticas con bacterias intracelulares que indican esta condición (rango 2-25%). Debemos recordar sin embargo que las bacterias capsuladas (Ej: S. pneumoniae) son habitualmente extracelulares. Si bien existe consenso internacional para considerar a 104 ufc/ml como punto de corte, algunos autores han tomado los valores de 103 o de 105 cfu/ml. En la Fundación Favaloro sobre 241 episodios de neumonía intrahospitalaria, 86% de los casos cursaban con recuentos mayores a 104 ufc/ml, en tanto que en el grupo control solo 18% superaba este valor (p<0,001). En la tabla 5 se presenta la sensibilidad, especificidad, valor predictivo positivo y negativo e Indice de Youden para los distintos puntos de corte en el trabajo mencionado. BRITANIA 27 Tabla 5. Datos sobre 241 episodios de neumonía intrahospitalaria (Fundación Favaloro). Punto de corte (ufc/ml) Sensibilidad Especificidad V.Predictivo (+) V.Predictivo (-) Y. Youden ≥ 103 ≥ 104 ≥ 105 100 86 40 63 82 92 17 58 73 100 91 74 0.63 0.68 0.32 La mayor sensibilidad se encontró con el punto de corte de 103 ufc/ml, pero su especificidad y valor predictivo positivo fueron muy bajos. La mayor especificidad fué para el punto de corte de 105 ufc/ml pero la sensibilidad resultó muy baja. Si se analizan ambos parámetros con el Indice de Youden {(Sensibilidad + Especificidad) - 1} podemos ver que coincidiendo con el consenso internacional el mejor punto de corte fué 104 ufc/ml. Debido al mayor volumen del especimen, este procedimiento muestrea 1 millón de alveólos (1% de la superficie pulmonar) y a la dilución con solución fisiológica, los recuentos se ven menos afectados que en el caso de CEP por tratamientos antibióticos previos. El problema con tratamientos antibióticos recientes,dentro de las 48 horas de la fibrobroncoscopía, es de mayor magnitud que un curso prolongado donde hay más chances de seleccionar bacterias resistentes. Se demostró que el 93% de los cultivos de CEP y BAL han sido estériles cuando se repetían 48 horas después de iniciado el tratamiento antibiótico en pacientes en los que previamente se diagnosticó neumonía con cultivos cuantitativos. La relación del tratamiento antibiótico con falsos positivos no es tan clara aunque podría relacionarse con una propagación distal de colonizantes de tráquea más resistentes que el germen causal. Por otra parte en una revisión realizada por Meduri y Chastre, estos autores encontraban que en pacientes que estaban recibiendo antibióticos se observaba un 54% de aislamientos vs 76% en los que no lo recibían. Los falsos positivos iban de 41-60% para el CEP en el primer grupo vs 24% en el segundo. Aproximadamente un 25% de las neumonías en pacientes ventilados son polimicrobianas; Johanson y col. trabajando con mandriles intubados establecieron un Indice Bacteriano ( IB ) que se obtenía de aplicar logaritmo decimal a cada recuento individual y luego sumarlos; 77% de los lóbulos que histologicamente tenían neumonía daban un IB >6, en tanto que tan solo 7% de los que no tenían esta infección superaban dicho valor. En el mencionado estudio de la Fundación Favaloro sobre 241 episodios de neumonía intrahospitalaria, 25% eran polimicrobianas y todas superaban el valor de 6. La sensibilidad del BAL se encuentra en el rango de 72-100% y la especificidad en el rango de 69-100%. Para el BAL protegido los valores de sensibilidad están en el rango de 82-92% y los de especificidad en 83-97%. En el caso de hongos filamentosos, en pacientes inmuncomprometidos, el mayor problema es la baja sensibilidad (0-50%).La biopsia de pulmón generalmente es la muestra más importante para el diagnóstico . La colonización orofaríngea es poco frecuente y probablemente representa un factor de riesgo para infecciones invasivas en neutropénicos. En el caso de Candida spp, en cambio el principal problema es la carencia de especificidad debido a la frecuente colonización, dependiendo el diagnóstico final de la demostración de las levaduras en tejidos. No se deben aplicar puntos de corte a los cultivos para hongos. BRITANIA 28 Tabla 6 Causas de falsos positivos y negativos para BAL y CEP FALSOS NEGATIVOS FALSOS POSITIVOS Terapia antibiótica Succión de secreciones purulentas a medida que el fibrobroncoscopio avanza Incorrecta localización del fibrobroncoscopio Instilación de lidocaína a través del canal interno del fibrobroncoscopio Estadíos tempranos de la infección Terapia antibiótica Pobre retorno del BAL en pacientes con vías colapsables (enfisema) o en lóbulos inferiores Anormalidades anatómicas Retardo en el procesamiento Pacientes con EPOC Errores metodológicos al realizar diluciones o procedimientos inapropiados. Alta presión en las vías aéreas Figura 1. Procesamiento esquemático de BAL y CEP Centrifugar 10 ml, 1500-2000 rpm, 10-15’ 1 ml de caldo Sedimento BAL Fresco, Gram, Giemsa CEP Vortex 60 segundos Sembrar 0,1 ml en AS, ACH, CLDE, Agar anaerobio (CEP). Dilución final 1/10. 0,1 ml en 9,9 de solución fisiológica (1/100) Adicionales: Ziehl Neelsen*, *Kinyoun, *azul de o-toluidina *coloración fluorescente p/Legionella Sembrar 0,1 ml en AS, ACH, CLDE, Agar anaerobio (CEP). Dilución final 1/1000. BRITANIA 29 Referencias de Fig. 1 Casos especiales: AS: ACH: CLDE: Agar anaerobio: Tiempo de incubación: Atmósfera de incubación: (sospecha epidemiológica o en pacientes inmunocomprometidas) Adicionar coloraciones y medios para micobacterias, Nocardia spp, P. carinii, hongos. Utilizar el sedimento de la 1ºfracción. agar sangre agar chocolate cistina lactosa deficiente en electrolitos Agar sangre lacada suplementada con vitamina K y hermina. 72 horas AS y ACH en 5-10% de CO2; CLDE en aerobiosis, Agar anaerobio en anaerobiosis. Puede realizarse examen directo del CEP centrifugando el líquido donde se agitó el mismo o bien a partir de una segunda muestra. CRITERIOS DE INFORME PARA EL BAL Y CEP. DISTINTAS SITUACIONES 1) Recuentos por arriba del punto de corte (104 o 103 ufc/ml respectivamente) y respuesta inflamatoria importante (>10 neutrófilos/1000x) con /sin bacterias en el examen directo A) Unico microorganismo: tipificación y antibiograma B) Dos o tres microorganismos: tipificación y antibiograma de cada uno, informe del recuento individual y del Indice Bacteriano. 2) Recuentos "Borderline" (103 y 102 ufc/ml respectivamente) A) Con respuesta inflamatoria: tipificación y antibiograma del o los microorganismos. B) Sin respuesta inflamatoria: probable contaminación (quedan excluídos de esta consideración los pacientes neutropénicos) Evaluar factores que afectan los recuentos bacterianos, especialmente el tratamiento antibiótico instaurado dentro de las 24 horas de realizada la fibrobroncoscopía. Sugerir nueva muestra dentro de las 48 horas. LAVADO BRONQUIAL Tiene las mismas limitaciones que el cultivo de secreciones traqueales para gérmenes comunes, por lo tanto su principal utilidad en pacientes intubados reside en la búsqueda de micobacterias, micosis sistémicas, Nocardia spp y Rhodococcus equi. BIOPSIA TRANSBRONQUIAL Se obtiene con forceps que se pasan a través del canal de trabajo del broncoscopio y se toma muestra de alveólo y/o de tejido peribronquial. Es importante para la realización de técnicas histopatológicas en el diagnóstico de neoplasias, sarcoidosis. Tambien en pacientes con SIDA para el diagnóstico de P. carinii y tuberculosis. Permite observar invasión de tejidos por hongos y herpes virus. Debido al problema potencial de contaminación con secreciones respiratorias superiores, la especificidad para el cultivo de gérmenes comunes puede ser baja, como así tambien la sensibilidad debido al pequeño tamaño de la muestra. El procesamiento se discutirá junto con el de biopsia de pulmón a cielo abierto. 3) Recuentos bajos (102 y <10 ufc/ml respectivamente), con o sin respuesta inflamatoria. A) Cultivo negativo BRITANIA 30 Tabla 7 Comparación entre distintas técnicas fibrobroncoscopicas. Muestra broncoscópica Sitio anatómico Cantidad de muestra Dilución Punto de corte (ufc/ml) Lavado bronquial Bronquios 10-20 ml 1/10-1/100 Cepillo protegido Bronquiolos 0,01-0,001 ml 1/1000 103 Lavado broncoalveolar Alveólos 10-100 ml 1/10-1/100 104 Biopsia transbronquial Parénquima pulmonar 0,1 g Tabla 8 Utilidad de distintas técnicas broncoscópicas para el aislamiento de distintos gérmenes. Escala de 0-3 Microorganismos Lavado bronquial CEP BAL Biopsia transbronquial P. carinii 2 1 3 3 M. Tuberculosis 3 0 2 3 Bacterias “habituales” 0 3 3-2 0 Legionella spp 1 1 2 1 Nocardia spp 3 ND 2 1 Candida spp 0 0 1 2 Aspergillus spp 0 0 1 2 Micosis sistémicas 2 1 2 1 Ventajas del BAL sobre el CEP • Menor costo. • Menos afectado por el uso previo de antibióticos. • La muestra es de mayor volumen lo que permite la realización de diferentes técnicas diagnósticas. • Es una muestra válida para la búsqueda de micobacterias y hongos de micosis sistémicas, no así para anaerobios a menos que se utilize la técnica protegida descripta por Meduri. • El exámen directo provee información inmediata para el manejo del paciente con neumonía nosocomial. En pacientes intubados con sospecha clínica de neumonía, la real utilidad de la broncoscopía es excluir neumonía o bien documentar , en el caso de pacientes con esta infección, un germen distinto al aislado en las secreciones traqueales. La elección de un tratamiento antibiótico adecuado es tan crítica como establecer la verdadera presencia de neumonía puesto que tratamientos erróneos constituyen un importante factor de riesgo en la mortalidad atribuible a estas infecciones. Dentro de las principales complicaciones de la fibrobroncoscopía se encuentran hipoxemia, sangrado, arritmias y neumotórax .La frecuencia de presentación de las mismas depende del tipo de procedimiento y de la enfermedad de base del paciente. BRITANIA 31 El procesamiento de estas muestras es idéntico al de las muestras broncoscópicas, como así tambien los puntos de corte considerados. Sin embargo solo el CombiCath ha sido convenientemente evaluado contra un “gold standard” como la biopsia de pulmón. La sensibilidad se encuentra en el rango de 60-100% y la especificidad en el orden de 69100%. También se ha descripto una técnica de aspirado con catéter protegido telescópico; en este caso se inserta un catéter con un tapón de carbowax en el árbol bronquial, a ciegas, hasta que el dispositivo no avanza más, luego se retrotrae 1cm, se expulsa el tapón y se aspira aproximadamente 0,01 ml de secreción. Se corta y envía la punta del catéter que se procesa en forma similar al CEP, siendo el punto de corte 103 ufc/ml. La sensibilidad se encuentra en el orden del 60-70% y la especificidad en 84-100%. MUESTRAS NO BRONCOSCÓPICAS Existe una variedad de estas técnicas que poseen las ventajas potenciales de ser menos invasiva, de tener un costo inicial menor al de la broncoscopía, menor compromiso del paciente con respecto al intercambio de gases, posibilidad de realizarlas en pacientes con tubos endotraqueales pequeños, realización por cualquier médico sin necesidad de recurrir al neumonólogo, independizarse de la habilidad o capacidad del operador. Dentro de las desventajas está la posibilidad de error en la toma de muestra debido a que se realiza a ciegas y a que se instila un volumen de solución fisiológica mucho menor, (aproximadamente 10 ml.). Se han realizado CEP no broncoscópicos utilizando distintos tipos de catéteres como Metras, catéteres 15-Fr, nasotraqueales, etc; También se ha realizado BAL a través de distintos sistemas de doble catéter. Tabla 9 Comparación de técnicas no broncoscopicas TIPO DIRIGIDO VOLUMEN (ml) COMPARACION CULTIVO CUANTITATIVO COMBICATH NO 20 H/PMC SI (>103 UFC/ml) CATETER PARA DUODENOGRAFIAS NO 100-150 CLINICA SI (>104 UFC/ml) BAL-Cath SI 25-100 CEP-BAL SI (>104 UFC/ml) SWANZ-GANZ NO 150 H NO CATETERES DE SUCCION NO 20 CLINICA SI H/PMC Diagnóstico histológico post morten. MUESTRAS ADICIONALES BIOPSIA DE PULMÓN A CIELO ABIERTO Si bien se considera el "gold standard", cuando esta muestra es demasiado pequeña puede tener falsos negativos en aproximadamente un 25% de los casos si se compara con el pulmón entero. Proporciona un diagnóstico definitivo y exacto, pese a esto raramente se indica en el manejo de pacientes ventilados puesto que ha sido relegado a un segundo lugar por las técnicas broncoscópicas; se la utiliza para aquéllos pacientes que no evolucionan de acuerdo a lo esperado y/o en los que no se ha podido llegar al diagnóstico por métodos menos invasivos. Los resultados de este procedimiento han sido superiores a los de la biopsia transbronquial y a los de BRITANIA 32 la punción pulmonar percutánea, debido a que en general se puede tomar una muestra de tamaño suficiente y bajo visualización directa. El procesamiento microbiológico de rutina, previa homogeneización con mortero o Stomacher, debería contemplar la mayor cantidad de posibilidades (gérmenes comunes, anaerobios, micobacterias, nocardia, Legionella, hongos y P.carinii) y también debería remitirse una porción de la muestra para estudios histopatológicos. En pacientes sin tratamiento antibiótico se deben jerarquizar recuentos superiores a 104 ufc/g de tejido. Tabla 10 Procesamiento rutinario de biopsias de pulmón CULTIVO • CULTIVO CUANTITATIVO EN AGAR SANGRE Y EXAMEN DIRECTO • EXAMEN EN FRESCO COLORACIONES DE: • GRAM • GIEMSA • ZIEHL NEELSEN • KINYOUN • COLORACION FLUORESCENTE CON ANTICUERPOS POLICLONALES PARA LEGIONELLA • AZUL DE O-TOLUIDINA AGAR CHOCOLATE EN 5-10% DE CO2 • CLDE EN AEROBIOSIS • AGAR BHI SUPLEMENTADO CON VITAMINA K, HEMINA Y SANGRE LACADA, EN ANAEROBIOSIS • LOWENSTEIN- JENSEN Y STONEBRINK Y/O SIEMBRA EN FRASCOS DE BACTEC O BACTALERT PARA MICOBACTERIAS • AGAR SABOURAUD Y AGAR BHI CON ANTIBIOTICOS HEMOCULTIVOS Aproximadamente un 10% de los pacientes con neumonía asociada a respirador tienen hemocultivos positivos relacionados a este foco. En este grupo de riesgo la especificidad de esta muestra es baja, puesto que 60-70% de los hemocultivos positivos se producen a partir de un foco distinto al pulmonar. De todas formas es una muestra complementaria importante, sobre todo cuando se analiza en conjunto con el cultivo cuantitativo de BAL o CEP y puede ayudar a clarificar la interpretación de recuentos "borderline" en estas muestras. Tambien es necesario analizar en paralelo el cultivo de otros potenciales focos como ser urocultivo, catéteres, punción de heridas quirúrgicas, de senos paranasales , muestras intraabdominales, etc. Situaciones especiales Legionella spp Se aisló en 2-6% de los casos de neumonía de la comunidad en USA. La población en riesgo, está constituído por personas expuestas a fuentes contaminadas, gerontes, fumadores, y huespedes comprometidos en la inmunidad celular (transplantados). Se han identificado 15 serogrupos de L. pneumophila y 33 especies adicionales. El serogrupo 1 es responsable de cerca del 80% de las infecciones causadas por L. pneumophila. El resto de los casos corresponde a los serogrupos 4 y 6. Otras especies como L. micdadei, L. longbeache, L. durmoffii y L. bozemanii producen menos del 20% de los casos. Las indicaciones para su búsqueda son enfermedades severas que requieren internación en UCI, evidencias de adquisición en áreas endémicas o epidémicas, falta de respuesta al tratamiento con beta lactámicos, neumonía en inmunocomprometidos y sospecha clínica en base a fiebre alta, hiponatremia, manifestaciones a nivel de SNC, niveles de LDH mayores a 700 U/ml y enfermedad severa. Las muestras que presentan mejor rendimiento para su aislamiento son el BAL y la biopsia de pulmón, aunque también se ha recuperado de esputo, líquido pleural, secreciones traqueales, la- BRITANIA 33 vado bronquial, hemocultivo y otros materiales. Para el diagnóstico se puede recurrir a coloraciones fluorescentes con anticuerpos monoclonales, cultivos en medios selectivos suplementados con carbón, extracto de levadura y alfa ceto- glutarato (BCYE), detección de antígeno urinario para L. pneumophila serotipo 1 por RIA o ELISA, serología por inmunofluorescencia indirecta y PCR. (Tabla 11) Tabla 11 Sensibilidad y especificidad para las distintas metodologías de diagnóstico para Legionella spp. Metodo Cultivo Muestra Sensibilidad Especificidad Esputo, BAL 75-90 100 Biopsia de pulmón 90-99 100 Hemocultivo 10-30 100 Serología (IFI) Suero 75 Coloración fluorescente con anticuerpos monoclonales Esputo, BAL Biopsia de pulmón Antígeno urinario PCR Tiempo Observaciones 2-7 días SF utilizada en el BAL puede inhibir el desarrollo. 95-99 6-9 semanas Se requiere suero agudo y convalesciente. 25-75 95-99 1 día Detecta serogrupo1. No es sensible para otras especies. Reacciones cruzadas con B.pertussis. Orina 80-90 99 1 día Específica para serogrupo 1 Puede ser positivo, meses despues del tratamiento. Esputo, BAL, Hisopados nasofaríngeos >90 >90 2 días No disponible comercialmente. Mycoplasma spp y Chlamydia spp En un estudio sobre neumonía de la comunidad realizado en el Hospital de Clínicas de Bs. As. se documentó durante el año 1997, una incidencia de M. pneumoniae del 8% y C. pneumoniae de 6.8%. El diagnóstico de estos agentes se basa principalmente en demostrar la seroconversión. Ambos microorganismos pueden ser cultivados de muestras respiratorias como esputo, hisopado o aspirados nasofaríngeos, BAL, etc, pero esto es dificultoso y escapa a las posibilidades de la mayoría de los laboratorios clínicos. El diagnóstico utilizando PCR constituirá en el futuro una importante herramienta. C. pneumoniae es un importante agente etiológico de neumonía en la población general y en pacientes inmunocomprometidos, C. psittaci produce neumonía en pacientes que tuvieron contacto con aves y C. trachomatis en recién nacidos que adquieren el microorganismo de madres con infección genital. BRITANIA 34 Tabla 12 Diagnóstico de laboratorio de M.pneumoniae. Comparación de técnicas Método Muestra Sensibilidad Especificidad Tiempo Observación Cultivo Esputo, BAL >90 50-90 7-10 días Serología F.de C* Suero 75-80 80-90 4-9 semanas Se requiere suero agudo y convalesciente. Si solo se dispone del último considerar: >1/64 33-75 <50 2-6 semanas Inespecífico 95 95-99 2 días No se dispone comercialmente. Crioaglutinac. PCR Esputo, BAL, aspirado o hisopado nasofaríngeo F. de C.: Fijación de complemento. Tabla 13 Diagnóstico de laboratorio de C. pneumoniae. Comparación de técnicas Método Muestra Sensibilidad Cultivo Hisopado nasofaríngeo 50-90 SerologíaMIF Suero 50-90 Especificidad Desconocido Tiempo 6 días Se requiere medios de transporte especiales y líneas celulares HL o Hep-2 4-6 semanas Incremento en el el título de 4 veces o título individual de IgM>1/16 o IgG>1/512 F de C* Suero 30-40 <50 4-6 semanas PCR Hisopado nasofaríngeo, BAL 80-90 >85 2 días Rhodococcus equi Este microorganismo inicialmente fue aislado de caballos, pero recientemente empezó a adquirir relevancia en huéspedes inmunocomprometidos, principalmente en pacientes infectados con Observaciones Reacciones cruzadas con C.psittaci y C.trachomatis No disponible comercialmente el virus del HIV, enfermedades malignas y tratamiento inmunosupresor. El cuadro clínico incluye fiebre, tos y neumonía necrotizante, frecuentemente acompañada de bacteriemia . Debe realizarse el diagnóstico diferencial con M. tuberculosis, Nocardia spp y hongos. BRITANIA 35 Se han realizado aislamientos de muestras como esputo, lavado bronquial, líquido pleural, biopsia de pulmón, hemocultivos, abscesos cerebrales, pelvianos, subcutáneos, paraespinales, muestras óseas, senos paranasales, LCR, etc. Se presenta como cocobacilos gram positivos y puede observarse en los cultivos frescos una débil ácido resistencia con la coloración de Kinyoun. Esta propiedad se pierde con el envejecimiento de los mismos. Si bien las colonias presentan característicamente un pigmento rosa salmón, algunos aislamientos pueden ser de color crema o amarillentos. Debe realizarse la diferenciación bioquímica con los géneros Gordona, Tsukamurella y otros difteroides; para ello se recurre a la hidrólisis de la caseína, hipoxantina, tirosina, xantina, gelatina, urea y a la reducción del nitrato a nitrito. Nocardia spp Las infecciones por este germen son generalmente oportunistas y ocurren en pacientes con condiciones predisponentes como neoplasias, desórdenes pulmonares crónicos y en personas bajo tratamiento inmunosupresor. Otros grupos de riesgo son los pacientes con disgamaglobulinemia, enfermedad granulomatosa crónica, transplante renal y cardíaco. El sitio primario de infección suele ser el pulmón y de allí puede producirse la diseminación a otros focos. Las especies más frecuentemente aisladas en el ser humano son N. asteroides, N. brasiliensis y N. otitidis caviarum. Las mejores muestras para su aislamiento son el BAL, lavado bronquial, biopsia de pulmón. Es rara su recuperación a partir de muestras de esputo. En el exámen directo, la coloración de Kinyoun permite poner en evidencia a los bacilos o cocobacilos ácido resistentes. Los medios con carbón y extracto de levadura son útiles para su aislamiento, aunque tambien puede recuperarse de Lowenstein Jensen y agar Sabouraud Micobacterias Para su detección, el esputo sigue siendo la muestra de primera elección, pero en pacientes que no expectoran puede recurrirse al lavado gástrico, esputo inducido o bien a muestras tomadas por fibrobroncoscopía (BAL, lavado bronquial o biopsia transbronquial). Se recomienda tomar tres muestras sucesivas de esputo , preferentemente las primeras de la mañana, dada la liberación intermitente del bacilo. Algunos autores documentan una mejor sensibilidad con el lavado bronquial que con BAL, pero estas muestras pueden ser complementarias. También puede obtenerse esputo post broncoscopía. Para el exámen directo puede recurrirse a la coloración de Ziehl Neelsen o a la de auraminarodamina, con sensibilidad y especificad comparables. En el caso del cultivo puede recurrirse a técnicas de precipitación o de centrifugación, utilizando agentes decontaminantes como el NaOH al 4% o N- acetilcisteína con NaOH al 2%, luego se siembra en Lowenstein Jensen y medio de Stonebrink y/o en medios 7H9, 7H10, 7H11. El tiempo de aislamiento se encuentra entre 4-8 semanas. Los métodos de cultivo radiométricos (BACTEC) permiten disminuir el tiempo de detección en forma considerable . En la actualidad se encuentran en evaluación medios no radiopmétricos tanto para el sistema BACTEC como para el Bact-Alert. Estas técnicas pueden combinarse con sondas de DNA. Otras metodologías empleadas son PCR y ELISA. Las micobacterias atípicas producen enfermedad en pacientes inmunocomprometidos, y también en menor proporción en personas inmunocompetentes. Para jerarquizar su aislamiento se debe considerar evidencia clínica, radiológica e histopatológica; aislamiento repetido con alto número de colonias o de muestras "estériles" y ausencia de otras causas de enfermedad. Anaerobios Se los aisla en 85-95% de los abscesos de pulmón, 62-100% de las neumonías aspirativas, y en 22-33% de las neumonías de la comunidad. En los pacientes con asistencia respiratoria mecánica que desarrollan neumonía se recuperan con poca frecuencia, menos del 10%. Las muestras válidas para cultivo son la pun- BRITANIA 36 ción transtraqueal, punción pulmonar percutánea, biopsia de pulmón a cielo abierto, cepillo protegido (punto de corte de >103 ufc/ml) y BAL protegido (punto de corte de > 104 ufc/ml). Los especímenes deben ser sembrados en agar sangre lacada suplementada con vitamina K y hemina, con y sin antibióticos (aminoglucósidos) y caldo cerebro corazón suplementado , Los medios sólidos se incuban por 48 horas como mínimo y los caldos por 7 días, ambos en atmósfera de anaerobiosis. P. carinii Las mejores muestras para su detección son el BAL y la biopsia transbronquial, (sensibilidad >90%)aunque la sensibilidad del esputo induci- do con solución hipertónica se encuentra en el rango de 50-90%. En los pacientes que reciben pentamidina aerolizada como profilaxis, la sensibilidad del BAL y del esputo inducido se ve afectada, debiendo realizarse múltiples lavados que incluyan a los lóbulos medios y superiores o recurrir a la biopsia transbronquial. El diagnóstico se realiza a través de coloraciones dirigidas a la pared del quiste como azul de o-toluidina y metenamina plata o bien aquéllas dirigidas contra trofozoítos o esporozoítos intraquísticos como las de Giemsa y Diff Quik. También puede realizarse inmunofluorescencia directa con anticuerpos monoclonales. Recientemente se ha aplicado la metodología de PCR con excelentes resultados. BIBLIOGRAFIA -Baselski, V. Microbiologic diagnosis ventilator-associated pneumonia. Infectious Disease Clinics of North America. 7 :331-357. 1993. -Baselski, V; Wunderink, R. Bronchoscopic diagnosis of pneumonia. Clin Microbiol Rev.7:533-557. 1994. -Baselski, V. Practical Laboratory guidelines for performing respiratory cultures on patients with ventilator-associated pneumonia. Clin Microbio. Newsletter. 9:65-69. 1994. -Barlett, J; Breiman, R; Mandell, L; File, T. Comunity-acquired pneumonia in adults: Guidelines for management. Clin Infect Dis.26:811838, 1998. -Barlett, J.; y col..Laboratory diagnosis of lower respiratory tract infection. Cumitech 7A. In Washington JA (ed. Washington DC American Society for Microbiology), 1-18.1987. -Baughman, R. Use of bronchoscopy in the diagnosis of infection in the immunocompromised host.Thorax.49:3-7.1994. -Coalson, J. The pathology of nosocomial pneumonia. Clinics in Chest Medicine.1:13-29., 1995. -Dreyfuss, D; y col.Clinical significance of borderline quantitative protected brush specimen culture results. Am Rev Resp Dis. 147:946951.,1993. - Fagon, J; y col.Evaluation of clinical judgment in the identification and treatment of nosocomial pneumonia in ventilated patients. Chest.103:547-553. 1993. - Famiglietti, A.; y col. Etiología de la neumonía adquirida en la comunidad en pacientes adultos. Utilidad de los métodos diagnósticos de laboratorio. Libro de Resúmenes VIII Congreso Argentino de Microbiología. Bs. As. 1998. - Finegold, S.; y col..Aspiration pneumonia. Rev Infect Dis.13(Suppl 9):S37-S42.1991. -Forceville, X.; y col..Reliability of quantitative cultures of PSB and BAL conserved at 4ºC during 48 hours. Libro de Resúmenes (J114) del 35th ICAAC Meeting. 1995. -George, D. Epidemiology of nosocomial pneumonia in the intensive care unit. Clinics in Chest Medicine.1:29-45.1995. -Johanson,W; y col. Bacteriologic diagnosis of nosocomial pneumonia following a prolonged mechanic ventilation. Am Rev Respir Dis. 137:259-264. 1988. - Kim, J.; y col..Nocardial infection as a complication of AIDS: report of six cases and review. Rev Inf Dis.13:624-629.1991. BRITANIA 37 -Meduri, U. Diagnosis and differential diagnosis of ventilator-associated pneumonia. Clinics in Chest Medicine.1:61-93.,1995. -Meduri, U. Protected bronchoalveolar lavage. Am Rev Respir Dis.143:855-864,1991. -Meduri, U; Chastre, J. The standarization of bronchoscopic techniques for ventilator-associated pneumonia. Chest. 102(suppl 1):S 557- S 564.,1992. -Morris, A.; y col..Rejection criteria for endotracheal aspirates from adults. J. Clin. Microbiol.31:1027-1029.1993. - Mundy, P.; y col. Community-acquired pneumonia: impact of immune status. Am J Respir Crit Care Med. 152:1309-1315.1995. - Pham, L.; y col. Diagnosis of nosocomial pneumonia in mechanically ventilated patients. Comparison of a plugged telescoping catheter with the protected specimen brush. Am Rev Respir Dis .143:1055-1061.1991. -Salata, R.; y col. Diagnosis of nosocomial pneumonia in intubated intensive care unit patients. Am Rev Respir Dis.135:126-132.1987. - Scott, M.; y col. Rhodococcus equi-An increasingly recognized opportunistic pathogen. Am J Clin Pathol.103:649-655.1995. - Scott, M.; y col. Rhodococcus equi. An increasingly recognized opportunistic pathogen. AJCP.Nº5,1995. - Sepkowitz, K.; y col..Tuberculosis in the AIDS era. Clin.Microbiol Rev.!80-199. ,1995. -Shelhamer, J.; y col. The laboratory evaluation of opportunistic pulmonary infections. Ann Inter Med.Nº 6:585-599.1996. - Shelhamer, J.; y col.. Respiratory disease in the immunosuppressed patient. Ann Intern Med 415-431.,1992. -Soloaga, R.; y col. Quantitative cultures of lower respiratory secretions by bronchoalveolar lavage and protected specimen brush techniques: role in the diagnosis of nosocomial pneumonia. Libro de Resúmenes del 37th ICAAC Meeting, Toronto, Canada. 1997. -Soloaga, R.; y col.Neumonía nosocomial: diagnóstico bacteriológico. Infect, Microb, Clín. 6:144-161.,1995. - Souweine, B.; y col..Impact of prior antibiotic treatment on quantitative cultures of pretected specimen brush in patients with ventilatorassociated pneumonia. Libro de Resúmenes (J114) del35th ICAAC Meeting, 1995. -Tokumoto, M.; y col. ¿Es posible la conservación del lavado broncoalveolar a 4ºC? Informe preliminar Libro de Resúmenes del I Congreso Internacional de Infectología y Microbiología Clínica (SADI-SADEBAC) Bs. As. Argentina. 1997. -Wimberley, N; y col.Use of a bronchoscopic protected catheter brush for the diagnosis of pulmonary infections. Chest. 81:556-562.1982. -Winterbauer,R; y col. The use of quantitative cultures and antibody coating of bacteria to diagnose bacterial pneumonia by fiberoptic bronchoscopy. Am Rev Respir Dis.128:95103.,1983. - Wunderink, R.; The diagnosis of nosocomial pneumonía. Pulmonary and Critical Care Update. 2:1-10-1994. - Yungbluth, M.; The laboratory diagnosis of pneumonia. Clinics in Laboratory Medicine. Nº 2.1995. -Zaidi, A.; y col.. Rejection criteria for endotracheal aspirates from pediatric patients. J Clin Microbiol.34::352-354.1996. BRITANIA 38 M E D I O S D E T R A N S P O R T E LABORATORIOS BRITANIA s.a. Los Patos 2175 (1283) Buenos Aires - Argentina Tel: 0054-11- 4306-0041 Fax: 0054-11- 4304-1623 Use nuestro nuevo servicio, consulte por Fax al 0-800-333-HEMO (0-800-333-4366). email: [email protected]