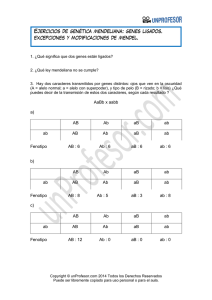
Un Paciente con Para´lisis Prolongada
Anuncio

Clinical Chemistry 58:3 496–501 (2012) Estudio de Caso Clı́nico Un Paciente con Parálisis Prolongada JoDell E. Whittington,1 Hoai D. Pham,2 Melinda Procter,3 David G. Grenache,1,3 y Rong Mao1,3* CASO Un varón asiático de 19 años sin historia médica notable que fue presentado en el departamento de emergencia con una historia de 12 horas de dolor abdominal agudo. La condición del paciente fue diagnosticada como apendicitis aguda y se sometió a una apendicectomı́a laparoscópica emergente. Se le administró una dosis de 1 mg de vecuronio seguido de 120 mg de succinilcolina para inducir parálisis y facilitar la intubación endotraqueal. Se monitoreó la progresión de la relajación muscular del paciente intra-operativamente con un monitor de cuatro contracciones en cadena y fue marcado por un estı́mulo más bajo haciéndolo a través de uniones neuromusculares. En cirugı́as generales, es adecuado un bloqueo neuromuscular de hasta 2 contracciones para la inducción de secuencia rápida. Normalmente, con una dosis de 0.5 a 2 mg de succinilcolina por kilogramo de peso corporal se elimina completamente la respuesta del músculo a la estimulación nerviosa. Entre 2 y 2.5 min, la unión neuromuscular comienza a mostrar signos de recuperación, o contracciones. En este caso, se le administró al paciente 1.7 mg/kg de succinilcolina. Después de que se concluyera la apendicectomı́a, sin embargo, el paciente de manera no caracterı́stica permaneció paralizado por 1.75 hs. No mostró contracciones musculares, ni esfuerzo inspiratorio espontáneo y no hubieron reflejos protectores en las vı́as aéreas. Subsecuentemente requirió calmantes y soporte ventilatorio asistido. DISCUSIÓN Las colinesterasas son enzimas que catalizan la hidrólisis de los esteres de colina. La acetilcolinesterasa se distribuye en la materia gris del sistema nervioso central, en donde termina la transmisión sináptica por hidrolización especı́fica del neurotransmisor acetilcolina (1, 1 Departamento de Patologı́a, Universidad de Utah Escuela de Medicina, Salt Lake City, UT; 2 Departamento de Anestesiologı́a, Universidad de Minnesota, Minneapolis, MN; 3 Instituto ARUP para Patologı́a Clı́nica y Experimental, Salt Lake City, UT. * Dirigir correspondencia al autor a: ARUP Laboratories, 500 Chipeta Way, Salt Lake City, UT 84108-1221. E-mail [email protected]. Recibido para publicación Febrero 17 de 2011; Aceptado para publicación Junio 13 de 2011. 4 Abreviatras no estándar: BChE, butirilcolinesterasa; DN, número de dibucaı́na. 496 PREGUNTAS A CONSIDERAR 1. ¿Cuáles son las propiedades farmacodinamia de la succinilcolina? 2. ¿Cuál es el papel de la butirilcolinesterasa en la farmacoquinesia de la succinilcolina? 3. ¿Qué condiciones pueden causar la recuperación retrasada de la administración de la succinilcolina? 4. ¿Qué pruebas adicionales debieron ser usadas para evaluar posteriormente a este paciente? 2 ). La butirilcolinesterasa (BChE), 4 también conocida como pseudocolinesterasa, se distribuye en la materia blanca del sistema nervioso central y en la sangre. Sin embargo, no ha conocido la función fisiológica, la BChE es de importancia farmacológica y toxicológica (1 ). A diferencia de la acetilcolinesterasa, la BChE es capaz de hidrolizar los ésteres del carboxil exógeno o ácido fosfórico encontrados en la succinilcolina, aspirina, mivacurium, anestésicos de tipo éster local, amitriptilina, cocaı́na, heroı́na y varias drogas todas anticonvulsivas (3 ). La succinilcolina, un agente bloqueador neuromuscular comúnmente usando procedimientos quirúrgicos para apoyar la intubación endotraqueal, actúa como un bloqueador neuromuscular deopolarizante por imitación de la acción de la acetilcolina, por tanto generando una acción potencial en la placa motora. La acción de la succinilcolina se determina por su difusión lejos de la placa motora en la sangre, en donde es hidrolizada por BChE (3 ). Normalmente se restaura la función muscular aproximadamente 10 minutos después de suspender la droga. El bloqueo extensivo con succinilcolina ocurre en un arreglo de individuos que tiene variantes de BChE a los que les falta aún suficiente cantidad de la enzima o demuestran un descenso de afinidad por el sustrato, por tanto causan parálisis prolongada. La BChE es el producto del gen BCHE (butirilcolinesterasa) en el cromosoma 3 región 3q26. El gen consiste de 73 kilobases en 4 exones separados por 3 intrones (3 ). Las mutaciones del gen BCHE codifican en productos de proteı́na BChE con reducciones variantes en actividad que producen bloqueo extendido y apnea en pacientes después de la exposición a la suc- Estudio de Caso Clı́nico Tabla 1. Caracterı́sticas asociadas con fenotipos de BChE. Fenotipo BChEa Actividad BChE, U/L DN, % Susceptibilidadb Frecuencia U 3300–10300 83–88 Ninguna 96% A 1600–4100 24–31 Mucha 1 en 3000 F 1600–4101 79–81 Algo 1 en 150 000 1 en 40 000 S Nada Mucha UA 1930–7300 0–650 72–79 Poca 3% UF 1260–5800 80–83 Poca Raro US 1300–5100 83–87 Poca 1 en 150 AS 540–1800 24–31 Mucha 1 en 8000 AF 800–3100 60–71 Algo Raro FS 1000–3800 78–84 Algo Raro a U, fenotipo inusual; A, fenotipo atı́pico; F, fenotipo resistente al fluoruro; S, fenotipo silencioso. Otros fenotipos son combinaciones heterocigóticas del U, A, F y S. Susceptibilidad a la parálisis inducida por agentes bloqueadores neuromusculares que requieren actividad metabólica vı́a BChE. b Frecuencia de fenotipos BChE entre la población general. b cinilcolina. Estas variaciones de enzimas genéticamente determinadas están caracterizadas por producción decreciente de BChE (variantes cuantitativas) o por la producción de moléculas disfuncionales de BChE que han descendido a la no actividad (variantes cualitativas) (2 ). La deficiencia de BChE por lo general es reconocida solo después de periodos de experiencias individuales inesperadas de parálisis prolongada después de la administración de succinilcolina. Una prueba bioquı́mica de los años 50 para la identificación de fenotipo de variantes de BChE ayudó a determinar el efecto farmacogenético de las variantes de BChE era familiar (4 – 6 ). La prueba cuantifica la actividad de la enzima BChE en el suero en la presencia y ausencia del inhibidor competitivo dibucaı́na, permitiendo el cálculo de un “número de dibucaı́na” (DN) que corresponde al porcentaje de inhibición enzimática: DN ⫽ [1⫺(actividad de BChE inhibida)/ (Actividad total de BChE)] ⫻ 100, en donde la actividad de es en unidades por litro. Juntas la actividad de BChE y el DN pueden ser usados para determinar un fenotipo bioquı́mico individual. (Tabla 1). Con la prevalencia del 96%, el fenotipo más común es el usual (U), el cual se caracteriza por un DN ⬎80%. Los individuos con este fenotipo responden normalmente a la administración de succinilcolinasa con recuperación de la unión neuromuscular, la recuperación alcanzó los 10 min después de la exposición. En contraste, los individuos con el fenotipo atı́pico A tuvieron un DN ⬍32% y la experiencia de la parálisis prolongada después de la exposición a la succinilcolinasa. Un alelo único con una frecuencia de 1 en 3000 es conocido como productor del fenotipo A (4 ). Aproxi- madamente el 3% de los individuos tienen el fenotipo heterocigótico UA fenotipo y demuestran propiedades clı́nicas y bioquı́micas entre los fenotipos U y A. El fenotipo resistente al fluoruro (F) muestra resistencia creciente a la inhibición por fluoruro y reduce la habilidad individual para hidrolizar la succinilcolinasa.Existen dos mutaciones conocidas de mutaciones conocidas resistentes al fluoruro, pero su frecuencia es muy rara (1 en 150 individuos) (7 ). Individuos con un fenotipo con raro silencio (S) completamente cerrado. Hay tres variantes cuantitativas de BChE que han sido descrito: James (J), Kalow (K) y Hammersmith (H). Todas tienen actividad normal del sustrato enlazante pero muestran concentraciones descendentes en el plasma (2 ). Las reducciones leves en la actividad de BChE debidas a las variantes cuantitativas no causan por lo general una respuesta prolongada importante a la succinilcolina. Estas variantes pueden afectar probablemente la duración de respuesta cuando están presentes con otros factores que tienen influencia en la actividad de la BChE, tal como variantes cualitativas de BChE, embarazo y drogas anti-colinesterasa (9 ). SEGUIMIENTO DEL PACIENTE Se obtuvo una muestra de sangre para comprobar la actividad de BChE y DN. La primera fue de 57 U/L (intervalo de referencia, 3300-10 300 U/L) y la DN fue de ⬍5% (intervalo de referencia, 83%– 88%). Después de un periodo de 4 horas más allá de la duración esperada para la acción de la succinilcolina, el paciente recuperó su fuerza y cumplió el criterio para extubación. Fue dado de alta del hospital 27.5 hs Clinical Chemistry 58:3 (2012) 497 Estudio de Caso Clı́nico Fig. 1. Resultados de la secuencia de BCHE identificando una mutación única hemicigoto/homocigoto: 1240 CT (p.Arg414Cys, conocido como Arg386Cys) en exon 2. después de la cirugı́a. Debido a que la succinilcolina se enlaza con el sitio activo de la BChE, su presencia en el plasma producirá una falsa baja de resultados de la actividad de BChE y DN. En el caso que se reporta, la prueba inicial de BChE se realizó en una muestra recolectada cuando la succinilcolina estaba probablemente circulando en la sangre del paciente. Se tomó una segunda muestra obtenida 8 dı́as después para repetir la evaluación de la actividad de la BChE y la DN; los resultados fueron 89 U/L y ⬍5% respectivamente. Este hallazgo de la BChE en conjunto con la baja de la DN (⬍5%) sugirió que el paciente tenı́a el fenotipo S 498 Clinical Chemistry 58:3 (2012) (Tabla 1). El conocimiento del fenotipo es importante debido a que podrá guiar las decisiones en relación con cualquier uso futuro de la succinilcolina. Para entender mejor la causa genética de la reducción de actividad de la BChE del paciente, realizamos una secuencia de BCHE. La amplificación de PCR de las tres regiones de codificación y los lı́mites del intron/ exón del gen BCHE fue realizada con cebadores M13 atados. Los cebadores no incorporados y los trifosatos desoxinucleótidos fueron inactivados por incubación con ExoSAP (USB Corporation). Se realizó una secuenciación bidireccional de ADN con quı́mica Big- Estudio de Caso Clı́nico Dye Terminator (Applied Biosystems) y cebadores M13 y el producto se analizó en el Analizador Genético ABI 3100 (Applied Systems). Los datos fueron analizados con el software Mutation Surveyor (SoftGenetics) comparando la secuencia generada a la de referencia de BCHE (Genbank NC_000003.11). La secuencia de BCHE identificó una mutación homocigótica: c.1240T (p.ARG414Cys, conocida como Arg386Cys en la proteı́na madura) en exón 2 (Fig. 1). Esta rara mutación ha sido reportada previamente solo como un heterocigoto y con una importancia clı́nica desconocida (10, 11 ). El caso aquı́ presentado establece que la variante de BCHE Arg414Cys en estado homocigoto produce parálisis prolongada ante la exposición a succinilcolina, de acuerdo con un fenotipo S. La Arg414Cys es probablemente una mutación equivocada que causa inactivación del sitio activo de la BChE. A pesar de que la comunidad de anestesistas está prevenida de que algunos individuos podrı́an tener variantes de la BChE con actividad catalı́tica reducida, las pruebas de BChE y DN son realizadas con poca frecuencia, la mayorı́a de las veces debido a la relativa baja incidencia de variantes de BChE dentro de la población en general. Hacer las pruebas es frecuentemente solicitado cuando un individuo experimenta parálisis prolongada después de la exposición a la succinilcolina, como ocurrió en este caso. En este escenario, sin embargo, el tiempo de recolección de la muestra es importante, las muestras debieron ser obtenidas solo después de que la succinilcolina se hubiera liberado por completo. La falla de no hacerlo produce resultados equivocados o datos bioquı́micos no interpretables lo que pudo haber llevado a un error, por ejemplo, en el cual el fenotipo obtenido no implica o solo representa un riesgo leve de parálisis prolongada en un individuo que actualmente está en alto riesgo. En un estudio (12 ), se les asignó un fenotipo BChE a tres pacientes de UF (riesgo leve), pero 1 de los pacientes resultó tener un genotipo AA BCHE (alto riesgo) (12 ). Debido a que el tiempo de vida de la succinilcolina se prolonga más allá de lo esperado 0.7 min en pacientes con variantes cualitativas de BChE debido a la actividad catalı́tica afectada, recomendamos esperar un mı́nimo de 48 hs después de la exposición de succinilcolina antes de recolectar una muestra para el fenotipo de BChE. Para nuestro paciente, se obtuvieron resultados similares para BChE y DN con dos muestras diferentes, una de las cuales fue recolectada cuando la succinilcolina estaba probablemente aún presente en la sangre del paciente. El efecto de la succinilcolina en los resultados fue menos aparente debido a que el paciente tenı́a un PUNTOS PARA RECORDAR • La succinilcolina es una droga paralizante usada para inducir relajación muscular y parálisis a corto plazo. • No se conoce la función fisiológica de la BChE pero es capaz de hidrolizar esteres de colina exógenos encontrados en ciertas drogas de abuso, aspirina, antidepresivos, anticonvulsivos y paralizantes. • La parálisis expendida por succinilcolina ocurre en individuos con actividad reducida de BChE debida a variantes de enzimas genéticamente determinadas. • La dibucaı́na es un inhibidor competitivo de BChE y se utiliza para determinar una DN de individuos, lo que es el porcentaje de BChE inhibida por dibucaı́na. • La actividad de BChE y DN puede ser usada para inferir un fenotipo bioquı́mico de BChE en individuos. genotipo raro SS BCHE, lo que produjo una variación de BChE con actividad catalı́tica muy baja. Contribuciones de autor: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han cumplido con los siguientes 3 requerimientos: (a) contribuciones significativas a la concepción y diseño, adquisición de datos, o análisis e interpretación de éstos; (b) redacción o revisión del artı́culo en cuanto a su contenido intelectual; y (c) aprobación final del artı́culo publicado. Declaración de los autores de posibles conflictos de interés: Ningún autor declaró algún posible conflicto de interés. Reconocimientos: Agradecemos al Dr. Christopher Reif en el Centro de Cuidado de la Salud Comunitario Universitario, Universidad de Minnesota, Minneapolis, Minnesota y su ayuda en la obtención de muestras de pacientes e información clı́nica. Referencias 1. Darvesh S, Hopkins DA, Geula C. Neurobiology of butyrylcholinesterase (Neurobiologı́a de la butirilcolinesterasa). Nat Rev Neurosci 2003;4:131– 8. 2. Primo-Parmo SL, Bartels CF, Wiersema B, van der Spek AF, Innis JW, La Du BN. Characterization of 12 silent alleles of the human butyrylcholinesterase (BCHE) gene [Caracterización de 12 alelos silenciosos del gen humano butirilcolinesterasa (BCHE)]. Am J Hum Genet 1996;58:52– 64. 3. Cokugras AN. Butyrylcholinesterase: structure and physiological importance (Butirilcolinesterasa; estructura e importancia fisiológica). Turk J Biochem 2003;28:54 – 61.4. Kalow W, Genest K. A method for the detection of atypical forms of human serum cholinesterase; determination of dibucaine numbers (Un método para la detección de formas atı́picas de colinesterasa en suero humano; determinación de números de dibucaı́na). Can J Biochem Physiol 1957;35:339 – 46. 5. Kalow W, Lindsay HA. A comparison of optical and manometric methods for the assay of human serum cholinesterase (Una comparación de métodos óptico y manométrico para el ensayo de colinesterasa en suero humano). Can J Biochem Physiol 1955;33:568 –74. 6. Lehmann H, Ryan E. The familial incidence of low pseudocholinesterase leve (La incidencia familiar del nivel bajo de pseudocolinesterasa). Lancet 1956; 271:124. Clinical Chemistry 58:3 (2012) 499 Estudio de Caso Clı́nico 7. Harris H, Whittaker M. Differential inhibition of human serum cholinesterase with fluoride: recognition of two new phenotypes (Inhibición diferencial de colinesterasa en suero humano con fluoruro: reconocimiento de dos nuevos fenotipos). Nature 1961;191:496 – 8. 8. Hodgkin W, Giblett ER, Levine H, Bauer W, Motulsky AG. Complete pseudocholinesterase deficiency: genetic and immunologic characterization (Deficiencia de pseudocolinesterasa complete: caracterización genética e inmunológica). J Clin Invest 1965;44:486 –93. 9. Bartels CF, Jensen FS, Lockridge O, van der Spek AF, Rubinstein HM, Lubrano T, La Du BN. DNA mutation associated with the human butyrylcholinesterase K-variant and its linkage to the atypical variant mutation and other polymorphic sites (Mutación del AND asociada con la variante humana de butirilcolinesterasa K y su vincula con la mutación variante atı́pica y otros sitios polimórficos). Am J Hum Genet 1992;50:1086 –103. 10. Yen T, Nightingale BN, Burns JC, Sullivan DR, Stewart PM. Butyrylcho- linesterase (BCHE) genotyping for post-succinylcholine apnea in an Australian population (Genotipo de la butirilcolinesterasa (BCHE) para apnea post-succinilcolina en una población australiana). Clin Chem 2003;49: 1297–308. 11. De Jaco A, Comoletti D, Kovarik Z, Gaietta G, Radic Z, Lockridge O, et al. A mutation linked with autism reveals a common mechanism of endoplasmic reticulum retention for the alpha,beta-hydrolase fold protein family (Una mutación vinculada con autism revela un mecanismo común de retención del retı́culo endoplásmico para envolver la familia de la proteı́na alfa, betahidrolasa) . J Biol Chem 2006; 281:9667–76. 12. Parnas ML, Procter M, Schwarz MA, Mao R, Grenache DG. Concordance of butyrylcholinesterase phenotype with genotype: implications for biochemical reporting (Concordancia del fenotipo de la butirilcolinesterasa con genotipo: implicaciones para el reporte bioquı́mico). Am J Clin Pathol 2011;135:271– 6. Comentario George Despotis* En este Estudio de Caso Clı́nico de J.E. Whittington et al., los autores resumen la literatura en relación con la deficiencia de butirilcolinesterasa (BChE) y proporcionan un amplio resumen de los fenotipos diferentes en la Tabla 1, lo que ilustra las frecuencias relativamente bajas de los fenotipos atı́picos de la BChE. Sin embargo, hay implicaciones sustanciales de actividad reducida de BChE. Los pacientes que tienen una baja actividad del fenotipo BChE pueden experimentar serias complicaciones si esta predisposición genética no es manejada apropiadamente. Mientras los autores del caso ilustran las implicaciones potencialmente serias de este desorden desde una perspectiva respiratoria, la importancia de la actividad de BChE reducida en la farmacoquinesis y actividad biológica de varios otros agentes farmacológicos también se resalta. Un asunto no considerado en este Estudio de Caso Clı́nico se refiere a la inhibición iatrogénica de esta enzima en el procedimiento perioperativo de reversión de agentes musculares relajantes no despolari- División de Laboratorio Médico y Genómico, Departamento de Patologı́a e Inmunologı́a, Universidad de Washington Escuela de Medicina, St. Louis, MO. * Dirigir correspondencia al autor a: Division of Laboratory and Genomic Medicine, Department of Pathology and Immunology, Washington University School of Medicine, 669 S Euclid Ave., Box 8118, St. Louis, MO 63110. Fax 314-3621461; e-mail [email protected]. Recibido para publicación: Agosto 22 de 2011; Aceptado para publicación: Agosto 29 de 2011. 500 Clinical Chemistry 58:3 (2012) zantes (e.g., neostigmina) o con el manejo crónico de la miastenia gravis (e.g., piridostigmina). Sin embargo, la duración prolongada de la acción de la succinilcolina después de la administración de agentes como la neostigmina que ha sido descrita extensamente, también hay algunos reportes de resistencia a la relajación muscular con succinilcolina. Uno puede especular que los pacientes con reducción hereditaria de la actividad de la BChE pueden mostrar los efectos de manera más profunda cuando estos inhibidores de acetilcolinesterasa son administrados. La utilidad clı́nica de la BChE recombinante (transgénica) en estas variantes de los pacientes también pueden ser de cierto beneficio. Una mejor comprensión de estos asuntos mencionados en este caso pudo ayudar a los médicos a confirmar el diagnóstico y ayudar con el manejo de pacientes con BChE reducida cuando se encuentran en su práctica clı́nica. Contribuciones de autor: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han cumplido con los siguientes 3 requerimientos: (a) contribuciones significativas para la concepción y diseño, adquisición de datos o análisis e interpretación de éstos; (b) redacción o revisión del artı́culo en cuanto a su contenido intelectual; y (c) aprobación final del artı́culo publicado. Declaración de los autores de posibles conflictos de interés: Ningún autor declaró algún posible conflicto de interés. Estudio de Caso Clı́nico Comentario Roberta Goodall* La parálisis prolongada debida a la baja actividad de la butirilcolinesterasa (BChE) después de la administración de suxametionium aparece tanto de una deficiencia hereditaria o adquirida, pero el riesgo de la parálisis prolongada depende tanto de la actividad enzimática como el genotipo. El BCHE es un gen altamente polimórfico y la prevalencia de las diferentes mutaciones muestra una gran variación geográfica y étnica. La terminologı́a puede ser un reto (1). Los fenotipos bioquı́micos están definidos por el patrón de valores obtenidos después de la inhibición diferencial para determinar “números de inhibidores”, e.g. el número de dibucaı́na (DN). La identificación más precisa del fenotipo usa 3 inhibieres, tı́picamente dibucaı́na más fluoruro y el carbamato Ro 02-0683 (2), lo que permite la identificación de dichos fenotipos como AK y AF, ası́ como el original fenotipo Atı́pico (A) y el UA y mejora la extrapolación del fenotipo al genotipo. Los valores bajos de DN normalmente indican un fenotipo A (DN tı́picamente entre 20 y 30), lo que se demuestra solo por homocigotos para la definición de la mutación Asp70Gly (genotipo A/A) o por sus compuestos heterocigotos con una mutación variante silenciosa (genotipo A/S), el producto de la variante silenciosa del gen contribuye un poco al total. En una muy baja actividad enzimática, la pequeña significancia puede ser colocada en el DN; la imprecisión en estos Departamento de Bioquı́mica Clı́nica, Department of Clinical Biochemistry, Fideicomiso NHS de North Bristol, Hospital Southmead, Bristol, UK. * Dirigir correspondencia al auto a: Department of Clinical Biochemistry, North Bristol NHS Trust, Southmead Hospital, Bristol, UK BS10 5NB. Fax ⫹44-1173238377; e-mail [email protected]. Recibido para publicación Julio 12 de 2011; Aceptado para publicación Julio 14 de 2011. niveles previene su determinación especı́fica. Un muy bajo DN podrı́a ser considerado como un puntaje cercano al fenotipo “silencioso” y no a un fenotipo A, una conclusión apoyada en este caso por el hecho de que los resultados del genotipo no muestran la mutación Asp70Gly. En casos en los que los números inhibidores pueden ser determinados precisamente, la presencia de una variante silenciosa en heterocigotos es enmascarada por el fenotipo de los otros alelos. Eso se ha demostrado en relación con un heterocigoto para la mutación Arg386Cys descrita aquı́, lo que demuestra un fenotipo “Usual”, ası́ como para otro U/S y compuestos heterocigotos. Este caso muestra el valor del genotipo en una situación de baja actividad de BChE, debido a que la identificación de una causa genética puede tener repercusiones para otros miembros de la familia. Notas a pie: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han cumplido con los siguientes 3 requerimientos: (a) contribuciones significativas a la concepción y diseño, adquisición de datos o análisis e interpretación de éstos; (b) redacción o revisión del artı́culo en cuanto a su contenido intelectual; y (c) aprobación final del artı́culo publicado. Declaración de los autores de posibles conflictos de interés: Ningún autor declaró algún potencial conflicto de interés. Referencias 1. La Du BN, Bartels C, Noqueira CP, Arpagaus M, Lockridge O. Proposed nomenclature for human butyrylcholinesterase genetic variants identified by DNA sequencing (Nomenclatura propuesta para variantes genéticas humanas de butirilcolinesterasa identificadas por secuencia de ADN. Cell Mol Neurobiol 1991;11:79 – 89. CrossRefMedlineOrder article via InfotrieveWeb of Science 2. Goodall R. Cholinesterase: phenotyping and genotyping (Colinesterasa: fenotipo y genotipo). Ann Clin Biochem 2004; 41:98 –110. Abstract/FREE Full Text Clinical Chemistry 58:3 (2012) 501