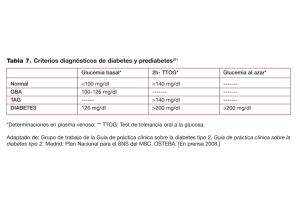
Protocolo Diabetes Mellitus - Sociedad Riojana de Hipertensión
Anuncio

PROTOCOLO DE DIABETES MELLITUS DEL AREA DE SALUD DE LA RIOJA AUTORES Cámara Balda, Alejandro1 y Torres Baile, José Luis2 1Sección 2Centro de Endocrinología y Nutrición. Hospital San Pedro de Logroño de Salud Rodríguez Paterna de Logroño COORDINADOR Adán Gil, Francisco M3 3Centro de Salud de Alfaro. La Rioja Logroño, Abril de 2013 INDICE 1.-INTRODUCCION 2.-CRITERIOS PARA EL DIAGNOSTICO DE DIABETES, PREDIABETES Y DIABETES GESTACIONAL 3.-CLASIFICACION DE LA DIABETES 4.-DETECCION PRECOZ DE LA DIABETES 5.-OBJETIVOS DE CONTROL 6.-DIETA Y EJERCICIO -Intervenciones para la pérdida de peso -Recomendaciones sobre tipos de alimentos -Planificación de la alimentación -Aumento de actividad física 7.-TRATAMIENTO NO INSULINICO -Metformina -Sulfonilureas -Secretagogos de acción rápida o glinidas -Glitazonas -Inhibidores -glucosidasas -Fármacos reguladores de las incretinas: inhibidores de la DPP-4 y análogos del GLP-1 -Tratamiento combinado 8.-TRATAMIENTO INSULINICO. -Tipos de Insulina -Insulinas de acción rápida -Insulinas de acción intermedia -Insulinas de acción prolongada -Insulinas bifásicas -Indicaciones de la Insulina en Diabetes tipo 2 -Esquemas de administración de Insulina -Insulina basal mas hipoglucemiantes orales -Insulinoterapia en pauta basal-bolo -Insulina bifásica en dos dosis -Pauta móvil de Insulina rápida 9-TRATAMIENTO DE OTROS FACTORES DE RIESGO CARDIOVASCULAR -Hipertensión Arterial -Dislipemia -Antiagregación 10-SEGUIMIENTO EN LA DIABETES TIPO 2 -Medición de la glucemia capilar por el sujeto en la Diabetes tipo 2 11-CRITERIOS DE DERIVACION A ATENCION ESPECIALIZADA 12.-ANEXOS 13.-BIBLIOGRAFIA 3 3 4 5 6 7 7 8 7 8 8 8 9 9 9 10 10 11 14 14 14 14 15 15 15 16 17 18 18 19 19 19 20 20 21 21 22 24 34 ABREVIATURAS Y ACRONIMOS ACV ADA Anti-GAD ARA II c-LDL CT DM DPP-4 ECV ERC FG GBA GLP-1 HbA1c HLA IC ICAS IECAS IMC ITB ITG LADA MODY NNT NPH NPL PAD PAS PPAR-gama RCV SOG SU Accidente Cerebro Vascular American Diabetes Association Autoanticuerpos frente a la descarboxilasa del Acido Glutámico Antagonistas de los receptores de la Angiotensina II Colesterol unido a las lipoproteinas de baja densidad Colesterol Total Diabetes Mellitus Dipeptidil Peptidasa 4 Enfermedad Cerebro Vascular Enfermedad Renal Crónica Filtrado Glomerular Glucemia Basal Alterada Péptido similar al Glucagón tipo 1 Hemoglobina Glicosilada Sistema de Histocompatibilidad Indice de Concordancia Autoanticuerpos frente a los islotes celulares Beta Inhibidores de la enzima convertidora de la Angiotensina Indice de Masa Corporal Indice Tobillo Brazo Intolerancia a la Glucosa Diabetes Autoinmune Latente del Adulto Diabetes de la Madurez de inicio en la Juventud Número necesario de pacientes a tratar Insulina Isófana Humana Insulina Lispro Protamina Presión Arterial Diastólica Presión Arterial Sistólica Receptor Gamma Activado por el Proliferador de Peroxisomas Riesgo Cardiovascular Sobrecarga Oral de Glucosa Sulfonilureas 2 1-INTRODUCCION La diabetes mellitus (DM) se define como un conjunto de alteraciones metabólicas de múltiples etiologías caracterizadas por hiperglucemia crónica y trastornos del metabolismo de los hidratos de carbono, las grasas y las proteínas, resultado de defectos en la secreción de insulina, en la acción de ésta, o en ambas (Organización Mundial de la Salud - OMS, 1999) 1 La diabetes mellitus tipo 2 (DM2) es una enfermedad compleja que implica una predisposición genética para una disfunción de la célula β que ocasiona una deficiencia relativa de insulina, una insulinorresistencia, un incremento en la secreción de glucagón, hiperglucemia basal y postprandial así como un aumento de la apoptosis y reducción de la masa de la célula β. Los pacientes diabéticos se consideran de alto riesgo cardiovascular (RCV) tanto por la hiperglucemia como por las enfermedades que se asocian frecuentemente a la diabetes. Presentan un incremento de la morbimortalidad cardiovascular respecto a la población que no lo es. Por otra parte, las complicaciones microvasculares específicas de la diabetes (retinopatía, nefropatía y neuropatía) y las enfermedades de origen tanto macro como microvascular como el pie diabético alteran notablemente su calidad de vida. Al ser una enfermedad crónica y que afecta a un gran número de personas supone también un importante problema de salud pública. En España se ha realizado el estudio [email protected] sobre la prevalencia de la DM y la prediabetes y su asociación con diversos factores de riesgo en una muestra representativa de población española. Los datos reflejan una prevalencia de DM del 13,8% (IC 95%, 12.8-14.7%), siendo la diabetes desconocida del 6% (IC 95%, 5.4- 6.7%). El porcentaje de personas con alteraciones prediabéticas fue del 3,4% (IC 95%, 2.9-4.0%) con glucosa basal alterada y del 9,2% (IC 95%, 8.2-10.2%) con intolerancia a la glucosa. Si estos datos los aplicamos a la población de 18 ó más años de La Rioja que en el año 2010, según el Instituto Nacional de Estadística era de 268.365 habitantes, nos encontramos con que hay aproximadamente 37.000 diabéticos en nuestra comunidad, de los cuales alrededor de 16.100 no saben que lo son. La obesidad y la vida sedentaria son factores determinantes en el desarrollo de la diabetes tipo 2. Para disminuir su incidencia es importante la promoción de estilos de vida saludables: una alimentación sana y equilibrada y la práctica de ejercicio físico regular. Diversos estudios han demostrado que el control glucémico junto con el abordaje de todos los factores de riesgo cardiovascular es efectivo para reducir la incidencia o la progresión de las complicaciones micro y macrovasculares de la diabetes y que un buen control implica una mejora de la calidad y esperanza de vida del paciente con DM3-6. 2-CRITERIOS PARA EL DIAGNOSTICO DE DIABETES, PREDIABETES Y DIABETES GESTACIONAL En la Tabla I se exponen los criterios de la Asociación Americana de Diabetes (ADA) para el diagnóstico de diabetes y prediabetes7. Las categorías de prediabetes con riesgo aumentado de desarrollar diabetes son la glucemia basal alterada, la intolerancia a la glucosa y la hemoglobina glicosilada (HbA1c) alterada. Para la OMS la glucemia basal alterada se define por valores de glucemia entre 110-125 mg/dl. La HbA1c presenta menor variabilidad interindividual e intraindividual y es más estable a la hora de conservar la muestra que la glucemia basal o la sobrecarga oral de glucosa (SOG). Cuando se utiliza para el diagnóstico de diabetes se debe tener en cuenta que: - El resultado puede verse afectado en diferentes situaciones como en la anemia ferropénica o hemolítica, determinadas hemoglobinopatías, cirrosis y con algunos medicamentos. Aumenta con la edad y hay diferencias entre razas. El consenso del Reino Unido publicado en 2012 sobre la utilización de la HbA1c para el diagnóstico de diabetes, implementando las directrices de la OMS8 aconseja no utilizarla en las siguientes situaciones: niños y jóvenes, primer trimestre de embarazo, sospecha de DM1 (no importa la edad), pacientes con sintomatología diabética de corta duración, pacientes gravemente enfermos, si están tomando medicación que eleve la glucemia rápidamente como por ejemplo corticoides o drogas antipsicóticas durante menos de dos meses, si hay daño pancreático o cirugía pancreática, insuficiencia renal o pacientes con infección por VIH. 3 Tabla I. Criterios diagnósticos de diabetes mellitus. ADA 2013 Síntomas y glucemia al azar ≥ 200 mg/dl Glucemia en ayunas ≥ 126 mg/dl* Glucemia a las 2 h SOG ≥ 200 mg/dl* HbA1c ≥ 6,5% * Diabetes mellitus 1. 2. 3. 4. Glucemia Basal Alterada (GBA) Glucemia en ayunas: 100-125 mg/dl Intolerancia a la Glucosa (ITG) Glucemia entre 140-199 mg/dl a las 2 h de SOG con 75 g de glucosa Mayor riesgo de diabetes HbA1c entre 5,7-6,4% *Es necesario comprobar el diagnóstico con una nueva determinación de glucemia en ayunas, SOG o HbA1c Respecto a la Diabetes Gestacional sus criterios diagnósticos son 2 valores alterados en la sobrecarga oral de glucosa (con 100gr de glucosa): 0 min: > 105 mg/dL 60 min: > 190 mg/dL 120 min: > 165 mg/dL 180 min: > 145 mg/dL 3-CLASIFICACION DE LA DIABETES -DIABETES TIPO 1 (DM1): Suele iniciarse antes de los 30 años de manera aguda, con los síntomas típicos de la diabetes, cetosis y pérdida importante de peso. Los pacientes con DM1 tienen un déficit absoluto de secreción de insulina. Más del 90% presentan autoanticuerpos frente a la descarboxilasa del ácido glutámico (anti-GAD), autoanticuerpos frente a los islotes celulares beta (ICAs) y otros. El péptido C es indetectable o muy bajo. Precisan insulina para sobrevivir. -DIABETES TIPO 2: Es de aparición lenta, con síntomas escasos y ausencia de cetosis. Se asocia frecuentemente a sobrepeso u obesidad (80%). Presencia de antecedentes familiares. Los pacientes presentan fundamentalmente resistencia a la insulina y un déficit relativo de secreción de la misma. -DIABETES GESTACIONAL: Diabetes detectada durante el embarazo en mujeres previamente no diabéticas. -OTROS TIPOS ESPECÍFICOS DE DIABETES (Anexo I). A continuación se describen brevemente dos tipos específicos de diabetes que, por su frecuencia, debemos tener más presentes en la práctica clínica diaria: Diabetes TIPO LADA (Latent Autoinmune Diabetes of the Adult): Es una diabetes autoinmune en la que la destrucción de las células beta ocurre lentamente. Suele presentarse en personas entre 30 y 50 años, no obesas y sin antecedentes familiares de diabetes. Inicialmente responden bien a los hipoglucemiantes orales, pero en unos meses precisan insulina para conseguir un buen control. La prevalencia varía entre 9-17% (10% en el estudio UKPDS). Es más frecuente que la DM1. Tiene una relación con el sistema HLA DR3-DR4 tanto personal como familiar con presencia de enfermedades autoinmunes como: enfermedades del tiroides, enfermedad celiaca, enfermedad de Addison, artritis reumatoidea, enfermedad de Sjögren, etc. Su diagnóstico se basa en la presencia de un nivel alto de anti-GAD. Diabetes TIPO MODY: La diabetes de la madurez de inicio en la juventud, traducción del término inglés Maturity Onset Diabetes of the Young (MODY) comprende un grupo heterogéneo de enfermedades monogénicas, en la mayoría de los casos de herencia autosómica dominante, caracterizadas por disfunción de las células β pancreáticas. Tiene una prevalencia del 1-2% tanto entre los tipo 1 como en los tipo 2. Los pacientes suelen mostrar una o más de las siguientes características: un fuerte historial familiar de diabetes con varios familiares diagnosticados antes de los 25 años, inicio de la diabetes en la adolescencia o juventud, no 4 insulinodependencia (aunque la insulina puede ser necesaria para un control óptimo), ausencia de características de resistencia a la insulina, ausencia de marcadores autoinmunes a las células β y péptido C preservado. El subtipo genético específico de MODY determina la presentación clínica, pronóstico y la respuesta al tratamiento. Figura 1: Algoritmo de clasificación de la diabetes: ALGORITMO CLASIFICACIÓN DIABETES < 30 años no obeso Aparición brusca Pérdida de peso Sintomas típicos > 30 años Sintomas escasos Aparición lenta Hª familiar DM2 Sospecha DM1 Sospecha DM2 Delgado Obesidad central HTA Dislipemia Sospecha predominio déficit secreción insulina LADA: Latent Autoinmune Diabetes of the Adult Péptido C: valora la reserva pancreática de insulina ICAs: Ac contra islotes pancreáticos. Sugestivos de DM1 AntiGAD: Ac contra glutamato decarboxilasa.Sugestivos de LADA < 25 años. Hª familiar de diabetes en más de 2 generaciones. Aparente DM 2. Sin autoAc, con peptidoC Sospecha D. Monogénica Derivación a especialista para confirmación con > 25-30 años Aparición progresiva Sin obesidad. No Hª fam de DM. Hª personal y/o familiar enf. autoinmunes Sospecha LADA - Toma corticoides, diuréticos, betabloqueantes, H.tiroideas .. - Enfermedades asociadas (infecciones, pancreatitis, etc) Sospecha DM secundaria Valorar antiGAD estudio cromosómico (+) confirma LADA Descartar Solicitar ICAs Valorar (+) confirma DM1 Péptido C Peptido C <2ng/ml Déficit absoluto de secreción de insulina Déficit relativo de secreción de insulina Peptido C >3ng/ml Resistencia a la acción periférica de la insulina Defectos genéticos en la función de la célula Déficit progresivo de secreción de insulina - Enfermedades del páncreas exocrino (neoplasias, pancreatitis alcohólica, hemocromatosis …) - Endocrinopatías - Inducida por fármacos (corticoides) o sustancias químicas - Infecciones -- Defectos genéticos en la acción de la insulina - Formas desconocidas inmunodependientes - Otros síndromes genéticos asociados con DM 4-DETECCION PRECOZ DE LA DIABETES No existen evidencias que justifiquen el cribado poblacional universal pero sí consenso en recomendar la detección oportunista en grupos de riesgo. La población diana para la detección precoz de la diabetes se expone en la Tabla II. Para el cribado en población general se dispone de tres métodos: la glucemia basal, el test de tolerancia oral a la glucosa y la HbA1c. La prueba más costo-eficiente y sencilla es la glucemia basal en plasma venoso9. Tabla II. Cribado de diabetes en pacientes asintomáticos (ADA 2013) 7 Realizar una glucemia basal cada 3 años en mayores de 45 años. Anualmente, en personas con un índice de masa corporal (IMC) ≥ 25 Kg/m² y al menos uno de los siguientes factores de riesgo: Antecedentes de diabetes en familiares de primer grado Sedentarismo ITG, GBA o HbA1c entre 5,7 y 6,4% en analíticas previas Macrosomía o diabetes gestacional previa Colesterol-HDL ≤ 35 y/o triglicéridos ≥ 250 mg/dl Hipertensión arterial Antecedentes de enfermedad cardiovascular Etnias de alto riesgo ( centroamericanos, asiáticos, etc) Mujeres con síndrome de ovario poliquístico Entidades clínicas con resistencia a la insulina (obesidad severa, acantosis nigricans, etc) 5 5-OBJETIVOS DE CONTROL El tratamiento del paciente diabético debe abordar además de la glucemia, todos los factores de riesgo cardiovascular. El control de la presión arterial, lípidos o tabaquismo disminuye las complicaciones micro y macrovasculares de la DM6,10. La Tabla III recoge los objetivos generales para el control de los pacientes con DM2. La relación entre complicaciones y control glucémico se estableció en el estudio UKPDS3, que puso de manifiesto que una disminución de 0,9% de la HbA1c en el grupo de tratamiento intensivo (7,0% vs. 7,9%) redujo el 25% las complicaciones microvasculares, con un número de pacientes que es necesario tratar para evitar un evento (NNT) de 35 y una disminución de 16% en la incidencia de infarto de miocardio, aunque no significativa. El tratamiento con metformina en pacientes con sobrepeso se asoció a una reducción significativa de la mortalidad cardiovascular 4. Igualmente el control estricto de la presión arterial (144/82 mmHg vs 154/87)11 demostró una reducción significativa del 32% en la mortalidad relacionada con la diabetes (NNT de 15), un 44% en los accidentes cerebrovasculares (NNT de 20) y un 37% en las complicaciones microvasculares (NNT de 14). El seguimiento observacional del UKPDS a los diez años de finalizar la intervención demostró que el control glucémico intensivo añadió beneficios macrovasculares y de mortalidad total a los beneficios microvasculares12. Estudios posteriores realizados en pacientes con una diabetes de años de evolución, con un mayor riesgo cardiovascular y un alto porcentaje de complicaciones cardiovasculares 13-15 nos enseñaron que es necesario flexibilizar el objetivo de control glucémico en función de las características de cada persona. Recomendaciones para el control de la glucemia7,16: Se considera un buen control glucémico una HbA1c < 7%. En pacientes con diabetes de corta duración, con larga expectativa de vida y sin enfermedad cardiovascular el objetivo debe ser más estricto, si puede conseguirse sin efectos adversos: HbA1c < 6,5%. En pacientes con complicaciones micro y macrovasculares avanzadas, historia de hipoglucemias graves, expectativa de vida limitada o importantes comorbilidades los objetivos son menos estrictos: HbA1c < 8%. Pacientes mayores de 75 años sin comorbilidades graves: HbA1c < 7-7,5% Paciente frágil (dependiente, con riesgo de caídas, con enfermedades graves, institucionalizados o con demencia): HbA1c < 7,6-8,5%. Tabla III. Objetivos generales de control en la diabetes tipo 2 Parámetros Objetivos de control Hba1c (%) < 7% Glucemia capilar plasmática preprandial (mg/dl) 90 – 130 Glucemia capilar plasmática postprandial (mg/dl) < 180 Triglicéridos (mg/dl) < 150 Colesterol total (mg/dl) < 200 ** HDL colesterol (mg/dl) > 40/50 * LDL colesterol (mg/dl) < 100 ** Presión Arterial (mm Hg) < 140/90 IMC (kg/m2) < 25 Consumo de tabaco NO * 40 en hombres y 50 en mujeres ** Los niveles de colesterol total, HDL y LDL colesterol son orientativos y la decisión del tratamiento con estatinas en prevención primaria vendrá determinada por el riesgo cardiovascular (Tabla REGICOR ≥ 10%). 6 6-DIETA Y EJERCICIO La terapia nutricional junto al ejercicio constituyen uno de los pilares fundamentales del tratamiento de la diabetes. Se debe realizar consejo nutricional individualizado a todos los sujetos con diabetes con independencia del tipo de diabetes, el peso o el tratamiento que se haya instaurado. Los objetivos básicos del tratamiento nutricional en la diabetes son lograr el normopeso y conseguir el adecuado control glucémico y del resto de factores de riesgo cardiovascular, teniendo en cuenta las preferencias personales y culturales de cada individuo17. El conocimiento en aspectos nutricionales de la alimentación del diabético por parte de todo el equipo sanitario es un punto básico para conseguir resultados18. La educación nutricional es una parte fundamental de la educación diabetológica y, en su aplicación, es clave el papel de enfermería. Intervenciones para la pérdida de peso La pérdida de peso debe ser un objetivo primario en todos los diabéticos con sobrepeso u obesidad. Aunque el normopeso sea la meta ideal, no siempre es posible. Recomendamos plantear objetivos de pérdida de peso pactados con el sujeto que sean realistas e individualizados. La disminución del 5-10% en el peso corporal ha demostrado mejorar parámetros como la glucemia, la hipertensión arterial o la dislipemia19. Para conseguir la pérdida de peso se deben conseguir cambios en los hábitos de vida que conduzcan a una restricción en las calorías ingeridas y a un aumento de la actividad física. Ensayos clínicos aleatorizados han demostrado que se puede conseguir una pérdida de peso moderada y mantenida en el tiempo con intervenciones sobre el estilo de vida que incluyan consejo nutricional y prescripción de ejercicio individualizado e intensivo 20. Respecto al tipo de dieta, la dieta mediterránea y dietas bajas en grasas han demostrado resultados a corto plazo por lo que son las más recomendadas. Las dietas bajas en hidratos de carbono también son eficaces, pero existen dudas sobre su seguridad en diabéticos, por lo que no pueden ser recomendadas para su uso general18. El único fármaco comercializado para el tratamiento de la obesidad es orlistat. Se puede usar con seguridad en sujetos en los que exista dificultad para alcanzar objetivos de peso, pero siempre asociado a dieta y ejercicio. La cirugía bariátrica puede ser una opción a considerar en diabéticos con IMC superior a 35 que no consigan reducir el peso por otros medios21. Los individuos que deseen considerar esta opción deben ser remitidos a Atención Especializada (Endocrinología y Nutrición). Recomendaciones sobre tipos de alimentos La proporción de macronutrientes recomendada en la alimentación del diabético es la misma que en población general: 50-60% del total de calorías diarias en forma de hidratos de carbono, menos del 30% en forma de grasas y 15% en forma de proteínas17. Se recomienda reducir la ingesta de carbohidratos de absorción rápida (menos del 10% del total de calorías diarias)22. La ingesta de carbohidratos debe repartirse en las distintas ingestas adaptándolas al tratamiento prescrito (fundamentalmente a la pauta de insulina rápida), para minimizar la carga glucémica y el riesgo de hipoglucemia. Es recomendable controlar el aporte de grasas, en especial de grasas saturadas (con un aporte inferior al 7% del total de calorías diarias) y de grasas transaturadas18. Por el contrario hay que favorecer el consumo de grasas monoinsaturadas y de poliinsaturadas omega 3. Si no hay otra causa que así lo recomiende no es necesario contraindicar el consumo moderado de alcohol (10 gramos en varones y 20 gramos en mujeres) en sujetos con diabetes22. Planificación de la alimentación La alimentación en los individuos con diabetes se puede organizar con distintos métodos: directrices generales, menús fijos, intercambio de raciones,... No hay estudios que demuestren superioridad de un método sobre otro 17. 7 Antes de diseñar el plan de alimentación debemos motivar al paciente, dotarle de conocimientos y realizar una encuesta dietética previa. Nuestro plan debe ser flexible, individualizado, adaptado a la realidad familiar y cultural, sin olvidar el placer gastronómico. Se considera una mala técnica que no ayuda al manejo de la diabetes suministrar un listado de alimentos permitidos y prohibidos. El método de elección es la dieta por raciones, siendo una ración la proporción de un determinado alimento que contiene el equivalente a 10g de glucosa. Se distribuyen las raciones con las ingestas del día teniendo en cuenta las necesidades individuales y el tratamiento prescrito y se completa con alimentos que aporten grasas y proteínas. Recomendamos su utilización en todos los diabéticos que lleven pauta basal-bolo de insulina, sean tipo 1 ó tipo 2. Cuando este método se considere demasiado complejo, se puede organizar la ingesta en base a conocimientos básicos sobre el contenido de hidratos de carbono de los alimentos y cómo distribuirlos a lo largo del día. Conviene recalcar la importancia de reevaluar periódicamente el cumplimiento y los logros alcanzados junto al paciente con el plan establecido. Aumento de actividad física El ejercicio regular mejora el control de la glucemia y otros factores de riesgo vascular, favorece la pérdida de peso y mejora la sensación de bienestar. Se recomienda incrementar el ejercicio en la actividad diaria habitual reduciendo por ejemplo el uso del transporte motorizado o del ascensor en el trabajo y el domicilio. Por otra parte, debemos prescribir una actividad física regular al sujeto con diabetes al margen de la actividad diaria. El tipo de ejercicio más asequible para la mayoría de la población es caminar, aunque otras actividades aeróbicas como natación o bicicleta también son muy adecuadas. Se debe recomendar a las personas con diabetes la realización de un mínimo de 150 minutos a la semana de actividad física aeróbica de intensidad moderada, distribuida en al menos tres días a la semana, sin más de dos días consecutivos sin ejercicio18. El profesional debe evaluar antes de prescribir el ejercicio la idoneidad del mismo por la existencia de complicaciones vasculares de la diabetes (fundamentalmente riesgo de enfermedad coronaria, pie diabético o neuropatía autonómica). También es importante que el paciente conozca cómo prevenir y tratar la aparición de hipoglucemia o cetosis durante la actividad física. 7-TRATAMIENTO NO INSULINICO Estudios como el metaanálisis de Bloomgarden et al23 o la revisión sistemática de Bolen S et al24 concluyen que la eficacia para reducir la glucemia de los distintos fármacos orales es similar. Otros estudios apuntan a que la metformina, las sulfonilureas, las glitazonas y los agonistas del GLP-1 reducen la HbA1c entre el 1-1,5% y el resto de los antidiabéticos orales entre 0,5-1% y así lo refleja el algoritmo de tratamiento consensuado entre la ADA y la Asociación Europea para el Estudio de la Diabetes (EASD)25. No obstante, la reducción de la glucemia no debe ser el único factor determinante a la hora de elegir el tratamiento. Además de contar con las preferencias del paciente, al prescribir un fármaco hipolipemiante hay que tener en cuenta: la evidencia en la reducción de la morbi-mortalidad, su eficacia a corto y largo plazo para controlar la glucemia, los efectos sobre otros factores de riesgo cardiovascular (hipertensión arterial, dislipemia, etc), sus efectos secundarios, contraindicaciones, facilidad de uso y coste. En la Tabla IV aparecen las principales características de los antidiabéticos no insulínicos y en la Tabla V las recomendaciones de ajuste de dosis de los antidiabéticos en caso de enfermedad renal. METFORMINA Es el fármaco de primera elección para el tratamiento de la diabetes tipo 2 tanto en monoterapia como en combinación con otros fármacos orales o con insulina26-29. Actúa disminuyendo la producción hepática de glucosa y en menor medida aumentando la captación periférica de la misma. No produce hipoglucemia ni aumento de peso. 8 Aunque en ficha técnica la metformina está contraindicada si el filtrado glomerular (FG) es < 60 ml/min, diferentes estudios avalan que hasta con un FG de 30 ml/min su uso es relativamente seguro, debiendo utilizarse con precaución y reducir la dosis con FG < 45 ml/min. Contraindicaciones: alcoholismo, insuficiencia renal grave (FG< 30 ml/min), insuficiencia hepática, insuficiencia cardiaca severa (grado III-IV de NYHA), insuficiencia respiratoria, embarazo y lactancia. Prescripción : iniciar con medio comprimido de 850 mg e ir aumentando cada 2 semanas. La dosis máxima eficaz es de 1.000 mg/12h . Hay modestos incrementos de efectividad a dosis de 2.500 mg/día, pero los efectos secundarios gastrointestinales pueden limitar su utilización. Es preferible administrarlo durante las comidas para minimizar los efectos gastrointestinales SULFONILUREAS ( SU) (glibenclamida, gliclazida, glimepirida, glipizida, gliquidona, glisentida) Actúan principalmente estimulando la secreción de insulina por las células beta pancreáticas. Su efecto secundario más importante es la hipoglucemia. Para reducir ese riesgo se recomienda iniciar el tratamiento con dosis bajas e ir aumentándola cada una o dos semanas, teniendo en cuenta la edad, la función renal, las interacciones farmacológicas y el consumo de alcohol. Han demostrado su eficacia en ensayos clínicos de larga duración reduciendo las complicaciones microvasculares, no siendo inferiores a fármacos más modernos en cuanto a control glucémico y con un coste menor. Diferentes guías clínicas las consideran una alternativa razonable a la metformina27-29. Glimepirida y Gliclazida son de elección en ancianos por el menor riesgo de hipoglucemias graves. Ambas permiten una sola toma diaria. En insuficiencia renal hay que evitar glibenclamida. Aunque en ficha técnica las SU están contraindicadas en insuficiencia renal grave, algunas de ellas como glipizida, gliclazida y glimepirida pueden utilizarse cuando el FG < 30 ml/min reduciendo la dosis 30,31. Glipizida y glicazida pueden utilizarse en pacientes que reciben diálisis30-32. Contraindicaciones: alergia a sulfamidas, diabetes tipo 1 ó secundaria a enfermedad pancreática, embarazo y lactancia, insuficiencia hepática grave. Prescripción: iniciar el tratamiento con dosis bajas por la mañana y aumentar la dosis cada una o dos semanas. Tomarlas treinta minutos antes de las comidas (no es necesario con glimepirida ni gliclazida). Debe insistirse en no omitir ninguna comida y no tomar alcohol. SECRETAGOGOS DE ACCIÓN RÁPIDA O GLINIDAS (repaglinida y nateglinida) Mecanismo de acción similar a las SU, con una acción más rápida y corta (4-6 horas). Pueden ser útiles para controlar la hiperglucemia postprandial, en pacientes con horarios irregulares de comidas, alérgicos a sulfamidas o con insuficiencia renal. Repaglinida está autorizada en monoterapia y en combinación con metformina. Nateglinida sólo está autorizada en combinación con metformina. Contraindicaciones: diabetes tipo 1 ó secundaria a enfermedad pancreática, insuficiencia hepática grave, embarazo y lactancia. Repaglinida no debe utilizarse junto con gemfibrozilo. Prescripción: tomar de 1-15 minutos antes de cada comida principal. Si se suprime una de las ingestas no tomar el fármaco. Repaglinida (comprimidos de 0.5, 1 y 2 mg.): iniciar con 0.5 mg y aumentar la dosis progresivamente según respuesta, hasta un máximo de 4 mg por toma. Nateglinida (comprimidos de 60, 120 y 180 mg.): iniciar con 120 mg por toma, pudiéndose aumentar a 180 mg en caso de respuesta insuficiente. GLITAZONAS ( pioglitazona) Actúan a través de la activación del receptor nuclear PPAR-gamma (receptor gamma activado por el proliferador de peroxisomas) reduciendo con ello la resistencia a la insulina, fundamentalmente en los tejidos periféricos. También inhiben la gluconeogénesis hepática. 9 No producen hipoglucemias y no requieren ajuste de dosis en insuficiencia renal, aunque cuando el FG< 30 ml/min hay que tener precaución por el posible aumento de los efectos adversos. Su principal indicación es el tratamiento combinado con metformina y/o SU. También pueden utilizarse en monoterapia cuando hay intolerancia o contraindicación a la metformina y asociadas a insulina. Contraindicaciones: diabetes mellitus tipo 1, embarazo y lactancia, insuficiencia cardiaca o historia de insuficiencia cardiaca y hepatopatía. Prescripción: iniciar el tratamiento con 30 mg de pioglitazona (1 comprimido) en la comida e incrementar la dosis a 45 mg si la respuesta es insuficiente. Actualmente se dispone de una asociación a dosis fija de pioglitazona con metformina (15/850mg) y con glimepirida (30/2-4 mg) que permite simplificar la toma y mejorar el cumplimiento. INHIBIDORES α-GLUCOSIDASAS (acarbosa y miglitol) Inhiben de forma reversible las -glucosidasas intestinales, retardando la absorción de los hidratos de carbono. Reducen especialmente las glucemias postprandiales. No producen hipoglucemias ni aumento de peso. Son una alternativa cuando existe intolerancia o contraindicación al resto de antidiabéticos orales. Contraindicaciones: en pacientes con FG < 25 ml/min, enfermedades intestinales inflamatorias crónicas y diverticulosis, cirrosis hepática, embarazo y lactancia. Prescripción: dosis inicial de 50 mg/día que se aumentará semanalmente para minimizar los efectos secundarios. La dosis efectiva es de 300 mg/día, repartida en las tres comidas principales. Se deben administrar al inicio de la comida y sin masticar. Ambas se presentan en comprimidos de 50 y 100 mg. FARMACOS REGULADORES DE LAS INCRETINAS Las incretinas son péptidos endógenos secretados en el intestino delgado en respuesta a la ingesta de alimentos. El más importante es el péptido similar al glucagón tipo 1 (GLP-1). Estimulan la secreción de insulina e inhiben la de glucagón de manera glucosa-dependiente. Además enlentecen el vaciamiento gástrico produciendo sensación de saciedad. Tienen una vida media muy corta, inactivándose en minutos por la enzima dipeptidilpeptidasa 4 (DPP-4). Actualmente se dispone de dos grupos de fármacos: los análogos del GLP-1 y los inhibidores de la DPP-4. 1. INHIBIDORES DE LA DPP-4 (sitagliptina, vildagliptina, saxagliptina, linagliptina) Son un grupo de fármacos que mediante un bloqueo temporal de la enzima DPP-4 retrasan la degradación de las incretinas prolongando su acción. Estimulan la secreción de insulina e inhiben la de glucagón. No tienen efecto sobre el vaciamiento gástrico ni producen sensación de saciedad. Al depender su acción de la ingesta, se reduce en gran medida la aparición de hipoglucemias. No producen aumento de peso. Linagliptina al eliminarse en un 95% por vía biliar puede utilizarse en todos los estadíos de la insuficiencia renal sin ajuste de dosis. El resto de estos fármacos dado que su eliminación es fundamentalmente renal precisan ajuste de dosis. Contraindicaciones: embarazo y lactancia, diabetes tipo 1. Vildagliptina no debe utilizarse en pacientes con insuficiencia hepática, incluyendo aquellos pacientes con valores pre-tratamiento de enzimas hepáticas superiores a 3 veces el valor normal. Prescripción: la dosis de las distintas moléculas se administran una vez al día excepto vildagliptina que se recomienda dos veces al día salvo si se combina con una SU, en cuyo caso se dará la mitad de la dosis para minimizar el riesgo de hipoglucemia. De todos ellos existen combinaciones a dosis fijas con metformina. 10 2. ANÁLOGOS DEL GLP-1 ( exenatida y liraglutida) Los análogos del GLP-1 reproducen las acciones de esta hormona, al tener una afinidad comparable por el receptor de GLP-1 y ser resistentes a la degradación de la enzima DPP-4. Además de estimular la secreción de insulina e inhibir la de glucagón, enlentecen el vaciamiento gástrico y producen sensación de saciedad. Ambos polipéptidos deben administrarse por vía subcutánea pues son degradados por el jugo gástrico. No tienen un riesgo importante de hipoglucemia y su principal ventaja es la pérdida de peso, que en algunos pacientes puede ser considerable. Están indicados en pacientes con un índice de masa corporal (IMC) > 30 en biterapia cuando no hay un control adecuado con metformina, en triple terapia o asociados a insulina basal. Contraindicaciones: diabetes tipo 1, embarazo y lactancia, enfermedad gastrointestinal grave, insuficiencia renal (exenatida si FG < 30 ml/min y liraglutida si FG < 60 ml/min). Prescripción : exenatida se administra dentro de un periodo de 60 minutos antes del desayuno y antes de la cena. La dosis inicial recomendada es de 5 µg 2 veces al día durante al menos un mes para mejorar la tolerabilidad e ir aumentando hasta 10 μg dos veces al día. Liraglutida se administra una vez al día, independientemente de las comidas y preferentemente a la misma hora cada día. La dosis inicial es de 0,6 mg al día, debiéndose incrementar a 1,2 mg ó a 1,8 mg en función de la respuesta clínica. TRATAMIENTO COMBINADO: -Dos fármacos: si no se consigue el objetivo de HbA1c se debe asociar a metformina un segundo fármaco. La asociación de fármacos consigue mayor disminución de la HbA1c que la monoterapia y con menor dosis de cada fármaco, reduciendo así los efectos secundarios. La mejor asociación es aquella cuyos fármacos tengan diferentes mecanismos de acción y actúen sinérgicamente. La combinación de metformina y sulfonilurea sigue siendo la más recomendada tras el fracaso de cada fármaco en monoterapia 27-29,33,34. -Triple terapia: como alternativa a la insulinización en pacientes que no la acepten, cuando exista un riesgo elevado de hipoglucemia o cuando haya limitaciones físicas o sociales que dificulten su uso. Conviene utilizar fármacos de dosis única y combinaciones fijas para facilitar la adherencia del paciente al tratamiento. Si tras un período de tres a seis meses no se consiguen los objetivos se debería optar, si es posible, por la insulinización. 11 Tabla IV. Características principales de los antidiabéticos orales y análogos del GLP-1 RIESGO DE HIPOGLUCEMIA METFORMINA NO SULFONILUREAS -Glibenclamida: significativo -Gliclazida: OTRAS VENTAJAS OTRAS DESVENTAJAS CONTRAINDICACIONES -No aumento de peso -Mejora perfil lipídico y otros marcadores de RCV -Disminución de la mortalidad y complicaciones macrovasculares en pacientes obesos (UKPDS) -Disminución de eventos cardiovasculares mayores en diabéticos con enfermedad arterial coronaria -Posible efecto protector en el desarrollo de cáncer -Bajo coste -Efectos adversos digestivos (titular dosis) -Acidosis láctica (muy rara) -Interfiere con la absorción de Vit B12 sin repercusión clínica -FG < 30 ml/min -I. Cardiaca severa -I. Hepática -I. Respiratoria -Alcoholismo -Disminución de las complicaciones microvasculares (UKPDS/ADVANCE) 3,14 -Bajo coste -Ganancia de peso -I. Hepática severa -Alergia a Sulfamidas -NO contraindicadas en I.Renal -Reducen preferentemente la glucemia postprandial -Utiles en horarios irregulares -Ganancia de peso -No asociar Repalinida con Gemfibrozilo -I.Hepática severa -NO contraindicadas en I.Renal -Pioglitazona mejora el perfil lipídico y otros marcadores de RCV -Aumento de peso -Edemas -Incremento de incidencia de I.Cardiaca -Aumento de fracturas en extremidades -Incremento de incidencia de cáncer de vejiga -Necesitan de 6-12 semanas para valorar su máximo efecto -I.Cardiaca -I.Hepática -NO aumento de peso -Efectos adversos gastrointestinales -Baja eficacia si dieta pobre en hidratos de carbono -La hipoglucemia debe tratarse con glucosa pura -FG < 25 ml/min -I.Hepática severa -Enfermedad intestinal crónica -NO aumento de peso -Bien tolerados -Aumento de las infecciones de vias respiratorias altas y urinarias -Se han notificado casos de pancreatitis aguda -Beneficios y seguridad a largo plazo desconocidos -Coste alto -Vildagliptina en I.Hepática -Disminución de peso -Potencial efecto protector de la célula beta -Disminución de la presión arterial -Administración subcutánea -Efectos adversos digestivos (náusea, vómito) -Se han notificado casos de pancreatitis aguda -Beneficios y seguridad a largo plazo desconocidos -Coste alto -Exenatida con FG<30 ml/min -Liraglutida con FG<60 ml/min -Enfermedad gastrointestinal grave moderado/mínimo -Glimepirida: moderado35 GLINIDAS -Moderado GLITAZONAS NO INHIBIDORES DE α-GLUCOSIDASAS NO INHIBIDORES DE DPP-4 ANALOGOS DEL GLP-1 NO NO FG: Filtrado Glomerular. I.Hepática: Insuficiencia Hepática. I.Respiratoria: Insuficiencia Respiratoria. I.Cardiaca: Insuficiencia Cardiaca. I.Renal: Insuficiencia renal. RCV: Riesgo Cardiovascular 12 Tabla V: Recomendaciones de ajuste de dosis de fármacos del tratamiento de la hiperglucemia en la enfermedad renal crónica (ERC)31. Clase Medicamento Dosis recomendada en ERC estadío 3,4 ó transplante renal Dosis recomendada en diálisis Biguanidas Metformina No recomendada si FG < 30 ml/min Evitar Sulfonilureas (SU) Glipizida SU preferida: no requiere ajuste de dosis. No requiere ajuste de dosis Precaución con la de liberación prolongada Gliclazida SU preferida: no requiere ajuste de dosis No requiere ajuste de dosis Gliquidona No recomendada con FG < 30 ml/min Evitar Glimepirida Iniciar con dosis bajas (1mg/día) Evitar Glisentida Evitar si FG < 30 ml/min Evitar Glibenclamida Evitar Evitar Repaglinida No requiere ajuste de dosis No requiere ajuste de dosis Nateglinida Podría requerir ajuste de dosis si FG <30 ml/min Evitar Glitazonas Pioglitazona No requiere ajuste de dosis No requiere ajuste de dosis Inhb. DPP-4 Sitagliptina 50mg/día si FG ≥ 30 < 50 ml/min 25mg/día Meglitinidas 25mg/día si FG < 30 ml/min Vildagliptina 50mg/dia si FG < 50 ml/min Evitar Linagliptina No requiere ajuste de dosis No requiere ajuste de dosis Saxagliptina 2,5mg/día si FG < 50 ml/min Evitar Inhibidores alfa glucosidasa Acarbosa Evitar si FG < 25 ml/min Evitar Miglitol Evitar si FG < 25 ml/min Evitar Análogos del GLP-1 Exenatida Evitar si FG < 30 ml/min Evitar Liraglutida Evitar si FG < 60 ml/min Evitar 13 8-TRATAMIENTO INSULINICO La insulina es, sin duda, el hipoglucemiante más potente de que disponemos, así como el más fisiológico. Es el único tratamiento aprobado para el manejo de la diabetes tipo 1 y es necesario en muchos casos de diabetes tipo 2 para conseguir los objetivos metabólicos marcados. Es un fármaco seguro que lleva utilizándose desde hace más de 80 años. Su principal efecto adverso y limitación es la hipoglucemia. También se asocia a aumento de peso y a lipodistrofias en el lugar de inyección. El resto de efectos adversos son raros. La insulina se mide en unidades internacionales (UI). Una unidad internacional de insulina equivale a 41 mcg de insulina. Todas las insulinas comercializadas en España tienen una concentración de 100 UI/ml. Tipos de insulinas La secreción de insulina en el páncreas se produce con dos patrones: una secreción continua durante la fase de ayuno (insulinemia basal) y un pico de insulinemia en respuesta a la ingesta (insulinemia prandial). Tratando de imitar la secreción fisiológica de insulina, existen insulinas de acción intermedia o prolongada (para cubrir las necesidades basales de insulina) y otras insulinas de acción rápida (para cubrir las necesidades prandiales de insulina). Finalmente, existen un grupo de preparados con dos tipos de insulina mezcladas (insulinas bifásicas). Todos los tipos de insulina tienen unos efectos metabólicos similares, lo que les diferencia es su perfil de acción (farmacocinética). Los principales dispositivos de administración de insulina así como los distintos tipos de insulina comercializadas en la actualidad se recogen en los Anexos IV y V. INSULINAS DE ACCION RAPIDA La insulina humana (también llamada regular o cristalina) ha sido la primera insulina de acción rápida disponible. Cuando se administra vía subcutánea forma hexámeros en el tejido subcutáneo y su liberación a sangre se retarda. Comienza a actuar a los 30 minutos, tiene el pico máximo de acción a las 2-4 horas y dura unas 6 horas. Administrada por vía intravenosa su acción no se retarda y es inmediata, con una duración de unos 60 minutos. Se recomienda su administración 20-30 minutos antes de comenzar la ingesta (el periodo de espera puede alargarse a 45 minutos si la glucemia es elevada o incluso acortarse a 0 minutos si la glucemia es baja). En un estudio reciente con diabéticos tipo 2, el riesgo de hipoglucemias era similar cuando se administraba la insulina 20 minutos antes o cuando se administraba justo antes de la ingesta36. Los análogos de insulina son modificaciones de la molécula de insulina que buscan cambiar su perfil farmacocinético. Los análogos de acción rápida producen una liberación más rápida a sangre desde el tejido subcutáneo tratando de imitar la secreción prandial de insulina por el páncreas. Existen tres fármacos con perfiles de acción y eficacia similares: lispro, aspart y glulisina. Los análogos rápidos comienzan a actuar a los 10-15 minutos de administrarse, tienen un pico de acción a los 60 minutos y su acción dura unas 2-3 horas. Se recomienda su administración justo antes de comenzar la ingesta con un menor riesgo de hipoglucemia postprandial que con la insulina humana. En cualquier caso, no se ha demostrado en los metaanálisis realizados que la utilización de análogos sea superior a la insulina humana en el descenso de hemoglobina glicosilada o en el riesgo de hipoglucemias1. INSULINAS DE ACCION INTERMEDIA La insulina NPH ha sido durante varias décadas la única forma de retardo de la insulina humana. Tiene un comienzo de acción a los 60 minutos de administrarse, un pico de acción a las 6-8 horas y una duración de 16-18 horas. Sin 14 embargo, es difícil que tenga una eficacia hipoglucemiante suficiente más allá de 12 horas, por lo que se considera una insulina de acción intermedia. Se recomienda administrarla unos 30 minutos antes de la ingesta y asegurar otra ingesta a las 2-3 horas (para evitar el riesgo de hipoglucemia a las 3-4 horas de su administración). Es una insulina con una gran variabilidad farmacocinética intra e interindividual. La insulina NPL constituye la misma forma de retardo que la NPH, pero con insulina lispro. Es también una insulina intermedia con un perfil de acción similar a la NPH. INSULINAS DE ACCION PROLONGADA Los análogos de acción prolongada pretenden obtener un perfil de acción plano (con el menor efecto pico posible) y que dure 24 horas para cubrir las necesidades basales del paciente. Existen dos análogos: insulina glargina e insulina detemir. Tienen una eficacia similar en cuanto a control glucémico y riesgo de hipoglucemias con ligeras diferencias en otros aspectos. La insulina detemir tiene una menor duración de acción sobre todo en diabéticos tipo 142 (suele ser necesario su administración dos veces al día) con una variabilidad menor. La insulina glargina suele precisar menos dosis y produce mayor aumento de peso. Existen varias revisiones sistemáticas que comparan el uso de NPH y análogos en diabéticos tipo 1 y tipo 2. Los análogos no han demostrado conseguir un mejor control metabólico, aunque el riesgo de hipoglucemia fundamentalmente nocturna- es menor37. INSULINAS BIFASICAS Son preparados en los que se mezcla una insulina rápida con insulina de acción intermedia. Las mezclas pueden ser con insulina humana o con análogos de insulina38. El objetivo de esta insulina es conseguir cubrir en una administración las necesidades prandiales y basales del paciente. Las limitaciones de la insulina bifásica vienen condicionadas por el hecho de que la cantidad de insulina rápida es fija (la ingesta de hidratos de carbono debe adaptarse a la dosis de insulina), existe riesgo de hipoglucemia postprandial tardía (debe existir una segunda ingesta a las 2-3 horas de la primera) y su acción difícilmente dura más de 12 horas (por la acción de la insulina de acción intermedia). Sólo existe una mezcla con insulina humana comercializada que lleva 30% de insulina humana y 70% de NPH (humulina 30:70 ó mixtard 30). Debe administrarse 30 minutos antes de la ingesta. Con insulina lispro existen dos mezclas, con 25 y 50% de insulina rápida respectivamente (humalog mix 25 y 50). Con insulina aspart existen tres mezclas, con 30, 50 y 70% de insulina rápida (novomix 30, 50 y 70). Deben administrarse justo antes de comenzar la ingesta. Indicaciones de la insulina en diabetes tipo 2 - Hiperglucemia franca (>250 mg/dl) con intensa clínica cardinal (poliuria, polidipsia, pérdida de peso) al diagnóstico o en cualquier momento de la historia evolutiva de la enfermedad. Hiperglucemia con cetosis. Cuando no alcanzamos controles glucémicos con dos fármacos orales. Contraindicación de otros hipoglucemiantes. Embarazo. De forma provisional, durante circunstancias intercurrentes que provoquen empeoramiento de la hiperglucemia de forma transitoria. El ejemplo más habitual es el uso de corticoides por distintas circunstancias. 15 Esquemas de administración de insulina Las pautas con insulina más empleadas en la diabetes tipo 2 se recogen en la Figura 2: Figura 2: Algoritmo de insulinización en diabetes tipo 2. Criterios de insulinización1 Insulina basal2 + hipoglucemiantes no insulínicos Aumento de dosis 3 hasta glucemia en ayunas < 110 Si Hb A1c > objetivo, mirar glucemia precena Glucemia precena >120 y en tto con detemir/NPH/NPL Glucemia precena < 120 o tto con glargina Segunda dosis de insulina por la mañana4 Aumento de dosis 3 hasta glucemia precena < 120 5 Si Hb A1c > objetivo, INTENSIFICAR TRATAMIENTO 1 Criterios de insulinización: clínica cardinal intensa con hiperglucemia franca, cetosis, contraindicación de otros hipoglucemiantes, fracaso a 2 ó 3 hipoglucemiantes no insulínicos, empeoramiento del control glucémico por situación intercurrente. En los casos con muy mal control metabólico (Hb A1c>9%) se puede plantear de inicio una pauta con dos mezclas de insulina o con pauta basal-bolo para conseguir un control metabólico más rápido. 2 Dosis de inicio: 0.2 UI/kg de peso. Momento de inyección preferiblemente nocturna. 3 Ajuste de dosis de insulina basal: si glucemia en ayunas durante 3 días seguidos es <80 ó hipoglucemias - disminuir la dosis un 20%, entre 120-160 - aumentar 2 unidades la dosis de insulina, entre 160-200 - aumentar 4 UI y si es >200 - aumentar 6 UI. 4 En caso de añadir una segunda dosis de insulina detemir, NPH o NPL comenzar con 10 ó 12 UI por la mañana. La insulina detemir a una hora concreta con independencia del desayuno (con un intervalo de unas 12 horas de la inyección nocturna) y las insulinas NPH o NPL unos 30 minutos antes del desayuno. 5 En los casos con muy mal control metabólico (Hb A1c>9%), se puede plantear de inicio un tratamiento con múltiples dosis de insulina para conseguir un control metabólico más rápido. 16 INSULINA BASAL MAS HIPOGLUCEMIANTES ORALES39,40 Es la pauta de elección al comenzar la insulinización en diabéticos tipo 2 con mal control glucémico con dos o tres hipoglucemiantes orales. Consiste en añadir al tratamiento previo una dosis de insulina de acción intermedia o prolongada, con el objetivo principal de controlar la glucemia en ayunas. En caso de elegir una insulina de acción intermedia (NPH o NPL), se recomienda administrarla antes de acostarse con la ingesta de una ración de hidratos de carbono a los 30 minutos para minimizar el riesgo de hipoglucemia. Si optamos por una insulina de acción prolongada (detemir o glargina) se puede elegir el momento de administrarla. Recomendamos la administración por la mañana en sujetos donde el riesgo de hipoglucemia nocturna sea alto, y la administración por la noche en sujetos con neoglucogenesis hepática aumentada durante el ayuno. Se empieza con una dosis de 0.1-0.2 UI/kg de peso, aunque en casos de hiperglucemia franca, dosis de 0.3-0.4 UI/kg de peso son seguras. El ajuste de dosis se realiza según la glucemia en ayunas, una o dos veces por semana con aumento de la dosis progresiva (Figura 3). La autotitulación por parte del paciente se ha demostrado eficaz. Respecto a los hipoglucemiantes orales se recomienda mantener la metformina en todos los casos en los que no exista contraindicación. También se pueden mantener los inhibidores de DPP4, los agonistas de GLP1 o los secretagogos si están prescritos. En este último caso se recomienda disminuir la dosis para reducir el riesgo de hipoglucemias. No se recomienda asociar pioglitazona con insulina de forma general. En cualquier caso, se ha visto que la eficacia de esta pauta no es duradera y suele ser necesario intensificar el tratamiento insulínico en unos pocos años41. Figura 3: Algoritmo de intensificación de la pauta de insulina Criterios de intensificar la pauta de insulina 1 Mirar glucemias postprandiales durante 2-3 días. Dos mezclas de insulina 3 antes de desayuno y cena Insulina basal + rápida antes de la comida con la postprandial más alta. Ajustar dosis: -Dosis de la mañana según glucemias precomida y precena. - Dosis de la noche según glucemia en ayunas. Ajustar dosis2 hasta glucemia postprandial < 160 Si Hb A1c > objetivo Si Hb A1c > objetivo, elegir la segunda postprandial más elevada Insulina basal + rápida antes de las dos ingestas elegidas. Tercera dosis de insulina antes de comida4 Si Hb A1c > objetivo Ajustar dosis según algoritmo2 hasta glucemia postprandial < 160 Si Hb A1c > objetivo PAUTA BASAL – BOLO: insulina basal + rápida antes de las principales comidas 17 1 La intensificación de la mayoría de casos se haría por pasos hasta un esquema basal-bolo (rama de la izquierda). Se recomiendan dos mezclas de insulina en diabéticos con controles e ingestas regulares, que no quieran o no puedan llevar una pauta de múltiples dosis de insulina. 2 Ajuste de dosis de insulina rápida: Comenzar con 4 UI de rápida antes de la ingesta. Según glucemia postprandial durante 2-3 días de la ingesta con una cantidad similar en hidratos de carbono: -<80: reducir 2 UI la dosis. -160-200: aumentar 2 UI la dosis. ->200: aumentar 4 UI la dosis. 3 Elegir mezclas con una proporción de insulina rápida del 25-30%. Dosis de inicio: 0.3 UI/kg de peso repartido en 60% antes de desayuno y 40% antes de cena. 4 Añadir insulina rápida antes de la comida, o bien una mezcla con 50-70% de insulina rápida. Comenzar con 4 UI e ir ajustando hasta normalizar la glucemia de antes de cenar. INSULINOTERAPIA EN PAUTA BASAL-BOLO39,40 Consiste en la administración de insulina de acción prolongada en una o dos dosis para cubrir las necesidades basales y la administración de bolos de insulina rápida antes de las principales comidas. Es la pauta más flexible, que se asemeja más a la secreción fisiológica de insulina y con la que se pueden conseguir objetivos más ambiciosos. Pero también es la que requiere una mayor implicación del paciente con conocimientos de educación diabetológica y mayor número de autocontroles de glucemia capilar. Pese a todo, faltan estudios en diabetes tipo 2 que demuestren su eficacia a largo plazo en conseguir los objetivos glucémicos y prevenir complicaciones. Se puede intensificar el tratamiento desde la pauta basal más hipoglucemiantes orales de dos formas: de forma directa o por pasos41. De forma directa consiste en iniciar bolos de insulina rápida antes del desayuno, comida y cena (con 4 UI por ejemplo) e ir ajustando con la glucemia postprandial a las 2 horas para conseguir un valor inferior a 160 mg/dl. Por pasos consiste en iniciar sólo un bolo de rápida antes de la ingesta principal e ir ajustando la dosis. Si no se consiguen los objetivos, añadir un segundo y después un tercer bolo de insulina rápida. Este segundo esquema trata de conseguir una mejor aceptación por el sujeto. Por ambos caminos debemos suspender los hipoglucemiantes no insulínicos excepto la metformina que se mantiene en cualquier esquema. INSULINA BIFASICA EN DOS DOSIS La intensificación del tratamiento insulínico hacia una pauta basal-bolo no es lo más adecuado en algunos sujetos con diabetes tipo 2 que por distintos motivos no pueden autogestionar su enfermedad (edad avanzada, limitaciones físicas o psíquicas, falta de interés, etc). En estos casos se recomienda intensificar la pauta insulínica con dos dosis de insulina premezclada2. Se recomienda administrar insulina con una mezcla 25/75 ó 30/70 antes del desayuno y antes de la cena. La dosis de inicio recomendada es la dosis de insulina basal que lleve ó 0.3 UI/kg peso repartida en un 60% por la mañana y el 40% restante por la noche. Los horarios de ingestas y la cantidad de carbohidratos en las mismas deben ser constantes para evitar hipoglucemias (desayuno, media mañana, comida, cena y recena). En algunos casos, se puede añadir una insulina rápida o una mezcla con elevada proporción de rápida (50/50 ó 70/30) en la comida para controlar la glucemia posprandial. 18 PAUTA MOVIL DE INSULINA RAPIDA Consiste en administrar insulina rápida humana cada 6 horas en una cantidad que depende de la glucemia regular. Se trata de una pauta que no previene la hiperglucemia, ni la corrige de forma adecuada. No se recomienda su utilización en Atención Primaria, salvo en algunos casos de insulinización transitoria hasta decidir la pauta y dosis más adecuada. 9-TRATAMIENTO DE OTROS FACTORES DE RIESGO CARDIOVASCULAR La mayoría de los pacientes con diabetes tipo 2 presentan comorbilidades que aumentan el riesgo de episodios macrovasculares, como hipertensión arterial, sobrepeso u obesidad o dislipemia. Además tienen un riesgo cardiovascular 2 veces superior al de las personas no diabéticas 43. Por lo tanto, es fundamental el control de los factores de riesgo cardiovascular para reducir la incidencia de complicaciones macrovasculares. HIPERTENSION ARTERIAL Los objetivos de control de la presión arterial en pacientes con DM2 difieren en las distintas guías de práctica clínica,con recomendaciones entre 130-140 mmHg para la presión arterial sistólica (PAS) y 80-90 mmHg para la diastólica (PAD). La mayoría de los ensayos clínicos realizados en pacientes diabéticos e hipertensos y que obtuvieron beneficios en el tratamiento intensivo de la presión arterial no consiguieron PAS inferiores a 140 mmHg44,45. En el estudio ACCORD, en su rama de tratamiento de la presión arterial46, compararon 2 estrategias terapéuticas: una cuyo objetivo era conseguir una PAS<120 mmHg y otra con el objetivo de una PAS<140 mmHg. No hubo diferencias respecto a la variable principal de estudio que fue infarto agudo de miocardio no fatal, accidente cerebrovascular (ACV) no fatal o muerte cardiovascular. Sí se obtuvo por el contrario una disminución del riesgo de ictus (variable secundaria) con más efectos adversos graves en el grupo de tratamiento intensivo. Mitka47 en su artículo sobre resultados del estudio INVEST en el subgrupo de pacientes diabéticos y con enfermedad arterial coronaria, comenta que valores de PAS<140 mmHg reducían el riesgo cardiovascular; sin embargo PAS<130 mmHg no ofrecían beneficios adicionales y PAS<115 mmHg se asociaban a un incremento de la mortalidad. No hay evidencias sólidas que recomienden objetivos de PA <135/85 mmHg 48. El metaanálisis de McBrien K et al49 compara los efectos del tratamiento intensivo (PA< 130/80 mmHg) frente al tratamiento convencional (PA 140-160/ 85-100 mmHg ). Concluye, que si bien es cierto que un control más estricto es capaz de disminuir ligera, pero significativamente, el riesgo de ACV en los individuos DM2, no se encontraron evidencias de que estos umbrales redujeran el riesgo de mortalidad o de infarto de miocardio. Recomendaciones: El objetivo de control para la mayoría de los diabéticos tipo 2 es una presión arterial < 140/90. En pacientes jóvenes con larga expectativa de vida, pacientes con riesgo de ictus o que presenten daño orgánico o microalbuminuria es aconsejable una presión arterial <130/80 si se consigue con pocos fármacos y sin efectos secundarios. 7,27,44,49 Estrategia terapeútica: Fármacos: Los diuréticos, betabloqueantes, calcioantagonistas, IECA y ARA II han demostrado ser efectivos en la reducción de la morbimortalidad cardiovascular sin que se hayan encontrado diferencias entre ellos. Se recomienda que los fármacos que actúan sobre el sistema renina angiotensina formen parte del tratamiento inicial de la hipertensión del paciente diabético por su efecto beneficioso sobre la albuminuria y su capacidad de reducir la morbimortalidad cardiovascular incluso en los diabéticos hipertensos normoalbuminúricos. Si se necesita un segundo fármaco para conseguir los objetivos se debe añadir un diurético tiazídico o uno de asa si el FG<30 ml/min, o un calcioantagonista dihidropiridínico. 19 DISLIPEMIA La mayoría de las guías de práctica clínica recomiendan el tratamiento con estatinas en los pacientes diabéticos en prevención primaria, al considerar que la diabetes es un equivalente de riesgo coronario. Asumen que todos los diabéticos tiene un riesgo cardiovascular (RCV) alto o muy alto. En la mayor parte de los estudios realizados en prevención primaria la participación de diabéticos ha sido muy reducida. Si analizamos los ensayos clínicos y metaanálisis que hayan incluido sólo pacientes diabéticos o un número importante de ellos se observa que el beneficio en el tratamiento de la dislipemia en el paciente diabético depende en gran medida del riesgo cardiovascular50. No todos los pacientes con DM2 tienen el mismo RCV. Este riesgo depende de diferentes variables incluyendo la edad, la duración de la diabetes, el grado de control de los diferentes factores de RCV y de la presencia o no de nefropatía u otras lesiones arterioscleróticas subclínicas. En prevención primaria se recomienda la valoración del RCV 50,51 por medio de la función de Framingham calibrada por el grupo REGICOR52 que ha sido validada en población española (estudio VERIFICA) 53 y dispone de una tabla para la población con diabetes. Estas tablas calculan el riesgo coronario. (Anexo VI ). No deben utilizarse las tablas de riesgo en las siguientes situaciones: · En prevención secundaria. · En pacientes mayores de 75 años de edad. · En pacientes con Colesterol Total (CT) > 320 mg/dl o Colesterol LDL (c-LDL) > 240 mg/dl. · En pacientes con hipercolesterolemia familiar o dislipemias genéticas Recomendaciones: -Prevención Secundaria: Todos los diabéticos que han presentado un evento cardiovascular deben ser tratados con una estatina y establecer como objetivo de control c-LDL < 70 mg/dl. 7 -Prevención Primaria50,51: estimar el riesgo coronario. Aquellos diabéticos que presenten antecedentes familiares de enfermedad cardiovascular precoz, obesidad, retinopatía, alteración del índice tobillo/brazo o aumento del grosor de la íntima media carotídea deben reclasificarse a una categoría de riesgo superior. - Diabéticos con un RCV ≥ 10%: conseguir un c-LDL <100 mg/dl. Diabéticos con un RCV < 10%: conseguir un c-LDL <130 mg/dl. Los pacientes diabéticos de más de 15 años de evolución y/o microalbuminuria equipararse a prevención secundaria. podrían Estrategia terapéutica: Iniciar el tratamiento con estatinas cuando sea preciso para alcanzar los objetivos marcados. Si éstos no se logran, al menos conseguir una reducción del 30 al 40% del c-LDL. Si con la dosis moderada-alta no se alcanzase el objetivo señalado, hay que valorar el empleo de combinaciones farmacológicas adecuadas para la consecución de los objetivos indicados. ANTIAGREGACION La indicación de aspirina en prevención primaria en pacientes diabéticos sigue siendo objeto de debate y las guías de práctica clínica establecen recomendaciones diferentes. Varios metaanálisis publicados54-58 concluyen que no hay evidencia suficiente para recomendar la prescripción de aspirina en prevención primaria cardiovascular en personas con diabetes. A pesar de las escasas evidencias, la ADA recomienda considerar el tratamiento con aspirina en prevención primaria en diabéticos con un riesgo cardiovascular >10%. Esto incluye a varones mayores de 50 años y mujeres mayores de 60 años que tengan al menos un factor de riesgo mayor (historia familiar de ECV, tabaquismo, dislipemia, hipertensión arterial o albuminuria). 20 En pacientes con enfermedad cardiovascular (ECV) el beneficio de la antiagregación, principalmente con aspirina, está bien documentado. Se han cuantificado reducciones de eventos cardiovasculares del 25%, siendo el beneficio en pacientes diabéticos similar al de la población general. Recomendaciones: -Se prescribirá aspirina en dosis entre 75 y 162 mg/día a todos los diabéticos con ECV. -Actualmente no hay evidencia suficiente para recomendar aspirina en prevención primaria en pacientes diabéticos 10-SEGUIMIENTO EN LA DIABETES TIPO 2 En la valoración inicial del paciente con diabetes debemos: - Establecer el tipo de diabetes. Revisar tratamientos previos si los hubiera y valorar el grado de control metabólico. Valorar el resto de factores de riesgo cardiovascular. Detectar posibles complicaciones crónicas asociadas a la enfermedad. Acordar un plan de tratamiento y seguimiento con el sujeto. El contenido de las revisiones programadas tanto médicas como de enfermería queda recogido en la Tabla VI. Tabla VI: Contenido de las revisiones programadas médicas y de enfermería en el diabético: Anamesis Examen físico Laboratorio Síntomas Peso e IMC Hemoglobina A1c Valoración de otros factores de RCV TA y frecuencia cardiaca Perfil lipídico Cumplimiento dieta y ejercicio Perímetro cintura Creatinina y filtrado glomerular estimado Cumplimiento terapéutico Exploración física general Cociente albúmina-creatinina urinaria Revisión de autocontroles Examen del pie (pulsos, ECG Detección y manejo de hipoglucemias Educación diabetológica monofilamento, sensibilidad táctil, térmica y vibratoria) Zonas de inyección de insulina Cada 2-3 meses. Cada 6 meses. Al diagnóstico y anualmente. Medición de la glucemia capilar por el sujeto en la diabetes tipo 2 La medición de la glucemia capilar realizada por el propio paciente tiene como objetivo ofrecer información al paciente y a los profesionales para tomar decisiones sobre el tratamiento. Si el resultado no va a suponer una actuación por el paciente o en la consulta por el profesional, la medición no debería hacerse. 21 La frecuencia y momento de las mediciones de glucemia capilar deben ser individualizados y estar pactados por el equipo sanitario con el paciente. El número de mediciones debe depender del tipo de diabetes, el tipo de tratamiento, el grado de control necesario o la existencia de periodos especiales de inestabilidad (como el cambio de tratamiento o una enfermedad intercurrente). Como pauta general, la Sociedad Española de Diabetes en 2012 establece las siguientes recomendaciones sobre la frecuencia de las mediciones (Tabla VII): Tabla VII: Recomendaciones de autocontrol en el diabético tipo 2 (SED 2012) Control glucémico estable Control glucémico inestable Medidas no farmacológicas 0* 1 vez/día ó 1 perfil**/semana Fármacos que no provocan hipoglucemias 0* 1 vez/día ó 1 perfil/semana Fármacos que sí provocan hipoglucemias 1 vez/semana 1 vez/día ó 1 perfil/semana 3 veces/semana 2-3 veces/día 1-3 veces/día 2-3 veces/día + 1 perfil/semana 3-4 veces/día + 1 perfil/semana 4-7 veces/día Tipo de tratamiento Insulina basal Insulina bifásica o intermedia en 2-3 dosis Terapia bolo-basal * Su utilización sólo está justificada como medio de educación terapéutica y de forma temporal. ** Perfil semanal: medición de la glucemia capilar antes y a las 2 horas del desayuno, la comida y la cena. 11-CRITERIOS DE DERIVACION A ATENCION ESPECIALIZADA La diabetes mellitus es un problema de salud de primer orden cuya atención conlleva una gran cantidad de recursos sanitarios. La utilización de los mismos con eficiencia debe ser prioritaria, evitando entre otros las visitas innecesarias. Aunque no es el objetivo de esta guía, creemos que deberían existir mecanismos de comunicación entre los profesionales que atienden al sujeto con diabetes para evitar actuaciones duplicadas o descoordinadas. Se exponen a continuación criterios de derivación59,60 de forma general que deberían concretarse en nuestro ámbito de actuación en el contexto de un programa específico de atención al diabético. Derivación a Endocrinología y Nutrición - - - Diabetes mellitus tipo 1: o En el momento del diagnóstico. o En todos los casos para su seguimiento. En cualquier caso, el papel de Atención Primaria es importante en la detección temprana de situaciones que puedan derivar en complicaciones agudas, así como en el ajuste de tratamiento cuando proceda. Diabetes y embarazo. o Planificación del embarazo. o En la confirmación del embarazo en gestaciones no planificadas. o Al diagnóstico de la diabetes gestacional. Ante sospecha de una diabetes específica (genética, secundaria a endocrinopatía, etc). En sujetos con diabetes e IMC > 35 que quieran considerar la cirugía bariátrica como opción terapéutica. Diabetes mellitus tipo 2: 22 o Mal control metabólico (hiperglucemia crónica, hipoglucemias recurrentes moderadas o severas) pese a la instauración de las actuaciones previstas en el algoritmo de tratamiento. o Para intensificar la educación diabetológica en sujetos en los que se piense que una educación más compleja vaya a mejorar el autocontrol. o En cualquier caso a criterio del médico de Atención Primaria en el que considere que la Atención Especializada pueda ser beneficiosa para el paciente. o Diabéticos con pie diabético de tipo vascular o neuropático. Los agonistas de GLP1 necesitan visado de inspección médica para su financiación y en parte de nuestro ámbito no se admite la firma del médico de Atención Primaria. Mientras no se modifique esta situación enviar a Atención Especializada cuando se considere oportuna esta opción farmacológica para intensificar el tratamiento en sujetos con IMC > 30. Derivación a Nefrología Según el último documento de Consenso sobre Enfermedad Renal Crónica61 de varias Sociedades españolas, los criterios de derivación son iguales en sujetos diabéticos y no diabéticos. Los principales criterios de derivación son: - Cociente albúmina/creatinina > 300 mg/g o proteinuria > 300 mg en 24 horas. Filtrado glomerular inferior a 30 ml/mn (excepto mayores de 80 años sin progresión renal). ERC e HTA resistente refractaria al tratamiento (> 140/90 mmHg) con tres fármacos a plena dosis, uno de ellos diurético, una vez descartado el incumplimiento terapéutico. Deterioro agudo de la función renal descartados factores exógenos. Sospecha de patología renal distinta de la nefropatía diabética. Derivación a Oftalmología - Revisión oftalmológica al diagnóstico de la diabetes tipo 2 (fondo de ojo, tensión ocular, agudeza visual). Fondo de ojo anual. Se puede realizar cada 2-3 años en caso de buen control glucémico y fondo de ojo previo normal. En caso de retinopatía en progresión acortar el lapso hasta la siguiente revisión. Derivación a Cirugía Vascular - Arteriopatía periférica con dolor en reposo o nocturno en miembro inferiores. Sospecha clínica de arteriopatía periférica: clínica de claudicación intermitente, pulsos ausentes en extremidades inferiores, índice tobillo-brazo < 0.5. Ante la progresión de la clínica de arteriopatía periférica. Úlcera en pie que no cura. Derivación a Urgencias - Sospecha de síndrome hiperglucémico-hiperosmolar o de cetoacidosis diabética. Hipoglucemia grave o coma hipoglucémico, en especial cuando es provocado por sulfonilureas o insulinas de acción prolongada. - Hiperglucemia que precisa insulinización urgente y que en Atención Primaria no pueda realizarse. 23 13-ANEXOS ANEXO I: Otros tipos específicos de diabetes DEFECTOS GENETICOS DE LA FUNCION DE LA CELULA BETA DROGAS • Cromosoma 12, HNF-1α • Vacor (raticida), Pentamidina (MODY 3) • Cromosoma 7, glucocinasa (MODY 2) • Acido nicotínico • Cromosoma 20, HNF-4α (MODY 1) • Corticoides y Hormonas Tiroideas • Cromosoma 13, IPF-1 (MODY 4) • Diazóxido • Cromosoma 17, HNF-1β (MODY 5) • Agonistas betaadrenérgicos • Cromosoma 2, NeuroD1 (MODY 6) • ADN mitocondrial • Tiazidas • Dilantin • Interferon alfa DEFECTOS GENETICOS EN LA ACCION DE LA INSULINA INFECCIONES • Resistencia insulínica tipo A • Rubéola congénita • Leprechaunismo • Citomegalovirus • Síndrome de Rabson-Mendenhall • Otras • Diabetes lipoatrófica ENFERMEDADES DEL PANCREAS EXOCRINO • Pancreatitis • Hemocromatosis • Traumatismo/pancreatectomía • Neoplasia FORMAS INFRECUENTES DE DIABETES MEDIADAS POR FENOMENOS INMUNES • Síndrome del hombre rígido (stiff man) • Anticuerpos antirreceptor de insulina • Otros • Fibrosis quística • Pancreatopatía fibrocalculosa ENDOCRINOPATIAS OTROS SINDROMES GENETICOS ASOCIADOS CON DIABETES • Acromegalia • Síndrome de Down • Feocromocitoma • Síndrome de Klinefelter • Cushing • Síndrome de Turner • Glucagonoma • Porfirias • Hipertiroidismo • Ataxia de Friedreich • Somatostinoma • Corea de Huntington • Aldosteronoma • Distrofia miotónica • Síndromes de Lawrence-Moon-Biedl, Prader Willi y Wolfram 24 ANEXO II: Dieta por intercambio de raciones Normas a tener en cuenta Una ración es la cantidad de alimento que contiene 10 gr de proteínas en el caso de los alimentos proteicos, 10 gr de grasa en el caso de alimentos grasos y 10 gr de hidratos de carbono en el resto. La suma de raciones de alimentos de los grupos de lácteos, verduras, frutas y farináceos debe nos ayuda a elegir la dosis de insulina rápida que necesita. Los alimentos proteicos y grasos tienen un bajo contenido en hidratos de carbono y no se tienen en cuenta a la hora de calcular la dosis de insulina rápida. Utilizando los grupos de intercambio podrá dar variedad a sus menús y adaptar la dieta a sus necesidades. Se deben respetar las raciones pactadas en cada comida del día, sin intercambiar raciones entre ingestas o de un día para otro. Cantidad de alimento por una ración Lácteos 200 ml de leche (entera, semidesnatada o desnatada) 2 yogures (naturales, sabores, desnatados, bio) 2 Actimel Verduras 300 gr de escarola, lechuga, endibias, acelgas, espinacas, setas, champiñón, espárragos, pepinos, tomates, pimientos, col, berenjenas, calabacín 200 gr de judías verdes, nabos, puerros 100 gr de alcachofas, coles de Bruselas, zanahoria, remolacha, cebolla Frutas Farináceos 150 gr de melón, sandía 100 gr de naranja, albaricoque, pera, mandarina, ciruelas, piña, kiwi, fresa 50 gr de plátano, uva, cerezas, higos, mango, níspero, mango, chirimoya Grasas 10 gr de mantequilla, margarina 40 gr de aceitunas 30 gr de nata, crema de leche 15 gr de frutos secos 1 cucharada sopera de aceite o mayonesa 60 gr de guisantes (100 gr cocidos), habas (100 gr cocidas) 50 gr de patatas (cruda, hervida, al horno), boniatos 50 gr de maíz dulce 30 gr de patatas fritas 20 gr de legumbres (50 gr cocidas) 20 gr de pan (una rebanada pequeña) 20 gr de cereales de desayuno integrales (2 cucharadas soperas) 15 gr de tostadas, biscotes (2) 15 gr de cereales para desayuno (2 cucharadas soperas), galletas (2 tipo María) 15 gr de arroz (40 gr cocido), sémola (50 gr cocido), harina 15 gr de pasta (50 gr cocido) Alimentos proteicos 50 gr de ternera magra, buey, pollo, conejo, cordero o cerdo 60 gr de jamón de York, pechuga de pavo 75 gr de pescado blanco, azul, mársico 40 gr de ambutido 40 gr de queso 35 gr de jamón serrano Un huevo 25 Ejemplo de Dieta de 1500 kcal - Reparto de raciones Lácteos Desayuno Verduras Frutas Grasas Farináceos 1 0.5 1 1 Media mañana Comida Merienda 1 1 Cena Antes de dormir 1 Proteicos 2 0.5 2 2 2 4 1 0.5 1 2 2 4 2 0.5 Ejemplo de Dieta de 1500 kcal - Plan de alimentación: DESAYUNO: 1 vaso de leche ó 2 yogures + 20g de pan ó 15g de cereales + 1 fruta pequeña MEDIA MAÑANA: Medio vaso de leche ó 1 yogur ó 20g de queso, jamón, atún... COMIDA: + 1 fruta pequeña 1 plato de verdura o ensalada + ELEGIR ENTRE: -2 cucharones de pasta, arroz, patata, guisantes, legumbre sin pan -1 cucharón de pasta, arroz, patata, guisantes, legumbres y 40g de pan -Sin cucharón y 80g de pan + 100 g de carne ó 150g de pescado + 1 fruta mediana MERIENDA: 1 vaso de leche ó 2 yogures + 20g de pan ó 15g de cereales ó 2 tostadas CENA: Igual que en la comida, pero variando los platos RECENA: Media taza de leche ó 1 yogur + 1 fruta pequeña -30 g de aceite de oliva para todo el día (3 cucharadas soperas). -Tomar 3/4 nueces, avellanas o almendras crudas al día 26 Ejemplo de Dieta de 1800 kcal - Reparto de raciones Lácteos Desayuno Verduras Frutas Grasas Farináceos 1 1 2 1 Media mañana Comida Merienda 1 1 Cena Antes de dormir 1 Proteicos 2 1 2 2 2 4 1 1 2 2 2 4 2 1 Ejemplo de Dieta de 1800 kcal - Plan de alimentación: DESAYUNO: 1 vaso de leche ó 2 yogures + 40g de pan ó 30g de cereales + 1 fruta pequeña MEDIA MAÑANA: Medio vaso de leche ó 1 yogur ó 20g de queso, jamón, atún... + 40g de pan ó 30g de cereales o tostadas COMIDA: 1 plato de verdura o ensalada + ELEGIR ENTRE: -2 cucharones de pasta, arroz, patata, guisantes, legumbre sin pan -1 cucharón de pasta, arroz, patata, guisantes, legumbres y 40g de pan -Sin cucharón y 80g de pan + 100 g de carne ó 150g de pescado + 1 fruta mediana MERIENDA: 1 vaso de leche ó 2 yogures + 40g de pan ó 30g de cereales ó 2 tostadas CENA: Igual que en la comida, pero variando los platos RECENA: 1 taza de leche ó 2 yogures + 1 fruta pequeña -40 g de aceite de oliva para todo el día (4 cucharadas soperas). -Tomar 3/4 nueces, avellanas o almendras crudas al día 27 Ejemplo de Dieta de 2000 kcal - Reparto de raciones Lácteos Desayuno Verduras Frutas Grasas Farináceos 1 1 2 1 Media mañana Comida Merienda 1 1 Cena Antes de dormir 1 Proteicos 3 1 2 2 2 6 1 1 2 2 2 6 2 1 Ejemplo de Dieta de 2000 kcal - Plan de alimentación: DESAYUNO: MEDIA MAÑANA: COMIDA: 1 vaso de leche ó 2 yogures + 40g de pan ó 30g de cereales + 1 fruta pequeña Medio vaso de leche ó 1 yogur ó 20g de queso, jamón, atún... + 60g de pan ó 45g de cereales o tostadas 1 plato de verdura o ensalada + ELEGIR ENTRE: -3 cucharones de pasta, arroz, patata, guisantes, legumbre sin pan -2 cucharones de pasta, arroz, patata, guisantes, legumbres y 40g de pan -1 cucharón de pasta, arroz, patata, guisantes, legumbres y 80g de pan -Sin cucharón y 120g de pan + 100 g de carne ó 150g de pescado + 1 fruta mediana MERIENDA: 1 vaso de leche ó 2 yogures + 40g de pan ó 30g de cereales ó tostadas CENA: Igual que en la comida, pero variando los platos RECENA: 1 taza de leche ó 2 yogures + 1 fruta pequeña -40 g de aceite de oliva para todo el día (4 cucharadas soperas). -Tomar 3/4 nueces, avellanas o almendras crudas al día 28 Anexo III: Tratamiento de la hiperglucemia en la Diabetes tipo 2 Tratamiento de la hiperglucemia en la diabetes tipo 2 Algoritmo de la Sociedad Española de Diabetes Modificaciones del estilo de vida (dieta y ejercicio) Modificaciones del estilo de vida HbA 6,5-8,5% HbA1c 1c 6,5-8,5% Si existe intolerancia o contraindicación valorar: 1.Su** 2.IDPP4 3.TZD 4.Repaglinida 5.Inh. De las disacaridasas HbA > 8,5% HbA1c 1c > 8,5% Asintomático Asintomático No No se se alcanza alcanza el el objetivo objetivo de * en 3 meses de HbA HbA1c 1c* en 3 meses Hiperglucemia Hiperglucemia sintomática sintomática No * en 3 meses No se se alcanza alcanza el el objetivo objetivo de de HbA HbA1c 1c* en 3 meses *Objetivos de HbA1c Diabetes de corta duración, con larga expectativa de vida, sin complicaciones, ni comorbilidades No * en 3 meses No se se alcanza alcanza el el objetivo objetivo de de HbA HbA1c 1c* en 3 meses < 6,5% Diabetes con comorbilidades asociadas, con complicaciones vasculares avanzadas o con expectativa de vida limitada < 8% **Gliclazida o glimepirida No * en 3 meses No se se alcanza alcanza el el objetivo objetivo de de HbA HbA1c 1c* en 3 meses SU: sulfonilureas IDPP4: inhibidores de la dipeptidilpeptidasa 4 TZD: tiazolidindionas GLPI: Clucagon-like peptide l Adaptado de: Menéndez E, et al. Av Diabetol. 2010; 26:331-338. Anexo IV: Dispositivos de administración de insulina Kwikpen Flexpen Solostar Innolet 29 Anexo V: Tipos de insulinas Tipo Principio activo Nombre comercial Dispositivo Duración media* Innolet Actrapid Rápida Vial Humana Humulina regular 6 horas Vial Kwikpen Lispro Humalog Vial Análogos de acción rápida Flexpen Aspart Novorapid 2 horas Vial Solostar Glulisina Apidra Vial Flexpen Insulatard Vial NPH 12 horas Intermedias Kwikpen Humulina NPH Vial NPL Humulina basal Glargina Lantus Kwikpen 12 horas Solostar 24 horas Vial Análogos de acción prolongada Flexpen Detemir Levemir 24 horas Innolet Innolet Mixtard 30 Bifásicas con insulina humana Vial 30% 2 horas Kwikpen 70% 12 horas Mezcla 30/70 Humulina 30:70 Vial Bifásicas con análogos de acción rápida 25% 2 horas Mezcla 25/75 con lispro Humalog Mix 25 Mezcla 50/50 con lispro Humalog Mix 50 Mezcla 30/70 con aspart Novomix 30 Mezcla 50/50 con aspart Novomix 50 Mezcla 70/30 con aspart Novomix 70 Kwikpen 75% 12 horas 50% 2 horas Kwikpen 50% 12 horas 30% 2 horas Flexpen 70% 12 horas 50% 2 horas Flexpen 50% 12 horas 70% 2 horas Flexpen 30% 12 horas * La duración media indicada es orientativa y depende de múltiples factores (variabilidad inter e intraindividual, técnica y lugar de inyección, etc). Insulinas comercializadas en España. Consulta www.vademecum.es en febrero de 2012. 30 Anexo VI: Tablas REGICOR de RCV para Diabéticos 31 32 13-BIBLIOGRAFIA 1. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications: report of a WHO Consultation. Part1: Diagnosis and clasification of diabetes mellitus. Geneve: World Heath Organization; 1999. 2. Soriguer F, Goday A, Bosch-Comas A, Bordiú E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the [email protected] Study. Diabetologia. 2012 Jan;55(1):88-93.. 3. United Kingdom Prospective Diabetes Study Group. Intensive blood-glucose control with sulfonilureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes :UKPDS 33. Lancet 1998; 352: 837-52. 4. United Kingdom Prospective Diabetes Study Group. Effect of Intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352:854-864. 5. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year Follow-Up of Intensive Glucose Control in Type 2 Diabetes. N Engl J Med. 2008; 359:1577-89. 6. Gaede P., Lund-Andersen H., Parving H.-H., Pedersen O.; Effect of a multifactorial intervention on mortality in type 2 diabetes, N Engl J Med 2008; 358 : 580-591. 7. American Diabetes Association. Standards of Medical Care in Diabetes-2013.Diabetes Care. 36 (Supplement 1):S11-S66, January 2013. 8. John WG; UK Department of Health Advisory Committee on Diabetes. Use of HbA1c in the diagnosis of diabetes mellitus in the UK. The implementation of World Health Organization guidance 2011. Diabet Med. 2012 Nov; 29(11):1350-7. doi: 10.1111/j.1464-5491.2012.03762.x. 9. Practica clinica en la DM2. Análisis crítico de las evidencias por la redGDPS. Barcelona: Elsevier; 2011. 10. U K Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38.BMJ 1998; 317: 703-13. 11. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ. 1998; 317(7160): 703-13. 12. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year-follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577-89 13. Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M et al. ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes inpatients with type 2 diabetes. N Engl J Med. 2008;358:2560–2572 14. Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes.N Engl J Med 2008; 358:2560-72 15. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD et al for the VADT Investigators. Glucose Control and Vascular Complications in Veterans with Type 2 Diabetes. N Engl J Med 2009; 360:129-139 16. Alan J. Sinclair, Giuseppe Paolisso, Marta Castro, Isabelle Bourdel-Marchasson, Roger Gadsby, Leocadio Rodriguez Mañas. European Diabetes Working Party for Older People 2011 Clinical Guidelines for Type 2 Diabetes Mellitus. Executive Summary. Diabetes & Metabolism. Volume 37(S3):S27-S38. 17. Guía de práctica clínica sobre diabetes tipo 2. Ministerio de Sanidad y Consumo. 2008. Disponible en: http://www.guiasalud.es/viewGPC.asp?idGuia=429 18. American Diabetes Association. Standards of Medical Care in Diabetes-2013.Diabetes Care. 36 (Supplement 1):S11-S66, January 2013. 19. Klein S, Sheard NF, Pi-Sunyer X, et al. American Diabetes Association; North American Association for the Study of Obesity; American Society for Clinical Nutrition. Weight management through lifestyle modification for the prevention and management of type 2 diabetes: rationale and strategies: a statement of the American Diabetes Association, the North American Association for the Study of Obesity, and the American Society for Clinical Nutrition. Diabetes Care 2004;27:2067–2073. 20. Wing RR; Look AHEAD Research Group. Long-term effects of a lifestyle intervention on weight and cardiovascular risk factors in individuals with type 2 diabetes mellitus: four-year results of the Look AHEAD trial. Arch Intern Med 2010;170:1566–157. 21. Dixon JB, Zimmet P, Alberti KG, et al. Bariatric surgery: an IDF statement for obese Type 2 diabetes. Diabetic Medicine 2011; 28, 628–642. 33 22. Mann JI, Antwerp I, Hermansen K et al. Evidence-based nutritional approaches to the treatment and prevention of diabetes mellitus. Nutr Metab Cardiovasc Dis (2004) 14: 373–394. 23. Bloomgarden ZT, Dodis R, Viscoli CM, Holmboe ES, Inzucchi SE. Lower baseline glycemia reduces apparent oral agent glucose-lowering efficacy: a meta-regression analysis. Diabetes Care. 2006; 29(9):2137-9. 24. Bolen S, Feldman L, Vassy J, Wilson L, Yeh H, Marinopoulos S, et al. Systematic Review: Comparative Effectiveness and safety of Oral Medications for Type 2 Diabetes Mellitus. Ann Intern Med. 2007; 147(6):386-99. 25. Management of hyperglycemia in Type 2 Diabetes: A Patient-Centered Approach:Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Inzucchi SE et al. Diabetes Care 2012; 35(6):1364-79. 26. Nathan DM, Buse JB, Davidson MB, Ferranini E, Holman RR, Sherwin R, Zinman B. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustement of therapy. Diabetes Care.2009; 32(1):193-203. 27. NICE (National Institute for Health and Clinical Excellence) . Type 2 diabetes: the management of type 2 diabetes (update) Clinical guideline. Disponible en: http://www.nice.org.uk/nicemedia/pdf/CG87NICEGuideline.pdf 28. SIGN (Scottish Intercollegiate Guidelines Network). Management of diabetes. A national clinical guideline.March 2010. Disponible en: http://www.sign.ac.uk/pdf/sign116.pdf 29. Guia de práctica clínica sobre diabetes tipo 2. Ministerio de Sanidad y Consumo. 2008. Disponible en :http://www.guiasalud.es/viewGPC.asp?idGuia=429 30. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.2013;Volume 3 (1) . Disponible en : http://www.kidney-international.org. 31. Esmatjes E, Rodríguez N, Quiros C, Poch E. Tratamiento de la hiperglucemia en la enfermedad renal crónica. Endocrinol Nutr. 2012;59(supl. 1):12-21 32. Arjona JC, Corry D, Mogensen CE, Sloan L, Xu L, Golm GT et al . Efficacy and Safety of Sitagliptin in Patients With Type 2 Diabetes and ESRD Receiving Dialysis: A 54-Week Randomized Trial. Am J Kidney Dis. 2013 Jan 23. doi:pii: S02726386(12)01510-7. 10.1053/j.ajkd.2012.11.043. [Epub ahead of print] 33. Cano JF, Franch J y miembros de los grupos de la redGDPS de España. Guía de la diabetes tipo 2. Recomendaciones clínicas con niveles de evidencia. 5.a ed. Barcelona: Elsevier España; 2011. 34. Second-Line Therapy for Patients With Diabetes Inadequately Controlled on Metformin: A Systematic Review and CostEffectiveness Analysis. Canadian Agency for Drugs and Technologies in Health .2010; 4 (2) 35. Gangji AS, Cukierman T, Gerstein HC, Goldsmith CH, Clase CM. A systematic review and meta-analysis of hipoglicemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin. Diabetes Care 2007;30:389-94 36. Müller N, Frank T, Kloos C, et al. Randomized Crossover Study to Examine the Necessity of an Injection-to-Meal Interval in Patients With Type 2 Diabetes Mellitus and Human Insulin. Diabetes Care. 2013 Jan 22. [Epub ahead of print] 37. Guía de práctica clínica sobre diabetes tipo 2. Ministerio de Sanidad y Consumo. 2008. Disponible en: http://www.guiasalud.es/viewGPC.asp?idGuia=429 38. Masmiquel L, Mauricio D, Vidal Parto JI et al. Consenso sobre el uso de insulinas premezcladas en el tratamiento de la diabetes tipo 1 y 2. Current Opinion in Endocrinology, Diabetes and Obesity 2009; 16 (número especial 1): S3-S15. 39. Menéndez Torre E, Lafita Tejedor J, Artola Menéndez S, et al. Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2. Avances en Diabetología 2010; 26: 331-338. 40. Inzucchi SI, Bergenstal RM, Buse JB, et al. Management of Hyperglycemiain Type 2 Diabetes: A Patient-Centered Approach. Diabetes Care 2012; 35: 1364-1379. 41. Holman RR, Farmer AJ, Davies MJ et al. Three year efficacy of complex insulin egimens in type 2 diabetes. N Engl J Med 2009: 361: 1736-1747. 42. Porcellati F, Bolli GB, Fanelli CG. Farmacocinética y farmacodinamia de las insulinas basales. Diabetes technology & therapeutics 2011; 13 (suplemento 1): S15-S24. 43. Sarwar N, Gao P, Seshasai SR, Gobin R,Kaptoge S, Di Angelantonio E, Ingelsson E, Lawlor DA, Selvin E, Stampfer M,Stehouwer CD, Lewington S, Pennells L, Thompson A, Sattar N, White IR, Ray KK,Danesh J. Emerging Risk Factors 34 Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative metaanalysis of 102 prospective studies. Lancet. 2010 ;375:2215-22. 44. Mancia G, Laurent S, Agabiti-Rosei E, Ambrosioni E, Burnier M, Mark J, et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. Journal of Hypertension. 2009; 27: 2121-58. 45. ADVANCE Collaborative Group. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet 2007;370:829-40. 46. The ACCORD study group. Effects of intensive blood pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362:1575-85. 47. Mitka M. Aggressive lipid, hypertension targeting yields no benefit for some with diabetes. JAMA 2010;303:1681-3. 48. Grossman E, Messerli FH. . Management of blood pressure in patients with diabetes Am J Hypertens. 2011 Aug;24(8):863-75. 49. McBrien K, Rabi DM, Campbell N, Barnieh L, Clement F, Hemmelgarn BR, Tonelli M, Leiter LA, Klarenbach SW, Manns BJ. Intensive and Standard Blood Pressure Targets in Patients With Type 2 Diabetes Mellitus: Systematic Review and Meta-analysis. Arch Intern Med. 2012 172(17):1296-1303. 50. Rodriguez A, Alemán JJ, Alvarez A, Torres JL en representación de la RedGDPS. Estatinas en la prevención primaria de la enfermedad cardiovascular en pacientes con diabetes tipo 2. Diabetes Práctica. 2012; 3: 9-17 51. Ministerio de Sanidad, Servicios Sociales e Igualdad. Estrategia en diabetes del Sistema Nacional de Salud. Actualización. Madrid: Centro de Publicaciones, Ministerio de Sanidad Servicios Sociales e Igualdad, 2012. 52. Marrugat J, Solanas P, D'Agostino R, Sullivan L, Ordovas J, Cordón F, Ramos R, Sala J, Masià R, Rohlfs I, Elosua R, Kannel WB.[Coronary risk estimation in Spain using a calibrated Framingham function]. Rev Esp Cardiol. 2003; 56:253-61. 53. Marrugat J, Subirana I, Comín E, Cabezas C, Vila J, Elosua R, Nam BH, Ramos R, Sala J, Solanas P, Cordón F, Gené-Badia J, D'Agostino RB; VERIFICA Investigators. Validity of an adaptation of the Framingham cardiovascular risk function: the VERIFICA Study. J Epidemiol Community Health. 2007;61:40-7. 54. De Berardis G, Sacco M, Strippoli GF, Pellegrini F, Graziano G, Tognoni G, Nicolucci A. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ. 2009;339:b4531. 55. Zhang C, Sun A, Zhang P et al. Aspirin for primary prevention of cardiovascular events in patients with diabetes: A meta-analysis, Diab. Res. Clin. Pract. 2010; 87 (2): 211-18. 56. Calvin AD, Aggarwal NR, Murad MH, Shi Q, Elamin MB, Geske JB, et al. Aspirin for the Primary Prevention of Cardiovascular Events: A Systematic Review and Meta-Analysis Comparing Patients With and Without Diabetes. Diabetes Care 2009,3212:2300-06 57. Scot H. Simpson, , PharmD, John-Michael Gamble, , Laurie Mereu, Thane Chambers.J Effect of Aspirin Dose on Mortality and Cardiovascular Events in People with Diabetes: A Meta-Analysis. Gen Intern Med 26(11):1336–44. 58. Seshasai SR, Wijesuriya S, Sivakumaran R, Nethercott S, Erqou S, Sattar N, Ray KK. Effect of Aspirin on Vascular and Nonvascular Outcomes Meta-analysis of Randomized Controlled Trials. Arch Intern Med. 2012 Feb 13;172(3):209-16. 59. Guía de práctica clínica sobre diabetes tipo 2. Ministerio de Sanidad y Consumo. 2008. Disponible en: http://www.guiasalud.es/viewGPC.asp?idGuia=429 60. Forga L, Astorga R, Albero R et al. Criterios de derivación desde atención primaria a atención especializada del paciente diabético. Endocrinol Nutr 2005; 52 (1): 30-31. 61. Documento de consenso sobre Enfermedad Renal Crónica. Noviembre http://www.seen.es/pdf/noticias/dic12/consenso-enfermedad-renal-cronica.pdf en 2012. Disponible en: 35 36