anexo c. pruebas diagnósticas más frecuentes
Anuncio
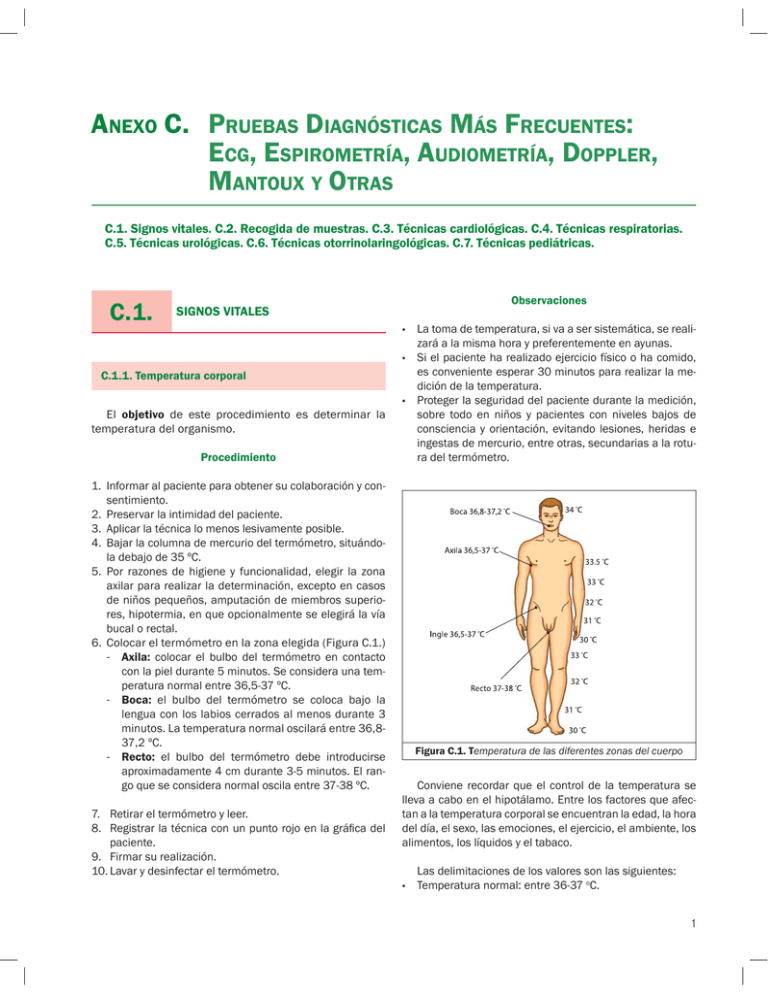
ANEXO C. PRUEBAS DIAGNÓSTICAS MÁS FRECUENTES: ECG, ESPIROMETRÍA, AUDIOMETRÍA, DOPPLER, MANTOUX Y OTRAS C.1. Signos vitales. C.2. Recogida de muestras. C.3. Técnicas cardiológicas. C.4. Técnicas respiratorias. C.5. Técnicas urológicas. C.6. Técnicas otorrinolaringológicas. C.7. Técnicas pediátricas. C.1. SIGNOS VITALES C.1.1. Temperatura corporal El objetivo de este procedimiento es determinar la temperatura del organismo. Procedimiento 1. Informar al paciente para obtener su colaboración y consentimiento. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Bajar la columna de mercurio del termómetro, situándola debajo de 35 ºC. 5. Por razones de higiene y funcionalidad, elegir la zona axilar para realizar la determinación, excepto en casos de niños pequeños, amputación de miembros superiores, hipotermia, en que opcionalmente se elegirá la vía bucal o rectal. 6. Colocar el termómetro en la zona elegida (Figura C.1.) - Axila: colocar el bulbo del termómetro en contacto con la piel durante 5 minutos. Se considera una temperatura normal entre 36,5-37 ºC. - Boca: el bulbo del termómetro se coloca bajo la lengua con los labios cerrados al menos durante 3 minutos. La temperatura normal oscilará entre 36,837,2 ºC. - Recto: el bulbo del termómetro debe introducirse aproximadamente 4 cm durante 3-5 minutos. El rango que se considera normal oscila entre 37-38 ºC. 7. Retirar el termómetro y leer. 8. Registrar la técnica con un punto rojo en la gráfica del paciente. 9. Firmar su realización. 10. Lavar y desinfectar el termómetro. Observaciones • La toma de temperatura, si va a ser sistemática, se realizará a la misma hora y preferentemente en ayunas. • Si el paciente ha realizado ejercicio físico o ha comido, es conveniente esperar 30 minutos para realizar la medición de la temperatura. • Proteger la seguridad del paciente durante la medición, sobre todo en niños y pacientes con niveles bajos de consciencia y orientación, evitando lesiones, heridas e ingestas de mercurio, entre otras, secundarias a la rotura del termómetro. Figura C.1. Temperatura de las diferentes zonas del cuerpo Conviene recordar que el control de la temperatura se lleva a cabo en el hipotálamo. Entre los factores que afectan a la temperatura corporal se encuentran la edad, la hora del día, el sexo, las emociones, el ejercicio, el ambiente, los alimentos, los líquidos y el tabaco. Las delimitaciones de los valores son las siguientes: • Temperatura normal: entre 36-37 oC. 1 MANUAL CTO OPOSICIONES DE ENFERMERÍA • Hipotermia: cifras inferiores a 36 oC. • Febrícula o décimas de fiebre: entre 37,1 oC y 37,9 oC. • Hipertermia o pirexia: cifras superiores a 38 oC. En función de la curva que describa la fiebre, se puede distinguir varios tipos: • Fiebre en agujas o intermitente: en la gráfica se observan bruscos ascensos y descensos de la temperatura. Se caracteriza por presentar elevaciones durante la tarde y por las mañanas puede ser normal. • Fiebre ondulante o remitente: a lo largo del día se producen numerosas variaciones de la temperatura manteniéndose siempre uno o dos grados por encima de la normal. • Fiebre en meseta o continua: la temperatura se mantiene por encima de los valores normales a lo largo del día y sufriendo muy pocas variaciones. Observaciones • Es importante no comenzar el recuento del pulso inmediatamente y dejar al paciente que se sienta relajado, para no inducir a error. • No utilizar el dedo pulgar, pues percibirá su propio latido. • Hay que tener en cuenta que si hay un cambio de posición en el paciente de decbito supino a bipedestación se incrementa la frecuencia del pulso. C.1.2. Frecuencia cardíaca La toma de la frecuencia cardíaca consiste en contar los latidos cardíacos durante un minuto. Procedimiento 1. Informar al paciente para obtener su colaboración y su consentimiento. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Se puede realizar la medición del pulso radial (más frecuente) y apical (Figura C.2): - Radial: › Localizar el latido sobre la arteria radial a la altura de la muñeca, por debajo de la tabaquera anatómica. › Apoyar la yema de los dedos índice, medio y anular en dicha arteria. › Contar el número de latidos en 30 segundos y multiplicar por dos. › Si se observa alteración, repetir la determinación durante un minuto o tomar el pulso apical. - Apical: › Colocar al paciente en posición decúbito supino con el hemitórax izquierdo descubierto. › Situar el fonendoscopio en la zona apical (línea media clavicular en el quinto espacio intercostal) y contar el número de latidos durante un minuto. 5. Registrar la medición en la gráfica con un punto de color azul. 6. Firmar su realización. 2 p Figura C.2. Toma de pulso Conviene recordar lo siguiente: • La frecuencia del pulso es el número de pulsaciones por minuto. Así, se considera: - Frecuencia normal: de 60 a 80 pulsaciones/minuto. - Bradicardia: por debajo de 60 pulsaciones/minuto. - Pulso acelerado: de 80 a 90 pulsaciones/minuto. - Taquicardia: valores superiores a 100 pulsaciones/ minuto. • El ritmo del pulso indica la regularidad de los latidos. Según el ritmo, el pulso puede ser: - Rítmico: cuando las pulsaciones se producen a intervalos regulares de tiempo. - Arrítmico: cuando las pulsaciones se producen a intervalos irregulares de tiempo. ANEXO C • La amplitud del pulso indica el volumen de sangre expulsado por el corazón en una contracción. Según la amplitud, el pulso puede ser: - Débil o filiforme: el que es muy fino y escasamente perceptible. - Febril: pulso característico de la fiebre; suele describirse como pleno y rebotante. - Fuerte: pulso forzado; pulso de gran amplitud. - Pleno: pulso que se percibe con facilidad; el que produce gran amplitud en el vaso que se palpa. - Rebotante: aquel en el que ocurre una expansión mayor de lo normal que luego desaparece rápidamente. • Se recomienda determinar la frecuencia respiratoria inmediatamente tras la toma del pulso, sin retirar los dedos de la arteria escogida y desviando la mirada hacia el tórax del paciente sin avisarlo, para que no cambie el ritmo respiratorio. • La tensión del pulso indica la fuerza con que la sangre sale del corazón. Según la tensión del pulso, se encontrará: - Blando: pulso de tensión baja. - Duro: el que se caracteriza por tensión muy elevada. - Elástico: pulso completo que produce una sensación elástica en el dedo. - De tensión baja: pulso con iniciación súbita, duración breve y declinación rápida; se oblitera fácilmente mediante presión. Existen diferentes tipos de respiraciones que se exponen a continuación: • Abdominal: respiración en la cual intervienen el diafragma y los músculos respiratorios. • Artificial: la que se efectúa por medios artificiales. • De Biot: respiración caracterizada por periodos irregulares de apnea alternados con periodos en los que se efectúan cuatro o cinco respiraciones de profundidad idéntica; se observa en pacientes víctimas de hipertensión craneal. • De Bouchut: respiración en la que la fase inspiratoria es más breve que la fase espiratoria; se observa en niños víctimas de bronconeumonía. • De Cheyne-Stokes: respiración caracterizada por intensificación y disminución de la profundidad respiratoria, con periodos de apnea que recurren con regularidad. Se observa especialmente en caso de coma resultante de afección de los centros nerviosos. • Diafragmática: la efectuada principalmente por el diafragma. • Estertorosa: la que se acompaña de ruidos roncantes anormales. • Fetal: intercambio de gases a través de la placenta. • Laboriosa: la que se efectúa con dificultad. • Suprimida: respiración sin ningún ruido apreciable, como puede ocurrir en caso de consolidación extensa del pulmón o derrame pleural. • Torácica: respiración efectuada por los músculos intercostales y torácicos de otro tipo. C.1.3. Frecuencia respiratoria La medición de la frecuencia respiratoria se puede definir como la determinación del número de respiraciones en un minuto. Procedimiento 1. Informar al paciente para obtener su colaboración y su consentimiento. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Observar el tórax del paciente y contar el número de respiraciones en 30 segundos y multiplicar por dos. En caso de estar alterada, se repetirá la operación durante un minuto. 5. En pacientes con movimientos respiratorios poco perceptibles que induzcan a error se realiza la medición con fonendoscopio situado en el hemitórax derecho del paciente, contando el número de respiraciones durante un minuto. 6. Registrar la medición en la gráfica con un punto de color negro. 7. Firmar su realización. Según los resultados obtenidos de la medición, la frecuencia respiratoria se puede clasificar de la siguiente forma: • Eupnea: de 12 a 18 respiraciones/minuto (en el adulto). • Taquipnea: cifras superiores a 18 respiraciones/minuto. • Bradipnea: cifras inferiores a 12 respiraciones/minuto. • Apnea: ausencia de respiración. C.1.4. Presión arterial La determinación de la presión arterial consiste en medir la resistencia que ofrecen las paredes de las arterias con relación a la intensidad del flujo sanguíneo. Observaciones Procedimiento • En esta técnica no hay que informar al paciente antes de realizarla, ya que puede alterar el resultado de la medición. 1. Informar al paciente para obtener su colaboración y consentimiento. 3 MANUAL CTO OPOSICIONES DE ENFERMERÍA 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Colocar al paciente en situación cómoda y relajada, preferentemente en decúbito supino, observando que no existan entre el corazón y la zona de aplicación del manguito obstáculos para la circulación. En pacientes hipertensos es aconsejable el control además en bipedestación También se recomienda a pacientes mayores de 65 años, por la posibilidad de hipotensión ortoestática fisiológica. 5. Colocar el manguito del tamaño adecuado y totalmente desinflado alrededor del brazo. 6. Localizar el pulso braquial con las yemas de los dedos índice y medio y colocar en ese punto la membrana del fonendoscopio. 7. Cerrar la válvula e insuflar el manguito hasta que desaparezca el pulso radial (180-200 mmHg). 8. Dejar salir el aire lentamente (20 mmHg/s) observando la escala del manómetro y anotar la lectura al primer latido que corresponde a la presión arterial sistólica o máxima. La presión diastólica o mínima corresponde al momento en que el sonido de la pulsación desaparece o cambia de nitidez o intensidad. 9. Desinflar completamente el manguito y retirarlo. Cuando se aprecien arritmias o bradicardias, se desinflará muy lentamente. 10.Registrar la medición con bolígrafo verde en la gráfica. 11.Firmar su realización. Figura C.3. Toma de la tensión arterial C.2. RECOGIDA DE MUESTRAS C.2.1. Extracción de sangre Observaciones Extracción de sangre con jeringa • En caso de necesidad, puede realizarse la determinación en los miembros inferiores (arteria poplítea). Los valores de la presión arterial (PA) en los miembros inferiores oscilan entre 10 y 40 mmHg más elevados que en miembros superiores • La presión arterial sistólica se puede determinar sin necesidad de fonendoscopio por palpación de la arteria radial. • El manguito de presión tiene que ocupar dos tercios (75%) de la longitud del brazo, 2 o 3 cm por encima de la flexura del codo. • Con un manguito excesivamente estrecho, las cifras de tensión arterial se sobrevaloran, y si es demasiado ancho, se subestiman. Para tomar la tensión arterial es aconsejable que el paciente: • Se halle en reposo, por lo menos unos 20 minutos antes. • Se realice fuera de las comidas. • Siempre con el mismo aparato, vigilando que esté bien calibrado. • A las mismas horas cada día. • La medición debe hacerse estando el paciente sentado o acostado. 4 Consiste en el acceso a una vía vascular venosa periférica con el objetivo de conseguir sangre venosa para su posterior examen. A. 1. 2. 3. 4. 5. Procedimiento Lavarse las manos y enfundarse los guantes. Identificar al paciente. Leer la petición. Preparar los tubos. Selecciónar la jeringa dependiendo de la cantidad de sangre a extraer. 6. Conectar la jeringa a la aguja. 7. Colocar el compresor por encima del codo. 8. Elegir la zona y la vía a puncionar. 9. Desinfectar el lugar elegido. 10. Puncionar con el bloque jeringa-aguja. 11. Extraer la sangre. 12. Retirar el compresor. 13. Retirar la jeringa y taponar con el soporte de coagulación. 14. Informar al paciente sobre la compresión de 5 a 10 minutos en el lugar de la punción, advirtiendo de las posibles complicaciones. ANEXO C 15. Traspasar la sangre de la jeringa a los tubos, resbalándola por las paredes, o bien dejando que el tubo primario de vacío absorba la sangre hasta el nivel correcto. 16. Sujetar el soporte de coagulación con esparadrapo. 17. Informar del tiempo en recoger el análisis. 18. Registrar la técnica. Entre las complicaciones que pueden presentarse estarían los hematomas. Extracción de sangre con sistema de vacío Esta técnica consiste en canalizar un vaso sanguíneo con una aguja o catéter para sacar sangre y analizarla. A. Procedimiento 1. Informar al paciente del procedimiento. 2. Identificar al paciente y seleccionar los tubos necesarios para la extracción según el volante de petición. 3. Colocar al paciente sentado o tumbado. 4. Situar el compresor aproximadamente 10 cm por encima de la flexura del codo y la cara anterior del antebrazo a la vista del profesional encargado de la extracción. 5. Seleccionar por palpación una vena para la extracción. 6. Desinfectar la zona con el soporte de coagulación humedecido en el antiséptico. 7. Comprobar la vena seleccionada. 8. Conectar la aguja al portatubos (Holder). 9. Avisar al paciente de que se va a realizar la punción. 10. Realizar la punción y conectar los tubos al portatubos para la extracción. 11. Soltar el compresor. 12. Sacar la aguja y hacer compresión con el soporte de coagulación. 13. Sujetar el soporte de coagulación con esparadrapo. B. Observaciones • Comprimir durante unos 10 minutos con el brazo estirado. • Aconsejar que el esparadrapo solo se sujeta, no se comprime. • Si se tiene constancia de la extravasación de sangre ponerlo en conocimiento del paciente y las medidas que puede tomar. C.2.2. Glucemia capilar 2. Preparar las tiras reactivas de glucemia. 3. Comprobar los códigos (aparato y envase de tiras reactivas). 4. Preparar el dispositivo automático para lancetas y el algodón. 5. Sugerir al paciente diabético el lavado de manos con agua y jabón en consulta, evitando el alcohol en la zona de posterior punción. 6. Explicar la técnica, mínimamente dolorosa, (quizás molesta) pero rápida. 7. Elegir la zona de punción. 8. Obtener una buena gota de sangre (a ser posible despreciar la primera, utilizando la siguiente). 9. Depositar la gota de sangre en la tira reactiva, cubriendo totalmente el reactivo. 10. Seguir las instrucciones específicas de cada aparato para la colocación de la tira reactiva y leer el resultado. 11. Presionar la zona de punción con algodón o gasa. 12. Retirar el material utilizado. 13. Registrar la técnica. Observaciones • Es necesario entrenar al paciente diabético en la realización de la técnica e interpretación de la misma, fomentando de esta forma el autocuidado y el autocontrol. • En la limpieza del dedo (o zona de punción) debe evitarse el alcohol para no interferir en los valores y evitar el deterioro de la piel. Figura C.4. Glucemia capilar C.2.3. Gasometría arterial Es la determinación del nivel de glucosa en sangre periférica (capilar) por medio de tiras reactivas. Es la técnica que consiste en canalizar una arteria y extraer suficiente sangre arterial para analizarla. Procedimiento Procedimiento 1. Preparar del reflectómetro (puesta en marcha, comprobación, funcionamiento, calibración). 1. Lavarse las manos y enfundarse unos guantes. 2. Comprobar los datos del paciente y etiquetar la jeringa. 5 MANUAL CTO OPOSICIONES DE ENFERMERÍA 3. Explicar al paciente en términos coloquiales lo que se le va a hacer. 4. Seleccionar la zona de punción por este orden: - Arteria radial. - Arteria humeral. - Arteria femoral. Preferiblemente se puncionará la arteria radial más accesible y con menos complicaciones. No obstante, antes de seleccionar el punto de punción, es preciso comprobar que la circulación colateral sea adecuada realizando el test de Allen. 12. Extraer la jeringa y comprimir con el soporte de coagulación. 13. Comprobar que es sangre arterial y desconectar la aguja. Desechar el aire y las burbujas purgando la jeringa. Tapar con el tapón de seguridad. 14. Agitar y homogeneizar. 15. Poner el esparadrapo. 16. Informar del riesgo de hematoma, el paciente deberá apretarse 10 minutos sobre la zona de punción. 17. Mandar al laboratorio lo antes posible. 18. Esperar el resultado y comprobar que los valores se corresponden con sangre arterial (Figuras C.6 y C.7). Durante la aplicación de esta técnica se pueden producir las siguientes complicaciones: • Hematomas. • Dolor por dañar zonas tendinosas o nervios. • En caso que se hubiera extraído sangre venosa, se deberá repetir la técnica. Hay que tener en cuenta las siguientes precauciones: • Si el paciente tiene oxigenoterapia, deberá estar 20 minutos con ella. • Si el médico expresara la necesidad de realizar la técnica con oxigenoterapia, es necesario anotar en la petición la concentración de oxígeno y el caudal del mismo. NOMBRE VALOR pH De 7,35 a 7,45 (7,38-7,42) PO2 De 80 a 100 mmHg PCO2 De 35 a 45 mmHg HCO3- De 22 a 26 mEq/l Saturación de O2 De 95 a 100% Exceso de bases Margen de +/- 2 Fgura C.6. Gasometría arterial Figura C.5. Test de Allen 5. Colocar el antebrazo en la almohadilla con la palma de la mano en extensión, visualizando la zona de punción. En la almohadilla descansa la articulación de la muñeca; ésta hay que llevarla a la hiperextensión. 6. Desinfectar la zona con el soporte de coagulación y el antiséptico. 7. Con el dedo índice y el medio localizar la arteria con presión moderada. 8. Preparar la jeringa y seleccionar el volumen de sangre. Retraer el émbolo hasta la cantidad deseada. 9. Confirmar la localización de la arteria. 10. Puncionar entre los dedos índice y medio con un ángulo aproximadamente entre 45º y 60º con el bisel hacia arriba. 11. Introducir lentamente hasta visualizar que en el cono de la aguja retorna sangre y esperar a que se llene la jeringa. 6 NOMBRE VALOR pH 7,32 a 7,38 PO2 40 mmHg PCO2 De 42 a 50 mmHg HCO3- De 23 a 27 mEq/l Saturación de O2 75% Exceso de bases Margen de +/- 2 Figura C.7. Gasometría venosa C.2.4. Hemocultivo Para realizar un hemocultivo es preciso obtener de forma aséptica una o varias muestras de sangre introduciéndolas ANEXO C en un medio de crecimiento adecuado con el objetivo de determinar los gérmenes presentes en el torrente circulatorio. Procedimiento 1. Realizar el lavado rutinario de manos. 2. Informar al paciente para obtener su colaboración y consentimiento. 3. Preservar la intimidad del paciente. 4. Aplicar la técnica lo menos lesivamente posible. 5. Identificar cada uno de los frascos con las etiquetas del paciente. Anotar también el número de orden de la extracción (1.ª, 2.ª, 3.ª). No hay que pegar nunca las etiquetas ni escribir encima del código de barras del frasco (abrir los frascos y desinfectar el tapón con povidona yodada). 6. Ponerse los guantes. 7. Limpiar la zona de punción con una gasa estéril, impregnada en alcohol yodado, povidona yodada o alcohol de 70º. 8. Desinfectar con antiséptico la zona de punción de manera concéntrica. Dejar secar para que ejerza la acción antiséptica. No volver a palpar la vena en el sitio de punción, salvo que se pinten con antiséptico las zonas del guante utilizadas para la palpación. 9. Obtener 20 ml de sangre por extracción (10 ml por frasco en adultos). Si no es posible (niños, etc.), se obtendrá la mayor cantidad posible. 10. Introducir la sangre en los frascos a través del tapón de goma (primer frasco anaerobios y segundo frasco aerobios), en el caso que se haya pinchado con jeringa, sin que entre aire en ellas. Agitar y enviar al laboratorio sin abrir los tapones. 11. Las extracciones se realizarán como mínimo cada 15 minutos. Observaciones • El número de extracciones dependerá del motivo por el cual se haga el hemocultivo. • La correcta extracción de la muestra es primordial. Una técnica defectuosa puede llevar al crecimiento de contaminantes. • Realizar la toma de hemocultivos antes de la instauración de tratamiento antibiótico. En caso de ya existir, hacer las extracciones justo antes de la siguiente dosis. • No utilizar catéteres periféricos ya insertados, pudiéndose hacer a la vez que se inserta. • Las extracciones de sangre se realizarán cada vez en venas distintas, a ser posible alternando los brazos. • Siempre se realizarán por debajo de la zona de inserción del catéter. • Se podrá tomar la muestra de un catéter central extremando las medidas de asepsia, siempre que la venopunción esté imposibilitada. • Preferiblemente se emplearán palomillas adaptadas a vacío para evitar la entrada de aire en el frasco de cultivos para anaerobios. • Los frascos nunca deben refrigerarse o congelarse. C.2.5. Punción lumbar La punción lumbar consiste en la introducción percutánea de un catéter en el espacio subaracnoideo a la altura de los espacios intervertebrales L3-L4 o L4-L5. Sus objetivos son los que se citan a continuación: • Obtener líquido cefalorraquídeo (LCR) con fines diagnósticos. • Evaluación del LCR. • Administración de analgesia por vía raquídea (en el espacio epidural o en el espacio subaracnoideo). • Anestesia raquídea (en el espacio epidural o en el espacio subaracnoideo). Procedimiento 1. La punción lumbar siempre la realiza un médico. El personal enfermero colabora en la preparación del paciente y en los cuidados posteriores a la punción. 2. Informar al paciente para obtener su colaboración y su consentimiento. 3. Realizar la técnica lo menos lesivamente posible. 4. Preparación del paciente: - En enfermos programados es necesario que estén en ayunas. - Procurar que el paciente haya vaciado vejiga y recto antes de la prueba. - Situarle en posición decúbito lateral con la espalda hacia el médico y el cuerpo al borde de la cama más cercano al facultativo. Mantener los hombros al mismo nivel y poner almohada para que la columna quede horizontal. - Flexionarle la cabeza y los muslos en el mayor grado posible para ampliar el espacio entre las apófisis espinosas de las vértebras. - Comprobar que la ventilación es correcta, especialmente en enfermos intubados o con bajo nivel de consciencia. - Si se trata de niños, las medidas a seguir son las siguientes: › Decúbito lateral: colocar una mano por detrás del cuello y sujetar las piernas del niño. Con el otro brazo rodear las nalgas agarrándole de las manos, ejerciendo presión sobre el cuello y las piernas. › Posición sedente: en lactantes y neonatos, sentarles sobre la mesa arqueando su columna y sujetándoles brazos, piernas y cabeza, de manera que no se puedan mover. 7 MANUAL CTO OPOSICIONES DE ENFERMERÍA 5. Vigilar el color y la respiración, por si la expansión torácica estuviese comprometida. 6. Colocar el campo estéril. Desinfectar con antiséptico y gasas estériles en círculo, de dentro hacia fuera, la zona entre las crestas ilíacas y el sacro. 7. Aplicar un anestésico local si es necesario. 8. Introducir el trocar a la altura de L3-L4 o L4-L5. 9. Enviar los primeros mililitros de LCR al laboratorio de microbiología, los siguientes al de bioquímica, identificando correctamente los tubos. 10. Una vez retirado el trocar, cubrir la zona con apósito estéril. 11. Enviar las muestras inmediatamente al laboratorio. 12. Registrar la técnica. C.2.6. Citología vaginal Es una prueba diagnóstica de patología cervical uterina y permite la detección precoz del cáncer de cuello de útero. Además puede aportar información sobre aspectos microbiológicos. Procedimiento 1. Informar al paciente para obtener su colaboración y consentimiento. 2. Colocar al paciente en posición ginecológica. 3. Rotular el porta por la parte esmerilada con el nombre de la paciente 4. Introducir el espéculo y localizar el cérvix. 5. Sujetar el porta con la mano izquierda por la parte esmerilada y con la espátula se hace la primera toma de fondo de saco vaginal, extendiéndola sobre el extremo (zona más próxima a la parte esmerilada). Introduciendo la parte en forma de tibia de la espátula se realiza la toma cervical, depositándola a continuación de la primera. 6. La toma endocervical se realiza con el hisopo, girándolo hacia la derecha y extendiendo en sentido contrario. Se coloca en la parte distal del porta. Para que no se seque el material se fijará con laca a una distancia de unos 20 cm. 7. Se envía al laboratorio de anatomía patológica. Observaciones • Si al introducir el espéculo se observa que en el cérvix existe una amplia zona de eritroplasia (úlcera) que sangra al contacto, advertir a la paciente que puede sangrar. C.2.7. Exudado vaginal Figura C.8. Punción lumbar Consiste en la realización de una toma de flujo vaginal con fines diagnósticos. Observaciones Procedimiento • Mantener al paciente en decúbito supino, sin almohada, durante las siguientes 4-6 horas tras la punción. • Vigilar la tensión arterial y posibles complicaciones neurológicas (la más frecuente es la cefalea) durante las primeras horas. • No administrar comida ni líquidos en las 2 horas siguientes a la prueba. Posteriormente, es necesario beber abundantes líquidos. En los niños, este tiempo se puede reducir. 8 1. 2. 3. 4. Informar a la paciente de los pasos a seguir. Colocar a la paciente en posición ginecológica. Introducir el espéculo y localizar cérvix. Se introduce la torunda, realizando la toma del flujo del fondo de saco vaginal. 5. Se retira el espéculo. 6. Se rotula la torunda con el nombre de la paciente. 7. Se envía al laboratorio de microbiología. ANEXO C Observaciones • Al introducir el espéculo en la vagina se observa el color y la consistencia de la leucorrea: - Si es blanquecina y con aspecto de “requesón”, puede tratarse de una infección por hongos. - Si es amarilla y espumosa, puede existir una infección por tricomonas. 4. Seguir las recomendaciones del fabricante de las tiras reactivas. 5. Comparar el color obtenido con la escala de colores y valorar el resultado. • No es conveniente mantener relaciones sexuales hasta saber el resultado del exudado. C.2.8. Toma de esputo Consiste en la recogida de muestra de material expectorado por el paciente. Procedimiento 1. Indicar al paciente cómo debe expectorar a base de inspirar profundamente varias veces antes de forzar una tos. 2. Recoger el esputo en el recipiente estéril. Taparlo inmediatamente para evitar su posible contaminación y mandarlo al laboratorio, si no es posible el envío inmediato, se recomienda guardar la muestra en nevera, un máximo de 48 horas. 3. Registrar la técnica y firmar su realización. Observaciones • Animar al paciente a aumentar la ingestión de líquidos, siempre que sea posible. • Indicar que no coma, no se cepille los dientes ni se enjuague la boca antes de expectorar para evitar la presencia de partículas ajenas que puedan contaminar la muestra. • Evitar la realización de esta técnica después de las comidas. Figura C.9. Determinación de la glucosuria (tiras reactivas) C.2.10. Sedimento y urocultivo de orina Esta técnica consiste en la recogida de la orina con fines diagnósticos. Procedimiento 1. Realizar la higiene genital según protocolo. Indicar al paciente, si es varón, que retire el prepucio hacia atrás, y si es mujer, que separe los labios vaginales, iniciando la micción. 2. Informar al paciente de que deseche el primer chorro de orina. 3. Colocar el recipiente recolector estéril bajo el chorro de orina. 4. Recoger la muestra y cerrar la tapa estéril, evitando la contaminación de la muestra. Observaciones C.2.9. Glucosuria y cetonuria Ambas técnicas tienen como objetivo determinar la presencia de glucosa y cetona en la orina, respectivamente. Procedimiento 1. Pedir al paciente que orine hasta vaciar la vejiga por completo. 2. Indicar al paciente que beba agua y espere 15-30 minutos. 3. Pedirle que orine de nuevo. En pacientes con sonda vesical permanente hay que tener en cuenta los siguientes aspectos: 1. Pinzar la sonda vesical durante 30-60 minutos. 2. Si la bolsa de recolección dispone de un dispositivo de látex o silicona, utilizar este dispositivo para realizar la punción, previo lavado y desinfección de la zona, con el fin de no dañar la sonda vesical. Si no se dispone de él, en la bolsa de recolección extraer por punción del látex de la sonda por el lado opuesto al balón, previa desinfección de la sonda, unos 10 ml de orina. 3. Depositar la orina en frasco estéril. 4. Despinzar la sonda. 9 MANUAL CTO OPOSICIONES DE ENFERMERÍA C.2.11. Prueba de la tuberculina: técnica de Mantoux Esta prueba se utiliza para realizar el diagnóstico de la infección tuberculosa. El diagnóstico se fundamenta en el resultado de la prueba de la tuberculina (PT). Ésta pone de manifiesto un estado de hipersensibilidad del organismo frente a las proteínas del bacilo tuberculoso, que se adquiere después de una infección producida por M. tuberculosis. 68. Hay que introducir 0,1 ml de tuberculina intradérmica (no subcutánea) en la cara anterior del antebrazo. La inyección causará una discreta elevación de la piel con un habón de 6 a 10 mm de diámetro. Es conveniente instruir al paciente para que no se frote, rasque o coloque tiritas o esparadrapo. Las vacunas de sarampión, paperas y rubéola administradas el mismo día o en las seis semanas anteriores a la PT pueden ocasionar falsos negativos de ésta. Lectura e interpretación de la prueba Indicaciones La prueba de la tuberculina debe realizarse a la población que presente mayor probabilidad de infección y que podrían beneficiarse de un tratamiento, o también a aquellos sujetos en los que se sospeche enfermedad tuberculosa [A-II]. • Personas en contacto con pacientes con la enfermedad de la tuberculosis pulmonar o laríngea. • Pacientes con infección por el VIH. • Personas con lesiones radiológicas sugestivas de tuberculosis (TBC) antigua curada, pero que no fueron tratados con pautas de reconocida eficacia. • Personas con factores de riesgo para padecer tuberculosis, como diabetes mellitus, silicosis, corticoterapia prolongada o tratamiento inmunosupresor, insuficiencia renal crónica grave, neoplasias hematológicas, cáncer de cabeza y cuello, gastrectomía, síndrome de malabsorción crónica o bajo peso. • Empleados o residentes en instituciones como hospitales, prisiones, asilos de ancianos, centros de deshabituación de toxicómanos. • Personas procedentes de áreas del mundo con incidencia elevada de TBC. • Mujeres embarazadas: la PT no se recomienda como una prueba de cribado en el embarazo, dado que la gestación en sí misma no aumenta el riesgo de infección de TBC. Sin embargo, la prueba de la tuberculina es segura y fiable en la mujer gestante y está indicada en las siguientes situaciones: - Síntomas sugestivos de TBC o infección por el VIH. - Otras enfermedades que elevan el riesgo de TBC. - Contacto con personas con TBC pulmonar o laríngea. - Inmigrantes de áreas con alta incidencia de TBC. Por último, hay que recordar que la prueba de la tuberculina no es necesaria en personas con una prueba positiva previa bien documentada. Técnica de Mantoux Para llevar a cabo esta técnica se deben utilizar 2 U de derivado proteico purificado (PPD) RT-23 o 5 U de PPD CT10 1. Leer a las 48-72 horas. 2. Medir únicamente la induración, no el eritema. 3. Medir el diámetro mayor transversal, registrando la lectura en milimetros y no como positivo o negativo. Si no existe induración, marcar como 0 milímetros. La interpretación del resultado depende del tamaño de la induración y de los factores de riesgo epidemiológicos y de la situación médica del individuo. Si bien los actuales criterios pueden modificarse en un futuro cercano, actualmente se considera: Si la lectura es > 5 mm, la PT es positiva en: • Pacientes VIH (+). • Contactos próximos de personas con TBC pulmonar o laríngea. • Evidencia radiológica de TBC antigua curada, en pacientes que no fueron tratados con pautas de reconocida eficacia. Si la lectura es > 10 mm, la PT es positiva en: • Personas con factores de riesgo para TBC diferentes de VIH (+). • Historia de consumo de drogas o ADVP seronegativos para el VIH. • Personas que viven en residencias de ancianos, hospitales, prisiones o centros de deshabituación de toxicómanos. • Personal sanitario. • En niños menores de 5 años. Si la lectura es > 15 mm, la PT es positiva en: • Los que no cumplen ninguno de los criterios anteriores. Cuando la induración es inferior a los diámetros indicados anteriormente se considera que la PT es negativa. La conversión tuberculínica consiste en la detección de un incremento en la induración superior a 10 mm en una persona con respuesta negativa a la tuberculina en los dos años previos. Esto significa la adquisición reciente de la infección tuberculosa si previamente se ha descartado el efecto booster. ANEXO C Si la PT es negativa, la actitud a seguir es la siguiente: • Si no hay antecedentes de vacunación con BCG: - En menores de 65 años se aceptará el resultado como negativo y, por tanto, se considerará el sujeto como no infectado. - En pacientes de 65 años o más se repetirá la PT a los 7-10 días después de la primera, y éste será el resultado que se acepte. • Con antecedente de vacunación con BCG: - Sin tener en cuenta la edad, se repetirá la PT a los 7-10 días después aceptando el resultado de la segunda prueba. En determinadas ocasiones es de obligado cumplimiento repetir la PT. Esta prueba puede llegar a dar un resultado imperceptible en pacientes de edad avanzada que se infectaron en la juventud, o en individuos vacunados no infectados por Mycobacterium tuberculosis, porque la capacidad de reaccionar a una PT disminuye con el tiempo. En estos casos, para detectar el denominado efecto booster, se repetirá una nueva prueba 7-10 días después. › Si la lectura es > 10 mm, la PT es positiva en: • Personas con factores de riesgo para TBC diferentes de VIH (+). • Historia de consumo de drogas o ADVP seronegativos para el VIH. • Personas que viven en residencias de ancianos, hospitales, prisiones o centros de deshabituación de toxicómanos. • Personal sanitario. • Niños menores de 5 años. C.3. TÉCNICAS CARDIOLÓGICAS C.3.1. Electrocardiograma Esta técnica se utiliza para determinar y valorar el registro de la actividad eléctrica del corazón. El efecto booster consiste en un refuerzo de la respuesta inmunitaria debilitada a la tuberculina (no ausente) por la primera prueba empleada. El resultado de la segunda prueba es el que se considera el válido. En pacientes a los que se realiza la PT, se lee en las primeras 48-72 horas, y si el resultado es negativo, posteriormente ha de repetirse en 7-10 días. En el caso de tener que repetir la prueba es necesario realizarla en los plazos de tiempo indicados para evitar que el efecto booster lleve a interpretar un resultado positivo como una conversión reciente, cuando se hace la PT repetidamente. En los individuos vacunados se interpretan los resultados de la siguiente manera: • La historia previa de vacunación con BCG no debería influir en la indicación o la interpretación de la PT salvo en los casos de administración en los 12 últimos meses. • Si la PT es negativa, la actitud a seguir es la siguiente: - En los pacientes vacunados una induración < 15 mm se considera resultado negativo, excepto en las situaciones siguientes: › Si la lectura es > 5 mm, la PT es positiva en: • Pacientes VIH (+). • Contactos próximos de personas con TBC pulmonar o laríngea. • Evidencia radiológica de TBC antigua curada, en pacientes que no fueron tratados con pautas de reconocida eficacia. Figura C.10. Derivaciones frontales Procedimiento 1. Informar al paciente para obtener su colaboración y su consentimiento. 11 MANUAL CTO OPOSICIONES DE ENFERMERÍA 2. Preservar la intimidad del paciente. Aplicar la técnica lo menos lesivamente posible. 3. Colocar al paciente en la posición correcta (decúbito supino). - Tórax y zona distal de las extremidades descubiertas y evitando que el paciente roce la estructura metálica de la cama. 4. Preparar la piel frotando enérgicamente con papel de celulosa impregnado en alcohol, el tórax y la parte distal de las extremidades. 5. Consta de 12 derivaciones: - Tres bipolares (DI, DII y DIII) (Figura C.10). - Nueve unipolares (precordiales y miembros). 6. Colocar los electrodos periféricos ajustando las placas metálicas, con la mínima presión posible, en la zona distal de las extremidades (cara interna de la muñeca y región pretibial). - AVR (brazo derecho). - AVL (brazo izquierdo). - AVF (pierna izquierda). 7. Colocar los electrodos precordiales. Una correcta localización de los espacios intercostales puede realizarse utilizando como referencia el ángulo de Jewis (formado entre el mango esternal y el cuerpo del esternón), que corresponde al segundo espacio intercostal - V1: cuarto espacio intercostal a la derecha del esternón. - V2: cuarto espacio intercostal a la izquierda del esternón. - V3: equidistante entre V2 y V4. - V4: quinto espacio intercostal izquierdo en la línea media clavicular. - V5: línea axilar anterior izquierda, al mismo nivel que V4. - V6: línea axilar media izquierda, al mismo nivel que V4. Figura C.11. Derivaciones precordiales 12 8. Realizar el electrocardiograma de acuerdo con las instrucciones de manejo del electrocardiógrafo. 9. Desconectar las derivaciones y retirar los electrodos, limpiando los restos de pasta conductora, si se ha utilizado. 10. Cubrir las zonas del cuerpo del paciente que se han dejado al descubierto, y si estuviera encamado, arreglar la ropa de la cama. 11. Si el electrocardiógrafo no lo registra, identificar las derivaciones en la tira obtenida, así como la identificación del paciente y la fecha y hora de registro. 12. Registrar la técnica y firmar su realización. Observaciones • El paciente ha de venir aseado para la correcta realización del ECG. En caso de ser varones con mucho vello torácico, se les recomienda un rasurado previo para la fijación de los electrodos de ventosa. C.3.2. Electrocardiograma de esfuerzo Esta técnica consiste en someter al corazón, tras un ejercicio, al máximo esfuerzo de forma controlada. Tiene como objetivo valorar la actividad cardíaca con fines diagnósticos, vigilando que el esfuerzo se realice de forma progresiva y con el menor riesgo posible para el paciente. Procedimiento 1. Informar al paciente para obtener su colaboración. Obtener el consentimiento informado. 2. Rasurar el pecho del paciente, si se precisa, y realizar su limpieza con alcohol. 3. Colocar los electrodos como en la técnica del ECG, situando los electrodos de los miembros en el abdomen. 4. Conectar los cables del ergómetro a los electrodos. 5. Tumbar al paciente en la camilla en decúbito supino y realizar el ECG, y la toma de tensión arterial (TA) y frecuencia cardíaca (FC) basal. 6. Elegir el protocolo de ECG de esfuerzo. 7. Poner en marcha el ergómetro con movimiento de la cinta sin fin. 8. Realizar una demostración al paciente subiendo a la cinta en marcha. 9. Ayudar al paciente a subir a la cinta y aumentar la velocidad de ésta según sea la capacidad del paciente. 10.Tomar la TA, FC y ECG cada tres minutos, tanto en movimiento como tumbado en decúbito supino. 11. Vigilar en todo momento, en la pantalla del ergómetro, el registro del ECG, y al paciente, por si presenta algún síntoma. ANEXO C 12. Al terminar la prueba, tumbar al paciente durante cinco minutos y tomar la TA y la FC a los uno, tres y cinco minutos. 13. Desconectar los electrodos y parar la cinta del ergómetro. 14. Registrar la técnica. Observaciones • El paciente estará en ayunas 2-3 horas antes de la prueba. • Deberá venir con la medicación habitual tomada, a no ser que expresamente se le haya indicado lo contrario. • Deberá acudir con ropa adecuada, cómoda, de deporte o similar y calzado cómodo y antideslizante. • Deberá venir con el pecho rasurado, si es posible. • Indicar al paciente, cuando esté en la cinta en marcha, que no se pare o se tire de la cinta. • Si es posible, acudirá con un familiar si la técnica se realiza de forma ambulatoria. • Esta técnica se puede realizar también con una bicicleta conectada al ergómetro. Hay que detener la prueba cuando: • El paciente alcance el 100% de la FC submáxima (se calcula restando a 220 la edad del paciente). • Si hay alteraciones del espacio ST. • Si aparece dolor torácico, opresión, fatiga, mareo, hipertensión, hipotensión o si no hay aumento de la FC con el esfuerzo. • Si el paciente no se adapta a la cinta del ergómetro. C.3.3. Holter: colocación y retirada El holter es un método de diagnóstico no invasivo que consiste en el registro continuo de todos los complejos electrocardiográficos habidos durante 24 horas. Su objetivo es realizar el registro en las mejores condiciones posibles para conseguir una información bioeléctrica cardíaca a efectos diagnósticos. Procedimiento 1. Informarle para obtener su colaboración y consentimiento. 2. Realizar un ECG (véase la técnica de realización). 3. Rasurar el vello del pecho del paciente, si procede. 4. Limpiar bien con gasas mojadas en alcohol. 5. Colocar los electrodos, según sea el tipo de holter, evitando los pliegues de la piel, lunares y cicatrices. Asegurarlos con esparadrapo y colocar una camiseta de malla elástica para mejorar la sujeción. Hacer un bucle con los cables. 6. Conectar las derivaciones del holter. 7. Poner la pila y la cinta de cassette en la grabadora. Colocar en el estuche. 8. Poner en marcha el holter anotando la hora de inicio. 9. Rellenar la hoja diario con los datos del paciente e indicarle que escriba las incidencias, si las hubiera. 10. Informar al paciente que debe volver al día siguiente para retirar el holter. 11. Anotar la técnica y firmar su realización. Observaciones • El paciente deberá realizar su vida normal. • Durante la realización de la prueba, el paciente debe anotar las actividades realizadas, la hora y los síntomas que experimente al realizar dicha actividad. • Deberá evitar: - Las áreas de alto voltaje y rayos X. - El uso de mantas eléctricas. - El contacto de la grabadora con el agua. - La desconexión de los cables. - Despegar los electrodos de la piel. - La manipulación de la grabadora. C.3.4. Ecocardiograma Esta técnica consiste en la aplicación de ondas ultrasónicas en el tórax del paciente, a altura del costado izquierdo, a través de un terminal o sonda ecocardiográfica. Permite una visualización de las cavidades cardíacas con fines diagnósticos. Procedimiento 1. Informar de la técnica al paciente para obtener su colaboración y su consentimiento. 2. Indicarle que se desnude de cintura para arriba. 3. Colocarle en decúbito supino en la camilla. 4. Colocar los electrodos y conectar los cables del ecocardiógrafo. 5. Situar al paciente en decúbito izquierdo. 6. Identificar al paciente en la cinta de vídeo. 7. El facultativo comienza a realizar la técnica. Es necesario colaborar con él en todo lo que necesite. 8. Una vez terminada la prueba, desconectar los cables y parar la cinta de vídeo. 9. Limpiar el pecho del paciente. 10. Registrar la técnica. Observaciones • En pacientes hospitalizados hay que liberar el pecho del paciente de posibles obstáculos que puedan interferir en el desarrollo de la técnica. • Esta técnica se realiza en penumbra. 13 MANUAL CTO OPOSICIONES DE ENFERMERÍA C.3.5. Ecocardiograma transesofágico Esta técnica consiste en la aplicación de ondas ultrasónicas a través de un terminal o sonda ecocardiográfica introducida en el esófago del paciente. Permite la visualización de las cavidades cardíacas con fines diagnósticos. C.3.6. Pericardiocentesis Esta técnica consiste en la punción percutánea del pericardio con el objetivo de: • Extraer líquido del pericardio, cuando exista derrame, para mejorar la función contráctil miocárdica. • Análisis diagnóstico del líquido pericárdico. Procedimiento Procedimiento 1. Informar de la técnica al paciente para obtener su colaboración. Éste debe firmar el consentimiento informado. 2. Indicarle que se descubra de cintura para arriba y colocarle tumbado en la camilla en decúbito supino. 3. Colocar los electrodos y conectar los cables. Visualizar el trazado electrocardiográfico. 4. Canalizar la vía venosa periférica y preparar la medicación intravenosa. 5. Colocarle un mordedor de lengua. 6. Sedar al paciente según indicación médica. 7. Anotar la hora de comienzo de la técnica para valorar su duración (el tiempo suele ser entre 30 y 60 minutos). 8. Preparar y conectar adecuadamente el equipo y la sonda antes de comenzar. 9. Tomar la tensión arterial basal, durante y al final de la técnica. 10. Poner lubricante en la sonda. 11. El facultativo administra el anestésico en la garganta del paciente e introduce la sonda. 12. Una vez colocada la sonda hasta el esófago, comenzar la perfusión de contraste (suero fisiológico y hemocé). 13. El facultativo comienza la realización del ecocardiograma. 14. Controlar al paciente por si presenta algún signo o síntoma. 15. Finalizada la técnica, limpiar la sonda y el mordedor con agua e introducirlos en desinfectante durante 20 minutos. 16. Retirar la vía venosa periférica, los electrodos y limpiar el pecho del paciente. 17. Registrar la técnica. Observaciones • Valorar que la situación del paciente sea la más adecuada hasta el final de la técnica para evitar cualquier complicación. • Si el paciente es portador de prótesis valvular, deberá realizar profilaxis de endocarditis según protocolo. • Deberá venir en ayunas cuatro horas antes de realizar la técnica. • Se habrá de retirar la prótesis dentaria, si la lleva. • El paciente no deberá tomar nada en las dos horas siguientes, después de la prueba, si se le administró anestésico. • No podrá conducir ni tomar nada en las próximas cuatro horas si se le administró algún inductor de sedación. 14 1. Informar al paciente para obtener su colaboración y su consentimiento. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Colocar el cabecero de la cama en ángulo de 45º a 60º con el fin de facilitar la punción del saco pericárdico. 5. Si el paciente no fuera portador de vía, canalizar una vía para la administración de medicación. 6. Preparar el campo estéril. 7. Administrar anestesia local cercana a la zona de punción. 8. Conectar el trocar a una jeringa de 50 ml mediante una llave de tres pasos. 9. Enchufar el cable de una derivación precordial del electrocardiógrafo al cono de la aguja mediante pinzas de caimán. Este paso es muy importante, ya que el posible contacto del trocar con el miocardio se manifiesta con una elevación del segmento ST. Si éste se produjera, habría que retirar unos milímetros dicho trocar. 10. Colaborar con el facultativo en la punción: - Elegir la zona de punción. Hay varios sitios posibles para realizar la punción y posterior aspiración. La aguja puede introducirse entre el ángulo formado por el borde paraesternal izquierdo y el apéndice xifoides en dirección al hombro, o a la izquierda del quinto o sexto espacio intercostal y también el lado derecho del cuarto espacio intercostal. - Se introduce el trocar lentamente hasta que salga el líquido. Una caída de la presión venosa central (PVC) asociada a una subida de la TA indica mejoría del cuadro de taponamiento cardíaco. - El paciente siente casi siempre alivio inmediato y desaparición del dolor. 11. Enviar las muestras de líquido pericárdico aspirado a los laboratorios para su examen. 12. Registrar técnica. Observaciones • Vigilar posibles arritmias en el monitor del paciente durante la realización de la prueba. • Ayudar a paliar la posible ansiedad del paciente antes y durante la realización de la prueba. ANEXO C • Realizar la técnica y retirada del trocar de forma estéril. • Llevar a cabo la toma frecuente de constantes tras la realización de la prueba. C.3.7. Presión venosa central Consiste en medir la presión en centímetros de agua en la aurícula derecha con el objetivo de: • Cuantificar el volumen circulante eficaz (precarga). • Medir en centímetros de agua la presión venosa en la aurícula derecha a través de un catéter. 15. La cifra normal de PVC oscila entre 4-10 cm de H2O, indicando hipervolemia cifras por encima de 10 cm e hipovolemia valores iguales o inferiores a 2-4 cm de H2O. 16. Se cierra todo el sistema de PVC y se conecta el paso de fluidos correspondientes. 17. Lavarse las manos. 18. Anotar la medición obtenida en la gráfica con bolígrafo rojo. 19. Registrar la técnica y firmar su realización. Procedimiento 1. Informar al paciente de la técnica a realizar para obtener su colaboración y su consentimiento. 2. Preservar la intimidad del paciente. Aplicar la técnica lo menos lesivamente posible. 3. Colocar al paciente en posición de decúbito supino con la cama horizontal. 4. Lavarse las manos, colocarse los guantes y preparar el equipo de PVC. 5. Conectar el sistema (de PVC) al suero fisiológico y purgar el equipo. 6. Colocar la regla graduada (venotonómetro) en el pie de goteo e insertar la parte del sistema que corresponde sobre ella. 7. Conectar el sistema a la llave de tres pasos del catéter. 8. Situar la columna graduada de modo que el punto 0 esté a la altura de la línea media axilar del paciente, cuarto o quinto espacio intercostal (aurícula derecha). En caso de no poder colocar al paciente en posición horizontal, se pondrá la cama a 30º y el punto 0 a la altura del ángulo de Lewis (formado por la segunda costilla y la unión del mango y el cuerpo del esternón). 9. Para ayudarnos a colocar el punto 0, nos asistiremos de una regla terminada en punta de flecha que tiene adosada por detrás el venotonómetro. 10. Abrir el sistema del suero fisiológico para realizar el lavado de todo el trayecto del catéter. 11. Abrir el paso del sistema hacia la columna graduada hasta que el suero fisiológico rebose, no permitiendo el paso en este momento del suero hacia el catéter. 12. Cerrar el paso del suero fisiológico y abrir el regulador del sistema de la columna para que el contenido de ésta se comunique con el catéter del paciente. 13. Observar el descenso del suero a través de la escala graduada, debiendo coincidir con la respiración, hasta el momento que oscile ligeramente y detenga su descenso. 14. En el punto donde se pare el suero, será donde se efectuará la lectura; para que sea más fiable, se observará la posición del suero durante dos o tres movimientos respiratorios. Figura C.12. Medida de la presión venosa central (PVC) Observaciones • Para obtener mediciones exactas hay que colocar al paciente en la postura correcta. • A la hora de realizar la lectura, no deben existir burbujas en el equipo de medición. • Si al realizar la lectura se observa que la columna de agua desciende muy rápidamente, sin detenerse y sin oscilaciones, indicará la existencia de una fuga o que el circuito está desconectado. • Mantener el equipo y conexiones limpios, manipulando las menos veces posibles para evitar infecciones. • Para medir la PVC no debe pasar ninguna otra sustancia por la luz del catéter. • El punto de la línea mediaaxilar se marcará con lápiz grueso, para asegurarnos que en posteriores mediciones se utilizará el mismo punto de referencia. • Cuando se van a realizar mediciones frecuentes de PVC, no hay que desconectar el sistema montado a tal efecto en ningún punto del circuito. 15 MANUAL CTO OPOSICIONES DE ENFERMERÍA C.3.8. Monitorización cardíaca Esta técnica de enfermería consiste en registrar la actividad eléctrica cardíaca, en un monitor y a través de tres electrodos. La monitorización cardíaca permite: • El control visual permanente de la frecuencia y del ritmo cardíaco. • La visualización permanente de la morfología del trazado electrocardiográfico. • El control visual y sonoro de las alteraciones de la frecuencia y/o ritmo cardíaco, siempre que salgan de unos límites preestablecidos. • El registro instantáneo de cualquier alteración. • Se elige la derivación II porque reproduce los complejos QRS correctos que reflejan la actividad ventricular y las ondas P positivas que registran la actividad auricular. • Vigilar la zona de colocación de los electrodos ante posibles reacciones alérgicas. Procedimiento 1. Explicar al paciente lo que se le va a realizar, siempre y cuando sea posible. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. Limpiar la zona de colocación de electrodos con gasas impregnadas en alcohol. Si hay mucho vello, cortar con tijera, no se debe rasurar. 5. Colocar los electrodos. La zona más frecuente es la siguiente: - Debajo de la clavícula izquierda, línea medioclavicular (electrodo negativo). - Quinto espacio intercostal izquierdo, línea medioclavicular (electrodo positivo). - Debajo de la clavícula derecha, línea medioclavicular (electrodo de tierra). 6. Encender el monitor. 7. Enganchar los cables de derivación del monitor a los electrodos (RA, LL, colores). 8. Seleccionar la derivación y velocidad de trazado: - Fijar el trazado en una posición adecuada en la pantalla. - Regular la amplitud de trazado. Figura C.13. Colocación de los electrodos de un marcapasos C.4. TÉCNICAS RESPIRATORIAS C.4.1. Pulsioximetría 9. Fijar los niveles inferiores y superiores del sistema de alarma. 10. Registrar la técnica y firmar su realización. Esta técnica consiste en la colocación de un sensor de forma no invasiva en pacientes que requieren monitorización oximétrica. Observaciones Su objetivo es medir continuamente el porcentaje de hemoglobina oxigenada (saturación de oxígeno) y la frecuencia cardíaca. • Tiene que existir unacorrecta distribución de los cables de derivación según sus colores o referencias y su conexión a los electrodos. • No se puede mojar los electrodos una vez conectados los cables de derivación. • Evitar el contacto del cable con objetos metálicos y/o eléctricos: barras de cama, bombas de perfusión, etcétera. 16 Procedimiento 1. Explicar el procedimiento al paciente, informándole de modo sencillo sobre su utilidad y sobre la necesidad de su colaboración. Si se trata de un niño pequeño, lactante o neonato, informar a la madre o acompañante. ANEXO C 2. Elegir la zona más adecuada para colocar el sensor periférico. 3. Limpiar la zona elegida con una gasa con alcohol. 4. Colocar el sensor en la zona elegida, comprobando que no comprima los tejidos y apretando bien el sensor y el emisor de rayos infrarrojos para evitar lecturas erróneas. 5. Fijar los límites de alarma. 6. Preservar la intimidad del paciente. 7. Registrar la técnica y firmar su realización. Durante la realización de esta técnica conviene prestar atención a los siguientes motivos de lecturas erróneas: • Edema marcado. • Hemoglobinas anormales. • Mala perfusión periférica. • Hipotermia grave. Hay que tener en cuenta las siguientes recomendaciones y precauciones: • Realizar la prueba con el paciente el reposo. • Dejar un tiempo prudencial entre maniobra y maniobra. • En los individuos con bronquitis crónica, se deberá efectuar la prueba de exploración en su situación basal. • Anotar todas aquellas circunstancias que puedan alterar el resultado de la prueba. C.5. TÉCNICAS UROLÓGICAS C.5.1. Uroflujometría Esta técnica consiste en la medición del flujo miccional. Su objetivo es descartar un síndrome obstructivo. C.4.2. Espirometría Procedimiento La espirometría o exploración funcional respiratoria (EFR) es el método de medida de la cantidad de aire espirado en cada acto respiratorio, que permite el valorar la capacidad vital del pulmón. Procedimiento 1. Informar al paciente para obtener su colaboración y su consentimiento. 2. Aplicar la técnica lo menos lesivamente posible. 3. Preparar el espirómetro por parte del enfermero/a: - Conexión espirómetro a la red. - Calibración del aparato según el modelo. - Identificación del paciente. - Colocar la boquilla del espirómetro en presencia del paciente. 4. Preparar al paciente: - La espiración forzada será realizada por el paciente sentado recto. - Se le pondrá una pinza nasal con una gasa para evitar que parte del flujo aéreo salga por las fosas nasales. 5. Los pasos a seguir son: - Realizar inspiración máxima según sus posibilidades. - Introducir el tubo terminal del espirómetro en la boca. - A la orden del enfermero/a, realizar una sola espiración forzosa (brusca y mantenida en el tiempo). - La espirometría supondrá siempre un mínimo de tres espiraciones forzadas, satisfactorias y máximo de ocho, cuando no sean juzgadas adecuadas. 6. Registrar la técnica y firmar su realización. 1. Informar al paciente para obtener su colaboración y su consentimiento. 2. Preservar la intimidad del paciente. 3. Aplicar la técnica lo menos lesivamente posible. 4. El paciente vendrá con deseo miccional. 5. Indicarle que debe orinar en el recipiente del flujómetro para medir su volumen y flujo máximo y medio, por el tiempo invertido en la micción. 6. Se le tumba en la camilla y se le sonda para medir el residuo vesical. 7. Registrar la técnica y firmar su realización. Observaciones • Todos los valores de flujo máximo superiores a 10 ml/s y flujos medios por encima de 8 ml/s son aceptables. Por debajo de estos valores significa que puede existir un síndrome obstructivo de forma de estonosis uretral o por obstrucción de la próstata. Los flujos máximos o medios se determinan por volumen emitido por tiempo invertido. • Al finalizar la prueba se aconseja al paciente una profilaxis antibiótica el mismo día de la prueba. C.6. TÉCNICAS OTORRINOLARINGOLÓGICAS Existen numerosas pruebas diagnósticas que se aplican para la detección de la deficiencia auditiva, como son la otoemisiones acústicas, electrococleografía, PEATC, audiometrías diversas, productos de distorsión, timpanometría, 17 MANUAL CTO OPOSICIONES DE ENFERMERÍA reflejo estapediano, etc.; sin embargo, este apartado se centrará en las más importantes y en las que con mayor frecuencia se realizan. C.6.1. Acumetría Es una prueba exploratoria de la que se obtiene una cuantificación orientativa sobre el grado de audición. Existen dos tipos de acumetría según el estímulo aplicado: la que se realiza con voz y realizada con diapasones. La audiometría instrumental clásica con diapasones (acumetría) es una exploración de gran utilidad para averiguar de forma sencilla y rápida si la lesión que produce la pérdida auditiva se asienta en el oído externo o medio (hipoacusia de conducción), o bien en el oído interno (hipoacusia de percepción). Su importancia pues, no se centra en hallar el umbral de audición del sujeto, sino en realizar un topodiagnóstico que permita localizar la lesión. - Que el sonido se oiga mejor (lateraliza) en el oído de peor audición, lo que determina la existencia de una hipoacusia de conducción o transmisión en este oído. - Que el sonido se oiga mejor por el oído de mejor audición, lo que determina una hipoacusia de percepción en el oído contrario. • Prueba de Rinne. El objetivo de esta prueba es comparar la vía aérea con la vía ósea, estableciendo la diferencia de tiempo de audición entre ambas vías. Se coloca el mango diapasón en la mastoides del sujeto examinado, pidiéndole que diga cuándo deja de percibirlo; a continuación se acercan las varillas del diapasón al pabellón auditivo solicitándole que diga al examinador si percibe aún por vía aérea. - Si el sujeto sigue oyendo el diapasón por vía aérea, aunque haya dejado de percibirlo por vía ósea, la prueba de Rinne es positiva (+) y existe una audición normal o una hipoacusia de percepción. - Si el sujeto no percibe la vibración del diapasón por vía aérea más tiempo que por vía ósea, la prueba de Rinne es negativa (-) y existe una hipoacusia de transmisión. El diapasón es una horquilla metálica de acero o de aleaciones de magnesio que tiene dos ramas iguales unidas a un mango, que al ponerse en vibración produce sonidos puros de distinta frecuencia. La frecuencia del diapasón vendrá determinada por la constitución, el peso y el grosor de la pieza. El característico “set de Hartman” que consta de cinco diapasones de frecuencias comprendidas entre las octavas de 128 Hz a 2.048 Hz, que es el más utilizado para estas exploraciones. Existen diversas pruebas acumétricas con diapasones, pero las que se utilizan más frecuentemente son la prueba de Weber, la de Schwabach y la de Rinne. • Prueba Weber. Consiste en hacer vibrar el diapasón y colocarlo sobre el vértex, preguntando al sujeto en qué oído percibe con más intensidad el sonido. Los resultados pueden ser: - Que el sonido se oiga igual por ambos oídos, lo que significa que el sujeto tiene una audición normal o idéntica patología en ambos oídos. Figura C.14. Prueba de Weber 18 Figura C.15. Prueba de Rinne En ocasiones, ante la existencia de una cofosis o una hipoacusia profunda de un oído, el sujeto percibe el sonido por vía ósea, pero no en el oído explorado, sino en el contralateral, dado que la vibración se transmite a través del cráneo al oído contrario. El sujeto contesta que oye, pero esta audición se está realizando a través del oído sano y no a través del patológico. Se podría deducir que existe una hipoacusia de transmisión, cuando en realidad es una hipoacusia profunda de percepción. Estos casos se denominan como “falso Rinne (-)”. • Prueba de Schwabach. Se fundamenta en el tiempo de percepción de un sonido por vía ósea, entre el sujeto examinado y el examinador (con audición normal). Se coloca el diapasón en vibración sobre la mastoides del sujeto examinado, pidiéndole que indique cuándo deja de percibir el sonido, en ese momento se coloca el diapasón sobre la mastoides del examinador, comprobando si el examinador continúa percibiendo sonido o por el contrario no lo percibe. Se trata pues de comprobar si la audición del sujeto examinado es normal o patológica. ANEXO C Esta prueba es complementaria a la de Weber y a la de Rinne. C.6.2. Audiometría Esta técnica permite conocer el grado de pérdida auditiva (umbral de la audición), el tipo de pérdida (conducción o percepción) y los restos auditivos existentes (zonas frecuenciales aprovechables). La audiometría se basa en el estudio de dos parámetros: frecuencia e intensidad, que son los que van a permitir establecer el campo auditivo o espacio acústico. La frecuencia de un sonido es el número de oscilaciones por segundo que se producen como consecuencia de una onda sonora; viene determinada por una unidad cuantificable que es el Hertz (Hz) y la sensación subjetiva de oír esta frecuencia se llama tono. Se puede percibir tonos graves y tonos agudos, que se corresponden con frecuencias bajas y con frecuencias altas. La intensidad o fuerza de un sonido viene determinada por la amplitud de su onda, es decir, la distancia existente entre dos zonas de máxima y mínima presión y su unidad de medida es el decibelio (dB). Si el sonido se emite con muchos decibelios, se oirá con mayor intensidad, y a la inversa, si se emite con pocos decibelios se oirá con poca fuerza. El espacio acústico entendido de una manera amplia, sería aquel que está comprendido por todas las frecuencias e intensidades existentes. Dicho espacio varía en cada ser vivo, existiendo muchos animales cuyo espacio acústico es más amplio que el del hombre. El oído humano está capacitado para percibir sensaciones sonoras de frecuencias e intensidades comprendidas entre los 16 y 20.000 Hz y 0 y 140 dB, situándose en 120 dB el umbral del dolor. La diferencia de intensidad existente entre el umbral de la audición y el umbral del dolor, se denomina “dinámica auditiva”. Para realizar la audiometría se utiliza el audiómetro, que es un aparato eléctrico capaz de producir o reproducir estímulos sonoros (tonos puros o palabras) de intensidades comprendidas entre los 10 dB y los 120 dB, y frecuencias comprendidas entre los 128 Hz y los 16.000 Hz, recogiendo gráficamente los resultados en un audiograma (Figura C.16). La exploración se puede realizar por vía aérea, vía ósea y a campo libre, siempre en cámara insonorizada, con el fin de evitar sonidos ambientales ajenos a la exploración. El principal objetivo de la audiometría es obtener los niveles mínimos de intensidad a los que el sujeto explorado es capaz de percibir estímulos sonoros. Cuando la prueba se realiza mediante la emisión de tonos puros se denomina audiometría tonal y cuando se utilizan palabras amplificadas se llama audiometría vocal o logoaudiometría. En ambas pruebas es necesaria la colaboración del sujeto. • Audiometría tonal. La audiometría tonal por vía aérea explora, mediante unos auriculares que se coloca el sujeto, el nivel mínimo de audición que percibe dicho sujeto, realizando un recorrido exhaustivo por todas las frecuencias e intensidades disponibles. La exploración por vía ósea se realiza utilizando el mismo procedimiento, con la salvedad de que se utiliza un vibrador en lugar de los auriculares, colocando este sobre la mastoides del oído del sujeto el sonido se transmite directamente al oído interno, eliminando la función del oído externo y medio. Los resultados de la exploración se reflejarán sobre la gráfica con unos códigos o símbolos determinados (Figura C.16). Los obtenidos en la exploración del oído derecho se reflejarán en color rojo y de acuerdo con la simbología indicada, mientras que los obtenidos en el oído izquierdo se reflejarán en color azul. Para los resultados en campo libre se utilizará el color verde. 125 250 500 1.000 2.000 4.000 8.000 Hz -10 0 dB x x x > x> 10 x x 20 x 30 < < 40 > > 50 60 < < < 70 80 90 100 110 X Via aérea o. izquierdo > Via ósea o. izquierdo Via aérea o. derecho < Via ósea o. derecho Figura C.16. Audiograma y sus códigos de interpretación 19 MANUAL CTO OPOSICIONES DE ENFERMERÍA dicaría una alteración de alguno de los elementos que componen el oído medio. Si se presenta esta disfunción, implicaría la existencia de una hipoacusia de transmisión es, por tanto, una prueba que ayuda en el diagnóstico etiológico y topográfico de este tipo de hipoacusias. PACIENTE CON TAPÓN DE CERUMEN VALORACIÓN POR MÉDICO A.P. CONTRAINDICACIÓN DE LA TÉCNICA SÍ DERIVACIÓN ORL NO Movimiento del timpano Figura C.17. Audiograma vocal 1,5 • Audiometría vocal. Establece la capacidad de comprensión del oído ante los fonemas, mientras que la audiometría tonal solamente determina la capacidad de captación de tonos. Las palabras empleadas en la audiometría vocal deben tener significado para el paciente, tienen que ser del vocabulario usual del sujeto. Existen muchas listas de palabras de diferentes autores, pero cada profesional debería elaborarse su propia lista en función del sujeto valorado y del vocabulario utilizado en la zona geográfica. Como caso excepcional hay que destacar las audiometrías infantiles, en las que se condiciona al niño para responder ante juegos o imágenes. Estas pruebas se realizan en niños de corta edad, donde su desarrollo comprensivo no permite realizar adecuadamente audiometrías tonales. Entre ellas, cabe destacar la audiometría de reflejo de orientación condicionado, la audiometría Peep-Show y la audiometría lúdica. C.6.3. Impedanciometría Esta prueba consiste en la medición y posterior representación gráfica de la dificultad para la transmisión de la energía sonora (impedancia acústica) que presenta el oído medio. Es decir, es la resistencia al paso de una energía. En la energía sonora esta dificultad vendrá determinada por la masa, la elasticidad y la resistencia que presentan las diferentes estructuras que componen el oído medio (tímpano, cadena osicular, ligamentos, etc.). El aparato con el que se lleva a cabo esta prueba es el impedanciómetro, y la gráfica donde se reflejan los resultados es el timpanograma, dicho aparato analiza la distensibilidad o complianza (facilidad para dejar pasar la energía), que es la magnitud inversa a la impedancia. Esta prueba consiste en comprobar si la resistencia o dificultad que presenta el oído medio es la normal o si la misma se encuentra incrementada o disminuida, lo que in20 1,0 0,5 0,0 -400 -200 0 200 Presión Figura C.18. Timpanograma normal Asimismo, la impedanciometría permite igualmente determinar el umbral de audición de un sujeto mediante el estudio del reflejo cocleoestapedial. Para ello, es necesario determinar la aparición del reflejo estapediano. Cuando la audición de un sonido se realiza a una intensidad entre 70 y 80 dB por encima del umbral de audición del paciente, se produce una contracción refleja del músculo estapediano que provoca una rigidez en la cadena osicular, modificando esta la impedancia del sistema. Por tanto, la aparición de dicho reflejo evidencia la existencia de audición, pudiéndose determinar el umbral de la misma. C.6.4. Potenciales evocados auditivos del tronco cerebral (PEATC) Esta técnica es la prueba objetiva más utilizada en la actualidad, pudiéndose aplicar a niños de edades muy tempranas. Para realizarla es necesario que el sujeto se encuentre dormido o sedado, en reposo, con silencio y oscuridad. También se la conoce como BERA, del inglés Brainstem Evoked Responses Audiometry. La percepción de un estímulo auditivo desencadena en la cóclea del sujeto, y más concretamente en las células ANEXO C sensoriales del órgano de Corti, unos potenciales bioeléctricos que producirán una corriente neuronal hacia las estructuras cerebrales, desde el nervio coclear hasta la corteza. El PEATC determina la actividad bioeléctrica que desencadena un estímulo auditivo en las vías nerviosas del tronco cerebral. Aparecen una serie de ondas (cinco), como respuesta neurológica a la señal auditiva, que coinciden con el paso por los diferentes núcleos nerviosos, donde se encuentran los nexos (sinapsis). Los parámetros más importantes a valorar son las latencias de las ondas I, III y V, especialmente la V, debido a que su desaparición va a permitir reconocer el umbral de audición del sujeto. Para realizar la prueba, el paciente debe mantener las condiciones indicadas anteriormente, aplicándole los electrodos en el vértex, en el lóbulo de la oreja y en la frente el que hace masa. A continuación se estimula auditivamente al sujeto con clics a un ritmo de 30 impulsos por segundo y se valoran los resultados de las ondas y sus latencias, cuyos valores pueden variar según el aparato utilizado. Su promedio puede oscilar según los valores representados en la Figura C.19. Su estudio es de gran valor diagnóstico, tanto para confirmar la existencia de una sordera y su intensidad, como para determinar posibles lesiones de las vías auditivas y su localización. ONDAS LATENCIA I 1,5 ms Nervio acústico II 2,5 ms Protuberancia III 3,5 ms Núcleo olivar superior IV 4,5 ms Zona del colículo 5,5 ms Mesencéfalo V ZONA DE ORIGEN permitir valorar la audición del paciente en una determinada frecuencia del tono portador. C.6.6. Otoemisiones acústicas La estimulación que se produce en el órgano de Corti ante una onda sonora procedente del exterior se transmite por las células ciliadas como potenciales bioeléctricos, a través de los axones del nervio auditivo. Estas células se agrupan en tres hileras externas y una interna, enervándose con las terminaciones del nervio auditivo para enviar la información a la corteza cerebral. Estas células ciliadas externas tienen propiedades contráctiles y modulan la información que generan las células ciliadas internas. Como consecuencia de la estimulación de las células ciliadas externas se produce una vibración de carácter interno en el órgano de Corti, que genera a su vez un desplazamiento de los líquidos cocleares, cuya energía se libera, produciendo un eco coclear; esta respuesta endógena recibe el nombre de otoemisión. Las otoemisiones acústicas son sonidos generados en el interior de una cóclea sana, como respuesta a un estímulo sonoro y pueden ser recogidos mediante un micrófono alojado en el oído externo del sujeto explorado. Actualmente esta técnica se ha comenzado a utilizar como método de diagnóstico neonatal de las deficiencias auditivas por su objetividad, su inocuidad y su relativa sencillez. Ante una prueba diagnóstica de estas características cabe la posibilidad de realizar un cribado auditivo a toda la población neonatal, con lo que la detección de una posible deficiencia auditiva en todo neonato se realizaría en los primeros días de vida. Figura C.19. Latencias promedio del PEATC C.6.5. Potenciales evocados auditivos de estado estable multifrecuencial Esta prueba facilita la presentación simultánea de múltiples tonos continuos, o tonos portadores, que se modularán sinusoidalmente en amplitud a diferentes frecuencias (82 a 105 Hz) para cada tono portador. La evaluación de los umbrales electrofisiológicos en las frecuencias de 500, 1.000, 2.000 y 4.000 Hz, va a permitir obtener un audiograma electrofisiológico que mantiene una adecuada correlación con la audiometría del niño en las mencionadas frecuencias. Asimismo, esta técnica va a C.7. TÉCNICAS PEDIÁTRICAS C.7.1. Toma de constantes vitales Monitorización de la PCO2 y PO2 transcutánea Es un método no invasivo que mide las tensiones de O2 y PCO2 en sangre arterial, basándose en la utilización de electrodos de aplicación percutánea. Su objetivo es poder conocer en todo momento y de forma prolongada las tensiones de O2 y PCO2 en sangre arterial. 21 MANUAL CTO OPOSICIONES DE ENFERMERÍA A. Procedimiento 1. Aplicar la técnica lo menos lesivamente posible. 2. Colocar una bombona de gas en el calibrador de PCO2. 3. Conectar el monitor TCC3 al portaelectrodo del monitor TM3. 4. Enchufar el monitor a la red eléctrica. 5. Conectar el electrodo en el portaelectrodos. 6. Comprobar los valores correctos para la calibración: temperatura, tiempo de programación, PO2 y PCO2 correctos para la presión barométrica, límite de alarmas y abrir la bombona de gas. 7. Elegir una zona de la piel que presente una buena circulación sanguínea. 8. Limpiar la zona elegida con suero, arrastrando posibles restos de vérmix y secarla bien. 9. Colocar el anillo adhesivo. 10. Echar dentro del anillo una gota de líquido de contacto. 11. Comprobar si el electrodo está calibrado (monitor TCC3 tiene la luz verde encendida). 12. Ajustar el electrodo al anillo adhesivo. 13. Esperar un minuto aproximadamente para leer los valores de PO2 y PCO2. 14. Registrar la técnica en la gráfica respiratoria. 15. Cuando ya no es necesaria la lectura de PO2 y PCO2, se retirará el anillo adhesivo suavemente, utilizando agua o aceite. 16. Colocar y guardar el material en el lugar indicado. 2. Elegir la zona del talón a puncionar. Si estuviese fría, calentar introduciendo el talón en una batea con agua templada-caliente o bien friccionar la zona con las manos. 3. Limpiar la zona con antiséptico y dejar secar. 4. Puncionar el talón con la lanceta. 5. Presionar el talón y obtener una buena gota de sangre. 6. Colocar los capilares e irlos rellenando. 7. A veces es preciso vaciar el capilar en un tubo para bilirrubinemias, hasta que haya suficiente muestra de sangre. 8. También se puede obtener muestras para gasometría capilar. 9. Limpiar la zona y poner un algodón seco con esparadrapo. 10. En pruebas metabólicas, impregnar bien el papel secante por ambos lados. Gasometría capilar La gasometría capilar consiste en la punción de un vaso capilar arterializado. Esta técnica está indicada en niños con la siguiente finalidad: • Para evitar puncionar arterias que son de difícil acceso. • Conocer el estado de deshidratación en niños con gastroenteritis aguda. • Evaluar la eficacia de la ventilación en niños con problemas respiratorios. A. Procedimiento B. Observaciones • Comprobar atentamente la zona de ubicación del electrodo. • Asegurarse de que haya un buen ajuste entre el anillo adhesivo y la piel. • Manejar el aparato con suavidad. • Asegurarse de que el recién nacido no está encima del electrodo. C.7.2. Toma de muestras para laboratorio Punción de talón Esta técnica consiste en extraer sangre del talón para determinaciones capilares. Entre los objetivos destacan: • Realizar gasometrías capilares. • Bilirrubinas capilares. • Pruebas metabólicas. A. Procedimiento 1. Informar al paciente de modo sencillo de la utilidad de la técnica y de la necesidad de su colaboración. Si se trata de un niño pequeño, informar a la familia. 22 1. Informar al paciente de modo sencillo de la utilidad de la técnica y de la necesidad de colaboración. Si se trata de un niño, informar a la familia. 2. Elegir la zona correcta de punción (dedo, talón, etc.). Si la zona estuviese demasiado fría, en caso de ser el niño un neonato o de bajo peso, llenar una batea con agua templada e introducir el talón del niño en ella. 3. Limpiar la zona con una gasa impregnada en la solución antiséptica y dejar secar. 4. Ponerse los guantes. 5. Aplicar vaselina en la zona a puncionar. 6. Puncionar en el punto deseado con la lanceta (zona lateral del dedo o zona lateral del talón), para extraer una buena gota de sangre. 7. Colocar el extremo del capilar, ligeramente inclinado en la base de la gota, e ir rellenando el capilar, facilitando el llenado vascular mediante masaje. 8. Evitar la entrada del aire en el capilar; para ello, cada vez que se deje de llenar, se tapará el extremo opuesto del capilar con el dedo índice. 9. Poner un algodón seco con esparadrapo en la zona de punción. 10. Una vez lleno, colocar en un extremo el tapón. 11. Introducir por el otro extremo la barrita de hierro. 12. Colocar el otro tapón. ANEXO C 13. Pasar el imán por la parte externa del capilar con el fin de mover la barra de hierro durante tres minutos. 14. Remitirlo al laboratorio. 15. Aplicar la técnica lo menos lesivamente posible. 16. Registrar la técnica y firmar su realización. Sus objetivos son los siguientes: • Conocer la talla del niño para poder clasificarlo. • Valorar la talla en relación con las diferentes medidas antropométricas. • Valorar posibles trastornos relacionados con dicha medida. A. Procedimiento C.7.3. Medidas antropométricas PESO · · · · · · PN: 3.500g Pérdida fisiológica: 5-10% 1.ª semana Recuperación a la semana Duplican al 5.º mes Triplican al año Cuadruplican a los 2 años TALLA · · · Al nacer: 50 cm Al año: 75 cm Duplica a los 4 años Perímetro cefálico · Al nacer 33-35 cm Fontanelas · · FA: 12-18 cm FA: 2-4 cm Figura C.20. Medidas antropométricas del recién nacido 1. Informar al niño y/o a los padres de lo que se va a hacer para obtener su colaboración. 2. En lactantes: - Colocar al niño sobre el tallímetro. - Mientras una persona sujeta firmemente la cabeza del lactante sobre el soporte fijo, la otra persona mantendrá estirado el tronco y las extremidades y llevará el soporte móvil hasta el talón del lactante, que tendrá el pie perpendicular. 3. En preescolares y escolares: - Se colocará al niño en posición erecta con los tobillos juntos, apoyando el occipital en la superficie vertical y llevando el extremo móvil hasta la coronilla. Medida antropométrica del peso 4. Registrar en la gráfica diaria y también en la de percentiles. Es la medición en gramos de la masa corporal. Sus objetivos se citan a continuación: • Conocer el peso para poder clasificar al niño. • Valorar el peso en relación con las diferentes medidas antropométricas (talla, perímetro cefálico, perímetro abdominal…). • Valorar posibles trastornos relacionados con dicha medida. Medida antropométrica del perímetro cefálico A. Procedimiento 1. Informar al niño y/o a los padres de lo que se va a realizar para obtener su colaboración. 2. Colocar una hoja de papel desechable sobre la plataforma de la báscula. 3. Comprobar que la báscula está calibrada. 4. Colocar al niño sobre la misma, evitando dentro de lo posible que se mueva (de pie, sentado, tumbado, de lado…). 5. Registrar en la gráfica diaria el peso y la hora. 6. Anotar en la gráfica de percentiles el peso del ingreso. B. Observaciones • Salvo en el ingreso, el pesaje del niño se realizará a primera hora de la mañana antes del desayuno, y en los niños mayores se les invitará a vaciar la vejiga antes de pesarles. Medida antropométrica de la talla Esta medida es la distancia entre la parte superior de la cabeza y los pies, estando el niño en máxima elongación. Es la medida expresada en centímetros de la circunferencia occipitofrontal. Sus objetivos son los siguientes: • Conocer el perímetro cefálico del niño para poder clasificarlo. • Valorar el perímetro cefálico del niño en relación con el resto de las medidas antropométricas. • Evaluar posibles trastornos relacionados con dicha medida. A. Procedimiento 1. Informar al niño y/o a los padres de lo que se va a hacer para obtener su colaboración. 2. Se adaptará la cinta por encima de los arcos supraorbitales hasta el occipucio. 3. Registrar en la gráfica diaria el valor resultante y también en la gráfica de percentiles. Medida antropométrica del perímetro abdominal Es la circunferencia máxima del abdomen. Sus objetivos se citan a continuación: • Conocer el perímetro abdominal del niño para poder clasificarlo. • Valorar el perímetro abdominal en relación con el resto de las medidas antropométricas. • Evaluar posibles trastornos relacionados con dicha medida. 23 MANUAL CTO OPOSICIONES DE ENFERMERÍA A. Procedimiento 1. Informar al niño y/o a los padres de lo que se va a hacer para obtener su colaboración. 2. Se realizará la medición a la altura del ombligo, rodeando todo el abdomen. 3. Anotar en la gráfica el valor obtenido. Medida antropométrica del perímetro torácico Es la circunferencia máxima del tórax. Entre sus objetivos se citan los siguientes: • Conocer el perímetro torácico del niño para poder clasificarlo. • Valorar el perímetro del niño en relación a otras medidas antropométricas. • Evaluar posibles trastornos relacionados con dicha medida. A. Procedimiento 1. Informar al niño y/o a los padres de lo que se va a realizar para obtener su colaboración. 2. Se tomará la medida a la altura de las mamilas, rodeando el tórax. 3. Registrar en la gráfica el valor obtenido. 24 BIBLIOGRAFÍA • Charrier J. El plan de cuidados estandarizado. Elsevier, 2005. • Chocarro González L, Venturini Medina C. Procedimientos y cuidados en enfermería medicoquirúrgica. Elsevier, 2006. • Doenges M. Planes y cuidados en enfermería. McGrawHill, 2008. • Hogston R. Fundamentos de la práctica de enfermería. McGraw-Hill, 2008. • López Izuel C, Riu Camps M, Forner Bscheid MT. Cuidados enfermeros. Elsevier, 2004. • Manual CTO Enfermería, 5.ª ed. CTO Editorial, 2011. • Oltra Rodríguez E, González Aller C, Mendiolagoitia Cortina L, Sánchez Quiroga P. Suturas y cirugía menor para profesionales de enfermería, 2.a ed. Panamericana, 2008. • Smith Temple J, Young Johnson J. Guía de procedimientos para enfermeras, 2.a, ed. Panamericana, 1995. • Swearingen PL. Manual de enfermería medicoquirúrgica. Intervenciones enfermeras y tratamientos interdisciplinarios. Elsevier, 2008.