savene (desrazoxano)
Anuncio

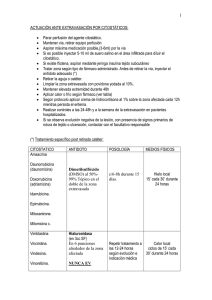
CLINICA UNIVERSITARIA Centro de Información de Medicamentos Servicio de Farmacia. Tfno. 948-25 54 00 ext. 4122 ________________________________________________________________________________________________ SAVENE (DESRAZOXANO) Extravaxación de antraciclinas Informe para la Comisión de Farmacia y Terapéutica de la Clínica Universitaria de Navarra Fecha 30/11/2006 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Dexrazoxano Indicación clínica solicitada: Extravasación por antraciclinas Autores / Revisores: Giráldez, Ortega Declaración Conflicto de Intereses de los autores: Ningún conflicto intereses 2.- SOLICITUD Y DATOS DEL PROCESO DE EVALUACIÓN: Facultativo que efectuó la solicitud: Servicio: Justificación de la solicitud: Extravasación de antraciclinas, evitar consecuencias negativas. Fecha recepción de la solicitud: Noviembre-2006 3.- AREA DESCRIPTIVA DEL MEDICAMENTO. Nombre genérico: Dexrazoxano Nombre comercial: Savene® Laboratorio: Topotarget Grupo terapéutico. Denominación: Antídoto y cardioprotector Vía de administración: Endovenosa Tipo de dispensación: Hospitalario Vía de registro: Centralizado Presentaciones y precio Forma farmacéutica y dosis Viales de 500 mg (y 3 bolsas de 500 mL disolvente) Envase de unidades 10 x Código EU/1/06/350/001 Código ATC: VO3AF Coste por unidad Coste por unidad PVP con IVA PVL con IVA 9750 € 4.- AREA DE ACCIÓN FARMACOLÓGICA. 4.1 Mecanismo de acción. Dexrazoxano tiene dos mecanismos de acción principales: 1. Previene la cardiotoxicidad de la antraciclina: la quelación del hierro, especialmente a través de su metabolito de anillo abierto, reduce el estrés oxidativo de los radicales libres dependientes del hierro, que se asocia a la cardiotoxicidad producida por la antraciclina. 2. Efecto antineoplásico: inhibición de la topoisomerasa II. No se sabe en qué medida contribuye cada uno de estos mecanismos al efecto protector contra la destrucción de tejidos después de una extravasación de antraciclina. La extravasación por antraciclinas es muy raro que ocurra, pero una vez que ha sucedido es una situación complicada y peligrosa ya que conlleva la posibilidad de necrosis de la piel y tejido subcutáneo, nervios, daño articular y vascular. A veces es necesaria la cirugía plástica con transplante de piel. El paciente sufre dolor y alteraciones funcionales, se prolonga la estancia hospitalaria, interrupción de los ciclos de quimioterapia, etc. 1 4.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación AEM: Extravasación por antraciclinas. Está en fase de registro por la AEM. EMEA: Extravasación por antraciclinas (28 Julio 2006) FDA: Cardiomiopatía secundaria a doxorubicina en pacientes con cáncer de mama metastásica. De momento es medicamento huérfano para la extravasación por antraciclinas (2004) 4.3 Posología, forma de preparación y administración. Debe ser administrado bajo la supervisión de un facultativo con experiencia en el empleo de agentes para la quimioterapia del cáncer. Se administra una vez al día durante 3 días consecutivos. 2 2 2 La dosis recomendada es: Día uno: 1.000 mg/m Día dos: 1.000 mg/m Día tres: 500 mg/m 2 Para pacientes con un área de superficie corporal superior a 2 m , la dosis individual no debe exceder los 2.000 mg. Se administra como perfusión intravenosa durante un periodo de 1 a 2 horas en una vena grande situada en un área o extremidad diferente de la afectada por la extravasación. La primera perfusión debe iniciarse lo antes posible y en las primeras seis horas después del accidente. La aplicación de bolsas de hielo debe ser retirada del área al menos 15 minutos antes de la administración del antídoto para que haya suficiente riego sanguíneo. Los tratamientos del Día 2 y del Día 3 deben iniciarse a la misma hora (+/- 3 horas) que el primer día. El polvo se reconstituye con 25 ml de agua estéril para obtener una concentración de 20 mg de dexrazoxano por ml de agua estéril. Una vez reconstituida, la solución debe diluirse en la bolsa con el disolvente de 500 mL de Savene. No se debe utilizar dimetilsulfoxido (DMSO) en pacientes a los que se administra dexrazoxano para tratar la extravasación producida por antraciclina. 4.4 Farmacocinética. Sigue un modelo abierto de dos compartimentos independiente del tiempo y de la dosis. Los volúmenes aparentes de distribución son 0,13 a 1,3 l/kg (mediana 0,49 l/kg). El volumen de distribución es independiente de la dosis. Las áreas bajo la curva fueron proporcionales a las dosis. La distribución por los tejidos es rápida, apareciendo los mayores niveles de sustancia principal inalterada y de producto hidrolizado en el hígado y riñones. Muy poco unido a proteínas plasmáticas (2 %). Sufre hidrólisis intracelular primero y se obtienen sus dos intermedios. de un anillo abierto (B y C) y, después, la forma de dos anillos abiertos (ADR-925) que tiene una estructura similar al EDTA y es un potente quelante de hierro y de cationes divalentes como los iones de calcio. Desde un 34 % al 60 % se elimina inalterado en orina. 4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital/mercado Las antraciclinas pertenecen al grupo A de los medicamentos que se extravasan. El procedimiento que actualmente se sigue cuando se produce una extravasación con este fármaco es el siguiente: PROTOCOLO DE ACTUACIÓN: EXTRAVASACIÓN DE CITOSTÁTICOS (A) Medidas generales: Independientemente del fármaco extravasado, las primeras medidas a aplicar son una serie de cuidados que serán suficientes siempre y cuando la extravasación se detecte a tiempo y se trate de fármacos con baja capacidad de producir necrosis: 1. Detener la administración del fármaco, pero dejar el catéter o la aguja en el mismo lugar. 2. Extraer unos 5 ml de sangre para eliminar parte del medicamento extravasado. 3. Si es posible, administrar entre 5 y 10 ml del diluyente para disminuir la concentración del fármaco. 4. Retirar el dispositivo de inyección. 5. Elevar la extremidad afectada, evitando cualquier presión, manipulación o vendaje que puedan agravar la lesión. 6. Controlar periódicamente la evolución de la zona afectada. Medidas específicas: Grupo de fármacos citostáticos: Actinomicina D Amsacrina Adriamicina Daunorrubicina Epirrubicina Idarrubicina Mitomicina 2 Mitoxantrone R 1. Administrar dexametaxona (Fortecortin 4 mg, 1 ml) vía subcutánea. No se administrará más de 0,5 ml por punción. El número de punciones puede ser variable según la cantidad de fármaco extravasado, aplicadas siempre alrededor del área afectada y nunca encima de ésta. 2. Dimetilsulfóxido 95% (DMSO). Aplicar, aproximadamente, sobre el doble del área afectada, previamente cubierta con una gasa que se empapará con unos ml de DMSO (1,5-3 ml). Dejar secar al aire, sin aplicar presión ni vendajes. Repetir cada 6 horas, durante, al menos, 14 días. Se debe tener la precaución de no administrar mayor cantidad de DMSO que la recomendada, ya que su rápida absorción proporciona una elevada concentración del producto en el área afectada, lo cual puede producir sensación de calor, picor, descamación y halitosis. 3. Aplicar frío durante 20 minutos, 4 veces al día durante 3 días. Se aplicarán las bolsas de frío seco evitando presionar la zona (en caso necesario, solicitar más bolsas al Servicio de Farmacia). 5.- EVALUACIÓN DE LA EFICACIA. Existen dos Ensayos Clínicos en los que la EMEA se ha basado para autorizar la comercialización del medicamento: el TT01 y el TT02. Ambos son abiertos, con un solo brazo y multicéntricos. Objetivo principal: evaluar la eficacia para prevenir los daños en los tejidos producidos por la extravasación accidental de antraciclina y, por lo tanto, evitar quelos pacientes sean sometidos a la escisión quirúrgica del tejido afectado. Criterio de inclusión: la extravasación de antraciclina debía ser probada por microscopía fluorescente de una o varias biopsias. En los estudios clínicos no se incluyeron pacientes con neutropenia ni trombocitopenia con criterios de toxicidad comunes superior a grado 1. En el estudio TT01 entraron 23 pacientes y recibieron tratamiento con Savene. En dieciocho se pudo evaluar la eficacia y la seguridad y en otros cinco pacientes se evaluó sólo la toxicidad. Diecisiete de dieciocho pacientes (94,4%) no sufrieron necrosis del tejido. Ninguno de los pacientes requirió intervención quirúrgica. En el estudio TT02 entraron 57 pacientes y recibieron la primera dosis de Savene. Se evaluó la eficacia en 36 pacientes. Un criterio de exclusión del TT02 y no requerido en el TT01 eran los pacientes que habían recibido DMSO tópico.Sólo uno de los 36 pacientes requirió cirugía. En ambos estudios, todos los pacientes habían recibido antraciclina. En general, la antraciclina recibida con más frecuencia fue epirubicina (56% de los pacientes). En la evaluación de la eficacia no se incluyeron pacientes con extravasación desde un dispositivo de acceso venoso central. En ambos estudios, el tratamiento con dexrazoxano evitó el desarrollo de necrosis, permitió continuar el tratamiento contra el cáncer según lo programado en la mayoría de los pacientes y redujo la aparición de secuelas (sólo se observaron secuelas leves y escasas a largo plazo). Variable evaluada en el estudio Escisión quirúrgica Necrosis Retraso en ciclo de QMT Hospitalización debida a la extravasación Secuelas a largo plazo (tras 3 meses) No secuelas Por lo menos una secuela: Alteraciones sensoriales Atrofia de la piel Dolor Malformación Limitación de la movilidad Resultados TT01 N=18 Ninguno. IC 95 %:0-18,5 % 1 (5,6 %) 6 (33,3 %) 9 (50 %) TT02 N=36 1 (2,8%).IC 95%: 0,1-14,5 % 3 (8,3%) 10 (27,8%) 13 (36,1%) 16 (88,9%) 2 (11,1%) 2 (11,1%) 1 (5,6%) 1 (5,6%) No relatadas 0 23 (63,9%) 13 (36,1%) 7 (19,4%) 4 (11,1%) 9 (25 %) 1 (2,8%) 3 (8,3%) En total sólo uno de los 54 pacientes incluidos en los ensayos clínicos evaluables para la eficacia tuvo necrosis que requirió cirugía como consecuencia de la extravasación. Para evaluar la eficacia se tomó como referencia (población control) el porcentaje de pacientes que son sometidos a cirugía en Dinamarca (100 %) para el ensayo TT01 y datos obtenidos de la literatura (35 %) para el ensayo TT02 3 La naturaleza del tratamiento ha impedido que el ensayo se realizara doble ciego, por lo que adolece de un grupo bien definido de pacientes que actúen como controles. Hay que tener en cuenta que en la Clínica la mayor parte de los pacientes reciben quimioterapia mediante catéter venoso central (tipo Hickman o Porth a cath) y en los dos EC sólo uno de los pacientes tenía este dispositivo. Es decir, la eficacia de este fármaco en pacientes con catéter venoso central no ha sido evaluada. Por otra parte pacientes con neutropenia y trombocitopenia con CTC>grado I no han sido incluídos, y la mayor parte de los pacientes que reciben quimioterapia sufren esta toxicidad o incluso de mayor grado. 6. EVALUACIÓN DE LA SEGURIDAD. En los estudios realizados hasta la comercialización, los efectos adversos más frecuentes son toxicidad hematológica, aumento de alanina aminotransferasa, náuseas y dolor en el lugar de inyección del dexrazoxano. Variable de seguridad evaluada en el estudio Flebitis Fiebre Fatiga Reacción en el lugar de inyección Infección de herida Alopecia Nausea Vómitos Diarrea Estomatitis/faringitis Neutropenia febril TT01 y TT02 N =80 Grado 1-4 6(7,5 %) 5(6,3%) 2 (3,5%) 22 (27,5%) 8(10%) 5(6,3%) 15(18,8%) 6(7,5%) 3(3,8%) 2(3,5%) 2(3,5%) Las reacciones adversas observadas en los dos ensayos clínicos son muy similares entre sí. Uno de los pacientes del EC TT01 discontinuó el tratamiento por los efectos adversos, que no estaban relacionados con el dexrazoxano. En el TT02 otro paciente discontinuó el tratamiento por presentar durante la primera infusión vértigos y progresiva somnolencia. El tratamiento fue retirado tras la segunda infusión ya que los síntomas no cesaban. 6.2 Precauciones de empleo en casos especiales, No se ha evaluado la eficacia ni la seguridad en pediatría, pacientes con insuficiencia renal ni hepática ni en ancianos. No está recomendado su uso en estos pacientes. Si se utiliza es necesario monitorizar estrechamente a los pacientes. Está contraindicado en pacientes con hipersensibilidad al principio activo o a algunos de los excipientes, en mujeres embarazadas, durante la lactancia y en pacientes recientemente vacunados frente a la fiebre amarilla. Debido a que Savene disolvente contiene potasio (98 mg/500 ml) se debe controlar estrechamente el nivel de potasio en plasma en pacientes con riesgo de hipercalemia. También contiene sodio (1,61 g/500 ml) que puede resultar dañino para pacientes con una dieta baja en sodio. No se recomienda el uso concomitante con vacunas vivas atenuadas, fenitoína (agrava convulsiones) ni junto con ciclosporina y tacrolimus ya que puede producirse una excesiva inmunosupresión con riesgo de transtorno linfoproliferativo. El fármaco podría sumarse a la toxicidad producida por el ciclo de quimioterapia durante el cual tuvo lugar el accidente, por lo que requiere un control cuidadoso de los parámetros hematológicos. 4 7. AREA ECONÓMICA Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s medicamento Savene® Control Dexrazoxano DMSO (Equipo extravasación A) Precio unitario (PVL+IVA) * 9750 15,7 Posología Durante 3 días: 2 Día uno: 1.000 mg/m 2 Día dos: 1.000 mg/m 2 Día tres: 500 mg/m Coste día 3250 5,23 Coste tratamiento completo 9750 15,7 o tratamiento/año La caducidad que le dan al fármaco es de 2 años. En un estudio realizado por la MD Anderson informaban que en un periodo de 6 años, el número de extravasaciones había sido de 44 casos en 40-60000 tratamientos de quimioterapia administrados. Doce de esos 44 casos era extravasaciones por doxorubicina y de estos doce, diez requirieron intervención quirúrgica. Se estima que durante un año será tratado un paciente con el nuevo fármaco. En lo que va de año, han solicitado 3 veces el equipo A de extravasación al Servicio de Farmacia, dos debidas a la extravasación de antraciclinas que se resolvieron con las medidas generales. 8.- AREA DE CONCLUSIONES. Savene fue designado medicamento huérfano en Septiembre de 2001 ya que el número de pacientes que presentan extravasación por antraciclinas es muy pequeño. En Julio de 2006 el Comité de Medicamentos de Uso Humano concluyó que el fármaco había demostrado su eficacia en el tratamiento de la extravasación de antraciciclinas y afirmaba que los beneficios son mayores que sus riesgos, por lo que autorizó su comercialización. El efecto del dexrazoxano fue considerado como clínicamente relevante en una indicación donde no existe otro tratamiento estándar y donde no se existen ensayos clínicos previos. En lo que va de año, han solicitado 3 veces el equipo A de extravasación al Servicio de Farmacia, dos debidas a la extravasación de antraciclinas que se resolvieron con las medidas generales. 9.- BIBLIOGRAFÍA. 1. Informe EPAR Savene®. 2. Ficha técnica de Savene. 3. Langstein HN. Retrospective study of the management of chemotherapeutic extravasation injury. Annals of plastic Surgery 49 (4):369-374 Oct 2002 4. Hasinoff Brian. Dexrazoxane use in the prevention of anthracycline extravasation injury. Future Oncol (2006) 2 (1);15-20 5