actividades de superación segundo periodo 10
Anuncio

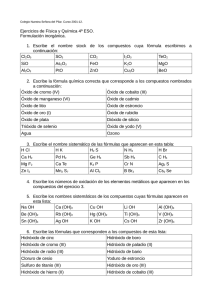
ACTIVIDADES DE SUPERACION – QUIMICA – GRADO 10 SEGUNDO PERIODO Las siguientes actividades deben desarrollarse como requisito indispensable para la sustentación de las mismas el día lunes 25 de Julio de 2016, en el horario de 6:00 a.m. a 1:00 p.m. y según el horario dado por la coordinación académica. Así también ellas se presentarán en hojas de tamaño carta, a manuscrito y en carpeta, guardando las normas estéticas de presentación, ESTAS ACTIVIDADES SON REQUISITO INDISPENSABLE PARA LA EVALUACIÓN DE SUPERACIÒN, LA CUAL EQUIVALE AL 100% DE LA VALORACIÓN. El estudiante debe asistir en uniforme de diario. LOGRO APLICA LAS DIFERENTES FORMAS DE NOMENCLATURA DE LA QUÍMICA INORGÁNICA, PARA IDENTIFICAR TIPOS DE ÓXIDOS, ÁCIDOS, Y SALES DE USO COTIDIANO, A PARTIR DEL RECONOCIMI E NTO DE LOS ELEMENTOS COMO METALES Y NO METALES DE LA TABLA PERIÓDICA VALORANDO SU IMPORTANCIA EN LOS PROCESOS BIOLÓGICOS E INDUSTRIALES. 1. Complete la siguiente tabla. FÓRMULA QUÍMICA TIPO DE ÓXIDO ESTADO DE OXIDACIÓN DEL METAL O NO METAL NOMENCLATURA STOCK NOMENCLATURA SISTEMÁTICA NOMENCLATURA TRADICIONAL O COMÚN CaO Br2O PbO Cr2O3 I2O7 Au2O3 SeO2 N2O5 CrO3 2. Dados los siguientes cationes, forme el hidróxido correspondiente y escriba su nombre en los tres sistemas de nomenclatura. a. Cu+1__________ =________________________ , _______________________ , _______________________ b. Ni+3 __________ =________________________ , _______________________ , _______________________ c. Au+3__________ =________________________ , _______________________ , _______________________ d. Cu+2__________ =________________________ , _______________________ , _______________________ e. Cd+2__________ =________________________ , _______________________ , _______________________ f. Cu+2__________=________________________ , _______________________ , _______________________ g. Ca+2__________=________________________ , _______________________ , _______________________ h. Hg+1__________=________________________ , _______________________ , _______________________ 3. Escriba el producto de la reacción. Indique el nombre del compuesto resultante e indique los estados de oxidación de cada elemento en el compuesto. a. SeO3 + H2O _____________ _________________________________________________ b. I2O5 + H2O _____________ _________________________________________________ c. AsO2 + H2O _____________ _________________________________________________ d. Cl2O + H2O _____________ _________________________________________________ e. Mn2O7 + H2O _____________ _________________________________________________ f. P2O5 + 3H2O _____________ _________________________________________________ g. Cr2O6 + H2O _____________ _________________________________________________ 4. Complete las siguientes reacciones y nombre todos los compuestos que intervienen en ellas: a. HCl + KOH b. __________ + H2O c. CuO + H2O d. _________________ e. FeCl3 + NaOH f. Ba g. _______________ h. Au2O3 i. H2SO4 + Co(OH)3 5. Relacione los iones de la tabla y forme los compuestos correspondientes, escriba la formula y el nombre utilizando la nomenclatura tradicional de la sustancia resultante. + _________________________ 2HClO ____________________________ + ___________________ 3NaCl + O2 ION OH-1 NO3-1 ClO-1 PO4-3 CO3-2 6. ______________________ FeSO 4 + H2O + H 2O _________________ + __________________ + ____________ H 2CO3 Au(OH)3 ___________________ Cu+2 Al+3 + NH4+1 ___________________ Fe +3 Na +1 Pb+4 Teniendo en cuenta el siguiente esquema, coloque la letra del catión y el número del anión correspondiente para formar los compuestos que se piden a continuación. b. Ni +2 c. Li+1 a. Mg+2 2. BO3-2 3. SO4-2 1. MnO4-1 Catión Anión d. Ag +1 e. H+1 4. IO4-1 5. Se-2 Sulfato de plata ( ___, ___ ); Ácido peryódico ( ___, ___ ); Sulfato de magnesio ( ___, ___ ); Ácido bórico( ___, ___ ); Peryódato niqueloso ( ___, ___ ); Permanganato de plata ( ___, ___ ); Ácido sulfúrico ( ___, ___ ); Borato de magnesio ( ___, ___ ). 7. En el siguiente esquema se plantea la formación de 8. Forme la sal a partir de los elementos, teniendo en una sal a partir de sus óxidos; complete con las cuenta sus estados de oxidación, indique el nombre fórmulas y los nombres de los compuestos de la sal obtenida: respectivos, luego consulte las aplicaciones de la sal que se obtiene: Na+1 N+5 Estado de oxidación del Metal Estado de oxidación del No Metal Óxido Básico Óxido Ácido Hidróxido Ácido CuSO4 + O-2 + H2O + O-2 + H2O 1. Nombre o formule los siguientes óxidos, indique para cada elemento el estado de oxidación con que se encuentra en el compuesto. Li2O, Cu2O, Cr2O3, Al2O3, SiO2, N2O, FeO, MgO, CaO, PbO, Óxido de nitrógeno (III), Óxido de cloro (V), Óxido de estaño (IV), Óxido de nitrógeno (V), Óxido de fósforo (III), Óxido sulfúrico, Pentaóxido de di cloro, Óxido hipocloroso, Óxido cobaltoso y Óxido carbónico. 2. Nombra o formula los siguientes hidróxidos, indique para cada elemento el estado de oxidación con que se encuentra en el compuesto. LiOH, Cu(OH)2, Cr(OH)3, Al(OH)3, Mg(OH)2, AgOH, Fe(OH)2, NaOH, Ca(OH)2, Pb(OH)4., Hidróxido de oro (III), Hidróxido mercúrico, Hidróxido crómico, Hidróxido ferroso, Hidróxido de plata (I), Hidróxido de cobre(II), Dihidóxido de zinc, Hidróxido de escandio, Hidróxido cobaltoso e Hidróxido áurico. 3. Nombra o formula los siguientes ácidos, indique para cada elemento el estado de oxidación con que se encuentra en el compuesto. HClO3, H2SO4, HNO, H3PO4, H2CO3, H4SiO4, H3BO3, HMnO4, H2Cr2O7, H2MoO4, Ácido perclórico, Ácido selenioso, Ácido fosfórico, Ácido silícico, Ácido bórico, Ácido manganoso, Ácido crómico, Ácido volfrámico y Ácido gálico. 4. Nombra o formula las siguientes sales, indique para cada elemento el estado de oxidación con que se encuentra en el compuesto. AgNO3, Fe2(SO4)3, Pb3(PO4)4, CoCO3, KBrO, Ni2(SO4)3, Na3BO3, KMnO4, Ag2Cr2O7, CaMoO4, Perclorato de hierro (III), Selenito de bario, fosfato de plata, silicato de estroncio, sulfato de Níquel (III), sulfato de hierro (II), Dicromato de potasio, iodato de cobre (I) y permanganato de cromo (II). Lic. Myriam Alejandra Amezquita R Lic. Mery Juliette Navarro C. Docente de Química