Informe
Anuncio

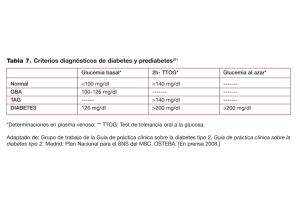
DIABETES MELLITUS EN NIÑOS Y ADOLESCENTES Residencia de Nutrición de la Provincia de Bs. As. - HIGA “Prof. Dr. Ramón Carrillo”. Caamaño M. Victoria, Nastasi Victoria, Ramón Evangelina. 2015 La Diabetes Mellitus constituye un grupo de desórdenes metabólicos de etiología múltiple caracterizado por la hiperglucemia como consecuencia de una alteración en la secreción o actividad de la Insulina. Se encuentra alterado principalmente el metabolismo de los hidratos de carbono, así como también el metabolismo de las proteínas y de las grasas. Ante la hiperglucemia sostenida, se pueden afectar de manera progresiva diferentes órganos, originando distintas patologías (hipertensión arterial, enfermedad cardiovascular, dolor isquémico o neuropático, afección renal, etc). Además pueden presentarse complicaciones agudas como: hipoglucemia, cetoaciosis y coma hiperosmolar. Cabe destacar que el 90% de los casos que se presentan en la infancia y adolescencia, pertenecen a Diabetes Mellitus Tipo 1 (DM1). Si bien la diabetes en pediatría se correspondía, históricamente, con una forma de presentación con características definidas tales como: poliuria, polidipsia, polifagia, pérdida de peso, y cetosis (DM1), en la actualidad, y desde hace algunas décadas, aumentó la epidemia de la obesidad y la frecuencia de Diabetes Mellitus Tipo 2 (DM2). En este contexto epidémico, hay más niños con DM1 que presentan sobrepeso y obesidad y jóvenes con DM2 que pueden haber perdido una cantidad considerable de peso antes del diagnóstico y al momento del mismo pueden presentar cetosis. Existe un tercer grupo de patologías: Diabetes Monogénicas; en las cuales se incluye la MODY (Maduraty Onset Diabetes Young) y la Diabetes Neonatal, trasmitidas en forma autosómica dominate. En cuanto a la epidemiología, en líneas generales, la incidencia es mayor en poblaciones de origen europeo y caucásico, incluyendo países de Europa, Estados Unidos y Canadá. Otros países con alto porcentaje de población caucásica tienen la incidencia más alta de sus respectivas regiones, tales como Argentina y Uruguay en América del Sur y Australia y Nueva Zelandia en el Pacífico Occidental. Por otra parte, la incidencia es baja en países con una proporción elevada de otros grupos étnicos, tales como México, Perú y China. En nuestro país se estima que existen alrededor de 1.500.000 diabéticos. La enfermedad se presenta con mayor frecuencia en niñas que en niños y en edades de 10 a 14 años. CRITERIOS DIAGNÓSTICOS: En niños sintomáticos (poliuria, polifagia, polidipsia y pérdida de peso) el diagnóstico se confirma con un valor de glucemia por encima de 200 mg/dl, independientemente del tiempo transcurrido desde la última ingesta. En niños asintomáticos, el diagnóstico se realiza con la presencia de uno de los siguientes criterios de laboratorio: 1. Glucemia en ayunas superior a 126 mg/dl. Glucemia alterada en ayunas (100- 126 mg/dl). 2. Test de sobrecarga a la Glucosa: Glucemia por encima de 200 mg/ dl obtenida dos horas después del test de sobrecarga oral a la glucosa. Intolerancia a la glucosa: es cuando la glucemia a las dos horas postcarga es mayor de 140 y menor de 200 mg/ dl. CLASIFICACIÓN ETIOLÓGICA DE LA DIABETES: Tipo 1: destrucción de las células beta, deficiencia absoluta de insulina (Autoinmunidad). Tipo 2: relacionada con la resistencia a la insulina con una deficiencia relativa de insulina esta puede ser por: defecto secretorio con o sin resistencia a la insulina. Otros tipos de diabetes: monogénicas, diabetes mitocondrial, defectos genéticos en la secreción de insulina, enfermedades del páncreas exócrino, endocrinopatías, inducida por drogas o por químicos, infecciones, formas poco frecuentes de diabetes inmunomediada, síndromes genéticos que pueden asociarse a diabetes, diabetes gestacional. La DM1 se desarrolla por la combinación de factores genéticos desencadenada por factores ambientales que producen la destrucción autoinmune de las células beta, productoras de insulina en el páncreas. Determinar anticuerpos permite distinguir entre DM1 y DM2, cuando las características clínicas dificultan el diagnóstico diferencial. SUSCEPTIBILIDAD A OTRAS ENFERMEDADES AUTOINMUNES Y FACTORES DE RIESGO Los pacientes que presentan anticuerpos son susceptibles a otras enfermedades autoinmunes como: Tiroiditis de Hashimoto, Enfermedad Celíaca, Enfermedad de Addison, Miastenia gravis. 1 Dentro de estos mencionaremos los más destacados: Familiares de primer grado, familiares cercanos con anticuerpos positivos. Antecedentes familiares de enfermedades autoinmunes: tiroiditis, vitíligo, artritis reumatoidea, enfermedad celíaca, presencia de antígenos de histocompatibilidad de riesgo HLA D3 y /o HLA D4, falta de amamantamiento, exposición a la leche de vaca de manera prematura; Incorporación precoz del gluten, tóxicos ambientales; Obesidad (más que un factor de riesgo acelera la presentación en individuos predispuestos). PRESENTACIÓN CLÍNICA/ ETAPAS DE LA DM1: 1) Fase Preclínica: Esta se relaciona con una predisposición genética (puede anteceder en años a la presentación de la diabetes). Es aquí donde existe la exposición a un factor ambiental que impulsa la autoinmunidad activa y que comienza la destrucción progresiva de las células beta. Como las células beta tienen una amplia capacidad secretoria, es posible que los síntomas se produzcan cuando se ha destruido entre el 80- 90% de las células beta. Lo más frecuente es la normoglucemia, el diagnóstico no es posible excepto que haya antecedentes de DM1 y se hagan estudios de anticuerpos y estudios genéticos 2) Fase de Presentación: Con los síntomas clásicos de la diabetes, la presentación puede darse de manera no constituir una emergencia médica. En esta etapa se inicia el tratamiento insulínico. Síntomas: Poliuria, polidipsia, polifagia, pérdida de peso, enuresis en niños que ya controlaban los esfínteres o infecciones urinarias. Irritabilidad en niños pequeños, cambio de carácter y disminución del rendimiento escolar en niños más grandes. Dolor abdominal, vómitos que pueden interpretarse como gastroenteritis. Infecciones recurrentes de piel. Candidiasis vaginal, especialmente en niñas prepúberes. Poliuria con deshidratación severa, trastornos hidroelectrolíticos, shok. Polipnea, respiración característica de acidemia, aliento frío con olor característico. Hipotensión, hipotermia. Trastornos del sensorio: desorientación, coma. 3) Fase de Remisión Parcial o de “Luna de Miel”: Los requerimientos de insulina disminuyen transitoriamente en el 80% de los niños y adolescentes. Ocurre a los pocos días o semanas de iniciado el tratamiento insulínico. Puede durar semanas o meses. La glucemia se encuentra estable, dentro del rango normal o ligeramente elevada a pesar de las fluctuaciones en la dieta y en el ejercicio. Algunos niños dejan de requerir la insulina de manera transitoria. 4) Fase Crónica: Se instaura la enfermedad y se requiere insulina, de por vida. En relación al tratamiento, es la insulina (en la DM1), el único medicamento eficaz para disminuir los valores de glucemia. La administración de la dosis adecuada de insulina requiere del conocimiento de la relación entre la alimentación, la actividad física y la insulina. Su uso correcto evita las hiperglucemias y las hipoglucemias. Objetivos terapéuticos: El equipo a cargo del paciente diabético debe estar compuesto por un equipo interdisciplinario (pediatra, médico nutricionista, licenciado en nutrición, personal de enfermería, equipo de psicología, podólogo). Los objetivos terapéuticos iniciales son: Eliminar la cetosis. Evitar el edema cerebral. Mejorar los síntomas. Alcanzar recuperación hidroelectrolítica y nutricional. Tratar las infecciones asociadas al debut. CLASIFICACIÓN DE LA INSULINA De acuerdo a su origen Insulina de origen animal (bovina, porcina). Insulina humana semisintética (transpetidación de insulina porcina). Insulina humana biosintética. Análogos de insulina: Se desarrollan a partir de modificaciones en la estructura molecular de la insulina. De acuerdo al tiempo de acción Rápidas: Insulina corriente o regular, es la insulina natural. Intermedia: NPH. Ultralenta: Glargina y determir. Ultrarápida: Análogos Lispro, Aspártica y Glulisina. 2 CONTROL METABÓLICO: El adecuado control metabólico de estos pacientes es fundamental para garantizar un crecimiento y desarrollo adecuado y para evitar complicaciones tanto agudas como crónicas. Es conocido que la hiperglucemia juega un papel importante en el desarrollo de complicaciones micro y macrovasculares, sin embargo, lograr niveles de glucemia y HbA1c ideales es difícil en esta población. Los niños con diabetes corren el riesgo de desarrollar complicaciones incapacitantes y potencialmente mortales en edades tempranas, constituyendo una importante demanda humana y económica para sus padres y familiares. La complicación aguda más frecuente es la hipoglucemia. La cetoacidosis diabética, otra complicación aguda, se debe comúnmente a la omisión del tratamiento o por un proceso infeccioso asociado. Se presenta con mayor frecuencia en la DM1, que es la principal causa aguda de morbilidad y mortalidad como resultado de la insuficiente secreción relativa o absoluta de insulina. Entre las complicaciones crónicas se describen las microvasculares, que incluyen retinopatía, nefropatía y neuropatía diabéticas, y las complicaciones macrovasculares como HTA, enfermedad cardiovascular y pie diabético, siendo éstas últimas, menos frecuentes que las primeras en la DM1. Estudios en adolescentes y jóvenes (hasta 25 años) refieren prevalencias de retinopatía variables entre un 10% y un 50%, de nefropatía entre 30 y 40% y de neuropatía de 40 a 50% de la población con DM1 con más de 10 años de evolución de su enfermedad. En adolescentes, el tratamiento intensivo comparado con el tratamiento convencional reduce el riesgo y progresión de retinopatía en 53%, neuropatía clínica en 60% y microalbuminuria en 54%. DIAGNÓSTICO DE DIABETES MELLITUS 2 En líneas generales, estos pacientes tienen hiperglucemia menor que los pacientes portadores de DM1, carecen de autoinmunidad, tienen niveles significativamente mayores de insulinemia y de péptido C, con menor frecuencia desarrollan cetonuria y acidosis aunque su presencia no se descarta. El objetivo terapéutico en estos pacientes es favorecer el descenso de peso, la vida activa y la alimentación saludable. En cuanto al laboratorio es importante lograr HbAc1 menores de 7% y glucemias preprandiales menores de 126 mg/dl. Es muy importante destacar que el tratamiento inicial dependerá de la presentación: glucemia mayor o igual a 250 mg/dl o HbA1c mayor o igual a 9% se iniciara tratamiento con insulina basal con NPH o análogo lento y bolo con insulinas de acción rápidas; glucemia menor a 250 mg/ dl o HbA1c menor o igual a 9 % con metformina, siempre acompañado de un plan de alimentación. TERAPIA NUTRICIONAL La terapia nutricional es un pilar fundamental en el tratamiento de la DM1, junto con la adecuada administración de insulina, el ejercicio físico y la educación alimentaria continua. Es crucial que el niño y sus familiares/cuidadores comprendan los efectos de cada uno de estos aspectos en los niveles de glucosa sanguínea, siendo la alimentación el mayor responsable de la variabilidad glucémica. Siguiendo la premisa de la ley de adecuación, cada plan de alimentación debe ser individualizado para cada niño de acuerdo a su estado nutricional y presencia de comorbilidades, adecuado a su edad, actividad, hábitos, costumbres y situación socioeconómica. Habitualmente existe una impresión de que la dieta de un niño diabético debe ser excesivamente rígida, con muchas restricciones. Sin embargo, es importante brindar un plan de alimentación equilibrado y variado, que provea energía y nutrientes suficientes para un óptimo crecimiento y desarrollo, educando y alentando al niño y a sus familiares en la adquisición de un estilo de vida saludable, tomándose el tiempo necesario para que adquieran confianza en el tratamiento de una enfermedad crónica que requerirá cuidados especiales. EDUCACIÓN ALIMENTARIA NUTRICIONAL Existe evidencia grado A de que las intervenciones educativas en niños y adolescentes con diabetes tienen un efecto beneficioso en el control glucémico y en los resultados psicosociales. Muchas de las guías pediátricas incluyen capítulos específicos de educación donde se enfatiza la necesidad de empoderar a los niños y a sus familias en el control de su diabetes. Es decir, proveerlos con los conocimientos y habilidades necesarias para el autocuidado de la diabetes, manejo de crisis, y para la realización de cambios de estilo de vida. En un primer momento, se sugiere brindar recomendaciones dietéticas básicas de alimentación saludable y hidratos de carbono, trabajando sobre la necesidad de realizar las comidas pautadas en horario regular, estableciendo horarios en función de los hábitos alimentarios, para luego trabajar en el plan nutricional, con consejos cualicuantitativos sobre la ingesta de hidratos de carbono, fibra, grasas y proteínas, manejo de la alimentación en eventos sociales y cuando realiza actividad física, alimentos dietéticos, edulcorantes y bebidas, prevención de trastornos de la conducta alimentaria, entre otros. Existe consenso entre las diferentes Guías de Práctica Clínica, de que las recomendaciones nutricionales se basan en las 3 recomendaciones disponibles para adolescentes sanos y que los principios nutritivos deben guardar una distribución armónica. La prevención del sobrepeso y la obesidad en niños con DM1 es un punto clave del cuidado y debe realizarse bajo un enfoque que involucre a toda la familia. En los niños con diabetes, la sobreinsulinización, el snacking, y el exceso de ingesta para evitar o tratar la hipoglucemia contribuye al desarrollo de obesidad. Al momento del diagnóstico muchas veces es necesario favorecer la recuperación del peso perdido. Sin embargo, es fundamental monitorear la adecuada ganancia de peso y reducir la ingesta de energía cuando se ha alcanzado el peso adecuado. NUTRIENTES Los hidratos de carbono no deben restringirse en la alimentación de un paciente con DM1. El porcentaje del requerimiento energético que debe estar cubierto por hidratos de carbono, varía desde un 5055% para las Guías de la International Society for Pediatric and Adolescent Diebetes (ISPAD), 45-60% según las guías Australianas, y 130 g/día para las Guías de la American Diabetes Association (ADA), con predominio de complejos, que requieren una digestión más prolongada, tienen una absorción más lenta y por lo tanto producen menores oscilaciones glucémicas. Recomendar la ingesta de alimentos fuentes saludables de hidratos de carbono como panes y cereales integrales, legumbres, frutas, vegetales y lácteos descremados. La distribución diaria de hidratos de carbono siempre debe acompañar el esquema insulínico. Para esto, resulta indispensable educar en la identificación de los alimentos que contienen hidratos de carbono para asegurar que el niño los incluya en todas las comidas que realice y evitar así los episodios de hipoglucemia. La sacarosa puede representar hasta el 10% del total de la ingesta calórica diaria. La sacarosa no aumenta la glucemia más que cantidades isocalóricas de almidón. Es preferible su uso junto con otros alimentos que hagan más lenta su absorción. Debe ser consumida en el contexto de una alimentación saludable evitando esquemas rígidos y estrictos, que no mejoran la adherencia al tratamiento. Resulta indispensable alentar el consumo de fibra, teniendo en cuenta que su ingesta suele ser menor a la recomendada. La fibra soluble es beneficiosa para reducir los niveles de lípidos. La fibra insoluble mejora la saciedad y disminuye la ingesta de alimentos de alta densidad calórica. Esta debe ser incorporada lentamente a la alimentación para prevenir disturbios abdominales y siempre debe estar acompañada de un aumento de la ingesta de líquidos. Con respecto a las proteínas, constituyen una fuente de nitrógeno que promueve el crecimiento cuando las cantidades calóricas son adecuadas. No hay evidencia de eficacia o seguridad de dietas con bajo o alto aporte de proteínas en niños o adultos con DM1 sin nefropatía. Una dieta alta en proteínas y baja en hidratos de carbono puede afectar el crecimiento y favorecer la deshidratación y cetosis. En relación con las grasas, el 25% al 35% restante estará aportado por las grasas, preferentemente en la etapa 1 del National Cholesterol Education Program (NCEP). Múltiples estudios han demostrado que niños y jóvenes con diabetes presentan un consumo de grasas por encima de las recomendaciones. El consumo de ácidos grasos saturados, induce a insulinorresistencia, hipercoagulabilidad y empeora el control metabólico de la diabetes. La ingesta de ácidos grasos trans durante un periodo de tiempo prolongado afecta la sensibilidad a la insulina alterando las funciones de las membranas celulares. No es necesario el uso de suplementos de vitaminas y minerales porque pueden ser cubiertos con la alimentación, salvo en estados de carencia. Dentro de los electrolitos, el sodio merece una consideración especial. Su aporte debe ser normal. Las guías ADA recomiendan un aporte de entre 1500 a 2300 mg/día, mientras que las guías ISPAD establecen sus recomendaciones por categorías de edad: 1000 mg para niños entre 1 y 3 años, 1200 mg para niños entre 4 y 8 años, y 1500 mg para mayores de 9 años. La presencia de HTA obliga a restringir el consumo de sal en la dieta y la presencia de cetosis o cetoacidosis, a suplementar su aporte debido al incremento de las pérdidas urinarias. Los productos alimenticios comercializados como productos para diabéticos, no son recomendados debido a que no son necesarios, son costosos, con frecuencia poseen un alto contenido de grasa y pueden contener edulcorantes con efectos laxantes, como el sorbitol. Tampoco se recomienda indicar edulcorantes a los niños de corta edad, menores de 5 años, ya que los valores de ingesta diaria admisible se calculan en función del peso del niño por lo tanto, a más corta edad menor peso y menor margen de seguridad para sobrepasar dichas cantidades. En menores de 5 años se debe contemplar además los edulcorantes no nutritivos que se encuentran en los productos dietéticos. 4 TRATAMIENTO INTENSIVO Con el tiempo, cuando el niño necesita un tratamiento más flexible, no tan pendiente de horarios y colaciones, suele considerarse comenzar con un tratamiento intensivo. Esta terapéutica requiere que el paciente conozca con más exactitud la cantidad de hidratos de carbono de las comidas que ingiere a fin de calcular el bolo de insulina que puede variar de acuerdo a la edad del niño e incluso puede variar en cada momento del día (sensibilidad por tramos). Para niños en edad escolar se propone un ratio I/HC de 1/15, distinto al de adolescentes que puede establecerse en 1/107.5 y al de prescolares: 1/30-50. Si bien el tratamiento intensivo se adapta a hábitos menos estrictos, siempre se debe tener como premisa el concepto de alimentación saludable y evitar la alta ingesta de alimentos ricos en azucares y grasas saturadas con el consiguiente aumento de IMC. Esta modalidad no hace necesario el uso de colaciones, por ello el paciente deberá saber que si realiza alguna comida extra a las principales también deberá aplicarse insulina en función de la cantidad de hidratos de carbono. Existen distintos métodos para cuantificar la ingesta de hidratos de carbono. No hay evidencia fuerte que sugiera que un método en particular sea superior a otro. La educación con respecto a los hidratos de carbono, debe ser individualizada para cada niño y su familia, de acuerdo a su nivel de entendimiento y al régimen de insulina. Habitualmente, estos cálculos no tienen en cuenta la cantidad de grasas y de proteínas de la comida. En los últimos años se han recomendado algoritmos contando unidades de proteínas y grasas, en adición a los hidratos de carbono, para determinar un requerimiento de insulina complementario para comidas altas en grasas y proteínas. En el año 2008 Lodefalk M comparó la respuesta glucémica de comidas con mismo contenido de hidratos de carbono y proteínas pero diferente contenido de grasa en adolescentes con DM1 y concluyó que la respuesta glucémica inicial estaba reducida luego de una comida alta en grasa, por lo tanto era necesario ajustar según el contenido de grasa el tipo y dosis de insulina preprandial para alcanzar la normoglucemia posprandial. Un estudio aleatorizado llevado a cabo por Carmel EM Smart y colaboradores, en dos centros pediátricos de Australia, examinó el efecto de 4 desayunos, todos con la misma cantidad de hidratos de carbono pero con diferente cantidad de proteínas y grasas, en la glucemia posprandial en niños y adolescentes con terapia de insulina intensificada. En este estudio se demostró que: 1) Las grasas reducen las excursiones glucémicas posprandiales tempranas pero aumentan la hiperglucemia tardía; 2) La sumatoria de grasas y proteínas tiene un efecto aditivo, prolongando la hiperglucemia; 3) Las proteínas y grasas deben ser consideradas. Es necesaria una mayor dosis de insulina. Sin embargo, los momentos de administración aun no quedan claros. En base a todo esto se propone considerar las grasas y las proteínas y utilizar la Unidad de Intercambio de Grasas y Proteínas: 1 UI cada 100 kcal de grasas y proteínas; 1 UI cada 11 g de grasa y cada 25 g de proteínas. ADOLESCENCIA El tratamiento del adolescente con diabetes implica un gran desafío por diferentes motivos. Por un lado, la ingesta de alcohol ha aumentado considerablemente en los jóvenes de todo el mundo. La edad promedio del consumo de alcohol es de 13 años. Este puede producir hipoglucemia e hiperglucemia, puede enmascarar los síntomas de hipoglucemia, bloquea la producción hepática de glucosa necesaria para salir de ella (glucogenólisis), y es fuente de calorías que pueden contribuir al sobrepeso. Por lo tanto el consumo de alcohol debe evitarse en los adolescentes con diabetes. Sin embargo es fundamental mantener una actitud realista en cuanto a la ingesta de alcohol: informar sobre sus efectos y que en el caso de su ingesta esta debe ser moderada y acompañada de alimentos con hidratos de carbono antes, durante y después de la ingesta, para reducir el riesgo de hipoglucemia, fundamentalmente la nocturna. Por otro lado, también se ha estudiado el uso de drogas en adolescentes con y sin diabetes. El cannabis es la droga ilícita más frecuentemente utilizada, especialmente en individuos jóvenes. Un estudio llevado a cabo por Annemarie Hennessy, identifico una presentación anormal de la cetosis en los usuarios de cannabis: un pH mayor al esperado de acuerdo al grado de los síntomas y al nivel de cetonuria. Los adolescentes que fumaban cannabis tenían una tendencia a la alcalosis metabólica. La cetosis requirió tratamiento con insulina y fluidos intravenosos para su recuperación. Este trabajo concluye que el uso de 5 marihuana puede enmascarar la cetosis diabética, por lo tanto los pacientes con un estado ácido base inusual deben ser interrogados sobre el uso de drogas. Por último, se ha reportado una asociación más frecuente de trastornos de la conducta alimentaria en adolescentes con DM1 que en la población general. La frecuencia de omisión de insulina en adolescentes mujeres, con el objetivo de bajar de peso, es del 15 al 25%. Además, se ha reportado que los adolescentes con diabetes y trastornos alimentarios tienen peor control metabólico y mayor mortalidad que los adolescentes sin diabetes. En base a estos datos, es importante interrogar a los adolescentes con diabetes sobre la percepción de la imagen corporal ya que a veces los síntomas no son completos. Son múltiples los avances que hemos vivenciado en los últimos años en el manejo de la DM1, tanto del tratamiento médico como del nutricional. Sin embargo, se requieren más investigaciones en muchas áreas del manejo de la diabetes en edades pediátricas, particularmente en intervenciones de nutrición efectivas. BIBLIOGRAFÍA: American Diabetes Association. Position of the American Diebetes Association. Use of nutritive and nonnutritive sweeteners. J Am Diet Assoc. 2004; 104: 255-275. American Diabetes Association. Standard of Medical Care in Diabetes. Diabetes Care. 2015; 38 (1) Australian Diabetes Society. National Evidence-Based Clinical Care Guidelines for Type 1 Diabetes in Children, Adolescent and Adults. 2011. Ferraro MF, Andres ME. Síndrome Metabólico, Prediabetes y Diabetes 2 en niños y adolescentes. Figueroa Sobrero A, Evangelista P, Mazza C et al. Seguimiento a 3 años del control metabólico en pacientes con diabetes tipo 1 con trastornos de la conducta alimentaria y sin ellos. Arch Argent Pediatr. 2010; 108:130-135. Hennessy A. Cannabis masks diabetic ketoacidosis. BMJ Case Reports. 2011. Hirschler V, Preiti MC, Caamaño A, Jadzinsky M. Diabetes tipo 2 en la infancia y adolescencia. Arch. argent. Pediatr. 2000; 98(6), 382. International Diabetes Federation, Global IDF/ISPAD Guideline for Diabetes in Childhood and Adolescence. 2011 ISPAD Clinical Practice Consensus Guidelines 2014 Compendium Nutritional management in children and adolescents with diabetes. Pediatric Diabetes 2014: 15(Suppl. 20): 135–153. Lodefalk M, Åman J, Bang P. Effects of fat supplementation on glycaemic response and gastric emptying in adolescents with Type 1 diabetes. Diabetic Medicine2008; 25(9), 1030-1035. Martınez-Aguayo A, Araneda JC, Fernandez D, Gleisner A, Perez V, Codner E. Tobacco, alcohol, and illicit drug use in adolescents with diabetes mellitus. Pediatric Diabetes. 2007: 8: 265–271. Nielsen S, Emborg C, Molbak A. Mortality in concurrent type 1 diabetes and anorexia nervosa. Diabetes Care. 2002; 25:309-312. Programa Nacional de Actualización Pediátrica 2011 (PRONAP). MÓDULO 2. Sánchez AD, Ortega YP, Fraga AO, Cabrera JN. Factores que predisponen al debut de la diabetes mellitus tipo 1 en la edad pediátrica. Revista de Ciencias Médicas de La Habana. 2015; 21, 187-200. Smart C., Evans M., O’connell S., Mcelduff P., et al. Both dietary protein and fat increase postprandial glucose excursions in children with type 1 diabetes, and the effect is additive. Diabetes Care. 2013; 36:3897–3902. Sociedad Argentina de Diabetes. Guías de práctica clínica para el manejo de la diabetes tipo 1. 2012. Risérus U. Trans fatty acids and insulin resistance. Atheroscler Suppl. 2006; 7(2):37-39. Rivera NG, Zárate MGG, Chon IF, Figueroa COG, Jiménez IAG, García LV. Cetoacidosis diabética en niños: experiencia hospitalaria. Estudio retrospectivo de 15 años. Boletín Médico del Hospital Infantil de México. 2015; 72(5), 313-317. Villarreal Y, Briceño Y, Paoli M. Diabetes mellitus tipo 1: características clínicas y demográficas en pacientes del Servicio de Endocrinología del Instituto Autónomo Hospital Universitario de los Andes, Mérida, Venezuela. Rev Venez Endocrinol Metab. 2015; 13(1): 33-47. 6