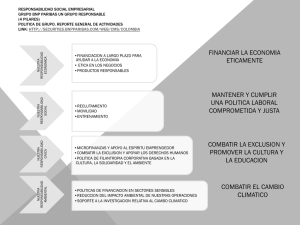
péptidos natriuréticos. adrenomedulina. vasopresina
Anuncio

INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , CAPÍTULO 5 PÉPTIDOS NATRIURÉTICOS. ADRENOMEDULINA. VASOPRESINA Los Péptidos Natriuréticos (PNs) tienen una relevante participación en la regulación de [1-5] funciones renales, humorales y cardiovasculares . Se conoce de su existencia desde el año 1981, cuando el bioquímico argentino Alfredo De Bold descubrió al primero de ellos, el Péptido Natriurético Atrial (ANP=siglas inglesas). Nota1 Tipos de PN Los primeros PNs que fueron descriptos corresponden a tres tipos: 1) El tipo A es el ANP (Atype Natriuretic Peptide o Atrial Natriuretic Peptide), que es un polipéptido de 28 aminoácidos que forman un anillo de 17 aminoácidos (aa) unidos por una ligadura disulfídica entre dos residuos de cisteína, con una extensión terminal carboxilo que le confiere la actividad biológica. Es secretado como prohormona que luego da lugar al pro-ANP terminal amino (t-N) y al ANP activo. Posee propiedades natriuréticas, vasodilatadoras, inhibidoras de la renina, y supresoras del crecimiento. 2) El tipo B es el BNP (B-type Natriuretic Peptide o Brain Natriuretic Peptide ), que se origina en el miocardio, y es un polipéptido de 32 aa, que forma un anillo similar al del ANP, de 17 aa. 3) El tipo C es el CNP (C-type o C- Natriuretic Peptide): es producido en las células endoteliales (CE), y presenta dos sub-tipos: c-53 y C-22 (de acuerdo al número de aa de cada uno), que forman - como en el caso de los anteriores - un anillo de 17 aminoácidos (aunque carece de la terminal carboxilo); hay subtipos de Tomados en conjunto el ANP, el BNP CNP en el corazón, aunque en cantidades muy (BNP), y el proANP t-a, constituyen bajas. Nota2 menos del 5% de los péptidos circulantes. Existe un cuarto PN, la urodilatina, que es El pro-ANP 1-30 o péptido natriurético de un proANP formado en el riñón por los aa 95larga acción, el dilatador vascular y el 126 formadores del mismo anillo de los tipos kaliurético constituyen el 95% de los PNs anteriores, con un terminal carboxilo. Son circulantes conocidos[3]. escasos los niveles plasmáticos de urodilatina (9-12 pg/ml). Se han encontrado nuevos PNs en ofidios. El Dendroaspis Natriuretic Peptide (DNP), de 38 aa, ha sido aislado del veneno de la serpiente Mamba verde (Dendroaspis angusticeps), y se encuentra en el plasma y en las aurículas humanas, y produce efectos natriuréticos y vasodilatadores (en arterias coronarias)[5].Nota3 Se han descrito otros 3 nuevos PN presentes en la víbora Oxyuranos microlepidotus, y se los ha denominado TNP-a, TNP-b y TNP-c[6]. Otros sustancias natriuréticas. Pendrina 1 - En el texto se usarán las siglas inglesas de los PNs, que la costumbre de su uso ha impuesto. - De Bold prefiere le denominación ANF (Atrial Natriuretic Factor) en vez de ANP. También destaca la errónea denominación del CNP, dado que no es diurético. Ogawa T., De Bold AJ. El corazón endocrino y el proceso inflamatorio. Medicina 2013;73:562-566 3 - Se encuentran moléculas de DNP en casos de hemorragia cerebral por aneurisma, previo a la aparición de espasmo arterial cerebral. Serephan A, Altas M, Carf A, Isik N, Edmaci I. A new molecule in aneurysmal subarachnoid hemorrage; Dendroaspis natriuretic peptide. Turkish Neurosurgery 2014;1:38-43 2 89 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , Hamlyn[7] señala que además de los PNs existe una sustancia natriurética controlada por el SNC, aparentemente secretada por la hipófisis , que es modulada por la ingesta de sal y la concentración de Na+ en sangre y en líquido céfalo-raquídeo, que contribuye a diuresis posprandial y deshidratación. Otros natriuréticos son estimulados por estiramiento atrial, y la natriuresis que provocan requiere de la intervención de la dopamina y el NO. Estas sustancias tienen una muy corta vida media plasmática. De los esteroides endógenos como la ouabaína, la digoxina y la bufadienolida sòlo esta última es natriurética. La ouabaína provoca retención de Na+. La pendrina es una nueva meta de transcripción del sistema uroguanilina[8]. La guanilina (GN) y la uroguanilina (UGN) son hormonas de bajo peso molecular de la mucosa intestinal que se secretan en respuesta a la ingesta de sal. GN y UGN inducen secreción de H2O y electrolitos en intestino y riñón (Intestinal Natriuretic Factor [INF]). Las funciones de la pendrina son mediadas por la guanilciclasa, por el GMPc y por vías dependientes de proteínas G. En las células del tubo colector renal actúa por medio de la fosfolipasa A, por ser intercambiador Cl-/HCO3; y es esencial para la secreción de bicarbonato y también para el balance del ClNa y regulación de la PA. El intercambio de aniones en el túbulo colector está regulado por la uroguanilina, que inhibe al gen de la pendrina. Nota al pie4 Aspectos bioquímicos de los PNs Los PN provienen de precursores (Natriuretic Peptide Precursor = NPP). El precursos del ANP (NPPA) consta de 126 aminoácidos y contiene diversos péptidos, numerados por sus secuencias de aminoácidos[3] : proANP con los aminoácidos 1-30 que es el péptido natriurético de larga acción; proANP con los aminoácidos 31-67 que es el dilatador vascular,: proANP con los aminoácidos 79-98 que es el peptido kaliurético y el ANP con los aminoácidos 99-126 . El dilatador vascular y el natriurético de larga acción circulan en proporciones 24 veces mayores que el ANP en normales; el kaliurético en proporciones 3 veces mayores que el ANP. El proANP 1-30 y el 31-67 aumentan la síntesis de prostaglandina E2, y por ella inhiben la Na+K+ATPasa renal. Los efectos diuréticos y natriuréticos son mediados por el GMPc. El ANP es sintetizado principalmente en la aurícula y el BNP en los ventrículos; ambos participan en el control de la P.A. y el equilibrio hidroelectrolítico, protegiendo al sistema cardiovascular de la sobrecarga de volumen. El ANP tambiés es producido en el riñón, y en un proceso alternativo genera urodilatina. El CNP es producido fundamentalmente por las células endoteliales (CE) y otros tejidos (en el cerebro en pequeña cantidad), y tiene escasa o nula acción natriurética, pero si vasodilatadora e inhibidora del crecimiento de las células musculares lisas (CML) [2]. El proANP terminal-amino (proANP t-a) es depurado en el riñón siendo su vida media considerablemente más larga que el ANP. Es inactivo, pero su dosaje da una adecuada noción de los niveles activos de los PN. Las determinaciones de proANP t-N permitirían detectar personas en fases iniciales de IC[3]: el ProANP 31-67, vasodilatador, el 1-30, natriurético de larga acción y 79-98, kaliurético, tienen una sensibilidad del 100% (p = 0,01), 83% (p = 0,09) y 50% (NS), respectivamente, en diferenciar a la IC de clase I de normales. El proANP 31-67 se correlaciona con las clases funcionales mas que la Fey.. La vida media del ANP circulante es de 3-5 minutos, mientras que la del BNP es ~23 minutos y la del proBNP-ta 60-120 minutos (este último, aunque inactivo, por su mayor vida media cobra importancia para las pruebas diagnósticas)[9]. El ANP se expresa en condiciones fisiológicas normales, mientras que el BNP se expresa vinculado a aumento de estrés hemodinámico de la pared miocárdica. La cantidad de BNP circulante es la 5ta. parte de la de ANP. Se dice que la cantidad normal de BNP debe ser menor que la mitad de la edad cronológica en años. 4 . Otros péptidos guanilínicos descritos son la linfoguanilina y la renoguanilina. Estos péptidos están involucrados en condiciones tales como fibrosis quística del páncreas, asma bronquial, tumores intestinales IC, insuficiencia renal (IR), obesidad y síndrome metabólico. Sindis A. Current understanding of guanylin peptides actions. ISRN Nephrol 2013; April 17;2013:813648. . 90 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , Además del corazón otros órganos contienen ANP, tales como el cerebro, el lóbulo anterior de la hipófisis, el pulmón y el riñón. En el cerebro las lesiones en el tercer ventrículo ánteroventral y en la eminencia media bloquean la liberación de ANP hacia la circulación. Las neuronas productoras de oxitocina activan a sus receptores (ubicados en aurículas) e incrementan la producción de ANP[10]. La oxitocina produce además los siguientes efectos: 1) Disminución de la PA; 2) Inotrópicos y cronotrópicos negativos; 2) Moduladores del SNP; 4) vasodilatadores; 5) antinflamatorios; 6) antioxidantes; 7) metabólicos. Sus acciones son mediadas por el NO y el ANP. La oxitocina se sintetiza en el Núcleo Supraóptico y el Núcleo Paraventricular del hipotálamo. La inyección de oxitocina en ratas aumenta la excreción de Na+ y eleva el nivel plasmático de ANP. (Ver más adelante Vasopresina) En pacientes con IC crónica estable el estímulo mayor para la producción de ANP sería la [11,12] dilatación auricular derecha por aumento de volumen de retorno venoso , aunque para [13] Leskinen y col. la liberación del péptido estaría mediada por la endotelina (ET.1). La sobrecarga de volumen o de presión de los ventrículos estimula a los miocitos cardiacos y estos producen proBNP108, que libera un fragmento inerte, el proBNP-terminal amino y también al BNP activo[14]. El BNP estimula natriuresis y vasodilatación; es inhibidor de la renina, de la aldosterona y de la actividad del SNS; es además antifibrótico y tiende a mejorar la relajación ventricular. El proBNP-ta tiene más alto nivel plasmático que el BNP, y no es depurado por los receptores o por endopeptidasas (neutras), pero si por varios órganos (tejido esquelético, hígado, y riñon). El CNP se origina en las células endoteliales estimuladas por citoquinas tales como el TGF- y el TGF- y el TNF-[15]. y actúa como regulador del tono vascular y del crecimiento del músculo liso. Hobbs y col.[16] han descrito un nuevo camino de señalamiento en la vasculatura en el que interviene el CNP y el el NPR-c y la apertura de una GIRK (G Protein-Coupled Inwardly-Rectifying Potassium Channels) para hiperpolarización y relajación del músculo liso, o sea la acción de EDHF. El CNP también contribuye a la regulación del flujo coronario. La activación del CPN/NPRc es importante para la regulación de la circulación coronaria comportándose como un EDHF y su activación constituye un mecanismo de protección contra la injuria de reperfusión. En una excelente revisión de Rose y Giles[17] se señala que el NPR-c se acopla a la proteína Gi, causando inhibición de la adenilciclasa y activación de la fosfolipasa C. También han comprobado que el CNP inhibe la corriente de Ca2+ (por canales L) en los miocitos y en células marcapaso. El CNP participaría en los efectos antiproliferativos en los fibroblastos cardiacos juntamente con el BNP, por medio del NPR-c. En arteriolas mesentéricas y coronarias funciona como un factor hiperpolarizante. Las células endoteliales (CE) producen el EDHF (Endothelium Derived Hyperpolarizing Factor) cuya identidad se desconoce, y que no es óxido nítrico (NO) ni prostaciclina (PGI2). Chauhan y col. [18] consideran que el CNP es el EDHF. La liberación de CNP provocada por la acetilcolina activa al receptor de CNP en el músculo liso vascular el cual, acoplado a la proteína Gi, promueve hiperpolarización. Estos hallazgos confirman la trascendente participación del CNP en la regulación del tono y flujo vascular. Conversión de los PNs Yan y col.[19] han reportado la existencia de la corina, enzima convertidora del pro-ANP en ANP. La corina es una serina proteasa tipo tripsina altamente expresada en miocitos cardiacos[20] que consta de un dominio transmembrana terminal amino que la fija a la superficie celular y que luego de escisión específica de proteínas (Arg-98) del proANP, produce un ANP de 26 aa, terminal amino (ta). También convierte al proBNP en BNP, aunque no específicamente. La enzima convertidora del proBNP es la furina. La corina no interviene en la activación del CNP, y si la furina. Aspectos fisiológicos de los PNs. Receptores de PNs (NPR) 91 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , Los PNs estimulan la acumulación de GMPc, y por la acción favorecedora de éste sobre el NO, [21] pueden intervenir regulando el remodelado vascular . Intervienen, juntamente con el NO y el GMPc, inhibiendo los efectos promotores del crecimiento sobre cardiomiocitos y fibroblastos de la noradrenalina (N-A)[22]. Además, al reducir la precarga, mejoran la función ventricular[23]. Los PNs son una de las dos principales vías de generación del GMPc, a partir del GTP, y su accionar se vincula al aumento intracelular del mismo. Actúan a través de las guanilatociclasas de membrana (GC-A y GC-B).. La segunda. vía para la síntesis del GMPc implica activación de la óxido nítrico sintetasa (NOs), y es el NO el activador de las guanilato ciclasas solubles[24]. La guanilato ciclasas son vasodilatadoras; además inhiben el crecimiento de las células vasculares. El ANP y el BNP liberados por el corazón ante el estiramiento miocárdico y el CNP, liberado por el endotelio, causan vasodilatación por relajación del músculo liso. La acción diurética de los PNs se debe a acciones hemodinámicas sobre el riñón o directamente en los túbulos [25]. Dentro de las primeras la más importante es la de aumentar la filtración glomerular (FGL) como resultado de vasodilatación de la arteria aferente y vasoconstricción de la arteria eferente. También provoca acumulación de GMPc en las células mesangiales causando relajación de las mismas y aumentando la superficie de filtración. Como acción directa tubular pueden inducir la producción de urodilatina, o responder a PNs de la circulación general. CNP BNP ANP NPR-A ANP>BNP>CNP NPR-B NPR-C NO membrana KINASAS CLEARANCE Gs Gs GTP GUANILIL CICLASAS AMPc GMPc FDE NATRIURESIS VASODILATACIÓN INHIBICIÓN DE RENINA INHIBE CRECIMIENTO INHIBE ENDOTELINA Figura 1. Receptores de PNs: NPRA, NPRB y NPRC (clearance). NO aporta para formación de guanilciclasas e intervención en vasodilatación. Accciones del GMPc, contrarrestadas por fosfodiesterasa La natriuresis responde a diversos mecanismos : 1) aumento de Na+ en el túbulo colector (TC) de la médula interna a través de una disminución de la hipertonicidad medular interna que reduce el flujo líquido hacia el asa de Henle; 2) efecto inhibitorio de la captación de Na+ al inhibir su canal sensible a la amilorida; y 3) estimulación de la secreción sensible a la furosemida de Na+ y Cl- en el TC. Además el ANP inhibe la inducción por Ang II del transporte de Na+ y H2O en el túbulo proximal, el transporte tubular de H2O por antagonismo de vasopresina en el TC, y las acciones tubulares distales de aldosterona. También provoca aumento del aporte de Na+ a la mácula densa inhibiendo asi la secreción de renina y producción de Ang II. A diferencia de los otros PNs, el CNP tiene escasa o nula acción diurética[25]. Logran sus efectos biológicos a través del GMPc luego de activar 2 receptores de PN (NPR) biológicamente activos, del tipo guanilato 92 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , ciclasa (unido a la membrana) denominados GC-A y GC-B o NPR-A (o NPR-1) y NPR-B (o NPR-2)[ Un tercer receptor es el NPR-3, que se desempeña como un receptor de “clearance” (depuración), por lo que es denominado NPR-C. El GMPc es sintetizado a partir del GTP por las guanilciclasas (GC), enzimas de las cuales se conocen hasta el presente desde la A hasta la G (GC-A hasta GC-G). La guanilato ciclasa soluble es parcialmente homóloga a esas enzimas, y es el receptor del NO. Las GCs de la membrana tienen una tipología característica que consiste en un dominio extracelular, una región transmembrana y un dominio intracelular que contiene la región catalítica en su terminal carboxilo; NPR-A y NPR-B tienen el dominio catalítico de guanilciclasa, mientras que el NPR-c carece del mismo (funciona para depuración = “clearance” de los PNs). Estas enzimas funcionarían como receptores para ligandos específicos.. La primera de las GC que fue aislada presenta receptores para la familia de los PNs: GC-A para el ANP y el BNP y GC-B para el CNP. El BNP parece no tener un receptor Doi y col.[27] han demostrado que el ANP y el específico, y usa el GC-A (NPR-A) para sus BNP tienen alta afinidad por el GC-A, mientras acciones y al NPR-c para su depuración. que el CNP se liga selectivamente al GC-B. En Es secretado hacia la circulación en forma el acápite “Otros natriuréticos” hemos pulsátil a través de los senos coronarios mencionado a la pendrina, una guanilciclasa[8]. en respuesta al estrés por sobrecarga de En la insuficiencia cardiaca (IC) hay la pared ventricular, y es metabolizado aumento de la densidad de los receptores de por la endopeptidasa neutra (~30%) y por depuración o clearance (NPR-c) concordante endocitosis mediada por receptor (~70%, con su reducción de actividad biológica. Hay sobre todo en el riñón). Tiene una vida receptores de ese tipo en las plaquetas, los media de 22 minutos[28]. cuales estarían regulados hacia arriba en la IC. Pese a la elevación de los PN en la IC su acción biológica está severamente deprimida en modelos experimentales y humanos, lo que podría explicarse por aumento de actividad del Sistema Renina Angiotensina (SRA) y del Sistema Nervioso Simpático (SNS), o por regulación hacia abajo de los receptores de los PN[29,30]. En la IC avanzada los receptores de los PNs están regulados hacia abajo. El receptor NPR-c contribuye a la depuración metabólica del ANP y del BNP y no estimula generación de GMPc. Los PNs se ligan a esos receptores quienes luego se internalizan, siendo destruidos los péptidos por lisosomas; luego el receptor es reciclado y enviado hacia la superficie. Este receptor de depuración está presente en varias células: CE, CMLV, células glomerulares y parénquima pulmonar. Otras acciones de los PNs Además de sus acciones diuréticas y vasodilatadoras el ANP modula el SNS sensibilizando las terminaciones nerviosas de los eferentes de los barorreceptores arteriales y cardíacos, inhibiendo la transmisión simpática ganglionar y por acción sobre el SNC[30].. Hay un relativo efecto inhibitorio en el tráfico simpático a los músculos esqueléticos (pantorrillas). También ejerce efectos inhibitorios indirectos sobre el SNS al disminuir la activación de los BR cardiopulmonares mediante el descenso de las presiones de llenado ventricular[31,32]. Thomas y col.[33] han demostrado experimentalmente en ovejas conscientes que el ANP, el BNP y el CNP aumentan la respuesta bradicardizante a la activación de los receptores cardiopulmonares. Los mismos autores también han demostrado en ratas y en ovejas conscientes que el ANP aumenta la bradicardia del reflejo von Bezold-Jarisch (activado por serotonina endovenosa). Es muy importante la intervención de los PNs en el mantenimiento de la estabilidad circulatoria, actuando como factores antihipertensivos y reductores del volumen líquido. Asi se ve en la IC un significativo aumento de ANP y de BNP en los ventrículos cardíacos. Los PNs provocan disminución del retorno venoso, y de allí disminución del VM. Inhiben la acción vasoconstrictora del SRA, del SNS y de la ET.1 y en el SNC modulan el tono vasomotor, la sed y 93 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , la liberación de vasopresina. Pareciera que el ANP, en este caso, actúa no solamente como sustancia endocrina sino también localmente, a través del GC-A, disminuyendo la hipertrofia miocítica y la fibrosis de la matriz extracelular. En el estudio de Kishimoto Los PNs participan en la regulación del tamaño Rossi, y Garbers[34] en ratones en los miocárdico, al inhibir la hipertrofia y la fibrosis. cuales se había producido expresión en En ratones hipertensos carentes de GC-A se exceso del gen de GC-A, los niveles desarrolla una marcada hipertrofia [30,37-40] ventriculares de ANP se presentaron cardiaca . En la sobrecarga de volumen significativamente disminuidos, hay un significativo aumento de la expresión de [39,40] coincidiendo con una disminución del ANP y sobre todo BNP en los ventrículos . área hipertrofiada; esto implica que el ANP es un excelente marcador de hipertrofia miocítica. Se ha planteado la hipótesis de que el camino de señalamiento a través de GC-A constituya un componente importante en la regulación del tamaño miocítico, independientemente de la presión arterial (PA), y que probablemente proteja contra la hipertrofia miocítica. La densidad de los receptores de PN en los miocitos es mayor en los pulmones, riñones y suprarrenales que la existente en el corazón, planteando dudas sobre la significación fisiológica del NPRA en los miocitos, aunque se ha visto que la supresión experimental del NPRA lleva a alteración de la relajación y respuesta exagerada a la sobrecarga de presión, de lo cual puede inferirse que NPRA del miocito interviene en la modulación estructural cardiaca y en su función, en forma independiente de la carga[36]. En un estudio de Tamura y col.[37] se establece Los PNs y el GMPc tienen propiedades que el BNP es un factor antifibrótico derivado de que contrarrestan la hipertrofia los miocitos cardíacos in vivo y se aportan miocítica y la fibrosis de la matriz evidencias de su papel como regulador local del extracelular, y que además favorecen remodelado ventricular. la relajación ventricular. El BNP antagoniza la estimulación de SERCA2a producida por aumento de precarga, a través de un mecanismo via kinasa de GMPc y guanilciclasa-A. Este mecanismo puede afectar negativamente la contractilidad en pacientes con IC[38]. Experimentalmente la supresión experimental del ANP o de su receptor GC-A lleva a hipertensión arterial (HTA) crónica severa, mientras que la expresión en exceso de uno o ambos de los dos produce una caída de PA. La principal acción hipotensora del ANP incluye la vasodilatación; mayor permeabilidad vascular; inhibición del SRA por acciones directas sobre las células yuxtaglomerulares; inhibición del tono simpático y estimulación de la función renal. Se debe tener en cuenta la posible existencia de variaciones genéticas de los PNs, algunas de ellas asociadas a determinadas enfermedades o alteraciones funcionales- Los PNs en la insuficiencia cardiaca Los PNs tienen un importante papel como indicadores diagnósticos y pronósticos. Han sido propuestos como método de diagnóstico de IC en el paciente añoso[39,40], y aportan información muy útil para la prevención, detección precoz y tratamiento. Smith y col. [41] , en un estudio en 155 pacientes entre 70 y 84 años de edad, encontraron que la determinación de los niveles plasmáticos del BNP es útil en la pesquisa de disfunción ventricular izquierda en la comunidad añosa, aunque sin ser tan buena prueba como para establecer con firmeza el diagnóstico (es preferible la ecocardiografía). La medición de la concentración plasmática de BNP parece una prueba sensible y específica para identificar IC en los servicios de emergencia. Se diría que las pruebas iniciales en pacientes que consultan por experimentar disnea serían la determinación 94 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , de niveles de BNP y la radiografía de tórax, como trataría de comprobar el estudio BNP (“Breathing Not Proper”). El Breathing Not Properly Multinacional Study[42,43] ha sido un estudio de 7 centros de EEUU, Francia y Noruega cuyo objetivo fue valorar las determinaciones de niveles plasmáticos de BNP para el diagnóstico de IC, en pacientes que se presentaren con disnea a los servicios de emergencias. Se incorporaron 1.586 pacientes (64±17 años de edad, 56% varones, y el 40% con historia de EPOC), que no habían padecido IM, y que no tenían insuficiencia renal ni algún traumatismo que hubiera causado disnea. Los médicos participantes ignoraban los resultados del test de BNP. Los resultados mostraron que los niveles medios de BNP fueron mayores en aquellos a los que se les diagnosticó IC (~ 600 pgm/ml), que de los que padecían disfunción ventricular pero no IC (~ 200 pgm/ml), mientras que los que tenían disnea no vinculada a IC mostraron valores de ~ 40 pgm/ml. El estudio PRIDE (N-Terminal Pro-BNP Investigation of Dyspnea in the Emergency Department Study)[44] comparó la eficacia diagnóstica de únicamente los datos clínicos, versus los obtenibles con la medición de pro-BNP t-a, y comprobó la superioridad del pro-BNP t-a sobre el estudio clínico aislado, mientras que el criterio clínico sumado a la determinación de pro-BNP t-a fue superior a las dos actitudes diagnósticas , con lo cual se comprueba la importancia del agregado de la determinación de pro-BNP t-a, para el diagnóstico diferencial de IC en la Guardia. También lo es para el monitoreo de la eficacia del tratamiento de la IC. Diversos estudios sobre eficacia del tratamiento de la IC en el largo plazo han mostrado cambios de BNP y pro-BNP que no están más allá de las variaciones atribuibles a cambios biológicos. Puede cuestionarse el pretendido éxito terapéutico cuando aparecen beneficios clínicos sin disminuciones significativas de los niveles de BNP/pro-BNP[45]. La concentración plasmática del BNP varía en la misma persona sin que se hayan producido cambios en el estado de la IC[46,47]. La variación puede alcanzar a triplicar en más o disminuir hasta cerca de un tercio los valores originales de BNP. Comparando entre si a los PNs y su valor en IC, las investigaciones indican que la elevación de niveles plasmáticos de BNP es más específica como marcador de disfunción ventricular [48-52] izquierda , por su origen ventricular, mientras que el ANP se produce en la aurícula. En la [51] IC experimental sin provocación de IAM hay liberación inmediata de ANP pero no de BNP , apareciendo este último tardíamente luego de prolongada sobrecarga. Una constante en IC crónica es la elevación de ANP y de BNP. [53] Maeda y col. encontraron altos niveles de ANP en la IC, asi como de N-A y ET-1, premonitores de progresión de la IC. Para esos autores el incremento de BNP sería mejor indicador (comparado con ANP) de alta presión de fin de diástole en pacientes con DVI sintomática. Se ha demostrado alteración de la liberación de ANP en humanos con miocardiopatía dilatada e IC leve, indicando que en algunos casos puede existir un déficit en la producción de PN[54]. Además puede ser que exista una disminución de la respuesta orgánica natriurética a los PN endógenos y exógenos[55]. En un estudio de Kinugawa y col.[56], en 84 pacientes con IC, se encontró en el análisis univariado que la edad (P < 0.001), la relación cardiotorácica (P < 0.001), el nivel plasmático de N-A (P < 0.0001), de ANP (P < 0.001), de BNP (P < 0.01), se correlacionaron significativamente con el VO2 pico. El análisis de regresión indicó que la N-A y el ANP son determinantes significativos del VO2 (R=0,61; P<0,0001). La noradrenalina (N-A) y el ANP fueron premonitores independientes de la capacidad para ejercicio. Stevens[57] ha demostrado que la transición de disfunción ventricular izquierda asintomática experimental a IC manifiesta se acelera cuando se emplea un inhibidor de los PNs: asi especula que estrategias de tratamiento basadas en la potenciación de las acciones biológicas de los PNs pueden retardar la progresión de la IC. El BNP y el equivalente inactivo proBNP-ta son rápidamente liberados por los miocitos después de su estiramiento y por ello son importantes marcadores de la IC aguda y crónica. Hay una significativa relación inversa entre función renal y niveles elevados de esos péptidos. A 95 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , menor función renal mayor cantidad de péptidos. La concentración de estos péptidos en pacientes con insuficiencia renal corre a la par con la severidad de IC y ofrece información pronóstica. En el ICON (Internacional Collaborative on NT-proBNP) se han estudiado 1.256 pacientes de los cuales 720 (57%) presentaron IC aguda en su presentación, y mostraron una concentración promedio de 4.647 pgm/ml. La creatinina promedio fue 1,3±0,68 mg/dl con una correspondiente filtración glomerular (FGl) media de 60,5±26,0 ml/min/1,73 m². Cuando la FGl fue < 60 ml/min/1,73 m² la concentración media de proBNP-ta fue mas alta que cuando la FGl fue > 60 ml/min/1,73 m² (7.214 pgm/ml vs 3.054 pgm/ml, P<0,001). La conclusión es que la determinación conjunta de FGl y proBNP-ta permite identificar pacientes con IC con más alto riesgo de mortalidad a corto plazo. El aumento de la creatininemia en pacientes con IC indica alto riesgo de mayor mortalidad, riesgo que se hace evidente solamente en aquellos con aumento concomitante de proBNP-ta. Los pacientes con aumento de la creatinina desde el ingreso pero sin elevación evidente del proBNP t-a tendrán una mortalidad a 60 días relativamente baja, similar a la aquellos con bajo nivel de proBNP t-a; pero cuando hay altos valores de proBNP t-a en la admisión, un FGl <60 ml/min/1,73 m² sugiere un mal pronóstico en ese momento, sin tener que recurrir a mediciones seriadas de la creatininemia[58]. Los pacientes con IC tienen altos niveles de ANP originado principalmente en las aurículas y del BNP, de los ventrículos. Estos niveles aumentados se correlacionan con la presión de wedge (PW) y con la fracción de eyección (Fey). Se han estudiado los efectos relajantes vasculares coronarios del ANP, BNP y otros vasodilatadores durante IC severa experimental en el perro, inducida por marcapaseo de alta frecuencia[59]. En los perros con IC se elevaron los niveles de los péptidos pero se suprimieron los efectos relajantes vasculares (comparados con controles, o sea perros sin IC); asi se sugiere la existencia de una regulación hacia abajo de los receptores de los PN. También se ha visto que la liberación de PN en respuesta a expansión de volumen está alterada cuando se ha activado el SRA. En un estudio en ratas se produjo sobrecarga de volumen mediante una fístula aorto-cava, observándose atenuación de liberación de PN, que se normalizó cuando se administraron inhibidores de la ECA (IECAs) o bloqueadores del receptor AT.1 (BRAs). Esa interacción entre los dos sistemas indicaría un mecanismo adicional de beneficio de los IECAs o de los BRAs en la IC[60]. En un estudio realizado en 22.071 médicos (hombres) desde 1982 a 1999[61] , se encontró una vinculación genética de accidente cerebro vascular (ACV) con PNs. El ADN en aquellos con ACV muestra una variante molecular en el exon 1 del gen del ANP, que se asocia con un aumento de 2 veces del riesgo de ACV, y constituye un factor de riesgo independiente. En los ACV no aparecen modificaciones genéticas del BNP. El exon 1 codifica los primeros 16 aminoácidos del ANP de larga acción. A través de estudios en ratones transgénicos se conoce que la expresión disminuida de genes de PNs se asocia con altos niveles de PA e hipertrofia ventricular izquierda, mientras que cuando hay expresión en exceso se presenta hipotensión arterial[62,63]. El BNP se encuentra elevado después de hemorragia subaracnoidea provocando diuresis y natriuresis (agotamiento de sal cerebral) y puede exacerbar déficits neurológicos tardíos[64]. . La Food and Drugs Administration de USA (FDA) ha aceptado el uso para diagnóstico de IC de la prueba “Triage BNP Test”. También las guías para el diagnóstico de IC de la Sociedad Europea de Cardiología han reconocido el valor potencial del uso del BNP (BNP) para el diagnóstico y manejo de la IC. Las Guías de la American Heart Association y del American College of Cardiology de EEUU consideran que el uso de los PN para el diagnóstico de IC aún necesita ser aclarado. Sin embargo, Redfield – en una reciente Editorial propone que esas Guías conjuntas respalden el uso de los BNP para el diagnóstico de la IC[65] .Otro uso del BNP, es el de la estratificación de riesgos en la IC[66]. En un estudio de una población de pacientes con disnea, los hipertensos tuvieron mayores niveles de proBNP t-N que los normotensos. La diferencia desapareció cuando fueron excluidos del análisis los con disfunción diastólica. Esto sugiere que la HTA puede ser un factor confundidor que potencialmente disminuye la especificidad del proBNP t-N para el diagnóstico de IC[67]. 96 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , Para Brandt[55] el proANP t-a (que es un fragmento sin actividad biológica más fácilmente dosable por su lenta depuración plasmática y por ser más estable) tiene buena especificidad y sensibilidad para el diagnóstico de pacientes con disfunción ventricular izquierda asintomática (DVIA). Está consistentemente aumentado en pacientes en clase I de la NYHA. Hall y col.[68] señalan que el proANP t-a es un poderoso indicador pronóstico independiente en pacientes con DVIA luego de IM (246 pacientes del estudio SAVE). En el estudio de Steg y col.[69] se comparó la eficacia de la determinación de BNP con la ecocardiografía en el diagnóstico de IC en la Sala de Emergencias. Se estudiaron 1.586 pacientes con disnea aguda, yendo 709 de ellos a ecocardiografía para determinación de Fey.: 492 pacientes, o sea el 69,4% tuvieron un diagnóstico final de IC. Los pacientes con el diagnóstico ecocardiográfico de IC mostraron valores más altos de BNP (693 pgm/ml) que los considerados sin IC (129 pgm/ml), siendo el valor de p<0,0001. La sensibilidad de BNP (≥100 pgm/ml) para el diagnóstico de IC fue del 89% y la especificidad del 73%, mientras que los valores de Fey. ≤ 50% mostraron sensibilidad del 70% y especificidad del 77%. La proporción de pacientes correctamente diagnosticados fue del 67% considerando solamente el BNP, 55% con solo la Fey., 82% sumando ambos, y 97% cuando se añadieron datos clínicos, electrocardiográficos y radiológicos. La conclusión fue que la determinación de BNP es superior al ecocardiograma, pero que ambos métodos tienen un importante valor cuando se los combina. Hay importantes diferencias entre las determinaciones de BNP y de proBNO t-a[70]: 1) BNP es menos influenciable por la edad y la función renal; y 2) tiene un solo punto de corte para el diagnóstico de IC; 3) el BNP tiene una vida media de ~22 minutos y puede entonces reflejar cambios en la presión capilar pulmonar cada dos horas, mientras que la vida media del proBNP t-a es 120 minutos, siendo capaz de monitorizar solamente cambios hemodinámicos que sucedan cada 12 horas. Hay una relación inversa entre Indice de Masa Corporal (IMC) y concentración de BNP en sujetos con y sin IC, habiéndose propuesto como explicación la presencia de un aumento de la expresión del receptor depurador de PN (NPR-c) por el tejido adiposo. En el estudio Dallas[71] se trató de demostrar si la concentración de proBNP t-a, que se estima no es depurado por el NPRc , se correlaciona con obesidad, y además si Cuadro 5-1. Causas potenciales de BNP se relaciona inversamente con masa [10] niveles aumentados de BNP .. aumentada por obesidad pero no con masa magra. No pudo demostrarse que los bajos Cardiacas niveles de BNP de la obesidad se deban a Insuficiencia cardiaca Disfunción diastólica aumento de su depuración, mediada por el NPR Síndromes coronarios agudos c. En el Cuadro 5-1 se detallan causas potenciales HTA e HVI de aumentos de BNP, según Felker y col.[9]. Valvulopatías (Estenosis Aórtica, Debe recordarse sin embargo que niveles de insuficiencia mitral) PN más altos que los normales son encontrados Fibrilación auricular frecuentemente en pacientes añosos sin IC No cardiacas manifiesta[72]; esto se explica por ciertos grados Embolia de pulmón de disfunción renal y disfunción sistólica, HVI y Hipertensión pulmonar Sepsis función diastólica alterada sin evidencias de IC. EPOC con Cor pulmonale o Los obesos tiene bajos niveles circulantes de insuficiencia respiratoria PNs[73,74], lo cual puede contribuir a su predisposición a HTA, y esto debe ser tenido en cuenta cuando se usan los mismos para detección de IC. Más aún si esta disminución de niveles de PN es más acentuada en obesos con IC. Se han intentado distintas explicaciones: sobrecarga hemodinámica; lipoapoptosis, alteración de la oxidación de ácidos grasos, o daño vascular difuso. En la obesidad hay disminución de la lipólisis. La lipólisis está modulada por las catecolaminas que la estimulan y por la insulina que la inhibe. Los PNs tienen similar potencia estimulante de la lipólisis que las catecolaminas y los adipocitos expresan el NPR-c (clearance), con lo cual puede 97 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , presentarse un estado de reducida concentración de PNs, con consiguiente retención de sodio y aumento de volumen, eventos caractrerísticos de la HTA de los obesos[73,74]. El nivel plasmático de BNP da importante información pronóstica que es independiente de las determinaciones hemodinámicas - tales como presión de wedge y Fey - para predecir mortalidad. La presencia de niveles elevados de BNP en la fase precoz o subaguda de IAM es un [75,76] fuerte indicador de pobre pronóstico . El BNP tiene mayor potencial para ser usado en estratificación de riesgos, aunque el ANP parece ser mejor indicador de disfunción ventricular. En la evolución de un IAM, la concentración de BNP puede ser un marcador útil de remodelado con mala adaptación[77]. En un estudio de Nilsson y col.[78], que siguieron durante un año a pacientes que habían sufrido su primer IAM transmural, observaron por medio de Resonancia Magnética Nuclear que aproximadamente el 30% de los infartados mostró incrementos paulatinos del índice de volumen de fin de diástole (IVFD) y del índice de volumen de fin de sístole (IVFS), sin que se presentasen cambios en la Fey.. Concluyeron diciendo que los pacientes que desarrollarán dilatación pueden ser identificados precozmente después del IAM cuando presentan niveles elevados de proBNP t-a (nivel basal proBNP t-a >115 pmol/lt). En pacientes con enfermedad coronaria estable se encuentran niveles elevados de BNP asociados con isquemia de miocardio inducible, sobre todo en aquellos con antecedentes de infarto de miocardio : asi se explica por que las pruebas de BNP no son específicas de disfunción ventricular izquierda en pacientes coronarios[79]. En un modelo de IC en el cerdo, provocada por marcapaseo a alta frecuencia, se evaluaron ANP, BNP y proANP t-a en relación a las presiones auriculares existentes monitoreadas en forma continua por telemetría[80]. El BNP mostró el mayor incremento relativo. Los análisis multivariados evaluando cambios de los PNs y las presiones auriculares mostraron que la presión auricular izquierda (PAI) tuvo la más fuerte correlación con el BNP. Los PNs se corrrelacionaron con la presiones auriculares siendo el BNP el marcador mas sensible de las presiones de llenado comparado con ANP y proANP t-a. El pro-BNP t-a, asi como la cardiotrofina, aumentan en la estenosis aórtica en forma proporcional al gradiente de presión transvalvular, pudiendo la determinación de ambas ser usada como indicador no invasivo de progresión[80,81]. [82] En el estudio SAVE , en pacientes que sufrieron un IAM y continuaron luego con disfunción ventricular asintomática con Fey. <= 40%, se vió que la determinación de ANP, de aldosterona y de N-A permite conocer la posibilidad de eventos cardíacos futuros. De las tres hormonas el ANP pareció ser el mas importante como indicador pronóstico. Cowie y col. [83] han señalado que en pacientes con síntomas que hacen sospechar IC, el aumento de BNP plasmático se presenta como un marcador útil de la presencia de la enfermedad. Al respecto Bettencourt y col.[84] opinan que los niveles de BNP son seguros para el diagnóstico de IC, pero sobretodo para el caso de disfunción diastólica primaria. Fruhwald y col.[85,86] encuentran correlación entre niveles elevados de PNs y parámetros por Doppler de trastornos de llenado ventricular en pacientes con miocardiopatía dilatada y disfunción diastólica. Señalan que el aumento de proANP t-a y de BNP indica mal pronóstico, y que hay una significativa diferencia entre niveles de PNs y parámetros Doppler de disfunción diastólica según ésta sea leve o severa. El proANP t-a se correlacionó con el diámetro auricular izquierdo, la Fey., y la relación E/A por Doppler del flujo transmitral. Con respecto al valor de los PNs para el pronóstico, Tsutamoto y col.[87] midieron los niveles plasmáticos de ANP, BNP, N-A, Ang II y ET-1 y monitorearon parámetros hemodinámicos en 290 pacientes con Disfunción Ventricular Izquierda Asintomática (DVIA) o mínimamente sintomática (Fey = 37%), haciendo un seguimiento de 812 días. Evaluaron la asociación de variables con mortalidad y morbilidad. 24 pacientes fallecieron y 25 fueron hospitalizados por agravación de su IC. Dentro de 21 variables tales como carácterísticas clínicas, tipos de tratamiento, alteraciones hemodinámicas y presencia de factores neurohumorales, los altos niveles de BNP 98 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , (p<0,0001), N-A (p=0,042), índice de VFD (p=0,0035), y PFD (p=0,033) mostraron ser predictores independientes de mortalidad y morbilidad. Entre todas las determinaciones únicamente el alto nivel de BNP se mostró como premonitor independiente de mortalidad en esos pacientes (p<0,0001). Los resultados indican que la presencia de altos niveles de BNP aporta información importante sobre mortalidad y morbilidad en pacientes con DVI asintomática o mínimamente sintomática. Ver Figura 5-1 En un estudio comunitario de Landray y col.[88], diseñado para investigar la efectividad de la determinación de BNP para diagnosticar DVI sistólica, se encontró que la concentración de BNP >17,9 pg/ml tuvo una sensibilidad del 88% y una especificidad del 34%; una concentración de 10 pg/ml tuvo una sensibilidad del 92% pero una especificidad de sólo el 18%; mientras que un valor de 76 pg/ml tuvo una sensibilidad del 66% y una especifidad del 87%. Los autores concluyeron diciendo que parece haber una pequeña ventaja diagnóstica con medir BNP agregado a investigaciones de rutina (ECG y radiografía de tórax) aunque 1 de cada 7 pacientes tuvo un diagnóstico negativo falso. En IC aguda un alto nivel de BNP pronostica mortalidad elevada al año, mostrando así su utilidad para la estratificación de riesgos[89]. En 466 pacientes referidos al Laboratorio de Ecocardiografía de la Mayo Clinic[90] para evaluación de su función sistólica, se valoró la determinación de BNP como forma de estratificación de riesgo. Se excluyeron a los pacientes con disfunción ventricular izquierda previa documentada, a los portadores de prótesis valvular o con valvulopatías, a los con cardiopatías congénitas, con miocardiopatías, con insuficiencia renal (creatinina >2,5 mg/dl), o a los enviados para evaluación por presentar soplo cardiaco siendo asintomáticos. Se definió como anormal un nivel de BNP >37 pg/ml (media + 2 derivaciones estándar en normales). Con pacientes con Fey. >35% pero <45% la sensibilidad de la determinación de BNP fue 79%, la especificidad 64%, el Valor Predictivo Positivo (VPP) 21% y el Valor Predictivo Negativo (VPN) 96%. Cuando la Fey. fue menor de 35%, la sensibilidad (determinación de BNP) fue 90%, la especificidad 61%, el VPP 9,8% y el VPN 99,3%. Estos resultados indican que la determinación de BNP puede ser útil para la detección o exclusión de disfunción sistólica en pacientes en riesgo, permitiendo una pesquisa más amplia y reduciendo la necesidad de otros métodos diagnósticos. Un problema es la falta de especificidad y el muy modesto VPP. Selvais y col.[91] estudiaron el valor pronóstico del ET-1, proANP t-a y BNP para mortalidad cardíaca a largo plazo en pacientes con tratamiento completo por IC. Se midieron las concentraciones plasmáticas de los péptidos en 109 pacientes con Fey <35%, de clase funcional II (n° 65) o III a IV (n° 44), de la NYHA. Seguimiento a 3 años. El resultado fue que las elevaciones de las concentraciones de ET-1 y de BNP identificaron mejor que distintos marcadores clínicos a un grupo de alto riesgo, probablemente candidatos a trasplante o a nuevos intentos terapéuticos. En pacientes con IC y Fey normal (ICFEN), Andersson y Hall[92] evaluaron el valor pronóstico del proANP t-a. De 149 pacientes estudiados, 84 presentaban ICFEN, con Fey. ≥40%. Los pacientes fueron seguidos durante 7 años. La conclusión del estudio fue que el proANP t-a elevado es un marcador pronóstico independiente de mayor mortalidad y morbilidad en pacientes con ICFEN. En la disfunción diastólica aislada se han encontrado niveles aumentados de BNP[93-95]. Ver Figura 5-2 En un estudio de Troughton y col.[96] se determinaron los niveles de BNP en 106 pacientes sintomáticos con disfunción cardiaca sistólica, y se estudiaron por ecocardiografía modo M-color (CMM) e imagen de Doppler Tisular (TDI), las funciones diastólicas y sistólicas ventriculares izquierda y derecha. Se encontró que los niveles plasmáticos de BNP están significativamente relacionados a nuevos índices aportados por las técnicas CMM y TDI, incluyendo los de relajación por medio de estudio de velocidad del anillo mitral, y determinaciones de distensibilidad ventricular y presiones de llenado. Además los niveles de BNP se correlacionaron positivamente con la gravedad de la disfunción ventricular derecha y de la insuficiencia mitral. Cuando los 99 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , pg/ml niveles de BNP estuvieron dentro de límites normales hubo menor alteración de las funciones sistólica y diastólica, mostrando solo grados leves de insuficiencia ventricular derecha y de insuficiencia mitral. En el estudio Rapid Emergency Department Heart Failure Outpatient Trial (REDHOT)[97] se observaron las relaciones entre el BNP con el diagnóstico y pronóstico de IC y toma de decisiones en 464 pacientes que se presentaron con dificultades respiratorias en los Departamentos de Emergencias de los centros participantes, y que admitieron se les determine BNP en la admisión. Uno de los criterios de inclusión en el estudio estipulaba que el nivel de BNP fuese >100 pgm/ml. De los 464 pacientes el 90% fue PNMC en normales y en disfunción diastólica internado. Los dos tercios de los pacientes internados fueron considerados 300 pg/ml Normal como de clase III ó IV 250 (NYHA). El nivel DD 200 elevado de BNP fue 150 un premonitor 100 potente de la evolución a 90 días. 50 De los pacientes 0 DD internados el 11% Normal tuvo niveles de BNP Lubien E, De María A, et al. Circulation 2002;105:595 <200 pgm/ml (66% Figura 2. BNP (en la figura PNMC) en disfunción diastólica de estos estaban en clase funcional IIIIV). La tasa de eventos combinados (episodios de IC con consulta - internación o muerte) a 90 días en el grupo primitivamente admitido con BNP <200 pgm/ml fue de 9%, mientras que los que habían presentado BNP>200 pgm/ml fue del 29% (p=0,006). La conclusión del 500 REDHOT fue que en 290 pacientes, seguidos 450 PNA pacientes que se 400 PNMC durante 812 días: presentan en las 350 PNMC p<0,0001 guardias con 300 250 aparente IC, hay una N-A p=0,042 200 discordancia entre la 150 IxVFD p=0,0035 gravedad de la IC 100 PFD p=0,033 50 percibida por los 0 médicos actuantes y NYHA II NYHA III NYHA IV la determinada por los niveles de BNP. Tsutamoto T, 1997 Los niveles de BNP Figura 3. BNP (PNMC) y ANP (PNA) en IC, según clase funcional. (Tsutamoto). pueden predecir la evolución y de esta forma pueden ayudar a la toma de decisiones tales como la de internar a los pacientes, o indicar tratamiento ambulatorio o domiciliario. En el preoperatorio de cirugía cardiaca se ha encontrado que la determinación de BNP es útil para predecir complicaciones posoperatorias y evolución. En estos casos el punto de corte es 100 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , mucho más alto, y se observa evolución más tórpida cuando supera los 385 pg/ml, siendo mas alta la mortalidad a un año en aquellos que superan ese nivel[98]. La activación neurohormonal y el comportamiento ante ejercicio han sido usados como indicadores pronósticos en IC. Isnard y col.[99] estudiaron 264 pacientes con IC por disfunción sistólica. Midieron ANP, N-A y ET-1 en reposo y luego fueron a ejercicio máximo limitado por síntomas con determinación de consumo de oxígeno (VO2). En un análisis univariado la clase funcional (NYHA), la presión arterial sistólica en reposo, el diámetro de fin de diástole, la Fey., el VO2pico , el % del VO2pico predecido, el ANP plasmático, la N-A plasmática y el ET-1 se asociaron con sobrevida sin trasplante cardiaco urgente. En un análisis de regresión escalonado multivariado solamente el ANP plasmático (p=0,0001), la Fey. (p=0,007), y la N-A plasmática (p=0,035) fueron predictores de muerte o de trasplante urgente, y no así el VO2.. La función renal alterada es más fuerte predictor de mortalidad que la Fey. y la clase funcional, y se asocia con niveles aumentados de proANP t-a[100]. La expresión de genes de ANP y de BNP en el VI está regulada en forma diferente en corazones con sobrecarga de presión. La expresión de ANP se ve incrementada cuando se desarrolla hipertrofia ventricular, mientras que para que se produzca el aumento de expresión del BNP es necesaria la transición de HVI a IC[101]. Se ha visto en casos de miocardiopatía hipertrófica que el espesor de la pared del ventrículo izquierdo es un fuerte premonitor independiente de los niveles de BNP, por lo cual se relativiza la importancia del péptido para el diagnóstico precoz o diferencial de IC[102] La fibrilación auricular[103,104] es una determinante de aumento de niveles de proANP t-a, y hace confundir la visualización de la relación con la disfunción ventricular que tienen los PNs. Es además una arritmia de frecuente observación en los ancianos, quienes como hemos dicho muestran gran prevalencia de IC. No se conoce a ciencia cierta el papel del CNP en la fisiopatología de la IC. Wright y col.[105] estudiaron 305 pacientes con disnea de reciente comienzo y/o edemas periféricos que se presentaron en consultorios primarios, por medio de determinación de proCNP t-a y otras hormonas plasmáticas vasoactivas y de ecocardiografía. Se diagnosticó IC en el 25,2 %. EL CNP t-N estuvo elevado en pacientes con IC, relacionándose con la edad, la función renal y la fracción de acortamiento en el ecocardiograma. El hallazgo de aumento del CNP t-a en la IC indicaría la presencia de una respuesta compensadora endotelial de la vasculatura periférica. Para Logeart y col.[106] la presencia de altos niveles de BNP (punto de corte 350 pg/l) en el alta luego de internación por IC descompensada, es un marcador independiente de muerte o reinternación (a 6 meses), más relevante que otros indicadores clínicos o ecocardiográficos. En pacientes que han sufrido un infarto agudo de miocardio pero que permanecen asintomáticos, la determinación del BNP denota que sus niveles aumentan en proporción al tamaño de la necrosis, constituyendo un dato importante para predecir el desarrollo de IC[107]. Nishikimi y col.[108] han encontrado que los niveles de los PNs están aumentados en pacientes con enfermedad coronaria pero sin alteraciones en la función ventricular. Diversos investigadores señalan que los niveles plasmáticos de ANP, BNP y proANP t-a están elevados en la IC, en el IAM y en la HTA. De estos el mejor marcador de existencia de estenosis coronaria de alto grado es el proANP t-a. Se ha visto que el BNP plasmático está aumentado en casos de síndrome coronario agudo, quizás en relación con disfunción ventricular . En el estudio OPUS-TIMI 16 (Orbofiban in Patients with Unstable Coronary Syndromes-Thrombolysis in Myocardial Infarction 16 study)[109] los niveles plasmáticos de BNP se correlacionaron con el riesgo de muerte, a 30 días y 10 meses. El nivel de BNP se asoció con el riesgo de nuevo o recurrente infarto de miocardio, y aparición o empeoramiento de IC a 10 meses. O sea que la determinación bioquímica del BNP pocos dias después de la iniciación de los síntomas isquémicos aporta importante información con respecto al pronóstico de los mismos. En pacientes con insuficiencia aórtica y función ventricular izquierda normal, Eimer y col. han encontrado elevación de los niveles de BNP que expresarían presencia de remodelación[110] 101 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , La investigación de niveles de BNP (dentro de las 48 hs. de ingreso al servicio de emergencia) no distingue al edema de pulmón no cardiogénico del cardiogénico[111], y no se correlaciona con las determinaciones hemodinámicas y no se vincula con cambios en el estado del volumen circulante en mediciones diarias consecutivas. Los PN tienen además un importante papel en el mantenimiento del estado compensado de [112,113] la disfunción ventricular izquierda asintomática (DVIA) . Participan en la homeostasis cardíaca y renal durante la IC aguda a través de la liberación de ANP y en la precoz disfunción ventricular izquierda a través del reclutamiento de BNP ventricular, pero su papel en la fisiopatología general de la IC aún no está dilucidado. Los niveles plasmáticos de los PNs Los niveles plasmáticos de BNP aumentan con la edad, siendo la media 26,2±1,8 pg/ml para pacientes de 55-64 años; de 31,0±2,4 pg/ml para los de 65-74 años; y 63,7±6 pg/ml para los mayores de 75 años. Los niveles están aumentados en la insuficiencia renal y en todos los dializados. El BNP se correlaciona estrechamente con la clasificación funcional de la IC (NYHA), observándose los mayores niveles del péptido en las clases más severas (152±16 pg/ml para clase I, 590±31 pg/ml para clase III y 960±34 pg/ml para clase IV). Para Maisel[114] el punto de corte para sin IC/con IC podría ser 100 pgm/ml, que tiene una sensibilidad del 82,4% para todos los casos de IC y del 99% para IC clase IV (NYHA). La especificidad fue mayor del 95%. Pueden usarse dos límites, uno superior como el mencionado para mayor especificidad y valor pronóstico positivo y uno más bajo de 40-60 pg/ml para mayor sensibilidad y valor pronóstico negativo. Valores menores de 100 pg/l de BNP hacen improbable la existencia de IC, mientras que valores de proBNP-ta >450 pg/l para menores de 50 años de edad y de ≥900 pg/l para ≥50 años de edad, son sensibles y específicos para el diagnóstico de IC. Cuando el valor es <300 pg/l es altamente improbable la existencia de IC (valor predictivo negativo= 99%)[53]. Tienen valores altos los pacientes con IC derecha, sepsis,, stroke, e hipertrofia ventricular izquierda. En pacientes con edema de pulmón e insuficiencia mitral aguda, pueden no elevarse inicialmente los valores mencionados. En el estudio Framigham se señala que los niveles de PNs predicen una amplia variedad de eventos futuros cardiovasculares y que proveen información que se suma a la obtenida por factores de riesgo habituales establecidos[115]. Encuentran importante asociación entre niveles de PNs y riesgo de muerte por toda causa, ACV o ataques isquémicos transitorios, y eventos cardiovasculares mayores. Tang y col.[116] informan que más de 1 de 5 pacientes con IC crónica y síntomas vistos en Consultorio Externo de su Clínica de IC tienen BNP <100 pg/ml, niveles que son considerados normales en algunos estudios. En el estudio Breathing Not Properly se encontró que la media de BNP en pacientes con IC diastólica fue 413 pgm/ml en comparación a 34 pgm/ml de pacientes con disnea no causada por IC[43]. Los pacientes con IC sistólica tienden a valores mas elevados (821 pg/ml) aunque no establecen distinción con los de IC diastólica. Wang y col.[117] señalan que las mujeres tienen niveles de PNs marcadamente superiores a los de los hombres. Para Atisha y col.[118] el punto de corte con respecto a niveles de BNP para la detección de IC sería de 20 pgm/ml. Doust y col.[119], en un importante metanálisis de 20 estudios, empleó como unidad de medida picomoles por litro en vez de picogramos por mililitro , siendo que 1 pg/ml = 0,289 pmol/lt. y señaló que con un punto de corte de 15 pmol/lt la prueba es de alta sensibilidad diagnóstica, y que los pacientes con valores de BNP por debajo de esa cifra pueden ser excluídos del diagnóstico de IC. 102 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , ADRENOMEDULINA, ADRENOMEDULINA-2 (INTERMEDINA) Kitamura, Kangawa y col. identificaron en el año 1993 un nuevo péptido hipotensor aislado del AD, al que denominaron adrenomedulína (AM) [120]. La AM consta de 52 aa y fue aislada juntamente con otros péptidos tales como el CGRP (Calcitonin Gene Related Peptide) y el VIP (Vasoactive Intestinal Peptide), y se piensa que pertenece a la superfamilia del primero. El gen de la AM , está localizado en el cromosoma 11 y es expresado en numerosos tejidos, habiendo altas tasas de transcripción del gen y síntesis del péptido en células musculares lisas vasculares (CMLV) y endoteliales (CE)[121]. Contribuye a la homeostasis, y su acción vasodilatadora e hipotensora - probablemente mediada por el óxido nítrico (NO) y el AMPc - ha sido bien documentada. Está presente en el SNC y puede tener un papel en la modulación del apetito a la sal, la sed, y la [122,123]. El precursor de la AM es la preproadrenomedulina que consta de 185 aa. La proadrenomedulína contiene aparte de la AM otro péptido designado como PAMP (proAM nt Peptide). El PAMP inhibiría la transmisión neuronal en las terminaciones simpáticas periféricas mientras que la AdrM relajaría directamente al músculo liso vascular. El ANP aumenta la liberación de AdrM, por lo que la acción diurética e hipotensora del péptido podría deberse en [124] parte a ésta última sustancia . Cuando se la administra por vía intravenosa aumenta la tasa de flujo en aquellos órganos en donde el gen de la AM está altamente expresado, o sea que actúa como una hormona vasoactiva paracrina o autocrina. Es secretada por las CE y CML y los secretagogos son las citoquinas, tales - , IL- y también ET-1[125]. Los fibroblastos son un sitio importante de producción de AM. La AM aumenta el VM y la contractilidad de VI in vivo y tiene un efecto directo inotrópico in vitro. Su concentración plasmática está aumentada en la HTA, en la insuficiencia renal crónica y en la IC. En la IC inducida por marcapaseo (en perros) la AM es activada durante la progresión, y se establece correlación entre masa ventricular aumentada y concentración de AM. En el estudio de Romppanen y col.[126] se observó que el gen de AM es precozmente activado bien antes del desarrollo de HVI, imitando la rápida producción de proto-oncogenes en respuesta a estrés hemodinámico. La sobrecarga de presión estimula la producción del gen de AM en la aurícula izquierda, aún antes que en el ventrículo. La inducción de AM es independiente de la Ang II y del ET-1. [127-129] La concentración plasmática de AM está aumentada en pacientes. con IC , y se ha comprobado que está presente en el corazón humano, habiendo sido detectada en otros órganos como la suprarrenal, pulmones, riñón, órganos gastrointestinales y cerebro. En la IC se relaciona inversamente con la Fey. y directamente con la PFD[130,131]. Inhibe la liberación de ET1 y de Ang II, de aldosterona, de ACTH, y de catecolaminas por las suprarrenales; es vasodilatadora y diurético-natriurética. Actúa como factor autocrino o paracrino homeostático en la regulación de la función [130-136] [132] cardíaca . Según Szokodi y col. tiene efecto inotrópico positivo por liberación de Ca2+ [133] de los almacenes intracelulares, hecho ya señalado por Parkes . Szokodi también señala que la inhibición de la sintasa de NO (con L-NAME) permite observar el efecto inotrópico positivo en fase precoz, indicando que la AM puede activar el NO con el resultado de atenuación de la fase inicial de inotropismo positivo. Ihara[137] encuentra efecto inotrópico positivo de la AM en el músculo papilar de rata, observando que también aumenta significativamente el contenido intracelular de AMPc. El efecto inotrópico positivo se incrementa administrando un inhibidor de la fosfodiesterasa, indicando que el inotropismo positivo responde a la vía del AMPc. La AM actúa en el SNC y modifica el apetito de sal, la sed y la actividad simpática[123,138,139]. Inhibe la secreción de aldosterona en la suprarenal[140,141] y de ET-1[142] en las CMLV. A su vez la 103 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , estimulación de los receptores ETB aumenta la producción de AM por las CE aórticas en el perro[143]. Se han encontrado niveles aumentados de AM en la HTA, en la insuficiencia renal y en la IC, en relación con la gravedad de la enfermedad[144] actuando el péptido sobre los miocitos [145] cardíacos aumentando en ellos la síntesis de NO , con intervención del AMPc. La AM [144] plasmática se correlaciona con la presión de wedge . [146] [147,148] También ha sido encontrado en la estenosis mitral y en el IAM y en la miocardiopatía [149] hipertrófica . La AM vasodilata más a los vasos pulmonares que a los sistémicos, por lo cual se piensa que regula la circulación pulmonar. La forma activa de AM es depurada del plasma en el pulmón, y los pacientes con estenosis mitral tienen concentraciones venosas de AM significativamente más altas que normales, que servirían para atenuar los incrementos de resistencia arterial pulmonar en la hipertensión pulmonar secundaria de la estenosis mitral[150]. Es potente vasodilatador de las arterias pulmonares, y este efecto no es mediado por receptores del [151] CGRP . Se ha visto que la AM endovenosa tiene efectos hemodinámicos y hormonales beneficiosos en pacientes con hipertensión pulmonar precapilar[152]. Las CMLV tienen receptores de AM acoplados a la adenilciclasa y la vasodilatación que producen es dependiente de AMPc[137], aunque también puede existir una vía NO/GMPc. El ARN mensajero de la AM es altamente expresado en las suprarrenales, corazón, pulmón y riñón. Es producido por las células endoteliales, mesangiales glomerulares y CMLV principalmente, pero [153] también por los fibroblastos . La síntesis y secreción de AM en los fibroblastos está regulada por citoquinas inflamatorias, como el TNF- y la IL-1 y por lipopolisacáridos y factores de crecimiento, y por hormonas. El TNF-, la IL-1, y la dexametasona aumentan su secreción, mientras que el TGF- y el IFN- la suprimen. Oie y col[154]. han demostrado inducción concertada de varios componentes del señalamiento miocárdico de AM durante la IC post-infarto y que los vasos son la principal fuente de AM. La AM sería un factor autocrino/paracrino que interviene en la remodelación post-infarto. Uno de los procesos importantes que intervienen en el engrosamiento intimal de las lesiones ateroscleróticas es la migración de las CMLV hacia la íntima. Se ha establecido en este proceso la existencia de una interacción entre la Ang II y la AM. El péptido estimula la formación de AMPc en las CMLV. La Ang II estimula la migración de las CMLV y la AM la inhibe a través de un [155] mecanismo parcialmente dependiente de AMPc . La AM puede ser considerado como un factor antimigratorio en ciertas condiciones patológicas. Se ha observado incremento de niveles de AM durante el ataque agudo de asma bronquial, [156] como mecanismo compensador por su propiedad broncodilatadora . Dos formas moleculares de AM circulan en el plasma: una activa , madura (AM-m) y una intermedia, inactiva, relacionada con la glicina (AM-Gli). En un estudio clínico de Asakawa y col.[157] de pacientes con IAM, los niveles de AM-m, AM-Gli y AM-T (AM Total) estuvieron incrementados en el ingreso y sus niveles alcanzaron un pico 24 hs después del inicio de los síntomas. Esos niveles se correlacionaron significativamente con los de BNP y la presión en la arteria pulmonar. Los niveles de ambas formas moleculares se encontraron aumentados en orina y en plasma en la fase aguda de IAM, indicando que la AM puede estar involucrada, por sus acciones vasodilatadoras y diuréticas, en un mecanismo de defensa contra las elevaciones de la resistencia periférica y la retención de líquidos en este proceso. La AM tiene un receptor de alta afinidad compuesto por la Proteína modificadora de la actividad del receptor (Receptor activity modifying protein = RAMP) y el Receptor tipo receptor de calcitonina (Calcitonin-receptor-like receptor = CRLR), que ha sido detectado en el corazón de ratas con IC[158], indicando la posibilidad de producción y acción local de AM en el corazón insuficiente. 104 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , En ratas adultas desprovistas de RAMP2 se observa hiperpermeabilidad vascular y alteración de la neovascularización[159]. Las células endoteliales que expresan RAMP2 muestran producción aumentada de capilares, mayor firmeza de la uniones apretadas (tight junctions), y reducción de permeabilidad vascular. RAMP2 es fundamental para los efectos de la AM sobre la vasculatura siendo esencial para la angiogénesis e integridad vascular. Terata[160] ha investigado si la AM produce vasodilatación de las arterias coronarias en el ser humano. Propone que en las arteriolas coronarias la AM produce vasodilatación en parte a través de producción de NO y también por activación de canales de K+, con poca participación de la adeniciclasa. Según De Matteo y May[161] la AM tiene efecto vasodilatador coronario directo mediada por la liberación de NO, con resultante incremento del flujo coronario. Los autores no encontraron evidencias de algún efecto inotrópico directo. El probable rol de AM de antagonismo de la acción vasopresora de la Ang II, mas sus efectos vasodilatadores y diuréticos hacen suponer su utilidad en el manejo de la HTA. En ratas se ha logrado transportar por adenovirus el gen de AM observándose luego protección contra la HTA inducida por sal (y de las complicaciones cardiacas y renales) vía activación del AMPc como segundo mensajero[162]. La Intermedina (IMD) o adrenomedulina-2 (AM-2)[163] es un péptido de la familia CGRP (Calcitonin Gen Related Protein) y AM. La IMD comparte receptores RAMP (Receptor Activity Modifying Proteins) con AM, y CALCRL (Calcitonin Receptor like receptor) con CGRP. Está esparcida en la vasculatura y en el corazón, y en bajos niveles en el plasma. Su predominante ubicación es en el hiopotálamo, la hipófisis y el riñón, indicando que juega un papel en la regulación de la circulación y de la homeostasis hidroelectrolítica. Tiene potente efecto vasodilatador de arterias sistémicas y pulmonares; interviene en la regulación de distribución de flujo y tiene efectos inotrópicos. Tiene acciones protectoras del efecto perjudicial del estrés oxidativo y se opone a mecanismos hipertrofiantes. VASOPRESINA La arginina vasopresina (AVP) es un nonapéptido de peso molecular 1.099 sintetizado en el hipotálamo. En los primeros años de su descubrimiento se tuvo en cuenta su potente efecto vasoconstrictor, pero más tarde se constató que aumentaba la permabilidad al H2O en los tubos colectores del riñón, incrementando la reabsorción de la misma, razón por la cual también se la conoce como Hormona Antidiurética. Cuando en ese nonapéptido se sustituye la isoleucina ubicada en posición 3 por fenilalanina, se forma la oxitocina (Ox), que tiene acción constrictora uterina potente[164,165]. Juntamente con neurofisina que posee 95 aa y un glucopéptido de 39 aa, forman la prohormona denominada preproneurofisina II, que se sintetiza en las células parvo y magnocelulares de los núcleos supraóptico y paraventricular, desde donde es transportada al lugar donde se almacena (en forma de gránulos) y secreta: el lóbulo posterior de la hipófisis[166]. La secreción de vasopresina se produce en respuesta a la hiperosmolaridad o a la acción estimulante de la Ang II, que actúan en conglomerados magnocelulares del hipotálamo, tales como el órgano subfornical y células del órgano vascular de la lámina terminalis o del núcleo mediano preóptico, que producen la hormona que luego almacenan en el lóbulo posterior de la hipófisis (constituido por los axones de las células magnocelulares y parvocelulares ubicadas en los núcleos mencionados). Se encuentran además en el cerebro, varios conglomerados parvocelulares, localizados en el núcleo para ventricular del cerebro, en la estria terminalis, la amígdala media y el núcleo supraquiasmático[167]. La AVP participa de forma importante en funciones cerebrales, tales como la regulación de la agresión y la memoria, y se investiga su rol en el estrés, la ansiedad y la depresión, o sea la integración del comportamiento humano Los estímulos para la secreción de AVP aumentan el mARN y su trascripción en las neuronas magnocelulares. En ratas la deshidratación acelera la transcripción y aumenta los niveles de los 105 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , mARN de AVP y de oxitocina, mientras que la hipoosmolarididad produce una disminución de esos mensajeros. La cantidad de AVP almacenada en la hipófisis posterior es aproximadamente equivalente a la cantidad de hormona suficiente como para mantener una liberación - en condiciones basales - durante 30 a 60 días o en la caso de necesidad de liberación máxima, durante 5 a 10 días [168]. La deshidratación o la sobrecarga de sal estimulan la liberación de AVP, y si el estímulo es prolongado e intenso puede llevar al agotamiento del almacenamiento. Experimentalmente se observa retorno al estado fisiológico basal en 7 a 14 días, cuando en la experimentación se permite al animal ingerir la cantidad normal de agua. Cuando existe una hipovolemia lo suficientemente intensa como para causar un descenso de la presión arterial se produce un abrupto y exponencial aumento en sangre del nivel de AVP. La AVP participa entonces principalmente en el sistema de regulación de la osmolaridad pero también en el sistema de regulación de la presión y del volumen, aunque en este último es francamente predominante la acción del SRAA. La estimulación de la liberación de AVP se produce por disminución súbita del estiramiento cardiaco por caída del volumen de carga ventricular – sensado por el mecanorreceptor ventricular – y por el cese de la acción inhibitoria simpática de los barorreceptores carotídeo y aórtico y directamente por activación de receptores hipotalámicos que sensan cambios ósmóticos menores del 1%. El estímulo de la hipovolemia puede sobrepasar al efecto de la disminución osmótica en forma tal que se puede estimular la liberación de AVP pese a la existencia de hiponatremia significativa[168]. La N-A y la Ang II son importantes estimulantes de la secreción de AVP La concentración plasmática normal de AVP es de 3 pg/ml. Un leve aumento de esa cantidad a 9 pg/ml reduce el flujo medular renal y ejerce potente efecto antidiurético al aumentar la permeabilidad al agua del tubo colector. O sea que la AVP es la determinante mayor de la tasa de excreción renal de agua. Cuando hay depleción de volumen e hipotensión arterial pueden observarse altos niveles plasmáticos de AVP (20-400 pg/ml). La AVP tiene 3 receptores: V1a, V1b (también llamado receptor V3) y V2 . El gen del receptor V1a – mediador de vasoconstricción e hipertrofia miocárdica - se expresa en los vasos sanguíneos de una amplia variedad de órganos y tejidos (células musculares lisas vasculares, plaquetas, linfocitos y monocitos, corteza supararrenal y miocardio). Los receptores V2 se encuentran principalmente en las células de los tubos colectores renales, donde estimulan a la acuaporina2 (proteína de los canales de agua celulares, que aumenta la permeabilidad de la membrana celular al agua). El receptor V1b (o V3) modula la liberación de ACTH -endorfina. Cabe señala que la ACTH estimula la liberación de aldosterona (que puede provocar retención de sodio y reabsorción de agua)[168]. En normales la estimulación de V1a no provoca HTA porque hay simultánea estimulación de V2 , que tiende a bajar la frecuencia cardiaca y el volumen minuto. Niveles que superan los límites fisiológicos reducen la contractilidad y el flujo coronario por mediación de V1a , mientras que en niveles fisiológicos tienen efectos opuestos provocando ligero aumento de la contractilidad. En pacientes con IC los niveles plasmáticos de AVP se encuentran elevados, sobre todo en los descompensados que presentan hiponatremia. El aumento de AVP lleva a un incremento en el número de canales de acuaporina-2 en los tubos colectores renales, con aumento de la reabsorción de agua, aun en presencia de hiponatremia. El aumento del retorno venoso por la reabsorción de agua consecutiva a la presencia en exceso de AVP causa mayor precarga, aumento de la presión capilar pulmonar y de llenado ventricular izquierdo. La vasoconstricción causa aumento de la poscarga[168]. Por todo lo señalado se ha considerado en el tratamiento de la IC que la inhibición de la secreción de AVP puede tener efectos beneficiosos. El conivaptan antagoniza ambos receptores de AVP e induce excreción de agua libre (disminución de peso corporal), disminución de presión arterial y de péptido natriurético plasmático y de masa ventricular[164]. Shimizu investigó los efectos de OPC 31260 (un antagonista del receptor V2 de la AVP) al agregarlo al tratamiento con furosemida y llegó a la conclusión de que la droga es particularmente efectiva en el tratamiento 106 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , del edema combinado con hiponatremia en estados de retención de líquidos. En pacientes internados por IC, el 18-27% presenta hiponatremia (Na+ <135 mEq/lt) que se produce por una combinación de factores agudos y crónicos, dentro de los cuales predomina la secreción aumentada de AVP, a lo que se suma la alteración por los diuréticos de los procesos que deben acontecer en el asa de Henle del túbulo renal. La secreción de AVP es regulada por la osmolaridad plasmática y factores no vinculados con la misma. En la IC, pese a que la AVP plasmática disminuye a medida que la osmolaridad disminuye, su concentración no cae en proporción sino que permanece inapropiadamente elevada, indicando que hay factores no osmóticos que influyen sobre su secreción. En los capítulos 17 y 19 se tratarán aspectos farmacológicos de los inhibidores de la AVP. Bibliografía 1. De Bold AJ, Borestein HB, Veress AT, Sonnenberg H : A rapid and potent natriuretic response to intravenous injection of atrial myocardial extract in rats. Life Sci 1981;28:89-94 2. Kone BC : Molecular biology of natriuretic peptides and nitric oxide synthases. Cardiovasc Res 2001;51:429-41 3. Vesely DL : Atrial natriuretic peptides in the diagnosis and treatment of congestive heart failure . Cong Heart Failure1999:5:171-79 4. Lisy O; Burnett JC Jr : Potential future therapies: natriuretic peptides. Coron Artery Dis 1999;10:389-94 5. Schirger JA, Heublein DM, Chen HH, et al: Presence of Dendroaspis natriuretic peptide-like immunoreactivity in human plasma and its increase during human heart failure. Mayo Clin Proc 1999;74:126-30 6. Fry, BG; Wickramaratana, JC; Lemme, S; Beuve, A; Garbers, D; Hodgson, WC; Alewood, P. Novel natriuretic peptides from the venom of the inland taipan (Oxyuranus microlepidotus): isolation, chemical and biological characterisation. Biochem Biophys Res Commun. 2005;327:1011–1015 7. Hamlyn JM. Natriuretic hormones, endogenous ouabain, and related sodium transport inhibitors. Endocrinology 2014, December (Epub ahead of print). 8. Rosenfeld J, Tal O, Kladnitsky O, Adler L, Efrati E, Carrithers SL, Alper SL, Zelicovic I. Pendrin, a nvel transcriptional target of the uroguanyl system. Cell Biol Biochem 2011;12:221-37 9. Felker GM, Petersen JW, Mark DB.: Natriuretic peptides in the diagnosis and management of heart failure. CMAJ 2006;175:611-17 10. Gutkowska J, Jankowski M, Antunes-Rodriguez J. The role of oxytocin in cardiovascular regulation. Braz J Med Biol Res 2014;47:206-14 11. Edwards BS, Zimmerman RS, Schwab TR, Heublein DM, Burnett JC Jr;: Atrial stretch, not pressure, is the principal determinant controlling the acute release of atrial natriuretic factor. Circ Res 1988;62:191-95 12. Globits S, Frank H, Pacher B, Huelsmann M, Ogris E, Pacher R.: Atrial natriuretic peptide is more dependent on atrial volume than on filling pressure in chronic congestive heart failure. Am Heart J 1998;135:592-97 13. Leskinen H; Vuolteenaho O; Ruskoaho H : Combined inhibition of endothelin and angiotensin II receptors blocks volume load-induced cardiac hormone release. Circ Res 1997;80:114-23 14. Scali MC, Simoniuc A, Dini FL, Narzilli M. The potential value of integrated peptide and echo guided heart failure management. Cardiovascular Ultrasound 2014; 12:27 15. Stingo AJ, Clavell AL, Aarhus LL, et al: Cardiovascular and renal actions of C-type natriuretic peptide. Am J Physiol 262:H308–H312, 1992 16. Hobbs A, Foster P, Prescott C, Scotland R, Ahluwalia A : Natriuretic peptide receptor-C regulates coronary blood flow and prevents myocardial ischemia/reperfusion injury. Circulation 2004;110:1231-35 17. Rose RA, Giles WR.: Natriuretic peptide C receptor signaling in the heart and vasculature. J Physiol 2008;586(Pt 2):353-366 18. Chauhan SD, Nilsson H, Ahluwalia A, Hobbs AJ. Release of C-type natriuretic peptide accounts for the biological activity of endothelium-derived hyperpolarizing factor. Proc Natl Acad Sci U S A. 2003;100:1426–1431 19. Yan W, Wu F, Morser J, Wu Q. : Corin, a transmembrane cardiac serine protease, acts as a pro-atrial natriuretic peptide-converting enzyme. Proc Natl Acad Sci U S A. 2000;97: 8525–8529 20. Zhou Y, Wu Q. Corin in natriuretic peptide processing and hypertension. Curr Hypertens Rep 2014;16:415-21 21. Marumo T, Nakaki T, Hishikawa K, Hirahashi J, Suzuki H, Kato R, Saruta T.: Natriuretic peptide-augmented induction of nitric oxide synthase through cyclic guanosin 3',5'monophosphate elevation in vascular smooth muscle cells. Endocrinology 1995;136:2135-42 22. Calderone A, Thaik C, Takahashi N, Chang DLF, Colucci WS : Nitric oxide, atrial peptide, and cyclic GMP inhibit the growth-promoting effects of norepinephrine in cardiac myocytes and fibroblasts. J Clin Invest 1998;101:812-18 23. Lainchbury JG, Burnett JC Jr, Meyer D, Redfield MM : Effects of natriuretic peptides on load and myocardial function in normal and heart failure dogs. Am J Physiol 2000;278:H33-40 107 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , 24. Münxel T, Fiel R, Mülsch A, Lohmann SM, Hofmann F, Walter U.: Physiology and pathophysiology of vascular signaling controlled by cyclic guanosine 3’,5’-cyclic monophosphate-dependent protein kinase. Circulation 2003;108:2172 25. Brenner BM, Rector P. Nephrology.7th Edition. In MdConsult, 2004 26. Kuhn N.: Structure, Regulation, and Function of Mammalian Membrane Guanylyl Cyclase Receptors, With a Focus on Guanylyl Cyclase-A. Circ Res. 2003;93:700-09 27. Doi K, Ikeda T, Itoh H, Ueyama K, Hosoda K, Ogawa Y, Yamashita J, Chun TH, Inoue M, Masatsugu K, Sawada N, Fukunaga Y, Saito T, Sone M, Yamahara K, Kook H, Komeda M, Ueda M, Nakao K. C-type natriuretic peptide induces redifferentiation of vascular smooth muscle cells with accelerated reendothelization. Arterioscler Thromb Vasc Biol. 2001;21:9306. 28. Gallagher MJ, McCullough PA,. The emerging role of natriuretic peptides in the diagnosis and treatment of decompensated heart failure. Curr Heart Failure Rep 2004;1:129-35 29. Andreassi MG, Del Ry S, Palmieri C, Clerico A, Biagini A, Giannessi D : Up-regulation of “clearance” receptors in patients with chronic heart failure: a possible explanation for the resistance to biologic effects of cardiac natriuretic hormones. Eur J Heart Fail 2001;3:407-14 30. Holtwick R, Gotthardt M, Skryabin B, Steinmetz M, Potthast R, Zetsche B, Hammer RE, Herz J, Kuhn M: Smooth muscle-selective deletion of guanylyl cyclase-A prevents the acute but not chronic effects of ANP on blood pressure. Proc Natl Acad Sc 2002;99:7142-47 31. Abramson BL, Ando S-i, Notarius CF, Rongen GA, Floras JS : Effect of atrial natriuretic peptide on muscle sympathetic activity and its reflex control in human heart failure. Circulation 1999;99:1810-15 32. Azevedo ER, Newton GE, Parker AB, Floras JS, Parker JD : Sympathetic responses to atrial natriuretic peptide in patients with congestive heart failure. J Cardiovasc Pharmacol 2000;35:129-35 33. Thomas CJ, May CN, Sharma AD, Woods RL. ANP, BNP, and CNP enhance bradycardic responses to cardiopulmonary chemoreceptor activation in conscious sheep. Am J Physiol. 2001; 280: R282–R288 34. Kishimoto I, Rossi K, Garbers DL : A genetic model provides evidence that the receptor for atrial natriuretic peptide (guanylyl cyclase-A) inhibits cardiac ventricular myocyte hypertrophy. Proc Natl Acad Sci 2001;98:2703-06 35. Knowles JW, Esposito G, Mao L, Hagaman JR, Fox JE, Smithies O, Rockman HA, Maeda N : Pressure-independent enhancement of cardiac hypertrophy in natriuretic peptide receptor A-deficient mice. J Clin Invest 2001;107:975-84 36. Patel JB,, Valencik ML, Pritchett AM, Burnett JC, McDonald JA, and Redfield MM.: Cardiacspecific attenuation of natriuretic peptide A receptor activity accentuates adverse cardiac remodeling and mortality in response to pressure overload. Am J Physiol Heart Circ Physiol 2005;289:H777-H784 37. Tamura N; Ogawa Y; Chusho H; Nakamura K; Nakao K; et al.: Cardiac fibrosis in mice lacking brain natriuretic peptide. Proc Natl Acad Sci 2000;97:4239-44 38. Kögler, H, Schott P, Toischer K, at al.: Relevance of brain natriuretic peptide in preloaddependent regulation of cardiac sarcoplasmic reticulum Ca2+ ATPase expression. Circulation 2006;113:2724-32 39. Davis KM; Fish LC; Elahi D; Clark BA; Minaker KL : Atrial natriuretic peptide levels in the prediction of congestive heart failure risk in frail elderly. JAMA 1992;267:2625-29 40. Wallen T; Landahl S; Hedner T; Saito Y; Masuda I; Nakao K : Brain natriuretic peptide in an elderly population. J Intern Med 1997, 242:307-11 41. Smith H; Pickering RM; Struthers A; Simpson I; Mant D : Biochemical diagnosis of ventricular dysfunction in elderly patients in general practice: observational study. BMJ 2000 ;320 :906-08 42. Maisel A. S., Krishnaswamy P., Nowak R. M., McCord J., Hollander J. E., Duc P., Omland T., Storrow A. B., Abraham W. T., Wu A. H.B., Clopton P., Steg P. G., Westheim A., Knudsen C. W., Perez A., Kazanegra R., Herrmann H. C., McCullough P. A., the Breathing Not Properly Multinational Study Investigators. Rapid Measurement of B-Type Natriuretic Peptide in the Emergency Diagnosis of Heart Failure. N Engl J Med 2002; 347:161-167 43. Maisel A, Clopton P, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, et al : Impacto of age, race and sex on the ability of B-natriuretic peptide to aid in the emergency diagnosis of heart failure: Results from the Breathing Not Properly (BNP) multinational study. Am Heart J 2004;147:1078-84 44. Januzzi JL, Camargo CA, Anwaruddin S, Baggish AL, et al: The N-Termianl Pro-BNP Investigation of Dyspnea in the Emergency Department (PRIDE) Study. Am J Cardiol 2005;95:948-54 45. Wu AHB.: Serial testing of B-type natriuretic peptide and NTpro-BNP for monitoring therapy of heart failure: The role of biologic variation in the interpretation of results. Am Heart J 2006;152:828-34 46. Takeda Y, Takeda Y, Suzuki S, Kimura G.: Within-person variation on the plasma concentration of B-type natriuretic peptide: safety range in stable patients with heart failure. Am Heart J 2009;157:97-101 47. De Bold, A. J., Ma, K. K., Zhang, Y., de Bold, M. L., Bensimon, M., Khoshbaten, A. The physiological and pathophysiological modulation of the endocrine function of the heart. Can. J. Physiol. Pharmacol. 2001;79, 705 714 48. Yamamoto K, Burnett JC, Jougasaki M, Nishimura RA, Bailey KR, Saito Y, Nakao K, Redfield MM.: Superiority of brain natriuretic peptide as a hormonal marker of ventricular systolic and diastolic dysfunction and ventricular hypertrophy. Hypertension 1996;28:988-94 49. Tsutamoto T, Wada A, Maeda K, Hisanaga T, Maeda Y, Fukai D, Ohnishi M, Sugimoto Y, Kinoshita M.: Attenuation of compensation of endogenous cardiac natriuretic peptide system 108 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , in chronic heart failure. Prognostic of plasma brain natriuretic peptide concentration in patients with chronic symptomatic left ventricular dysfunction. Circulation 1997;96:509-16 50. Yu CM, Sanderson JE : Plasma brain natriuretic peptide- an independent predictor of cardiovascular mortality in acute heart failure. Eur J Heart Fail 1999;1:59-65 51. Jaffe AS, Babuin L, Apple FS.: Biomarkers in acute cardiac disease. J Am Coll Cardiol 2006;48;1-11 52. Struthers AD. : Diastolic dysfunction and ANP/BNP levels. Eur Heart J 1996;17:1617-18 53. Maeda K, Tsutamoto T, Wada A, Hisanaga T, Kinoshita M.: Plasma brain natriuretic peptide as a biochemical marker of high left ventricular end-diastolic pressure in patients with symptomatic left ventricular dysfunction. Am Heart J 1998;135:825-32 54. Volpe M; Tritto C; De Luca N; Mele AF; Lembo G; et al: Failure of atrial natriuretic factor to increase with saline load in patients with dilated cardiomyopathy and mild heart failure. J Clin Invest 1991;88:1481-9 55. Brandt RR, Burnett JC Jr : Humoral control of the kidney during congestive heart failure: role of cardiac natriuretic peptides and angiotensin II. In Heart Failure. Edited by Phillip A Poole-Wilson, Wilson S. Colucci, Barry M. Massie, Kanu Chatterjee, Andrew JS Coats. Churchill Livingstone inc., New York 1997 56. Kinugawa T, Kato M, Ogino K, Igawa O, Hisatome I, Shigemasa C, Nohara R. Neurohormonal determinants of peak oxygen uptake in patients with chronic heart failure. Jpn Heart J. 2003;44:725-34 57. Stevens TL, Rasmussen TE, Wei CM, Kinoshita M, Matsuda Y, Burnett JC Jr. : Renal role of the endogenous natriuretic peptide system in acute congestive heart failure. J Card Fail 1996;2:119-25 58. van Kimmenade RRJ, Januzzi JL, Baggissh AL, Lainchbury JG, Bayes-Genis A, Richards AM, Pinto YM.: Amino-terminal pro-brain natriuretic peptide, renal function and outcomes in acute heart failure. Redefining the cardiorenal interaction?. J Am Coll Cardiol 2006;48:162127 59. Matsumoto T; Wada A; Tsutamoto T; Omura T; Yokohama H; Ohnishi M; Nakae I; Takahashi M; Kinoshita M : Vasorelaxing effects of atrial and brain natriuretic peptides on coronary circulation in heart failure. Am J Physiol 1999;276:H1935-42 60. Willenbrock R, Scheuermann M, Thibault G, Haass M. et al: Angiotensin inhibition and atrial natriuretic peptide release after acute volume expansion in rats with aortocaval shunt. Cardiovasc Res 1999;42:733-42 61. Vesely DL : Atrial natriuretic peptides in pathophysiological diseases. Cardiovasc Res 2001;51:647-58 62. John SW, Krege JH, Oliver PM, et al. Genetic decreases in atrial natriuretic peptide and salt-sensitive hypertension. Science. 1995; 267: 679–681. 63. Melo LG, Steinhelper ME, Pang SC, et al. ANP in regulation of arterial pressure and fluidelectrolyte balance: lessons from genetic mouse models. Physiol Genomics. 2000; 3: 45–58 64. McGirt MJ, Blessing R, Nimjee SM, Friedman AH, Alexander MJ, Laskowitz DT, Lynch JR. Correlation of Serum Brain Natriuretic Peptide with Hyponatremia and Delayed Ischemic Neurological Deficits after Subarachnoid Hemorrhage. Neurosurgery. 2004 Jun;54(6):13691374. 65. Redfield MM: The Breathing Not Proper trial: enough evidence to change heart failure guidelines?. J Card Fail. 2002; 8:120-3. 66. McCullough PA, Sandberg KR.: Sorting out the evidence on natriuretic peptides. Rev Cardiovasc Med 2003;4(suppl 4):S13-S19 67. Rivera M, Talens-Visconti R, Salvador A, Bertomeu V, Miro V V, Garcia De Burgos F, Climent V, Cortes R, Paya R, Perez-Bosca JL, Mainar L, Jordan A, Sogorb F, Cosin J, Mora V, Diago JL, Marin F. NT-proBNP Levels and Hypertension: their importance in the diagnosis of heart failure. Rev Esp Cardiol. 2004 May;57(5):396-402. 68. Hall C; Rouleau JL; Moye L; de Champlain J; Bichet D; Klein M; Sussex B; Packer M; Rouleau J; Arnold MO; et al : N-terminal proatrial natriuretic factor. An independent predictor of long-term prognosis after myocardial infarction Circulation 1994;89:1934-42 69. Steg PG, Joubin L, McCord J, Abraham WT, Hollander JE, Omland T, Mentre F, McCullough PA, Maisel AS.: B-type natriuretic peptide and echocardiographic determination of ejection fraction in the diagnosis of congestive heart failure in patients with acute dyspnea. Chest 2005;128:21-29 70. McCullough PA, Omland T, Maisel AS.: B-Type natriuretic peptides: a diagnostic breakthrough for clinicians. Rev Cardiovasc Med 2003;4:72-80 71. Das SR, Drazner MH, Dries DL, Vega GL, et al: Impact of body mass and body composition on circulating levels of natriuretic peptides. Results from The Dallas Heart Study. Circulation 2005;112:2163-68 72. Sayama H; Nakamura Y; Saito N; Kinoshita M: Why is the concentration of plasma brain natriuretic peptide in elderly inpatients greater than normal? Coron Artery Dis 1999;10:537-40 73. Thomas J. Wang, MD; Martin G. Larson, ScD; Daniel Levy, MD; Emelia J. Benjamin, MD, ScM; Eric P. Leip, MS; Peter W.F. Wilson, MD; Ramachandran S. Vasan, MD. Impact of Obesity on Plasma Natriuretic Peptide Levels . Circulation. 2004;109:594-600 74. Mehra MR, Uber PA, Park MH, Scott RL, Ventura HO, Harris BC, Frohlich ED : Obesity and suppressed B-type natriuretic peptide levels in heart failure. J Am Coll Cardiol 2004;43:159095 75. Arakawa N; Nakamura M; Aoki H; Hiramori K : Plasma brain natriuretic peptide concentrations predict survival after acute myocardial infarction. J Am Coll Cardiol 1996;27:1656-61 76. Omland T, Aakvaag A, Bonarjee VVS et al. : Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction. 109 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , Comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide. Circulation 1996;93:1963-69 77. Hirayama A, Yamamoto H, Sakata Y, Asakura M, et al : Usefulness of plasma brain natriuretic peptide after acute myocardial infarction in predicting left ventricular dilatation six months later. Am J Cardiol 2001;88:890-92 78. Nilsson JC, Groenning BA, Nielsen G, Fritz-Hansen T, et al : Left ventricular remodeling in the first year after acute myocardial infarction and the predictive value of N-terminal pro brain natriuretic peptide. Am Heart J 2002;143:696-702 79. Bibbins-Domingo K, Ansari M, Schiller NB, Massie B, Whooley MA.: B-type natriuretic peptide and ischemia in patients with stable coronary disease: data from the Heart and Soul study. Circulation. 2003 Dec 16;108(24):2987-92. 80. Qi W; Kjekshus H; Klinge R; Kjekshus JK; Hall C:Cardiac natriuretic peptides and continuously monitored atrial pressures during chronic rapid pacing in pigs. Acta Physiol Scand 2000;169:95-102 81. Talwar S, Downie PF, Squire IB, Davies JE, Barnett DB, Ng LL : Plasma N-terminal pro BNP and cardiotrophin-1 are elevated in aortic stenosis. Eur J Heart Failure 2001;3:15-19 82. Vantrimpont P, Rouleau JL, Ciampi A, Harel F, de Champlain J, Bichet D, Moyé LS, Pfeffer M, for the SAVE Investigators.: Two-year time course and significance of neurohormonal activation in the Survival and Ventricular Enlargement (SAVE) Study. Eur Heart J 1998;19:1552-63 83. Cowie MR; Struthers AD; Wood DA; Coats AJ; Thompson SG; Poole-Wilson PA; Sutton GC Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care. Lancet 1997;350:1349-53 84. Bettencourt P, Ferreira A, Pardal-Oliveira N, Pereira M, Queiros C, Araujo V, CarqueiraGomes M, Maciel MJ : Clinical significance of brain natriuretic peptides in patients with postmyocardial infarction. Clin Cardiol 2000;23:921-27 85. Fruhwald FM; Fahrleitner A; Watzinger N; Dobnig H, Schumacher M, Maier R, et al.: Nterminal proatrial natriuretic peptide correlates with systolic dysfunction and left ventricular filling pattern in patients with idiopathic dilated cardiomyopathy. Heart 1999;82:630-3 86. Fruhwald FM; Fahrleitner A; Watzinger N; Fruhwald S; Dobnig H; Schumacher M; Maier R; Zweiker R; Klein WW : Natriuretic peptides in patients with diastolic dysfunction due to idiopathic dilated cardiomyopathy. Eur Heart J 1999;20:1415-23 87. Tsutamoto T; Wada A; Maeda K; Hisanaga T; Mabuchi N, et al: Plasma brain natriuretic peptide level as a biochemical marker of morbidity and mortality in patients with asymptomatic or minimally symptomatic left ventricular dysfunction. Comparison with plasma angiotensin II and endothelin-1. Eur Heart J 1999;20:1799-807 88. Landray MJ, Lehman R, Arnold I : Measuring brain natriuretic peptide in suspected left ventricular dysfunction in general practice: cross-sectional study. BMJ 2000;320:985-86 89. Yu CM; Sanderson JE; Shum IO; Chan S; Yeung LY; Hung YT; Cockram CS; Woo KS Diastolic dysfunction and natriuretic peptides in systolic heart failure. Higher ANP and BNP levels are associated with the restrictive filling pattern. Eur Heart J 1996;17:1694-702 90. Yamamoto K, Burnett JC Jr, Bermudez EA, Jougasaki M, Bailey KR, Redfield MM : Clinical criteria and biochemical markers for the detection of systolic dysfunction. J Card Failure 2000;6:194-200 91. Selvais PL, Robert A, Ahn S, van Linden F, Ketelslegers JM, Pouleur H, Rousseau MF : Direct comparison between endothelin-1, N-terminal proatrial natriuretic factor, and brain natriuretic peptide as prognostic markers of survival in congestive heart failure. J Card Fail 2000;6:201-07 92. Andersson B, Hall C : N-terminal proatrial natriuretic peptide and prognosis in patients with heart failure and preserved systolic function. J Card Failure 2000;6:208-13 93. Redfield MM, Burnet JC Jr, Jacobsen SJ, Mahoney DW, Rodeheffer RJ : Elevation of circulating BNP in isolated diastolic dysfunction. J Card Failure 1999(suppl 1):18(abstract) 94. Redfield MM, Mahoney DW, Jacobsen SJ, Rodeheffer RJ : Isolated diastolic dysfunction in the community. Circulation 1999;18 (suppl I):I381 (abstract) 95. Lubien E, DeMaria A, Krishnaswamy P, Clopton P, Koon J, Kazanegra R, Gardetto N, Wanner E, Maisel AS. Utility of B-natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recordings. Circulation. 2002;105:595-601. 96. Troughton RW, Prior DL, Pereira JJ, Martin M, Fogarty A, et al : Plasma B-type natriuretic peptide levels in systolic heart failuire. J Am Coll Cardiol 2004;43:416-22 97. Maisel A, Hollander JE, Guss D, McCullough P, Nowak R, Green G, Saltzberg M, Ellison SR, Bhalla MA, Bhalla V, Clopton P, Jesse R; Rapid Emergency Department Heart Failure Outpatient Trial investigators. Primary results of the Rapid Emergency Department Heart Failure Outpatient Trial (REDHOT). A multicenter study of B-type natriuretic peptide levels, emergency department decision making, and outcomes in patients presenting with shortness of breath. J Am Coll Cardiol. 2004;44:1328-33. 98. Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, Chen A, Clopton P, James C, Chiu A, Maisel AS. Utility of B-type natriuretic peptide in predicting postoperative complications and outcomes in patients undergoing heart surgery. J Am Coll Cardiol. 2004 May 19;43(10):1873-9. 99. Isnard R; Pousset F; Trochu J; Chafirovskaia O; Carayon A; Golmard J; Lechat P; Thomas D; Bouhour J; Komajda M : Prognostic value of neurohormonal activation and cardiopulmonary exercise testing in patients with chronic heart failure. Am J Cardiol 2000;86:417-21 100. Hillege HL; Girbes AR; de Kam PJ; Boomsma F; de Zeeuw D; Charlesworth A; Hampton JR; van Veldhuisen DJ : Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation 2000;102:203-10 110 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , 101. Yamamoto K, Masuyama T, Sakata Y, Doi R, et al.: Local neurohumoral regulation in the transition to isolated diastolic heart failure in hypertensive heart disease: absence of AT.1 receptor downregulation and ‘overdrive’ of the endothelin system. Cardiovasc Res 2000;46:421-32 102. Maron BJ, Tolakanahalli VN, Zenovich AG, at al: Usefulness of B-type natriuretic peptide assay in the assessment of symptomatic state in hypertrophic cardiomyopathy. Circulation. 2004;109:984-9. 103. Rossi A, Enriquez-Sarano M, Burnett JC, Lerman A, Abel MD, Seward JB : Natriuretic peptide levels in atrial fibrillation. J Am Coll Cardiol 2000;35:1256-62 104. Tuinenburg AE; Brundel BJ; Van Gelder IC; Henning RH; Van Den Berg MP; Driessen C; Grandjean JG; Van Gilst WH; Crijns HJ : Gene expression of the natriuretic peptide system in atrial tissue of patients with paroxysmal and persistent atrial fibrillation. J Cardiovasc Electrophysiol 1999;10:827-35 105. Wright SP, Prickett TC, Doughty RN, Frampton C, Gamble GD, Yandle TG, Sharpe N, Richards M. Amino-terminal pro-C-type natriuretic peptide in heart failure. Hypertension. 2004;43:94-100. Epub 2003 Dec 01. 106. Logeart D, Thabut G, Jourdain P, Chavelas C, Beyne P, Beauvais F, Bouvier E, Cohen-Solal A. Predischarge B-type natriuretic peptide assay for identifying patients at high risk of readmission after decompensated heart failure. J Am Coll Cardiol. 2004;43:635-41. 107. Nakagawa K, Umetani K, Fujioka D, Sano K, Nakamura T, Kodama Y, Kitta Y, Ichigi Y, Kawabata K, Obata JE, Takano H, Inobe Y, Kugiyama K. Correlation of plasma concentrations of B-type natriuretic peptide with infarct size quantified by tomographic thallium-201 myocardial scintigraphy in asymptomatic patients with previous myocardial infarction. Circ J. 2004 ;68:923-7. 108. Nishikimi T, Mori Y, Ishimura K, Tadokoro K, Yagi H, Yabe A, Horinaka S, Matsuoka H. Association of plasma atrial natriuretic peptide, N-terminal proatrial natriuretic peptide, and brain natriuretic peptide levels with coronary artery stenosis in patients with normal left ventricular systolic function. Am J Med. 2004 Apr 15;116(8):517-23. 109. de Lemos JA, Morrow DA, Bentley JH, Omland T, Sabatine MS, McCabe CH, Hall C, Cannon CP, Braunwald E. The prognostic value of B-type natriuretic peptide in patients with acute coronary syndromes. N Engl J Med. 2001;345:1014-21 110. Eimer MJ, Ekery DL, Rigolin VH, Bonow RO, Carnethon MR, Cotts WG.: Elevated B-type natriuretic peptide in asymptomatic men with chronic aortic regurgitation and preserved left ventricular systolic function. Am J Cardiol 2004;94:676-78 111. Levitt JE, Vinayak AG, Gelbach BK et. al.: Diagnostic utility of B-type natriuretic peptide in critically ill patients with pulmonary edema: a prospective cohort study. Crit Care 2008;12(1):R3 112. Mukoyama M; Nakao K; Hosoda K; Suga S; Saito Y; Ogawa Y; Shirakami G; Jougasaki M; Obata K; Yasue H; et al : Brain natriuretic peptide as a novel cardiac hormone in humans. Evidence for an exquisite dual natriuretic peptide system, atrial natriuretic peptide and brain natriuretic peptide. J Clin Invest 1991;87:1402-12 113. Grantham JA; Burnett JC Jr : BNP: increasing importance in the pathophysiology and diagnosis of congestive heart failure. Circulation 1997;96:388-90 114. Maisel A : B-type natriuretic peptide levels: A potential novel “white count” for congestive heart failure. J Card Failure 2001;7:183-93 115. Wang TJ, Larson MG, Levy D, Benjamín EJ, et al.: Plasma natriuretic peptides levels and the risk of cardiovascular events and death. N Engl J Med 2004;350:655-63 116. Tang WH, Girod JP, Lee MJ, Starling RC, Young JB, Van Lente F, Francis GS. : Plasma Btype natriuretic peptide levels in ambulatory patients with established chronic symptomatic systolic heart failure. Circulation. 2003;16;108:2964-6. 117. Wang TJ, Larson MG, Levy D, Leip EP, Benjamin EJ, Wilson PW, Sutherland P, Omland T, Vasan RS. Impact of age and sex on plasma natriuretic peptide levels in healthy adults. Am J Cardiol. 2002;90:254-8. 118. Atisha B, Bhalla MA, Morrison LK, Felicio L, Clopton P, Gardetto N, Kazanegra R, Chiu A, Maisel AS : A prospective study in search of an optimal B-natriuretic peptide level to screen patients for cardiac dysfunction. Am Heart J 2004;148:518-23 119. Doust JA, Glasziou PP, Pietrzak E, Dobson AJ. A systematic review of the diagnostic accuracy of natriuretic peptides for heart failure. Arch Intern Med. 2004;164:1978-84 120. Kangawa K, Kitamura K, Minamino N, Eto T, Matsuo H : Adrenomedullin: an new hypotensive peptide. J Hypertens 1996;14(suppl 5):S105-S110. 121. Troughton RW, Lewis LK, Yandle TG, Richards AM, Nicholls G : Hemodynamic, hormone, and urinary effects of adrenomedullin infusion in essential hypertension. Hypertension 2000;36:588-93 122. Matsumura K, Abe I, Tsuchihashi T, Fujishima M : central adrenomedullin augments the baroreceptor reflex in conscious rabbits. Hypertension 1999;33:992-97 123. Saita M, Shimokawa A, Kunitake T, Kato K, Hanamori T, Kitamura K, Eto T, Kannan H : Central actions of adrenomedullin on cardiovascular parameters and sympathetic outflow in conscious rats. Am J Physiol 1998;274:R979-R984 124. Vesely DL, Blankenship M, Douglas MA et al. : Atrial natriuretic peptide increases adrenomedullin in the circulation of healthy humans. Life Sci 1996;59:243-54 125. Jougasaki M, Burnett JC Jr : Continuing insights into the heart as an endocrine organ: adrenomedullin and cardiac fibroblasts. Cardiovasc Res 2001;49:695-6 126. Romppanen H, Puhakka J, Szokodi I, VuolteenahoO, Tokola H, Tóth M, Ruskohao H . Endothelin-1-independent and angiotensin II-independent induction of adrenomedullin gene expresión. Hypertensión 2001;37:84-90 111 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , 127. Jougasaki M, Wei CH-M, McKinley LJ, Burnett JC.: Elevation of circulating and ventricular adrenomedullin in human congestive heart failure. Circulation 1995;92:286-89 128. Nishikimi T, Horio T, Sasaki T, Yoshihara F et al. Cardiac production and secretion of adrenomedullin are increased in heart failure. Hypertension 1997;30:1369-75 129. Rademaker MT, Charles CJ, Lewis LK, Yandle TG, Cooper GJS, Coy DH, Richards AM, Nicholls MG.: Beneficial hemodynamic and renal effects of adrenomedullin in a ovine model of heart failure. Circulation 1997;96:1983-90 130. Jougasaki M, Rodeheffer RJ, Redfield MM, Yamamoto K, Wei C-M, McKinley LJ, Burnett JC.: Cardiac secretion of adrenomedullin in human heart failure. J Clin Invest 1996;97:2370-76 131. Nishikimi T; Saito Y; Kitamura K; Ishimitsu T; Eto T; Kangawa K; Matsuo H; Omae T; Matsuoka H : Increased plasma levels of adrenomedullin in patients with heart failure. J Am Coll Cardiol 1995;26:1424-31 132. Szokodi I, Kinnunen P, Tavi P, Weckström M, Tóth M, Ruskoaho H.: Evidence for cAMPindependent mechanisms mediating the effects of adrenomedullin, a new inotropic peptide. Circulation 1998;97:1062-70 133. Parkes DG; May CN : Direct cardiac and vascular actions of adrenomedullin in conscious sheep. Br J Pharmacol 1997;120:1179-85 134. Jougasaki M, Stevens TL, Borgeson DD, Luchner A, Redfield MM, Burnett JC Jr : Adrenomedullin in experimental congestive heart failure: cardiorenal activation. Am J Physiol 1997;273:R1392-99 135. Daggubati S, Parks JR, Overton RM, Cintron G, Schocken DD, Vesely DL.: Adrenomedullin, endothelin, neuropeptide Y, atrial, brain, and C-natriuretic prohormone peptides compared as early heart failure indicators. Cardiovasc Res 1997;32:246-55 136. Richards AM, Nicholls MG, Yandle TG, Frampton C, et al : Plasma N-terminal pro-brain natriuretic peptide and adrenomedullin: new neurohormonal predictors of left ventricular function and prognosis after myocardial infarction. Circulation 1998;97:121-29 137. Ihara T, Ikeda U, Tate Y, Ishibashi S, Shimada K : Positive inotropic effect of adrenomedullin on rat papillary muscle. Eur J Pharmacol 2000;390:167-72 138. Samson WK. Adrenomedullin and the control of fluid and electrolyte homeostasis. Annu Rev Phisiol 1999;61:363-89 139. Matsumura K; Abe I; Tsuchihashi T; Fujishima M : Central adrenomedullin augments the baroreceptor reflex in conscious rabbits. Hypertension 1999;33:992-97 140. Yamaguchi T; Baba K; Doi Y; Yano K; Kitamura K; Eto T: Inhibition of aldosterone production by adrenomedullin, a hypotensive peptide, in the rat. Hypertension 1996;28:308-14 141. Petrie MC, Hillier C, Morton JJ, McMurray JJ : Adrenomedullin selectively inhibits angiotensin II-induced aldosterone secretion in humans. J Hypertens 2000;18:61-4 142. Kohno M; Kano H; Horio T; Yokokawa K; Yasunari K; Takeda T : Inhibition of endothelin production by adrenomedullin in vascular smooth muscle cells. Hypertension 1995;25:118590 143. Jougasaki M, Schirger JA, Simari RD, Burnett JC Jr : Autocrine role for the endothelin-B receptor in the secretion of adrenomedullin. Hypertension 1998;32:917-22 144. Kobayashi K; Kitamura K; Etoh T; Nagatomo Y; Takenaga M; Ishikawa T; Imamura T; Koiwaya Y; Eto T Increased plasma adrenomedullin levels in chronic congestive heart failure. Am Heart J 1996;131:994-98 145. Ikeda U, Kanbe T, Kawahara Y, Yokoyama M, Shimada K : Adrenomedullin augments inducible nitric oxide synthase expression in cytokine-stimulated cardiac myocytes. Circulation 1996;94:2560-65. 146. Yamamoto K, Ikeda U, Sekiguchi H, Shimada K : Plasma levels of adrenomedullin in patients with mitral stenosis. Am Heart J 1998;135:542-49 147. Yoshitomi Y, Nishikimi T, Kojima S, Kuramochi M. et al. : Plasma levels of adrenomedullin in patients with acute myocardial infarction. Clin Science 1998;94:135-39 148. Miyao Y, Nishikimi T, Goto Y, Miyazaki S, et al. : Increased plasma adrenomedullin levels in patients with acute myocardial infarction in proportion to the clinical severity. Heart 1998;79:3944 149. Hamada M, Shigematsu Y, Kawakami H, Minamino N, Kangawa K, Matsuo H, Hiwada K : Increased plasma levels of adrenomedullin in patients with hypertrophic cardiomyopathy: its relation to endothelin-1, natriuretic peptides and noradrenaline. Clin Science 1998;94:21-8 150. Nishikimi T, Nagata S, Sasaski T, Yoshihara F, Nagaya N, Horio T, Matsuo H, Matsuoka H, Kangawa K : The active molecular form of plasma adrenomedullin is extracted in the pulmonary circulation in patients with mitral stenosis: possible role of adrenomedullin in pulmonary hypertension. Clin Sci 2000;100:61-66 151. Pinto A; Sekizawa K; Yamaya M; Ohrui T; Jia YX; Sasaki H : Effects of adrenomedullin and calcitonin gene-related peptide on airway and pulmonary vascular smooth muscle in guineapigs. Br J Pharmacol 1996;119:1477-83 152. Nagaya N, Nishikimi T, Uematsu M, Satoh T, Oya H, Kyotani S, Sakamaki F, Ueno K, Nakanishi N, Miyatake K, Kangawa : Haemodynamic and hormonal effects of adrenomedullin in patients with pulmonary hypertension. Heart 2000 ;84 :653-58 153. Isumi Y, Minamino N, Katafuchi T, Yoshioka M, Tsuji T, Kangawa K, Matsuo H : Adrenomedullin production in fibroblasts : its possible function as a growth regulator of Swiss 3T3 cells. Endocrinology 1998;139:2552-63 154. Oie E, Vinge LE, Yndestad A, Sandberg C, Grogaard HK, Attramadal H : Induction of myocardial adrenomedullin signaling system during ischemic heart failure in rats. Circulation. 2000;101:415-22 155. Kohno M, Yokokawa K, Kano H, Yasunari K, Minami M, Hanehira T, Yoshikawa J : Adrenomedullin is a potent inhibitor of angiotensin II-induced migration of human coronary artery smooth muscle cells. Hypertension 1997;29:1309-13 112 INSUFICIENCIA CARDIACA CRÓNICA. DR. FERNANDO DE LA SERNA. CAPÍTULO 5. PÉPTIDOS NATRIURÉTICOS , 156. Kohno M; Hanehira T; Hirata K; Kawaguchi T; Okishio K; Kano H; Kanazawa H; Yoshikawa J : An accelerated increase of plasma adrenomedullin in acute asthma. Metabolism 1996;45:1323-5 157. Asakawa H, Nishikimi T, Suzuki T, Hara S, Tsubokou Y, Yagi H, Yabe A, Tsuchiya N, Horinaka S, Kangawa K, Matsuoka H: Elevation of two molecular forms of adrenomedullin in plasma and urine in patients with acute myocardial infarction treated with early coronary angioplasty. Hypertension 2000;36:995-1001 158. Totsune K, Takahashi K, Mackenzie HS, Murakami O, Arihara Z, Sone M, Mouri T, Brenner BM, Ito S: Increased gene expression of adrenomedullin and adrenomedullin-receptor complexes, receptor-activity modifying protein (RAMP)2 and calcitonin-receptor-like receptor (CRLR) in the hearts of rats with congestive heart failure. Clin Sc 2000;99:541-46 159. Ichikawa-Sindo Y, Sakurai T, Kamiyoshi A, et al.: The GPCR modulator protein RAMP2 is essential for angiogenesis and vascular integrity. J Clin Invest 2008;118:29-39 160. Terata T, Miura H, Liu Y, Loberiza F, Gutterman DD : Human coronary arteriolar dilation to adrenomedullin: role of nitric oxide and K(+) channels. Am J Physiol Heart Circ Physiol 2000;279:H2620-26 161. De Matteo R, May CN. Direct coronary vasodilator action of adrenomedullin is mediated by nitric oxide. Br J Pharmacol. 2003;140:1414-20. 162. Zhang JJ, Yoshida H, Chao L, Chao J. Human adrenomedullin gene delivery protects against cardiac hypertrophy, fibrosis, and renal damage in hypertensive Dahl salt-sensitive rats. Hum Gene Ther 2000 Sep 1;11(13):1817-27 163. Bell D, McDermott BJ- Intermedin (adrenomedullin-2): a novel counter-regulatory peptide in the cardiovascular and renal systems. Br J Pharmacol 2008;153 (Suppl 1):S247-62 164. Larsen: Williams Textbook of Endocrinology, 10th ed., Copyright © 2003 Saunders. In MDconsult. http://www.mdconsult.com 165. Costello-Boerritger LC; Smith WB, Boerritger G, Ouyang J, Zimmer CA, Orlandi C, Burnett JC. Vasopressin-2-receptor antagonism augments water excretion without chages in renal hemodynamics or sodium and potassium excretion in human heart failure. Am J Physiol Renal Physiol 2006;290:F273-F278 166. Caldwell HK, Lee H-J, MacBeth AH, Scott Young III W.: Vasopressin;behavioral roles of an “original” neuropeptide. Prog Neurobiol 2008;84:1-24 167. Chatterjee K: Neurohormonal activation in congestive heart failure and the role of vasopressin. Am J Cardiol 2005;95[suppl]:8B-13B 168. Lee CR, Watkins MI, Patterson JH, Gattis W, O’Connor CM, Gheorghiade M, Adams KF: vasopressin: a new target for the treatment of heart failure. Am Heart J 2003;146:9-18 €€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€€ 113