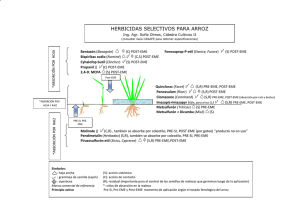
Estudio de la duración del efecto inhibitorio de la administración de
Anuncio

UNIVERSIDAD DE CHILE Instituto de Nutrición y Tecnología de los Alimentos Efecto del Consumo de Prebióticos sobre la Biodisponibilidad de Hierro Valerie Weinborn Astudillo Tesista Fernando Pizarro Aguirre Director de Tesis Tesis para optar al grado de Magíster en Nutrición y Alimentos Mención Alimentos Saludables 1 Comisión de Tesis Sr. Fernando Pizarro – Tutor Sra. Eva Hertrampf – Profesora INTA Sr. Martín Gotteland – Profesor INTA Sr. Tulio Nuñez – Profesor Facultad de Ciencias Fecha de Examen de Grado: ______________ Calificación Final: ________________ 2 Dedicatoria A mis padres… 3 Agradecimientos A todos quienes facilitaron este proceso, en especial a mi profesor guía Fernando Pizarro y al Sr. Ricardo Weill, quien fue el responsable del financiamiento de este proyecto. Además a Angélica Letelier, a Sebastián Flores, a Daniel López de Romaña, a Carolina Valenzuela y a Constanza Miranda. 4 Financiamiento Este proyecto fue financiado por el Instituto Danone del Conosur y su investigador responsable es el profesor Fernando Pizarro Aguirre. 5 Índice Resumen 1 Summary 2 Introducción 3 Revisión Bibliográfica 4 Hipótesis 14 Objetivo General 14 Objetivos Específicos 14 Materiales y Métodos 15 Resultados 24 Discusión 30 Conclusión 35 Bibliografía 36 Anexo 1: Consentimiento de participación en el Proyecto “ Efecto de los prebióticos sobre la biodisponibilidad de hierro hem y no hem en humanos” 44 Anexo 2: Técnica de doble marcaje isotópico de Eakins y Brown 48 6 Resumen Antecedentes: El hierro (Fe) es un elemento esencial para el ser humano, pero en exceso puede ser tóxico. La homeostasis de Fe es regulada por su absorción a través del enterocito. En la dieta el hierro se encuentra de dos formas: el hierro no hemínico (Fe-no hem) y el hierro hemínico (Fe-hem). La forma en que se encuentra el hierro en la dieta determina de cómo será absorbido. La absorción de Fe-no hem es influenciada por componentes intraluminales y dietarios: los taninos, fitatos y calcio disminuyen la absorción de hierro y la carne y el ácido ascórbico la favorecen. En cambio la absorción del Fe-hem sólo es inhibida por calcio y favorecida por la carne de vacuno. Por otro lado, existe evidencia que los prebióticos presentan múltiples y variados beneficios por su consumo en el humano. Estudios previos in vitro y en animales han demostrado tener efectos positivos sobre la absorción de hierro, pero éstos no han concordado con los pocos estudios que se han realizado en humanos. Objetivo: Establecer el efecto del consumo de prebióticos sobre la biodisponibilidad de Fe. Sujetos y Métodos: Participaron 24 mujeres (35 a 45 años) sanas. Los sujetos fueron aleatorizados en dos grupos. Un grupo consumió un yogurt diario por 12 días con una mezcla de prebióticos y el otro grupo recibió el mismo yogurt pero sin prebióticos. Previo y posterior a la ingesta los sujetos participaron en estudios de absorción de hierro. En los estudios de absorción se utilizaron isótopos radiactivos de hierro (55Fe y 59 Fe). Se aplicó ANOVA de dos vías como prueba de comparación. Resultados: La biodisponibilidad de Fe-hem y Fe-no hem del grupo control no mostraron diferencias significativas (16.5/17.3% pre/post Fe-hem y 29.6/29.8% pre/post Fe-no hem). La biodisponibilidad del grupo que consumió prebiótico mostro un incremento significativo en Fe-hem (11.7/18.2% pre/post, p=0.007). Sin embargo, para Fe-no hem no hubo diferencias (20.7/19.8% pre/post). Conclusiones: El consumo crónico de yogurt con agregado de prebióticos aumenta la biodisponibilidad de Fe-hem, y no produce cambios en la absorción del Fe-no hem. 1 Summary Background: Iron (Fe) is an essential element for humans; however in excess it could be toxic. The Fe homeostasis is regulated by its absorption through the enterocyte. In the diet, Fe comes into of two forms: non heme Fe and heme Fe. The way that iron comes in the diet can determine how it will be absorbed. The non heme Fe absorption is influenced by intraluminal and dietary components. While tannins, phytate, and calcium decrease the iron absorption, ascorbic acid and meat enhance it. In contrast, heme Fe absorption is inhibited only by calcium and enhanced by meat. On the other hand, there is evidence that prebiotics have multiples and varied benefits to the humans beings by its consumption. Studies performed in vitro and in animals have demonstrated positive effects on iron absorption. However there is no consensus about the results shown by studies done in humans. Objective: To establish the effect of consumption of prebiotics on iron bioavailability. Subjects and Methods: 24 healthy women (35-45 years old). Subjects were randomized into of two groups. One group ate one yogurt per day for 12 days with a prebiotic mix and the other group received the same yogurt but without prebiotics. Before and after the intake period, subjects participated in iron absorption studies. These studies used iron radioactive isotopes (55Fe and 59Fe). Two-way ANOVA was applied as comparison test. Results: There were no significant differences in heme and non heme Fe bioavailability in the control group (16.5/17.3% pre/post heme Fe and 29.6/29.8% pre/post non hem Fe). Fe bioavailability of the group who consumed prebiotics increased significantly (11.7/18.2% pre/post, p=0.007).However, there were no significant differences in non heme Fe bioavailability in the same group (20.7/19.8% pre/post). Conclusions: Chronic consumption of yogurt with added prebiotics increases heme Fe bioavailability and does not change non heme Fe absorption. 2 Introducción Uno de los grandes problemas a nivel nutricional en humanos es la deficiencia de microminerales, y dentro de éstos el hierro es el más importante. La principal manifestación de la deficiencia de hierro es la anemia. El hierro es un mineral esencial para la vida y participa en diversos procesos biológicos indispensables. Existen dos tipos de hierro, el hemínico (Fe-hem) y el no hemínico (Fe-no hem), que se diferencian, además de su forma química, en el proceso de absorción. Se describe una mayor estabilidad y biodisponibilidad del hierro hem, ya que su absorción es poco afectada por factores de la dieta e intraluminales, por lo tanto, podría llegar a ser una mejor fuente de para la suplementación con hierro. En términos generales, el hierro se absorbe principalmente en duodeno, es transportado a través del torrente sanguíneo y líquido extracelular unido a la transferrina y se almacena predominantemente dentro de la célula en forma de ferritina. Los mecanismos de absorción y factores que la afectan dependen del tipo de hierro ingerido. Uno de los factores en que no se ha podido llegar a un consenso de cómo afecta dicha absorción son los prebióticos; moléculas fermentables añadidas a distintos alimentos que producen un efecto favorable sobre la flora intestinal del huésped. Basados en estudios previos in vitro e in vivo, donde no se observan resultados decidores respecto a la absorción de hierro y su interacción con prebióticos, hemos decidido realizar la siguiente tesis que tiene como propósito aclarar la interacción que se genera entre hierro y prebióticos a nivel de tubo digestivo. Hipotetizamos que la biodisponibilidad de hierro es amplificada por la acción de prebióticos. Como metodología, se planificaron protocolos de absorción en humanos que incluyen la marcación intrínseca de hierro hemínico con 55Fe y 59Fe. 3 Revisión Bibliográfica La anemia y el hierro La malnutrición continúa siendo hasta el día de hoy un importante problema de salud pública a nivel mundial (Schofield y Ashworth, 1996). Es así, como las dietas en las poblaciones humanas son frecuentemente deficientes en macronutrientes (proteínas, carbohidratos y grasas), llevándonos a una malnutrición proteico-energética, y también en micronutrientes (electrolitos, vitaminas y minerales) (Millward y Jackson, 2004). Dentro del concepto de malnutrición, se encuentran las deficiencias de micronutrientes. Estas deficiencias se han convertido durante los últimos años, en un importante problema de salud pública, comparativamente con la deficiencia de macronutrientes (Ferraz et al., 2005; Darnton-Hill et al., 2005). Dentro de ellas, destacan la deficiencia de hierro, yodo, vitamina A y zinc (Díaz et al., 2003). El hierro es el cuarto elemento más abundante en la corteza terrestre (de Duve, 1990). Puede existir en estados de oxidación cuyo rango va de -2 a +6. En sistemas biológicos, estos estados de oxidación están principalmente limitados a los estados ferroso (+2) y férrico (+3) (Beard y Piñero, 1997). Este mineral es indispensable para la vida; actúa como cofactor de muchas enzimas, hemoproteínas y proteínas no hem que cumplen funciones biológicas cruciales como síntesis de ADN, síntesis de ARN, transporte de oxígeno (hemoglobina y mioglobina), metabolismo del oxígeno (oxidasas, peroxidasas, catalasas e hidroxilasas) y transporte de electrones (citocromos) (Palomo et al., 2005). En el humano, cerca del 70% del contenido total de hierro se encuentra como hemoglobina, proteína que transporta oxígeno. Otro 25% de encuentra como reserva (ferritina y hemosiderina), un 4% como mioglobina y un 1% unido a la transferrina y como componentes de diferentes enzimas (Bothwell et al., 1979). 4 Diariamente, un adulto sano pierde alrededor del 0,025% de su hierro total (equivalente a 1 mg), el cual debe ser reemplazado desde la dieta. Estas pérdidas son producidas principalmente por la descamación de las células epiteliales del tracto gastrointestinal y por el micro sangrado fisiológico intestinal; en el caso de las mujeres las pérdidas aumentan debido al sangrado menstrual. Los requerimientos en el ser humano son muy bajos, diariamente se requieren absorber 1-2 mg desde la dieta (Conrad y Umbreit, 2002). La deficiencia de hierro es uno de los principales problemas de salud pública, aún en los países desarrollados. Durante los primeros años de vida, esta deficiencia nutricional afecta el desarrollo cognitivo de los individuos y en la edad adulta disminuye la capacidad productiva (Darnton-Hill et al., 2005). En las mujeres embarazadas se ha asociado la deficiencia de este mineral con el aumento en los riesgos de muerte materna durante el parto y el puerperio, además, los hijos de madres deficientes en hierro tienen mayor riesgo de bajo peso al nacer, lo cual condiciona el desarrollo de enfermedades crónicas asociadas a la nutrición (Singh et al., 2004). La manifestación más común de la deficiencia de hierro es la anemia, y ésta ocurre cuando los niveles del micronutriente son tan bajos que la concentración de hemoglobina cae por debajo de los valores de corte específicos para la edad y sexo (Dallman et al., 1980; Cook et al., 1994). Alrededor de 2 mil millones de personas y más del 30% de la población mundial, son anémicos y la mayoría de ellos es debido a la deficiencia de hierro (WHO, 2007). Cerca del 46% de los niños entre 5 y 14 años padecen anemia y la mayoría de ellos viven en países en vías de desarrollo. En Estados Unidos, el 3% de los preescolares y el 2 a 5% de las adolescentes, presentan anemia por deficiencia de hierro. A nivel mundial, el 48% de las embarazadas están afectadas, y esta cifra aumenta si nos enfocamos al Tercer Mundo, con un 56% de mujeres gestantes que padecen esta enfermedad (Muñoz y Molina, 2005). 5 La deficiencia de hierro se puede prevenir mediante modificaciones de la dieta, fortificación de los alimentos y suplementación con hierro medicinal. Ninguna de estas estrategias es excluyente. La forma ideal de prevenir la carencia de hierro es mediante una dieta adecuada, lo que no siempre es posible de lograr por limitaciones económicas o hábitos muy arraigados. Las modificaciones de la dieta incluyen aumentar el consumo de alimentos ricos en sustancias que favorecen la absorción del hierro no hemínico (ácido ascórbico, carne), disminuir el consumo de inhibidores de la absorción y aumentar el consumo de hierro hemínico (Olivares y Walter, 2003). La fortificación de los alimentos con hierro es la forma más práctica de prevenir la carencia de hierro (INACG, 1977). Su principal ventaja es que el consumo de estos productos no requiere de una conducta activa del sujeto (Olivares y Walter, 2003). Cuando no se está consumiendo alimentos fortificados con hierro o se requiere proveer una gran cantidad de hierro en un período corto, se recomienda la suplementación con hierro medicinal (Hurrell, 2002). En los alimentos el hierro se encuentra, principalmente, como Fe-no hem y Fe-hem o asociado a hemoproteínas. El Fe-no hem está representado por fracciones de Fe+2 o Fe+3. Esta forma de hierro se encuentra en cantidades apreciables en los alimentos de origen vegetal y en los derivados lácteos (Yip, 2003). El Fe-hem se encuentra en todo tipo de carnes, vísceras y en la sangre de animales, aunque también existe un contenido muy bajo de Fe-hem en las semillas de las plantas, asociado a los anillos tetrapirrólicos de la clorofila (Santana et al., 1998). El metabolismo del hierro está regulado principalmente a través de su absorción. Ésta se lleva a cabo en el duodeno proximal. El enterocito regula la absorción de hierro según las necesidades del organismo: altos niveles corporales de hierro bloquean su absorción y bajos niveles la incrementan (Flanagan, 1989). Además de esto, la absorción de hierro es controlada por factores intraluminales, de la mucosa intestinal y sistémicos. Los factores intraluminales reguladores más importantes son la forma química del hierro y la presencia 6 de factores favorecedores o inhibidores. Los factores que intervienen en la absorción de hierro a nivel de la mucosa intestinal son la extensión de la superficie y motilidad intestinal, y entre los factores sistémicos se incluyen el estado de los depósitos de hierro, la velocidad de la eritropoyesis y la hipoxia (Cook, 1990). A pesar del alto contenido de Feno hem de los alimentos, su biodisponibilidad varía desde menos del 1% hasta el 20%, esto se debe a que otros nutrientes de la dieta pueden aumentar o disminuir su tasa de absorción (Hallberg, 1981; Lynch, 1997; Miret et al., 2003; Sandstrom, 2001), tales como ácido ascórbico, ácidos orgánicos y tejidos animales, que la facilitan; y fitatos, polifenoles, productos de digestión proteica, calcio, fibra y hierro hemínico, que la inhiben (Beard y Piñero, 1997). En cambio, la biodisponibilidad del Fe-hem, varía desde un 10% hasta un 30%, y al parecer sólo es afectada por las proteínas animales, como potenciador; y por el calcio como inhibidor (Hallberg et al., 1991; Hallberg y Sölvell, 1967; Layrisse y MartinezTorres, 1972). Se describe que el enterocito diferencia químicamente a los dos tipos de hierro para su absorción (Pizarro et al., 2005). El Fe-no hem es reducido desde el estado férrico (Fe+3) al ferroso (Fe+2) (Miret et al., 2003). La reducción ocurre en el borde en cepillo del enterocito por acción de la reductasa férrica duodenal (Dcytb) (Fleming y Bacon, 2005). Luego, el Fe+2 es transportado a través de la membrana plasmática del enterocito por un transportador de metales divalentes (DMT1) al interior de la célula (Beard y Piñero, 1997). El hierro absorbido puede pasar a ser parte de la reserva intracelular como ferritina o enviado a circulación (Fleming y Bacon, 2005). El transporte del Fe+2 desde el citosol hacia la circulación es realizado por una ferroportina IREG1 e inmediatamente es oxidado a su estado férrico por la hefestina, ferroxidasa que permite la unión del hierro a la transferrina, proteína transportadora de hierro (Muñoz y Molina, 2005). Se describe que el Fe-hem es solubilizado en la cámara gástrica y, sin ser modificado, se transporta en compañía del anillo de protoporfirina hacia el duodeno donde es absorbido 7 (Beard y Piñero, 1997), para lo que se requiere que previamente el anillo porfirínico sea separado de la globina en el lumen intestinal (Miret et al., 2003). Recientemente se ha descrito una proteína transportadora intestinal para el Fe-hem, la HCP-1 (Hem Carrier Protein) (Shayeghi et al., 2005) que internaliza al hierro hemínico hacia el enterocito por un mecanismo de endocitosis (Arredondo et al., 2008). Luego de que el Fe-hem ingresa al citoplasma del enterocito, la enzima hemoxigenasa libera los iones del metal, separándolos de la bilirrubina (Raffin et al., 1974) y los hace indistinguibles del Fe-no hem (Pizarro et al., 2005). Además se conoce que la absorción del Fe-hem es saturable (Pizarro et al., 2003). Figura 1: Esquema de la absorción intestinal de los distintos tipos de hierro. En los últimos años, se estableció una nueva vía de absorción de hierro, a través de la ferritina, que es una proteína de gran tamaño (12 nm de diámetro y 480.000 Da), constituida por 24 subunidades que forman una cubierta esférica, alrededor de un conglomerado de hasta 4500 átomos de hierro. Su función es almacenar grandes cantidades de hierro en su interior, en una forma biodisponible. (Theil, 2004). La ferritina es medianamente estable a la proteólisis (Crichton, 1971) y su absorción se realiza a través 8 de endocitosis mediante un receptor de alta afinidad, el cual aún no ha sido identificado (Theil, 2011). Una vez dentro del enterocito, el complejo proteico es degradado y los átomos de hierro pasan a ser parte del pool común de la célula (San Martín et al., 2008). Recientemente se comprobó que no existe competencia ni con la absorción de Fe-hem ni con la de Fe-no hem, lo que refuerza la teoría de una vía de absorción independiente (Theil et al., enviado a publicar a JNutr). La mayor parte del hierro administrado vía oral se absorbe durante las primeras dos horas (Fawwaz et al., 1966; Wheby y Crosby, 1963). Esto ha sido denominado como la fase rápida de la absorción intestinal de hierro y se correlaciona con el paso del bolo de hierro a través del lumen del duodeno y el yeyuno (Fawwaz et al., 1966). Durante las siguientes 24-48 horas, una cantidad adicional de hierro es absorbida. A esto se ha denominado como la fase lenta de la absorción intestinal de hierro y se correlaciona con la presencia de hierro en el lumen del intestino delgado distal y colon. Por otra parte, se ha sugerido que el hierro absorbido en la fase lenta se debe a hierro retenido en la parte proximal del intestino delgado (Wheby y Crosby, 1963).Además, en ratas ha sido demostrada la expresión de transportadores de hierro no hemínico a nivel colónico y que esta expresión aumenta en situaciones de deficiencia de hierro (Johnston et al., 2006; Takeuchi et al., 2005).En 1963, Ohkawara et al., logró demostrar que el intestino grueso humano era capaz de absorber pequeñas cantidades de hierro no hemínico. Los prebióticos Los prebióticos se definen como ingredientes, principalmente carbohidratos no digestibles, que afectan beneficiosamente al organismo mediante la estimulación selectiva del crecimiento y actividad de una o varias poblaciones bacterianas de la flora normal del colon. Para que un ingrediente alimentario sea clasificado como prebiótico se debe cumplir que no sea hidrolizado ni absorbido en la parte superior del tracto 9 gastrointestinal, ser un sustrato selectivo para una o un número limitado de bacterias comensales beneficiosas del colon y, por consiguiente, ser capaz de alterar la flora colónica en favor de una composición más saludable, y así, inducir los efectos sistémicos que son beneficiosos para la salud del huésped. Comparados con probióticos, que introducen bacterias exógenas hacia el lumen, los prebióticos estimulan el crecimiento preferencial de un número limitado de bacterias, especialmente, aunque no exclusivamente, Lactobacillus y Bifidobacterium (Van Loo, 2004). El consumo de productos lácteos fermentados (fuente de probióticos) se ha asociado históricamente con beneficios para la salud, como por ejemplo efectos contra enfermedades causadas por el desbalance de la flora intestinal (Sanders, 1994). Además se sabe de sus efectos positivos en múltiples trastornos del sistema digestivo (constipación, diarrea, deficiencia de microflora, indigestión, acidez, ente otras) y de otros sistemas o multisistémicos (diabetes, hipercolesterolemia, obesidad, osteoporosis, desordenes de hígado y riñón, entre otras) (Hitchins y Mcdonough, 1989). Entre los ingredientes alimentarios candidatos a prebióticos se encuentran, hidratos de carbono no digestibles (oligo y polisacáridos), algunos péptidos y proteínas, y ciertos lípidos (Gibson y Roberfroid, 1995). Se encuentran comúnmente en trigo, vegetales como cebolla, achicoria, ajo, puerros y alcachofas y frutas como el plátano (Quera et al., 2005) Al llegar al colon, los prebióticos son fermentados por bacterias endógenas lo que da lugar a la producción de ácidos grasos de cadena corta (AGCC) como el butírico, el acético, el láctico y el propiónico (Macfarlane et al., 2007; Nicholson et al., 2005). También se producen H 2 , CO 2 y una disminución del pH intestinal a <5.0. Esto último, previene el crecimiento de patógenos y promueve la proliferación de Lactobacillus y Bifidobacterium, bacterias pertenecientes a la flora benéfica (Forchielli y Walker, 2005). Los AGCC se absorben en el intestino, contribuyendo a la homeostasis del NaCl y del agua en el colon. 10 Posteriormente pasan a la vena porta para ser metabolizados en el hígado (Macfarlane et al., 2007). Ha sido sugerido que los prebióticos podrían aumentar la biodisponibilidad del hierro dietario. A pesar de que los mecanismos involucrados no han sido completamente dilucidados, la fermentación mibrobiana de estos compuestos en el intestino grueso podría jugar un rol fundamental (Yeung et al., 2005). Respecto a prebióticos y el efecto que producen en la absorción de hierro existen muy pocos estudios, no concordantes entre sí y casi no existen en humanos. Estudios in vitro En estudios in vitro con células Caco-2 se estimó la biodisponibilidad de Fe como producción de ferritina. La inulina en cantidades de 40 g por kilo de porotos no aumentó significativamente la disponibilidad de hierro de los porotos (Laparra et al., 2009). Otro estudio evaluó el efecto de la inulina sobre la captación de hierro por parte de células Caco-2 desde soluciones de sulfato ferroso (FeSO 4 ) y FeEDTA. Los autores concluyeron que la inulina aumentaba la absorción de hierro desde la solución de FeEDTA, pero no desde FeSO 4 . Los autores atribuyeron esta diferencia a que la inulina, probablemente, formó complejos inulina-Fe, disminuyendo la difusión del hierro por la membrana apical de los enterocitos (Laparra et al., 2008). En ambos estudios, el efecto de la inulina no se midió en presencia de bacterias que pudieran fermentarla, por lo tanto no se está evaluando el efecto prebiótico, sino que solamente el efecto de la inulina sobre el hierro. Estudios en modelos animales En ratas, se logró establecer que la adición de prebióticos galactooligosacáridos (GOS) y simbióticos (mezcla de prebióticos y probióticos) a una fórmula infantil, ingeridos por 30 11 días, aumentaba la absorción de hierro cuando éstos se encontraban en una concentración del 10%. En este estudio se determinó, además, que la principal porción del intestino involucrada en la estimulación de la absorción de hierro era el colon. La cantidad de hierro absorbido se determinó por la diferencia entre el hierro ofrecido a ratas en las dietas y la cantidad de hierro en las heces medido por espectrometría de absorción atómica (Pérez-Conesa et al., 2007). Validando la tesis de que los prebióticos mejoran la absorción de hierro se encuentra el trabajo de Sakai et al., el cual probó en ratas al efecto de fructooligosacáridos (FOS) de cadena corta en ratas anémicas. Sakai pudo demostrar que la adición de estos FOS a la dieta prevenía la caída del hematocrito y hemoglobina producida en ratas gastroectomizadas (Sakai et al., 2000). Sin embargo, no se ha podido encontrar un incremento en el hierro sérico y capacidad de unión a hierro (Ohtaet al., 1998). En cerdos deficientes en hierro, se determinó que la suplementación con inulina no promovía la absorción colónica de este micromineral (Patterson et al., 2009). Estudios en humanos Existen en la literatura sólo dos estudios en humanos. Uno, mediante el método de balance mineral con recolección de heces y orina, mostró el no efecto de la inulinasobre la absorción de hierro en adultos sanos (Coudray et al., 1997). Un segundo estudio, mediante la técnica doble isotópica con isótopos estables, investigó el efecto de prebióticos como inulina, oligofructosa y GOS. Ninguno de los compuestos testeados mostró efectos sobre la absorción de hierro (Van Den Heuvel et al., 1998). Respecto al hierro hemínico no existen estudios que hayan evaluado el posible efecto que tendrían los prebióticos sobre su absorción. Existen algunos estudios que determinaron que los prebióticos aumentaban la absorción de otros minerales como el calcio y magnesio (Coudray et al., 2003; Scholz-Ahrens et al., 12 2007; Scholz-Ahrens y Schrezenmeir, 2007; Wang et al., 2010). La principal explicación que se propone en estos estudios es que las fibras utilizadas contrarrestan el efecto de los fitatos, potente inhibidor de la absorción de estos minerales, ya que se podrían unir a ellos (Wang et al., 2010). Los fitatos también afectan en forma negativa la absorción de hierro (Beard y Piñero, 1997), por lo que este mismo mecanismo de acción podría estar involucrado. Otros mecanismos propuestos son el aumento de solubilidad de los minerales, aumento de la superficie de absorción promoviendo la proliferación de enterocitos mediada por los productos de fermentación bacteriana, aumento de la expresión de proteínas involucradas en la absorción del calcio y degradación del complejo mineral-ácido fítico (Scholz et al., 2007). Problema de investigación: ¿Cuál es el efecto de los prebióticos sobre la biodisponibilidad de hierro hem y no hem? 13 Hipótesis Hipótesis: El consumo de prebióticos aumenta la biodisponibilidad de hierro en el humano. Hipótesis Nula: El consumo de prebióticos no promueve la absorción de hierro. Objetivo general Determinar el efecto del consumo de prebióticos sobre la biodisponibilidad de hierro. Objetivos específicos 1. Determinar el efecto del consumo de un yogurt más mix de prebióticos sobre la biodisponibilidad de Fe-no hem. 2. Determinar el efecto del consumo de un yogurt más mix de prebióticos sobre la biodisponibilidad de Fe-hem. Para alcanzar estos objetivos se realizó un protocolo de absorción de hierro en humanos. En este protocolo se determinó el efecto del yogurt + mix de prebióticos sobre los dos tipos de hierro (objetivos 1 y 2). También se estudió un grupo control para comparación. Los porcentajes de biodisponibilidad de Fe fueron sometidos a análisis de varianzas de dos vías para muestras repetidas. 14 Materiales y Métodos El estudio fue realizado en el Laboratorio de Micronutrientes del Instituto de Nutrición y Tecnología de los Alimentos (INTA), de la Universidad de Chile. Métodos Como trazadores de la absorción de hierro se utilizaron isótopos de hierro 55 Fe y 59 Fe (NEN, Life Science Products, Inc., Boston, MA). Las dosis de isótopos administradas fueron autorizadas por la Comisión Chilena de Energía Nuclear. Las ingestas se realizaron los días 1, 2, 15 y 16; y los días 15 y 29 se extrajeron 30 y 20 ml de sangre respectivamente. Con 10 ml de sangre del día 15 se determinó el estado de nutrición de hierro de los voluntarios: hemoglobina y VCM (Contador electrónico de células CELL-DYN 1700, ABBOTT Diagnostics, Abbott Park, IL), Fe sérico, TIBC y % de saturación de la transferrina (Fischer y Price, 1964), protoporfirina libre eritrocitaria (Hematofluorímetro ZP-M206D, AVIV Biomedical Inc., Lakewood, NJ), ferritina sérica por ELISA (INACG, 1985) y receptor de transferrina por ELISA (Human sTrF, BioVendor, Laboratorní Medicína AS, Modrice, República Checa). Con 20 ml de sangre de los día 15 y 29 se medió la radiactividad circulante (cpm/ml) según técnica doble isotópica de Eakins y Brown (Eakins y Brown, 1966). Para el cálculo de la radiactividad ingerida se contaron cuadruplicados de los compuestos marcados con 55 Fe o 59 Fe. La biodisponibilidad del Fe se calculó a partir de duplicados de sangre de los voluntarios, asumiendo que el 80% del hierro absorbido es destinado a la síntesis de hemoglobina de los eritrocitos circulantes y este 80% se alcanza a los 14 días post ingesta(Bothwell et al., 1979). La volemia se estimó desde las tablas de Tulane (Nadler et al., 1962). Las muestras fueron contadas el tiempo necesario hasta obtener un error menor al 3% en un contador de centelleo líquido (Packard 1600TR TriCarb Scintillation Counter System, Meriden CT). La muestra de sangre y las ingestas de los compuestos se efectuaron luego de ayuno nocturno. Sólo después de 3 horas de 15 administrada los compuestos estuvo permitida la ingesta de alimentos. Desde el día 3 al 14, los sujetos consumieron diariamente un yogurt, con o sin agregado de prebióticos, según correspondiera. Este yogurt era entregado diariamente en el domicilio de los sujetos y era consumido en presencia de los trabajadores de terreno. Prebióticos Los prebióticos fueron entregados a través de un yogurt líquido sabor frutilla en botellitas de 200 ml elaborado por Danone Argentina. Se utilizó polidextrosa, inulina, goma arábiga y goma guar como fuente de prebióticos en una cantidad de 2 gramos en total. Marcación isotópica del hierro hemínico Para obtener hierro hemínico marcado intrínsecamente y no marcado se utilizaron terneros Holstein-Fresian de tres meses de edad y corderos adultos Hampshire Down. Hem marcado con 55 Fe: En un trabajo previo se obtuvo hem marcado intrínsecamente con 55Fe desde sangre de los terneros (Valenzuela, 2007). Hem no marcado (hem frío): Tres corderos fueron exsanguinados para obtener sangre sin marca isotópica, la cual fue utilizada para completar las dosis de hierro isotópico. Este protocolo se encuentra aprobado por el Comité de Bioética para la experimentación en Animales del INTA. Todas las intervenciones fueron realizadas por un Médico Veterinario. Las dosis de radioisótopos indicadas no provocaron ninguna sintomatología a los animales y al momento de su exsanguinación fueron previamente tranquilizados con anestésicos inyectables. La muerte se produjo por anemia aguda y sin dolor para el animal. Los cuerpos de los corderos y los restos del ternero fueron cubiertos con cal y 16 guardados en el depósito de desechos radiactivos, que dispone el INTA de acuerdo a las normas relativas al manejo de material radiactivo, para su posterior eliminación por la Comisión Chilena de Energía Nuclear. Extracción de hem De sangre de vacuno y ovino se extrajo el hem mediante la técnica de Labbé y Nishida (Labbé y Nishida, 1957). La sangre fue recibida en recipientes con anticoagulante. La hemina, marcada y no marcada, fue separada de la hemoglobina mezclando la sangre con acetona y cloruro de estroncio al 2% en ácido acético glacial y llevada a punto de ebullición, con el fin de solubilizar la hemina y precipitar proteínas; las que fueron filtradas. Una vez hecha la filtración, la muestra se calentó a 100°C para evaporar la acetona y el agua; y se dejó enfriar a temperatura ambiente. Luego se centrifugó por 10 minutos a 2500 RPM, en tubos de 100ml. Se eliminó el sobrenadante y finalmente los tubos se llevaron a secado en estufa con lo que se obtuvo hemina en forma de polvo. En todos los procedimientos se utilizaron reactivos de alta pureza (Merck). Estudios de Biodisponibilidad en Humanos Análisis estadístico Muestra: las causas de las variabilidades fisiológicas y variación día a día que presenta la absorción de hierro, en un mismo individuo (intra sujeto), no han sido plenamente identificadas, pero presumiblemente se asocian con cambios en la motilidad gastrointestinal y las secreciones gástrica, pancreática o biliar (Layrisse y Martínez-Torres, 1972); sin embargo, es adecuado realizar protocolos de absorción de hierro, incluyendo grupos de entre 12 y 13 sujetos con un mínimo de 8 por protocolo de absorción (Cook y 17 Lipschild, 1977), por otra parte, en un modelo de ANOVA, 9 sujetos son suficientes para determinar diferencias de ±1 desviación estándar (DS) de la misma variable (absorción de hierro), con un error α = 0,05 y un poder = 80%. Basado en lo anterior, se decidió trabajar con 12 sujetos teniendo en cuenta las posibles pérdidas durante el protocolo experimental, ya sea por rechazo a la ingesta o efectos laterales no deseados después de la ingesta. Análisis: Se realizó estadística descriptiva a cada una de las variables y se describieron como promedio y desviación estándar (DS). Dado que los valores de absorción y biodisponibilidad de hierro presentan una distribución asimétrica en la población normal, éstas fueron transformadas a sus logaritmos naturales (ln) antes de realizar las comparaciones para demostrar la hipótesis y posteriormente se retransformaron estos resultados mediante el uso del antilogaritmo, con el fin de reportarlos como promedios geométricos y rangos de ±1 DS en las unidades originales. Para medir el efecto de los prebióticos, los lnde las variables de absorción de Fe se sometieron a la prueba ANOVA de dos vías para muestras repetidas. Las variables hematológicas y bioquímicas que miden estado de nutrición de hierro fueron comparadas con la prueba t de Student. Sujetos experimentales Se seleccionaron 12 mujeres en edad fértil (entre 35 a 45 años) para cada protocolo de absorción (tratamiento y control), las cuales estaban aparentemente sanas, no presentaron patologías del tracto gastrointestinal y no consumieron fármacos ni suplementos de minerales o multivitamínicos durante los 6 meses anteriores ni durante el estudio. Dado que se utilizaron isótopos radioactivos, sólo se permitió la participación a mujeres que usaban un método anticonceptivo (dispositivo intrauterino, anticonceptivos orales, ligadura de trompas) y previo a los protocolos de biodisponibilidad de hierro se les realizó una prueba de embarazo (hCG Combo Cassetteforurine, serum and plasma, 18 inmunoensayocromatográfico, sensibilidad del test: 25 mIUhCG/mL orina), en donde la muestra correspondió a tres gotas de orina de primera micción. Todas las participantes asistieron a una reunión informativa en la cual se les explicó, en lenguaje simple y en detalle, exactamente en qué consistía el estudio al cual se iban a someter y las precauciones que debían tomar para obtener un resultado satisfactorio. Luego de aclaradas sus dudas, procedieron a firmar un consentimiento aprobado por el Comité de Ética del INTA (Anexo 1). Al momento de empezar el estudio todas cumplieron con los requisitos de ingreso. Protocolo experimental Las mujeres seleccionadas asistieron al Laboratorio de Micronutrientes del INTA los días 1, 2, 15, 16 y 29 del protocolo, luego de un ayuno nocturno de 8 horas. En el día 1, se obtuvieron los pesos (báscula de plataforma marca SECA con una precisión de 50 g) y las tallas (tallímetro metálico de pared con una precisión de 0,1 cm) de cada uno de los sujetos, con el fin de calcular su volemia utilizando la tabla de Tulane (Nadler et al., 1962). Posteriormente, con los sujetos en ayunas, se realizaron dos protocolos de estudio de biodisponibilidad de hierro. Diseño estudio de biodisponibilidad grupo tratamiento (A) Día 1: Previo al tratamiento, la mitad de los sujetos ingirió 50 mL de una solución acuosa que contiene 3 mg de Fe-no hem como sulfato ferroso marcado con 1 uCi del isótopo 59FeCl 3 . La otra mitad ingirió 2 cápsulas que contienen glóbulos rojos de ternero desecados que contiene 3 mg de hierro hemínico marcado intrínsecamente con 3 uCi de 55Fe. 19 Día 2: Los sujetos que consumieron Fe-no hem recibieron las 2 cápsulas de Fe-hem y los que consumieron Fe-hem recibieron Fe-no hem. Todos los compuestos marcados de la misma forma que el día anterior. Día 3-14: Los sujetos consumieron diariamente una ración del producto en estudio (yogurt + mix de 2 g prebióticos). Día 15: Se tomó una muestra de 30 mL de sangre con el fin de medir la biodisponibilidad de hierro basal y el estado nutricional de hierro de los sujetos. Posteriormente, la mitad de los sujetos ingirió 50 mL de una solución acuosa que contiene 3 mg de Fe-no hem como sulfato ferroso marcado con 1 uCi del isótopo 59FeCl 3 . La otra mitad ingirió 2 cápsulas que contienen glóbulos rojos de ternero desecados que contiene 3 mg de hierro hemínico marcado intrínsecamente con 3 uCi de 55Fe. Dia 16: Los sujetos que consumieron Fe-no hem recibieron las 2 cápsulas de Fe-hem y los que consumieron Fe-hem recibieron Fe-no hem. Todos los compuestos marcados de la misma forma que el día anterior. Día 29: Se realizó una toma de muestra de 20 mL de sangre para medir biodisponibilidad de hierro post tratamiento. Diseño estudio de biodisponibilidad grupo control (B) Día 1: Previo al tratamiento, la mitad de los sujetos ingirió 50 mL de una solución acuosa que contiene 3 mg de Fe-no hem como sulfato ferroso marcado con 1 uCi del isótopo 59FeCl 3 . La otra mitad ingirió 2 cápsulas que contienen glóbulos rojos de ternero desecados que contiene 3 mg de hierro hemínico marcado intrínsecamente con 3 uCi de 55Fe. Día 2: Los sujetos que consumieron Fe-no hem recibieron las 2 cápsulas de Fe-hem y los que consumieron Fe-hem recibieron Fe-no hem. Todos los compuestos marcados de la misma forma que el día anterior. 20 Día 3-14: Los sujetos consumieron diariamente una ración de un yogurt de las mismas características del que consumió el grupo tratamiento pero sin el agregado de prebióticos. Día 15: Se tomó una muestra de 30 mL de sangre con el fin de medir la biodisponibilidad de hierro basal y el estado nutricional de hierro de los sujetos. Posteriormente, la mitad de los sujetos ingirió 50 mL de una solución acuosa que contiene 3 mg de Fe-no hem como sulfato ferroso marcado con 1 uCi del isótopo 59FeCl 3 . La otra mitad ingirió 2 cápsulas que contienen glóbulos rojos de ternero desecados que contiene 3 mg de hierro hemínico marcado intrínsecamente con 3 uCi de 55Fe. Dia 16: Los sujetos que consumieron Fe-no hem recibieron las 2 cápsulas de Fe-hem y los que consumieron Fe-hem recibieron Fe-no hem. Todos los compuestos marcados de la misma forma que el día anterior. Día 29: Se realizó una toma de muestra de 20 mL de sangre para medir biodisponibilidad de hierro post tratamiento. Evaluación del estado nutricional de hierro La determinación de las variables bioquímicas del estado nutricional de hierro, se pudo llevar a cabo a través de las siguientes pruebas: Hemoglobina (Hb) y volumen corpuscular medio (VCM): determinadas en un contador electrónico de células (CELL-DYN 1700, ABBOTT Diagnostics, Abbott Park, IL). Ferritina sérica (FS): se realizó mediante una prueba de ELISA en sándwich, para lo cual, se utilizó como anticuerpo primario anti-ferritina (Ref: A0362) y como secundario antiferritina conjugado con peroxidasa (Ref: A0031), ambos de marca Dako Corporation. Hierro sérico: se realizó mediante fotocolorimetría, utilizando el cromógeno TPTZ. 21 Capacidad total de unión a hierro (TIBC): según la metodología propuesta por Fischer y Price, 1964. Porcentaje de saturación de la transferrina (% Sat): se calculó mediante la fórmula de hierro en suero / TIBC (Fischer y Price, 1964). Protoporfirina libre eritrocitaria: (ZP Hematofluorímetro Modelo 206D, AVIV Biomedical Inc., Lakewood, NJ). Biodisponibilidad Para el cálculo de la biodisponibilidad se utilizó la técnica de doble marcaje isotópico descrita por Eakins y Brown, 1966, utilizando como trazadores los isótopos radioactivos 55 Fe y 59 Fe (NEN, Life Science Products, Inc., Boston, MA). En términos generales, cada una de las muestras se digirió en medio ácido y se precipitó el contenido total de hierro. Luego, se determinó la radioactividad emitida en un contador de centelleo líquido LS 5000 TD, para lo cual se utilizaron 2 muestras blanco, cuadruplicados de dos estándares (55Fe y 59 Fe) y sextuplicados de las muestras de cada sujeto. Las muestras permanecieron en el contador el tiempo necesario para tener un error menor al 3%; el equipo reportó las cuentas por minuto (cpm) de radioactividad emitida de 55Fe (carril A) y de 59Fe (carril B). En el Anexo 2 (Técnica de doble marcaje isotópico de Eakins y Brown) se describe en forma detallada los pasos que se siguieron para desarrollar esta técnica. Debido a que existe un traslape de las cuentas en cada uno de los carriles del contador de centelleo, se hizo necesario determinar la magnitud de este traslape y calcular a partir de esto la biodisponibilidad de hierro de la siguiente manera: 1) corrección de las cpm totales en cada carril por las muestras blanco; 2) corrección de las cpm para cada uno de los isótopos según el traslape; 3) cálculo de las cpm por mL de sangre para cada isótopo; 4) 22 cálculo de las cpm de cada isótopo por mg de solución ingerida; 5) cálculo del total de cpmcirculantes de cada uno de los isótopos; 6) cálculo del total de cuentas ingeridas de cada isótopo; 7) cálculo del porcentaje de absorción de cada isótopo y 8) cálculo de la biodisponibilidad de los isótopos. La tabla 1 muestra las fórmulas utilizadas en cada uno de los pasos mencionados anteriormente. Pasos 1 2 3 4 5 6 7 8 Ecuación cpm A = cpm en A – Promedio de los blancos en A cpm B = cpm en B – Promedio de los blancos en B cpm55Fe = cpm en A – cpm de traslape de B a A cpm59Fe = cpm en B – cpm de traslape de A a B cpm55Fe/mL sangre = cpm55Fe/ mL sangre analizada cpm59Fe/mL sangre = cpm59Fe/ mL sangre analizada cpm55Fe/mg solución = cpm Standard 55Fe/mg solución analizados cpm59Fe/mg solución = cpm Standard 59Fe/mg solución analizados cpm circulantes 55Fe = cpm55Fe/mL sangre* volemia cpm circulantes 59Fe = cpm59Fe/mL sangre* volemia cpm ingeridas 55Fe = mg de solución ingeridos * cpm55Fe/mg de solución cpm ingeridas 59Fe = mg de solución ingeridos * cpm59Fe/mg de solución % 55Fe absorbidas = cpm ingeridas 55Fe/cpm circulantes 55Fe*100 %59Fe absorbidas = cpm ingeridas 59Fe/cpm circulantes 59Fe*100 Biodisponibilidad de 55Fe = % 55Fe absorbido * 0,81 Biodisponibilidad de 59Fe = % 59Fe absorbido * 0,81 Tabla 1: Fórmulas utilizadas para el cálculo de la biodisponibilidad de Fe mediante la utilización de los isótopos 55Fe y 59Fe. 1 Corrección de Bothwell (80% del hierro ingerido se destina a eritropoyesis) Para los cálculos de biodisponibilidad de los días 15 y 16 se les restó la radiactividad contada de los días 1 y 2, para evitar sobreposición de ésta. 23 Resultados Los 24 sujetos que aceptaron participar en el estudio terminaron los protocolos. El estado de nutrición de hierro de los sujetos estudiados fue relativamente normal (Tablas 2 y 3). No hubo sujetos con anemia por deficiencia de hierro (Hb<120 g/L más dos de los parámetros de nutrición de hierro alterados: VCM<80 fL y/o Zpp>80 ug/dL GR y/o Sat<15% y/o FS<12 ug/dL). Tampoco se observó la presencia de deficiencia de hierro sin anemia (Hb normal más dos de los parámetros de nutrición de hierro alterados) ni de depósitos de hierro depletados (Ferritina sérica <12 ug/L). ARC AVP BCA CMS KMD MAR MCR MMS RGR RLP TAR WWE Media DS Edad (a) IMC (Kg/m2) Hb (g/L) VCM (fL) Zpp (ug/dL GR) Fe (ug/dl) TIBC (ug/dL) Sat (%)* FS (ug/L)* 39 34 34 35 36 40 42 37 35 46 34 36 29.0 23.3 22.3 23.8 29.8 29.8 24.9 27.0 25.0 27.4 25.1 22.9 13.8 14.0 13.5 13.3 12.8 13.8 12.5 13.9 14.9 13.7 13.9 13.0 88 86 86 89 86 85 92 87 92 92 92 96 59 57 57 74 74 59 59 53 53 74 93 70 285 311 302 349 320 323 277 314 349 225 300 297 32 30 41 27 14 11 36 39 29 17 30 55 22.2 20.6 34.6 8.1 11.6 11.3 11.9 26.4 26.3 16.4 21.4 30.5 92 92 125 93 45 34 100 122 102 37 89 163 37 25.9 13.6 89 65 304 30 18.4 82.6 4 2.7 0.6 4 12 33 12 11.6-29.1 50.3-135.7 Tabla 2: Antropometría y estado nutricional de hierro de sujetos del grupo tratamiento (A). *Promedio Geométrico y rango ±1DE. Con respecto al Grupo A (tratamiento), el promedio de edad de las 12 participantes fue 37 ± 4 años. El índice de masa corporal (IMC) promedio fue de 25.9 ± 2.7 Kg/m2 y el estado 24 nutricional de la muestra, valorado por este índice, fue 5 normales (IMC 18.5 – 24.9) y 7 con sobrepeso (IMC entre 25 a 29.9). ACG CHR GME GBS GCG ICM JPC JCR JAV MGF MJA POG Media DS Edad (años) IMC (Kg/m2) Hb (g/L) VCM (fL) Zpp (ug/dL GR) Fe (ug/dl) TIBC (ug/dL) Sat (%)* FS (ug/L)* 47 40 44 36 48 42 35 40 43 42 40 39 22.9 29.4 27.2 25.5 27.9 29.6 25.6 26.2 23.8 19.2 22.8 19.1 14.3 12.2 12.0 12.5 12.7 13.9 13.7 14.3 13.5 13.9 13.2 14.2 89 85 81 81 89 83 84 92 82 88 89 91 49 73 76 51 50 61 67 52 74 77 61 57 294 438 380 259 259 325 400 288 366 403 343 262 30 10 7 31 41 27 20 26 19 13 39 32 23.8 5.4 4.5 24.9 35 20.9 16.9 18.9 3.5 4.5 11.5 20.8 89 43 27 79 107 89 80 75 68 53 133 83 41 24.9 13.3 86 62 335 25 12.4 71.7 4 3.5 0.8 4 11 63 11 5.5-27.7 46.9-109.8 Tabla 3: Antropometría y estado nutricional de hierro de sujetos del grupo control (B). *Promedio Geométrico y rango ±1DE. En el Grupo B (control), el promedio de edad de las 12 participantes fue 41 ± 4 años. El índice de masa corporal (IMC) promedio fue de 24.9 ± 3.5 Kg/m2 y el estado nutricional de la muestra, valorado por este índice, fue 5 normales y 7 con sobrepeso. No se observaron diferencias estadísticamente significativas en estos parámetros entre ambos grupos (t de Student>0.05). Los promedios de los parámetros que miden estado de nutrición de hierro [hemoglobina (Hb), volumen corpuscular medio (VCM), Protoporfirina libre eritrocitaria (FEP), Saturación de la transferrina (%Sat) y ferritina sérica (FS)] no presentaron diferencias significativas. En resumen, los dos grupos presentaron su estado de nutrición general de hierro comparable. 25 Análisis de los datos de biodisponibilidad de hierro: los valores de biodisponibilidad de hierro se distribuyen asimétricamente, por lo tanto los datos individuales se transformaron a su ln y se calculó el promedio geométrico. Las curvas de los promedios geométricos de absorción de hierro se expresaron en % de biodisponibilidad. Biodiosponibilidad de hierro del grupo en tratamiento: la tabla 4 muestra las biodisponibilidades individuales del grupo tratamiento (A). Biodisponibilidad de Fe (%) 55 Hem 59 Fe 55 59 Hem Post-ingesta Fe Post-ingesta Índice de absorción C/A D/B ARC AVP BCA CMS KMD MAR MCR MMS RGR RLP TAR WWE A 15.6 19.6 12.8 25.3 32.1 5.7 11.6 8.4 16.8 9.2 7.7 3.1 B 21.4 18.9 37.9 35.3 28.7 12.5 24.7 12.8 36.5 18.2 20.1 7.5 C 33.1 25.8 13.8 31.2 19.6 11.8 20.7 10.2 21.8 11.9 18.6 14.9 D 40.2 27.0 17.7 17.3 5.8 8.4 28.2 11.5 26.8 25.2 39.1 26.8 2.1194 1.3158 1.0787 1.2337 0.6087 2.0621 1.7942 1.2049 1.2933 1.2825 2.4041 4.7494 1.8745 1.4307 0.4662 0.4897 0.2027 0.6694 1.1404 0.8995 0.7357 1.3858 1.9452 3.5638 PG* - 1 DS 11.7 6.1 20.7 12.7 18.2 12.3 19.8 10.9 1.55 0.93 0.96 0.44 +1 DS 22.5 33.8 26.7 36.2 2.58 Tabla 4: Absorciones individuales del Grupo Tratamiento (A). * Promedio Geométrico y rango de 1 ±DE 2.08 Los promedios geométricos de biodisponibilidad de este grupo fueron de 11.7 y20.7% para Fe-hem y Fe-no hem pre-ingesta de yogurt con prebióticos; y de18.2 y 19.8% para Fehem y Fe-no hem post-ingesta de yogurt con prebióticos. Al calcular las razones de las 26 biodisponibilidades respecto a basal, los promedios geométricos resultaron ser de 1.55 para Fe-hem y de 0.96 para Fe-no hem. Biodiosponibilidad de hierro del grupo control: la tabla 5 muestra las biodisponibilidades individuales del grupo control (B). Biodisponibilidad de Fe (%) 55 Hem 59 Fe 55 59 Hem Post-ingesta Fe Post-ingesta Índice de absorción C/A D/B ACG CHR GME GBS GCG ICM JPC JCR JAV MGF MJA POG A 19.2 21.1 27.7 12.7 12.3 20.6 12.5 10.0 41.6 17.1 13.4 9.2 B 32.9 88.8 76.3 17.7 15.2 17.0 18.3 27.1 38.4 42.2 20.6 27.0 C 22.5 27.8 21.7 11.2 13.5 21.3 9.6 13.1 32.6 23.5 11.2 14.8 D 30.1 92.5 90.3 13.8 12.9 13.4 21.6 24.3 55.3 33.2 31.5 26.7 1.17 1.32 0.78 0.88 1.10 1.03 0.77 1.31 0.78 1.38 0.84 1.61 0.91 1.04 1.18 0.78 0.85 0.78 1.18 0.90 1.44 0.79 1.53 0.99 PG* - 1 DS 16.5 10.6 29.6 16.6 17.3 11.6 29.8 15.2 1.05 0.81 1.00 0.80 +1 DS 25.6 52.9 25.8 58.5 1.36 Tabla 5: Absorciones individuales del Grupo Control (B). * Promedio Geométrico y rango de 1 ±DE 1.27 Los promedios geométricos de biodisponibilidad de este grupo fueron de 16.5 y29.6% para Fe-hem y Fe-no hem pre-ingesta de yogurt sin prebióticos; y de17.3 y 29.8% para Fehem y Fe-no hem post-ingesta de yogurt sin prebióticos. Al calcular las razones de las biodisponibilidades respecto a basal, los promedios geométricos resultaron ser de 1.05 para Fe-hem y de 1.00 para Fe-no hem. 27 Al aplicar la prueba de ANOVA de dos vías para muestras repetidas al efecto de prebióticos sobre la biodisponibilidad de hierro según tipo de hierro se observó; para Feno hem un F=3.28 (N.S.) para efecto tratamiento, F=0,02 (N.S.) para efecto tiempo y un F=0.04 (N.S.) para la interacción tratamiento-tiempo (Figura 2). Figura 2: Efecto del prebiótico sobre la absorción de hierro no hemínico. Para Fe-hem un F=0.65 (N.S.) para efecto tratamiento, un F=8.69 (p<0.007) para efecto tiempo y un F=5.57 (p<0.028) para la interacción tratamiento-tiempo (Figura 3). 28 Figura 3: Efecto del prebiótico sobre la absorción de hierro hemínico. 29 Discusión Los prebióticos, como inulina, goma guar, polidextrosa y goma arábiga, utilizados en el presente estudio pasan a través del estómago y el intestino delgado sin ser mayormente digeridos (Gibson y Roberfroid, 1995) y se retienen en el intestino grueso. Los prebióticosactúan como sustrato para la flora bacteriana benéfica provocando un crecimiento selectivo de bacterias como bifidobacterias y lactobacilos, a expensas de poblaciones patógenas como clostridia, enterobacteria, entre otras (Gibson et al., 2004; Rastal et al., 2005). Esta proliferación de flora benéfica genera un incremento en la producción de ácido grasos de cadena corta (AGCC) que proveen de energía a la mucosa colónica, y como consecuencia producen una acidificación del pH a nivel colónico (Macfarlane et al., 2007; Nicholson et al., 2005). Se ha sugerido que los prebióticos podrían aumentar la biodisponibilidad del hierro dietario posiblemente por acción de la fermentación microbiana de estos compuestos en el intestino grueso (Yeung et al., 2005). Respecto a prebióticos y el efecto que producen en la absorción de hierro existen muy pocos estudios y sólo existen dos en humanos. El hierro es un elemento esencial requerido por los seres vivos para un amplio espectro de funciones. Sin embargo, el exceso de hierro puede producir la generación de radicales libres que pueden ser tóxicos para los componentes celulares. Debido a esto, la cantidad de hierro debe ser estrictamente regulada para prevenir su deficiencia o exceso (Takeuchi et al., 2005). Al no existir un sistema de excreción de este mineral, dicha regulación se realiza a nivel de absorción intestinal. El duodeno es la principal región intestinal donde se absorbe el hierro dietario. La dieta occidental ofrece aproximadamente 10 mg de Fe diarios de los cuales se estima que sólo el 10% se absorbe en el duodeno y que el 90% restante del hierro consumido pasa sin ser absorbido hacia el intestino delgado distal y colon. Se presume que este exceso de hierro es simplemente excretado en las 30 heces. Curiosamente, la evidencia reciente sugiere que el colon proximal, específicamente el ciego en ratas, puede tener cierta capacidad de captación y absorción de Fe-no hem (Bougle et al., 2002; Campos et al., 1996), aunque la naturaleza de esta vía de transporte es desconocida. Otros estudios, que también utilizaron ratas como modelo, han sugerido que el íleon podría absorber parte del Fe-no hem, pero a un nivel mucho menor que el duodeno (Chowromootoo et al., 1992a; Chowromootoo et al., 1992b). La absorción de cada tipo de hierro es independiente entre sí. El hierro no hemínico es reducido de ferroso (Fe+3) a férrico (Fe+2) por una reductasa férrica citocromo b ubicada en el borde apical del enterocito (McKie et al., 2001). El hierro férrico es transportado hacia el interior del enterocito por el transportador de metales divalentes DMT1 (Beard y Piñero, 1997). Por otro lado, el hierro hemínico parece ser transportado intacto (junto a su anillo protoporfirínico) desde el lumen intestinal hacia el enterocito a través de la actividad de la proteína transportadora de hierro heme HCP1 (Shayeghi et al., 2005) que internaliza al hierro hemínico hacia el enterocito por un mecanismo de endocitosis (Arredondo et al., 2008). Luego, por la acción de la enzima hemoxigenasa, el hierro hemínico es desamblado y el hierro liberado entra a las mismas vías que las tomadas por el hierro no hemínico (Pizarro et al., 2005). Dentro del enterocito el hierro puede tener dos destinos, uno como reserva en forma de ferritina y otro ser exportado a través de la membrana basolateral del enterocito por acción de la ferroportina IREG1 siendo inmediatamente oxidado a su estado férrico por la hefestina que permite la unión del hierro a la transferrina, proteína transportadora de hierro a nivel sanguíneo (Muñoz y Molina, 2005). Curiosamente DMT1, IREG1, Dcytb y hefestina han sido detectados en células colónicas de modelos animales (Gunshin et al., 1997; McKie et al., 2000; Frazer et al., 2001; Takeuchi et al., 2005), lo que siguiere que a este nivel existiría un mecanismo similar de captación y absorción de Fe-no hem. Por otro lado, no hay información en la literatura que describa la presencia de HCP1, u otra vía de captación de Fe-hem en el colon. 31 Dados nuestros resultados, es decir, que solamente la absorción de Fe-hem fue favorecida por el consumo de prebióticos, podemos establecer que este efecto toma lugar en algún punto previo a que este hierro se haga indistinguible del hierro no-hem, ya sea a nivel luminal o de transporte trans-epitelial por medio de la HCP1. Resulta lógico pensar que si existe absorción de hierro no hemínico a nivel colónico, sumado al efecto acificador de pH que tienen los prebióticos a este nivel, debería haber habido un aumento en la biodisponibilidad de Fe-no hem. Sin embargo, esto no sucedió, lo que podría ser explicado porque en el presente estudio, los sujetos experimentales se encontraban en un adecuado estado de nutrición de hierro, no presentando depósitos depletados ni anemia por deficiencia este elemento, lo cual no sucedió en los trabajos presentados anteriormente, en modelos animales, donde la expresión de los genes de los transportadores de hierro se evidenciaba en situaciones experimentales de deficiencia de hierro (Johnston et al., 2006; Takeuchi et al., 2005). Por tanto presumimos que de haber absorción de hierro a nivel colónico en el humano este se daría solo en estados de deficiencia de hierro y/o con cantidades de prebióticos más altos que los entregados en el yogurt de este estudio. Lamentablemente no pudimos confirmar la disminución del pH en las deposiciones de nuestros sujetos para confirmar la efectividad de los prebióticos consumidos. Por otro lado, nuestros resultados coinciden con lo reportado por distintos autores en modelo porcino y estudios en humanos, donde no se encontró un efecto de los prebióticos sobre la absorción de Fe-no hem a nivel del intestino grueso, ni tampoco se evidenció un aumento a nivel general en su biodisponibilidad (Coudray et al., 1997; Patterson et al., 2009; Van Den Heuvel et al., 1998). 32 La absorción a nivel de duodeno está mediada también por variados factores que la afectan. Como agentes dietarios favorecedores de la absorción del Fe-no hem están las proteínas de la carne, alimentos fermentados (Layrisse et al., 1984) y ácido ascórbico (Stekel et al., 1985), el cual posee el efecto más notable. Entre los factores inhibidores de la absorción se encuentran los fitatos (Hallberg et al., 1987), fibra soluble (Simpson et al., 1981; Hallberg et al., 1987), caseína (Hurrel et al., 1989), soya (Cook et al., 1981) y taninos (Pizarro et al., 1994; Disler et al., 1975). La información disponible acerca de la absorción de Fe-hem es escasa y en contraposición a la del Fe-no hem, es poco afectada por factores intraluminales y de la dieta, entre los cuales se ha descrito que el calcio disminuye su absorción (Hallberg et al., 1991) y las proteínas la favorecen (Layrisse y Martinez-Torres, 1972), sin embargo, esta conclusión se basó en el aumento de la absorción de Fe-hem por parte de los individuos, después de ingerir una dosis de hemoglobina marcada con isótopos de Fe, junto a una porción de carne de vacuno y maíz, si bien la proporción de proteínas en estos alimentos es bastante alta, no se pueden descartar otros componentes de la matriz alimentaria que podrían estar afectando la absorción de Fe-hem. Un estudio realizado por García et al. (1996), sugirió que la carne ejercía un efecto favorecedor de la absorción de Fe-hem, lo que denominaron como factor carne. En estudios más actuales se logró determinar que es el estroma de eritrocito el responsable del aumento de la absorción de Fe-hem (Pizarro, 2008).Recientemente se ha demostrado en células Caco-2 que las proteínas de origen vegetal y animal que forman parte de una comida disminuyen la captación de Fe-hem, pero al estar de manera purificada aumentan la captación de Fehem (Villarroel et al., 2011), pero este efecto no se corroboró en estudios de absorción en humanos, donde las proteínas purificadas no ejercieron efecto alguno sobre la absorción de Fe-hem, excepto la proteína de la soya, que al entregarse como concentrado proteico, disminuyó la absorción de Fe-hem (Weinborn, 2008). Una posible explicación al aumento de la absorción y biodisponibilidad de Fe-hem sería que los prebióticos o sus productos de fermentación como lo son los AGCC, aumentaran 33 cualquiera de los compuestos favorecedores de la absorción de Fe-hem, o disminuyeran algunos de los inhibidores. Otra posibilidad es que de alguna forma los prebióticos aumentaran la expresión del receptor y transportador del Fe-hem, HCP1, como sucede con los transportadores de Fe-no hem en modelos animales. Una tercera explicación podría basarse en la utilización de Fe-no hem por parte de las bacterias, las cuales al aumentar en número estarían haciendo menos biodisponible al Fe-no hem y al no tener estas bacterias receptores de Fe-hem lo dejaría disponible para la absorción a nivel colónico. Con este diseño de estudio no es posible determinar por cuál de estos mecanismos (u otro no nombrado) o en qué lugar específicamente, se vio favorecida la absorción y biodisponibilidad de Fe-hem, por lo tanto se necesita más investigación para responder estas interrogantes. 34 Conclusión Se acepta parcialmente la hipótesis ya que por los resultados obtenidos se demuestra que el consumo habitual de yogurt con agregado de prebióticos aumenta en 55% la biodisponibilidad de hierro hemínico, y no produce cambios en la absorción del Fe nohem. 35 Bibliografía • Arredondo M, Kloosterman J, Núñez S, Segovia F, Candia V, Flores S, Le Blanc S, Olivares M, Pizarro F. Heme iron uptake by Caco-2 cells is a saturable, temperature sensitive and modulated by extracellular pH and potassium. Biol Trace Elem Res 125:109-119, 2008. • Beard J, Piñero D. Metabolismo del hierro. En: O’ Donnell A, Viteri F, Carmuega, E. Desnutrición oculta en Latinoamérica: Deficiencia de hierro. Buenos Aires, Centro de estudio sobre nutrición infantil 13-47, 1997. • Bothwell T, Charlton R, Cook J, Finch C. Iron metabolism in man. Blackwell Scientific Oxford, England, 1979. • Bougle D, Vaghefi-Vaezzadeh N, Roland N, Bouvard G, Arhan P, Bureau F. Influence of short-chain fatty acids on iron absorption by proximal colon. Scand J Gastroenterol 37:1008–1011, 2002. • Campos M, Gomez-Ayala A, Lopez-Aliaga I, Pallares I, Hartiti S, AlfkrezM.Role of the proximal colon in mineral absorption in rats with and without ferropenic anemia. Nutr Res 16:1529–1543, 1996. • Chowrimootoo G, Debnam E, Srai S, Epstein O. Regional characteristics of intestinal iron absorption in the guinea-pig. Exp Physiol 77:177–183, 1992a. • Chowromootoo G, Gillett M, Debnam E, Srai S, Epstein O. . Iron-transferrin binding to isolated guinea pigenterocytes and the regional localization of intestinal iron transfer during ontogeny. Biochim Biophys Acta 1116:256–260, 1992b. • Conrad M, Umbreit J. Pathways of iron absorption. Blood Cells Mol Dis 29(3):336-355, 2002. • Cook J. Adaptation in iron metabolism. Am J Clin Nutr 51:301-308, 1990. • Cook J, Morck T, Lynch S. The inhibitory effect of soy products on non heme iron absorption in man. Am J Clin Nutr 34(12):2622-2629, 1981. 36 • Cook J, Lipschild D. Clinical measurement of iron absorption. Clin Hematol 6:567-581, 1977. • Cook J, Skikne B, Baynes R. Iron deficiency: the global perspective. (Abstract). AdvExp Med Biol 356:219-228, 1994. • Coudray C, Bellanger J, Castiglia-Delavaud C, Rémésy C, Vermorel M, Rayssignuier Y. Effect of soluble or partly soluble dietary fibres supplementation on absorption and balance of calcium, magnesium, iron and zinc in healthy young men. Eur J Clin Nutr 51:375-380, 1997. • Coudray C, Demigné C, Rayssiguier Y. Effects of Dietary Fibers on Magnesium Absorption in Animals and Humans. J Nutr 133:1-4, 2003. • Crichton R. Studies on the structure of ferritin and apoferritin from horse spleen. II. Chymotrypsin, subtilisin, cathepsin D and pepsin digestion of ferritin and apoferritin. Biochim Biophys Acta 229:75–82, 1971. • Dallman P, Siimes M, Stekel A. Iron deficiency in infancy and childhood. Am J Clin Nutr 33:86-118, 1980. • Darnton-Hill I, Web P, Harvey P, Hunt J, Dalmiya N, Chopra M, Ball M, Bloem M, De Benoist B. Micronutrient deficiencies and gender: social and economic costs. Am J Clin Nutr 81:1198-1199, 2005. • De Duve C. Prelude to a cell. The Sci 30(6): 22-28, 1990. • Diaz J, De Las Cagigas A, Rodriguez R. Micronutrient deficiencies in developing and affluent countries. Eur J Clin Nutr 57:70-72, 2003. • Disler P, Lynch S, Charlton R, Torrance J, Bothwell T, Walker R, Mayet F. The effect of tea on iron absorption. Gut 16(3):193-200, 1975. • Eakins J, Brown D. An improved method for the simultaneous determination of iron55 and iron-59 in blood by liquid scintillation counting. Int J Appl Radiact Isotopes 17:191-197, 1966. • Fawwaz R, Winchell H S, PollycoveM, Sargent T, Anger H, Lawrence J. Intestinal iron absorption studies using iron52 and Anger positron camera. I Nuc Med 7:569, 1966. 37 • Ferraz I, Daneluzzi J, Vannucchi H, Jordao A, Ricco R, Del Ciampo L, Martinelli C, D´AngioEngelberg A, Bonilha L, Custodio V. Prevalence of iron deficiency and its association with vitamin A deficiency in preschool children. J Pediatr 81:169-174, 2005. • Fischer D, Price D. A simple serum iron method using the new sensitive chromogentripyridil-s-triazine. Clin Chem 10:21-31, 1964. • Flanagan P. Mechanisms and regulation of intestinal uptake and transfer of iron. Acta Paediatr Scand 361:21-30, 1989. • Fleming R, Bacon B. Orchestration of iron homeostasis. N Engl J Med 352:1741-1744, 2005 • Forchielli M. Walker W. The effect of protective nutrients on mucosal defense in the immature intestine. Acta Paediatr 94:74-83, 2005. • Frazer D, Vulpe C, McKie A, Wilkins S, Trinder D, Cleghorn G. Cloning and gastrointestinal expression of rat hephaestin: relationship to other iron transport proteins. Am J Physiol281:G931–G939, 2001. • García M, Matínez-Torres C, Leets I, Topper E, Ramírez J, Layrisse M. Heat treatment on heme iron and iron-containing proteins in meat: Iron absorption in humans from diets containing cooked meat fractions. J Nutr Biochem 7(1):49-53, 1996. • Glantz S. Primer of biostatistics: The program V 3.02. McGraw–Hill Inc. 1992. • Gibson G, Roberfroid M. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 125:1401-1412, 1995. • Gunshin H, Mackenzie B, Berger U, GunshinY, Romero M, Boron W. Cloning and characterization of a mammalian proton-coupled metal-ion transporter. Nature388:482–488, 1997. • Hallberg L. Bioavailability of dietary iron in man. Annu Rev Nutr 1:123-147, 1981. • Hallberg L, Brune M, Erlandsson M, Sandberg A, Rossander-Hultén L. Calcium: effect of different amounts on non heme and heme iron absorption in humans. Am J Clin Nutr 53(1):112-119, 1991. 38 • Hallberg L, Rossander L, Skånberg A. Phytates and the inhibitory effect of bran on iron absorption in man.Am J Clin Nutr 45(5):988-996, 1987. • Hallberg L, Sölvell L. Absorption of hemoglobin iron in man. Acta Med Scand 181:335-354, 1967. • Hitchins A, Mcdonough F. Prophylactic and therapeutic aspects of fermented milk. Am J Clin Nutr 49:675-684, 1989. • Hurrel R. Fortification: overcoming technical and practical barriers. J Nutr 132:806812, 2002. • Hurrell R, Lynch S, Trinidad T, Dassenko S, Cook J. Iron absorption in humans as influenced by bovine milk proteins. Am J Clin Nutr 49(3):546-552, 1989. • International Anemia Consultative Group (INACG). Measurements of iron status. Washington: Nutrition Foundation 35-54, 1985. • Johnston K, Johnson D, Marks J, Srai S, Debnam E, Sharp P. Non-haem iron transport in the rat proximal colon. Eur J Clin Invest 36(1):35-40, 2006. • Labbé R, Nishida G. A method of hemin isolation. Biochim Biophys Acta 26:437, 1957. • Laparra J, Glahn R, Miller D. Assessing potential effects of inulin and probiotic bacteria on Fe availability from common beans (Phaseolus vulgaris L.) to Caco-2 cells. J Food Sci 74:40-46, 2009. • Laparra J, Tako E, Glahn R, Miller D. Inulin affects iron dialyzability from FeSO4 and FeEDTA solutions but does not alter Fe uptake by Caco-2 cells. J Agric Food Chem 56:2846-2851, 2008. • Layrisse M, Martínez-Torres C. Model for measuring dietary absorption of hem iron: test with a complete meal. Am J Clin Nutr 25:401-411, 1972. • Layrisse M, Martinez-Torres C, Leets I, Taylor P, Ramirez J. Effect of histidine, cysteine, glutathione or beef on iron absorption in humans. Brit J Nutr 52:37-46,1984. • Macfarlane G, Steed H, Macfarlane S. Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics. J Appl Microbiol 1:40-47. 2007. 39 • McKie A, Marciani P, Rolfs A, Brennan K, Wehr K, Barrow D. A novel duodenal ironregulated transporter, IREG1, implicated in the basolateral transfer of iron to the circulation. Mol Cell5:299–309, 2000. • Miret S, Simpson R, Mckie A. Physiology and molecular biology of dietary iron absorption. Annu Rev Nutr 23: 283-301, 2003. • Muñoz A, Molina A. Tratado de nutrición: Hierro. Acción Médica. Granada, España. 931-971, 2005. • Nadler S, Hidalgo I, Block T. The Tulane table of blood volume in normal man. Surgeon 51:224-232, 1962. • Nicholson J, Holmes E, Wilson I. Gut microorganisms, mammalian metabolism and personalized health care. Nature Rev Microbiol 3:1-8, 2005. • Ohkawara Y, Bamba M, Kinka, S, Masuda M. The absorption of iron from the human large intestine. Gastroenterol 44:611-614, 1963. • Ohta A, Ohtsuki M, Uehara M, Hosono A, Hirayama M, Adachi T Hara H. Dietary fructooligosaccharides prevent postgastrectomy anemia and osteopenia in rats. J Nutr 128:485-490, 1998. • Olivares M, Walter T. Consecuencias de la deficiencia de hierro. Rev Chil Nutr 30(3):226-233, 2003 • Palomo I, Olivares M, Arredondo M, Pizarro F. Hematología fisiopatología y diagnóstico: Alteraciones del metabolismo del hierro y de la síntesis del grupo hem. Ed. Universidad de Talca. Talca, Chile. 6:133-158, 2005. • Patterson J, Rutzke M, Fubini S, Glahn R, Welch R, Lei X, Miller D. Dietary inulin supplementation does not promote colonic iron absorption in a porcine model. J Agric Food Chem 57(12):5250-5256, 2009. • Pérez-Conesa D, López G, Ros G. Effect of Probiotic, Prebiotic and Synbiotic Follow-up Infant Formulas on Iron Bioavailability in Rats. Food Sci Tech Inter 13:69-77, 2007. • Pizarro F. Informe final proyecto FONDECYT 1061060: Efecto de las proteínas sobre la biodisponibilidad de hierro. 2008. 40 • Pizarro F, Olivares M, Kain J. Hierro y zinc en la población de Santiago. Rev Chil Nutr 32:19-27, 2005. • Pizarro F, Olivares M, Hertrampf E, Mazariegos D, Arredondo M. Heme-iron absorption pathway is saturable by heme-iron dose in humans. J Nutr 133:22142217, 2003. • Pizarro F, Olivares M, Hertrampf E, Walter T. Factors which modify the nutritional state of iron: tannin content of herbal teas. Arch Latinoam Nutr 44(4):277-280, 1994. • Quera R, Quigley E, Madrid A. El rol de los prebióticos, probióticos y simbióticos en gastroenterología. Gastr Latinoam 16(3):218-228, 2005. • Raffin S, Woo C, Roost K, Price D, Schmid R. Intestinal absorption of hemoglobin heme iron cleavage by mucosal hemeoxygenase. J Clin Invest 54:1344-1352, 1974. • Sakai K, Ohta A, Shiga K, Takasaki M, Tokunaga T, Hara H. The cecum and dietary short-chain fructooligosaccharides are involved in preventing postgastrectomy anemia in rats. J Nutr 130:1608-1612, 2000. • Sanders M. Lactic acid bacteria as promoters of human health. In: Goldberg I, ed. Functional foods. New York: Chapman and Hall 305-322, 1994. • Sandstrom B. Micronutrient interactions: effects on absorption and bioavailability. Br J Nutr 85:5-181, 2001. • Santana M, Pihakaski-Maunsbach K, Sandal N, Marcker K, Smith A. Evidence that the plant host synthesizes the heme moiety of leg hemoglobin in root nodules. Plant Physiol 116:1259-1269, 1998. • San Martin C, Garri C, Pizarro F, Walter T, Theil E, Núñez M. Caco-2 intestinal epithelial cells absorb soybean ferritin by mu2 (AP2)-dependent endocytosis. J Nutr 138:659666, 2008. • Schofield C, Ashworth A. Why have mortality rates for severe malnutrition remained so high?. Bull World Health Organ 74:223-229, 1996. 41 • Shayeghi M, Latunde-Dada G, Oakhill J, Laftah A, Takeuchi K, Halliday N, Khan Y, Warley A, Mccann F, Hideret, R. Identification of an intestinal heme transporter. Cell 122:789-801, 2005. • Scholz-Ahrens K, Ade P, Marten B, Weber P, Timm W, Açil Y, Glüer C, Schrezenmeir J. • Prebiotics, probiotics, and synbiotics affect mineral absorption, bone mineral content, and bone structure. J Nutr 137(3 Suppl 2):838S-846S, 2007. • Scholz-Ahrens K, Schrezenmeir J. Inulin and oligofructose and mineral metabolism: the evidence from animal trials. J Nutr 137(11 Suppl):2513S-2523S, 2007. • Simpson K, Morris E, Cook J. The inhibitory effect of bran on iron absorption in man.Am J Clin Nutr 34(8):1469-1478, 1981. • Singh R, Shaw J, Zimmet P. Epidemiology of childhood type 2 diabetes in the developing world. Pediatr Diabetes 5:154-168, 2004. • Stekel A, Olivares M, Pizarro F, Amar M, Chadud P, Cayazzo M, Llaguno S, Vega V, Hertrampf E. The role of ascorbic acid in the bioavailability of iron from infant foods.Int J Vitam Nutr Res Suppl27:167-175, 1985. • Takeuchi K, Bjarnason I, Laftah A, Latunde-Dada G, Simpson R, McKie A. Expression of iron absorption genes in mouse large intestine. Scand J Gastroenterol40:169-177, 2005. • Theil, E. Iron, Ferritin and Nutrition. Annu Rev Nutr24: 327-343, 2004. • Theil, E. Iron homeostasis and nutritional iron deficiency. J Nutr 141(4):724S-728S, 2011. • Valenzuela, C. Contribución al estudio del ión hierro en bovinos: cuantificación y distribución de las distintas formas de hierro en músculos y vísceras. Tesis Médico Veterinario. U Chile, Fac. Cs. Veterinarias y Pecuarias. 64p. 2007. • Van Den Heuvel E, Schaafsma G, Muys T, Van Dokkum, W. Nondigestible oligosaccharides do not interfere with calcium and non heme-iron absorption in young, healthy men. Am J Clin Nutr 67:445-451, 1998. 42 • Van Loo J. Prebiotics promote good health: the basis, the potential, and the emerging evidence. J Clin Gastroenterol 38 (Suppl6):70-75, 2004. • Villaroel P, Flores S, Pizarro F, de Romaña DL, Arredondo M. Effect of dietary protein on heme iron uptake by Caco-2 cells. Eur J Nutr [Epub ahead of print], 2011. • Weinborn, V. Efecto de proteínas de origen animal y vegetal sobre la biodisponibilidad de hierro hemínico. Tesis Médico Veterinario. Santiago, U Chile, Fac Cs Veterinaria y Pecuarias. 44p. 2008. • Wang Y, Zeng T, Wang S, Wang W, Wang Q, Yu H. Fructo-oligosaccharides enhance the mineral absorption and counteract the adverse effects of phytic acid in mice. Nutrition 26(3):305-310, 2010. • Wheby M, Crosby W. The gastrointestinal tract and iron absorption. Blood 22:416, 1963. • World Health Organization (WHO). Micronutrient deficiencies. [en línea]. ‹http://www.who.int/nutrition/topics/ida/en/print.html› 2007. • Yip R. Hierro. En: Bowman B, Russell R, editors. Conocimientos actuales en nutrición. Organización Mundial de la Salud. Washington D.C. 340-359, 2003. • Yeung C, Zhu L, Glahn R, Miller D. Tissue iron distribution and adaptation of iron absorption in rats exposed to a high dietary level of NaFeEDTA. J Agric Food Chem 53(20):8087-8091, 2005. 43 Anexo 1: Consentimiento de participación en el Proyecto “El efecto del consumo de prebióticos sobre la biodisponibilidad de hierro” INFORMACIÓN SOBRE EL ESTUDIO DE INVESTIGACIÓN ¿Cuál es el propósito del estudio? Se quiere conocer qué efecto podría tener el consumo de un alimento funcional sobre la absorción del hierro. ¿Quién puede participar en este estudio? Pueden participar mujeres sanas cuya edad sea entre 35 y 45 años de edad, que no hayan recibido ningún suplemento mineral en los últimos 6 meses ni antibióticos en el último mes. No debe estar embarazada ni querer embarazarse. En el periodo del estudio, debe estar usando un método anticonceptivo (DIU, anticonceptivos orales o ligadura de trompas). ¿Por qué debiera yo considerar mi participación como sujeto de investigación en este estudio? Para colaborar en conocer cuál es el rol que tienen los prebióticos en la absorción de hierro. Este conocimiento permitirá mejorar las recomendaciones de ingesta de ciertos tipos de alimentos. ¿Tengo necesariamente que participar en este estudio? ¿Si acepto participar, puedo cambiar de opinión o retirarme? Usted no tiene ninguna obligación de participar en el estudio. Si acepta participar puede retirarse en cualquier momento del estudio. ¿Si decido participar en el estudio, en qué consisten precisamente las evaluaciones, y que tipo de tratamientos o procedimientos me van a practicar? Usted será citada al INTA para participar en una charla donde se le explicará en detalle de que se trata el estudio. Si usted decide aceptar participar, deberá concurrir en ayunas al INTA durante 5 mañanas (días 1, 2, 15, 16 y 29 del estudio). Los días 1, 2, 15 y 16 usted recibirá una solución acuosa o 2 cápsulas que contienen hierro que contiene una pequeña cantidad de un isótopo de 44 hierro radioactivo. Después de ingerir el hierro usted deberá permanecer 3 horas sin recibir ningún alimento. En dos oportunidades (día 15 y 29 del estudio) se le extraerá una muestra de sangre de una vena del brazo: una de 30 ml (6 cucharaditas de té), el día 15, para medir la absorción de hierro y para saber su nutrición de hierro y el día 29 una muestra de 20 ml (4 cucharaditas de té) para medir la absorción de hierro. Además, desde el día 3 al 14 del estudio, usted deberá consumir un yogurt todas las mañanas, el cual le será entregado en su domicilio. ¿Qué peligros podría experimentar en este estudio, y que harán los investigadores para reducir el riesgo de que éstos se presenten? Usted no corre ningún peligro. Las dosis de radioactividad que recibirá es menor a la que recibe al tomarse una radiografía de tórax. Además, para participar, a usted se le exigirá que esté con algún método anticonceptivo y para confirmar que no esté embarazada se le realizará el test de embarazo cada vez que concurra a ingerir hierro. En caso de fallar el método anticonceptivo y usted quede embarazada, las dosis utilizadas no constituyen ningún riesgo para el feto ni la madre. Tampoco es de riesgo para el entorno familiar ni laboral. Una posible molestia es que en el sitio de punción de la vena pudiera aparecer en algún caso un moretón. Esto se tratará de evitar, un Tecnólogo Médico de mucha experiencia será el que tome las muestras de sangre con material desechable. ¿Qué harán los investigadores para asegurar que la información que recolectarán sobre mí, no caerá en manos equivocadas? Usted será identificado con un código, siendo su identidad sólo conocida por el investigador responsable del proyecto. En la comunicación de los resultados no figurará su identidad. ¿Qué beneficios personales puedo yo esperar al participar en este estudio? A través de la muestra de sangre le haremos varios exámenes de laboratorio que nos permitirá saber si Ud. tiene anemia por deficiencia de hierro. En el caso de presentar anemia se le derivará a su centro de salud o médico personal para su tratamiento. 45 ¿En qué podría este estudio beneficiar a otros? Los resultados del estudio podrán contribuir a conocer los efectos benéficos del consumo de prebióticos, y así mejorar la recomendación de consumo de alimentos, lo que contribuirá a una mejor salud de nuestra población. ¿Qué harán los investigadores si sufro algún daño durante el estudio? No se espera que usted sufra daño. ¿Recibiré algún pago por participar en este estudio? Usted recibirá una compensación por los gastos de locomoción y tiempo ocupado en el proyecto al completar el estudio. Ésta se pagará al final del estudio y corresponde a $60.000 ¿Se cobrará a mí, a mi Isapre o FONASA el costo de algunos de estos estudios? Este estudio no tiene ningún costo para usted o su sistema de salud. ¿Una vez que yo haya ingresado como sujeto de estudio, a quien tendría que dirigirme para averiguar más acerca del estudio o para hacer llegar algún reclamo respecto al trato que hubiese recibido? Usted se podrá dirigir a TM Fernando Pizarro (fono 9781522) o a la Alumna de Magíster Valerie Weinborn (fono 9781513), en INTA, El Líbano 5542. ¿Qué sucede si decido no participar en este estudio? Nada. 46 Documentación del Consentimiento ¿Después que firme el documento, quien lo guardará? El investigador responsable del proyecto. Declaro haber leído la información descrita y mis preguntas acerca del estudio han sido respondidas satisfactoriamente. Al firmar esta copia, indico que tengo un entendimiento claro del proyecto Nombre del participante : Firma: Fecha: Consentimiento del investigador Al sujeto de investigación he entregado información sobre el estudio, y en mi opinión esta información es precisa y suficiente para que el sujeto entienda completamente la naturaleza, los riesgos y beneficios del estudio, y los derechos que tiene en tanto sujeto de investigación. No ha existido coerción ni ha actuado bajo influencia alguna. He sido testigo que el sujeto firmó el documento. Nombre Investigador del Fernando Pizarro Aguirre Firma: Fecha: 47 Anexo 2: Técnica de doble marcaje isotópico de Eakins y Brown I. Etapa: Digestión a) Estándares: los estándares con que trabajamos en los estudios consistieron en triplicados de las cápsulas usadas en cada uno de ellos. Así, la primera semana del estudio se obtenían seis cápsulas estándares, tres que correspondían a 55Fe y tres a 59Fe, y de esta misma forma ocurría en la segunda semana de estudio. b) Blancos y muestras: ambos ítems se trabajaron en duplicados. Las muestras blanco correspondieron a 5 mL de sangre de banco de sangre del Instituto de Salud Pública (ISP). Las muestras como tal, correspondieron a 8 mL de sangre de cada sujeto participante del estudio. Cada estándar, blanco y muestra, se puso en un tubo de digestión y se colocaron 6 a 8 perlas de vidrio de 5 mm de diámetro y se le agregó primero 3 mL de ácido sulfúrico al 95-97% p.a. (Merck, Germany) y luego 2 mL de ácido nítrico al 65% p.a. (Merck, Germany) y se dejó reposar al menos una noche, idealmente todo el fin de semana. Ya transcurrido este tiempo, se colocaron los tubos de digestión en un digestor marca Quimis distintos tiempos a distintas temperaturas: - 95°C por 10 minutos - 135°C por 5 minutos - 150°C por 5 minutos - 200°C por 10 minutos - 250°C por 10 minutos - 290°C por 15 minutos y se apagó (muestra color petróleo). Luego, se agregó 1 mL de ácido perclórico al 70-72% p.a. (Merck, Germany) a cada tubo y se siguió con la digestión a: - 220°C por 10 minutos - 250°C por 5 minutos - 290°C hasta que la muestra quede color amarillo pálido (aproximadamente 60 minutos). Luego, los matraces se sacaron del digestor y cuando ya estaban fríos, se les agregó 10 mL de ácido clorhídrico fumarante 37% p.a. (Merck, Germany). 48 II. Etapa: Precipitación 1 En tubos de fondo redondo de 100 mL siliconados, se agregó cantidad necesaria de carrier según la siguiente fórmula: mg de Fe que tiene la muestra = mL de carrier = Hb × 3,39 × volumen de sangre 100 5 − mg de Fe de la muestra 5 mg de Fe/mL (concentración Carrier ) Se trasvasijó la muestra completa desde el tubo de digestión al tubo de 100 mL incluyendo las perlas de vidrio. Se lavó cinco veces el matraz con 4 mL de agua desionizada enjuagando las paredes del cuello del matraz y vortexeando en cada lavado. Se adicionó hidróxido de amonio 10 M enérgicamente con pizeta la cantidad necesaria para formar un precipitado de color café e insoluble en agua. Se dejó decantar el precipitado y luego se centrifugó a 1.800 rpm durante 30 minutos a 22°C. Terminado el proceso, se descartó el sobrenadante sin perder el precipitado, y se agregó 1 mL de ácido clorhídrico 1 N. III. Etapa: Precipitación 2 Se trasvasijó el contenido completo del tubo de 100 mL a tubos de 15 mL y se realizaron 4 lavados en vortex con 2,5 mL de agua desionizada. Se adicionó hidróxido de amonio 10 M enérgicamente con pizeta la cantidad necesaria para formar un precipitado de color café. Esta precipitación en particular, se hace en vortex cuidando que la formación de precipitado llegue hasta el fondo del tubo. Se dejó decantar el precipitado y luego se centrifugó a 2.500 rpm durante 20 minutos a 22°C. Después, se eliminó el sobrenadante y se agregaron 10 mL de agua desionizada, se agitó en vortex hasta que se levantó el precipitado y se lavaron las paredes con 5 mL más de agua desionizada. Se repitió la centrifugación a 2.500 rpm durante 20 minutos a 22°C. Luego, se eliminó el sobrenadante y se agregó 0,5 mL de ácido ortofosfórico al 85% p.a. (Merck, Germany) (la muestra queda transparente) y después se precipitó en vortex con 10 mL de cloruro de amonio en etanol 0,05 M, más 5 mL de la misma solución sin vortexear. Se repitió la centrifugación a 2500 rpm durante 20 minutos a 22°C. Después, se eliminó el sobrenadante y se agregaron 4 mL de etanol absoluto (Merck, Germany), se 49 agitó en vortex hasta que se levantó el precipitado y se lavaron las paredes con 8 mL más de etanol absoluto (Merck, Germany). Se repitió la centrifugación a 2.500 rpm durante 20 minutos a 22°C y se eliminó el sobrenadante. IV. A Etapa: Conteo cada tubo, se agregó 4 mL de Ultrafluor (Complete liquidscintillationcountingsolutionforaqueousradioactivesamples; Nacional Diagnostics, USA) y se agitó en vortex. Luego, el contenido de los tubos fue trasvasijado a viales de conteo que fueron previamente llenados a tres cuartos de su capacidad con CAB-O-SIL (Thixotropicgellingpowder, scintillation grade; Nacional Diagnostics, USA). Los tubos, fueron lavados posteriormente dos veces con 4 mL de Ultrafluor y agitados en vortex para luego ser trasvasijados al vial. Finalmente, cada vial fue agitado en vortex aproximadamente 30 segundos hasta homogenizar el gel y se guardó en cajas en un lugar oscuro durante 48 a 36 horas. Cumplido este tiempo, las muestras estuvieron aptas para su lectura en el contador de centelleo líquido. 50