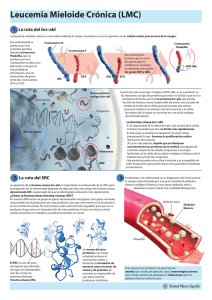
1 Respuesta de los pacientes con Leucemia Mieloide Crónica al
Anuncio

Respuesta de los pacientes con Leucemia Mieloide Crónica al tratamiento con Imatinib Ana Libia Moreno García Trabajo de grado presentado como requisito parcial para optar al título de BACTERIÓLOGO Pontificia Universidad Javeriana Facultad de Ciencias Carrera de Bacteriología. Bogotá DC. 2009 Respuesta de los pacientes con Leucemia 1 Mieloide Crónica al tratamiento con Imatinib Ana Libia Moreno García Directora: Aura Bibiana Martínez Mayorga, Bact.Espc Asesora: Aura Rosa Manascero, Bact. MSc Pontificia Universidad Javeriana Facultad de Ciencias Carrera de Bacteriología. Bogotá DC. 2009 NOTA DE ADVERTENCIA 2 Artículo 23 de la resolución No. 13 de julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará porque no se publique nada contrario al dogma y la moral católica y porque la tesis no contenga ataques personales contra persona alguna, antes bien se vea en ellas el anhelo por buscar verdad y justicia”. 3 4 DEDICATORIA 5 A Dios por regalarme todo lo que tengo y todo lo que soy, a mis padres, José Moreno y Emilcen García, a mis hermanos, a Christian Bedoya por su apoyo, paciencia y colaboración. Ana Libia Moreno García AGRADECIMIENTOS 6 A las doctoras. Aura Bibiana Martínez, Aura Rosa Manasceros y al Doctor Juan Felipe Combariza por su apoyo, paciencia, dedicación, ayuda y orientación en el desarrollo de este trabajo de grado. Al departamento de Hematología y archivo de historias clínicas del Instituto Nacional de Cancerología por la formación ética, profesional y a todos sus integrantes por su colaboración en la realización de este proyecto. TABLA DE CONTENIDO 7 Tabla de contenido Pág. Lista de figuras Lista de tablas Resumen Abstract 1. INTRODUCCION 1 2. ANTECEDENTES Y MARCO TEÓRICO 5 2.1. Definición 5 2.2. Epidemiología 5 2.3. Patogenia 7 2.4. El gen ABL 10 2.4.1. Proteína Abl 10 2.4.2. Abl actividad enzimática de la proteína quinasa 12 2.4.3. Otras propiedades: impacto sobre citoesqueleto, 2.5. Ciclo celular y reparación del ADN 13 El gen BCR 13 2.5.1. Localización subcelular del Bcr 14 2.6. La biología del BCR-ABL 16 2.7. Mecanismos de transformación maligna en células positivas BCR-Abl 2.8. 18 Vías de señalización activadas y propiedades biológicas en las células positivas BCR-Abl 21 2.8.1. Vía RAS 22 2.8.2. Vía Fosfatidilinositol 3- cinasa 22 2.8.3. Vía Jak- Stat 23 2.9. Heterogeneidad fenotípica de las enfermedades cromosoma de Filadelfia positivo 2.10. 26 Leucemia Aguda con cromosoma 8 de Filadelfia positivo 27 2.11. Implicaciones de estudios moleculares en cromosoma de Filadelfia negativo en LMC y LA 27 2.11.1. Leucemia Aguda con cromosoma de Filadelfia positivo 28 2.12. 28 Características clínicas de la LMC 2.12.1. Fase Crónica 28 2.12.2. Fase Acelerada 31 2.12.3. Fase Blastica 31 2.13. Diagnostico de la Leucemia Mieloide Crónica 32 2.14. Tratamiento con inhibidores de la tirosincinasas 32 2.15. Imatinib 33 2.15.1. Farmacocinética 37 2.15.2. Efectos adversos 38 2.15.3. Mecanismos de resistencia al Imatinib 39 3. JUSTIFICACION 41 4. PLANTEAMIENTO DEL PROBLEMA 43 5. OBJETIVOS 44 5.1. Objetivo general 44 5.2. Objetivos específicos 44 6. MATERIALES Y METODOS 45 6.1. Población en estudio 45 6.1.1. Universo 45 6.1.2. Muestra 45 6.1.3. Variables del estudio 45 6.2. 46 Proceso de selección 6.2.1. Criterios de Inclusión 46 6.2.2. Criterios de Exclusión 46 6.3. Tipo de estudio 46 6.4. Recolección de la Información 46 6.5. Procedimiento 47 7. RESULTADOS 48 7.1 Características generales 48 9 7.2 Respuesta al tratamiento 49 7.3 Análisis de supervivencia 49 8. ANALISIS DE RESULTADOS 53 9. CONCLUSIONES 55 10. RECOMENDACIONES 57 11. REFERENCIAS 58 LISTA DE FIGURAS Pág. 10 Figura 1. La t(9;22) translocación y sus productos: el encogen Bcr-Abl en el cromosoma de Filadelfia 7 Figura 2. Proteínas anormales Bcr-Abl 9 Figura 3. Estructura de la proteína Abl 11 Figura 4. Estructura de la proteína BCR 16 Figura 5. P210 codificación BCR- Abl vías de señalización 24 Figura 6. Mecanismos de acción del Imatinib 35 LISTA DE TABLAS Pág. 11 Tabla 1. Características moleculares de BCR, ABL, y BCR- ABL 8 Tabla 2. Propiedades biológicas de p210BCR-ABL y p190BCR-ABL 17 Tabla 3. Frecuencia del Cromosoma de Filadelfia, p210Bcr-Abl, p190Bcr-Abl, en Leucemia 26 Tabla 4. Síntomas y signos más frecuentes de la LMC Ph (+) en fase crónica 31 Tabla 5. Respuesta hematológica al Imatinib 37 Tabla 6. Respuesta citogenética al Imatinib 38 Tabla 7. Respuesta molecular al Imatinib 38 Tabla 8. Reacciones adversas 39 Tabla 9. Características generales de la cohorte analizada 48 LISTA DE ANEXOS Anexo No 1 Instrumento de recolección de la información Anexo No 2 Distribución por Edad Anexo No 3 Distribución por sexo Anexo No 4 Pacientes con seguimiento hematológico y citogenético del INC 12 Anexo No 5 Comportamiento de blastos, eosinófilos, basófilos en sangre periférica al momento del diagnostico Anexo No 6 Tratamiento Previo Anexo No 7 Porcentaje de la respuesta hematológica Anexo No 8 Porcentaje de la respuesta citogenética RESUMEN Se realizó un estudio de tipo Retrospectivo, de pacientes con Leucemia Mieloide Crónica (LMC), con el objetivo de establecer el comportamiento y la respuesta de los pacientes con LMC al tratamiento con Imatinib.Los pacientes que cumplieron los criterios de inclusión fueron 26 con una mediana de edad de 41 años, un porcentaje de hombres 69,2% (n=18) y de mujeres 30,7% (n=8). La respuesta hematológica según los hallazgos del frotis de sangre periférica al momento de hacer el mielograma al tratamiento con Imatinib fue de 86,6% (n=13) y la no respuesta de 13,3% (n=2) La respuesta citogenética a los 7-10 meses fue completa en el 57,1 % (n=8), parcial en 7,1% (n=1), no respuesta a Imatinib se presentó en el 35,7% (n=5) de 13 los pacientes.Desde los 41-50 meses se observo que los pacientes alcanzaban respuestas hematológicas mayores a 60% y solo un 25% no alcanzaron una respuesta hematológica. Se observo que la respuesta citogenética completa comienza a presentarse a partir de los 31-40 meses de tratamiento 69,2 %, respuesta citogenética parcial de 15,3%, respuesta citogenética menor de 7,6 % y una no respuesta citogenética de 7,6%, La supervivencia total de la serie fue del 96,1% a los 3 años; la mediana de seguimiento todavía no ha sido alcanzada, es interesante observar que en los pacientes con LMC en fase crónica la progresión a fase acelerada y crisis blástica ocurren en un 80% a los dos años de iniciado el tratamiento y la progresión citogenética ocurre en un 86% a los dos años de iniciado el tratamiento. Llama la atención la pobre evidencia encontrada, a pesar de iniciar con una población de 156 pacientes el solo poder trabajar con 26, debido a los criterios de exclusión del estudio, las perdidas ocurridas se deben principalmente a la falta de seguimiento del tratamiento, en gran mayoría debidas a las no autorizaciones de las EPS en la realización del cariotipo y el suministro del Imatinib por no estar incluidos en el POS, desafortunadamente el desinterés de la parte administrativa es el responsable de que a pesar de la evolución terapéutica durante la ultima década en nuestro país esta enfermedad represente un problema de gran magnitud. Palabras clave: Leucemia Mieloide Crónica, Imatinib, gen de fusión BCR-Abl ABSTRACT A retrospective study was done from patients with chronic myelogenous (or myeloid) leukemia (CML), with the objective to establish the behavior and response of the patients under treatment with the drug Imatinib. Patients who met the inclusion criteria were 26 with a median age of 41 years, a rate of 69.2% men (n = 18) and women 30.7% (n = 8). The Hematological response was 86.6 % (n=13) and the hematological non-response was 13.3% (n=2) upon 7 – 10 months of treatment. The cytogenicity response upon 7 – 10 months was 57.1% (n=8) complete. 7.1% (n=1) partial. no response to Imatinib was presented in 35.7% (n = 5) patients. 14 From 41-50 months was observed that patients achieved hematologic responses greater than 60% and only 25% did not achieve an hematologic response. it was observed that the complete cytogenetic response begins to appear from 31-40 months of treatment 69.2%, partial cytogenetic response of 15.3%, minor cytogenetic response of 7.6% and no cytogenetic response, 7, 6%. The survival of the entire series was 96.1% at 3 years, the median follow-up has not yet been reached, it is interesting to note that in patients with CML in chronic phase progression to accelerated phase and blast crisis occur in 80% two years after initiating treatment and cytogenetic progression occurs in 86% at two years of starting the treatment. It’s interesting to note the poor evidence found, despite starting with a population of 156 patients, only 26 to work with because of the exclusion criteria of the study, losses are mainly due to lack of monitoring of treatment, most due to the lack of Authorizations from EPS in the realization of the karyotype and the supply of Imatinib for not being included in the POS, Unfortunately the indifference of the administration is responsible for this, despite the therapeutic developments during the last decade in our country, this disease still represents a major problem. Keywords: Chronic myeloid leukemia, Imatinib, gene fusion BCR-Abl 1. INTRODUCCIÓN La leucemia mieloide crónica es la primera forma de leucemia en ser reconocida como una entidad separada dentro de las neoplasias mieloproliferativas crónicas.1 Ha sido definida como una proliferación clonal cuyo blanco es la célula madre pluripotente2. A pesar de que la enfermedad se describió primero en la literatura inglesa en 1845 por Hughes Bennett, el primer hecho destacado no tuvo lugar hasta 1960 cuando 1 J.W. Vardiman, J.V. Melo, M. Baccarani, J Thiele Chronic myelogenous leukemia, BCR-ABL1 positive , 2008; 32-37 2 Fialkow PJ, Jacobson RJ, Papayannopoulou T. Chronic myelocytic leukemia: clonal origin in a stem cell common to the granulocyte, erythrocyte, platelet and monocyte/macrophage. Am J Med 1977; 63:125-30. 15 Nowell Y Hungerford3 descubrieron en las células leucémicas una anormalidad citogenética constante, que desde entonces ha sido utilizada como un marcador cromosómico de la enfermedad, denominado cromosoma Filadelfia (Ph) que consiste en una translocación entre el brazo largo del cromosoma 9 y el corto del 22, t (9; 22) (q34; q11)4,5,6. Se ha podido establecer que el punto de ruptura del cromosoma 22 se localiza, en más del 99 % de los casos, en una región específica de sus brazos largos, denominada (M-bcr) o región mayor de agrupamiento, situada en un segmento de ADN de 5,8 kilobases, la consecuencia molecular de la translocación es el oncogén BCR-Abl que codifica para proteínas de fusión inusuales que aumentan la actividad de la tirosina quinasa. 7 Las técnicas de análisis molecular han demostrado que la translocación que da lugar al cromosoma Ph es recíproca. Dicho material genético, llamado proto oncogén Abl por su similitud con el oncogén de la leucemia murina experimental de Abelson, parece constituir el factor clave para la aparición de la LMC 8 El encogen da origen a un ARN mensajero quimérico bcr-abl, que codifica la síntesis de una proteína con actividad tirosina cinasa aumentada (p210, de 210 kilodaltons), la cual controla el crecimiento y diferenciación celular y parece ser la responsable que las células hematopoyéticas adquieran un comportamiento neoplásico9 3 Michael W. N. Deininger and Brian J. Drunker.Specific therapy of chronic myelogenous leukemia with Imatinib.pharmacol Rev2003; 55: 401-423 4 Rowely JD. A new consistent chromosomal abnormality in chronic myelogenous leukemia identified bye quinacrine fluorescence and giemsa staining. Nature 1873; 243:290-3 5 Heisterkamp N, Groffen J, Stephenson JR, et al. chromosomal localization of human cellular homologues of two viral oncogenes, Nature 1982;299: 747-49 6 Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science 1960; 132:1497. 7 Rene R. Mechanisms of BCR- Abl in the pathogenesis of chronic myelogenous leukemia. Nat Rev cancer 2005;5:172-83 8 Helhlman R, Andreas H, Michele Bacarani, et al. Chronic myeloid leukemia. Lancet 2007;370:432-50 9 AS Shet, BN Jahagirdar, CM Verfaillie, et al. Chronic myelogenous leukemia: mechanisms underlying disease progression.Leukemia 2002;16, 1402-14 16 La LMC es una enfermedad bifásica o trifásica: inicia con una fase Crónica (LMC- FC) seguida por una fase acelerada (LMC- FA) finalizando con una transformación mas agresiva a crisis blástica (LMC-FB)10 En la actualidad se considera la neoplasia mieloproliferativa crónica mas común, representa el 15 al 20 % de todos los casos de leucemia y tiene una incidencia en todo el mundo de 1 a 1.5 casos por cada 100.000 habitantes al año, puede ocurrir en cualquier edad, pero la edad media de diagnostico es alrededor de los 50 años de vida. 11 Esta patología es potencialmente curable con el transplante de células madre alogénico, pero menos del 30 % de los pacientes tienen un donante compatible 12,13, 5 Tratamientos con interferón alfa pueden inducir una respuesta citogenética en 5 a 20% de los pacientes y resulta una larga sobrevida relacionada con la terapia, pero esta asociado con serios efectos tóxicos14. Actualmente las principales herramientas para el tratamiento de la LMC se basan en el conocimiento de la biología molecular de la enfermedad así como inhibidores de transducción de señales (ITS), que bloquean o impiden a una proteína ejercer su actividad oncogénica. Debido a que una de las acciones del BCR- Abl es la activación como proteína tirosina quinasa, la inhibición de esta proteína parece ser el medio más lógico para silenciar su actividad oncogénica.15 Varios inhibidores de la tirosina quinasa han sido evaluados por su potencial para modificar el fenotipo de las células en la LMC15 10 JW wardiman, R Pierre, Jthiele.et al chronic myelogenous leukemia. World health organization classification of tumours pathology & genetics.tumours of haematopoietic and lymphoid tissues.Ed Elaine S 2001:17-26 11 M. Kantarjian, M.D Susan O’Brien et al. The biology of chronic myeloid leukemia. The new England journal of medicine 1999; 194-172 12 Sawyers CL. Chronic myeloid leukemia. N Engl J Med 1999;340:1330-40 13 Kantarjian HM, deisseroth A, Kurzrock, Estrov Z, Talpaz M. chronic myelogenousvleukemia: a concise update. Blood 1993;82:691-703 14 Silver Rt, Woolf SH, Hehlman r, et al, an evidence based analysis of the effects of busulfan, hidroxiurea,interferon, and allogenic bone marrow transplantation in treating the chronic phase of chronic myeloid leukemia: develomed for the American Society of Hematology. Blood 1999; 94:1517-36 15 Michael W.N. Deininger John M. Goldman and Junia V Melo. The molecular bilogy of chronic myeloid leukemia 2000; 96:3343-3356 17 El Imatinib (2 – fenilaminopirimidina) induce una respuesta hematológica durable en la LMC en fase crónica con mínimos efectos tóxicos, es un compuesto desarrollado por Brian Drunker, cuyos niveles in vitro, celulares e in vivo suprimen poderosamente el BCR- Abl tirosina quinasa. Inhibe de manera selectiva la proliferación e induce la apoptosis de las líneas celulares con positividad para BCR-Abl así como de las células leucémicas frescas de pacientes con LMC, inhibe las tirosinas quinasas de los receptores del factor de crecimiento derivado de las plaquetas (PDFG), del factor de las células troncales (SCF) y c-Kit, también suprime las reacciones celulares mediadas por PDFG y SCF16. Para el médico tratante es indispensable realizar un adecuado control del tratamiento y pronostico de la enfermedad. Usualmente monitorean los pacientes con cuadro hemático, citogenética y realización de PCR para valorar respuestas hematológicas, citogenéticas y moleculares respectivamente. La mayoría de estos pacientes no reciben o se les dificulta el control citogenético y molecular por que son exámenes que no están incluidos en el POS lo que impide saber si hay enfermedad mínima residual o no. Teniendo en cuenta que la LMC es una enfermedad común en el ser humano y que en nuestro país es un problema de salud publica17, vale la pena conocer cual es el comportamiento y el pronóstico de la enfermedad en los pacientes que recién diagnosticados inician tratamiento con Imatinib. 16 www.glivec.com Francisco Luis Ochoa Jaramillo, Liliana Patricia Montoya Velez. Mortalidad por cáncer en Colombia 2001. CES medician Vol. 18 No 2 17 18 2. ANTECEDENTES Y MARCO TEORICO 2.1 Definición La Leucemia Mieloide Crónica (LMC) es una neoplasia mieloproliferativa crónica de gran importancia por su frecuencia y pronóstico, es una proliferación de carácter clonal que tiene su origen en una célula madre (stem cell) pluripotencial común a las tres series hematopoyéticas, su cuadro clínico, biológico e histológico viene determinado por una intensa proliferación de la serie granulocítica en la médula ósea, la sangre periférica y otros órganos hematopoyéticos, fundamentalmente el bazo. Se caracteriza por una leucocitosis intensa en la que están representados todos los elementos madurativos de la granulopoyesis, basofilia, acompañada a menudo de esplenomegalia y de una disminución de la fosfatasa alcalina leucocitaria. La mayoría de los pacientes son diagnosticados en fase crónica, cerca del 20- 40 % de los pacientes son asintomáticos y su diagnóstico ocurre cuando se realizan un cuadro hemático de rutina18,19,20 18 Cotta CV, Bueso – Ramos CE (2007). New Insinghts into the pathobiology and treatment of chronic myelogenous leucemia. Ann Diagn Pathol 11:68-72 19 Garcia-Manero G, Faderel S. O’ Brian S, Cortes J Talpaz M, Kantarjian HM (2003). Chronic myelogenous leucemia: a review and update of therapeutic strategies Cancer 98: 437-457 19 La Organización Mundial de la Salud, define la leucemia mieloide crónica (LMC) como una neoplasia mieloproliferativa que se origina de una célula “madre” (Stem Cell) pluripotencial asociada al cromosoma de Filadelfia o al gen de fusión Bcr-Abl21 2.2 Epidemiología La Leucemia Mieloide Crónica tiene una incidencia de 1 a 2 casos por cada 100.000 personas por año en los países occidentales y representa el 15 % de las leucemias en los adultos. Del 12 al 30 % de ellos tienen más de 60 años. El 85% de los casos se diagnostican en la fase crónica de la enfermedad y alrededor del 50 % de ellos tienen diagnostico accidental. La edad media de presentación es de 53 años, la incidencia máxima se encuentra entre los 40 y los 60 años y predomina ligeramente en varones, con una relación de 1.3: 1, las mujeres parecen tener una mayor sobrevida 22,17,23 Alrededor de la mitad de los pacientes son asintomáticos al momentos del diagnostico y la mediana de sobrevida global después de este, es de 4 a 6 años (sobrevida global a 5 años del 39 %) con un rango que oscila desde menos de un año a más de 10 años. La mortalidad ajustada por edad es de 0,6 por 100 000 habitantes/año; la gran mayoría de los sujetos que fallecen por LMC tienen mas de 55 años (74,7%) y se ha estimado que el 0,16% (1 de cada 619 hombres y mujeres) de las personas que nacen en la actualidad tendrán la enfermedad en algún momento de sus vidas y que el 0,06% morirán por ella24,25,26 20 Savage DG. Szydio RM. Goldman JM, (1997). Clinical features at diagnosis in 430 patients with chronic myeloid leukaemia seen at referral centre over a 16 year period. Br J Haematol 99: 30-35 21 JW wardiman, R Pierre, Jthiele.et al chronic myelogenous leukemia. World health organization classification of tumours pathology & genetics.tumours of haematopoietic and lymphoid tissues.Ed Elaine S 2001:17-26 22 Helman R, Andreas H, Michele B. Chronic myeloid leukemia.Lancet 2007;370:342-50 23 Registro institutional de cancer, INC 24 Goldman JM, Melo JV. Chronic myeloid leukemia advances in biology and new approaches to treatment. N Engl J Med. 2003; 349 (15): 1451-1464 25 Ries LAG, Eisner MP, Kosary CL, Hankey BF, Miller BA, Clegg L, et al En: Mariotto A, Feuer EJ, Edwards BK, editors. SEER Cancer Institute. 26 Raul Hernando Murillo Moreno, et al., Anuario estadístico..Ministerio de la protección social, Instituto Nacional de cancerología, 2006 Volumen 4 20 En la actualidad, la tasa de mortalidad anual de la LMC es menor del 10% durante los dos primeros años después del diagnostico; en los pacientes en fase crónica con bajo riesgo es del 12% durante los tres primeros años, mientras que en los de riesgo intermedio y alto riesgo es del 76%,55% y 25%, y para los sujetos en fase acelerada y blástica es inferior al 10% y 5%, respectivamente21, 27 2.3 Patógenia La LMC es la malignidad más estudiada, en 1956 Peter Nowel y David Hungerford la asociaron con una translocación genética, convirtiéndose en la primera enfermedad maligna asociada a una alteración cromosómica, partiendo en dos la historia de la biología del cáncer. Las metafases de estos pacientes contaban de manera recurrente con un cromosoma más pequeño de lo normal al que se le llamo cromosoma de filadelfia en 19606. Esta anormalidad afecta a los cromosomas 9 y 22, el defecto genético del cromosoma Filadelfia consiste en un fenómeno conocido como translocación. Partes de dos cromosomas, el 9 y el 22, intercambian sus posiciones. El resultado es que parte del gen de la región de fractura (BCR, Breakpoint Cluster Región) del cromosoma 22 (región q 11) se fusiona con parte del gen ABL del cromosoma 9 (región q34). (Figura 1) Figura. 1. La t (9; 22) Translocación y sus productos: el oncogén Bcr-Abl en el cromosoma de Filadelfia 27 Kurzrock R, Bueso-Ramos CE, Kantarjian H. BCR rearrangement negative chronic myelogenous leucemia revisted J Clin Oncol. 2001; 819(11): 2915-2926. 21 Fuente: Stefan Faderl,M.D., Moshe Talpaz,M.D.,Zeev Estrov,M.D ., Susan O’Brien, M.D., Razelle Kurzrock, M.D., and Hagop M. Kantarjian, M.D. The Biology of Chronic Myeloid Leukemia. The New England Journal of Medicine 1999; 164-172 La genética molecular del cromosoma de Filadelfia es bien conocida (Tabla1). La t (9; 22) anormal da lugar a un intercambio de ADN entre los cromosomas 9 y 22. El 3’del gen ABL (3 es el final del gen, donde se realiza la transcripción (síntesis de ARN)) en el cromosoma 9 se yuxtaponen para el segmento proximal del gen BCR alterado en el cromosoma 22. El resultado es un gen quimérico BCR-ABL, las rupturas en el gen BCR en el cromosoma 22 pueden variar, en la LMC, la mayoría de las veces se producen centralmente, es decir, entre exones 12 y 16 (también conocidos como exones b1 a b5), en una región designada como el grupo mayor de ruptura (M-BCR), rupturas en el primer intrón del gen BCR, origina un área denominada punto de ruptura menor (m-BCR) entre exones e1 y e2. Sin embargo, en un pequeño subconjunto de los pacientes, una región mas distal (entre los exones 19 y 20; la región µ- BCR) se ve afectado (Tabla 1) Tabla. 1. Características moleculares de BCR, ABL y BCR- ABL 22 Característica BCR Localización cromosómica 22q11 ABL BCR-ABL 9q34 22q11 Tamaño del gen, kb 130 230 Numero de exones 23 11 RNA mensajero kb 4.5 y 7.0 variable variable 6.0 y 7.0 7.0, 8.5 y 10 Peso molecular de las principales proteínas Kd 130000 y 160000 145000 190000,210000 y 230000 Fuente: Razelle Kurzrock, MD; Hagop M. Kantarjian, MD; Brian J. Drunker, MD; y Moshe Talpaz, MD. Philadelphia Chromosome – positive leukemia: From Basic Mechanisms to Molecular Therapeutics. Ann Intern Med. 2003; 138:819-830 Las rupturas en M-BCR, m-BCR y en µ- BCR unidas a diferentes exones del ABL dan como resultado proteínas Bcr-Abl 210 kd, de 190 kd, y 230 kd respectivamente. Todas las proteínas tienen la misma cantidad de Abl. Sutiles diferencias en el efecto biológico de la variación de las proteínas Bcr-Abl pueden ser cruciales para el fenotipo de la enfermedad. (Figura 2) 28,29,30,31 Figura .2. Proteínas anormales Bcr- Abl 28 Kurzrock R, Shtalrid M, Romero P, Kloetzer WS, Talpas M, Trujillo JM, et al. A novel c-abl protein product in Philadelphiapositive acute lymphoblastic leukaemia. Nature. 1987;325:631-5. [PMID: 3543692] 29 Kurzrock R, Gutterman JU, Talpaz M. The molecular genetics of Philadelphia chromosome-positive leukemias. N Engl J Med. 1988;319:990-8. 30 Groffen J, Stephenson JR, Heisterkamp N, de Klein A, Bartram CR, Grosveld G. Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22. Cell. 1984;36:93-9. [PMID: 6319012] 31 Heisterkamp N, Stam K, Groffen J, de Klein A, Grosveld G. Structural organization of the bcr gene and its role in the Ph_ translocation. Nature. 1985; 315:758-61. [PMID: 2989703] 23 Fuente: Razelle Kurzrock, MD; Hagop M. Kantarjian, MD; Brian J. Drunker, MD; y Moshe Talpaz, MD. Philadelphia Chromosome – positive leukemia: From Basic Mechanisms to Molecular Therapeutics. Ann Intern Med. 2003; 138:819-830 2.4 El gen ABL Formas del ABL ABL viral y celular El gen ABL celular es el homologo humano del gen viral ABL (v – ABL) oncogén que lleva el virus de la leucemia murina32,33 ABL viral se origina desde el ABL celular (cABL). Presumiblemente en algún momento de la evolución, el virus de la leucemia murina se incorporo en el gen ABL28 2.4.1 Proteína Abl 32 Abelson HT, Rabstein LS. Lymphosarcoma: virus-induced thymic-independent disease in mice. Cancer Res. 1970;30:2213-22. [PMID: 4318922] 33 Rosenberg N, Witte ON. The viral and cellular forms of the Abelson (abl) oncogene. Adv Virus Res. 1988;35:39-81. PMID: 2852893] 24 Es una proteína de 145 kd, con dos isoformas28, que provienen del corte y empalme del primer exón, (SH1-SH3) está localizado en el NH2 terminal. El dominio SH1 lleva la función de tirosina quinasa, donde los dominios SH2 y SH3 realizan la interacción con otras proteínas (Figura 3),34 secuencias ricas en prolina en el centro de la molécula pueden, a su vez interactuar con el dominio SH3 de otras proteínas como la Crk encargada de estabilizar las proteínas tirosina quinasa,35 puede también localizarse en núcleo y unirse al ADN, fenómeno que puede participar en la transcripción del ADN al ARN, en la respuesta al daño del ADN y en el proceso de meiosis. En el citoplasma se une a la actina del citoesqueleto. Figura 3. Estructura de la proteína Abl Fuente: Michael W. N. Deininger and Brian J. Druker. Specific Targed Therapy of Chronic Myelogenous Leukemia with Imatinib. Pharmacol Rev 2003;55: 401-423 34 35 Cohen GB, Ren R, Baltimore D. Modular binding domains in signal transduction proteins. Cell. 1995;80:237-248. Feller SM, Knudsen B, Hanafusa H. c-Abl kinase regulates the protein binding activity of c-Crk. EMBO J. 1994;13:2341-2351. 25 En células hematopoyéticas el Abl disminuye con la maduración mieloide36.Abl funciona como un no receptor de la enzima tirosina quinasa proteica con efectos biológicos37,38 En la región N-terminal de la proteína se encuentran 3 secuencias llamadas SH1, SH2 y SH3. La SH3 y la SH2 regulan positiva y negativamente de forma respectiva la actividad de tirosina quinasa que posee la región SH1. La región SH2 puede unirse específicamente al extremo N-terminal de la proteína BCR cuando este se encuentra fosforilado en los aminoácidos serina/ treonina. A continuación se presenta un segmento donde hay una secuencia continua de 5 lisinas que median la localización nuclear y otro rico en arginina, lisina y prolina, que pueden unirse con elementos específicos en el ADN y donde hay un sitio serina/prolina que puede ser fosforilado por la cdc2 quinasa y que al parecer interviene en el proceso de la mitosis celular. En una zona mas distal en el extremo C terminal, se ubica un sitio de fijación a la actina. Esta conformación estructural sugiere que la proteína Abl comparte funciones de tirosina quinasa y de factor de transcripción. Abl puede localizarse dentro del núcleo, donde puede ordenar al DNA, y al citoesqueleto, y manejar la actina39. En las células hematopoyéticas primarias31 y las neuronas40, Abl es más citoplasmático que nuclear. Funciones citoplasmáticas del Abl incluyen señalización y moldeo del citoesqueleto; Abl nuclear ha sido implicado en la regulación del ciclo celular34 y la genotoxicidad41. Abl también tiene capacidad de unión de DNA de significado incierto. 36 Wetzler M, Talpaz M, Van Etten RA, Hirsh-Ginsberg C, Beran M, Kurzrock R. Subcellular localization of Bcr, Abl, and Bcrabl proteins in normal and leukemic cells and correlation of expression with myeloid differentiation. J Clin Invest. 1993;92:1925-39. [PMID: 8408645] 37 Konopka JB, Witte ON. Detection of c-abl tyrosine kinase activity in vitro permits direct comparison of normal and altered abl gene products. Mol Cell Biol. 1985;5:3116-23. [PMID: 3879812] 38 Cheng K, Kurzrock R, Qiu X, Estrov Z, Ku S, Dulski KM, et al. Reduced focal adhesion kinase and paxillin phosphorylation in BCR-ABL-transfected cells. Cancer. 2002;95:440-50. [PMID: 12124845] 39 Van Etten RA. Cycling, stressed-out and nervous: cellular functions of c-Abl. Trends Cell Biol. 1999;9:179-86. [PMID: 10322452] 40 Koleske AJ, Gifford AM, Scott ML, Nee M, Bronson RT, Miczek KA, et al. Essential roles for the Abl and Arg tyrosine kinases in neurulation. Neuron. 1998;21:1259-72. [PMID: 9883720] 41 Wang JY. Cellular responses to DNA damage. Curr Opin Cell Biol. 1998; 10:240-7. [PMID: 9561848] 26 2.4.2 Abl actividad enzimática de la tirosina quinasa Tirosina quinasa son enzimas que fosforilan (adhieren un grupo fosfato) a una tirosina en un sustrato. Ellas tienen un dominio catalítico, que promueve la transferencia de un grupo terminal, trifosfato de adenosina (ATP) a un grupo de aminoácidos tirosina que aceptan el sustrato (o que pueden autofosforilarsen). Normalmente la fosforilación del Abl es herméticamente controlada34, probablemente por segmentos en la N-terminal. La perdida de esta región (como ocurre en la formación de BCR-ABL) da como resultado un incremento en la actividad enzimática, un factor clave oncogénico potencial en la transformación de las proteínas Abl42,43 2.4.3 Otras propiedades: impacto sobre citoesqueleto, ciclo celular y reparación del ADN La mayoría del Abl citoplasmático se asocia con los filamentos de actina, construyendo un bloque en el citoesqueleto celular44. Abl también interactúa con las células del ciclo de genes reguladores en varios puntos de control, lo cual afecta la proliferación celular45,34 Abl tiene acción activadora del DNA, que puede estar implicada en la iniciación de la transcripción del ADN a ARN, en daños a la respuesta del ADN, y en procesos mitóticos46,47,48. La alteración de la reparación del ADN puede dar lugar a errores 42 Pluk H, Dorey K, Superti-Furga G. Autoinhibition of c-Abl. Cell. 2002; 108:247-59. [PMID: 11832214] Dai Z, Pendergast AM. Abi-2, a novel SH3-containing protein interacts with the c-Abl tyrosine kinase and modulates c-Abl transforming activity. Genes Dev. 1995;9:2569-82. [PMID: 7590236 44 Van Etten RA, Jackson PK, Baltimore D, Sanders MC, Matsudaira PT, Janmey PA. The COOH terminus of the c-Abl tyrosine kinase contains distinct F- and G-actin binding domains with bundling activity. J Cell Biol. 1994;124: 325-40. [PMID: 8294516] 45 Sawyers CL, McLaughlin J, Goga A, Havlik M, Witte O. The nuclear tyrosine kinase c-Abl negatively regulates cell growth. Cell. 1994;77:121-31. [PMID: 7512450] 46 Kharbanda S, Pandey P, Morris PL, Whang Y, Xu Y, Sawant S, et al. Functional role for the c-Abl tyrosine kinase in meiosis I. Oncogene. 1998;16: 1773-7. [PMID: 9583675] 47 Miao YJ, Wang JY. Binding of A/T-rich DNA by three high mobility group-like domains in c-Abl tyrosine kinase. J Biol Chem. 1996;271:22823-30. [PMID: 8798460] 48 Yuan ZM, Huang Y, Ishiko T, Kharbanda S, Weichselbaum R, Kufe D. Regulation of DNA damage-induced apoptosis by the c-Abl tyrosine kinase. Proc Natl Acad Sci U S A. 1997;94:1437-40. [PMID: 9037071 43 27 genéticos sutiles, que se manifiestan como una evolución clonal y progresión a una crisis blastica. 2.5 El gen BCR BCR esta situado en el brazo largo del cromosoma 22 (22q11). Que se traduce en dos grandes proteínas que tienen pesos moleculares de 160000 y 130000 kd49,50. Situación similar que con el Abl, los niveles de proteínas de Bcr disminuyen con la maduración mieloide de las células hematopoyéticas31. 2.5.1 Localización subcelular del Bcr Como la proteína Abl y proteínas Bcr se encuentran normalmente en citoplasma y núcleo 31,51,52 . En el núcleo, la proteína Bcr se asocia con el DNA condensado en la interfase y metafase53 La proteína Bcr es una complicada molécula con muchos y diferentes motivos funcionales, implicados en vías de señalización en eucariotas (fosforilación y activación de guanosin trifosfato, GTP)54,55 49 National Center for Biotechnology Information. Entrez. Accessed at www .ncbi.nlm.nih.gov/Entrez on 20 March 2003. Stam K, Heisterkamp N, Reynolds FH Jr, Groffen J. Evidence that the phl gene encodes a 160,000-dalton phosphoprotein with associated kinase activity. Mol Cell Biol. 1987;7:1955-60. [PMID: 3299055] 51 Dhut S, Dorey EL, Horton MA, Ganesan TS, Young BD. Identification of two normal bcr gene products in the cytoplasm. Oncogene. 1988;3:561-6. [PMID: 3078961] 52 Laurent E, Talpaz M, Wetzler M, Kurzrock R. Cytoplasmic and nuclear localization of the 130 and 160 kDa Bcr proteins. Leukemia. 2000;14:1892-7. [PMID: 11069024] 53 Wetzler M, Talpaz M, Yee G, Stass SA, Van Etten RA, Andreeff M, et al. Cell cycle-related shifts in subcellular localization of BCR: association with mitotic chromosomes and with heterochromatin. Proc Natl Acad Sci U S A. 1995; 92:3488-92. [PMID: 7724587 54 Maru Y, Witte ON. The BCR gene encodes a novel serine/threonine kinase activity within a single exon. Cell. 1991;67:459-68. [PMID: 1657398] 55 Maru Y, Kobayashi T, Tanaka K, Shibuya M. BCR binds to the xeroderma pigmentosum group B protein. Biochem Biophys Res Commun. 1999;260:309- 12. [PMID: 10403766] 50 28 El primer exón del gen BCR es el centro de la ontogénesis, conocido en todas las proteínas de fusión del Bcr-Abl56,57. Bcr tiene actividad serina, treonina quinasa con actividad enzimática en el primer exón, esta puede autofosforilarse así como a los principales sustratos y, por ende, se propagan señales celulares. Varios dominios homólogos Src-2 (SH2), pueden activar también el primer exón del BCR. Dominio SH2 es muy conservado, regiones no catalíticas de 100 aminoácidos que se unen a SH2 activa sitios de 3 a 6 aminoácidos, incluyendo la fosfotirosinas. La interacción es importante en la compleja transducción de señales58. Bcr también interactúa o tiene homología con las proteínas G a diferentes niveles. Estas proteínas son agentes fundamentales en la señalización intracelular, organización del citoesqueleto, el crecimiento celular, y el desarrollo normal, la homeostasis dentro de este proceso esta regulada por la guanosin trifosfato (GTPasa) la activación de las proteínas, guanina y factores de intercambio de nucleótidos. Bcr tiene actividad GTPasa, activación de proteínas, guaninas y factores de intercambio, lo que sugiere un papel importante de las proteínas G asociadas a las rutas de señalización. La proteína BCR de 160 kd, se ubica en núcleo y citoplasma es una molécula compleja con distintas regiones funcionales; el primer exón el N- terminal codifica una serina, treonina quinasa, el centro de la secuencia contiene una región dbl la cual participa en dos fenómenos esenciales de la transducción de señales en las células (figura4), fosforilación y unión a guanosina trifosfato (GTP) por la guanosina bifosfato (GDP) activa factores de cambio Rho 59 lo que a su vez pueden activar factores de transcripción como el NF-kB60. El terminal C tiene actividad GTPasa activada por Rac61, una pequeña 56 Muller AJ, Young JC, Pendergast AM, Pondel M, Landau NR, Littman DR, et al. BCR first exon sequences specifically activate the BCR/ABL tyrosine kinase oncogene of Philadelphia chromosome-positive human leukemias. Mol Cell Biol. 1991;11:1785-92. [PMID: 2005881] 57 Arlinghaus RB. The involvement of Bcr in leukemias with the Philadelphia chromosome. Crit Rev Oncog. 1998;9:1-18. [PMID: 9754444] 58 Sadowski I, Stone JC, Pawson T. A noncatalytic domain conserved among cytoplasmic protein-tyrosine kinases modifies the kinase function and transforming activity of Fujinami sarcoma virus P130gag-fps. Mol Cell Biol. 1986;6:4396- 408. [PMID: 3025655] 59 Denhardt DT. Signal-transducing protein phosphorylation cascades mediated by Ras/Rho proteins in the mammalian cell: the potential for multiplex signalling. Biochem J. 1996;318:729-747. 60 Montaner S, Perona R, Saniger L, Lacal JC. Multiple signaling pathways lead to the activation of the nuclear factor kB by the Rho family of GTPases. J Biol Chem. 1998;273:12779-12785. 61 Diekmann D, Brill S, Garrett MD, et al. Bcr encodes a GTPase-activating protein for p21rac. Nature. 1991;351:400-402. 29 GTPasa de la superfamilia de las Ras regulan la polimerización de la actina y la actividad del NADPH oxidasa en las células fagocíticas62.La proteína BCR tiene actividad tirosina quinasa en la posición 177, residuos treonina y serina entre el aminoácido 192- 242 y 298-413 pueden autofosforilarse, la BCR es muy parecida a las proteínas G, esenciales en la señalización intracelular, organización del citoesqueleto, crecimiento celular y desarrollo celular normal.63 Figura 4. Estructura de la proteína BCR Fuente: Michael W. N. Deininger and Brian J. Druker. Specific Targed Therapy of Chronic Myelogenous Leukemia with Imatinib. Pharmacol Rev 2003;55: 401-423 2.6 La biología del BCR-ABL p210 Bcr-Abl y p190Bcr-Abl son moléculas pleiotropicas (expresión fenotípica múltiple que ocurre como consecuencia de la expresión de un par de genes) cualitativamente con muchas actividades similares, sus diferencias aún están por aclarar. Los estudios actuales 62 Diekmann D, Nobes CD, Burbelo PD, Abo A, Hall A. Rac GTPase interacts with GAPs and target proteins through multiple effector sites. EMBO J. 1995;14:5297-5305. 63 Deininger MW, Goldman JM, Melo JV, the molecular biology of chronic myeloid leukemia. Blood 2000; 96(10):3343-3356 30 sugieren que no solo p210 Bcr-Abl es fundamental para el desarrollo de la fase crónica de LMC, su efecto sobre el ADN y los procesos de reparación también pueden ser responsables de la inestabilidad genómica y, por lo tanto, la progresión de la enfermedad (Tabla 2). Tabla. 2. Propiedades biológicas de p210Bcr-Abl y p190Bcr-Abl 31 P210 Bcr-Abl • Constitutivamente ha activado la enzima tirosina quinasa • Forma bloques de actina en el citoesqueleto • Su expresión disminuye con la diferenciación mieloide • Atenúa la muerte celular programada • Esta vinculada a Jak- Stat vías de señalización (sobre todo Stat 5) • Esta vinculada a la quinasa 3 fosfatidil inositol vía de señalización • Activa las Jun quinasas • Interactúa y regula las proteínas de reparación del ADN • Tiene actividad mediada por vías de señalización Ras • Induce alteraciones en las propiedades de adherencia • Altera la expresión y la protección de los bucles de la fosforilación de proteínas ( involucrados en la mielopoyesis) 190 Bcr-Abl • Constitutivamente ha activado la enzima tirosina quinasa • Atenúa la muerte celular programada • Esta vinculada a Jak-Stat vías de señalización (sobre todo Stat 5) • Esta vinculada a la vía de señalización 3- quinasa fosfotidil inositol • Ha transformado la actividad mediada por la vía de señalización Ras • Induce la degradación de la tirosina quinasa Abl • Inhibidor de la interacción proteína Abelson • P230 • Puede provocar alteraciones en las propiedades de adherencia BCR-Abl Se presenta en pacientes con bajos recuentos de leucocitos, no usual en la LMC con progresión lenta a una crisis blástica • Se observa una maduración prominente de la línea neutrofilica y/o trombocitosis Fuente: Razelle Kurzrock, MD; Hagop M. Kantarjian, MD; Brian J. Drunker, MD; y Moshe Talpaz, MD. Philadelphia Chromosome – positive leukemias: From Basic Mechanisms to Molecular Therapeutics. Ann Intern Med. 2003; 138:819-830 2.7 Mecanismos de transformación maligna en células positivas BCR-Abl Tres mecanismos están implicados en la transformación maligna por el BCR-Abl: 32 alteraciones en la adhesión al estroma celular y matriz extracelular,64 activación de señales mitogenas 65 y disminución de la apoptosis66 1. Adhesión al estroma celular y matriz extracelular LMC es clínicamente caracterizada por que la medula ósea libera prematuramente células progenitoras, un fenómeno que puede atribuirse a defectos en las propiedades de adherencia de estas células. Los efectos de la BCR-Abl intracelular en un sustrato especifico puede causar una alteración en la estructura del citoesqueleto, que provoca una perturbación dentro y fuera de las moléculas de adhesión 67,68,69 Recientemente se sugiere un importante papel de las β – integrinas en la interacción entre el estroma y las células progenitoras. Las células en la LMC expresan una inhibición en la adhesión de la variante β 1 integrina no encontrada en los progenitores normales 70 En vinculación con sus receptores, las integrinas son capaces de iniciar la señalización normal desde adentro hacia fuera 67 ; por lo tanto es concebible que la transferencia de señales que normalmente inhiben la proliferación se vea afectada en células con LMC porque el gen Abl ha sido involucrado en la transducción intracelular de estas señales, este proceso puede ser alterado por la presencia de un gran numero de proteínas BCR-Abl en el citoplasma. Además, CrKl, una de las mas prominentes tirosina fosforilada por la 64 Gordon MY, Dowding CR, Riley GP, Goldman JM, Greaves MF. Altered adhesive interactions with marrow stroma of haematopoietic progenitor cells in chronic myeloid leukaemia. Nature. 1987;328: 342-344. 65 Puil L, Liu J, Gish G, et al. Bcr-Abl oncoproteins bind directly to activators of the Ras signaling pathway. EMBO J. 1994;13:764773. 66 Bedi A, Zehnbauer BA, Barber JP, Sharkis SJ, Jones RJ. Inhibition of apoptosis by BCR-ABL in chronic myeloid leukemia. Blood. 1994;83:2038- 2044. 67 Cheng K, Kurzrock R, Qiu X, Estrov Z, Ku S, Dulski KM, et al. Reduced focal adhesion kinase and paxillin phosphorylation in BCR-ABL-transfected cells. Cancer. 2002;95:440-50. [PMID: 12124845] 68 Verfaillie CM, Hurley R, Lundell BI, Zhao C, Bhatia R. Integrin-mediated regulation of hematopoiesis: do BCR/ABL-induced defects in integrin function underlie the abnormal circulation and proliferation of CML progenitors? Acta Haematol. 1997;97:40-52. [PMID: 8980609] 69 Gotoh A, Miyazawa K, Ohyashiki K, Tauchi T, Boswell HS, Broxmeyer HE, et al. Tyrosine phosphorylation and activation of focal adhesion kinase (p125FAK) by BCR-ABL oncoprotein. Exp Hematol. 1995;23:1153-9. [PMID: 7556524] 70 Lewis JM, Baskaran R, Taagepera S, Schwartz MA, Wang JY. Integrin regulation of c-Abl tyrosine kinase activity and cytoplasmic-nuclear transport. Proc Natl Acad Sci U S A. 1996;93:15174-15179. 33 proteína BCR-Abl71,esta involucrada en la regulación de motilidad celular 72 y en la adhesión mediada por integrinas 73,74,75 2. Activación de señales mitogenas La activación de las enzimas tirosina quinasas es fundamental para señalización celular y crecimiento, la elevada actividad de la cinasa se ha asociado con la transformación de varios sistemas. La proteína Abl es un no receptor de la tirosina quinasa cuya actividad enzimática esta bajo estricto control fisiológico, y aparece tanto en el núcleo como en el citoplasma76. En contraste, proteínas Bcr-Abl son constitutivamente activadas por las quinasas, y se encuentran exclusivamente en el citoplasma. El grado de transformación de la actividad de Bcr-Abl se correlaciona con el grado de actividad de la tirosina quinasa77. La P190Bcr-Abl, tiene mayor actividad tirosina quinasa74, y se relaciona con el desarrollo del fenotipo mas agresivo en la leucemia aguda (LA). Mientras que p210Bcr-Abl juega un papel importante en el desarrollo del fenotipo de la LMC. 3. Disminución de la apoptosis 71 Oda T, Heaney C, Hagopian JR, Okuda K, Griffin JD, Druker BJ. Crkl is the major tyrosine-phosphorylated protein in neutrophils from patients with chronic myelogenous leukemia. J Biol Chem. 1994;269:22925-22928. 72 Uemura N, Griffin JD. The adapter protein Crkl links Cbl to C3G after integrin ligation and enhances cell migration. J Biol Chem. 1999;274: 37525-37532. 73 Sattler M, Salgia R, Okuda K, et al. The protooncogene product p120CBL and the adaptor proteins CRKL and c-CRK link cABL, p190BCR/ABL and p210BCR/ABL to the phosphatidylinositol-3’ kinase pathway. Oncogene. 1996;12:839-846. 74 Salgia R, Pisick E, Sattler M, et al. p130CAS forms a signaling complex with the adapter protein CRKL in hematopoietic cells transformed by the BCR/ABL oncogene. J Biol Chem. 1996;271: 25198-25203. 75 Sattler M, Salgia R, Shrikhande G, et al. Differential signaling after b1 integrin ligation is mediated through binding of CRKL to p120(CBL) and p110(HEF1). J Biol Chem. 1997;272:14320- 14326. 76 Konopka JB, Watanabe SM, Witte ON. An alteration of the human c-abl protein in K562 leukemia cells unmasks associated tyrosine kinase activity. Cell. 1984;37:1035-42. [PMID: 6204766] 77 Lugo TG, Pendergast AM, Muller AJ, Witte ON. Tyrosine kinase activity and transformation potency of bcr-abl oncogene products. Science. 1990;247: 1079-82. [PMID: 2408149] 34 Las células normales para mantenerse vivas requieren ser estimuladas permanentemente mediante citoquinas, factores de crecimiento, contacto con células vecinas, que mantienen inhibida la apoptosis. Apoptosis o muerte celular programada puede ser considerada un mecanismo protector contra el cáncer, las señales celulares que someten una célula a la apoptosis son múltiples y complejas. La decisión final de una células para iniciar la apoptosis en lugar de detener el ciclo celular, depende de la magnitud y la duración en el daño del estimulo. En la LMC, múltiples mecanismos contribuyen a la resistencia contra la apoptosis. La fosforilación y la activación de la vía PI (3) quinasa78,79es una importante ruta por la que BCR- Abl ejerce su efecto antiapoptosico. La vía PI (3) quinasa activa la vía de la proteína quinasa B (PKB), resulta en la fosforilación y en la inactivación de la proteína pro apoptosica BAD un miembro de la familia Bcl-280.La familia de proteínas Bcl-2 esta constituida por 15 miembros, algunos de ellos activan (Bad, Bax, Bid), y otros inhiben la apoptosis. Las proteínas inhibidoras de la apoptosis representadas por Bcl-2, Bcl-xl y Mcl-1 se insertan como proteínas integrales en la membrana del retículo endoplasmático, membrana nuclear y membrana externa de las mitocondrias estabilizándolas, asegurando su integridad, evitando el aumento de permeabilidad y por ende de la apoptosis. Estas proteínas son codificadas por el proto-oncogén Bcl-2 que se ubica en el cromosoma 18q21. 78 Skorski T, Kanakaraj P, Nieborowska-Skorska M, Ratajczak MZ, Wen SC, Zon G, Gewirtz AM, Perussia B, Calabretta B. Phosphatidylinositol- 3 kinase activity is regulated by BCR/ABL and is required for the growth of Philadelphia chromosome-positive cells. Blood 1995; 86: 726–736. 79 Harrison-Findik D, Susa M, Varticovski L. Association of phos phatidylinositol 3-kinase with SHC in chronic myelogeneous leukemia cells. Oncogene 1995; 10: 1385–1391. 80 Franke TF, Kaplan DR, Cantley LC. PI3K: downstream AKT ion blocks apoptosis. Cell 1997; 88: 435–437. 35 BCR-ABL media la activación de STAT5 y el incremento de los niveles de Bcl-xl pueden aumentar la resistencia a apoptosis81,82,83 Por lo tanto, la generación de apoptosis o anti-apoptosis dependerá del predominio de proteínas de la familia Bcl-2 pro-apoptóticas (Bad, Bax) versus anti-apoptóticas (Bcl-2, Bcl-xl). 2.8 Vías de señalización activadas y propiedades biológicas en las células positivas BCR-Abl Una consecuencia del incremento de la actividad de la tirosina quinasa radica en que el BCR-ABL puede fosforilar diferentes sustratos, activando múltiples señales de transducción en las células. Las vías de señalización activadas son RAS, via Fosfatidilinositol 3- cinasa y Jack- Stat 2.8.1 Vía Ras p210Bcr-Abl y p190Bcr-Abl ejecutan su capacidad de transformación, por activación Ras84,85 .Las proteínas Ras son un conjunto de “interruptores” moleculares muy importantes en una gran variedad de rutas de transmisión de señales celulares que controlan diferentes fenómenos como la integridad del citoesqueleto, apoptosis, proliferación, diferenciación, adhesión y migración celular86,87. 81 de Groot RP, Raaijmakers JA, Lammers JW, Koenderman L. STAT5-dependent cyclinD1 and Bcl-xL expression in BcrAbltransformed cells. Mol Cell Biol Res Commun 2000; 3: 299–305. 82 Horita M, Andreu EJ, Benito A, Arbona C, Sanz C, Benet I, Prosper F, Fernandez-Luna JL. Blockade of the Bcr-Abl kinase activity induces apoptosis of chronic myelogenous leukemia cells by suppressing signal transducer and activator of transcription 5dependent expression of Bcl-xL. J Exp Med 2000; 191: 977–984. 83 Gesbert F, Griffin JD. Bcr/Abl activates transcription of the Bcl- X gene through STAT5. Blood 2000; 96: 2269–2276. 84 Sawyers CL, McLaughlin J, Witte ON. Genetic requirement for Ras in the transformation of fibroblasts and hematopoietic cells by the Bcr-Abl oncogene. J Exp Med. 1995;181:307-13. [PMID: 7807010] 85 Tauchi T, Okabe S, Miyazawa K, Ohyashiki K. The tetramerization domain-independent Ras activation by BCR-ABL oncoprotein in hematopoietic cells. Int J Oncol. 1998;12:1269-76. [PMID: 9592185] 86 Diekmann D, Brill S, Garrett MD, Totty N, Hsuan J, Monfries C, Hall C, Lim L, and Hall A (1991) Bcr encodes a GTPaseactivating protein for p21rac. Nature (Lond) 351:400–402. 36 También puede ser activado por mutaciones aberrantes, los mecanismos mediante los cuales BCR –Abl interactúan con la vía Ras son complejos. La activación inapropiada del gen RAS por una mutación del gen, ha demostrado ser una importante vía de la señal de transducción celular para la proliferación y transformación maligna de los tumores. 2.8.2 Vía Fosfatidilinositol – 3- cinasa La fosfadilinositol- 3. cinasa (PI 3- cinasa) funciona en la regulación del metabolismo lipídico fosfoinositídico y en la generación de segundos mensajeros lipídicos relacionados con la transducción de señales. Se ha visto que una subunidad de esta proteína se fosforila en residuos tirosina en células que expresan BCR-abl y forma complejos con cbl y moléculas adaptadas crk y crkl.76,88 PI3 está activado de forma constitutiva por la translocación BCR-abl jugando un papel importante en su transformación89 2.8.3 Vía Jak- Stat Funciones celulares como el crecimiento, diferenciación o activación están finamente reguladas por unos factores solubles como las citocinas, factores de crecimiento y 87 Michael W.N. Deininger John M. Goldman and Junia V Melo. The molecular bilogy of chronic myeloid leukemia 2000; 96:3343-3356 88 Rameh LE. Cantley LC. The role of phosphoinositide 3-kinase lipid products in cell function. L Biol Chem 1999; 274:8347-8350. Slorski T, Kamakaraj P. Nieborowskaskorska M et al. Phosphatidylinositol – 3 kinase activity is regulated by bcr-abl and is required for the growth of Philadelphia chromosome- positive cells. Blood 1995; 86: 726-736 89 37 hormonas. Estos factores ejercen dichas funciones a través de la interacción con sus receptores específicos en los distintos tipos celulares de modo que la unión con este receptor induce la dimerización del mismo y provoca la activación de diferentes vías de señalización empleadas por múltiples citocinas, las componen una serie de proteínas denominadas genéricamente Jak (Janus tyrosine kinases) y Stat (Signal Transducer and Activators of transcription). La vía de Jak- Stat se ha demostrado esencial tanto para las citocinas de tipo I ( aquellas cuyos receptores son miembros de la superfamilia de los receptores de citocinas el cual contiene cuatro residuos cisteína conservados y un motivo extracelular triptófano – serina – X- triptófano- serina), como para las de tipo II ( interferones e interleucina (IL) – 10 que posee los cuatro residuos cisteína pero no posee dominios extracelulares) representando una manera de señalización desde la membrana celular hasta el núcleo extraordinariamente rápida. Hasta el momento se han identificado tres Jak quinasas: Jak1, Jak 2, Jak 3. Fosforilación constitutiva de factores de transcripción Stat (Stat1 y Stat5) han sido reportados en líneas celulares positivas BCR-Abl90 y en células primarias con LMC91, la activación de Stat5 contribuye a la transformación maligna 78 aunque el Stat5 tiene funciones pleiotropicas92, su efecto en la transformación de células BCR-Abl parece ser anti-apoptosis e implica la activación transcripcional de Bcl-xL 79. En contraste con la activación de la vía Jak-Stat por medio de estímulos fisiológicos, BCR-Abl activa directamente Stat1 y Stat5 sin previa fosforilación de proteínas Jak. BCR-Abl con actividad tirosina quinasa puede inducir la expresión de citoquinas, factores de crecimiento, receptores del factor de crecimiento como el oncostatin M y receptor β93, sin embargo durante la fase crónica de la LMC las células progenitoras dependen todavía de los factores de crecimiento externo para su supervivencia y proliferación,94 (Figura.5) 90 Ilaria RL Jr, Van Etten RA. P210 and P190(BCR/ ABL) induce the tyrosine phosphorylation and DNA binding activity of multiple specific STAT family members. J Biol Chem. 1996;271:31704- 31710. 91 Chai SK, Nichols GL, Rothman P. Constitutive activation of JAKs and STATs in BCR-Abl-expressing cell lines and peripheral blood cells derived from leukemic patients. J Immunol. 1997; 159:4720-4728. 92 Nosaka T, Kawashima T, Misawa K, Ikuta K, Mui AL, Kitamura T. STAT5 as a molecular regulator of proliferation, differentiation and apoptosis in hematopoietic cells. EMBO J. 1999;18:4754- 4765. 93 Deininger MW, Vieira S, Mendiola R, Schultheis B, Goldman JM, Melo JV. BCR-ABL tyrosine kinase activity regulates the pression of multiple genes implicated in the pathogenesis of chronic myeloid leukemia. Cancer Res. 2000;60:2049- 2055 94 Amos TA, Lewis JL, Grand FH, Gooding RP, Goldman JM, Gordon MY. Apoptosis in chronic myeloid leukaemia: normal responses by progenitor cells to growth factor deprivation, X-irradiation and glucocorticoids. Br J Haematol. 1995; 91:387-393. 38 Figura. 5. P210 codificación BCR-Abl vías de señalización Fuente: Razelle Kurzrock, MD; Hagop M. Kantarjian, MD; Brian J. Drunker, MD; y Moshe Talpaz, MD. Philadelphia Chromosome – positive leukemias: From Basic Mechanisms to Molecular Therapeutics. Ann Intern Med. 2003; 138:819-830 2.9 Heterogeneidad fenotípica de las enfermedades cromosoma de filadelfia positivo La translocación del cromosoma de filadelfia se encuentra es mas del 90 % de pacientes con LMC y en algunas personas con Leucemia Aguda (LA) (Tabla 3). 39 Aproximadamente el 50 % de los casos de cromosoma de filadelfia positivo para LA en adultos se caracteriza por una anormalidad molecular que debe ser diferenciada de una LMC en crisis blástica, con una fase crónica asintomática95,96,97 Tabla.3. Frecuencia del Cromosoma de Filadelfia, p210 Bcr-Abl, p190Bcr-Abl, en Leucemia Desorden Pacientes Pacientes Pacientes Ph (-), Bcr- Ph (-) , Bcr- Ph (-), Bcr- con Ph con Ph (+) con Ph (+) Abl (+) Abl (+), Abl (+), Bcr-Abl Bcr-Abl (+) p210 p190 p210 Bcr-Abl p190Bcr-Abl % LMC 90-95 >99 <1 5 100 Raro LLA adulto 20 50-80 20-50 10 ~50 ~50 LLA niño 5 10 90 Desconocido Desconocido Desconocido LMA 2 50 50 raro Desconocido Desconocido Fuente: Razelle Kurzrock, MD; Hagop M. Kantarjian, MD; Brian J. Drunker, MD; y Moshe Talpaz, MD. Philadelphia Chromosome – positive leukemias: From Basic Mechanisms to Molecular Therapeutics. Ann Intern Med. 2003; 138:819-830 2.10 Leucemia Aguda con cromosoma de filadelfia positivo La leucemia linfoide aguda (LLA) se caracteriza por el crecimiento anormal de linfoblastos en la medula ósea, sangre, órganos linfoides, y sitios extramedulares, 95 Rodenhuis S, Smets LA, Slater RM, Behrendt H, Veerman AJ. Distinguishing the Philadelphia chromosome of acute lymphoblastic leukemia from its counterpart in chronic myelogenous leukemia [Letter]. N Engl J Med. 1985;313:51-2. [PMID: 3858671] 96 Kurzrock R, Shtalrid M, Romero P, Kloetzer WS, Talpas M, Trujillo JM, et al. A novel c-abl protein product in Philadelphiapositive acute lymphoblastic leukaemia. Nature. 1987;325:631-5. [PMID: 3543692] 97 Erikson J, Griffin CA, ar-Rushdi A, Valtieri M, Hoxie J, Finan J, et al. Heterogeneity of chromosome 22 breakpoint in Philadelphia-positive (Ph_) acute lymphocytic leukemia. Proc Natl Acad Sci U S A. 1986;83:1807-11. [PMID: 3513189] 40 acompañada frecuentemente por pancitopenia. La presencia del cromosoma de filadelfia es un factor de mal pronóstico por la alta incidencia de recaída y la no respuesta al tratamiento. En contraste, en LLA, aproximadamente el 50 % de los pacientes con cromosoma de filadelfia positivo tiene rupturas dentro de la región central M-BCR; el resto tiene rupturas mas proximales, justo distal del primer exón del BCR (en la región menor- BCR (m-BCR)).98 Otro apartado interesante del análisis molecular es el de las leucemias agudas Phpositivo, que constituyen el 25% de las leucemias agudas linfoblásticas del adulto, el 5% de las del niño y el 2% de las leucemias agudas mieloblástica99 2.11 Implicaciones de estudios moleculares en cromosoma de filadelfia negativo en LMC y LA Aproximadamente del 5% al 10 % de pacientes con LMC carecen de la translocación del cromosoma de Filadelfia. Sin embargo, análisis del cromosoma han demostrado que la huella dactilar de la LMC (BCR-ABL) esta presente en la mitad de estos pacientes100,101,102,103 .Aproximadamente el 10 % de los pacientes LLA con cromosoma Filadelfia negativo y BCR-ABL (+), tienen un curso clínico y respuesta a la terapia, semejante a los pacientes con LMC.104,96,95 Algunos pacientes con LMC son BCR-ABL negativos, pero sus cursos clínicos son distintos que los de sus homólogos BCR-ABL positivos.94, 95 98 Laurent E, Talpaz M, Kantarjian H, Kurzrock R. The BCR gene and Philadelphia chromosome-positive leukemogenesis. Cancer Res. 2001;61:2343- 55. [PMID: 11289094] 99 Epner DE, Koeffler HP.Molecular advances in chronic myelogenous leukemia. Ann Intern Med 1990; 113: 3-6 100 Kurzrock R, Bueso-Ramos CE, Kantarjian H, Freireich E, Tucker SL, Siciliano M, et al. BCR rearrangement-negative chronic myelogenous leukemia revisited. J Clin Oncol. 2001;19:2915-26. [PMID: 11387365] 101 Kurzrock R, Kantarjian HM, Shtalrid M, Gutterman JU, Talpaz M. Philadelphia chromosome-negative chronic myelogenous leukemia without breakpoint cluster region rearrangement: a chronic myeloid leukemia with a distinct clinical course. Blood. 1990;75:445-52. [PMID: 2403827] 102 Kurzrock R, Blick MB, Talpaz M, Velasquez WS, Trujillo JM, Kouttab NM, et al. Rearrangement in the breakpoint cluster region and the clinical course in Philadelphia-negative chronic myelogenous leukemia. Ann Intern Med. 1986; 105:673-9. [PMID: 3094418] 103 Shtalrid M, Talpaz M, Blick M, Romero P, Kantarjian H, Taylor K, et al. Philadelphia-negative chronic myelogenous leukemia with breakpoint cluster region rearrangement: molecular analysis, clinical characteristics, and response to therapy. J Clin Oncol. 1988;6:1569-75. [PMID: 3171624] 104 Kantarjian H, Talpaz M, Estey E, Ku S, Kurzrock R. What is the contribution of molecular studies to the diagnosis of BCRABL-positive disease in adult acute leukemia? Am J Med. 1994;96:133-8. [PMID: 8109597] 41 2.11.1 Leucemia Aguda con cromosoma de filadelfia positivo El cromosoma de Filadelfia positivo ha sido encontrado en algunos pacientes con Leucemia Aguda, constituyen el 25% de las leucemias agudas de precursores linfoides del adulto, el 5% del niño y el 2% de las leucemias mieloides agudas100 La proteína de fusión citoplasmática de 210 kd, puede ser b3a2, en el 55% de los casos o b2a2 en el 40 %. Esta proteína se observa en el 20 % de los pacientes con LLA. Mucho menos frecuente es el punto de ruptura menor (m-BCR) transcripciones (e2a2); resultando en la proteína de 190kd que se observa en el 10 % de las LLA del adulto y en el 5% de las LLA pediátricas.105 La presencia del cromosoma de filadelfia es un factor de mal pronóstico por la alta incidencia de recaída, y resistencia a la quimioterapia. 2.12 Características clínicas de la LMC La LMC evoluciona de una manera bi – o trifásica. El paso de una fase a otra se define mediante la evolución de parámetros clínicos y analíticos. El 80 % de los pacientes se diagnostican en fase crónica (FC), evolucionando a fase acelerada (FA) para terminar en crisis blástica (CB). El 20 % restante evoluciona directamente a CB sin previo paso por FA. De éstos, aproximadamente un 10 % se presentan directamente en FA o CB106, 101, 103 Los síntomas más frecuentes referidos por los pacientes por orden de frecuencia son astenia, anorexia o pérdida de peso, sudoración, fiebre, dolores óseos, cefalea, dolor esternal, hepatomegalia y esplenomegalia107 105 Laurent E, Talpaz M, Kantarjian H, Kurzrock R. The BCR gene and Philadelphia chromosome-positive leukemogenesis. Cancer Res. 2001;61:2343- 55. [PMID: 11289094] 106 Spiers, A.S.D. Clinical manifestations of chronic granulocityc leukemia. Seminars in Oncology 1995; 22:380-395. 107 Lithman M A, Heal J, Rowe Jm. Hyperleukocyte leukaemia. Bailliers Clin Haematol 1987; 1: 725 42 Otros síntomas de presentación menos frecuente serán los ocasionados por hipermetabolismo, como sudoración nocturna, intolerancia al calor, pérdida de peso que simula una tiroxicosis (es un trastorno poco frecuente en la infancia, está caracterizada por un metabolismo acelerado de los tejidos corporales debido a niveles séricos excesivos de hormonas libres), artritis gotosa aguda, priapismo, acúfenos, dolores a consecuencia de infartos esplénicos, diabetes insípida sensible a vasopresina108 2.12.1 Fase crónica La FC se define mediante datos del laboratorio: la sangre periférica se caracteriza por presentar una leucocitosis (12- 1000 X 109/ L) neutrófilos en diferentes estadios de maduración, con altos picos en el porcentaje de mielocitos y neutrófilos segmentados.101,102,109,110,111 Conteo de blastos usualmente menor a 2 %112,113, basofilia absoluta y en algunos pacientes se presenta también eosinofilia y puede estar presente un porcentaje de mas o menos el 3 % de monocitos114, el recuento de plaquetas puede estar normal o aumentado en este caso pueden exceder las 1000 X 109 /L. La mayoría de los pacientes hacen anemia por lo general normocítica normocromica. En la fase crónica, se presenta esplenomegalia por la infiltración en los cordones de la pulpa roja por granulocitos en diferentes estadios de maduración.114 La celularidad en la medula ósea incrementa con la proliferación y maduración reflejada en la sangre periférica.114,115 Los megacariocitos son más pequeños que lo normal e hipólobulados. Las células Pseudo Gaucher y los histiocitos azules son comúnmente 108 Juan D, Hsu S-D, Hunter J: Case report of vasopressin – responsive diabetes insipidus associated with chronyc myelogenous leukaemia. Cancer 1985; 56: 1468-1469. 109 Cotta CV, Bueso- Ramos CE (2007) New insights into the pathobiology and treatment of chronic myelogenous leukemia. Ann Diagn Pathol 11: 68-78 110 Garcia- Manero G, Faderl S, O’Brien S, Cortes J, Talpaz M, Kantarjian HM (2003). Chronic myelogenous leucemia: a review and update of therapeutic strategies, Cancer 98:437-457 111 Kluin- Nelemans HC, Buck G, le Cessie S, Richards S, Beverloo HB, Falkenburg JH, Littlewood T, Muss P, Bareford D, van der LH. Green AR, Roozendal KJ, Milne AE, Chapman CS, Shepherd P (2004). Randomized comparison of low- dose versus high-dose interferon- alfa in chronic myeloid leukemia: prospective collaboration of 3 joint trials by the MRC and HOVON groups. Blood 103: 4408-4415 112 Benett JM Catovsky D,Daniel MT, Flandrin G,Galton DA, Gralnick H, Sulfan C, Cox C (1994). The chronic myeloid leukaemias: guidelines for distinguishing chronic granulocytic, atypical chronic myeloid, and chronic myelomonocytic leukaemia. Proposals by the French –American- British cooperative leukaemia group. Br J Haematol 87:747-754 113 Spiers AS Bain BJ, Tuner JE (1977). The peripheral blood in chronic granulocytic leukaemia. Study of 50 untreated Philadelphia positive cases, Scand J Haematolog 18: 25-38 114 Spiers A,S Bain BJ, Turner JE (1977) the peripherial blood in chronic granulocytic leukaemia. Study of 50 untreated philadelphia positive cases. Scand J. Haematol 18:25-38 115 Muehleck SD, Mckenna RW Arthur DC, Parkin JL,Brunning RD (1984). Transformation of chronic myelogenous leukemia: clinical, morphologic, and cytogenetic features. Ann J Clinn Pathol 82: 1-14 43 observados secundarios al incremento celular derivado del clon neoplásico.116,117 Más del 80 % de los pacientes tienen una disminución significativa o ausencia de los macrófagos con hierro. La LMC se diagnostica en el 95% de los pacientes en la llamada fase crónica, cuyo inicio es habitualmente insidioso. El diagnostico de la enfermedad va precedido en muchos casos por un periodo de varios meses en que los pacientes presentan síntomas inespecíficos (astenia, anorexia, perdida de peso, sudoración nocturna), fácil de controlar con diferentes medidas terapéuticas101, 103, en relación con la existencia de un estado de hipermetabolismo debido al aumento del recambio granulocitario, o bien molestias provocadas por la esplenomegalia (por lo general, dolor en el flanco izquierdo del abdomen o sensación de llenura y con menor frecuencia, dolor agudo en hipocondrio izquierdo irradiado al hombro, que aumenta con la respiración y se debe a un infarto esplénico). Otras manifestaciones clínicas, como hemorragias, dolores óseos, síndrome anémico, priapismo, litiasis renal, crisis de gota o prurito, son menos frecuentes, siendo excepcionales los síntomas de leucostasis por leucocitosis extrema (cefalea, insuficiencia respiratoria). En la exploración física inicial el dato mas frecuente es la esplenomegalia. Dicho hallazgo se presenta en el 80-90%. No obstante, la frecuencia creciente de enfermos asintomáticos y con escasa leucocitosis al diagnostico, se ha visto acompañada por una frecuencia menor de esplenomegalia inicial (alrededor del 60% de los casos), pues suele existir correlación entre la intensidad de la leucocitosis y el tamaño del bazo.118 (Tabla.4.) Tabla.4. Síntomas y signos más frecuentes de la LMC Ph (+) en fase crónica Signos y Síntomas % de Pacientes • Astenia 80 • Anorexia 60 • Pesadez abdominal 40 15 116 Anastasi J, Musvee T, Roulston D, Domer PH, Larson RA, Vardiman JW (1998). Pseudo Gaucher histiocytes identified up to 1 year after transplantation for LMC are BCR/ABL positive. Leukemia 12: 233-237 117 Thiele J, Schmitz B, Fuchs, R, Kvasnicka HM, Lorenzen J, Fischer R (1998). Detection of the bcr/abl gene in bone marrow macrophages in LMC and alterations during interferon therapy-a fluorescence in situ hybridization study on trephine biopsies. J Pathol 186: 331-335 118 Jolynn sessions, Pharm D, BCOP. Chronic myeloid leukemia in 2007, JMCP Vol 13, No 8, 5-a 44 • Sudoración 10 • Fiebre 10 • Dolores óseos 5 • Cefalea 85 • Esplenomegalia 80 • Dolor esternal 40 • Hepatomegalia 21 • Esplenomegalia > 10 cm 2.12.2 La fase acelerada La clínica que presenta el paciente será la consecuencia de la progresión de la enfermedad, siendo ya frecuente la aparición de fiebre, sudoración, dolores óseos, nauseas, dolor abdominal, púrpuras y aumento de infecciones. La FA se define por la presencia de uno o más de los siguientes criterios 1. Persistencia en el incremento del recuento de glóbulos blancos ( 10 X 109/L) y/ o persistencia de esplenomegalia que no responde a la terapia 2. Persistencia de trombocitosis (1000 X 109/ L) no controlada con la terapia 3. Persistencia de trombocitopenia ( 100 X 109/ L) no relacionada a la terapia 4. Evolución clonal citogenética ocurre antes del diagnostico inicial con cariotipo 5. 20 % o mas de basófilia en sangre periférica 6. 10 – 19% mieloblastos en sangre o medula ósea Los criterios 1-4 están asociados con la transformación de fase Crónicas a fase acelerada, y los criterios 5- 6 indican frecuentemente transición entre fase acelerada a crisis blástica. 2.12.3 Fase Blástica La clínica continuará siendo la de la evolución de la enfermedad, con aparición de 45 hemorragias, complicaciones infecciosas, adenopatías y disfunción del sistema nervioso central. Los pacientes en crisis blástica tienen mal pronóstico, con una mediana de supervivencia de 3 a 6 meses.119,120 La fase blástica se define por: Blastos iguales o mayores a 20% ,cuando la proliferación blástica es extramedular, aproximadamente un 70% de los casos, el linaje del blasto es mieloide y puede incluir neutrófilos, eosinófilos, basófilos, monocitos, megacariocitos o blastos eritroides o una combinación de cualquiera de los anteriores. En aproximadamente un 20-30 % de los casos los blastos son linfoblastos121,122 2.13 Diagnostico de la Leucemia Mieloide Crónica • Aspirado de Medula Ósea • Biopsia de Medula Ósea • Estudio Citogenético • Estudio Molecular: FISH y PCR 2.14 Tratamiento con inhibidores de la tirosincinasa Las tirosincinasas son enzimas que transfieren un fosfato del ATP a las proteínas sustrato que regulan procesos como la proliferación celular, la diferenciación y la supervivencia, con un papel fundamental en la regulación de la apoptosis. El inicio irregular en la activación de una tirosincinasa concreta puede tener una gran importancia en la transformación maligna. Esto es lo que ha hecho a la inhibición de las tirosincinasas una diana terapéutica atractiva.123 La inhibición de las proteínas tirosincinasas implicadas en 119 Horowitz MM, Rowlings PA, Passeweg JR. Allogeneic bone marrow transplantation for CML: a report from the International Bone Marrow Transplant Registry. Bone Marrow Transplant 1996; 17 (suppl 3): S5-S6 120 McGlave PB, Shu XO, Wen W et al. Unrelated donor marrow transplantation for chronic myelogenous leukemia: 9 years experience of the National Marrow Donor Program. Blood 2000; 95: 2219-2225. 121 Derderian PM, Kantarjian HM, talpaz M, O’Brien S, Cork A, Estey E, Pierce S, Keating M ( 1993) Chronic myelogenous leukemia in the lymphoid blastic phase: characteristics, treatment response, and prognosis Ann J Med 94: 69-74 122 Jaffe ES, Harris NL, Diebold J, Muller- Hermelik HK(1998). World Health Organization Classification of lymphomas: a work in progress. Ann Oncol 9 Suppl 5: S25-S30 123 Druker BJ, Sawyer CL, Kantarjian H, Resta DJ, Reese SF, Ford JM et al. Activity of a specific inhibitor of the BCR ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med. 2001; 344: 1038-1042. 46 una determinada neoplasia puede producir beneficio terapéutico. Las siguientes consideraciones apoyan este hecho: • La necesaria activación de proteínas tirosincinasas para la proliferación o supervivencia de células tumorales • La potencia o especificidad del inhibidor. • La toxicidad del inhibidor, o sea, tanto las consecuencias específicas como las no específicas de la inhibición de la actividad tirosincinasa “ normal” • Las propiedades de los inhibidores, incluyendo la permeabilidad celular, la estabilidad, el metabolismo de productos activos e inactivos, la solubilidad y la distribución intracelular. La eficacia de un inhibidor de tirosincinasa dependerá del papel de éstas en el origen de la enfermedad. Por ejemplo, en la LMC, un inhibidor de la tirosincinasa ABL puede ser efectivo en estadíos tempranos de la enfermedad. Sin embargo, en otros procesos o, incluso en fases avanzadas de LMC, donde la actividad tirosincinasa es sólo una de las anormalidades, se requerirá una combinación con otras acciones terapéuticas124 Desde que se observó que todas las proteínas- cinasas usan ATP como donante de fosfato con un alto grado de conservación entre los dominios tirosincinasas, se pensó que los inhibidores de los puentes de unión del ATP podrían tener especificidad suficiente para ser clínicamente útiles. 2.15 Imatinib El Imatinib (STI- 571) es un derivado fenilaminopirimidina descrito en principio como un eficaz inhibidor de la proteína quinasa C (PKC).125El cual suprime selectivamente el crecimiento de líneas celulares de LMC y colonias BCR-ABL positiva formadoras de colonias de unidades granulocito macrófago (CFU-GM) obtenidas de pacientes con LMC126 124 Raitano AB., Whang YE, Sawyers CL. Signal transduction by wild-type and leukemiogenic Abl proteins. Biochim Biophys Acta 1997; 1333 (3): F 201-216 125 Capdeville R, Buchdunger E, Zimmerman J, Matter A. Glivec (STI, imatinib) a rationally developed targed anticancer drug, Nat Rev Drug Discov 2002; 1: 493-502. 126 Drunker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the abl tyrosine kinase on the growth of BCRABL positive cells. Nature Medicine 1996,2, 561 47 Ocurren tres mecanismos por los cuales el Imatinib ejerce su efecto: 1. Inhibición de la auto fosforilación de BCR-ABL y la de sus sustratos moleculares; La inactivación enzimática se consigue uniéndose a la zona de la tirosina quinasa que liga adenosina trifosfato (ATP).128A nivel molecular el Imatinib es capaz de inhibir la actividad tirosina quinasa del oncogén BCR- ABL p 210.La inhibición de la fosforilación que produce el Imatinib se correlaciona con la actividad antiproliferativa y muerte celular que produce el fármaco en las células BCRABL positivas. 2. Inhibición de la proliferación celular; Inhibe los receptores tirosina cinasas del factor de crecimiento derivado de las plaquetas y el c-Kit, ocupa los sitios de unión del ATP de varias moléculas de tirosina cinasas y previene la fosforilación de estas proteínas las cuales llevan a la activación de señales de transducción que juegan un papel importante en la proliferación celular. 3. Inducción de la apoptosis; El Imatinib induce apoptosis y parada de ciclo en las células BCR-ABL positivas a través de las proteínas Stat5. En estas células tumorales, el Imatinib inhibe la capacidad de Stat5 de transactivar genes relacionados con la apoptosis como Bcl-xl, e impide la pérdida de adhesión que sufren las células BCR- Abl positivas.126,127 (Figura.6) 127 Michael W.N. Deininger, Stephen G. O´Brien, John M, Ford, and Brian J. Druker. Practical management of Patients with Chronic Myeloid Leukemia Receiving Imatinib, J Clin Oncol 21:1637-1647 48 Figura.6. Mecanismos de acción del Imatinib 49 Fuente. Razelle kurzrock, MD; Hagop M. Kantarjian, MD; Brian Drunker, MD; and Moshe Talpaz, MD. Philadelphia Chromosome- Positive Leukemia: from Basic Mechanisms to Molecular Therapeutics Actualmente, el seguimiento del tratamiento con Imatinib de los pacientes con LMC es relativamente corto, pero si las respuestas son sostenidas y confirmadas de forma general (respuesta hematológica, citogenética y molecular), este fármaco nuevo se convertirá en una opción terapéutica, diferente al trasplante (Tabla 5, 6,7) Tabla .5. RESPUESTA HEMATOLOGICA AL IMATINIB Respuestas o Remisión Criterios Normalización completa de los recuentos en sangre periférica de: 3 Glóbulos blancos menor 10.000/mm Respuesta hematológica Ausencia de elementos inmaduros (promielocitos, clínica completa mielocitos o blastos en sangre periférica). Plaquetas dentro de rango normal. Desaparición de síntomas y signos clínicos de enfermedad Persistencia de células inmaduras en sangre periférica Respuesta hematológica Plaquetas menor 50% de la cuenta pre tratamiento, clínica parcial pero mayor de 450.000xmm 3 Esplenomegalia persistente, pero menor 50% de tamaño pre tratamiento. Fracaso de Imatinib Ausencia de respuesta hematológica completa a los tres meses 50 Tabla.6. RESPUESTA CITOGENETICA AL IMATINIB Respuesta citogenética Completa: Cromosoma de Filadelfia negativo Mayor: Cromosoma de Filadelfia 1- 35% ( R. Completa + R. Parcial) Menor: Cromosoma de Filadelfia 36-90 % Sin respuesta: Cromosoma de Filadelfia > 90% Tabla 7. RESPUESTA MOLECULAR AL IMATINIB Respuesta molecular molecular mayor (RMM):< 0.10 molecular completa RMC: No identificación de transcriptos Fuente: Baccarani M. Evolving concepts in the management of chronic myeloid leukemia. Recommendations from an expert panel on behalf of the European leukemianet. Blood 2006; 108: 1809 – 1820 2.15.1 Farmacocinética El Imatinib es bien absorbido luego de la administración oral con una concentración máxima a las 2 a 4 horas post administración. Tiene una biodisponibilidad del 98 %, la vida media es de aproximadamente 18 horas y su metabolito activo n-desmetil 40 horas. Un 95 % es transportado por proteínas plasmáticas, principalmente albúmina y glicoproteína α 1. Es principalmente metabolizado por la enzima CYP3A4 y 51 la enzima citocromo P450 entre otros128 2.15.2 Efectos Adversos El Imatinib es generalmente bien tolerado aunque los efectos adversos son bastante comunes, estos son usualmente leves y mas comunes en fases avanzadas de LMC y solo raramente conduce a la suspensión del tratamiento.130 Los efectos adversos, incluyen; náuseas (50-70%), vómitos (23-50%), diarrea (24-40%), dispepsia y dolor abdominal, edemas; más frecuentes peri orbitario o en extremidades inferiores (55-66%), la probabilidad de edemas fue incrementada con altas dosis de Imatinib y edad mayor de 65 años.82, 128 (Tabla 8) Tabla.8. Reacciones adversas Infecciones e infestaciones Poco comunes: Septicemia, neumonía, herpes simple, herpes zóster, infección respiratoria alta, gastroenteritis Trastornos hematológicos y linfáticos Muy comunes: Neutropenia, trombocitopenia, anemia Comunes: Neutropenia febril Poco comunes: Pancitopenia, mielodepresion Trastornos metabólicos y nutricionales Comunes: Anorexia Poco comunes: Deshidratación, hiperuricemia, hipopotasemia, gota, hipofosfatemia Raros: Confusión Trastornos psiquiátricos Poco comunes: Depresión, ansiedad, disminución de la libido Raros: Confusión Trastornos del sistema nervioso Muy comunes: Cefalea Comunes: Mareos, insomnio Poco comunes: hemorragia cerebral, sincope, neuropatía periférica, somnolencia, migraña, 128 Kantarjian H, Sawyer C, Hochhaus A, et al. Haematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med; 2002, 346: 645-652 52 alteraciones de la memoria Raros: Edema cerebral, hipertensión craneal, convulsiones La LMC es una de las pocas neoplasias que cursa con una única alteración genética, al menos en su fase inicial o crónica, y en la que la actividad quinasa de ABL desempeña un papel crucial, razón por la cual es preferible tratarla en esta fase.129, 130,131,132,133 2.15.3 Mecanismos de resistencia al Imatinib Hay dos categorías de resistencia a Imatinib las cuales han sido designadas como BCR – ABL independiente y BCR – ABL dependiente. En la primera categoría, la actividad de la tirosina quinasa del BCR-ABL es inhibida, alcanzando el Imatinib su objetivo, considerándose que esto es debido a cambios oncogénicos secundarios (evolución clonal). En el segundo escenario el BCR – ABL no es inhibido y en este pueden ser útiles otras drogas inhibidoras del BCR – ABL, estos mecanismos son: alfa –1 ácido glicoproteína, amplificación BCR – ABL, y mutaciones del dominio del BCR – ABL (Ploop, T315, m351, A –loop, entre otras)134,135 Es importante señalar que más del 50% de los pacientes con recaída y quizá cerca del 90% de los pacientes con resistencia al Imatinib presentan mutaciones puntuales en BCR – ABL y más del 50% de casos presentan evolución clonal principalmente; trisomía 8, cromosoma 17q, doble cromosoma Filadelfia y/o trisomía 18. Estas anormalidades cromosómicas pueden ser transitorias y desaparecer con terapia continua con Imatinib, 129 Faderl S, Talpaz M, Estrov Z, Kantarjian H, Chronic Myelogenous Leukemia: biology and therapy, Ann Intern Med; 1999:131:207 – 219. 130 Kantarjian H, Cortes J, O´Brian S, et al. Long term survival benefit and improved complete cytogenetic and molecular response rates with imatinib mesylate in Philadelphia chromosome – positive chronic – phase chronic myeloid leukemia after failed of interferon - α. Blood; 2004: 104:1979 – 1988. 131 Cortes J, Talpaz M, Giles F, et al. Prognostic significance of cytogenetic clonal evolution in patients with chronic myelogenous leukemia on mesylate therapy. Blood. 2003;101: 3794-3800. 132 O´Brien S, Guilhot F, larson R, et al, Imatinib Compared with interferon and low - cytarabine for newly diagnosed chronic phase chronic myeloid leukemia. N. Engl, J Med, 2003; 348:994 – 1004. 133 Druker B, Talpaz M, Resta D, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med.2001; 344: 1031-1037. 134 Michael W.N. Deininger, Stephen G. O´Brien, John M, Ford, and Brian J. Druker. Practical management of Patients with Chronic Myeloid Leukemia Receiving Imatinib, J Clin Oncol 21:1637-1647 135 Faderl S, Talpaz M, Estrov Z, Kantarjian H, Chronic Myelogenous Leukemia: biology and therapy, Ann Intern Med; 1999:131:207 – 219. 53 principalmente en aquellos pacientes que alcanzaron respuesta citogenética completa. 136,137 3. JUSTIFICACIÓN 136 Deininger M., Buchdunger E., Druker B. The development of Imatinib as a therapeutic agent for chronic myeloid Leukemia. Blood. 2005; 105: 2640-2653. 137 Griffin J., Weisberg E. Resistance to Imatinib (Glivec): Update on clinical mechanisms. Drug Resistance Updates. 2003: 6; 231238. 54 La leucemia Mieloide Crónica es considerada actualmente como un importante problema de salud publica, que tiende a incrementarse a medida que la población envejece, el 50 % de las LMC son diagnosticadas por exámenes de laboratorio de rutina11 Es una enfermedad común en el ser humano, pero con mayor impacto en países subdesarrollados como el nuestro, está entre las 10 primeras causas de muerte en Colombia y se encuentra cerca del 65% de todas las muertes por cáncer17 El manejo terapéutico de la LMC con agentes como hidroxiurea y busulfán logra conseguir el control clínico y hematológico de la enfermedad, aumenta la supervivencia de los pacientes, pero los expone a los pacientes a un seguimiento más estrecho debido a la alta frecuencia de efectos adversos graves, que pueden obligar a la suspensión de la terapéutica e inadecuado control de la enfermedad llevando a frecuentes hospitalizaciones y por ende mala calidad de vida. El interferón alfa logra remisión hematológica, citogenética y molecular aunque en un porcentaje muy bajo, el costo y los efectos adversos que en muchos pacientes no son tolerados son los principales problemas que se presentan con este tratamiento. Imatinib ha revolucionado el tratamiento de la LMC, por su precisión para dirigirse a los blancos moleculares ya que suprime los genes que expresan la enfermedad, lo que plantea una mayor probabilidad de control clínico-hematológico y citogenético facilitando la potencial remisión y manejo en aquellos pacientes en los que no es posible la realización de trasplante de células madres hematopoyéticas y con menos efectos adversos que los tratamientos anteriores. Han existido cambios dramáticos en el tratamiento de la LMC con la llegada del Imatinib, obteniéndose mayores tasas de remisiones hematológicas, citogenéticas y moleculares, que con los tratamientos anteriores no se obtenían, a pesar de los conocimientos adquiridos sobre Imatinib en el ámbito internacional, es necesario iniciar el estudio de este tipo de fármaco, para evaluar su 55 respuesta clínica-hematológica y citogenética y eventualmente conocer como modifica la evolución natural de la enfermedad en nuestra población. Dado la importante repercusión en la salud presente y futura de esta patología, junto al interés que suscita actualmente en la comunidad científica, se considera importante realizar este estudio, ya que en la literatura investigada en nuestro medio, no se encontraron antecedentes al problema. Finalmente debe mencionarse es importante conocer el estado actual del arte a nivel mundial en este tema a través de una revisión sistemática de la literatura para conocer el comportamiento de la enfermedad para así facilitar y promover el uso adecuado de los recursos en salud. 4. PLANTEAMIENTO DEL PROBLEMA ¿Cuál es la respuesta de los pacientes con Leucemia Mieloide Crónica al tratamiento con Imatinib en el Instituto Nacional de Cancerología, en Enero del 2002 - Enero del 2006? 56 5. OBJETIVOS 5.1 OBJETIVO GENERAL Conocer el comportamiento de la LMC y su respuesta al tratamiento con Imatinib. 5.2 OBJETIVOS ESPECIFICOS 57 • Revisar las historias clínicas de los pacientes tratados en el Instituto Nacional de Cancerología, caracterizarlos por edad, sexo y tipo de respuesta hematológica al tratamiento con Imatinib • Revisar las historias clínicas de los pacientes tratados en el Instituto Nacional de Cancerología, caracterizarlos por edad, sexo y tipo de respuesta citogenética al tratamiento con Imatinib • Conocer la continuidad terapéutica que tienen los pacientes en manejo con el Imatinib • Comparar los resultados hematológicos y citogenéticos al momento del diagnostico con los encontrados en los diferentes momentos de seguimiento en el INC • Determinar la respuesta al tratamiento con Imatinib • Conocer la supervivencia libre de progresión en los pacientes con LMC en tratamiento con Imatinib • Conocer la supervivencia total en los pacientes con LMC en tratamiento con Imatinib 6. MATERIALES Y MÉTODOS 6.1 POBLACIONES EN ESTUDIO 6.1.1 Universo El universo fue conformado por 157 pacientes con diagnostico de LMC que asistieron al Servicio de Hematología y transplante del Instituto Nacional de Cancerología en el periodo de Enero 2002 – Enero del 2006 6.1.2 Muestra La Conformaron 26 pacientes con diagnostico de LMC ingresados en el Instituto 58 Nacional de Cancerología entre Enero 2002 - Enero 2006, que cumplieron los criterios de inclusión. 6.1.3 VARIABLES DEL ESTUDIO • Edad • Sexo • Fecha de diagnóstico de la LMC al inicio de tratamiento con Imatinib • Recuento diferencial en el frotis de sangre periférica al momento del diagnostico • Porcentaje de células cromosomas Filadelfia positivo • Fases clínicas de la enfermedad • Respuesta hematológica • Respuesta citogenética 6.2 PROCESO DE SELECCIÓN 6.2.1 Criterios de inclusión • Pacientes con LMC atendidos y diagnosticados por morfología y citogenética en el Instituto Nacional de Cancerología en Enero 2002- Enero 2006 • Pacientes recién diagnosticados con LMC en fase crónica • Pacientes que no estén recibiendo ningún tratamiento para LMC 6.2.2 Criterios de exclusión • Pacientes diagnosticados con LMC antes del año 2001 • Pacientes diagnosticados con LMC 59 después del 2006 • Pacientes al momento del diagnostico con LMC en fase Acelerada • Pacientes al momento del diagnostico con LMC en crisis blástica • Pacientes con cromosoma de Filadelfia negativo • Los pacientes que no recibieron tratamiento con Imatinib • Los pacientes sin seguimiento al tratamiento con Imatinib • Pacientes que ya habían recibido tratamiento extrainstitucional 6.3 TIPO DE ESTUDIO Estudio Retrospectivo 6.4 RECOLECCION DE LA INFORMACION La recopilación y procesamiento de la información fue llevada a cabo mediante la evaluación de las Historias Clínicas de pacientes con LMC, tratados entre enero 2002 – enero 2006, de las cuales se obtuvieron datos como, edad, sexo, recuento diferencial en el frotis de sangre periférica, porcentaje de basófilos y blastos al momento del diagnostico, porcentaje de células cromosoma Filadelfia positivo, fechas de seguimiento y respuesta a tratamiento con Imatinib. . El diagnostico en todos los pacientes se realizo por examen clínico, reportes morfológicos del extendido de sangre periférica y medula ósea coloreados con Wright analizados por especialistas de la sección y se revisaron estudios citogenéticos (demostrando la presencia del cromosoma Filadelfia), el estudio citogenético se efectuó con células de la medula ósea, se empleo un método Standard y bandeo G. Se analizaron 30 metafases, la sensibilidad del método fue del 5%. Estos estudios se realizaron por especialistas en genética del Instituto Nacional de Cancerología. La información fue recopilada en una ficha (Anexo 1), registrando los datos que confirmaron el diagnostico, parámetros hematolólogicos y hallazgos citogenéticos. 60 6.5 PROCEDIMIENTO Los datos consignados en el instrumento de recolección de la información fueron transferidos a una base de datos elaborada en Excel 2000. El análisis y presentación de los resultados cuantitativos se realizó en tablas que reflejan medidas de tendencia central, así como frecuencias y porcentajes. El análisis de supervivencia total fue calculado con el método de Kaplan- Meier (Anexo 8) 7. RESULTADOS Los siguientes resultados, corresponden al estudio retrospectivo en donde se recogieron las historias clínicas registradas como Leucemia Mieloide Crónica en la sección de hematología y transplante del Instituto Nacional de Cancerología, creando así una cohorte de 157 pacientes desde el periodo comprendido entre Enero 2002 a Enero de 2006. 7.1 Características generales Para identificar y estudiar la población se revisaron un total de 157 historias clínicas, 203 protocolos de mielograma y 198 exámenes de cariotipo. Se excluyeron 67 (42,9%) pacientes por ser diagnosticados antes del 2002, 16 (10,2%) pacientes por tener cromosoma de Filadelfia negativo, 35 (22,4%) pacientes por no tener seguimiento en el Instituto Nacional de Cancerología, 10 (6,4%) pacientes por no tener seguimiento con Imatinib o suspensión de este, 3 (1,9%) pacientes por no estar en fase crónica de la enfermedad al momento del diagnostico. Los pacientes que cumplieron los criterios de inclusión fueron 26 con una mediana de edad de 41 años (Anexo 2), un porcentaje de hombres 69,2% (n=18) y de mujeres 61 30,7% (n=8) (Anexo 3) El 100% se encontraba en fase crónica (n=26) no se estudiaron pacientes en fase acelerada ni blástica Tabla 9. Tabla.9. Características generales de la cohorte analizada EDAD Mediana Rango ( Min-Max) n 41 26 22-77 SEXO hombres 69,2 % 18 mujeres 30,7 % 8 7.2 Respuesta al tratamiento Un porcentaje de 57,6% (n=15) tiene un seguimiento con mielograma de los 7-10 meses, un 53,8% (n=14) tiene un seguimiento citogenético de los 7- 10 meses (Anexo 4) Al diagnostico de la enfermedad se encontró en sangre periférica un promedio de blastos de 1.8%, eosinófilos 2.5% y basófilos 8.8%. (Anexo 5) Previo al tratamiento con Imatinib 18 pacientes fueron tratados con hidroxiurea, 1 con busulfán y 7 inician tratamiento con Imatinib de 400 mg durante el transcurso de la enfermedad. (Anexo 6) La respuesta hematológica según los hallazgos del frotis de sangre periférica al momento de hacer el mielograma al tratamiento con Imatinib fue de 86,6% (n=13) y la no respuesta de 13,3% (n=2) (Anexo 7) La respuesta citogenética a los 7-10 meses fue completa en el 57,1 % (n=8), parcial en 7,1% (n=1), no respuesta a Imatinib se presentó en el 35,7% (n=5) de los pacientes. (Anexo 8). 62 7.3 Análisis de supervivencia La supervivencia total de la serie fue del 96,1% a los 3 años; la mediana de supervivencia todavía no ha sido alcanzada. Solo hubo una muerte de un paciente que sucede a los 35 meses (Grafica1), este paciente se encontraba en respuesta hematológica completa, sin respuesta citogenética a los dos años de seguimiento y se encontraba con Imatinib 400 mg. Muere por falla orgánica multisistemica secundaria a proceso infeccioso La mediana de supervivencia libre de progresión a crisis blástica y fase acelerada no se ha alcanzado, la supervivencia a los 2 y a los 3 años fue del 80% (Grafica 2). 5 pacientes presentaron progresión a crisis blástica o fase acelerada. El primero progreso a los 44 meses del diagnostico, se encontraba con respuesta hematológica, sin respuesta citogenética, se encontraba con Imatinib 400 mg, se aumenta la dosis a Imatinib de 800 mg sin lograr respuesta hematológica ni citogenética al nuevo tratamiento. El segundo paciente progreso a los 15 meses del diagnostico, se encontraba en fase crónica, sin respuesta citogenética, se encontraba con Imatinib 400 mg, continua tratamiento con Imatinib 400 mg. El tercer paciente progreso a los 8 meses del diagnostico, se encontraba en fase crónica, con respuesta citogenética, se encontraba con Imatinib 400 mg, continua tratamiento con Imatinib 400 mg logrando respuesta hematológica y citogenética completa El cuarto paciente progreso a los 14 meses del diagnostico, se encontraba con respuesta hematológica, sin respuesta citogenética, se encontraba con Imatinib 400 mg, se aumenta la dosis a Imatinib de 800 mg logrando respuesta hematológica y citogenética mayor, al nuevo tratamiento. A los 56 meses recibe dasatinib logrando respuesta hematológica y citogenética completa. El quinto paciente progreso a los 5 meses del diagnostico, se encontraba en fase crónica, con respuesta citogenética completa, se encontraba con Imatinib 400 mg, continua tratamiento con Imatinib 400 mg logrando respuesta hematológica y citogenética completa a los 24 meses de seguimiento. La mediana de supervivencia libre de progresión citogenética aun no ha sido alcanzada, la supervivencia a los dos años fue de 80% y a los 3 años del 65% (Grafica 3). 63 Grafica No 1 Supervivencia total Supervivenvia total 1,2 1 p 0,8 0,6 Serie1 0,4 0,2 0 0 10 20 30 40 50 60 meses Grafica No 2 Supervivencia libre de progresión hematológica (SLPH) Supervivencia libre de progresiòn hematològica 1,2 1 p 0,8 0,6 Serie1 0,4 0,2 0 0 10 20 30 40 50 60 meses Grafica No 3 Supervivencia libre de progresión Citogenética (SLPC) 64 Supervivencia libre de progresion citogenètica 1,2 1 p 0,8 Serie1 0,6 0,4 0,2 0 0 10 20 30 40 50 60 meses 8. ANALISIS DE RESULTADOS En este estudio algunas de las variables analizadas no coinciden del todo con los reportes de la literatura probablemente por que la muestra analizada fue un grupo pequeño22, 17,23. Porque en la literatura se reporta que la edad media de presentación es de 53 años, la incidencia máxima se encuentra entre los 40 y los 60 años. Se observa que la edad de los pacientes de la cohorte de tiene una mayor tendencia a ser una población entre los 35- 44 años, con predominio ligero en varones. La respuesta hematológica según los hallazgos del frotis de sangre periférica al momento de hacer el mielograma al tratamiento con Imatinib mostró luego de 7-10 meses de tratamiento que los pacientes presentaron una disminución en el promedio de blastos, eosinófilos, basófilos y ausencia de desviación a la izquierda. Desde los 41-50 meses se observo que los pacientes alcanzaban respuestas hematológicas mayores al 60% y solo un 25% no alcanzaron una respuesta hematológica (Anexo 7) La respuesta hematológica se alcanza antes de obtener una respuesta citogenética, esta última predice la probable evolución a formas avanzadas de la enfermedad y resistencia al tratamiento. Las respuestas citogenéticas obtenidas a los 11- 20 meses, (ya que ningún paciente tubo 65 seguimiento exacto a los 12 y 18 meses que es lo establecido en la literatura), se relaciona con mayor supervivencia libre de progresión. 128 La respuesta citogenética en los pacientes estudiados muestra similitud 57,1% a los estudios internacionales, lo cual modificará la supervivencia de la enfermedad en estos pacientes138,139,140,141 Se observo que la respuesta citogenética completa comienza a presentarse a partir de los 31-40 meses de tratamiento 69,2 %, respuesta citogenética parcial de 15,3%, respuesta citogenética menor de 7,6 % y una no respuesta citogenética de 7,6% (Anexo 8) Observé que la presencia de blastos, basófilos y eosinófilos no tienen un aumento marcado al momento del diagnostico pero su presencia ayuda a definir la fase de la enfermedad. (Anexo 5). La supervivencia total de la serie fue del 96,1% a los 3 años; la mediana de supervivencia todavía no ha sido alcanzada. El primer evento sucede a los 35 meses (Grafica1) Es interesante observar que en los pacientes con LMC en fase crónica la progresión a fase acelerada y crisis blástica ocurren en un 20% a los dos años de iniciado el tratamiento y la progresión citogenética ocurre en un 20% a los dos años de iniciado el tratamiento. 138 Savage A, Antman K, Imatinib Mesylate – A new oral target therapy, N. Engl, J Med, 2002:346:683 – 93. Kantarjian H, Sawyer Cl, Hochhaus A, et al. Hematologic and citogenetic responses to imatinib mesylate in chronic myelogenous leukemia, N, Engl J Med, 2002;346:645 – 52. 140 Talpaz M, Silver RT, Druker B, et al, Gleevec (formerly ST1571): an active drug in patients with Ph+ chronic myeloid leukemia in accelerated phase - updated results of a phase II study. Blood, 2001; 98:845 abstract. 141 Sawyer Cl, Hochhaus A, feldman E, et al, Gleevec/Glivec (Imatinib mesylate, STI-571) in patients with chronic myeloid leukemia (CML) in myeloid blast crisis: updated results of a phase II study. Blood, 2001; 98:845ª abstract. 139 66 9. CONCLUSIONES 1. Llama la atención la pobre evidencia encontrada, a pesar de iniciar con una población de 157 pacientes el solo poder trabajar con 26, debido a los criterios de exclusión del estudio, las perdidas ocurridas se deben principalmente a la falta de seguimiento del tratamiento, en gran mayoría debidas a las no autorizaciones de las EPS en la realización del cariotipo y el suministro del Imatinib por no estar incluidos en el POS, desafortunadamente el desinterés de la parte administrativa es el responsable de que a pesar de la evolución terapéutica durante la ultima década en nuestro país esta enfermedad represente un problema de gran magnitud. 2. El uso del Imatinib en nuestros pacientes muestra el avance más importante de los últimos años en la terapéutica de la LMC, y se confirma que no es necesaria una respuesta citogenética para alcanzar una respuesta hematológica. Y el alcanzar una respuesta hematológica, no es suficiente predictor de una respuesta citogenética 3. De los pacientes evaluados en este estudio se observo una mayor incidencia en pacientes jóvenes este fenómeno pudo ser causado por el pequeño tamaño de la muestra estudiada, es necesario comparar los resultados con una población mas amplia con fin de acercarnos mas a los datos mostrados en la literatura. 4. Se observo que a pesar de los problemas administrativos que impiden un adecuado seguimiento de la enfermedad los pacientes muestran una excelente respuesta. 5. La falta del seguimiento encontrado en la revisión de las Historias Clínicas del los pacientes con LMC nos muestra que a pesar de esta falla en el sistema los pacientes que continúan en tratamiento logran alcanzar respuestas citogenéticas del 57,1 % y hematológicas 86,6 % 67 6. El tratamiento con Imatinib es en la actualidad el tratamiento de elección en LMC Ph positivo en Fase Crónica, ya que consigue, en la mayoría de los pacientes, remisiones hematológicas y citogenéticas. 7. La respuesta hematológica no necesariamente corresponde con la respuesta citogenética, ya que ésta ultima predice la evolución a formas avanzadas fase acelerada y Crisis blástica de la enfermedad y falta de respuesta al tratamiento 8. En nuestro estudio se observo que a pesar de los problemas administrativos que impiden un adecuado seguimiento de la enfermedad los pacientes muestran una excelente respuesta hematológica, 86,6 % similar a la literatura revisada. 10. RECOMENDACIONES 68 1. Se recomienda la realización de estudios morfológicos: mielograma, citogenéticos: cariotipo, moleculares: detección de BCR-ABL a los pacientes que se les sospeche LMC 2. Evaluar los pacientes con LMC que inicien tratamiento con Imatinib a los 3, 6, 12 y 18 meses de acuerdo a las recomendaciones establecidas con estudios morfológicos, citogenéticos y moleculares 3. Con las recomendaciones anteriores incluir mayor cantidad de pacientes con LMC en tratamiento con Imatinib, al realizar estudios con una población más amplia para saber si las respuestas obtenidas en este trabajo mejoran así como continuar el seguimiento del estudio por períodos mayores de tiempo en futuras investigaciones. 11. REFERENCIAS 69 1. J.W. Vardiman, J.V. Melo, M. Baccarani, J Thiele Chronic myelogenous leukaemia, BCR-ABL1 positive , 2008; 32-37 2. Fialkow PJ, Jacobson RJ, Papayannopoulou T. Chronic myelocytic leukemia: clonal origin in a stem cell common to the granulocyte, erythrocyte, platelet and monocyte/macrophage. Am J Med 1977; 63:125-30. 3. Michael W. N. Deininger and Brian J. Drunker.Specific therapy of chronic myelogenous leukemia with Imatinib.pharmacol Rev2003; 55: 401-423 4. Rowely JD. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified bye quinacrine fluorescence and giemsa staining. Nature 1873; 243:290-3 5. Heisterkamp N, Groffen J, Stephenson JR, et al. chromosomal localization of human cellular homologues of two viral oncogenes, Nature 1982;299: 747-49 6. Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science 1960; 132:1497. 7. Rene R. Mechanisms of BCR- Abl in the pathogenesis of chronic myelogenous leukemia. Nat Rev cancer 2005;5:172-83 8. Helhlman R, Andreas H, Michele Bacarani, et al. Chronic myeloid leukemia. Lancet 2007;370:432-50 9. AS Shet, BN Jahagirdar, CM Verfaillie, et al. Chronic myelogenous leukemia: mechanisms underlying disease progression. Leukemia 2002;16, 1402-14 10. JW wardiman, R Pierre, Jthiele.et al chronic myelogenous leukemia. World health organization classification of tumours pathology & genetics.tumours of haematopoietic and lymphoid tissues.Ed Elaine S 2001:17-26 11. M. Kantarjian, M.D Susan O’Brien et al. The biology of chronic myeloid leukemia. The new England journal of medicine 1999; 194-172 12. Sawyers CL. Chronic myeloid leukemia. N Engl J Med 1999;340:1330-40 13. Kantarjian HM, deisseroth A, Kurzrock, Estrov Z, Talpaz M. chronic myelogenous v leukemia: a concise update. Blood 1993;82:691-703 14. Silver Rt, Woolf SH, Hehlman r, et al, an evidence based analysis of the effects of busulfan, hidroxiurea,interferon, and 70 allogenic bone marrow transplantation in treating the chronic phase of chronic myeloid leukemia: develomed for the American Society of Hematology. Blood 1999; 94:1517-36 15. Michael W.N. Deininger John M. Goldman and Junia V Melo. The molecular bilogy of chronic myeloid leukemia 2000; 96:3343-3356 16. www.glivec.com 17. Francisco Luis Ochoa Jaramillo, Liliana Patricia Montoya Velez. Mortalidad por cáncer en Colombia 2001. CES medicina Vol. 18 No 2 18. Cotta CV, Bueso – Ramos CE (2007). New Insinghts into the pathobiology and treatment of chronic myelogenous leukemia. Ann Diagn Pathol 11:68-72 19. Garcia-Manero G, Faderel S. O’ Brian S, Cortes J Talpaz M, Kantarjian HM (2003). Chronic myelogenous leukemia: a review and update of therapeutic strategies Cancer 98: 437-457 20. Savage DG. Szydio RM. Goldman JM, (1997). Clinical features at diagnosis in 430 patients with chronic myeloid leukemia seen at referral centre over a 16 year period. Br J Haematol 99: 30-35 21. JW wardiman, R Pierre, Jthiele.et al chronic myelogenous leukemia. World health organization classification of tumours pathology & genetics. tumours of haematopoietic and lymphoid tissues.Ed Elaine S 2001:17-26 22. Helman R, Andreas H, Michele B. Chronic myeloid leukaemia.Lancet 2007;370:342-50 23. Registro institutional de cancer, INC 24. Goldman JM, Melo JV. Chronic myeloid leukemia advances in biology and new approaches to treatment. N Engl J Med. 2003; 349 (15): 1451-1464 25. Ries LAG, Eisner MP, Kosary CL, Hankey BF, Miller BA, Clegg L, et al En: Mariotto A, Feuer EJ, Edwards BK, editors. SEER Cancer Institute. 26. Raul Hernando Murillo Moreno, et al., Anuario estadístico..Ministerio de la protección social, Instituto Nacional de cancerología, 2006 Volumen 4 27. Kurzrock R, Bueso-Ramos CE, Kantarjian H. BCR rearrangement negative chronic myelogenous leukemia revisted J Clin Oncol. 2001; 819(11): 291528. Kurzrock R, Shtalrid M, Romero P, Kloetzer WS, Talpas M, Trujillo JM, et al. A novel c-abl protein product in 71 Philadelphia-positive acute lymphoblastic leukemia. Nature. 1987;325:631-5. [PMID: 3543692] 29. Kurzrock R, Gutterman JU, Talpaz M. The molecular genetics of Philadelphia chromosome-positive leukemias. N Engl J Med. 1988;319:990-8. 30. Groffen J, Stephenson JR, Heisterkamp N, de Klein A, Bartram CR, Grosveld G. Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22. Cell. 1984;36:93-9. [PMID: 6319012] 31. Heisterkamp N, Stam K, Groffen J, de Klein A, Grosveld G. Structural organization of the bcr gene and its role in the Ph_ translocation. Nature. 1985; 315:758-61. [PMID: 2989703] 32. Abelson HT, Rabstein LS. Lymphosarcoma: virus-induced thymic-independent disease in mice. Cancer Res. 1970;30:2213-22. [PMID: 4318922] 33. Rosenberg N, Witte ON. The viral and cellular forms of the Abelson (abl) oncogene. Adv Virus Res. 1988;35:39-81. PMID: 2852893] 34. Cohen GB, Ren R, Baltimore D. Modular binding domains in signal transduction proteins. Cell. 1995;80:237-248. 35. Feller SM, Knudsen B, Hanafusa H. c-Abl kinase regulates the protein binding activity of c-Crk. EMBO J. 1994;13:2341-2351. 36. Wetzler M, Talpaz M, Van Etten RA, Hirsh-Ginsberg C, Beran M, Kurzrock R. Subcellular localization of Bcr, Abl, and Bcr- abl proteins in normal and leukemic cells and correlation of expression with myeloid differentiation. J Clin Invest. 1993;92:1925-39. [PMID: 8408645] 37. Konopka JB, Witte ON. Detection of c-abl tyrosine kinase activity in vitro permits direct comparison of normal and altered abl gene products. Mol Cell Biol. 1985;5:3116-23. [PMID: 3879812] 38. Cheng K, Kurzrock R, Qiu X, Estrov Z, Ku S, Dulski KM, et al. Reduced focal adhesion kinase and paxillin phosphorylation in BCR-ABL-transfected cells. Cancer. 2002;95:440-50. [PMID: 12124845] 39. Van Etten RA. Cycling, stressed-out and nervous: cellular functions of c-Abl. Trends Cell Biol. 1999;9:179-86. [PMID: 10322452] 40. Koleske AJ, Gifford AM, Scott ML, Nee M, Bronson RT, Miczek KA, et al. Essential roles for the Abl and Arg 72 tyrosine kinases in neurulation. Neuron. 1998;21:1259-72. [PMID: 9883720] 41. Wang JY. Cellular responses to DNA damage. Curr Opin Cell Biol. 1998; 10:240-7. [PMID: 9561848] 42. Pluk H, Dorey K, Superti-Furga G. Autoinhibition of c-Abl. Cell. 2002; 108:247-59. [PMID: 11832214] 43. Dai Z, Pendergast AM. Abi-2, a novel SH3-containing protein interacts with the c-Abl tyrosine kinase and modulates c-Abl transforming activity. Genes Dev. 1995;9:2569-82. [PMID: 7590236 44. Van Etten RA, Jackson PK, Baltimore D, Sanders MC, Matsudaira PT, Janmey PA. The COOH terminus of the c-Abl tyrosine kinase contains distinct F- and G-actin binding domains with bundling activity. J Cell Biol. 1994;124: 325-40. [PMID: 8294516] 45. Sawyers CL, McLaughlin J, Goga A, Havlik M, Witte O. The nuclear tyrosine kinase c-Abl negatively regulates cell growth. Cell. 1994;77:121-31. [PMID: 7512450] 46. Kharbanda S, Pandey P, Morris PL, Whang Y, Xu Y, Sawant S, et al. Functional role for the c-Abl tyrosine kinase in meiosis I. Oncogene. 1998;16: 1773-7. [PMID: 9583675] 47. Miao YJ, Wang JY. Binding of A/T-rich DNA by three high mobility group-like domains in c-Abl tyrosine kinase. J Biol Chem. 1996;271:22823-30. [PMID: 8798460] 48. Yuan ZM, Huang Y, Ishiko T, Kharbanda S, Weichselbaum R, Kufe D. Regulation of DNA damage-induced apoptosis by the c-Abl tyrosine kinase. Proc Natl Acad Sci U S A. 1997;94:1437-40. [PMID: 9037071 49. National Center for Biotechnology Information. Entrez. Accessed at www .ncbi.nlm.nih.gov/Entrez on 20 March 2003. 50. Stam K, Heisterkamp N, Reynolds FH Jr, Groffen J. Evidence that the phl gene encodes a 160,000-dalton phosphoprotein with associated kinase activity. Mol Cell Biol. 1987;7:1955-60. [PMID: 3299055] 51. Dhut S, Dorey EL, Horton MA, Ganesan TS, Young BD. Identification of two normal bcr gene products in the 73 cytoplasm. Oncogene. 1988;3:561-6. [PMID: 3078961] 52. Laurent E, Talpaz M, Wetzler M, Kurzrock R. Cytoplasmic and nuclear localization of the 130 and 160 kDa Bcr proteins. Leukemia. 2000;14:1892-7. [PMID: 11069024] 53. Wetzler M, Talpaz M, Yee G, Stass SA, Van Etten RA, Andreeff M, et al. Cell cycle-related shifts in subcellular localization of BCR: association with mitotic chromosomes and with heterochromatin. Proc Natl Acad Sci U S A. 1995; 92:3488-92. [PMID: 7724587 54. Maru Y, Witte ON. The BCR gene encodes a novel serine/threonine kinase activity within a single exon. Cell. 1991;67:459-68. [PMID: 1657398] 55. Maru Y, Kobayashi T, Tanaka K, Shibuya M. BCR binds to the xeroderma pigmentosum group B protein. Biochem Biophys Res Commun. 1999;260:30912. [PMID: 10403766] 56. Muller AJ, Young JC, Pendergast AM, Pondel M, Landau NR, Littman DR, et al. BCR first exon sequences specifically activate the BCR/ABL tyrosine kinase oncogene of Philadelphia chromosome-positive human leukemias. Mol Cell Biol. 1991;11:1785-92. [PMID: 2005881] 57. Arlinghaus RB. The involvement of Bcr in leukemias with the Philadelphia chromosome. Crit Rev Oncog. 1998;9:1-18. [PMID: 9754444] 58. Sadowski I, Stone JC, Pawson T. A noncatalytic domain conserved among cytoplasmic protein-tyrosine kinases modifies the kinase function and transforming activity of Fujinami sarcoma virus P130gag-fps. Mol Cell Biol. 1986;6:4396- 408. [PMID: 3025655] 59. Denhardt DT. Signal-transducing protein phosphorylation cascades mediated by Ras/Rho proteins in the mammalian cell: the potential for multiplex signalling. Biochem J. 1996;318:729-747. 60. Montaner S, Perona R, Saniger L, Lacal JC. Multiple signaling pathways lead to the activation of the nuclear factor kB by the Rho family of GTPases. J Biol Chem. 1998;273:12779-12785. 61. Diekmann D, Brill S, Garrett MD, et al. Bcr encodes a GTPase-activating protein for p21rac. Nature. 74 1991;351:400-402. 62. Diekmann D, Nobes CD, Burbelo PD, Abo A, Hall A. Rac GTPase interacts with GAPs and target proteins through multiple effector sites. EMBO J. 1995;14:5297-5305. 63. Deininger MW, Goldman JM, Melo JV, the molecular biology of chronic myeloid leukemia. Blood 2000; 96(10):3343-3356 64. Gordon MY, Dowding CR, Riley GP, Goldman JM, Greaves MF. Altered adhesive interactions with marrow stroma of haematopoietic progenitor cells in chronic myeloid leukaemia. Nature. 1987;328: 342-344. 65. Puil L, Liu J, Gish G, et al. Bcr-Abl oncoproteins bind directly to activators of the Ras signaling pathway. EMBO J. 1994;13:764-773. 66. Bedi A, Zehnbauer BA, Barber JP, Sharkis SJ, Jones RJ. Inhibition of apoptosis by BCR-ABL in chronic myeloid leukemia. Blood. 1994;83:20382044. 67. Cheng K, Kurzrock R, Qiu X, Estrov Z, Ku S, Dulski KM, et al. Reduced focal adhesion kinase and paxillin phosphorylation in BCR-ABL-transfected cells. Cancer. 2002;95:440-50. [PMID: 12124845] 68. Verfaillie CM, Hurley R, Lundell BI, Zhao C, Bhatia R. Integrin-mediated regulation of hematopoiesis: do BCR/ABL-induced defects in integrin function underlie the abnormal circulation and proliferation of CML progenitors? Acta Haematol. 1997;97:40-52. [PMID: 8980609] 69. Gotoh A, Miyazawa K, Ohyashiki K, Tauchi T, Boswell HS, Broxmeyer HE, et al. Tyrosine phosphorylation and activation of focal adhesion kinase (p125FAK) by BCR-ABL oncoprotein. Exp Hematol. 1995;23:1153-9. [PMID: 7556524] 70. Lewis JM, Baskaran R, Taagepera S, Schwartz MA, Wang JY. Integrin regulation of c-Abl tyrosine kinase activity and cytoplasmic-nuclear transport. Proc Natl Acad Sci U S A. 1996;93:15174-15179. 71. Oda T, Heaney C, Hagopian JR, Okuda K, Griffin JD, Druker BJ. Crkl is the major tyrosine-phosphorylated protein in neutrophils from patients with chronic myelogenous leukemia. J Biol Chem. 1994;269:22925-22928. 72. Uemura N, Griffin JD. The adapter 75 protein Crkl links Cbl to C3G after integrin ligation and enhances cell migration. J Biol Chem. 1999;274: 37525-37532. 73. Sattler M, Salgia R, Okuda K, et al. The protooncogene product p120CBL and the adaptor proteins CRKL and c-CRK link c-ABL, p190BCR/ABL and p210BCR/ABL to the phosphatidylinositol-3’ kinase pathway. Oncogene. 1996;12:839-846. 74. Salgia R, Pisick E, Sattler M, et al. p130CAS forms a signaling complex with the adapter protein CRKL in hematopoietic cells transformed by the BCR/ABL oncogene. J Biol Chem. 1996;271: 25198-25203. 75. Sattler M, Salgia R, Shrikhande G, et al. Differential signaling after b1 integrin ligation is mediated through binding of CRKL to p120(CBL) and p110(HEF1). J Biol Chem. 1997;272:14320- 14326. 76. Konopka JB, Watanabe SM, Witte ON. An alteration of the human c-abl protein in K562 leukemia cells unmasks associated tyrosine kinase activity. Cell. 1984;37:1035-42. [PMID: 6204766] 77. Lugo TG, Pendergast AM, Muller AJ, Witte ON. Tyrosine kinase activity and transformation potency of bcr-abl oncogene products. Science. 1990;247: 107982. [PMID: 2408149] 78. Skorski T, Kanakaraj P, Nieborowska-Skorska M, Ratajczak MZ, Wen SC, Zon G, Gewirtz AM, Perussia B, Calabretta B. Phosphatidylinositol- 3 kinase activity is regulated by BCR/ABL and is required for the growth of Philadelphia chromosome-positive cells. Blood 1995; 86: 726–736. 79. Harrison-Findik D, Susa M, Varticovski L. Association of phos phatidylinositol 3-kinase with SHC in chronic myelogeneous leukemia cells. Oncogene 1995; 10: 1385–1391. 80. Franke TF, Kaplan DR, Cantley LC. PI3K: downstream AKT ion blocks apoptosis. Cell 1997; 88: 435–437. 81. De Groot RP, Raaijmakers JA, Lammers JW, Koenderman L. STAT5dependent cyclinD1 and Bcl-xL expression in Bcr-Abltransformed cells. Mol Cell Biol Res Commun 2000; 3: 299–305. 82. Horita M, Andreu EJ, Benito A, 76 Arbona C, Sanz C, Benet I, Prosper F, Fernandez-Luna JL. Blockade of the Bcr-Abl kinase activity induces apoptosis of chronic myelogenous leukemia cells by suppressing signal transducer and activator of transcription 5- dependent expression of Bcl-xL. J Exp Med 2000; 191: 977–984. 83. Gesbert F, Griffin JD. Bcr/Abl activates transcription of the Bcl- X gene through STAT5. Blood 2000; 96: 2269–2276. 84. Sawyers CL, McLaughlin J, Witte ON. Genetic requirement for Ras in the transformation of fibroblasts and hematopoietic cells by the Bcr-Abl oncogene. J Exp Med. 1995;181:307-13. [PMID: 7807010] 85. Tauchi T, Okabe S, Miyazawa K, Ohyashiki K. The tetramerization domainindependent Ras activation by BCR-ABL oncoprotein in hematopoietic cells. Int J Oncol. 1998;12:1269-76. [PMID: 9592185] 86. Diekmann D, Brill S, Garrett MD, Totty N, Hsuan J, Monfries C, Hall C, Lim L, and Hall A (1991) Bcr encodes a GTPase-activating protein for p21rac. Nature (Lond) 351:400–402. 87. Michael W.N. Deininger John M. Goldman and Junia V Melo. The molecular bilogy of chronic myeloid leukemia 2000; 96:3343-3356 88. Rameh LE. Cantley LC. The role of phosphoinositide 3-kinase lipid products in cell function. L Biol Chem 1999; 274:8347-8350. 89. Slorski T, Kamakaraj P. Nieborowskaskorska M et al. Phosphatidylinositol – 3 kinase activity is regulated by bcr-abl and is required for the growth of Philadelphia chromosome- positive cells. Blood 1995; 86: 726-736 90. Ilaria RL Jr, Van Etten RA. P210 and P190(BCR/ ABL) induce the tyrosine phosphorylation and DNA binding activity of multiple specific STAT family members. J Biol Chem. 1996;271:31704- 31710. 91. Chai SK, Nichols GL, Rothman P. Constitutive activation of JAKs and STATs in BCR-Abl-expressing cell lines and peripheral blood cells derived from leukemic patients. J Immunol. 1997; 159:4720-4728. 92. Nosaka T, Kawashima T, Misawa K, Ikuta K, Mui AL, Kitamura T. STAT5 as a molecular regulator of proliferation, differentiation and apoptosis in hematopoietic cells. EMBO J. 77 1999;18:4754- 4765. 93. Deininger MW, Vieira S, Mendiola R, Schultheis B, Goldman JM, Melo JV. BCR-ABL tyrosine kinase activity regulates the pression of multiple genes implicated in the pathogenesis of chronic myeloid leukemia. Cancer Res. 2000;60:2049- 2055 94. Amos TA, Lewis JL, Grand FH, Gooding RP, Goldman JM, Gordon MY. Apoptosis in chronic myeloid leukaemia: normal responses by progenitor cells to growth factor deprivation, X-irradiation and glucocorticoids. Br J Haematol. 1995; 91:387-393. 95. Rodenhuis S, Smets LA, Slater RM, Behrendt H, Veerman AJ. Distinguishing the Philadelphia chromosome of acute lymphoblastic leukemia from its counterpart in chronic myelogenous leukemia [Letter]. N Engl J Med. 1985;313:51-2. [PMID: 3858671] 96. Kurzrock R, Shtalrid M, Romero P, Kloetzer WS, Talpas M, Trujillo JM, et al. A novel c-abl protein product in Philadelphia-positive acute lymphoblastic leukaemia. Nature. 1987;325:631-5. [PMID: 3543692] 97. Erikson J, Griffin CA, ar-Rushdi A, Valtieri M, Hoxie J, Finan J, et al. Heterogeneity of chromosome 22 breakpoint in Philadelphia-positive (Ph_) acute lymphocytic leukemia. Proc Natl Acad Sci U S A. 1986;83:1807-11. [PMID: 3513189] 98. Laurent E, Talpaz M, Kantarjian H, Kurzrock R. The BCR gene and Philadelphia chromosome-positive leukemogenesis. Cancer Res. 2001;61:234355. [PMID: 11289094] 99. Epner DE, Koeffler HP.Molecular advances in chronic myelogenous leucemia. Ann Intern Med 1990; 113: 3-6 100. Kurzrock R, Bueso-Ramos CE, Kantarjian H, Freireich E, Tucker SL, Siciliano M, et al. BCR rearrangement-negative chronic myelogenous leukemia revisited. J Clin Oncol. 2001;19:2915-26. [PMID: 11387365] 101. Kurzrock R, Kantarjian HM, Shtalrid M, Gutterman JU, Talpaz M. Philadelphia chromosome-negative chronic myelogenous leukemia without breakpoint cluster region rearrangement: a chronic myeloid leukemia with a distinct clinical course. Blood. 78 1990;75:445-52. [PMID: 2403827] 102. Kurzrock R, Blick MB, Talpaz M, Velasquez WS, Trujillo JM, Kouttab NM, et al. Rearrangement in the breakpoint cluster region and the clinical course in Philadelphia-negative chronic myelogenous leukemia. Ann Intern Med. 1986; 105:673-9. [PMID: 3094418] 103. Shtalrid M, Talpaz M, Blick M, Romero P, Kantarjian H, Taylor K, et al. Philadelphia-negative chronic myelogenous leukemia with breakpoint cluster region rearrangement: molecular analysis, clinical characteristics, and response to therapy. J Clin Oncol. 1988;6:1569-75. [PMID: 3171624] 104. Kantarjian H, Talpaz M, Estey E, Ku S, Kurzrock R. What is the contribution of molecular studies to the diagnosis of BCR-ABL-positive disease in adult acute leukemia? Am J Med. 1994;96:133-8. [PMID: 8109597] 105. Laurent E, Talpaz M, Kantarjian H, Kurzrock R. The BCR gene and Philadelphia chromosome-positive leukemogenesis. Cancer Res. 2001;61:234355. [PMID: 11289094] 106. Spiers, A.S.D. Clinical manifestations of chronic granulocityc leukemia. Seminars in Oncology 1995; 22:380-395. 107. Lithman M A, Heal J, Rowe Jm. Hyperleukocyte leukaemia. Bailliers Clin Haematol 1987; 1: 725 108. Juan D, Hsu S-D, Hunter J: Case report of vasopressin – responsive diabetes insipidus associated with chronyc myelogenous leukaemia. Cancer 1985; 56: 1468-1469. 109. Cotta CV, Bueso- Ramos CE (2007) New insights into the pathobiology and treatment of chronic myelogenous leukemia. Ann Diagn Pathol 11: 68-78 110. Garcia- Manero G, Faderl S, O’Brien S, Cortes J, Talpaz M, Kantarjian HM (2003). Chronic myelogenous leucemia: a review and update of therapeutic strategies, Cancer 98:437-457 111. Kluin- Nelemans HC, Buck G, le Cessie S, Richards S, Beverloo HB, Falkenburg JH, Littlewood T, Muss P, Bareford D, van der LH. Green AR, Roozendal KJ, Milne AE, Chapman CS, Shepherd P (2004). Randomized comparison of low- dose versus high- 79 dose interferon- alfa in chronic myeloid leukemia: prospective collaboration of 3 joint trials by the MRC and HOVON groups. Blood 103: 4408-4415 112. Benett JM Catovsky D,Daniel MT, Flandrin G,Galton DA, Gralnick H, Sulfan C, Cox C (1994). The chronic myeloid leukaemias: guidelines for distinguishing chronic granulocytic, atypical chronic myeloid, and chronic myelomonocytic leukaemi. Proposals by the French –American- British cooperative leukaemia group. Br J Haematol 87:747-754 113. Spiers AS Bain BJ, Tuner JE (1977). The peripheral blood in chronic granulocytic leukaemia. Study of 50 untreated Philadelphia positive cases, Scand J Haematolog 18: 25-38 114. Spiers A,S Bain BJ, Turner JE (1977) the peripherial blood in chronic granulocytic leukaemia. Study of 50 untreated philadelphia positive cases. Scand J. Haematol 18:25-38 115. Muehleck SD, Mckenna RW Arthur DC, Parkin JL,Brunning RD (1984). Transformation of chronic myelogenous leukemia: clinical, morphologic, and cytogenetic features. Ann J Clinn Pathol 82: 1-14 116. Anastasi J, Musvee T, Roulston D, Domer PH, Larson RA, Vardiman JW (1998). Pseudo Gaucher histiocytes identified up to 1 year after transplantation for LMC are BCR/ABL positive. Leukemia 12: 233-237 117. Thiele J, Schmitz B, Fuchs, R, Kvasnicka HM, Lorenzen J, Fischer R (1998). Detection of the bcr/abl gene in bone marrow macrophages in LMC and alterations during interferon therapy-a fluorescence in situ hybridization study on trephine biopsies. J Pathol 186: 331-335 118. Jolynn sessions, Pharm D, BCOP. Chronic myeloid leukemia in 2007, JMCP Vol 13, No 8, 5-a 119. Horowitz MM, Rowlings PA, Passeweg JR. Allogeneic bone marrow transplantation for CML: a report from the International Bone Marrow Transplant Registry. Bone Marrow Transplant 1996; 17 (suppl 3): S5-S6 120. McGlave PB, Shu XO, Wen W et al. Unrelated donor marrow transplantation for chronic myelogenous leukemia: 9 years experience of the National Marrow Donor Program. 80 Blood 2000; 95: 2219-2225. 121. Derderian PM, Kantarjian HM, talpaz M, O’Brien S, Cork A, Estey E, Pierce S, Keating M ( 1993) Chronic myelogenous leukemia in the lymphoid blastic phase: characteristics, treatment response, and prognosis Ann J Med 94: 69-74 122. Jaffe ES, Harris NL, Diebold J, Muller- Hermelik HK(1998). World Health Organization Classification of lymphomas: a work in progress. Ann Oncol 9 Suppl 5: S25-S30 123. Druker BJ, Sawyer CL, Kantarjian H, Resta DJ, Reese SF, Ford JM et al. Activity of a specific inhibitor of the BCR ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med. 2001; 344: 1038-1042. 124. Raitano AB., Whang YE, Sawyers CL. Signal transduction by wild-type and leukemiogenic Abl proteins. Biochim Biophys Acta 1997; 1333 (3): F 201216 125. Capdeville R, Buchdunger E, Zimmerman J, Matter A. Glivec (STI, imatinib) a rationally developed targed anticancer drug, Nat Rev Drug Discov 2002; 1: 493-502. 126. Drunker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the abl tyrosine kinase on the growth of BCR- ABL positive cells. Nature Medicine 1996,2, 561 127. Michael W.N. Deininger, Stephen G. O´Brien, John M, Ford, and Brian J. Druker. Practical management of Patients with Chronic Myeloid Leukemia Receiving Imatinib, J Clin Oncol 21:1637-1647 128. Kantarjian H, Sawyer C, Hochhaus A, et al. Haematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med; 2002, 346: 645-652 129. Faderl S, Talpaz M, Estrov Z, Kantarjian H, Chronic Myelogenous Leukemia: biology and therapy, Ann Intern Med; 1999:131:207 – 219. 130. Kantarjian H, Cortes J, O´Brian S, et al. Long term survival benefit and improved complete cytogenetic and molecular response rates with imatinib mesylate in Philadelphia chromosome 81 – positive chronic – phase chronic myeloid leukemia after failed of interferon - α. Blood; 2004: 104:1979 – 1988. 131. Cortes J, Talpaz M, Giles F, et al. Prognostic significance of cytogenetic clonal evolution in patients with chronic myelogenous leukemia on mesylate therapy. Blood. 2003;101: 3794-3800. 132. O´Brien S, Guilhot F, larson R, et al, Imatinib Compared with interferon and low - cytarabine for newly diagnosed chronic - phase chronic myeloid leukemia. N. Engl, J Med, 2003; 348:994 – 1004. 133. Druker B, Talpaz M, Resta D, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med.2001; 344: 1031-1037. 134. Michael W.N. Deininger, Stephen G. O´Brien, John M, Ford, and Brian J. Druker. Practical management of Patients with Chronic Myeloid Leukemia Receiving Imatinib, J Clin Oncol 21:1637-1647 135. Faderl S, Talpaz M, Estrov Z, Kantarjian H, Chronic Myelogenous Leukemia: biology and therapy, Ann Intern Med; 1999:131:207 – 219. 136. Deininger M., Buchdunger E., Druker B. The development of Imatinib as a therapeutic agent for chronic myeloid Leukemia. Blood. 2005; 105: 2640-2653. 137. Griffin J., Weisberg E. Resistance to Imatinib (Glivec): Update on clinical mechanisms. Drug Resistance Updates. 2003: 6; 231-238. 138. Savage A, Antman K, Imatinib Mesylate – A new oral target therapy, N. Engl, J Med, 2002:346:683 – 93. 139. Kantarjian H, Sawyer Cl, Hochhaus A, et al. Hematologic and citogenetic responses to imatinib mesylate in chronic myelogenous leukemia, N, Engl J Med, 2002;346:645 – 52. 140. Talpaz M, Silver RT, Druker B, et al, Gleevec (formerly ST1571): an active drug in patients with Ph+ chronic myeloid leukemia in accelerated phase updated results of a phase II study. Blood, 2001; 98:845 abstract. 141. Sawyer Cl, Hochhaus A, feldman E, et al, Gleevec/Glivec (Imatinib mesylate, STI-571) in patients with chronic myeloid leukemia (CML) in myeloid blast crisis: updated results of a phase 82 II study. Blood, 2001; 98:845ª abstract. ANEXO No 1 INSTRUMENTO DE RECOLECCION DE LA INFORMACION Respuesta de los pacientes con Leucemia Mieloide Crónica al tratamiento con Imatinib Instituto Nacional de Cancerológica. A. Características generales 1. Edad: ______________ años 2. Sexo: femenino _________ Masculino ________ B. Fecha de diagnostico: _________________ C. Recuento diferencial al momento del diagnostico % Blastos en SP _______________ _______________ ________________ % Basófilos en SP _______________ _______________ ________________ % Eosinófilos en SP _______________ _______________ ________________ D. Comportamiento de blastos, eosinófilos, basófilos en sangre periférica al momento del diagnostico Rta hematológica Si / NO 7-10 meses _____________ ________________ _______________ 11-12 meses ____________ ________________ _______________ 21-30 meses ____________ 31-40 meses ____________ 50 meses ________________ ________________ ____________ 83 _______________ _______________ 41________________ _______________ 51-60 meses _____________ ________________ _______________ ≥ 60 meses _____________ _________________ _______________ Rta Citogenetica Si / NO 7-10 meses _____________ ________________ _______________ 11-12 meses ____________ ________________ _______________ 21-30 meses ____________ 31-40 meses ____________ 50 meses ____________ ________________ ________________ ________________ _______________ _______________ 41_______________ 51-60 meses _____________ ________________ _______________ ≥ 60 meses _____________ _________________ _______________ D. Fases Clínicas de la LMC al momento del diagnostico Fase crónica _______________ Fase acelerada _______________ Fase blástica _______________ 84 ANEXO No 2 Distribución por Edad Distribucion por edad 8 7 6 5 n4 3 2 1 0 15-24 25-34 35-44 45-54 edad Anexo No 3 85 55-64 65-77 Distribución por sexo Distribucion por sexo 31% 69% Mujeres Hombres Anexo No 4 Pacientes con seguimiento hematológico y 86 citogenético del INC meses Seguimiento de la Seguimiento de la respuesta hematológica respuesta citogenética 7-10 57,6% (n=15) 53,8% (n=14) 11-12 84,6% (n=22) 73% (n=19) 21-30 73,0% (n=14) 46,1% (n=12) 31-40 50% (n=14) 50 % (n=13) 41-50 15,3% (n=4) 15,3% (n=4) 51-60 11,5% (n=3) 7,6% (n=2) ≥60 3,8% (n=1) 11,5% (n=3) Anexo No 5 Comportamiento de blastos, eosinófilos, basófilos En sangre periférica al momento del diagnostico 87 Diagnostico % Blastos en Sangre Periférica Promedio Inicio n=26 1,8 0,65 • Mediana 1,5 ---------- • Rango (Min-Max) 0-5 0-8 • % Eosinófilos en Sangre Periférica • Promedio 2,5 2,0 1,0 • Mediana 2 2,62 1,8 • Rango (Min-Max) 0-7 1-13 0-8 • Promedio 8,8 1,58 1,53 • Mediana 9 1 1 • Rango (Min-Max) 1-20 0-9 0-9 % Basófilos en Sangre Periférica Anexo No 6 Tratamiento previo 88 Tratamiento previo 27% Hidroxiurea Busulfan Imatinib= 400 mg 4% 69% Anexo No 7 Porcentaje de la respuesta hematológica Meses % seguimiento en Si Rta No Rta Rta hematológica Hematológica Hematológica 89 7-10 57,6% (n=15) 86,6% (n=13) 13,3% (n=2) 11-20 84,6% (n=22) 90,2% (n=20) 9,02% (n=2) 21-30 73,0% (n=14) 100% (n=14) 31-40 50% (n=13) 50% (n=13) 41-50 15,3% (n=4) 75% (n=3) 51-60 11,5% (n=3) 100% (n=3) ≥60 3,8% (n=1) 100% (n=1) Anexo No 8 Porcentaje de la respuesta Citogenética 90 25% (n=1) Meses % seguimiento RCC RCP RCM No Rta Rta citogenética 7-10 53,8% (n=14) 57,1% (n=8) 7,1% (n=1) 11-20 73% (n=19) 52,6% (n=10) 5,2% (n=1) 21-30 46,1% (n=12) 58,3% (n=7) 16,6% (n=2) 31-40 50 % (n=13) 69,2% (n=9) 15,3% (n=2) 41-50 15,3% (n=4) 50% (n=2) 51-60 7,6% (n=2) 50% (n=1) ≥60 11,5% (n=3) 100% (n=3) 35,71% (n=5) 5,2% (n=1) 36,8% (n=7) 25% (n=3) 7,6% (n=1) 7,6% (n=1) 50% (n=2) 50% (n=1) RCC: respuesta citogenética completa, RCP: respuesta citogenética parcial, RCM: Respuesta citogenética mayor ♦ % de expresión de células con cromosoma Filadelfia positivo (Ph +) de muestras de medula ósea ♦ Respuesta citogenética completa: Ausencia del cromosoma de Ph ♦ Respuesta citogenética mayor: Cromosoma Ph 1- 35% (R. Completa + R. Parcial) ♦ Respuesta citogenética menor: Cromosoma Ph 36-90% ♦ Sin Respuesta: Cromosoma Ph > 90% Deficiniones: • Supervivencia total: Medida desde el momento del diagnostico hasta la muerte por cualquier causa • Supervivencia libre de progresión: Medida desde el momento del diagnostico hasta progresión de enfermedad, crisis blástica o fase acelerada 91