1 mol de compuesto A (C7H10O)
Anuncio
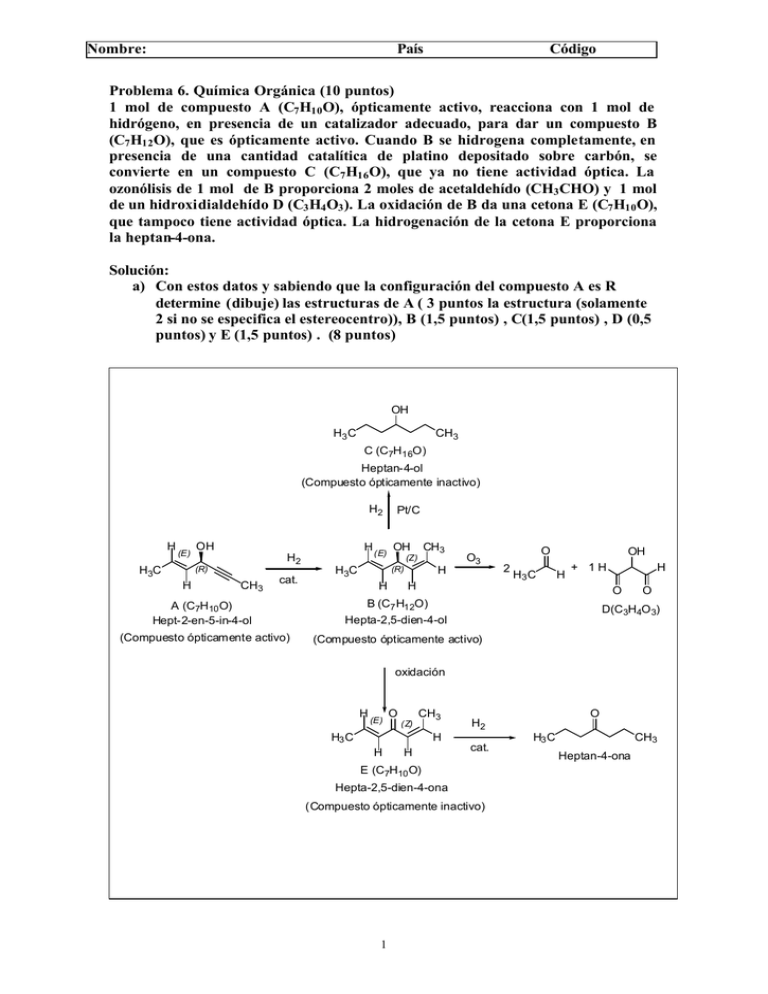
Nombre: País Código Problema 6. Química Orgánica (10 puntos) 1 mol de compuesto A (C7 H10 O), ópticamente activo, reacciona con 1 mol de hidrógeno, en presencia de un catalizador adecuado, para dar un compuesto B (C7 H12 O), que es ópticamente activo. Cuando B se hidrogena completamente, en presencia de una cantidad catalítica de platino depositado sobre carbón, se convierte en un compuesto C (C7 H16 O), que ya no tiene actividad óptica. La ozonólisis de 1 mol de B proporciona 2 moles de acetaldehído (CH3 CHO) y 1 mol de un hidroxidialdehído D (C3 H4 O3 ). La oxidación de B da una cetona E (C7 H10 O), que tampoco tiene actividad óptica. La hidrogenación de la cetona E proporciona la heptan-4-ona. Solución: a) Con estos datos y sabiendo que la configuración del compuesto A es R determine (dibuje) las estructuras de A ( 3 puntos la estructura (solamente 2 si no se especifica el estereocentro)), B (1,5 puntos) , C(1,5 puntos) , D (0,5 puntos) y E (1,5 puntos) . (8 puntos) OH H3 C CH3 C (C7H16O) Heptan-4-ol (Compuesto ópticamente inactivo) H2 H (E) OH H H (E) OH H2 (R) H3C CH3 cat. Pt/C CH3 (Z) (R) H3C H O3 H O 2 H3 C OH H + 1H H H O A (C7H10 O) Hept-2-en-5-in-4-ol B (C7 H12O) Hepta-2,5-dien-4-ol (Compuesto ópticamente activo) (Compuesto ópticamente activo) O D(C3H4O 3) oxidación H (E) O (Z) CH3 H3 C H H H cat. E (C7H10 O) Hepta-2,5-dien-4-ona (Compuesto ópticamente inactivo) 1 O H2 H3 C CH3 Heptan-4-ona Nombre: País Código b) ¿Cuántos litros de H2 , medidos a una presión de 1 atm y a 25ºC de temperatura, serán necesarios para hidrogenar 10 gramos de B y convertirlos en el compuesto C? (2 puntos) 1 punto planteamiento y 1 punto resolución H OH CH 3 H3 C H H OH Pt/C + 2 H2 H3C CH3 H C (C7 H16O) B (C7 H12O) Pmol de B = 112 g/mol 10g nº moles de B a hidrogenar = = 0.089 moles 112g/mol nº moles de H2 = 0.089 moles x 2 = 0.178 moles Vol H2 = nRT = P 0.178 moles x 0.082 atm.lit/ºK.mol x 298ºK 1 atm 2 = 4.34 litro