Hemorragia suprarrenal como primera manifestación de un
Anuncio

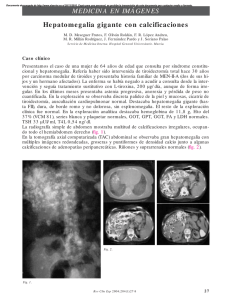
726 J.J. RODRÍGUEZ MAREZ, M. HERREROS VILLARAIZ, F.J. PÉREZ GARCÍA Y COLS. casos clínicos 13 Arch. Esp. de Urol., 53, 8 (726-730), 2000 Hemorragia suprarrenal como primera manifestación de un carcinoma pulmonar de células pequeñas. Presentación de un caso. JUAN JAVIER RODRÍGUEZ MARTÍNEZ, MARTA HERREROS VILLARAIZ1, F. JAVIER PÉREZ GARCÍA, JESÚS M. FERNÁNDEZ GÓMEZ, J. MARTÍNEZ GÓMEZ, JAVIER REGADERA SEJAS Y JAVIER CASASOLA CHAMORRO. Servicio de Urología I y Servicio de Anatomía Patológica1. Hospital Central de Asturias. Oviedo. Asturias. España. Resumen.- OBJETIVO: Presentar un caso de hemorragia retroperitoneal de origen suprarrenal, como la primera manifestación de un carcinoma pulmonar de células pequeñas. MÉTODO: Se describe un caso de hemorragia suprarrenal como primera manifestación de un carcinoma pulmonar de células pequeñas en un varón de 60 años y se expone las principales características de este tumor, así como de las metástasis suprarrenales. RESULTADOS: Se instauró tratamiento citostático complementario con carboplatino y VP-16 sin éxito. La T.A.C. craneal mostró varias lesiones ocupantes de espacio en parénquima cerebral en relación con metástasis. Se administró radioterapia craneal paliativa. El paciente experimentó empeoramiento progresivo, administrándole, en la actualidad, tratamiento paliativo únicamente. CONCLUSIONES: Las glándulas suprarrenales son un sitio habitual de metástasis. Uno de los tumores que, frecuentemente, las afecta es el carcinoma pulmonar de células pequeñas. Esta neoplasia se caracteriza por su extensión local y sistémica precoz, la asociación a síndromes paraneoplásicos y especial sensibilidad a determinados citostáticos. En masas suprarrenales, grandes, heterogéneas y bilaterales, se debe descartar metástasis como primera posibilidad. Palabras clave: Metástasis suprarrrenal. Hemorragia suprarrenal. Carcinoma metastásico suprarrenal. Carcinoma de células pequeñas. Oat cell. Summary.- OBJETIVE: To report on a case of small cell lung carcinoma presenting as adrenal hemorrhage. METHODS: A case of small cell lung carcinoma presenting as adrenal hemorrhage in a 60-year-old male is presented. The most important features of this tumor type and the adrenal metastasis are described. RESULTS: Treatment with carboplatin and VP-16 was unsuccessful. A brain CT scan showed several space occupying parenchymal lesions. Palliative radiotherapy was administered. The patient's condition has progressively become worse. He is currently receiving only palliative treatment. CONCLUSIONS: The adrenal gland is a common site of metastasis. One of the tumor types that frequently metastasize to the adrenals is small cell lung carcinoma, which is characterized by early local and systemic dissemination, associated paraneoplastic syndromes and its sensitivity to cytostatic agents. Adrenal metastasis from lung carcinoma should be suspected in patients with a large, heterogeneous, bilateral lesion. Keywords: Adrenal metastasis. Adrenal hemorrhage. Metastatic adrenal carcinoma. Small cell carcinoma. Oat cell. INTRODUCCIÓN El carcinoma de células pequeñas se caracteriza por su rápida invasión tanto local como sistémica, alcanzando, desde el pulmón, localización primaria más frecuente, diferentes órganos de la economía, entre las que se encuentran, en una frecuencia considerable, las glándulas suprarrenales. Las metástasis adrenales suelen presentarse como grandes masas, mayores de 6 cms, habitualmente, bilaterales, heterogéneas y difícilmente diferenciables, en ocasiones, de un carcinoma primario suprarrenal. El diagnóstico habitual de dichas metástasis suele ser al realizar un estidio de extensión del tumor primario, mediante ecografía o tomografía, no siendo frecuente que se presente como una urgencia urológica, como ocurre en el caso clínico que exponemos. CASO CLÍNICO Correspondencia Juan Javier Rodríguez Martínez C/ Manuel del Fresno, 12 - 2ªD 33012 Oviedo. Asturias. España. Trabajo recibido el 6 de agosto de 1998. Varón de 60 años, trabajador del campo, fumador de más de 20 cigarrillos/día como único antecedente de interés, que acudió al servicio de urgencias de su hospital comarcal, al presentar dolor abdominal de aparición brusca, localizado en hipocondrio derecho HEMORRAGIA SUPRARRENAL COMO PRIMERA MANIFESTACIÓN DE UN CARCINOMA PULMONAR DE CÉLULAS PEQUEÑAS Fig. 1: TAC abdominal: Masas suprarrenales bilaterales. Hematoma retroperitoneal. y acompañado de naúseas, vómitos y clínica vegetativa. A la exploración destacaba la presencia de un abdomen moderadamente distendido, con dolor y defensa a la palpación de hipocondrio y vacío derecho. En el hemograma, únicamente reseñar una hemoglobina de 11,9 mg/dl, siendo bioquímica y coagulación normales. En las pruebas rardiológicas realizadas (rx de abdomen y ecografía), se aprecia aire subhepático y protusión retrogástrica, impresionando de perforación de víscera hueca, por lo que se practica laparotomía de urgencia, apreciándose gran hematoma retroperitoneal, sin otros hallazgos. Dado que en dicho centro no existía urólogo de guardia, se decide traslado a nuestro hospital. Se practica T.A.C. abdominal de urgencia, observándose masa suprarrenal izquierda, sólida, con captación de contraste periférica, de unos 6 cms de diámetro mayor, adyacente a la cual se aprecia zona hiperdensa que desplaza el riñón izdo., de 11 x 7 cms Fig. 2: TAC torácico: Masa pulmonar biliar derecha. 727 correspondiente a hematoma retroperitoneal. Masa suprarrenal derecha de unos 3 mcs de diámetro (Fig. 1). En vista de la alta posibilidad de metástasis suprarrenales, se realiza T.A.C. torácico, apreciándose una hilio derecho aumentado de tamaño, que en T.A.C. dinámico presenta pequeña masa por debajo de la arteria pulmonar derecha, de unos 1,5 cms de diámetro, que sugiere neoplasia pulmonar (Fig. 2). Se realiza arteriografía abdominal, apreciándose masa hipervascular suprarrenal izda., sin datos actuales de hemorragia activa, irrigada por una arteria suprarrenal con origen aórtico (Fig. 3). Dado que el paciente se encontraba hemodinámicamente estable, y no existía evidencia de hemorragia activa, se decide observación estricta del paciente, sin plantearse otra actitud. Se repitió el T.A.C. a los tres días del ingreso, sin apreciarse cambios destacables. En vista de la presencia de masa pulmonar, se decidió valoración por el servicio de Neumología, indicando toma de citologías de esputo, con resultado negativo, y realizaron fibrobroncoscopia, no encontrando hallazgos de interés, no pudiendo etiquetar el origen de la masa pulmonar. Así mismo, el paciente fue valorado por el servicio de Endocrinología, para descartar posible funcionalidad de las masas suprarrenales, solicitando los siguientes estudios bioquímicos: Cortisolemia a.m.: 13 ug/dl, cortisolemia p.m.: 10 ug/dl, cortisoluria: 102 ng/24 h., testosterona total: 5 ng/ml., DHEA-S: 0,45 ug/ml, 17-OH-progesterona: 2,1 ng/ml, aldosterona: 25 pq/ ml, ACTH 8.a.m.: 22 pg/ml, ACTH 8.p.m.: 20 pg/ml, adrenalina: 9,2 mcg/24 h, noradrenalina: 5 mcg/24 h, dopaina: 274 mcg/24 h. Ionograma: normal. Una vez completados los estudios, sin clarificar la etiología del proceso, se decide laparotomía, apreciándose hematoma retroperitoneal organizado y gran masa de origen suprarrenal izquierdo, sin plano de cribaje con el riñón, practicándose nefrec- Fig. 3: Arteriografia renal: Masa hipervascular suprarrenal izda. 728 J.J. RODRÍGUEZ MAREZ, M. HERREROS VILLARAIZ, F.J. PÉREZ GARCÍA Y COLS. Fig. 4: Células tumorales de mediano tamaño, muy pleomórficas, creciendo de forma difusa y con escaso estroma intercelular. Abundantes mitosis. (H/E xlOO) neuroendocrino de células pequeñas. Se decidió consulta al servicio de Oncología Médica, para valorar tratamiento citostático complementario, en vista del origen neuroendocrino del tumor, comenzando ciclos de quimioterapia. El paciente fue sometido a seis ciclos de carboplatino y VP-16 en un periodo de seis meses, ajustando la dosis según la función renal. Se practicó T.A.C. abdominal de control al concluir los ciclos de citostáticos, apreciándose aumento significativo de la masa suprarrenal derecha (Fig. 7) y en T.A.C. torácico, crecimiento de la masa hiliar pulmonar (Fig. 8), ya observado en radiografías torácicas de control. A la exploración se apreciaban adenopatías inguinales, supraclaviculares y cervicales, refiriendo la familia que el paciente se encontraba bradipsiquico y, ocasionalmente, desorientado, por lo que se solicitó T.A.C. craneal, observándose varias lesiones ocupantes de espacio en parénquima cerebral en relación con metástasis. (Fig. 9) Se administraron 30 Gy en 10 fracciones de radioterapia craneal paliativa. El paciente experimentó empeoramiento progresivo, administrándole, en la actualidad, tratamiento paliativo, únicamente. tomía y siendo el diagnóstico anatomopatológico intraoperatorio. Carcinoma indiferenciado, y el informe definitivo de la pieza: Neoformación epitelial densamente celular, que crece en forma de masas constituidas por células fusiformes y ovaladas, que muestran importantes alteraciones morfotintoriales, monstruosidades celulares y numerosas mitosis. Estroma muy escaso, con abundantes zonas de necrosis y hemorragia (Figs. 4 y 5). Positividad para tinción inmunohistoquímica NSE y CAM (Fig. 6). La tumoración afectaba glándula suprarrenal, respetando parénquima renal. En vista de estos hallazgos histológicos, el informe patológico fue carcinoma neuroendocrino indiferenciado. A la vista de estos hallazgos histológicos e inmunohistoquímicos y dado que el paciente presentaba una masa pulmonar hiliar y metástasis suprarrenales bilaterales, la impresión diagnóstica fue metástasis suprarrenal bilateral de carcinoma pulmonar El carcinoma neuroendocrino de células pequeñas se caracteriza por su frecuente origen pulmonar, afectación sistémica precoz, asociación a síndromes paraneoplásicos y mayor respuesta a quimioterapia que a otras opciones terapeúticas. Esta neoplasia fue descrita por Barnard en 1926 (1), denominándolo carcinoma medular, conocido, posteriormente como carcinoma de células pequeñas, microcítico o de células en grano de avena (oat cell). Supone el 25-30% de los tumores pulmonares, siendo el segundo en frecuencia tras el carcinoma epidermoide. Afecta en el 85% de los casos a varones, apareciendo en edades más precoces que el Fig. 5: Nidos de células tumorales infiltrando tejido suprarrenal. (H/E x250) Fig. 6: Células tumorales con intensa positividad para la enolasa neural específica. (NSE x 400) DISCUSIÓN HEMORRAGIA SUPRARRENAL COMO PRIMERA MANIFESTACIÓN DE UN CARCINOMA PULMONAR DE CÉLULAS PEQUEÑAS Fig. 7: TAC abdominal: Aumento de la masa suprarrenal derecha. resto de tumores pulmonares (2) y asociándose a tabaquismo. Se presenta como una masa central no cavitada afectando a bronquios proximales y acompañándose de abundantes adenopatías hiliares y mediastinicas. (3) La broncoscopio puede ser normal si el tumor no afecta a la mucosa bronquial. Con mucha menor frecuencia puede presentarse de forma primaria en otras localizaciones no pulmonares como aparato digestivo, rinofaringe, glándulas salivales, timo, aparato ginecológico, piel,(2) vejiga (4, 5), próstata (6) y riñones (7, 8, 9, 10, 11) se ven afectados en menos del 1% de los casos. La histogénesis de esta neoplasia es controvertida, siendo postuladas tres teorías (13): -Célula madre de origen neuroendocrino (células de Fig. 8: TAC torácico: Aumento de la masa biliar pulmonar derecha. 729 Kultschitzky) -Células de la submucosa, procedentes de la cresta neural. -Células de la mucosa, que sufren metaplasia. El postulado más aceptado es el de origen neuroendocrino. En el estudio genético, se han observado cambios en todos los miembros de la familia myc (c-, N- y L-myc), así como alteraciones en los genes rb y p53, matados en más del 90% de los casos (3). Respecto a la histología del tumor, la O.M.S. describe tres tipos celulares que pueden constituirlo: carcinoma oat cell (variedad más frecuente), carcinoma de células intermedias y carcinoma oat cell combinado. Las células suelen ser de pequeño tamaño, escaso citoplasma, núcleo redondo y cromatina densa, conteniendo, de forma inconstante, gránulos densos argirófilos de neurosecrección, los cuales son el dato estructural más característico. (12, 13) Las variedades fusiforme y ovalada, como el caso descrito previamente, suelen presentar mejor pronóstico. El tiempo medio de duplicación celular es de 55 días. En las localizaciones extrapulmonares, con frecuencia, existe asociación a otras extirpes histológicas (adenocarcinoma, tumor carcinoide, sarcoma, transicional) (12) Las células neuroendocrinas que constituyen esta neoplasia forman parte del sistema A.P.U.D., presentando, por tanto, marcadores inmunohistoquímicos típicos como la citoqueratina AE1-AE3, queratina 8 de bajo peso molecular (CAM 5.2), antígeno epitelial de membrana (EMA),y marcadores neuroendocrinos como la enolasa neural específica (NSE), cromogranina A, serotonina,(2, 6, 7,13) Los más habituales son NSE, CAM 5.2 y cromogranina A, los cuales permiten diferenciar el carcinoma de células pequeñas de otros tumores. En más del 40°/0 de los casos se encuentra asociación a síndromes paraneoplásicos, pudiendo ser el primer indicio del tumor o recidiva del mismo tras tratamiento. Existe relación entre el grado de manifestación del síndrome, Fig. 9: TAC craneal: Metástasis cerebrales. 730 J.J. RODRÍGUEZ MAREZ, M. HERREROS VILLARAIZ, F.J. PÉREZ GARCÍA Y COLS. tamaño tumoral y la respuesta al tratamiento. Las sustancias que puede producir son ACTH like, segregada en el 75% de los síndromes paraneoplásicos, originando un s. Cushing atípico; ADH, provocando alteraciones jónicas; VIP; CEA; glucagón; (3) Así mismo, puede ocasionar síndromes neurológicos y miopáticos como el Lambert-Eaton, dermatológicos como el eritema gyratum repens, retinianas, reumáticas (14). En el 70% de los casos, el carcinoma de células pequeñas, se presenta como enfermedad diseminada al diagnóstico. En más del 95% de los pacientes fallecidos por esta neoplasia, presentan metástasis suprarrenales macro o microscópicas en la necropsia. La vía de diseminación es linfática y hematógena, alcanzando cerebro (10), hueso, médula ósea, hígado, g. suprarrenales, médula espinal. Dada la sensibilidad de este tumor a los citostáticos, la base del tratamiento es la quimioterapia, pudiendo asociarse a radioterapia. En tumores localizados, periféricos, pequeños, de células fusiformes o poligonales, puede plantearse la exéresis, siendo esta situación muy infrecuente. Existen varios regímenes quimioterápicos, siendo los más habituales: CAV (ciclotosfamida + doxorrubicina + vincristina), CAVP16 (ciclofosfamida + doxorrubicina + etopóxido) y VP-l 6 + cisplatina, siendo este último, el más utilizado Los citostáticos se administran en períodos de 6-12 meses, ciclos de 5 días y cada 3, 4 ó 6 semanas (3), según el citostático y la tolerancia del paciente. La radioterapia se asocia a la quimioterapia en neoplasias localizadas, principalmente, torácicas y en casos de metástasis cerebrales, a altas dosis (4.000 Rads) La supervivencia en pacientes no tratados oscila entre 6 y 17 semanas, en aquellos tratados con quimioterapia asociada o no a radioterapia, es de 40-70 semanas. La supervivencia global a los 5 años es menor del 7%. Las glándulas suprarrenales se afectan por metástasis en el 20% de las neoplasias. Los tumores primarios que con mayor frecuencia metastatizan en estas glándulas son pulmón, mama, estómago, colon, riñón, ganglios, ovario, melanoma, hígado (15). Más de un 20% de los pacientes presentan afectación suprarrenal en el momento de ser diagnósticados de un tumor de células pequeñas. Característicamente suelen ser masas grandes, bilaterales, de crecimiento rápido, asintomáticas o simulando clínica del tumor primario, como síndromes paraneoplásicos. Raramente ocasionan insuficiencia suprarrenal, que, cuando ocurre, se debe a destrucción o a necrosis glandular. El diagnóstico se establece por T.A.C., apreciándose una imagen similar al tumor primario, siendo masas grandes (>6 cms.), lobuladas, heterogéneas, con áreas sólidas, incrementadas con contraste, y áreas de baja atenuación por necrosis y/o hemorragia (15). Según Pagani (16), el T.A.C. presenta un 17% de falsos nega- tivos en metástasis de carcinoma de células pequeñas pulmonar. La punción suprarrenal bajo T.A.C., permite diferenciar carcinoma suprarrenal primario de metastásico. El tratamiento de las metástasis es el del tumor primario. En metástasis únicas, pequeñas y con buen pronóstico del tumor primario, lo cual ocurre en menos del 4% de los casos, puede considerarse la cirugía tras estudio de la posible funcionalidad de la masa. (17). Como conclusión podemos abstraer que, en masas suprarrenales, grandes, heterogéneas y bilaterales, se debe descartar metástasis como primera posibilidad. BIBLIOGRAFÍA: 1. BARNARD, W.G.: "The nature of the oat-cell sarcoma of the mediastinum." J. Pathol. Bacter., 29: 241, 1926. 2. lbrahim, N.; Briggs, J.; Carbishley, C.: "Extrapulmonary oat cell carcinoma." Cancer, 54: 1.645, 1984. 3. ISSELBACHER, K.J.; BRAUNWALD, E.; WILSON, J.D. y cols.: "Harrison's Principles of Internal Medicine".Vol. 1. Pags. 552-558. E. Mc Graw-Hill, New York. 1995. 4. YU, D.S.; CHANG, J.: "Small cell carcinoma of the urinary tract." Br. J. Urol., 66: 590, 1990. 5. MIKUZ, G.: "Non- urothelial tumor of the urinary tract." Verh. Dtsch. Ges. Pathol., 77: 180, 1993. 6. RIVAS ALONSO, A.; GÓMEZ DORRONSORO, M.; VALENTÍ PONSA, C.: "Carcinoma de células pequeñas de próstata con metástasis cerebral." Actas Urol. Esp., 20: 582, 1996. 7. TETU, B.; RO, J.Y.; AYALA, A.G. "Small cell carcinoma of the kidney: a clinicopathologic, immuno-histochemichal and ultrastructural study." Cancer, 60, 1809, 1987. 8. CAPELLA, C.; EUSEBI, V.; ROSAI, J.: "Primary oat cell carcinoma of the kidney." Am. J. Surg. Pathol., 8: 885, 1984. 9. ESSENFELD, H.; MANIVEL, J.C.; BENEDETTO, P. y cols.: "Small cell carcinoma of the renal pelvis: a clinicopathological, morphological and immunohistochemical study of two cases." J. Urol., 144: 344, 1990. 10. PÉREZ CESPEDES, M.; ARMORA, J.; AGUILÓ, F. y cols.: "Masa renal como manifestación inicial de un tumor de células pequeñas metastatizante." Actas Urol. Esp., 15: 202, 1991. 11. SHISHIKURA, Y.; SUZUKI, M.: "Clinicopathologic study of 97 cases of small renal cell carcinoma using DNA flow cytometric analyses." Pathol. Int., 46: 947, 1996. 12. DOMINGUEZ IGLESIAS, F.; RIVERA VELASCO, J.R.; JUNCO PETREMENT, P.: "Carcinoma de célula pequeña-sarcomatoide de vejiga urinaria." Arch. Esp. Urol., 49: 631, 1996. 13. RIPA SALDÍAS, E.; DELPÓN PÉREZ, E.; FDEZ. ROSAENZ, J.: "Carcinoma de células pequeñas de vejiga." Actas Urol. Esp., 21: 495, 1997. 14. BENAGES, J., CECCHINI, L.; SANFELIÚ, F. y cols.: "Dermatomiosistis y tumor de células pequeñas renal." Actas Urol. Esp., 21; 67, 1997. 15. COZAR OLMO, J.M.; MARTÍNEZ-PIÑEIRO, J.A.; GARCÍA MATES, M.J. y cols. "Diagnóstico por imagen de los tumores suprarrenales." Arch. Esp. Urol., 45; 331, 1992. 16. PAGANI J.: "Normal adrenal glands in small cell lung carcinoma: CT- guided biopsy." Am. J. Radiol., 140: 949, 1983. 17. KIRSCH, A.; MEHMET, C.; STOOPLER, M.: "Operative management of adrenal metastases from lung carcinoma." Urology, 42: 716, 1993.