1 LA MATERIA. ESTADOS DE AGREGACIÓN. LEYES DE LOS
Anuncio

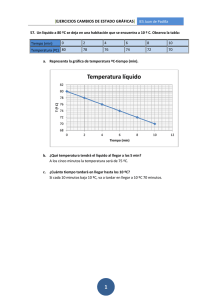
LA MATERIA. ESTADOS DE AGREGACIÓN. LEYES DE LOS GASES 1. PROPIEDADES DE LA MATERIA • Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material es la porción de materia que se aísla para su estudio. • Propiedades generales de la materia: masa (kg) cantidad de materia que posee. Volumen (m3), el espacio que ocupa. • Propiedades específicas: dependen del tipo de sustancia, son el color, brillo, dureza, densidad, punto de fusión, punto de ebullición. • Densidad: es una propiedad específica. m d= V kg La unidad en el SI es el 3 . Cada sustancia tiene una densidad que la m diferencia de cualquier otra sustancia. Por ejemplo a 4º C el agua tiene kg una densidad ρ agua = 1000 3 m • • • • Punto de fusión: temperatura a la que se produce el cambio de estado de sólido a líquido y viceversa. (Tf) Calor latente de fusión: energía que se intercambia en el paso del estado de sólido al líquido. Punto de ebullición: temperatura a la que se produce el cambio de estado de líquido a gas y viceversa. (Te) Calor latente de vaporización: energía que se intercambia en el paso del estado de líquido al gaseoso. 2. CLASIFICACIÓN SEGÚN SU ESTADO DE AGREGACIÓN Y CAMBIOS DE ESTADO. SÓLIDO-No se puede comprimir-Forma constante -Volumen constante. LÍQUIDO-Estado intermedio entre sólido y gas-Forma variable -No se pueden comprimir-Volumen constante. GAS-Forma variable- Muy compresible- Volumen variable. 1 • A continuación se refleja el cambio de estado de líquido a gas que puede ser de dos formas Evaporación Ebullición En un líquido, las partículas de la superficie, que están menos retenidas, pueden escapar y pasar a fase gaseosa. Este proceso se lleva a cabo a cualquier temperatura. Cuando la energía de las partículas es lo suficientemente alta, todas las partículas son capaces de pasar a fase gaseosa. De toda la masa del líquido salen burbujas. Para que se produzca este proceso es necesario alcanzar la Te • A continuación se refleja un esquema con los cambios de estado CAMBIOS DE ESTADO SUBLIMACIÓN FUSIÓN SÓLIDO VAPORIZACIÓN LÍQUIDO SOLIDIFICACIÓN GAS CONDENSACIÓN SUBLIMACIÓN INVERSA 2 • Durante un cambio de estado la temperatura permanece constante, a continuación se representa una gráfica de enfriamiento donde se refleja este hecho. T ºC 100 Gas Gas-Líquido Líquido 75 Líquido-Sólido 20 Sólido 2 8 13 20 24 t min 3. LEYES QUE EXPLICAN EL COMPORTAMIENTO DE LOS GASES. Magnitudes físicas: • Presión: se define la presión como la fuerza ejercida por unidad de superficie. En el sistema internacional (S.I) se mide en Pascales (Pa). Otras unidades de presión utilizadas son el mm de Hg, la atmósfera (atm). 1atm = 760 mm de Hg = 101300 Pa • Temperatura: medida de la energía interna de los cuerpos. Las escalas para medir las temperaturas: Escala Celsius toma como puntos de referencia la fusión del agua al que asigna el valor 0 y la ebullición al que asigna el valor 100. Escala Kelvin o escala absoluta de temperatura toma como referencia el 0 K o absoluto, temperatura a la que el movimiento de las partículas es nulo, en esta escala no existen valores negativos. El 0 K corresponde en la escala Celsius con -273 ºC, a partir de esta equivalencia se establece la relación entre las dos escalas: T ( K ) = T (º C ) + 273 3 Leyes de los gases • Ley de Boyle: si la temperatura de una masa de gas permanece constante, el producto de la presión que ejerce por el volumen que ocupa permanece siempre constante. El volumen y la presión son inversamente proporcionales y matemáticamente, la ley de Boyle y Mariotte se puede expresar: P ⋅V = K donde K representa una constante o lo que es lo mismo: P1 ⋅ V1 = P2 ⋅ V2 • Ley de Charles: a presión constante el volumen de una masa de gas es directamente proporcional a su temperatura absoluta. La ecuación matemática: V = K ⋅T • V1 V2 = T1 T2 Ley Gay-Lussac: a volumen constante, la presión de una masa de gas es directamente proporcional a su temperatura absoluta. La ecuación matemática: P = K ⋅T • o lo que es lo mismo: O lo que es lo mismo: P1 P2 = T1 T2 Ecuación general de los gases P.V =K T Para dos condiciones distintas: P1.V1 P2.V2 = T1 T2 4