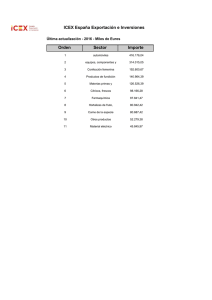
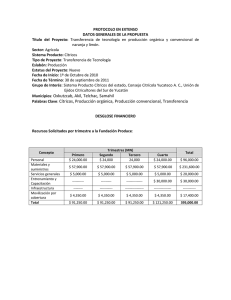
archivo
Anuncio

PLAGAS POTENCIALES DE HORTALIZAS Y CÍTRICOS Roberto Gastélum-Luque, Tirzo Paúl Godoy-Angulo, Miguel López-Meza, Moisés Gilberto Yañez-Juárez, Jacobo Enrique Cruz-Ortega 2.1. Piojos harinosos: plaga potencial en hortalizas 2.1.1. Generalidades de los piojos harinosos Las cochinillas o piojos harinosos son insectos de la familia Pseudoccocidae, Orden Hemiptera. Se llaman así porque muchas especies secretan una fina capa de secreciones de apariencia harinosa, con prolongaciones laterales y caudales de estas secreciones que pueden observarse en mayor o menor longitud dependiendo de la especie (Williams y Granara de Willink, 1992; Castillo y Bellotti, 1990). Se pueden encontrarse en casi cualquier parte de su planta hospedera, aunque muchas especies adquieren una posición característica. Relativamente pocas especies se encuentran en situación expuesta, tales como el haz de las hojas. Muchas especies viven debajo de la corteza, en envolturas de hojas y axilas, en brácteas, debajo de los cálices o en las raíces (Cox, 1987). En algunos casos, estos insectos establecen relaciones simbióticas con las hormigas, aumentando su potencial de dispersión. La miel de rocío (honeydew), que es la excreción de gotas de sustancias azucaradas, además de favorecer las relaciones simbióticas con hormigas que los transportan y protegen, puede permitir el crecimiento de asociaciones de bacterias y hongos del grupo Capnodium que producen fumaginas, disminuyendo la fotosíntesis de la planta hospedera (Hamon, 1998). Eventualmente pueden ser transmisoras de virus, pueden inyectar tóxinas a las plantas, o facilitar la penetración de hongos y bacterias (Kondo, 2001; Soria et al., 1998). Estos elementos se conjugan negativamente y acarrean efectos detrimentales en el desarrollo y la producción de cultivos. El macho adulto presenta el cuerpo dividido en regiones, pudiendo ser alado o áptero. El aparato bucal está atrofiado o no existe, siendo su vida de corta duración (Soria y Viñuela, 2003; Williams, 1991). El macho alado tiene siempre únicamente dos alas, las alas posteriores están reducidas a hamulohalterios (Williams, 1991). Los machos constituyen un material de estudio promisorio, de gran valor y ayuda en la definición y clasificación futura de las especies. Con muy pocas excepciones, aún no son utilizados porque su presencia en el material recolectado es muy rara. La localización de los machos adultos se dificulta debido, en parte, a que son alados y muy pequeños (Castillo y Bellotti, 1990). Las hembras presentan un cuerpo de consistencia blanda, el tamaño y el color del cuerpo varían de acuerdo con la especie y la forma puede ser alargada, ovoide o casi circular. Sobre la superficie dorsal puede verse la segmentación del cuerpo, pero no se nota una diferencia entre cabeza, tórax y abdomen. Sin embargo, en casi la totalidad de las especies es fácil observar un par de antenas y tres pares de patas (Castillo y Bellotti, 1990; Ramos, 2003). Individualmente las hembras adultas pueden variar en tamaño de acuerdo a las condiciones ambientales sobre las cuales se desarrolla y todas sufren agrandamiento durante la producción de huevos, después que alcanzan la madurez. Algunas especies son característicamente mucho más pequeñas que otras. La forma del cuerpo parece estar relacionada con el hábitat y es característico de especies más que de género (Cox, 1987). En la (figura 16) se indican las características usadas para la identificación de ejemplares de este género en el laboratorio. Figura 16. Estructuras utilizadas para la identificación de especies del género Sphenococcus (Williams, 1991). 2.1.2. Importancia económica Los estados de crecimiento de estos insectos, llamados ninfas, son fácilmente diseminados a través del transporte internacional. Después de que las personas visitan un campo infestado, las ninfas son capaces de adherirse a la ropa, pelos y plumas de los animales y también a los vehículos. El transporte de productos vegetales como semillas, raíces, hojas, yemas, tallos, esquejes, flores, frutas y plantas enteras entre países constituye una fuente muy importante para la diseminación de estos insectos. El pequeño tamaño de sus individuos y los hábitos críticos de la familia, hacen que con frecuencia no sean detectados en las inspecciones cuarentenarias vegetales. En el caso de las especies partenogenéticas, una sola hembra juvenil puede ser el inicio de una infestación importante si es introducida por accidente sin sus enemigos naturales. La introducción accidental de una especie de “cochinilla o piojo harinoso” puede, potencialmente, causar grandes daños económicos y ecológicos como es el caso de Maconellicoccus hirsutus (Green) (CHB) (Cochinilla Rosada del Hibiscus) en la región de Bahia de Banderas en Nayarit, en años recientes. Algunos de los géneros más importantes que atacan frutales y hortalizas son Planococcus, Pseudococcus, Phenacoccus, Maconellicoccus, entre otros. Dentro de estos destacan ciertas plagas como el piojo harinoso de la vid Planococcus ficus y de la uva Pseudococcus maritimus, piojos harinoso de los cítricos Planococcus citri, y algunos piojos harinosos del género Phenacoccus, este último encontrado recientemente atacando chile bell pepper en invernadero, en Sinaloa. El género Phenacoccus Cockerell 1893, es uno de los más antiguos y numerosos de la familia Pseudococcidae; incluye actualmente 186 especies (Granara de Willink y Szumik, 2008) con distribución en todas las regiones zoogeográficas. Varias de estas especies son importantes plagas de cultivos agrícolas y plantas ornamentales. Se citan para la región Neotropical, 22 especies de Phenacoccus (Granara de Willink y Szumik, 2008). Algunas de las principales especies se describen a continuación 2.1.3. Principales especies de piojos harinosos 2.1.3.1. Phenacoccus gossypii Townsend y Cockerel, 1898. 2.1.3.1.1. Distribución de la especie Conocido como piojo harinoso mexicano y normalmente se confunde con P. madeirensis. Esta especie tiene una distribución cosmopolita, en todas las regiones biogeográficas del mundo. Se reporta en Bahamas, México (Williams & Granara de Willink, 1992; citados por Granara de Willink y Szumik, 2008). Africa, Hawaii, USA, Cuba, Bermuda, Nicaragua (Maes y Téllez Robleto, 1988). 2.1.3.1.2. Hospederos Sus principales hospederos son plantas de algunas de las familias siguientes: Agavaceae, Amaranthaceae, Anacardiaceae, Asclepiadaceae, Asteraceae, Cactaceae, Convolvulaceae, Euphorbiaceae, Fabaceae, Malvaceae, Moraceae, Rutaceae, Solanaceae, Umbelliferae, Verbenaceae, etcétera. En el Perú es frecuente el daño en papa. Se ha encontrado en algunas hospederas, de las más conocidas en la región son mango (Mangifera indica), frijol (Phaseolus vulgaris), chile (Capsicun annuum y Solanum lycopersicum (Pérez y Hernández, 1987), entre otras. 2.1.3.1.3. Descripción morfológica El insecto se reconoce por la presencia de dos rayas obscuras sobre el dorso, con filamentos serosos cortos alrededor del cuerpo, ovisaco cubriendo el cuerpo, excepto la cabeza, con filamentos anales cerca de un cuarto de la longitud del cuerpo, secreta un fluido de color verde pálido (figura 17). En laboratorio el insecto se identifica por las características siguientes: antenas con nueve segmentos, tibias con poros translúcidos, círculo grande sin línea intersegmental, con proyecciones laterales (Figura 17). Dieciocho pares de cerarios marginales, el anal con tres setas de tamaño similar y otras próximas más pequeñas, con poros triloculares discoidales, cerarios dorsales en la línea media del tórax con asociaciones de setas y poros triloculares dispersos en la superficie, poros triloculares y discoidales numerosos y diseminados, los multiloculares son numerosos, se encuentran en grupos en el tórax y en bandas en el abdomen; conductos tubulares crateriformes intermedios, asociados o no con los poros multiloculares; dos pares de ostiolos presentes. Poros quinqueloculares en la cabeza, tórax y abdomen; los poros multiloculares en el abdomen forman filas que llegan hasta el margen, y en grupos pequeños en el margen del tórax, conductos tubulares de tipo crateriforme intermedio en el tórax y abdomen; conductos tubulares con collar oral en la zona media de los segmentos abdominales (Williams y Granara de Willink, 1992). 2.1.3.2. Phenacoccus madeirensis Green 2.1.3.2.1. Distribución de la especie Especie muy difundida en la región Neotropical, es polífaga y afecta más de 30 familias vegetales. Se le encuentra distribuido en Bahamas, Barbados, Bermuda, Bolivia, Brasil, Colombia, Costa Rica, Cuba, Dominica, Ecuador, Grenada, Guadalupe, Guatemala, Guyana, Haití, Isla Caimán, Islas Vírgenes, Jamaica, México, Montserrat, Nevis, Panamá, Paraguay, Perú, Puerto Rico, St. Kitts, St. Lucia, Tobago, Trinidad y Venezuela (Williams & Granara de Willink, 1992 y Granara de Willink y Szumik, 2008). Granara de Willink y Szumik (2008) lo citan por primera vez para la Argentina en diversos hospederos. 2.1.3.2.2. Hospederos Este insecto se ha encontrado en varios hospederos; algunos de los mas conocidos en la región son Chile (Capsicum annuum), toloache (Datura metel), tomate (Lycopersicon esculentum), berenjena (Solanum melongena), papa (S. tuberosum), limón (Citrus limonium), entre otros (Ben-Dov, 1994;Williams y Granada de Willink, 1992). 2.1.3.2.3. Descripción morfológica Cuerpo cubierto con cera pulverulenta, con filamentos cerosos cortos alrededor del cuerpo, sin rayas longitudinales obscuras sobre el dorso, sin filamentos caudales largos (figura 17). Produce masas de huevos u ovisacos. Despojada de la cera el cuerpo es verdoso. En preparaciones microscópicas se observa la antena con nueve segmentos, tibias posteriores con poros translúcidos, un círculo grande en forma de yunque; 18 pares de cerarios, formados en general por dos setas, excepto alguno de la cabeza y el anal con tres o cuatro setas, cerarios dorsales y asociaciones de poros triloculares y setas se encuentran en la línea media dorsal del tórax, y varios dispersos en el tórax y los primeros segmentos abdominales (figura 17). Poros triloculares y poros discoidales presentes, poros multiloculares en bandas o grupos en el abdomen, conductos tubulares crateriformes intermedios aislados y escasos en la cabeza y tórax, son más abundantes en el abdomen y también están en el segmento VIII. Dos pares de ostiolos. Poros triloculares y poros discoidales presentes, poros multiloculares se encuentran en el abdomen únicamente en la zona media de los segmentos y en grupos en el margen de los cinco primeros segmentos. Hay conductos tubulares con collar oral en la zona media del abdomen y conductos tubulares crateriformes intermedios en el tórax y en el margen del abdomen, poros quinqueloculares numerosos en la cabeza, tórax y abdomen (Granara de Willink y Szumik, 2008). Semejante a P. gossypii que posee características similares, con grupos de poros multiloculares dorsales en el tórax, pero P. madeirensis se diferencia de esa especie, porque los poros multiloculares dorsales están restringidos al abdomen, excepcionalmente pueden encontrarse dos o tres en el mesotórax. 2.1.3.3. Phenacoccus solenopsis 2.1.3.3.1. Distribución de la especie Es una especie poco frecuente en la región Neártica; en la Neotropical se le encuentra, en el norte de América del Sur, siendo ésta la cita más austral en el continente (Granara de Willink, 2003). Se reporta en Argentina, Colombia, Cuba, Ecuador, México, Panamá, República Dominicana (Williams & Granara de Willink, 1992). 2.1.3.3.2. Hospederos Este insecto se ha encontrado en varias plantas. Las hospederas más conocidas en la región son estafiate Ambrosia artemisifolia (Compositae) algodón Gossypium, Hibiscus rosasinensis y malva Sida (Malvaceae), Physallis y Solanum lycopersicum, por mencionar algunos. Larrain (2002) lo encontró atacando pepino dulce (Solanum muricatum Ait.) en Chile. 2.1.3.3.3. Descripción morfológica Cuerpo oval de 5 mm de longitud, algunas veces redondeado en vista lateral, de color verde oscuro a casi negro; patas rojas; cubierto con un material blanco ceroso; con una barra dorsosubmedia sobre las áreas intersegmentales del tórax y abdomen, la cual forma un par de líneas longitudinales obscuras en el dorso (figura 18); ovisaco ausente en el dorso pero bien desarrollado centralmente; con 18 pares de filamentos cerosos cortos; filamentos anales cerca de un cuarto de longitud del cuerpo; produce masas de huevos u ovisacos (Granara de Willink y Szumik, 2008). En los ejemplares revisados en el microscopio se observan18 pares de cerarios con dos setas lanceoladas (figura 18), cerarios dorsales ausentes, conductos tubulares con collar oral muy escasos y en el abdomen únicamente, dos pares de ostiolos. Círculo grande, sin línea intersegmental y poros multiloculares presentes hasta el segmento VI, poros quinqueloculares ausentes, conductos tubulares con collar oral escasos en el abdomen y tórax, antenas con nueve segmentos, tibias posteriores con poros translúcidos (Granara de Willink y Szumik, 2008). Presenta uña con dentículo. 2.1.4. Biología y hábitos de los piojos harinosos La hembra puede poner hasta 600 huevos usualmente en un ovisaco algodonoso en su cuerpo. Los huevos eclosionan entre 6 y 14 días. Las ninfas del primer instar se dispersan solamente a corta distancia en la misma hoja después insertan sus partes bucales y generalmente se mantienen ancladas, aunque pueden moverse a nuevos sitios si son molestadas. En invernadero se pueden presentar hasta ocho generaciones por año (Oetting, 2004). 2.1.5. Daños causados por los piojos harinosos El daño directo es causado por la alimentación de adultos e inmaduros sobre los tejidos del hospedero y por la inyección de toxinas o patógenos a las plantas hospederas. Los piojos harinosos succionan la savia y secretan abundante mielecilla sobre la que se desarrolla el hongo fumagina, que interfiere indirectamente en el proceso fotosintético de las plantas; además, la presencia de ésta sobre los frutos los inhabilita para la comercialización. Por otro lado, la presencia del material ceroso algodonoso con el que se cubre el insecto y que a veces queda en los frutos infestados por la plaga, da mal aspecto a los mismos y dificulta su venta. Las plantas infestadas muestran hojas, o parte de estas, cloróticas, caída prematura de hojas y pueden llegar a morir, si la infestación es alta (figura 19). En el caso de P. solenopsis puede causar distorsión de las hojas jóvenes en plantas de obelisco, síntoma que se puede confundir con el daño provocado por Macconellicoccus hirsutus en la misma planta (Oetting, 2004). 2.1.6. Detección y muestreo de piojos harinosos Las hembras de los piojos harinosos no vuelan y se dispersan con el traslado de plantas o sus derivados, con el movimiento de personas de un lugar a otro y las ninfas pequeñas lo hacen por corrientes de aire. El insecto se puede presentar desde plántula en el invernadero y desde ahí trasladarse a los invernaderos o casa sombra de producción, por lo que es importante revisar las plantas antes que entren. Los piojos harinosos pueden sobrevivir por uno o dos meses debajo de los plásticos que cubren las camas donde se coloca el sustrato hidropónico y en hospederas silvestres que quedan dentro de los invernaderos o casa sombra, por lo que es muy importante revisar y eliminar los insectos sobrevivientes antes de plantar de nuevo los cultivos. Si el cultivo se encuentra establecido, hacer un muestreo riguroso revisando cuidadosamente las hojas y tallos, buscando material ceroso algodonoso con el que se cubre el insecto. Normalmente las infestaciones empiezan de manera aislada y si no se detectan y eliminan oportunamente pueden alcanzar altas poblaciones. 2.1.7. Estrategias de manejo de piojos harinosos 2.1.7.1. Prácticas culturales Evitar la presencia de restos de plantas después de terminar el ciclo del cultivo. Antes de plantar, eliminar las hospederas silvestres y los piojos presentes en éstas, y los que están en el sustrato hidropónico, así como debajo del plástico que cubre la cama. La planta al establecerse en el invernadero o casa sombra debe estar libre de la plaga. Si el cultivo ya se estableció y la infestación va iniciando, se recomienda arrancar, sacar y eliminar las primeras plantas dañadas. Las acciones deben iniciar tan pronto como se detecte la plaga. 2.1.7.2. Control químico Antes de seleccionar el insecticida a usar se debe saber con precisión la especie de piojo harinoso que está causando problemas. Hay pocos productos efectivos contra P. medeirensis. Otras especies pueden ser controladas con insecticidas de amplio espectro y reguladores de crecimiento en insectos. El Orhene (acephate), Talstar (bifentrina), aceites y Enstar (S kinoprene) han sido los más efectivos contra P. madeirensis. Las aspersiones deben hacerse con alto volumen de agua para que penetren y cubran la cera que protege los piojos harinosos. Las ninfas pequeñas (caminantes) son las más susceptibles a los químicos, pero las generaciones sobrepuestas hacen difícil el control. En infestaciones muy altas también se dificulta el control (Oetting, 2004). 2.1.7.3. Control biológico Enemigos naturales de Phenacoccus gossypii. Algunos hymenopteros parasitoides son Anagyrus pseudococci, Anagyrus pseudococcus, Coccophagus gurneyi. ( Encyrtidae); depredadores como Azya sp., Cycloneda sanguinea, Hipodamia convergens, Olla sp., Scymnus sp. (Coccinellidae), Chrysopa arioles y Chrysopa iona (Chrysopidae) (Bio-Nica Org S/F). 2.1.8. Literatura citada Ben-Dov, Y. (1994). “A Systematic Catalogue of the Mealybugs of the World (Insecta: Homoptera: Coccoidea: Pseudococcidae and Putoidae) with Data on Geographical Distribution, Host Plants, Biology and Economic Importance. Disponible en: http://www.sel.barc.usda.gov/scalecgi/citation.exe?citation=MazzeoLoRu1994&last =2 Bio-Nica Org S/F. Fauna entomológica de Nicaragua: FAMILIA PSEUDOCOCCIDAE. http://www.bionica.info/Ento/Homop/PSEUDOCOCCIDAE.htm Castillo, J y Belotti A. (1990). “Carácteres diagnósticos de cuatro especies de piojos harinosos (Pseudococcidae) en cultivos de yuca (Manihot esculenta) y observaciones sobre algunos de sus enemigos naturales”. En: Revista Colombiana de Entomología. Vol. 16, No. 2 .Pp. 33-43. Cox, J.M. (1987). Pseudococcidae (Insecta: Hemiptera): fauna of New Zealand 11. Manaaki: Whenua Press. 232 p. Granara de Willink, M. C. y C. Szumik. (2008). “Phenacoccinae de Centro y Sudamérica (Hemiptera: Coccoidea: Pseudococcidae): sistemática y filogenia”. Rev. Soc. Entomol. Argent. [online]. jan./jul. 2007, vol.66, no.1-2, p.29-129. http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S037356802007000100005&lng=pt&nrm=iso>. ISSN 0373-5680 (consultado el 24 Junio 2008). Granara de Willink, M. C. (2003). “Nuevas citas y huéspedes de Phenacoccus para la Argentina (Hemiptera:Pseudococcidae)”. Revista de la Sociedad Entomológica Argentina 62(3/4): 80-82. Hamon, A. B. (1988). Introduction to Scale Insects. Disponible en: www.BromeliadBiota.ifas. ufl.edu/introscale.htm. Kondo, T. (2001). “Las cochinillas de Colombia (Hemiptera: Coccoidea)”. En: Biota Colombiana. Vol. 2, No. 1. Pp. 31-48. Larrain, S.P. (2002). “Incidencia de insectos y ácaros plagas en pepino dulce (Solanum muricatum Ait.) cultivado en la IV Region, Chile”. Agricultura Técnica. Chile. 62(1): 15-26. Maes J.M. y Tellez-Robleto J. (1988). “Catálogo de los insectos y artrópodos terrestres asociados a plantas de importancia económica en Nicaragua”. Rev. Nica. Ent., 51Disponible en: 95. http://www.bionica.info/Ento/Homop/PSEUDOCOCCIDAE.htm Mazzeo, G., Longo, S. & Russo, A. (1994). “Nuove acquisizioni sulla coccidiofauna dell'italia meridionale”. Memorie della Societa entomologica italiana. Genova, 72:201-209. Disponible en: http://www.sel.barc.usda.gov/scalecgi/citation.exe?citation=MazzeoLoRu1994&last =2 Oetting, R. (2004). “Insect and Arthropod Pest Identification and Management. En: Handout for southeast greenhouse conference workshops 2000-2004. Disponible en: http://mrec.ifas.ufl.edu/LSO/Manual/insect-text-only.htm Pérez G. G. y C Hernandez A. (1987). “Coccids of Horticultural Crops in the Canary Islands”. Bollettino del Laboratorio di Entomologia Agraria 'Filippo Silvestri' 43 (Suppl.):127-130. Disponible en: http://www.sel.barc.usda.gov/scalecgi/citation.exe?citation=PerezGCa1987&last=2 Ramos, A. (2003). Descripción de los carácteres morfológicos externos del adulto hembra de Pseudoccocus calceolariae Maskell (Sternorrhyncha: Pseudococcidae). Trabajo de grado (Maestría en Ciencias Agrarias). Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. 39 p. Soria, P. y Viñuela. (2003). “Las cochinillas de los pinos”. En: Terrata. No. 27. P. 7 . Soria, P.; del Estal P. y Viñuela E. (1998). “Plagas”. En: Boletín de Sanidad Vegetal. No. 24. Pp. 337-342. Williams, D. J. (1991). “Superfamilia Coccoidea”. En: Nauman, I. D. et al. (Eds.). The insects of Australia. Vol. 2. New York. Cornell University Press. Pp. 457-464. Williams, D.J. y Granara de Willink M.C. (1992). “Mealybugs of Central and South America”. CAB International, London, England. 635 p. disponible en: http://www.sel.barc.usda.gov/scalecgi/citation.exe?citation=MazzeoLoRu1994&last =2 a b c d Figura 17. Phenacoccus gossypii Townsend & Cockerell, hembra adulta (a y b) (tomado de Ferris, G.F. 1950 de Atlas of the Scale Insects of North America, Serie V, with the p Phenacoccus madeirensis Green, hembra adulta (c y d) (tomado de Williams 1987, Bulletin Entomological Research 77 Copyright CAB 1987. Permission of the publishers, Stanford University Press Copyright 1950). Figura 18. Phenacoccus solenopsis Tinsley, hembra adulta (tomado de Ferris, G.F. 1950 de Atlas of the Scale Insects of North America, Serie V, with the permission of the publishers, Stanford University Press Copyright 1950). Figura 19. Daños por Phenacoccus en el cultivo de chile bell pepper. 2.2. Situación Actual de la cochinilla rosada Maconellicoccus hirsutus Green 2.2.1. Introducción La Cochinilla Rosada del Hibisco (CRH) Maconellicoccus hirsutus Green (Homotera: Pseudococcidae) es uno de los principales insectos que ataca al hibisco, plaga exótica para la región de Asia, originaria de China, la cual está favorecida por la tendencia actual de la globalización del comercio internacional de productos agrícolas y el crecimiento del intercambio turístico entre el Caribe y nuestra región. En algunos países como India, Egipto, Guatemala, Costa Rica y México este insecto es considerado como una plaga de importancia económica y cuarentenaria. En México se encuentran afectados los estados de Nayarit en la región de Bahía de Banderas y Acaponeta, Sonora, Baja California, BC Sur, entre otros. En Sinaloa hay una estrecha vigilancia de la entrada y salida de plantas tanto en puertos y aeropuertos, así como revisión de camiones en las casetas fitosanitarias para impedir la entrada de ésta, ya que se descarta la idea de la presencia de la CRH en esta región, y se recomienda intensificarla para evitar que se siga dispersando a las diferentes regiones. Es muy grande el impacto socioeconómico derivado de la paralización de las exportaciones de frutas, ornamentales, hortalizas, flores y plantas vivas de nuestro país hacia Estados Unidos de América, Canadá, Europa y varios países latinoamericanos. 2.2.2. Hospederos La cochinilla rosada ataca a más de 215 especies de plantas de los siguientes grupos: hortalizas, ornamentales, frutales, forestales y malezas. Entre estas se encuentran las siguientes: obelisco (Hibiscus sp ), samán, guanábana, mamón, ciruela de huesito, mango, lima, mandarina, platanillo, algodón, cacahuate, caña de azúcar, vid, café, tomate, chile, dama de noche, maravilla, urape, verdolaga, etcétera. 2.2.3. Descripción morfológica Las hembras adultas carecen de alas y miden de 1 a 3 mm de longitud, son de color rojizo, cuerpo blando y ovalado, antenas de nueve segmentos y fluido corporal. Macho adulto, de color rojo oscuro, tienen un par de alas y son más pequeños que las hembras, tienen un par de filamentos cerosos al final del abdomen, poseen aparato bucal pero no es funcional, por lo que no se alimentan y viven solo unos pocos días. La ninfa es similar a la hembra pero esta no libera el fluido corporal, es elongada, rosada, patas bien desarrolladas y antenas de seis segmentos; la ninfa macho es más pequeña que la hembra. Los huevos, son depositados en sacos inicialmente son de color anaranjado y conforme va pasando el tiempo se torna de color rosado. Todos los estadios ninfales y la hembra son de color rojizo a rosado, cubiertos por una capa cerosa, melosa y blanquecina, trasluciendo el color de los cuerpos. Esa capa cerosa le provee alguna protección contra los plaguicidas. La ninfa y adulto hembra carece de filamentos cerosos bien desarrollados alrededor del cuerpo, esto lo hace distinguir del piojo harinoso de la vid, Pseudococcus maritimus, piojo harinoso de los cítricos Planococcus citri y el piojo harinoso de la uva Planococcus ficus. 2.2.4. Biología y hábitos Los estadíos de su ciclo de vida son: huevo y tres (hembra) o cuatro (macho) estadíos ninfales. La hembra pone los huevos en ovisacos que deposita sobre el hospedero, a veces en gran número, visibles como cobertura blancuzca sobre los extremos y hasta sobre las áreas principales del huésped. Las hembras adultas segregan una masa algodonosa en la cual depositan entre 300 y 600 huevos rosados, de los que emergen las ninfas de primer instar o gateadores. La cochinilla tiende a buscar áreas protegidas como grietas y hendiduras donde no es visible y es más difícil de eliminar. Las ninfas se pueden mover de una planta a otra por sus propios medios. El ciclo de vida en el trópico es de 23 -30 días. La etapa de huevo dura de 5 -6 días, ninfas de 20 -27 días y el adulto 28 días. 2.2.5. Daños provocados por la plaga La escama rosada succiona la savia de las plantas e inyecta una saliva tóxica llamada ligamasa, cuando se alimenta expulsan por su ano una sustancia clara y pegajosa que parece miel. La ligamasa, resultado del exceso de savia que están tomando las cochinillas, ocasiona la malformación de las hojas y frutos, así como de los puntos de crecimiento. Las hojas se enrollan en forma similar a un ataque de virosis. También se desarrolla fumagina que reduce el proceso fotosintético. Si la planta está débil, se marchita o desarrolla hojas y frutos mal formados. En ciertos casos el insecto puede alcanzar densidades de población tan altas que logra matar a sus hospederos, aun cuando estos sean árboles de varios metros de altura; los frutos pueden ser cubiertos totalmente con la secreción cerosa de la plaga y ocasionar su caída o desecamiento (William, 1996). 2.2.6. Muestreo de la plaga Los monitoreos dentro de las plantaciones pueden realizarse de dos formas, y depende del terreno. Si el terreno es homogéneo respecto a factores como suelo, humedad, tráfico (de personas, animales, carros), se escogen al azar varias parcelas para realizar muestreos de plantas dentro de cada una. Todas las partes de las plantas (raíz, tallo, ramas, hojas, flores, frutos) deben ser muestreadas, ya que la CRH puede estar en cualquiera de ellos. 2.2.7. Estrategias para el manejo integrado 2.2.7.1. Manejo Legal La cochinilla rosada, especialmente las ninfas, son fácilmente dispersadas por el viento, la lluvia, pájaros, hormigas, vehículos y en la ropa de las personas. El transporte de material vegetativo infestado es un buen medio de dispersión, así como el comercio internacional de plantas y sus productos. Se recomienda la inspección de verduras, frutas y flores en los puertos de entrada, ya que es un paso muy importante para prevenir su introducción, así como el reforzamiento de la ley cuarentenaria que consiste en vigilar cargamentos para evitar la introducción de la CRH en puertos y aeropuertos, también la destrucción de las plantas indeseables. Los objetivos del control legal son evitar que la plaga sea introducida a Sinaloa y preparar un plan emergente de control y erradicación en el caso que esto ocurra. Esta es una estrategia que integra varios componentes de ejecución inmediata y simultánea. Aunque la estrategia es nacional, es importante señalar que acciones similares se están implementando en todos los estados, pero principalmente con los que colindan con regiones infestadas (Nayarit, Baja California y Sonora). 2.2.7.2. Control físico La inmersión de ovisacos (masa de huevos) en agua, a temperatura de 47,48 y 49 0C durante 52, 24 y 14 minutos evitó la emergencia de ninfas. 2.2.7.3. Control biológico Existen muchas especies de parasitoides y depredadores de esta plaga en su lugar de origen. Unos de estos parasitoides es el Anagyrus kamali, originario de China, que puede reducir la población de la plaga hasta en un 90 %. Una hembra puede depositar hasta 60 huevos en forma individual en cada escama. El ciclo de vida de este parasitoide es de 15 días. También existe un depredador disponible comercialmente, Cryptolaemus montrouzieri Mulsant. Este es un devorador voraz, tanto la larva como el adulto consumen hasta 5,000 escamas rosadas durante su vida. La larva puede ser confundida con otras escamas, porque también cubren su cuerpo con filamentos cerosos. En Bahía de Banderas, Nayarit se liberaron 47,000 adultos de C. montrouzieri y 7,100 adultos del parasitoide Anagyrus kamali, en huertos de guanábana, diez meses después de la liberación se registró una disminución del 97.9% de la plaga. 2.2.7.4. Control químico El uso de insecticidas químicos no logran controlar eficientemente los adultos. Los mejores resultados se han obtenido contra ninfas de primer ínstar, aplicando pirimiphos metil y triazophos, pero son productos que afectan tanto a Anagyrus kamali, como a Cryptolaemus montrouziera. En Estados Unidos, el servicio de extenciòn y cooperación de Florida recomienda aplicar en drench al suelo imidacloprid y thiamethoxam y reforzar con aspersiones al follaje de bifentrin, clorpirifos metil, acephate, acetamiprid, buprofezin y pyriproxifen. 2.2.7.5. Control biorracional En un trabajo realizado en Acaponeta, Nayarit, se hicieron bioensayos con atomizador y se encontró que la incidencia de Cochinilla rosada del hibiscus fue significativamente menor donde se aplicó axión 3%, citrolina 3% + W-30 2% y resina soya 3% + W-30 2% y citrolina 3% + Knockout nem 2% + W-30 0.2%; consecuentemente, en estos tratamientos se registró la mayor eficacia. En los bioensayos con termonebulizador hubo significativamente menos ninfas de cochinilla rosada y mayor eficacia donde se aplicó la mezcla de diesel 50% + citrolina 50%, diesel solo, diesel 50% + resina soya 50% y citrolina + knockout nem 3%. En campo, con la aplicación que se hizo con el termonebulizador al cultivo de jicama, la incidencia de ninfas fue menor donde se aplicó diesel y citrolina con 9.75 y 11.0, respectivamente, en estos tratamientos la eficacia fue de 65 y 60%; con la aspersión a plantas de jícama hubo significativamente menos ninfas de cochinilla rosada donde se aplicó axión 5% , seguido de citrolina 3% + W-30 0.2%, resina de soya 1% + Knockout nem 2% + W-30 0.2%, pero la mayor eficacia se registró donde se aplicó axión 5% (Gastélum et al., 2007). 2.2.8. Literatura consultada Anónimo. (2004). “Agricultural Research. (Maconellicoccus hirsutus (Hemipreta: Pseudococcidae)” Proc. Natl. Acad. Sci. USA, 101, 9601. García–Valente, F. L. D. Ortega-Arenas, H. González-Hernández, J. A. VillanuevaJiménez, J. López-Collado, A. González-Hernández y H. Arredondo-Bernal. (2007). “Control biológico de la cochinilla rosada del hibico Maconelliccocus hirsutus (Green) (Hemiptera:Pseudococcidae) en frutales, en bahía de Banderas, Nayarit”. En: Estrada G. E. V., A. Equihua M., C. Luna L. y J. L. Rosas A. (editores) Entomología Mexicana. Vol. 6, Tomo 7. SME. 488-492. Gastélum L. R. V. Acosta V. y C. Gómez Llanos B. (2007). “Estudio de evaluación de efectividad biológica de productos bioracionales contra cochinilla rosada del hibisco Maconellicoccus hirsutus, en Acaponeta, Nayarit”. Informe Técnico. FA-UAS, CESAVESIN. Milton, A. Y C. M. Jacobson. (2005). “Hot Water Inmersion for Surface Desinfestacion of Maconelliccocus hirsutus (Green) (Homoptera:Pseudococcidae)”. Journal of Econ. Entomol. Vol 98:284-288. Padilla M.R. (2000). “Bioecología de la cochinilla rosada y su riesgo de ingreso en Honduras”. Manejo Integrado Plagas (Costa Rica) 57:10-22. Watson G.W, L.R Chandler. (2000). “Identificación de cochinillas o piojos harinosos de importancia en la región del Caribe”. Wallingford (UK). CAB International. 44 p. Williams D.J. (1986). “The Identity and Distribution of the Genus Maconellicoccus Ezzat (Hemiptera: Pseudococcidae) in Africa”. Bull. Entomol. Res 76:351-357. Williams D. J. (1996). “A Brief Account of the Hibiscus Mealy Bug Maconellicoccus hirsutus (Hemiptera: Pseudococcidae ), A Pest of Agriculture and Horticulture, with Descriptions of Two Related Species from Southern Asia”. Bull. Entomol. Res 86:617-628. 2.3. Psilido asiático de los cítricos, Diaphorina citri Kuwayama 2.3.1. Introducción e importancia El psilido asiático de los cítricos llamado comúnmente diaforina pertenece al Orden Hemiptera, Familia Psyllidae, y está ampliamente distribuido en las regiones tropicales y subtropicales de Asia. Este insecto se desarrolla exclusivamente en plantas de la familia Rutaceae, particularmente del género Citrus y Muralla. D. citri fue detectado en Arabia Saudita en 1974, así como en las Islas Reunión y Mauricio. En el continente Americano fue citada por primera vez en Brasil por Costa Lima. Posteriormente, fue localizado en Honduras, Uruguay, fue descubierto en Florida en 1998 y puede ser una de las plagas de cítricos mas serias si los patógenos que causan la enfermedad greening de los cítricos (Huanglongbing) están presentes. En México el insecto se reporta por vez primera en Arroyo Seco, Querétaro, en árboles de cítricos durante 2004. Posteriormente, se indica su presencia en San Luís Potosí, Monterrey, Tamaulipas y actualmente en Yucatán. 2.3.2. Descripción morfológica, biología y hábitos Los adultos de este insecto son de 3-4 mm de longitud, cuerpo café claro moteado cubierto de polvo ceroso, cabeza café claro, ojos rojos. Las antenas tienen el ápice negro y dos manchas café claro en la parte media. Alas anteriores son mas anchas en el extremo y presentan manchas café oscuro a lo largo del borde. Los machos son levemente más pequeños que las hembras. Se encuentran en posición inclinada con la parte posterior del cuerpo hacia arriba (figura 20). Los huevos son alargados, de 0.3 mm de longitud, recién colocados de color amarillo claro, tornándose anaranjados próximos a eclosionar. La hembra es capaz de poner hasta 800 huevos durante su vida. Presenta cinco instares ninfales de color anaranjado amarillento. El primer instar mide 0.25 mm de longitud y el último de 1.5 a 1.7 mm. El ciclo de vida del insecto varía de 15 a 47 días, dependiendo de las condiciones climáticas. En la India los adultos pueden vivir 190 días en invierno, pero sólo 20 días en verano Las mayores densidades de población son en los meses secos, disminuyendo en los meses de mayor precipitación. Diaphorina citri puede ser separado de aproximadamente 13 especies de psílidos reportadas en cítricos (figura 20). 2.3.3. Daños provocados por la plaga El daño directo es causado por ninfas y adultos al extraer grandes cantidades de savia en las hojas y pecíolos (figura, 21) lo cual debilita las plantas, al mismo tiempo introduce sustancias tóxicas en los tejidos, dejando manchas necróticas en las hojas donde se ha alimentado. La diaforina es el principal vector de la enfermedad llamada greening de cítricos, la cual es causada por la bacteria Candidatus Liberibacter que habita el floema, que puede infectar la mayoría de las variedades de cítricos y algunas plantas ornamentales. Solamente dos especies, D. citri y Trioza erytreae (del Guercio), han sido implicadas en la dispersión de esta enfermedad; ésta fue detectada en los Estados Unidos en agosto del 2005 en el condado de Miami–Dade, Florida. La enfermedad ha afectado seriamente la producción de cítricos en la India, Asia, Sureste de Asia, la península arábica y África. Hasta el momento no se ha reportado esta enfermedad en América, pero el peligro de introducción es inminente (figura 21). La enfermedad se caracteriza por causar hojas pequeñas y moteadas, los retoños tienen una apariencia amarillenta en general, floración deficiente y crecimiento detenido (frutas que no alcanzan su completo desarrollo). En áreas donde la enfermedad es endémica, los árboles de cítricos pueden vivir por solamente 5-8 años y nunca dar fruta provechosa. Las frutas son pequeñas, de pobre coloración, e irregulares. Las frutas tienen un sabor amargo, medicinal y agrio. La transmisión de greening de cítricos ocurre, principalmente, por medio de psílidos infectados y por injertar las plantas. Puede ser transmisible experimentalmente a través de cuscuta, posiblemente transmitida por la semilla de plantas infectadas y transovarialmente en los vectores psílidos. La enfermedad de greening de cítricos es restringida al Citrus y sus relativos cercanos debido al rango estrecho de hospederos de los vectores psílidos. 2.3.4. Estrategias de manejo D. citri puede ser controlado eficientemente con productos químicos. Este método a largo plazo trae como consecuencia la aparición de plagas secundarias, al tener que efectuar varias aplicaciones por año. Las aplicaciones de imidacloprid (Confidor) realizadas contra minador de los cítricos causaron 100 y 98% de mortalidad contra adultos y ninfas de diaforina, respectivamente, en tanto donde se aplicó abamectina (Vertime EC) no se controlaron los adultos (20% ) y controló moderadamente las ninfas (76%). En las Islas de Reunión fue controlado eficientemente con la introducción desde la India de un parasitoide específico, Tamarixia radiata (Waterston) (Hymenoptera: Eulophidae), igualmente esta especie se ha introducido a la Isla de Guadalupe con los mismos resultados. El manejo de la enfermedad de greening de cítricos es difícil y requiere una estrategia integrada incluyendo el uso de plantas no infectadas, la eliminación de inóculo por medios voluntarios y regulatorios, el uso de pesticidas para controlar los vectores psílidos en los huertos de cítricos, y el control biológico de los vectores psílidos en depósitos de plantas que no son cultivos. No hay ningún lugar en el mundo donde ocurre la enfermedad de greening de cítricos que esté completamente bajo un manejo exitoso. La erradicación de la enfermedad de greening de cítricos puede ser posible si la enfermedad está detectada tempranamente. Se necesita investigación sobre un diagnóstico rápido y eficiente, la epidemiología de la enfermedad, y el control del vector psílido. 2.3.5. Literatura consultada Halbert, S.E., and C. A. Núñez. (2004). “Distribution of the Asian Citrus Psyllid, Diaphorina citri Kuwayama (Rhynchota: Psyllidae) in the Caribbean Basin”. Florida Entomol. 87: 401-402. Halbert, S. E., and K L. Manjunath. (2004). “Asian Citrus Psyllids (Sternorrhyncha: Psyllidae) and Greening Disease of Citrus: A Literature Review and Assessment of Risk in Florida”. Florida Entomologist 87(3): 330-353 MCfarland, C. D. and M. A. Hoy. (2001). “Survival of Diaphorina citri (Homoptera: Psyllidae), and its Two Parasitoids, Tamarixia radiata (Hymenoptera: Eulophidae) and Diaphorencyrtus aligarhensis (Hymenoptera: Encyrtidae), under Different Relative Humidities and Temperature Regimes”. Florida Entomol. 84: 227-233. Michaud, J. P. (2002). “Biological Control of Asian Citrus Psyllid, Diaphorina citri (Hemiptera: Psyllidae) in Florida: A preliminary report”. Entomological News 113: 216-222. Tsai, J. H., and Y. H. Liu. (2000). “Biology of Diaphorina citri (Homoptera: Psyllidae) on four Host Plants”. J. Econ. Entomol. 93: 1721-1725. Viraktamath, C.A., and B.X. Bhumannavar. (2002). “Biology, Ecology and Management of Diaphorina citri Kuwayama (Hemiptera: Psyllidae)”. Pest management in Horticultural Ecosystems 7: 1-27. Figura 20. Adultos y ninfas del psílido asiático de los cítricos Diaphorina citri (tomada de la Campaña de la Dirección de Sanidad Vegetal) Figura 21. Daño indirecto (HLB) y daño directo del Psílido de los cítricos (Dirección General de Sanidad Vegetal