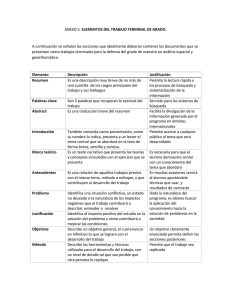
universidad austral de chile facultad de ciencias veterinarias
Anuncio

UNIVERSIDAD AUSTRAL DE CHILE FACULTAD DE CIENCIAS VETERINARIAS INSTITUTO DE PATOLOGÍA ANIMAL ANÁLISIS HISTOPATOLÓGICO DE HÍGADO, PULMONES Y RIÑONES DE LIEBRE MARRÓN EUROPEA (Lepus europaeus) DEL SUR DE CHILE Memoria de Título presentada como parte de los requisitos para optar al TÍTULO DE MÉDICO VETERINARIO. LUIS RODRIGO MAZA NAJLE VALDIVIA-CHILE 2010 PROFESOR PATROCINANTE Dr. Enrique Paredes H. Nombre PROFESOR COPATROCINANTE Dr. Juan Kruze V. Nombre PROFESOR COLABORADOR Dr. Manuel Moroni R. Nombre PROFESORES CALIFICADORES Dra. Sara Rodríguez C. Nombre Dr. Claudio Gutiérrez T. Nombre FECHA DE APROBACIÓN: 07 de diciembre de de 2010 ________________ Firma _________________ Firma _________________ Firma _________________ Firma _________________ Firma ÍNDICE Capítulo Página 1. RESUMEN………………………………………………………………… 1 2. SUMMARY……………………………………………………………….. 2 3. INTRODUCCIÓN………………………………………………………… 3 4. MATERIAL Y MÉTODOS……………………………………………….. 11 5. RESULTADOS……………………………………………………………. 13 6. DISCUSIÓN………………………………………………………………. 21 7. BIBLIOGRAFÍA………………………………………………………….. 26 8. ANEXOS………………………………………………………………….. 30 1 1. RESUMEN El presente estudio tuvo como propósito establecer los hallazgos histopatológicos con mayor frecuencia de presentación en hígado, pulmón y riñón de liebres marrón europea (Lepus europaeus Pallas, 1778) del sur de Chile y establecer las posibles causas de las alteraciones encontradas en los tejidos. Entre los meses de mayo y junio de 2008, como parte de otro estudio, se recibieron en el Instituto de Patología Animal de la Facultad de Ciencias Veterinarias de la Universidad Austral de Chile, vísceras correspondientes a 385 liebres provenientes de diferentes comunas de las Regiones de Los Ríos y Los Lagos, Chile. De estas vísceras se obtuvieron las muestras de los órganos en estudio, las cuales fueron depositadas en frascos plásticos (50 ml) de formalina al 10%, para procesarlas histológicamente con tinción hematoxilina/eosina y posterior análisis con microscopio óptico. Los principales hallazgos histopatológicos observados en hígado, fueron hepatocitos binucleados (99,7%), megalocitosis (99,7%), trastornos inflamatorios (50%) y congestión (45,6%). En pulmón los trastornos circulatorios fueron los más frecuentes, observándose congestión (99,7%), hiperemia (99,5%) y hemorragia (96,6%). Por otra parte, la congestión (32,5%) fue lo más frecuentemente observado a nivel renal. De los tres órganos examinados, el hígado es el que presenta lesiones microscópicas más importantes, las cuales son megalocitosis y la presencia de hepatocitos binucleados, ambas propias de un cuadro de hepatotoxicidad, coincidiendo con lo descrito para la acción de alcaloides pirrolizidínicos, como los presentes en las plantas del género Senecio, abundante en praderas del sur de Chile. Por otra parte, se debe destacar que la nefritis intersticial observada, aún cuando fue en escaso porcentaje (0,8%), concuerda con lo descrito para la acción de Encephalitozoon cuniculi, lo que sería de importancia debido a su acción que es una infección zoonotica. De este estudio se puede concluir que debido a la etiología multifactorial y/o ausencia de agentes específicos en las lesiones, no es posible determinar la presencia de enfermedades específicas que afecten a los órganos examinados por medio de este método diagnóstico, siendo necesario el uso de técnicas complementarias para lograr el diagnóstico definitivo, por otra parte a la luz de los resultados obtenidos se deberían realizar estudios a corroborar las sospechas indicadas en el párrafo anterior. Palabras claves: Lepus europaeus, hígado, pulmón, riñón, histopatología. 2 2. SUMMARY ANATOMICAL AND HYSTOPATHOLOGIC ANALYSIS OF LIVER, LUNGS AND KYDNEYS OF EUROPEAN BROWN HARE (Lepus europaeus) IN SOUTHERN CHILE The aim of the present study was to establish the most frequent histopathological findings in liver, lung and kidney of European brown hares (Lepus europaeus Pallas, 1778) in southern Chile, and the possible etiologies for the changes observed in the tissue. Between May and June 2008, samples were received at the Institute of Animal Pathology, Faculty of Veterinary Science, Universidad Austral de Chile, corresponding to 385 hares viscera from different communities in the regions of Los Ríos and Los Lagos, Chile. Samples were collected from the viscera, and stored in plastic containers (50 ml) with 10% formalin for histological hematoxylin/eosin staining and subsequent analysis with light microscope. The main histopathological findings in the liver were binucleated hepatocytes (99.7%), megalocytosis (99.7%), inflammatory disorders (50%) and congestion (45.6%). In the lungs, circulatory disorders were most frequent, including congestion (99.7%), hyperemia (99.5%) and hemorrhage (96.6%). Congestion (32.5%) was frequently observed in the kidneys. From the organs studied, liver presented the most important microscopic lesions. These lesions included megalocytosis and binucleated hepatocytes. These pathological changes are found in hepatotoxicity, similar to the alterations described pyrrolizidine alkaloids action, such as those present in plants of the genus Senecio, abundant in the grasslands of southern Chile. Moreover, it should be noted that interstitial nephritis (0.8%), agrees with changes described for Encephalitozoon cuniculi, which can have a zoonotical potential. In this study we can conclude that due to the multifactorial etiology and/or absence of specific agents in the lesions, it is not possible to determine the presence of specific diseases affecting the organs examined by means of this diagnostic test. Complementary techniques are required to achieve a definitive diagnosis. Further studies will be necessary to corroborate the previous conclusions. Key words: Lepus europaeus, liver, lung, kidney, histopathology. 3 3. INTRODUCCIÓN 3.1 ASPECTOS GENERALES DE LA LIEBRE 3.1.1 Clasificación La liebre marrón europea (Lepus europaeus Pallas, 1778) es un mamífero de tamaño medio perteneciente al orden Lagomorpha de la familia Leporidae. Los Lagomorfos fueron originalmente clasificados como roedores y no fue sino hasta 1912 que este orden fue reconocido oficialmente distinto al orden Rodentia. Anatómicamente, pueden ser diferenciados de los roedores por la presencia de un segundo par de incisivos ubicados directamente detrás de los incisivos frontales superiores. Además poseen la parte del rostro del cráneo alargado y reforzado con una estructura entrecruzada de hueso (fenestraciones), característica única de este orden (Chapman y Flux 1990). 3.1.2 Descripción La liebre marrón europea es un animal grande, con un peso promedio de 3,8 kg, de apariencia uniforme. El pelaje es largo y ondulado en la espalda, con un color rojizo sobre el pecho y a los lados. Por encima el color es más oscuro y por debajo se aprecia el vientre de color blanco. La cola es larga y llamativa, negra en la parte superior y blanca en la parte inferior. Las puntas de las orejas en su cara posterior tienen una gran mancha triangular negra en contraste con el color gris pálido del resto de la oreja (Flux y Angermann 1990). A continuación (tabla 1) se resumen los caracteres más importantes existentes en esta especie (Kötsche y Gottschalk 1974): Tabla 1: Resumen de caracteres de la liebre (adaptado de Kötsche y Gottschalk 1974). Caracteres de la liebre Vive en praderas y llanuras (animal de estepa) Peso: 3,5 – 5,5 kg Insociable, vive en pareja Longitud corporal: 60 – 65 cm Prepara yacijas (camas) al aire libre Longitud de las orejas: 12 – 14 cm Carrera veloz muy prolongada Orejas más largas que la cabeza Gestación: 41-44 días Conformación corporal esbelta Crías nacen con pelo y visión Pelos del dorso: 6 – 7 cm Crías por camada: 1-4 Vello muy marcado Camadas por año: 2-4 Carne roja Crías abandonan pronto el nidal Brazo más corto que antebrazo 4 3.1.3 Distribución geográfica e introducción en Chile La liebre marrón europea es una de las especies mamíferas de más amplia distribución. Su área de extensión original incluía casi toda Europa (excluyendo Escandinavia), Gran Bretaña, Cercano y Medio Oriente, y una gran parte de Asia. En África se extiende desde Etiopía y Sudán del sur hasta la provincia del Cabo. El hombre la introdujo en Escandinavia, las islas Hébridas, Irlanda, Bahamas, sureste de Canadá y noreste de Estados Unidos, Australia y Nueva Zelanda. En América del Sur, la liebre fue introducida en el centro de Argentina y el sur de Chile. En 1888, se importaron 36 liebres desde Alemania y se liberaron en la Provincia de Santa Fé, Argentina. En 1896, las liebres se introdujeron por primera vez desde Alemania en la Provincia de Ultima Esperanza, Magallanes (Grigera y Rapoport 1983). En la actualidad, la liebre europea se encuentra en todo el territorio continental chileno desde el río Copiapó (Región de Atacama) hasta el término del continente, encontrándose las mayores concentraciones en las regiones de Aisén y Magallanes (Jacksic y col 2002). 3.1.4 Hábitat y ecología Un buen hábitat para las liebres marrón europeas es el campo abierto con arbustos dispersos o setos para refugiarse. Son muy adaptables y alcanzan altas densidades en tierras agrícolas mixtas bajo la agricultura intensiva, como en los casos de Dinamarca, Alemania y Polonia. La agricultura mecanizada y el uso excesivo de herbicidas y pesticidas, ha conducido a una disminución en la población de esta especie en Inglaterra y Europa. En el caso de países como Chile, Argentina, Australia y Nueva Zelanda, los hábitats ocupados pueden ser especialmente variables, incluyendo pampas, dunas, pantanos y terrenos montañosos. La dieta de estos animales varía junto con el hábitat: las liebres marrón europeas en tierras agrícolas tienen un consumo de 90% de plantas herbáceas, 5,5% de plantas leñosas, 2,2% de cultivo de raíz, 1,7% cultivo de cereales y 0,5% de plantas forestales. En las zonas montañosas de Nueva Zelanda las liebres comen pasto corto en verano, arbusto y matas de hierbas en invierno (Flux y Angermann 1990). 3.1.5 Comportamiento y reproducción La liebre marrón europea es de hábitos preferentemente nocturnos, pero puede comenzar a alimentarse a media tarde en latitudes más altas y en la temporada de cría. La alimentación toma una tercera parte del tiempo de una liebre (Flux y Angermann 1990). Su época reproductiva se inicia entre julio, agosto o septiembre, dependiendo de la zona, siendo más tardía hacia el sur de Chile, la cual se prolonga por 6 a 7 meses (Manterola 2006). El periodo de gestación normal es de 42 días. El tamaño de la camada aumenta estacionalmente a un máximo y luego disminuye. Al nacer los lebratos pesan aproximadamente 123 g y aumentan alrededor de 19 g. por día hasta los tres meses de edad. Las crías se amamantan una o dos veces al día, generalmente esto acurre al anochecer y solo demora uno pocos minutos. El tamaño adulto se alcanza a los cinco meses de edad y algunos lebratos de nacimiento prematuro pueden reproducirse en el mismo año de su nacimiento (Flux y Angermann 1990). 5 3.2 HISTOLOGÍA DE HÍGADO, PULMÓN Y RIÑÓN A continuación se describe brevemente la histología general de hígado, pulmón y riñón. Esta información es de vital importancia por cuanto proporciona conocimientos de los órganos que serán utilizados en este estudio. 3.2.1 Hígado El hígado es una gran glándula lobulada rodeada por una cápsula delgada de tejido conectivo (cápsula de Glisson) y un mesotelio. La liebre marrón europea posee cuatro lóbulos, cada uno está dividido en numerosos lobulillos clásicos constituidos por sinusoides y placas de células parenquimatosas, los hepatocitos. Estos últimos se organizan radialmente alrededor de una vena central (Bacha y Wood 1991a). Los hepatocitos se caracterizan además por un núcleo esférico de ubicación central con uno o más nucléolos prominentes y grupos dispersos de heterocromatina. Ocasionalmente, se observan células binucleadas (Frappier 2006). Las áreas donde se reúnen tres o más lobulillos se denominan espacios portales, cada uno de los cuales contiene una o más ramas de la vena porta y de la arteria hepática y uno o más conductillos biliares y vasos linfáticos. Estos componentes están sostenidos por una trama de tejido conectivo. La bilis secretada por los hepatocitos circula por los diminutos canalículos biliares hacia los canales de Hering localizados cerca de cada espacio portal. Los canales se unen con el conductillo biliar que discurre por un espacio porta. Los conductillos biliares se unen para formar conductos mayores que finalmente forman el conducto biliar. El epitelio de los conductillos biliares es cúbico simple mientras que el conducto biliar es cilíndrico simple (Bacha y Wood 1991a). 3.2.2 Pulmón Los pulmones están cubiertos por la hoja visceral de la pleura, formada por tejido conectivo y algunas fibras musculares lisas. Los pulmones contienen una trama conectiva rica en fibras elásticas que sostienen al árbol bronquial y divide a los pulmones en lóbulos y lobulillos. Los bronquios están revestidos por un epitelio cilíndrico pseudoestratificado ciliado con células caliciformes. Sus células disminuyen de altura a medida que se reduce el calibre del bronquio. La lámina propia está rodeada por una capa de musculo liso cuyas fibras se orientan en sentido oblicuo y el tejido conectivo que rodea la muscular presenta glándulas mixtas y placas de cartílago hialino (Bacha y Wood 1991b). Los bronquios más pequeños dan origen a los bronquiolos y los bronquiolos más pequeños (bronquiolos terminales) se ramifican en dos o más bronquiolos respiratorios, estos últimos a su vez originan sucesivamente a los conductos y sacos alveolares. Los bronquiolos carecen de cartílago y glándula. Por fuera de la mucosa se encuentra la capa muscular de tejido muscular liso cuyas células tienen una orientación oblicua o espiral, la cantidad de este tejido es proporcional al tamaño del bronquiolo. La mucosa de los bronquiolos mayores (bronquiolo propiamente dicho) está revestida por células cilíndricas ciliadas mientras que en 6 los más pequeños las células son cuboides ciliadas y en las porciones más distales el epitelio es cúbico ciliado (Bacha y Wood 1991b). Los bronquiolos respiratorios están tapizados por un epitelio de células cubicas que se vuelven planas hacia distal, escasas fibras musculares lisas forman parte de la pared bronquial que se encuentra interrumpida por la apertura de los alveolos. Los conductos alveolares se originan de los bronquiolos respiratorios y sus paredes delgadas están constituidas por alvéolos, en el punto donde un alveolo se abre en un conducto existen fibras musculares lisas (Bacha y Wood 1991b). Cada conducto alveolar se ramifica para originar tres o más sacos alveolares, no se observan fibras musculares lisas en los sacos. Los alveolos están separados entre sí por una delgada capa delicada de fibras colágenas y elásticas muy vascularizada. Esta capa, junto con el revestimiento epitelial de los alveolos adyacentes, forman el tabique interalveolar (Bacha y Wood 1991b). El epitelio de los sacos alveolares y alvéolos está compuesto por dos tipos de células: neumocitos tipo I, que forman gran parte del revestimiento del alvéolo y saco alveolar, y neumocitos tipo II, células que elaboran surfactante, fosfolipido que disminuye la tensión superficial (Gartner y Hiatt 1998). 3.2.3 Riñón Los riñones son órganos pares muy vascularizados que mantienen constante la composición de los líquidos corporales y excretan los desechos metabólicos. Los riñones están rodeados por una cápsula de tejido conectivo. Tanto la corteza como la medula renal están compuestas por túbulos urinarios densamente agrupados y los espacios entre estos túbulos están ocupados principalmente por una extensa red capilar (Bacha y Wood 1991c). En la corteza los túbulos colectores y la porción recta de los nefrones forman los rayos medulares (pars radiata). El laberinto cortical (pars convulata) se localiza entre los rayos y está representado por los corpúsculos renales y numerosos túbulos contorneados proximales y distales. Los túbulos contorneados proximales son más largos que los túbulos contorneados distales y constituyen la mayor parte del tejido cortical. Los túbulos proximales se caracterizan porque las células epiteliales que lo revisten poseen ribete en cepillo. En el borde apical de los túbulos contorneados distales las células carecen de ribete en cepillo (Bacha y Wood 1991c). La médula del riñón está constituida por los túbulos colectores, los segmentos gruesos y delgados de las asas de Henle y por numerosos vasos rectos. Las porciones gruesas descendentes son continuaciones de los túbulos contorneados proximales y se localizan cerca de la unión cortico medular. Son túbulos rectos cuyas células poseen ribete en cepillo. La porción gruesa descendente se continúa abruptamente con el segmento delgado cuya pared está formada por células planas con núcleos fusiformes protruyentes. La porción gruesa ascendente recuerda su estructura al túbulo contorneado distal con el que se continúa. El filtrado de los nefrones pasa a los túbulos colectores que se abren, directa o indirectamente, vía cálices en la pelvis renal. La parte terminal de los túbulos colectores se fusiona con su homologo a nivel de la papila renal para formar los conductos papilares. Las células epiteliales 7 que revisten los túbulos colectores son pálidas, cúbicas cerca de los túbulos distales y cilíndricas cerca de la papila. La porción terminal de estos túbulos, el conducto papilar, esta tapizada por un epitelio cilíndrico simple o pseudoestratificado (Bacha y Wood 1991c). 3.3 ENFERMEDADES INFECCIOSAS Y PARÁSITOS La densidad de la población de la liebre marrón europea varía a causa de factores externos, como los abióticos (clima), bióticos (disponibilidad de alimentos, enfermedades, predadores, etc.), antropogénicos y factores internos (tasa reproductiva, habilidad para la adaptación, etc.). Las enfermedades infecciosas y los parásitos sin duda son los factores bióticos de mayor importancia que influyen en la población de liebres (Treml y col 2007). Es por esto que además la liebre silvestre, puede constituir una amenaza debido a la capacidad de actuar como portador, hospedador intermediario y reservorio de infecciones de importancia para animales domésticos y el hombre (González-Acuña y col 2005). A continuación se describen enfermedades de la liebre causantes de alteraciones en hígado, pulmón y riñón (órganos de interés en esta investigación). 3.3.1 Enfermedades Virales 3.3.1.1 Síndrome de la liebre marrón Europea (EBHS): enfermedad producida por un calicivirus perteneciente al género Lagovirus. Ésta se caracteriza por ser de rápida progresión, leve sintomatología nerviosa, severa hepatitis necrótica y disfunción circulatoria en varios órganos. Entre las lesiones macroscópicas encontradas en las liebres se destacan: edema, congestión, extensas hemorragias en pulmón, y severa congestión de la mucosa traqueal. El bazo se observa aumentado de tamaño de un color rojo-negruzco y los riñones congestivos. El hígado generalmente se encuentra aumentado de volumen, decolorado y friable (Billins y col 2005). El diagnóstico histopatológico del síndrome se realiza en base a las lesiones del hígado, consideradas propias de la enfermedad. Estas incluyen necrosis de coagulación en los hepatocitos periportales con focos de lisis hepatocelular, cuerpos acidófilos, acumulación granular de calcio en los hepatocitos y escasa presencia de infiltrado inflamatorio (GavierWidén y Mörner 1993). Puede ocurrir una infección oral o nasal, sin embargo, la ruta oro-fecal es la más importante. Los rangos de morbilidad y mortalidad son extremadamente altos con una susceptibilidad preferencial por los animales adultos, mientras que los animales menores de 40 días permanecen sin ser afectados (Wibbelt y Frölich 2005). 3.3.2 Enfermedades Bacterianas 3.3.2.1 Estafilococosis: Staphylococcus aureus está ampliamente distribuido en el ambiente y se encuentra a menudo en piel y mucosas de individuos sanos (Wibbelt y Frölich 2005). Estos pueden ser ingeridos con alimentos contaminados, aunque más importante resulta el contagio por vía cutánea, en cuyo caso penetran las bacterias bien por picaduras de insectos (en especial de pulgas) o bien a través de heridas por mordeduras o arañazos. De aquí que la enfermedad sea mucho más frecuente en los machos, por las luchas que sostienen entre sí (Kötsche y Gottschalk 1974). En liebres se sabe que causa múltiples abscesos subcutáneos de tamaño 8 variable, los cuales también pueden afectar a órganos internos y articulaciones (Wibbelt y Frölich 2005). 3.3.2.2 Pasteurelosis: el agente infeccioso es Pasteurella multocida subsp. multocida, un cocobacilo Gram negativo, no formador de espora. Flora normal de las vías respiratorias superiores de la mayoría de los animales (Wibbelt y Frölich 2005), cuya virulencia se ve exaltada al debilitarse la resistencia de los animales. Esta enfermedad es particularmente frecuente en los periodos de invierno y primavera, sobre todo cuando perdura el tiempo frio y húmedo. La infección se produce bien por multiplicación de las pasterelas situadas en el tracto respiratorio e irrupción de las mismas en el torrente sanguíneo, bien por ingestión oral del agente causal eliminado por animales enfermos y que contamina los pastos (Kötsche y Gottschalk 1974). En el caso de que la enfermedad curse de forma sobreaguda la muerte se producirá en un lapso de 12 a 48 horas. El curso subagudo es poco frecuente y los animales mueren después de días o semanas. Las lesiones histológicas producidas si se presenta una septicemia son una laringotraqueitis hemorrágica, sangrado subseroso petequial e inflamación de hígado y bazo. En la forma subaguda de la enfermedad las alteraciones son más pronunciadas y se caracterizan principalmente por una extensa bronconeumonía purulenta, pleuritis fibrinógena y pericarditis (Frölich y col 2001). 3.3.2.3 Pseudotuberculosis: es conocida como una típica enfermedad de lagomorfos y roedores, además puede afectar a aves y otros animales como también al hombre, destacando como una potencial zoonosis. El agente causal es Yersinia pseudotuberculosis (Wilbbelt y Frölich 2005). Es una infección factorial que en las liebres se presenta con preferencia desde finales de otoño hasta la primavera (Kötsche y Gottschalk 1974). El cuadro puede ser de curso agudo caracterizándose por una fulminante septicemia, llevando a la muerte en uno a tres días con una congestión intestinal como única lesión. La forma subaguda y la crónica se caracterizan por pérdida de peso durante un periodo de días a semanas, decaimiento, severa diarrea, distrés respiratorio, debilidad muscular e incoordinación (Mair 1973). Las lesiones típicas son áreas de necrosis caseosa multifocal dentro de bazo, hígado, intestino y nódulos linfáticos mesentéricos. La Pseudotuberculosis es una de las infecciones más importantes y letales en las liebres con pérdidas en la población por sobre el 50% (Wibbelt y Frölich 2005). 3.3.3 Enfermedades Parasitarias 3.3.3.1 Coccidiosis: las liebres son particularmente susceptibles a las infecciones coccidiales. Varios tipos de Eimeria han sido reportados en esta especie, de los cuales Eimeria stiedae es la que provoca las lesiones a nivel hepático. La transmisión ocurre a través de la ingesta de oocitos eliminados en las heces de los animales enfermos. Alrededor de 60 a 100% de los individuos de una población pueden estar infectados con coccidia (Wibbelt y Frölich 2005). Los síntomas clínicos generales de esta enfermedad son disminución del consumo de alimento, diarrea o constipación, aumento del tamaño del hígado, ascitis, ictericia, distensión abdominal y finalmente la muerte (Yücel y col 2008). Las lesiones macroscópicas típicas son hepatomegalia con múltiples y dispersos focos circunscritos (0,5 – 2 mm) de coloración amarilla gris. Histopatológicamente las lesiones están limitadas principalmente al hígado, 9 donde se produce hiperplasia e hipertrofia del epitelio de los conductos biliares con diferentes estadios de formación de E. stiedae (Singla y col 2000). 3.3.3.2 Toxoplasmosis: el agente causal de esta enfermedad es el Toxoplasma gondii, el cual es frecuentemente encontrado en la población de liebres y conduce a una enfermedad grave y mortal en la mayoría de los casos. La transmisión se produce generalmente por ingestión de alimentos o aguas contaminadas con ooquistes provenientes de heces de gatos. En las zonas donde es endémica la toxoplasmosis, las lesiones predominantes son neumonía intersticial, áreas de necrosis hepatocelular multifocal, encefalitis y necrosis moderada de los folículos linfoides de los nódulos linfáticos (Frölich y col 2003). 3.3.3.3 Trematodos: una infección con trematodos está limitada a zonas donde se encuentre el hospedador intermediario. Tanto Fasciola hepatica como Dicocroelium dendriticum se han encontrado en liebres (Wibbelt y Frölich 2005). La migración de las larvas de F. hepatica produce la destrucción de los hepatocitos dejando rastros de sangre, fìbrina y detritus celulares. La infiltración celular del hígado esta compuesta principalmente por neutrófilos, eosinófilos y linfocitos. En las lesiones crónicas el número de macrófagos, células epiteloides y células gigantes multinucleadas comienza a aumentar, particularmente alrededor de la larva muerta. Además, en las paredes de los conductos biliares hay infiltrado eosinofilico, linfocitos y macrófagos, la cual eventualmente se vuelve más gruesa por proliferación fibroblástica (Jones y col 1997a). En el caso de Dicocroelium dendriticum existe inflamación crónica de los conductos biliares con marcada proliferación del tejido conectivo. El lumen de los conductos biliares se encuentra distendido, las paredes son más gruesas y existe proliferación en la mucosa. Junto con esto las paredes de los conductos biliares muestran hiperplasia glandular y descamación superficial (Duchácek y Lamka 2003). 3.3.3.4 Nematodos: Las investigaciones sugieren que la ocurrencia de Protostrongylus commutatus en pulmones de liebres provoca un 42 – 60 % de infección dentro de una población (Wibbelt y Frölich 2005). Las infestaciones leves por vermes pulmonares transcurren en los lepóridos casi sin síntomas o siendo estos muy atenuados. Por el contrario, las infestaciones abundantes provocan graves alteraciones del estado general, observándose dificultades respiratorias, tos y frecuentes estornudos con flujo nasal viscoso claro. Los animales jóvenes y desmedrados enfermos de protostrongilosis mueren de debilidad y enflaquecimiento progresivo, especialmente en épocas de escasez de alimento (Kötsche y Gottschalk 1974). Histológicamente se caracteriza por una neumonía intersticial no purulenta. En adición, se observan cambios proliferativos del epitelio bronquiolar y neumocitos tipo II. Otro hallazgo microscópico importante es una marcada hiperplasia de lo nódulos linfáticos tanto perivasculares como interalveolares. Estos contienen predominantemente células linfoides con abundante o escasos eosinófilos. Los alvéolos adyacentes a las lesiones nodulares se encuentran a menudo afectados por enfisema (Battisti y col 2000). A la luz de los antecedentes entregados anteriormente, resulta interesante realizar un estudio detallado de las lesiones presentes en hígado, pulmón y riñón de las liebres silvestres, ya que hasta la fecha en Chile no existen trabajos que indiquen las alteraciones microscópicas que presentan dichos órganos. 10 3.4 OBJETIVOS 3.4.1 General: Realizar un análisis histopatológico de muestras de hígado, pulmón y riñón de liebre marrón europea en el sur de Chile, logrando así establecer las alteraciones de mayor frecuencia presentes en estos animales. 3.4.2 Específicos: Determinar y cuantificar los hallazgos histopatológicos en los órganos analizados de liebres. Establecer posibles causas responsables de las alteraciones histopatológicas encontradas en los tejidos. Identificar las enfermedades anteriormente descritas a través de los hallazgos encontrados en las muestras observadas. 11 4. MATERIAL Y MÉTODOS 4.1 MATERIAL 4.1.1 Material biológico Se utilizaron muestras de tejido de 385 liebres provenientes de cacerías realizadas en diferentes comunas de las Regiones de Los Ríos y Los Lagos, Chile, entre los meses de mayo y junio de 2008. Posteriormente al haber sido cazadas, las liebres fueron trasladadas hasta el centro de acopio de la empresa Comercial Mac-Lean y Cía. Ltda. de Puerto Natales (empresa privada dedicada a la exportación de carne), ubicada en la comuna de Río Bueno, Chile. En este lugar fueron obtenidas y recolectadas las vísceras, las cuales fueron transportadas en contenedores estériles para su posterior análisis bacteriológico y examen histopatológico en laboratorio como parte de otra investigación. 4.1.2 Manejo de muestras La recolección de muestras se realizó una vez por semana, desde las instalaciones del centro de acopio de liebres de Comercial Mac-Lean y Cía. Ltda. de Puerto Natales, lugar en donde las liebres fueron evisceradas. Las vísceras recolectadas fueron llevadas de inmediato al Pabellón de Necropsia del Instituto de Patología Animal de la Facultad de Ciencias Veterinarias, Universidad Austral de Chile, donde se procedió al examen anatomopatológico de vísceras y obtención de muestras de apéndice cecal, corazón, hígado, íleon, nódulos linfáticos mesentéricos, pulmón y riñón. Estas muestras fueron depositadas en frascos plásticos (50 ml) con formalina al 10%, los cuales fueron trasladados al Laboratorio de Anatomía Patológica Veterinaria del Instituto de Patología Animal para su procesamiento y posterior análisis histopatológico. 4.2 MÉTODOS Las muestras una vez obtenidas fueron rotuladas y registradas con un código asignado por el Laboratorio de Anatomía Patológica Veterinaria. De estas muestras, se obtuvieron cortes, los cuales fueron procesados en autotécnico, deshidratadas y embebidas en parafina, siendo cortados con micrótomo, para después ser teñidos con hematoxilina/eosina (H-E) con el objetivo de ser analizados con microscopio óptico (Olympus CX21) para realizar examen histopatológico de hígado, pulmón y riñón. En aquellas muestras que presentaron alteraciones microscópicas se les realizó una descripción histopatológica. La magnitud de cada una de estas lesiones fue cuantificada en forma semicuantitativa de acuerdo a una escala de graduación de severidad de los hallazgos, adaptando para este estudio la escala descrita por Díaz (2002) (Tabla 2). 12 Tabla 2: Grado asignado según severidad de la lesión (Díaz, 2002) Grado + ++ +++ Severidad Ausente, nulo Leve, escaso, pequeño Moderado, mediano Marcado, severo, grande Se excluyeron de este procedimiento las muestras con los códigos 586-08, 594-08, 859-08 para hígado y 567-08, 568-08, 592-08, 791-08, 792-08, 950-08 para riñón, por no encontrarse secciones de dichos órganos para su posterior procesamiento y análisis. Todas las muestras que presentaron lesiones granulomatosas fueron teñidas con la tinción de Ziehl-Neelsen y posteriormente examinadas al microscopio óptico, con el objetivo de determinar la presencia bacterias ácido/alcohol resistentes. 4.3 ANÁLISIS DE DATOS Se utilizó estadística descriptiva, determinando las cantidades y porcentajes para cada tipo y severidad de las lesiones encontradas en los hallazgos microscópicos. 13 5 RESULTADOS 5.1 EXAMEN HISTOPATOLÓGICO 5.1.1 Hígado En la tabla 3 se presentan los hallazgos histopatológicos más relevantes encontrados en los cortes de muestras de hígado de liebres. Tabla 3: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas. Hallazgo Congestión Edema Fibrosis periportal Granulomas Necrosis Tumefacción turbia Focos inflamatorios Grado + 94 0 4 0 5 0 173 Grado ++ 59 1 3 1 2 0 18 Grado +++ 21 3 1 1 0 53 0 Total 174 4 8 2 7 53 191 A nivel hepático se observaron dos tipos de trastornos circulatorios, los cuales fueron congestión y edema. La congestión fue el segundo hallazgo de mayor presentación observándose en el 45,6 % de las muestras, mientras que el edema solo en el 1,1% de estas. Fibrosis periportal (Figura 1) se observó en el 2,1% de los casos siendo leve 1,1%, moderado en el 0,7% y severo en el 0,3%. La presencia de granulomas (Figura 2) en el parénquima de las muestras de hígados fue de un 0,5%, siendo moderado y severo en el 0,25% de los casos. Estás muestras fueron teñidas con la tinción Ziehl-Neelsen, resultando negativas a bacterias ácido/alcohol resistentes. Necrosis celulares (Figura 1) se observaron en el 1,8% de los casos, siendo en su totalidad necrosis de coagulación periportal (Anexo 1). El único trastorno del metabolismo celular observado en las muestras de hígado fue la tumefacción turbia presentándose en el 13,9% de los casos. Focos inflamatorios fueron el hallazgo de mayor presentación en el hígado observándose en el 50% de los casos siendo principalmente leve en el 45,3% y moderado en el 4,7%. Cabe destacar que el mayor porcentaje corresponde a múltiples focos inflamatorios de carácter leve cuyo principal componente son células mononucleares (Anexo 1). 14 Figura 1: Hígado. Fibrosis periportal con leve infiltrado inflamatorio (A) y necrosis de coagulación periportal (B). H-E. (10x). Figura 2: Hígado. Granuloma. En el centro del granuloma se observa un foco de necrosis de coagulación (A) rodeado por infiltrado inflamatorio, compuesto principalmente por células mononucleares (B). H-E. (10x) 15 Tabla 4: Alteraciones del núcleo de los hepatocitos de los hígados de las 382 liebres muestreadas. Hallazgo Binucleados + ++ +++ Muestras Positivas % 5 102 274 1,3 26,7 71,7 Total Megalocitosis + ++ +++ 381 99,7 261 111 7 68,3 29,1 1,8 Total 379 99,2 El 99,7% de los hígados observados presentó a nivel de los hepatocitos 2 núcleos (Figura 3), siendo principalmente de carácter severo en el 71,7%, moderado en el 26,7% y leve en el 1,3% de las muestras. Megalocitosis (Figura 3) de los núcleos de los hepatocitos se presentó en el 99,2% de las muestras siendo leve en el 68,3%, moderado en el 29,1% y severo en el 1,8% de los casos. Figura 3: Hígado. Hepatocitos binucleados (A) y megalocitosis (B). H-E. (40x). 16 5.1.2 Pulmón Tabla 5: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas. Hallazgo Congestión Granulomas Hemorragia con presencia de hemosiderina Hiperemia Hiperplasia linfoide Grado + 2 4 Grado ++ 10 0 Grado +++ 372 0 Total 384 4 96 144 132 372 13 31 46 29 324 9 383 69 A nivel pulmonar los hallazgos histopatológicos más observados fueron los trastornos circulatorios (Figura 4), siendo de mayor a menor: congestión en el 99,7%, hiperemia en el 99,5% y hemorragia con presencia de hemosiderina en el 96,6% de los casos. En la congestión e hiperemia el grado de severidad con mayor porcentaje de presentación fue el de carácter severo con un 96,6% para el primero y un 84,2% para el segundo. En el caso de la hemorragia con presencia de hemosiderina (Figura 5) los grados de severidad con más alto porcentaje de presentación fueron moderado en el 37,7% y severo en el 34,3% de los casos. Granulomas (Figura 4) se observaron en el 1% de las muestras del parénquima pulmonar, los cuales se caracterizaron por ser en su totalidad de carácter leve. . Estás muestras fueron teñidas con la tinción Ziehl-Neelsen, resultando negativas a bacterias ácido/alcohol resistentes. Hiperplasia linfoide (Figura 5) se observó en el 17,9% de las muestras siendo leve en el 8,1%, moderado en el 7,5% y severo en el 2,3% de los casos, principalmente de ubicación peribronquiolar (Anexo 2). 17 Figura 4: Parénquima pulmonar. Granuloma (A), congestión (B), hiperemia (C) y hemorragia con hemosiderina (D). H-E. (10x). Figura 5: Pulmón. Bronquiolo propiamente dicho. Hiperplasia linfoide (A) y hemorragias con hemosiderina (B). H-E. (10x). 18 5.1.3 Riñón Tabla 7: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas. Hallazgo Congestión Glomerulonefritis Membranosa Infarto renal Mineralización Tubular Nefritis Intersticial Grado + 66 0 0 0 1 Grado ++ 43 2 0 0 2 Grado +++ 14 1 1 1 0 Total 123 3 1 1 3 A nivel renal el hallazgo histopatológico más observado fue la congestión la cual se presento en el 32,5% de las muestras siendo leve en el 17,4%, moderado en el 11,4% y severo en el 3,7% de los casos (Anexo 3). Glomerulonefritis membranosa (Figura 6) se observó en el 0,8% de las muestras siendo moderado en el 0,5% y severo en el 0,3% de los casos, caracterizándose por el engrosamiento de la membrana basal del glomérulo adhiriéndose a la cápsula de Bowman y disminución del número de podocitos. Infarto renal (Figura 7) se presentó en el 0,3% de las muestras siendo de carácter severo, observándose, desde corteza a médula renal, áreas de tejido fibroso infiltradas levemente por células inflamatorias mononucleares. Mineralización tubular (Figura 8) se presentó en el 0,3% de las muestras siendo de carácter severo, observándose junto con este hallazgo histopatológico una necrosis de coagulación a nivel medular con infiltrado inflamatorio de células mononucleares. Nefritis intersticial se observó en 0,8% de las muestras siendo leve en el 0,3% y moderado en el 0,5% de los casos, presentándose tanto en forma de focos como de infiltrado de células mononucleares. 19 Figura 6: Riñón. Glomerulonefritis membranosa. Glomérulo (A), membrana basal del glomérulo (B), capa parietal de la capsula de Bowman (C) y núcleos de células mesangiales (D). H-E. (40x). Figura 7: Riñón. Infarto renal. Tejido fibroso con leve infiltrado de células mononucleares (A). H-E. (4x). 20 Figura 8: Médula renal. Mineralización tubular (A). Necrosis de coagulación (B) e infiltrado inflamatorio mononuclear (C). H-E. (4x). Figura 9: Riñón. Nefritis intersticial. Se observa infiltrado de células mononucleares en la zona cortical (A). H-E. (10x). 21 6. DISCUSIÓN 6.1 HÍGADO El 45,6% de los hígados presentó algún grado de congestión, predominando las de carácter leve (54%) y moderado (34%) afectando principalmente venas centrales y sinusoides, en algunos casos produciendo la distención de estos. La congestión pasiva puede ser aguda o crónica, y la apariencia del hígado difiere según la duración y severidad de la congestión. Esta puede ocurrir en cualquier especie y casi siempre a causa de una disfunción cardiaca (Cullen y MacLachlan 2001). Debido a lo inespecífico de este tipo de hallazgo y que la liebres fueron cazadas desencadenando posiblemente en algunos casos esta alteración, desde el punto de vista de diagnóstico histopatológico no tendría ninguna relevancia. En dos muestras de hígado (0,5%) se encontraron lesiones granulomatosas en diferentes grados. En ambos casos con presencia de células gigantes, linfocitos, macrófagos y predominio de eosinófilos. Esta lesiones son similares a las causadas por Fasciola hepatica cuando realiza la migración por la superficie del hígado, la infiltración celular producida por este daño está compuesta principalmente de eosinófilos, macrófagos y linfocitos, acompañada por el desarrollo de folículos linfoides (Flynn y col 2010). Sin embargo, en este estudio no se pudo determinar que la etiología correspondiera a la acción de parásitos, por otra parte, el mismo tipo de lesión fue reportado por Frölich y col (2003) sin que tampoco pudieran determinar la presencia de estos a través del examen histológico. En el 1,8% de las muestras se observó la presencia de necrosis de coagulación periportal. En este tipo de lesión la arquitectura normal del tejido con sus componentes celulares es aún reconocible, pero el núcleo y el citoplasma exhiben cambios característicos, tales como núcleos picnoticos o ausentes y el citoplasma a menudo fuertemente acidófilo. Las causas que tienden a producir este tipo de lesión son: isquemia local, tóxicos producidos por algunas bacterias y venenos de acción local entre otros (Jones y col 1997b). Estas necrosis no tienen ningún significado específico, ya que se pueden observar en diferentes condiciones tales como la pasteurelosis, salmonelosis, listeriosis, colibacilosis, tularemia, tuberculosis, toxoplasmosis y clamidiosis. En enfermedades infecciosas las necrosis están acompañadas usualmente por una reacción celular inflamatoria (Marcato y Rosmini 1986a). En este estudio 3 de las 7 muestras presentaron necrosis con reacción inflamatoria. Para los hallazgos de tumefacción turbia (13,9%) y megalocitosis se podría establecer un agente etiológico en común. En el primer caso este tipo de degeneración celular se produce en cuadros tóxicos o infecciosos agudos (Gázquez 1991). En el caso de la megalocitosis se presentan sobre todo en las intoxicaciones exógenas, producidas por ejemplo, por alcaloides pirrolizidínicos presentes en algunos vegetales o hidrocarburos clorados como el dieldrín (Marcato y Rosmini 1986a). Estos alcaloides se encuentran en muchas familias de plantas, incluyendo, Compositae, Leguminosae y Borgaginaceae, que se producen a lo largo de gran 22 parte del mundo (Cullen y MacLachlan 2001). Dentro de estas familias se encuentra el género Senecio, del cual en Chile se han descrito alrededor de 300 especies, pero solo Senecio erraticus ha sido reportado como tóxico para bovinos y caballos. Esta especie se encuentra ampliamente distribuida en el sur del país (Araya 2009), cuyo consumo por parte de las liebres marrón europeas puede ser el causante de estas alteraciones. Según Vinogradov y col (2001) el porcentaje habitual de distribución de hepatocitos binucleados encontrados en Lepus europaeus es de un 26,3%, lo cual se relaciona con la tasa metabólica basal de la especie. Esto coincide con los grados leve y moderado determinados en este estudio, encontrándose dentro del rango estimado por estos autores. La marcada proliferación de hepatocitos binucleados observadas en un alto porcentaje de las muestras, es producto de un aumento de la tasa metabólica inducida por la acción detoxificadora del hígado. Estas dos variables (aparición de hepatocitos binucleados y tasa metabólica) se correlacionan positivamente (Vinogradov y col 2001). De lo anterior se podría deducir que el aumento de la tasa metabólica del hígado estaría relacionado con las noxas que provocan la formación de la megalocitosis y tumefacción turbia, probablemente por consumo de S. erraticus. La presencia de fibrosis periportal (2,1%), probablemente también se encuentre ligada al consumo de esta especie vegetal, debido a que otras consecuencias de la hepatotoxicidad de los alcaloides pirrolizidínicos son fibrosis progresiva, proliferación de conductos biliares, veno-oclusión y pérdida de las funciones metabólicas del hígado (Araya 2009). El hallazgo de focos inflamatorios crónicos (50,3%) en las muestras no es de relevancia en el presente estudio, debido a que se trata de lesiones leves y poco especificas que no permiten interpretación en el diagnostico histopatológico. De esta misma forma fueron interpretadas este tipo de lesiones en un estudio realizado por Frölich y col (2003). 6.2 PULMÓN En el 99,7% y 99,5% de las liebres se observó congestión e hiperemia respectivamente. La hiperemia es un proceso activo que forma parte de la inflamación aguda, mientras que la congestión es el proceso pasivo resultante de la disminución del flujo sanguíneo venoso, como ocurre en la insuficiencia cardiaca congestiva. La ausencia de infiltrado inflamatorio en el parénquima alveolar en la mayoría de las muestras, sugiere que la hiperemia es originada principalmente como resultado de una actividad fisiológica más que una causa patológica, ya que las liebres fueron cazadas posiblemente en movimiento produciendo el aumento de la presión arterial pulmonar originada por la actividad física. Con respecto a la congestión, esta es frecuentemente causada por una falla cardiaca izquierda, la cual produce un estancamiento de sangre en las venas pulmonares desencadenando edema y salida de eritrocitos al espacio alveolar, los que rápidamente son fagocitados por los macrófagos pulmonares. En el caso de que esta extravasación de sangre sea severa, el citoplasma de estos macrófagos se observa de color café debido a la acumulación de hemosiderina, denominándose como “células cardiacas” (López 2001). La ausencia de este tipo de células en las muestras permite inferir que las 23 causas de congestión son otras, tales como la producida por la gravedad post mortem (congestión hipostática) o a la irrigación sanguínea del órgano al momento de la muerte del animal, la cual fue desencadenada por la actividad fisiológica previa. El 96,6% de las muestras presentó hemorragias, las cuales son principalmente moderadas y severas. Las causas de hemorragias pulmonares más frecuentes son diátesis hemorrágica, septicemias, coagulación intravascular diseminada y congestión severa (Caswell y Willliams 2007). Como estas muestras presentaron paralelamente congestión/hiperemia en un porcentaje similar permite confirmar lo señalado por López (2001), para quien la congestión seria un factor predisponente a hemorragias, situación que coincide con el presente estudio. A nivel del parénquima pulmonar se observó presencia de granulomas aislados (1%) los cuales presentaron características similares a los producidos por Mycobacterium bovis en las liebres. Están formados por acúmulos de células gigantes y linfocitos, sin necrosis (Marcato y Rosmini 1986b). Sin embargo, al realizar la tinción de Ziehl-Neelsen a estas muestras, no fue posible encontrar bacterias ácido alcohol resistentes. Además, la ausencia de eosinófilos en estas lesiones permite descartar que estas fueran producidas por migración parasitaria (Ringler 1997). La presencia de hiperplasia linfoide peribronquial y peribronquiolar fue de escasa presentación (17,9%), estas al igual que los focos inflamatorios a nivel hepático son consideradas de carácter inespecíficos, debido a que son de etiología multifactorial, solo hay de uno a 2 focos por muestra y en su mayoría de carácter leve siendo de poco utilidad en la interpretación del diagnostico histopatológico. 6.3 RIÑÓN La congestión renal fue observada en el 32,5% de los casos, siendo principalmente leve. Esta puede ser originada por causas fisiológicas, activas, pasivas o hipostáticas (Confer y Panciera 2001). La congestión se hace más evidente a nivel medular donde los capilares corren en grupos produciendo líneas rojas radiales, las que a menudo son visibles a la necropsia (Jones y col 1997c). En este caso al igual que las congestiones a nivel de los demás órganos estudiados, se sospecha que son de origen fisiológico o posiblemente hipostático en algunos casos. Las glomerulonefritis observada en las muestras presentan engrosamiento de la membrana basal con adhesión a la capsula de Bowman y pérdida de podocitos (células epiteliales) de los glomérulos. Estos cambios morfológicos son los que identifican a una glomerulonefritis membranosa (Jones y col 1997c), y debido a que afecta a todo el glomérulo es difusa (Maxie y Newman 2007). En cuanto a la patogenia de la glomerulonefritis, esta puede ser consecuencia de embolias sépticas o ser inmune mediada. En el primer caso émbolos bacterianos se alojan en los capilares glomerulares donde se produce necrosis lobulillar con depósitos de fibrina e infiltración de leucocitos en los glomérulos (Marcato y 24 Rosmini 1986c). En el segundo caso, dos mecanismos inmunológicos han sido identificados a) anticuerpos reaccionan con antígenos de la membrana basal glomerular y b) los anticuerpos reaccionan con antígenos no glomerulares en la circulación, formándose complejos inmunes que se depositan en el glomérulo (Slauson y Lewis 1979). Se encontraron 2 infartos renales en una sola muestra, esto representa una alteración de importancia, ya que son áreas de necrosis coagulativa como resultado de isquemia o una oclusión vascular debido a una trombosis o a un émbolo (Confer y Panceira 2001). Estos ya se encontraban en estado de reparación y es por eso que se describen como crónicos coincidiendo con lo indicado por Jones y col (1997c), en que hay desaparición del tejido parenquimatoso a excepción de algunos glomérulos atróficos y renovación parcial del tejido por una cicatriz estrecha de tejido fibrinoso blanco. Tres muestras presentaron nefritis intersticial de carácter focal, estando el infiltrado predominante constituido por linfocitos y macrófagos. Esta es la inflamación renal más común en los conejos, pudiendo ser de carácter primario: encephalitozoonosis, infección zoonotica propia de lepóridos producida por protozoos de la familia Microspora, la cual está diagnosticada en conejos en Chile (Marchant y col 2007) y leptospirosis. Asimismo de forma secundaria, a varias alteraciones renales (causadas por cálculos) o enfermedades extra renales tales como enteritis, bronconeumonía, mastitis y metritis. Patogenéticamente la nefritis intersticial se desarrolla a partir de las lesiones tubulares o factores hematogenos (infecciosa o inmunológica). Debido a las características del infiltrado encontrado esta es de carácter agudo o subagudo (Marcato y Rosmini 1986c). A nivel de la médula renal se observó un caso de mineralización tubular acompañada de un área de necrosis de coagulación. Esta es una calcificación patológica la que consiste en depósito de sales de calcio en otros tejidos distintos de huesos y dientes. Posee tres formas de presentación de las cuales la que más se asemeja con la lesión observada es la calcificación distrófica, debido a que la presencia de tejido muerto o en degeneración es la causa fundamental de la deposición de sales de calcio y esta no se encuentra relacionado con el incremento de este mineral en la sangre. Su significancia está en que son relativamente permanentes interfiriendo mecánicamente con la función o pérdida de la fuerza del tejido renal. La calcificación ha sido listada como una de las vías por la cual el cuerpo dispone del tejido muerto, ya que el material calcificado es funcionalmente inerte (Jones y col 1997c). Por otro lado la causa de la muerte del tejido renal fue originada por una nefrosis, la cual es la forma en que las células epiteliales tubulares responden a una prolongada isquemia o nefrotoxinas sometiéndose primero a una degeneración, seguida por una necrosis y descamación de las células en el lumen tubular (Confer y Panciera 2001). 25 6.4 CONCLUSIONES El trastorno histopatológico más frecuente en los órganos observados fue de tipo circulatorio, siendo el órgano más afectado el pulmón donde se observo congestión (99,7%), hiperemia (99,5%) y hemorragia (96,6%). Los focos inflamatorios a nivel hepático fueron los hallazgos histopatológicos más frecuentes (50%), siendo principalmente pequeños acúmulos de células mononucleares. Además el 99% de los hepatocitos presentó duplicación nuclear o aumento de tamaño de este en algún grado de severidad. El alto índice de megalocitosis encontrado sugiere una intoxicación hepática por alcaloides pirrolizidínicos presentes en Senecio erraticus. La presencia en hígado de granulomas con predominio de eosinófilos resulto negativa a la presencia de parásitos. La presencia en pulmón de granulomas con características de tuberculosis resultaron negativos a la tinción de Ziehl-Neelsen. Debido a la etiología multifactorial y/o ausencia de agentes específicos en las lesiones, no es posible determinar la presencia de enfermedades específicas que afecten a los órganos examinados por medio de este método diagnóstico, siendo necesario el uso de técnicas complementarias para lograr un diagnostico definitivo. 26 7. BIBLIOGRAFIA Araya O. 2009. Árboles, arbustos y malezas tóxicas. En: Araya O (ed). Plantas toxicas y micotoxicosis para el ganado en Chile. 1a ed. Trama Impresores S.A, Hualpén, Chile, Pp 40-51. Bacha W, L Wood. 1991a. Aparato digestivo. En: Bacha W, Wood L (eds). Atlas color de Histologia Veterinaria. Inter-Médica, Buenos Aires, Argentina, Pp 111-114. Bacha W, L Wood. 1991b. Aparato respiratorio. En: Bacha W, Wood L (eds). Atlas color de Histologia Veterinaria. Inter-Médica, Buenos Aires, Argentina, Pp 161-163. Bacha W, L Wood. 1991c. Aparato urinario. En: Bacha W, Wood L (eds). Atlas color de Histologia Veterinaria. Inter-Médica, Buenos Aires, Argentina, Pp 151-153. Battisti A, M Di Paolo, G Di Guardo. 2000. Pulmonary Protostrongyliasis in a Mountain Hare from Italy. J Wildl Dis 36, 367–369 Billinis C, V Psychas, DK Tontis, V Spyrou, PK Birtsas, M Sofia, F Likotrafitis, OM Maslarinou, D Kanteres. 2005. European Brown Hare Syndrome in Wild European Brown Hares from Greece. J Wildl Dis 41, 783-786. Caswell JL, KJ Williams. 2007. Respiratory system. In: Maxie MG (ed). Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. 5th ed. Saunders Ltd, Ontario, Canada, Pp 524-575. Chapman J, J Flux. 1990. Introduction and Overview of the Lagomorphs. In: Chapman J, Flux J (eds). Rabbits, Hares and Pikas Status Survey and Conservation Action Plan. IUCN, Gland, Switzerland, Pp 1-6. Confer AW, RJ Panciera. 2001. The Urinary System. In: McGavin MD, Carlton WW, Zachary JF (eds). Thomson`s special veterinary pathology. 3rd ed. Mosby Inc, St. Louis, Missouri, USA, Pp 235-277. Cullen JM, NJ MacLachlan. 2001. Liver, Biliary System, and Exocrine Pancreas. In: McGavin MD, Carlton WW, Zachary JF (eds). Thomson`s special veterinary pathology. 3rd ed. Mosby Inc, St. Louis, Missouri, USA, Pp 81-116. Díaz GA. 2002. Estudio anátomo e histopatológico en pulmones de perros de la ciudad de Valdivia, Chile. Memoria de título. Escuela de Medicina Veterinaria, Universidad Austral de Chile, Valdivia, Chile. 27 Duchácek L, J Lamka. 2003. Dicrocoeliosis – The Present State of Knowledge with Respect to Wildlife Species. Acta Vet Brno 72, 613–626. Flux J, R Angermann. 1990. The Hares and Jackrabbits. In: Chapman J, Flux J (eds). Rabbits, Hares and Pikas Status Survey and Conservation Action Plan. IUCN, Gland, Switzerland, Pp 76-78. Flynn RJ, G Mulcahy, HM Elsheikha. 2010. Coordinating innate and adaptive immunity in Fasciola hepatica infection: Inplications for control. Vet Parasitol 169, 235-240. Frappier B. 2006. Digestive System. In: Eurrel JA, Frappier B (eds). Dellmann´s textbook of veterinary histology. 6th ed. Blackwell Publishing, Iowa, USA, Pp 201-206. Frölich K, S Thiede, J Wisser. 2001. Infektionskrankheiten des Feldhasen. NUASeminarbericht Bd 7, 34–46. Frölich K, J Wisser, H Schmüser, U Fehlber, H Neubauer, R Grunow, K Nikolaou, J Priemer, S Thiede, WJ Streich, S Speck. 2003. Epizootiologic and Ecologic Investigations of European Brown Hare (Lepus europaeus) in Selected Populations from SchleswigHolstein, Germany. J Wildl Dis 39, 751–761. Gartner L, J Hiatt. 1998. Aparato Respiratorio. En: Gartner L, Hiatt J (eds). Atlas color de histología. 2a ed. Editorial Medica Panamericana S.A, Buenos Aires, Argentina, Pp 222223. Gavier-Widén D, T Mörner. 1993. Descriptive epizootiological study of European Brown Hare síndrome in Sweden. J Wildl Dis 29, 15-20. Gázquez, A. 1991. Patología Veterinaria. Interamericana. Mc.Graw-Hill. Madrid, España. González-Acuña D, P Rebolledo, O Skewes, L Moreno, D Castro. 2005. Hares Parasites (Lepus europaeus) in two geographical Zone of Chile. Parasitol Latinoam 60, 3-4. Grigera D, E Rapoport. 1983. Status and distribution of the european hare in South America. J Mamm 64, 163-166. Jacksic F, J Iriarte, J Jiménez, D Martínez. 2002. Invaders without frontiers: cross-border invasions of exotic mammals. Biol Invasions 4, 157-173. Jones TC, RD Hunt, NW King. 1997a. Diseases Caused by Parasitic Helminths and Arthropods. In: Jones TC, Hunt RD, King NW (eds). Veterinary pathology. 6th ed. Lippincott Williams & Wilkins, Baltimore, Maryland, USA, Pp 658-661. 28 Jones TC, RD Hunt, NW King. 1997b. Introduction: Cell death and tissues. In: Jones TC, Hunt RD, King NW (eds). Veterinary pathology. 6th ed. Lippincott Williams & Wilkins, Baltimore, Maryland, USA, Pp 15-19. Jones TC, RD Hunt, NW King. 1997c. The urinary system. In: Jones TC, Hunt RD, King NW (eds). Veterinary pathology. 6th ed. Lippincott Williams & Wilkins, Baltimore, Maryland, USA, Pp 1111-1147. Kötsche W, C Gottschalk. 1974. Enfermedades y otras causas de bajas en las liebres. En: Enfermedades del conejo y de la liebre. Acribia, Zaragoza, España, Pp 245-269. López A. 2001. Respiratory System, Thoracic Cavity, and Pleura. In: McGavin MD, Carlton WW, Zachary JF (eds). Thomson`s special veterinary pathology. 3th ed. Mosby Inc, St. Louis, Missouri, USA, Pp 130-190. Mair NS. 1973. Yersiniosis in Wildlife and its Public Health Implications. J Wildl Dis 9, 6471. Manterola H. 2006. Producción de liebres en semicautiverio: Una real alternativa para los agricultores. Circular de extensión técnico ganadera 32, 26-31. Marcato PS, R Rosmini. 1986a. Liver. In: Marcato PS, Rosmini R (eds). Patologia del coniglio e della lepre: Atlante a colori e compendio. Societá Editricie Esculapio, Bologna, Italia Pp 105-130. Marcato PS, R Rosmini. 1986b. Respiratory System. In: Marcato PS, Rosmini R (eds). Patologia del coniglio e della lepre: Atlante a colori e compendio. Societá Editricie Esculapio, Bologna, Italia Pp 49-74. Marcato PS, R Rosmini. 1986c. Respiratory System. In: Marcato PS, Rosmini R (eds). Patologia del coniglio e della lepre: Atlante a colori e compendio. Societá Editricie Esculapio, Bologna, Italia Pp 131-147. Marchant CA, S Romero, MI Jercic. 2007. Pesquisa de la presencia de microsporidos en conejos de la Región Metropolitana de Chile. Parasitol Latinoam 62, 94-99. Maxie MG, SJ Newman. 2007. Urinary system. In: Maxie MG (ed). Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. 5th ed. Saunders Ltd, Ontario, Canada, Pp 451-454. Ringler D. 1997. Inflamation and repair. In: Jones TC, Hunt RD, King NW (eds). Veterinary pathology. 6th ed. Lippincott Williams & Wilkins, Baltimore, Maryland, USA, Pp 113120. 29 Singla LD, PD Juyal, BS Sandhu. 2000. Pathology and Therapy in Naturally Eimeria stiedaeInfected Rabbits. J Protozool Res 10, 185-191. Slauson DO, RM Lewis. 1979. Comparative pathology of glomerulonephritis in animals. Vet Pathol 16, 135-164. Treml F, J Pikula, H Bandouchova, J Horakova. 2007. European brown hare as a potential source of zoonotic agents. Vet Med-Czech 52, 451-456. Vinogradov AE, OV Anatskaya, BN Kudryavtsev. 2001. Relationship of hepatocyte ploidy levels with body size and growth rate in mammals. Genome 44, 350-360. Wibbelt G, K Frölich. 2005. Infectious Diseases in European Brown Hare (Lepus europaeus). Wildl Biol Pract 1, 86-93. Yücel C, A Atasever, G Eraslan, M Kibar, O Atalay, L Beyaz, A Inci, B Cem Liman. 2008. Eimeria stiedae: Experimental infection in rabbits and the effect of treatment with toltrazuril and ivermectin. J exppara 119, 164-172. 30 8. ANEXOS 31 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas. N° Caso 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 589 590 591 592 593 594 595 596 597 598 599 600 601 602 603 604 Congestión Grado (+++) (+) (+) (++) (+) (+) - Inflamación Grado Periportal Perivascular Parénquima 5 (+) 2 (+) 1 4 8 (++) 1 (+) 6 (+) 2 (+) 6 (+) 2 (+) 2 (+) 4 (+) 2 (+) 5 (+) 2 (+) 2 6 (++) 3 (+) (+) (++) (++) (+) (+) (+) (+) (+) (+) (++) (+) (+++) (+) (++) (+++) (+) (+) (+) (+) (+) (+) (+) - 1 1 3 2 3 2 1 2 Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn 1 1 1 Mn Mn Mn 2 5 Mn Mn 2 Mn Mn Mn Mn 1 3 Hepatocitos Binucleados Megalocitosis (+++) (+) (++) (++) (+) (+++) (+) (++) (+) (+) (+) (+++) (+) (++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (++) (+) (+++) (++) (++) (+) NO EXISTE MUESTRA (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) NO EXISTE MUESTRA (+++) (++) (+++) (++) (++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (++) Mononuclear (Mn) 2 Mn 5 Mn Mn Otros Hallazgos Tumefacción turbia Granulomas hepáticos focales (++) 32 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 605 606 607 608 609 610 611 612 613 614 615 616 617 618 619 620 621 622 623 624 625 626 627 628 629 630 631 632 633 634 635 636 637 638 639 640 641 642 643 Congestión Grado (+) (+++) (++) (++) (+) (+) (++) (+) (++) (+) (++) (+) (+) (++) (+) (+++) - Inflamación Grado Periportal Perivascular Parénquima 1 (+) 3 (+) 1 2 (+) 1 1 (+) 2 2 5 (+) 1 2 (+) 1 8 (++) 3 (+) 2 1 (+) 1 (+) 1 2 (+) (+) 1 1 3 (+) 2 6 (+) 2 2 3 (+) 1 1 (+) 2 (+) 3 (+) 3 1 4 (+) 1 (+) 1 2 (+) 1 (+) Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (+++) (++) (++) (++) (++) (++) (+++) (+) (+++) (+++) (+++) (+) (++) (++) (++) (+) (+++) (++) (+++) (+) (++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (+) Otros Hallazgos Necrosis de coagulación periportal (++) / Fibrosis periportal (+) 33 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 644 645 646 647 648 649 650 651 652 653 654 655 656 657 658 659 660 661 662 663 664 665 666 667 668 669 670 671 672 673 674 675 676 677 678 679 680 681 682 Congestión Grado (+) (++) (+++) (++) (+) (+) (+) (+) (+) (+) (+) (++) (++) - Inflamación Grado Periportal Perivascular Parénquima 2 1 (+) 4 (+) 1 4 1 1 (+) 4 (+) 3 (+) 1 5 (+) 3 (+) 6 (+) 7 (++) 2 6 (++) 2 (+) 1 (+) 5 (+) 7 (++) 1 (+) 2 (+) 2 (+) 1 (+) 1 (+) 2 1 8 (++) 1 1 1 (+) 1 (+) - Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (++) (+) (+++) (++) (++) (++) (++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (+) (+++) (+) (++) (+) (++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (++) (+) (++) (+++) (++) (++) (++) (++) Otros Hallazgos Edema hepático (+++) Autolisis hepática 34 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 683 684 685 686 687 688 689 690 691 692 693 694 695 696 697 698 699 700 701 702 703 704 705 706 707 708 709 710 711 712 713 714 715 716 717 718 719 720 721 Congestión Grado (+) (+) (+) (+) (+) (+) (+) (+++) (+++) (+) (++) (++) (+) (+) (++) (+) (+) (+) (+) (+) (++) (++) (+) (+) (++) (+) (+) Inflamación Grado Periportal Perivascular Parénquima 1 (+) 4 (+) 1 (+) 1 (+) 1 (+) 1 (+) 1 (+) 1 (+) 1 3 (+) 2 (+) 3 (+) 1 4 (+) 2 (+) 3 (+) 1 (+) - Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (++) (++) (++) (+) (+++) (+) (++) (+) (++) (+) (+++) (+) (+++) (+) (+++) (+) (++) (+) (++) (++) (++) (+) (++) (+) (++) (+) (++) (+) (+) (++) (++) (+) (+++) (++) (+++) (+) (++) (+) (++) (++) (+++) (+) (+++) (+) (++) (++) (++) (+) (+++) (++) (++) (+) (++) (+) (+++) (+) (+++) (++) (+) (+) (++) (+) (+) (+) (+++) (+) (+++) (+) (++) (++) (+++) (++) (++) (+++) (+++) (+) (+++) (++) Otros Hallazgos Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Edema hepático (+++) / Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia 35 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 722 723 724 725 726 727 728 729 730 731 732 733 734 735 736 737 738 739 740 741 742 743 744 745 746 747 748 749 750 751 752 753 754 755 756 757 758 759 760 Congestión Grado (++) (+) (+) (+) (++) (+) (+) (+) (+) (+) (+) (+) (+++) (+++) (+) (++) (++) Inflamación Grado Periportal Perivascular Parénquima 2 1 (+) 1 (+) 2 (+) 4 (+) 1 (+) 2 (+) 5 (+) 1 (+) 2 (+) 1 (+) 2 (+) 3 (+) 7 (++) 3 2 (+) 2 (+) 1 (+) 1 (+) Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (+++) (+) (+++) (+) (++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (++) (++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (++) (+) (+++) (++) (+++) (++) (++) (++) (+++) (++) (+++) (+) (++) (+) (+++) (+) (++) (+) (++) (+) (+++) (++) (+++) (++) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (++) (+++) (++) Otros Hallazgos Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción Turbia Necrosis de coagulación periportal (+) 36 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 761 762 763 764 765 766 767 768 769 770 771 772 773 774 775 776 777 778 779 780 781 782 783 784 785 786 787 788 789 790 791 792 793 794 795 796 797 798 799 Congestión Grado (++) (++) (+) (++) (+) (+++) (+) (+) (++) (+) (+) (+) (+) (+) (++) (++) (+) - Inflamación Grado Periportal Perivascular Parénquima 1 (+) 2 1 (+) 2 (+) 1 (+) 1 1 (+) 2 (+) 1 (+) 1 3 (+) 2 (+) 1 (+) 4 (+) 1 (+) 1 1 3 (+) 1 3 (++) 1 3 (+) 2 (+) 2 2 (+) 2 1 (+) 2 2 (+) 5 2 5 (++) 4 (+) 1 (+) - Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (+++) (++) (+++) (+) (+++) (++) (++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (+) (++) (+) (+++) (+) (++) (+) (++) (++) (+++) (+) (+++) (+) (++) (+) (++) (+) (+++) (++) (+++) (+) (++) (+) (++) (+) (++) (+) (+++) (+) (++) (+) (+++) (+++) (+++) (++) (+++) (+) (++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (++) (++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (+) Otros Hallazgos Necrosis de coagulación periportal (+) Fibrosis periportal (+++) Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Fibrosis periportal (+) Necrosis de coagulación periportal (+) Granulomatosis hepática (+++) 37 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 800 801 802 803 804 805 806 807 808 809 810 811 812 813 814 815 816 817 818 819 820 821 822 823 824 825 826 827 828 829 830 831 832 833 834 835 836 837 838 Congestión Grado (++) (+) (+) (+) (++) (++) (+) (+++) (++) (+) (++) (+) (++) (+) (+) (+) (++) (++) (+) (+) (+++) (+) (++) (+++) (+) - Inflamación Grado Periportal Perivascular Parénquima 2 5 (++) 1 (+) 1 (+) 1 (+) 4 (+) 1 1 (++) 2 (+) 1 2 2 (+) 1 (+) 2 (+) 3 (+) 1 2 (+) 2 (+) 1 (+) 1 2 (+) 3 (+) - Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (+++) (+) (+++) (+) (+++) (++) (+++) (++) (+++) (+) (++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (++) (+) (+++) (+) (++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (++) (++) (+) (+++) (+) (++) (++) (+++) (+++) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (+) (++) (+) (+++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (+) (+++) (+) (++) (+) Otros Hallazgos Edema hepático (+++) Tumefacción turbia Fibrosis periportal (+) Tumefacción turbia Fibrosis periportal (++) Tumefacción turbia Tumefacción turbia Fibrosis periportal (++) 38 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 839 840 841 842 843 844 845 846 847 848 849 850 851 852 853 854 855 856 857 858 859 860 861 862 863 864 865 866 867 868 869 870 871 872 873 874 875 876 877 Congestión Grado (++) (+) (+++) (++) (+) (++) (++) (++) (+) (++) (+) (++) (+) (+) (+++) (+) (+) - Inflamación Grado Periportal Perivascular Parénquima 2 1 (+) 5 (+) 2 (+) 1 (+) 2 (+) 1 (+) 3 (+) 4 (+) 3 (+) (++) (+) (+) (+) (+) (+) (+) (++) 2 Hepatocitos Binucleados Megalocitosis (+++) (+) (+++) (+) (++) (++) (++) (+) (+++) (+) (+++) (+) (++) (+) (++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (++) (+) (++) (+) (+++) (+) (+++) (+) (++) (+) NO EXISTE MUESTRA (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+) (++) (+) (++) (++) (+++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (++) (++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn 3 2 Mn Mn 2 Mn 4 2 Mn Mn 4 Mn 5 9 Mn Mn Otros Hallazgos Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Tumefacción turbia Sinusoides dilatados Sinusoides dilatados 39 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 878 879 880 881 882 883 884 885 886 887 888 889 890 891 892 893 894 895 896 897 898 899 900 901 902 903 904 905 906 907 908 909 910 911 912 913 914 915 916 Congestión Grado (++) (+) (++) (+) (++) (+++) (++) (++) (+) (+) (++) (++) (+++) Inflamación Grado Periportal Perivascular Parénquima 1 (+) 3 4 (++) 2 (+) 6 (+) 6 (+) 4 (+) 1 4 (+) 3 2 2 (+) 2 (+) 2 (+) 2 1 (+) 3 (+) 1 (+) 3 (+) 4 5 2 (++) 4 (+) 5 (+) Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (++) (+++) (++) (+++) (++) (+++) (++) (+++) (+) (++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+++) (+++) (+) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (+) (+++) (+) Otros Hallazgos Sinusoides dilatados Tumefacción Turbia Sinusoides dilatados Sinusoides dilatados Sinusoides dilatados Sinusoides dilatados Sinusoides dilatados Fibrosis Periportal (+) Sinusoides dilatados en áreas congestivas Sinusoides dilatados Sinusoides dilatados Necrosis de coagulación periportal (+) / Fibrosis periportal (++) 40 ANEXO 1: Hallazgos histopatológicos de hígados de las 382 liebres muestreadas (cont.). N° Caso 917 918 919 920 921 922 923 924 925 926 927 928 929 930 931 932 933 934 935 936 937 938 939 940 941 942 943 944 945 946 947 948 949 950 951 Congestión Grado (++) (+) (++) (+++) (++) (+) (++) (+) (+++) (++) (+++) (++) (+) - Inflamación Grado Periportal Perivascular Parénquima 2 2 (+) 6 (+) 1 (+) 2 1 (+) 3 2 (+) 3 3 2 (++) 3 (+) 2 (+) 1 2 (+) 1 (+) 1 (+) 1 (+) 1 2 2 (+) 1 (+) 2 (+) 1 (+) Mononuclear (Mn) Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Mn Hepatocitos Binucleados Megalocitosis (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+) (++) (+++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (++) (+) (++) (+) (+++) (++) (++) (+) (+++) (++) (++) (+) (+++) (+++) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (+) (+++) (+) (++) (+) Otros Hallazgos Sinusoides dilatados Sinusoides dilatados Necrosis coagulación periportal (++) Sinusoides dilatados Sinusoides dilatados Edema Hepático (++) Necrosis de coagulación Periportal (+) Tumefacción turbia Tumefacción turbia Tumefacción turbia 41 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas. N° Caso 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 589 590 591 592 593 594 595 596 597 598 599 600 601 602 603 604 605 606 607 608 609 610 611 612 613 614 615 616 617 618 619 620 621 622 623 624 625 626 627 628 629 630 631 Congestión (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia Hemorragia-Hemosiderina (+++) (+++) (+++) (++) (++) (++) (+++) (+) (+) (+++) (++) (+++) (+) (+++) (++) (+) (++) (++) (+++) (+++) (+++) (+++) (++) (++) (++) (++) (++) (+) (+++) (++) (+++) (++) (++) (++) (+++) (++) (+++) (++) (++) (++) (+++) (+++) (++) (++) (+++) (++) (+++) (++) (+++) (++) (+++) (++) (+++) (++) (+++) (++) (++) (++) (+++) (+++) (+++) (+++) (+++) (+) (++) (++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+) (+++) (++) (+++) (++) (+++) (+) (+++) (+++) (+++) (+) (+++) (+) (+++) (++) (+++) (+) (+++) (++) (+++) (+) (+++) (+++) (++) (++) (+++) (++) (++) (+) (+++) (++) (+++) (++) (++) (+) (+++) (+++) (+++) (+) (++) (+) (+++) (+++) (+++) (+++) (+++) (+) Hiperplasia Linfoide Infiltrado inflamatorio peribronquial (+) 2 Focos inflamatorios peribronquiolares (+) Foco inflamatorio peribronquiolar (+) Foco inflamatorio peribronquiolar (+++) 1 Foco inflamatorio peribronquial (++) 2 Focos inflamatorios peribronquiolares (++) 1 Infiltrado inflamatorio peribronquiolar (+) 1 Foco inflamatorio peribronquial (+) 1 Foco inflamatorio peribronquiolar (+) 4 Focos inflamatorios peribronquiolares (++) 1 Foco inflamatorio peribronquial (+) 1 Infiltrado inflamatorio peribronquial (+) 1 Foco inflamatorio peribronquiolar (+) 1 Foco inflamatorio peribronquiolar (+) 1 Infiltrado inflamatorio peribronquial (++) 1 Infiltrado inflamatorio peribronquiolar (++) - Otros Hallazgos Edema alveolar (+) Edema alveolar (++) Autolisis Edema alveolar (+) 42 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas (cont.). N° Caso 632 633 634 635 636 637 638 639 640 641 642 643 644 645 646 647 648 649 650 651 652 653 654 655 656 657 658 659 660 661 662 663 664 665 666 667 668 669 670 671 672 673 674 675 676 677 678 679 680 681 682 683 684 685 686 687 688 689 690 691 692 693 694 695 696 Congestión (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+) (++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hemorragia-hemosiderina (+++) (+++) (++) (+++) (++) (++) (+) (++) (+++) (++) (+) (+++) (+++) (+) (++) (++) (++) (+) (+++) (+++) (++) (++) (+) (+++) (++) (++) (++) (+) (++) (++) (+) (+++) (+++) (+) (+++) (++) (+++) (++) (+) (++) (+) (+) (++) (+) (++) (+++) (+) (++) (+++) (+) (+) (++) (++) (+) (++) (+++) (++) (+++) (++) (+) (+) (++) (+++) (++) (+) Hiperplasia Linfoide 1 Foco inflamatorio peribronquiolar (+) 1 Foco inflamatorio peribronquial (+) 1 Foco inflamatorio peribronquial (+) 1 Foco inflamatorio peribronquiolar (+) 1 Foco inflamatorio peribronquial (++) 2 Focos inflamatorios peribronquiales (++) 1 Foco inflamatorio peribronquial (+) 2 Focos inflamatorios peribronquiolares (++) 3 Focos inflamatorios peribronquiales (+++) - Otros Hallazgos Edema alveolar (+) Edema alveolar (+) Granuloma Edema alveolar (+) Edema alveolar (+) 43 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas (cont.). N° Caso 697 698 699 700 701 702 703 704 705 706 707 708 709 710 711 712 713 714 715 716 717 718 719 720 721 722 723 724 725 726 727 728 729 730 731 732 733 734 735 736 737 738 739 740 741 742 743 744 745 746 747 748 749 750 751 752 753 754 755 756 757 758 759 760 761 Congestión (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (++) (++) (+++) (+++) (+) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (++) (+++) (+++) (+++) (++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (++) (+++) (+) (+++) (+++) (+++) Hemorragia-hemosiderina (+++) (+++) (+++) (+) (+) (+) (++) (++) (+) (+) (++) (+) (++) (++) (++) (+) (+++) (++) (+++) (+++) (++) (+++) (+) (+) (++) (+) (+) (+) (+++) (+) (+) (++) (+++) (++) (+++) (++) (+++) (+) (++) (++) (+) (+++) (+++) (+++) (+) (+++) (++) (++) (+) (++) (+++) (++) (+++) (++) (++) (+++) (++) (+++) (++) (++) (++) (+) Hiperplasia Linfoide 2 Focos inflamatorios peribronquiolares (++) Infiltrado inflamatorio peribronquiolar (+) Foco inflamatorio peribronquial (++) Foco inflamatorio peribronquial (++) Foco inflamatorio peribronquial (+++) 2 Focos inflamatorios peribronquiolares (++) Foco inflamatorio peribronquiolar (++) Foco inflamatorio peribronquiolar (+) - Otros Hallazgos Granuloma 44 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas (cont.). N° Caso 762 763 764 765 766 767 768 769 770 771 772 773 774 775 776 777 778 779 780 781 782 783 784 785 786 787 788 789 790 791 792 793 794 795 796 797 798 799 800 801 802 803 804 805 806 807 808 809 810 811 812 813 814 815 816 817 818 819 820 821 822 823 824 825 826 Congestión (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia (++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hemorragia-hemosiderina (+) (++) (++) (+) (+) (+) (+++) (++) (+++) (+) (+++) (+) (++) (++) (+++) (+++) (+++) (+++) (+++) (++) (++) (++) (++) (+) (+) (+++) (+) (++) (+++) (+++) (++) (+++) (++) (+) (+++) (+) (++) (+) (++) (+++) (++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (++) (+++) (++) (++) (+++) (+++) (++) (+++) (+++) (++) (+++) Hiperplasia Linfoide Foco inflamatorio peribronquial (+) 2 Focos inflamatorios peribronquiolares (++) Infiltrado inflamatorio peribronquial (++) 2 Focos inflamatorios peribronquiolares (++) 2 Focos inflamatorios peribronquiales (++) Infiltrado inflamatorio peribronquiolar (++) - Otros Hallazgos Granuloma 45 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas (cont.). N° Caso 827 828 829 830 831 832 833 834 835 836 837 838 839 840 841 842 843 844 845 846 847 848 849 850 851 852 853 854 855 856 857 858 859 860 861 862 863 864 865 866 867 868 869 870 871 872 873 874 875 876 877 878 879 880 881 882 883 884 885 886 887 888 889 890 891 Congestión (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (++) (+++) (++) (+++) (+) (+++) Hemorragia-hemosiderina (++) (+++) (++) (+++) (++) (++) (++) (+++) (+++) (+) (+++) (+) (++) (++) (++) (+) (++) (+++) (+++) (+) (++) (++) (+) (+++) (++) (+) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (++) (+++) (+++) (++) (+++) (+++) (+++) (++) (+) (+++) (+++) (+++) (++) (+) (+) (++) (++) (+) (+++) (++) (+) (+++) (+) (+) (+) (+) (+) (+++) Hiperplasia Linfoide Foco inflamatorio peribronquiolar (+++) Infiltrado inflamatorio peribronquiolar (+) Infiltrado inflamatorio peribronquiolar (++) 2 Focos inflamatorios peribronquiales (++) 2 Infiltrados inflamatorios peribronquiolares (+) Foco inflamatorio peribronquiolar (+) Infiltrado inflamatorio peribronquiolar (+) 3 Focos inflamatorios peribronquiolares (+++) 2 Focos inflamatorios peribronquiolares (++) Foco inflamatorio peribronquiolar (+++) 2 Focos inflamatorios peribronquiolares (+) 3 Focos inflamatorios peribronquiales (++) 3 Focos inflamatorios peribronquiolares (++) Foco inflamatorio peribronquiolar (+) 2 Focos inflamatorios peribronquiolares (+) - Otros Hallazgos Granuloma 46 ANEXO 2: Hallazgos histopatológicos de los pulmones de las 385 liebres muestreadas (cont.). N° Caso 892 893 894 895 896 897 898 899 900 901 902 903 904 905 906 907 908 909 910 911 912 913 914 915 916 917 918 919 920 921 922 923 924 925 926 927 928 929 930 931 932 933 934 935 936 937 938 939 940 941 942 943 944 945 946 947 948 949 950 951 Congestión (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) Hiperemia (+) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (+++) (+++) (+++) Hemorragia-hemosiderina (++) (+) (+++) (+++) (++) (+) (+++) (+++) (+++) (++) (++) (++) (+) (+++) (++) (+) (+) (+) (+++) (+) (+++) (+) (+) (+++) (+++) (+++) (++) (+++) (++) (+++) (++) (++) (+) (++) (+) (++) (+++) (+++) (+) (++) (++) (+) (+) (+++) (+++) (++) (+++) (+++) (+++) (+++) (++) (+++) (+++) (++) (++) (+) Hiperplasia Linfoide 2 Focos inflamatorios peribronquiolares (+) Foco inflamatorio peribronquiolar (+) Foco inflamatorio peribronquiolar (++) Infiltrado inflamatorio peribronquial (++) Foco inflamatorio peribronquial (++) Foco inflamatorio peribronquiolar (++) 2 Focos inflamatorios peribronquiolares (++) Foco inflamatorio peribronquiolar (++) Foco inflamatorio peribronquiolar (+) Infiltrado inflamatorio peribronquial (++) 4 Focos inflamatorios peribronquiolares (++) Foco inflamatorio peribronquial (+) Foco inflamatorio peribronquiolar (+) Foco inflamatorio peribronquiolar (++) 3 Infiltrados inflamatorios peribronquiales (+++) - Otros Hallazgos 47 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas. N° Caso 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 589 590 591 592 593 594 595 596 597 598 599 600 601 602 603 604 605 606 607 608 609 610 611 612 613 614 615 616 617 618 619 620 621 622 623 624 625 626 627 628 629 630 631 Congestión Otros hallazgos NO EXISTE MUESTRA NO EXISTE MUESTRA (++) (+) (+) (+) (+) NO EXISTE MUESTRA (++) (++) (++) (+) (+) (++) (+) (++) (+) (+++) (+) (+) (++) (+) (+) - 2 Infiltrado inflamatorio en medula (+) 48 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas (cont.). N° Caso 632 633 634 635 636 637 638 639 640 641 642 643 644 645 646 647 648 649 650 651 652 653 654 655 656 657 658 659 660 661 662 663 664 665 666 667 668 669 670 671 672 673 674 675 676 677 678 679 680 681 682 683 684 685 686 687 688 689 690 691 692 693 694 695 696 Congestión (++) (+++) (+) (++) (+) (++) (+) (+) (++) (++) (+) (+) (++) (+) (+) (+) (+) (+++) (++) (++) (+) Otros hallazgos 1 Infiltrado inflamatorio Cortico-Medular (+) 49 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas (cont.). N° Caso 697 698 699 700 701 702 703 704 705 706 707 708 709 710 711 712 713 714 715 716 717 718 719 720 721 722 723 724 725 726 727 728 729 730 731 732 733 734 735 736 737 738 739 740 741 742 743 744 745 746 747 748 749 750 751 752 753 754 755 756 757 758 759 760 761 Congestión (++) (+) (+) (+) (+++) (+) (++) (+) (+++) (+) (++) (+) (++) (+) (+) (++) (+++) (+) (++) (++) (+) (+) (+) (+) (+++) (++) (++) (++) (++) (+++) (++) (+) Otros hallazgos Glomerulonefritis membranosa (+++) y Nefritis intersticial (+) Nefritis intersticial (++) Glomerulonefritis membranosa (+) Mineralización tubular (+++) 50 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas (cont.). N° Caso 762 763 764 765 766 767 768 769 770 771 772 773 774 775 776 777 778 779 780 781 782 783 784 785 786 787 788 789 790 791 792 793 794 795 796 797 798 799 800 801 802 803 804 805 806 807 808 809 810 811 812 813 814 815 816 817 818 819 820 821 822 823 824 825 826 Congestión (+) (+) (+) (+) (+) (++) (++) (++) (+) (++) Otros hallazgos Infarto renal crónico (+++) NO EXISTE MUESTRA NO EXISTE MUESTRA (+) (+) (+) (++) (++) (++) (+++) (+++) (++) (+) (+) (++) (+) (+++) Glomerulonefritis membranosa(+) 51 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas (cont.). N° Caso 827 828 829 830 831 832 833 834 835 836 837 838 839 840 841 842 843 844 845 846 847 848 849 850 851 852 853 854 855 856 857 858 859 860 861 862 863 864 865 866 867 868 869 870 871 872 873 874 875 876 877 878 879 880 881 882 883 884 885 886 887 888 889 890 891 Congestión (++) (+) (++) (+++) (++) (+) (+) (+) (+++) (+) (+) (+) (+) (++) (+) (++) - Otros hallazgos 1 Foco inflamatorio medular (+) 52 ANEXO 3: Hallazgos histopatológicos de los riñones de las 379 liebres muestreadas (cont.). N° Caso 892 893 894 895 896 897 898 899 900 901 902 903 904 905 906 907 908 909 910 911 912 913 914 915 916 917 918 919 920 921 922 923 924 925 926 927 928 929 930 931 932 933 934 935 936 937 938 939 940 941 942 943 944 945 946 947 948 949 950 951 Congestión (+) (++) (++) (+) (+) (+) (+++) (+) (+) - Otros hallazgos Nefritis intersticial (++) 1 Foco inflamatorio medular (+) NO EXISTE MUESTRA (+)