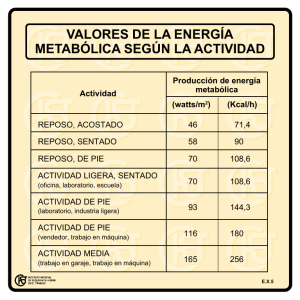
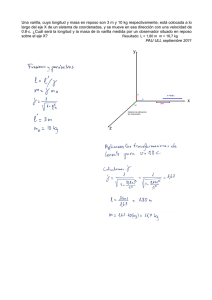
revisión de literatura de hallazgos hematológicos y fisiológicos
Anuncio

REVISIÓN DE LITERATURA DE HALLAZGOS HEMATOLÓGICOS Y FISIOLÓGICOS EN CABALLOS ATLETAS EN LA MODALIDAD DE COMPETICIÓN COMPLETA DE EQUITACIÓN LUISA FERNANDA UMBARILA BARRETO UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES FACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA Y ZOOTECNIA BOGOTÁ, D.C. 2007 REVISIÓN DE LITERATURA DE HALLAZGOS HEMATOLÓGICOS Y FISIOLÓGICOS EN CABALLOS ATLETAS EN LA MODALIDAD DE COMPETICIÓN COMPLETA DE EQUITACIÓN LUISA FERNANDA UMBARILA BARRETO CÓDIGO: 79910005 Monografia para optar al título de Médico Veterinário y Zootecnista DIRECTOR Dr. HUMBERTO CASTAÑO B. Médico Veterinário y Zootecnista UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES FACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA Y ZOOTECNIA BOGOTÁ, D.C. 2007 Nota de aceptación: HUMBERTO CASTAÑO B. Médico Veterinario y Zootecnista Director _______________________ Aceptado GIOVANNA MESA Bacterióloga Jurado _______________________ Aceptado CRISTINA RIVAS Médica Veterinaria Jurado _______________________ Aceptado Fecha 10 de abril de 2007 GLOSARIO Ac: Acetil colina AST: Aspartato aminotransferasa ATP-PC: Sistema Fosfageno BUN: Nitrógeno ureico sanguíneo CBH: Confederación Brasilera de Hipismo (Confederaçäo Brasileira de Hipismo) CC: Concurso completo CCE: Competición Completa de Equitación, Concurso Completo de Equitación, Prueba de los Tres días, 3-day-event. CCN: Pruebas de concurso completo (Con marchas y steeple-chase opcionales) CHCM: Concentración de hemoglobina corpuscular media CHECK UP: Inspección veterinaria CK: Creatin Kinasa CNC: Pruebas combinadas sin marchas ni steeple-chase CP: Fosfocreatinina CROSS-COUNTRY: Campo Traviesa DRESSAGE: Doma EC: Extra celular FA: Fosfatasa alcalina FAD: Flavin Adenindinucleotido FC: Frecuencia cardiaca FCL: Fibra de contracción lenta FCR: Fibra de contracción rápida FEI: Federación Ecuestre Internacional FR: Frecuencia respiratoria GGT: Gama glutamil transferasa HCM: Hemoglobina corpuscular media IC: Intra celular LDH: Lactato deshidrogenasa MK: Mioquinasa NAD: Nicotinamida Adenindinucleotido Pi: Fósforo inorgánico PMPT: Potenciales mínimos de placa motora terminal PMR: Potencial de membrana en reposo PSI: Pura Sangre Inglés PPT: Proteína plasmática total RC: Resultados calificatorios RFHE: Reglamento de concurso completo de equitación SNC: Sistema nervioso central STEEPLE-CHASE: Prueba de Obstáculos VCM: Volumen corpuscular medio VO2: Consumo de oxígeno VT: Volumen eritrocitario total TABLA DE CONTENIDO Pag. INTRODUCCIÓN 15 OBJETIVOS 18 Objetivo General 18 Objetivos Específicos 18 REVISIÓN DE LITERATURA 19 1. CONCURSO COMPLETO DE EQUITACIÓN O PRUEBA DE TRES DÍAS 19 1.1. Prueba de Campo travieso o Cross-country 21 1.2. Prueba de adiestramiento 21 1.3. Prueba de fondo 21 1.4. Prueba de salto 22 1.5. Participación de los caballos 23 1.6. Categorías y niveles de la Competición Completa de Equitación 23 1.7. Niveles 23 2. FISIOLOGÍA DEL EJERCICIO 26 2.1. Bases energéticas del ejercicio en el caballo 27 2.1.1. Contracción muscular, regulación del mecanismo contráctil 27 2.1.2. Cambios metabólicos 28 2.1.3. Producción de energía por la célula muscular 28 2.1.4. Procesos de abastecimiento intracelular de ATP 30 2.1.4.1. Fosforilación oxidativa 30 2.1.4.2. Fosforilación anaeróbica 31 2.1.5. Velocidad de producción de energía a las cambiantes necesarias de la célula muscular 32 2.2. Transmisión sináptica, unión neuromuscular 33 2.2.1. Cationes de la función neuromuscular 35 2.2.1.1. Potencial de la membrana en reposo (PMR) 36 2.2.1.2. Potencial de equilibrio iónico de K+ 38 2.2.1.3. Potencial de acción de la membrana (PA) 39 2.3. Transmisión neuromuscular 41 2.3.1. Anormalidades en la distribución catiónica 42 2.3.1.1. Calcio 42 2.3.1.2. Magnesio 44 2.3.1.3. Potasio 44 2.4. Evaluación de los músculos 46 2.4.1. Adaptación muscular al ejercicio y al entrenamiento 47 2.4.2. Bases moleculares para las propiedades contráctiles 48 2.4.3. Propiedades metabólicas de la unidad motora 48 2.4.4. Cambios del músculo esquelético durante el ejercicio 49 2.4.5. Adaptación de la fuente de energía al tipo de trabajo que realiza 49 2.4.5.1. Reposo 49 2.4.5.2. Ejercicio 50 2.4.6. Interacción de los sistemas aerobios y anaerobios durante el ejercicio 51 2.4.6.1. Recuperación del ejercicio 52 2.4.7. Retirada del ácido láctico de la sangre y del músculo 52 2.4.8. Contracción del músculo esquelético 53 2.4.8.1. Características de los filamentos contráctiles 53 2.4.9. Mecanismo de la contracción muscular 55 2.4.9.1. Regulación del mecanismo contráctil 57 2.4.10. Control de la actividad muscular 60 2.5. Factores ligados al desempeño atlético 62 3. RESPUESTAS FISIOLÓGICAS DEL ORGANISMO AL EJERCICIO 63 3.1. Animales en reposo 64 3.2. Respuesta fisiológica al ejercicio 65 3.2.1. Función cardiaca 65 3.2.2. Función respiratoria 68 3.2.3. Temperatura 72 3.3. Respuesta hematológica al ejercicio 73 3.3.1. Electrolitos sanguíneos 74 3.3.2. Serie roja 76 3.3.2.1. Eritrocitos 78 3.3.2.2. Índices eritrocitarios 79 3.3.2.3. Hemoglobina 80 3.3.3. Serie blanca 81 3.3.4. Bioquímica sanguínea 82 3.3.4.1. Lactato 83 3.3.4.2. Proteínas plasmáticas totales 89 3.3.4.3. Glucosa 89 3.3.4.4. Urea y creatinina 91 3.3.4.5. Nitrógeno ureico sanguíneo (BUN) 92 3.3.4.6. Creatin kinasa (CK) 93 METODOLOGÍA 95 IMPACTO ESPERADO 96 DISCUSIÓN 97 CONCLUSIONES 100 BIBLIOGRAFÍA 102 LISTA DE TABLAS Pág. Tabla 1. Característica, distancia recorrida y velocidad exigida en cada fase de la prueba de fondo de la Competición Completa de Equitación. 22 Tabla 2. Niveles y condiciones de participación en cada uno de los concursos del CCE en cada una de las categorías. 24 Tabla 3. Altura y anchura de los obstáculos. 25 Tabla 4. Tiempos, distancias, número de obstáculos y esfuerzos. 26 Tabla 5. Síntesis del ATP necesario para el esfuerzo muscular a partir del fosfato de creatina (PC) mediante el metabolismo anaeróbico y aeróbico en diferentes tipos de esfuerzo del caballo. 29 Tabla 6. Componentes de los mecanismos aeróbico y anaeróbico. 30 Tabla 7. Trastornos en la locomoción causados por desbalances minerales. 43 Tabla 8. Efecto del desbalance catiónico sobre la función neuromuscular. 45 Tabla 9. Ensayo de desempeño realizado a equinos atletas de la modalidad de concurso completo de equitación. 63 Tabla 10. Valores hematológicos mínimos de equinos de competición completa de equitación. 64 Tabla 11. Valores bioquímicos mínimos, medio y máximos observados en los equinos de competición completa de equitación. 64 Tabla 12. Media desviación estándar (DE) de la frecuencia cardiaca (Latidos / minuto) en reposo y post – ejercicio y, carga cardiovascular (CC) (%) en 10 equinos de salto Holsteiner. 67 Tabla 13. Media y desviación estándar (DE) de la frecuencia cardiaca (latidos / minuto) a los 5, 10 y 15 minutos después de realizar el ejercicio en 10 equinos de salto Holsteiner. 67 Tabla 14. Valores de la frecuencia respiratoria en caballos de salto Holsteiner. 72 Tabla 15. Promedios de la frecuencia respiratoria (FR) en caballos chilenos de rodeo antes y después del ejercicio en un período de entrenamiento de 45 días. 72 Tabla 16. Valores promedios de electrolitos sanguíneos en caballos chilenos en reposo y posterior a la competencia de rodeo. 75 Tabla 17. Valores de C, Ca y Na, en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 76 Tabla 18. Valores de hemoglobina (Hb) en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 80 Tabla 19. Valores promedio de hemoglobina (Hb) en caballos chilenos en reposo y posterior a la competencia de rodeo. 80 Tabla 20. Valores de AST y LDH en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 82 Tabla 21. Valores encontrados de GGT y AST (U/L) en equinos atletas de la competición completa de equitación. 83 Tabla 22. Valores promedio de AST y LDH en caballos chilenos en reposo y posterior a la competencia de rodeo. 83 Tabla 23. Ensayo de desempeño en caballos atletas de la competición completa de equitación. 84 Tabla 24. Valores de ácido láctico en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 86 Tabla 25. Valores promedio de ácido láctico en caballos chilenos en reposo y posterior a la competencia de rodeo. 86 Tabla 26. Media de la concentración de lactato sanguíneo (mmol/L). 87 Tabla 27. Valores promedio de ácido láctico en caballos chilenos en reposo y posterior a la competencia de rodeo. 88 Tabla 28. Valores de proteína plasmática total en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 89 Tabla 29. Valores promedio de proteína plasmática total en caballos chilenos en reposo y posterior a la competencia de rodeo. 89 Tabla 30. Hallazgos hematológicos de los niveles de glucosa (mg/dl) en equinos de concurso completo de equitación. 90 Tabla 31. Valores de glucosa en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 90 Tabla 32. Valores promedio de glucosa en caballos chilenos en reposo y posterior a la competencia de rodeo. 91 Tabla 33. Valores de creatin kinasa (CK) en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. 94 Tabla 34. Valores promedio de creatin kinasa (CK) en caballos chilenos en reposo y posterior a la competencia de rodeo. 94 Tabla 35. Sitios y mes donde fue recopilada la información de libros, artículos e Internet. 95 LISTA DE FIGURAS Pág. Figura 1. Obtención de energía para la contracción muscular. 33 Figura 2. Placa motora terminal y sus componentes. 34 Figura 3. Distribución del K+, Na+, Cl- y grandes aniones orgánicos. 37 Figura 4. Potencial del equilibrio iónico del K+. 38 Figura 5. Potencial de acción de la membrana. 39 Figura 6. Propagación del potencial de acción de la membrana 41 Figura 7. Estructura del sarcómero y de las proteínas contráctiles. 54 Figura 8. Ordenamiento de los filamentos gruesos y finos en el estado de reposo y durante la contracción. 55 Figura 9. Esquema del mecanismo de deslizamiento de los filamentos finos sobre los gruesos. 56 Figura 10. Efecto de los iones calcio en la interacción actina – miosina. 58 Figura 11. Respuesta contráctil a una serie de potenciales de acción en el músculo esquelético. 61 Figura 12. Consumo de oxígeno por metro recorrido. aumenta la demanda de oxígeno a los tejidos. 70 Figura 13. Factores que participan durante el ejercicio: Esplenocontracción e hipoxia tisular. 74 LISTA DE GRÁFICAS Pág. Gráfica 1. Valores medios de la frecuencia cardiaca, obtenidos en caballos de distinta raza sometidos a un ejercicio de intensidad creciente y en la recuperación. 68 Gráfica 2. Incremento relativo en el consumo de O2 (VO2), gasto cardíaco, Hb y diferencias arteriovenosas de O2, entre el reposo y un ejercicio extenuante. 71 Grafica 3. Recuento de eritrocitos (RE), de caballos en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. 77 Gráfica 4. Recuento de hematocrito (Hc) de caballos pura sangre en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. 77 Gráfica 5. Recuento del volumen corpuscular medio en caballos pura sangre en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. 78 Gráfica 6. Media de la concentración de lactato sanguíneo (mmol/L-1) en los diferentes tiempos y fases estudiadas. 87 Gráfica 7. Variación del ácido láctico en atletas equinos en diferentes tiempos de muestreo. 88 Gráfica 8. Variación de la glucosa en equinos atletas en diferentes tiempos de muestreo. 91 Gráfica 10. Valoraciones del BUN en equinos en diferentes tiempos de muestreo. 92 Gráfica 11. Valoraciones del BUN en equinos de bajo desempeño atlético en varios tiempos de muestreo. 93 Gráfica 12. Variación de la CK en el grupo de atletas equinos en los tiempos T0 y T1. 94 TRANSMISIÓN E INTERVENCIÓN DE LA RABIA BOVINA SILVESTRE 1 MAIRO URBINA 2 LUIS EDUARDO RICAURTE 3 2008 RESUMEN Se inicio el estudio, con el fin de evaluar los diferentes trasmisores y reconocer los métodos más eficaces de intervención para la rabia bovina silvestre; Ya que, es un serio problema que afecta a la ganadería mundial incrementando perdidas económicas y trayendo consigo problemas zoosanitarios, se realizo un sondeo de los transmisores encontrándose al murciélago hematófago como el de mayor incidencia en la propagación mundial, seguido por el zorro en el continente Europeo y la mofeta en Norte y Centro América, así mismo se encontraron métodos de intervención muy eficaces como los son la captura del transmisor, métodos de control tradicionales, sin captura del transmisor, y gases tóxicos o cebos vacúnales en los mamíferos silvestres, obtuviendose que el principal método de intervención y el mas eficaz es una vacunación responsable, seguida de un control de captura del murciélagos hematófagos con el uso de mallas de niebla y aplicación de la warfarina a estos mamíferos voladores. Palabras claves: Murciélago hematófago, Mallas de niebla, Warfarina 1. Trabajo de grado en modalidad de monografía. 2. Director. Docente Facultad de Medicina Veterinaria. 3. Estudiante ultimo semestre, Facultad de Medicina Veterinaria y Zootecnia. NOTA DE ACEPTACIÓN DIRECTOR MAIRO URBINA JURADO MANUEL GALLEGO JURADO MIGUEL MONTUFAR FECHA DE PRESENTACIÓN: 27 DE OCTUBRE DEL 2008 INTRODUCCIÓN A pesar que muchos investigadores han estudiado el tema, y se han especializado en equinos atletas en la modalidad de CCE, ésta información se encuentra dispersa. Aquí en Colombia también se maneja ésta modalidad ecuestre, pero sólo llega a 2 estrellas, y es inusual; de esta forma cuando comenzaron a aparecer otras modalidades hípicas el CCE se fue convirtiendo en una prueba poco practicada; además, la modalidad ecuestre de la que se hace referencia en esta monografía es muy compleja y exige mucho tanto del caballo como del jinete, lo que hace que la prueba sea algo difícil y extenuante para el caballo, por tanto es realizada en tres días, como se explica más adelante, y requiere de un alto nivel de entrenamiento, por lo que muchas personas prefieren participar en otras modalidades menos exigentes y más comunes en Colombia. Aunque existen estudios basados en el CCE, se encuentran dispersos, y son trabajos aislados que han sido realizados en diferentes partes del mundo, lo que hace que el entendimiento del tema sea un poco más complicado; de igual forma, dentro de la búsqueda de información no sé encontró un estudio completo donde se que abarque los hallazgos hematológicos y fisiológicos en equinos atletas en la modalidad de CCE. Hay algunos estudios hechos sobre la prueba de fondo de CCE, pero la información es escasa, y hasta ahora se está comenzado a mostrar un interés en ésta prueba hípica. El caballo ha sido factor de desarrollo y de comunicación entre los hombres y las sociedades modernas. En los jinetes encontramos valores tales como la disciplina, coraje, constancia, precisión; y en el caballo encontramos brío, atención, agilidad, destreza, inteligencia, fortaleza y potencia. Este dúo nos enseña trabajo en equipo, confianza mutua y compromiso para ganar; todas estas cualidades hacen atractivo este deporte al público, por lo cual el propósito de este trabajo es recopilar información, y de esta forma proporcionar a los lectores información de manera más fácil, para que exista mayor conocimiento del tema, y otras personas se interesen por dicha modalidad ecuestre. El valor de la medicina deportiva equina comenzó a aclararse en algunos veterinarios y entrenadores hace algunos años con la aceptación del hecho de que la resistencia de los huesos y ligamentos de los caballos de desempeño deportivo puede variar significativamente. Esta idea, unida a la gran cantidad de evidencia en crecimiento de que los músculos, el corazón, y los pulmones de los caballos de alto desempeño son sometidos a muchos cambios compensatorios con el entrenamiento, llevó a un esfuerzo concertado de romper algunas tradiciones del entrenamiento equino y a tratar de preparar a los caballos físicamente para los eventos deportivos (JONES, 1995). 15 El estudio de la fisiología del ejercicio, es una ciencia relativamente nueva cuando se trata de caballos, está revelando más conocimientos sobre cómo la fisiología del caballo cambia con el aumento del acondicionamiento. Están haciéndose muchos estudios de fisiología del ejercicio con los caballos en una pista de alta velocidad o banda transportadora. (JONES, 2002). Por esta razón, para lograr entender el tema y la complejidad de este deporte se hace necesario que a nivel nacional brinden la oportunidad de ver de cerca la competición, de participar en ella; y así muchas otras personas se podrían interesar en investigar el tema; de tal forma, que esta modalidad ecuestre sea realizada en nuestro país, y a partir de ello se logre incentivar a la población colombiana a participar en la Competición Completa de Equitación. En lo Social, en lo Económico y en lo Deportivo, la hípica para cualquier país del mudo es de suma importancia, pues a través de ésta se generan miles de empleos, se producen bienes y servicios, se pagan impuestos y se destinan recursos para la salud; además es fuente de recreación para millares de personas. La crianza y producción de caballos atletas se ha convertido en los renglones más destacados en las economías de otros países, por los ingresos que genera la exportación de caballos al mundo entero y por que además reciben apoyo e impulso del Estado; el desarrollo de la hípica en Colombia constituye una importante fuente de recursos para el sector de la salud, en razón de los impuestos que se derivan de esta actividad. Los caballos atletas son una fuente inagotable de empleo, la industria del caballo conlleva a una enorme riqueza de mano de obra (ASOCIACIÓN COLOMBIANA DE CRIADORES DE CABALLOS P.S.I. – ASOCRIADORES, 2007). En los últimos 40 años se ha hecho mucha investigación en la fisiología del ejercicio de los atletas equinos, incluidos los caballos de carreras, los caballos de salto y los de esfuerzo (MUTIS, 2005). Por lo cual, se pretende con este trabajo realizar una revisión de literatura, recopilando datos sobre las respuestas fisiológicas, hematológicas y el desempeño de los caballos atletas, antes, durante y después de la Competición Completa de Equitación (CCE) o Prueba de 3 días. El CCE es uno de los deportes ecuestres con mayor demanda muscular y energética (ANDREWS et al., 1995). El caballo como animal atleta pasa parte de su vida entrenando para mantener y mejorar su desempeño en las competiciones y, la bioquímica de la sangre es fundamental en el acompañamiento de la evolución del desempeño de esos animales, ya que las pruebas bioquímicas son usadas con la finalidad de evaluar la multiplicidad de funciones metabólicas desempeñadas por los órganos y tejidos del organismo animal (SILVEIRA et al., 1988). Estudios sobre las adaptaciones hematológicas y bioquímicas en caballos pura sangre de carrera (P.S.C), durante el ejercicio y después de éste, han demostrado que la frecuencia cardiaca, el volumen total de glóbulos rojos y la concentración de hemoglobina pueden ser indicadores confiables para evaluar la aptitud física y el nivel de entrenamiento que 16 presenta un caballo para realizar un determinado ejercicio (EVANS et al., 1993). También, el nivel de enzimas musculares en respuesta al ejercicio, ha sido propuesto como índice de aptitud, donde aquellos animales físicamente menos acondicionados debieran presentar mayores incrementos en la actividad enzimática que aquellos que presentan una mejor condición física (MILNE, 1982). La demanda energética de los caballos atletas aumenta en función del tipo y la duración de la actividad física (SNOW, 1992). La producción y la utilización apropiadas de energía son esenciales para el equino atleta y posee una función crítica para el óptimo desempeño (EATON, 1994; HARRIS & HARRIS, 1998). La glucosa es una importante fuente de energía para la actividad muscular. Con el aumento de la intensidad del ejercicio, gran parte de la energía es generada a través de la glucosa anaerobia, con consecuente producción de ácido láctico. Cuanto mayor es la intensidad del ejercicio, mayor es la cantidad de lactato y H+ producidos (EATON, 1994). Durante la prueba de fondo en el CCE, los animales realizan ejercicios extenuantes, siendo considerada una de las pruebas más desafiadoras del acondicionamiento y habilidad entre las modalidades ecuestres (WILLIAMSON et al., 1996; MARLIN et al., 1995). MUÑOZ, et al. (1999) relatan que la energía muscular durante la prueba de campo traviesa es originada tanto por el proceso oxidativo cuanto por la glucosa anaeróbia, con consecuente producción de lactato. WILLIAMSON et al. (1996), ANDREWS et al. (1995), y MARLIN et al. (1995) demostraron que los equinos, después de la prueba de fondo en el CCE, presentan varias alteraciones bioquímicas, relacionadas principalmente a la pérdida de líquido y electrolitos a través del sudor, además de la acidosis metabólica relacionada al acumulo de lactato en sangre. De esa forma, es indispensable el adecuado acondicionamiento físico de estos animales. Se puede observar que hay pocos estudios realizados sobre caballos atletas en la modalidad, antes mencionada; por lo tanto hay un desconocimiento de cómo es el desempeño de estos animales frente al ejercicio físico, en este caso sometidos al CCE. Por esta razón es importante conocer, recopilar y analizar los estudios y datos que existen, para observar el comportamiento hematológico y fisiológico que presentan estos equinos atletas. De esta forma podemos determinar los cambios encontrados en algunos estudios, y se puede llevar a la realización de algún experimento o simplemente podríamos observar los datos, analizarlos y con ello realizar una dieta que ayude al desempeño atlético de este tipo de animales, sin olvidar la correlación existente entre los factores que hacen parte del desarrollo atlético de los equinos sometidos a ejercicio físico. 17 OBJETIVOS OBJETIVO GENERAL Realizar una revisión bibliográfica, acerca de los hallazgos hematológicos y fisiológicos en equinos atletas en la modalidad de Competición Completa de Equitación (CCE), antes, durante y después del ejercicio físico. OBJETIVOS ESPECÍFICOS - Hacer una recopilación de hallazgos hematológicos en equinos atletas de Competición Completa de Equitación, en reposo y sometidos a pruebas físicas, en este caso divididas en tres días, las cuales corresponden respectivamente a una prueba de adiestramiento, campo traviesa y prueba de salto. - Obtener información de las respuestas fisiológicas en los equinos de la modalidad de CCE, expuestos a ejercicio físico. - Recopilar datos sobre el desempeño atlético de los caballos de Competición Completa de Equitación, antes, durante y después de la prueba. - Analizar la información encontrada, para determinar la correlación existente entre el desempeño atlético de los caballos, las respuestas hematológicas y los parámetros fisiológicos. 18 REVISIÓN DE LITERATURA 1. COMPETICIÓN COMPLETA DE EQUITACIÓN O PRUEBA DE TRES DÍAS La prueba de Competición Completa de Equitación (CCE), es un deporte de origen europeo, que tenía como principal objetivo colocar en competición los caballos de la época, que frecuentemente participaban en guerras, lo que también dio el nombre a ese deporte de “caballo de armas”, lo cual buscaba el animal más completo posible. Estos caballos debían ser ágiles, rápidos, obedientes, resistentes y valientes (www.hipismobrasil.com.br/modalidades/cce.asp, 2007). Esta disciplina ecuestre, fue introducida por primera vez en los Juegos Olímpicos de Estocolmo, en el 1902. Por aquel entonces era una competencia exclusiva para los Oficiales de Caballería de los Ejércitos de los distintos países. Recién en 1924 se permite la participación de civiles. Previamente se realizaron algunas transformaciones técnicas, fundamentalmente en las exigencias del Campo traviesa o “Cross-Country” (Fase D de la prueba del Segundo día) que preservando sus emocionantes alternativas, cuidaban la integridad física de jinetes y caballos. En 1964 comienzan a competir en esta disciplina las mujeres (ESPERANZA, 2000). Con el pasar del tiempo las guerras fueron acabando y el deporte continuo creciendo, logrando su cumbre cuando se tornó deporte olímpico. Entonces el CCE, puede ser definido como “Triatlón Ecuestre”, donde en apenas 3 días, el caballo y el jinete deben mostrar la elegancia y precisión del adiestramiento, y el preparo físico en el Campo traviesa y la flexibilidad en la última prueba, la prueba de salto de obstáculos (www.hipismobrasil.com.br/modalidades/cce.asp, 2007). En Argentina tiene un gran desarrollo en el ámbito militar a partir de 1948. Su mayor exponente fue el Coronel Carlos Moratorio quien, con el grado de Capitán de Caballería obtiene la medalla de plata en los Juegos Olímpicos de Tokio del año 1964 para luego consagrarse campeón mundial en Inglaterra en el año 1966. En 1994, se organizó en el Country Club San Diego (EEUU) un Concurso Internacional dos Estrellas, clasificatorio para los Juegos Panamericanos. Un año mas tarde Argentina presentó un equipo en los Juegos Panamericanos, donde se obtiene una medalla de plata, lograda por el Señor Federico Castaing. En la actualidad la Federación Ecuestre Argentina, conjuntamente con la Comisión de Pruebas Hípicas del Ejército se encuentra abocada a desarrollar esta disciplina en tal forma que permita mejorar la medalla de plata obtenida en el último Panamericano (www.paginaswebz.com/directorweb-deportes/equitacion_ar/deportes.ht ml, 2006). El CCE es una modalidad hípica caracterizada por la intensa actividad física de los equinos y, un buen desempeño de los caballos durante las competiciones, la cual resulta de la combinación de edad, alimentación, potencial genético, entrenamiento y manejo (QUEIROZ, 2006). 19 El Concurso Completo de Equitación, regido por las reglas de la Federación Ecuestre Internacional (FEI), es una modalidad ecuestre que exige mucho de los animales, tanto en la parte de adiestramiento como en el acondicionamiento físico (WILLIAMSON et al., 1996; WHITE et al., 1995). En el primer día, se desenvuelve una prueba de adiestramiento en una pista de 20 x 60 metros, que exige del conjunto (Jinete y caballo) la ejecución de ejercicios en perfecta armonía, como una prueba de sumisión y habilidad, en la cual el conjunto ejecuta una secuencia de movimientos preestablecida; en realidad es una demostración de doma (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). En el segundo día, se desarrolla la prueba de campo traviesa o “Cross-country", una prueba que exige mucho preparo físico y resistencia. Esa prueba es dividida en 4 etapas: - La etapa A, que consiste en un recorrido por caminos y senderos es una prueba de resistencia donde el caballo trota de 20 a 30 minutos, para calentar. - Sin intervalo, se inicia la etapa B o prueba de fondo, también denominada "Steeplechase" o prueba de obstáculos, donde el animal salta de 6 a 8 obstáculos a una velocidad elevada. - La etapa C (caminos y senderos) tiene una duración de 40 a 50 minutos, el conjunto (Jinete y caballo) hace un recorrido en la pista, el objetivo es descansar y recuperar el animal. El caballo podrá recibir en esta fase, agua, baño, masajes y un característico chequeo veterinario (check up). - En la última etapa, la etapa D es el punto más alto de la competición del segundo día, Campo traviesa o Cross-country, hay cerca de 35 obstáculos rústicos y naturales dispersos en un campo abierto, donde el conjunto (Jinete y caballo) deberá mostrar toda su valentía saltándolos. (www.hipismobrasil.com.br/modalidades/cce.asp, 2007). En el tercer día, el conjunto (Jinete y caballo) se someterá a una prueba más, de un modo más clásico, en un picadero, como en pruebas de saltos tradicionales. Deberán mostrar al público su habilidad y flexibilidad en los 10 obstáculos. Y así termina la prueba del CCE. (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). El CCE también puede ser hecho en un único día, con las siguientes pruebas: - Prueba de adiestramiento de 20 a 40 metros - Prueba de salto 20 Cuando las pruebas se celebren en el mismo día, deberá haber un intervalo mínimo de 30 minutos entre prueba y prueba de cada participante, aunque es deseable un intervalo más amplio (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). 1.1. PRUEBA DE CAMPO TRAVIESA O “CROSS–COUNTRY” a) Categorías de los jinetes y amazonas: - Infantiles: 8 a 14 años, podrán participar hasta el nivel 1* (Una estrella) - Jóvenes: 14 a 18 años, cadetes y juveniles podrán participar hasta el nivel 2** (Dos estrellas) - Adultos: Mayores de 18 años (BORJAILLE, 1997) 1.2. PRUEBA DE ADIESTRAMIENTO Tiene por objetivo el desarrollo armonioso de los recursos físicos y morales del caballo, tornándolo flexible, tranquilo, obediente, y atento a las ayudas, manteniendo el brío en sus movimientos con perfecto entendimiento con su jinete. Las pruebas son ejecutadas en pistas de 20 x 60 metros o 20 x 40 metros de acuerdo con las Reglas de la Confederación Brasilera de Hipismo (CBH) y la Federación Ecuestre Internacional (FEI). (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN). 1.3. PRUEBA DE FONDO Tiene como objetivo evidenciar la valentía, resistencia y aptitud tanto del jinete como del caballo al superar las dificultades de los obstáculos naturales del campo, en las situaciones mas adversas posibles. La prueba de fondo es subdividida en cuatro fases: - Fase A: Resistencia al Trote Fase B: Prueba de obstáculos (Steeple–chase) al galope Fase C: Resistencia al trote Fase D: Campo Traviesa (Cross–country) al galope 21 Faltas: - Primer escape o desvío: 20 puntos Segundo escape o desvío: 40 puntos Tercer escape o desvío: eliminado Retraso Caballo/Jinete: 60 puntos Omisión del obstáculo: eliminado Penalidad por exceso de tiempo: 0,4 puntos por segundo iniciado además del tiempo máximo concedido. (BORJAILLE, 1997). TABLA 1. Característica, distancia recorrida y velocidad exigida en cada fase de la prueba de fondo de la Competición Completa de Equitación, Sao Paulo: Sao Carlos, 2004. FASE CARACTERÍSTICA DISTANCIA NÚMERO DE VELOCIDAD (m) OBSTÁCULOS (m/min) A Caminos y senderos 3960 220 B Prueba de obstáculos 2415 8 690 C Caminos y senderos 560 160 D Campo traviesa 5415 40 570 Tomado de GOMIDE et al. (2006). 1.4. PRUEBA DE SALTO Tiene por objetivo demostrar la resistencia, flexibilidad y sumisión del caballo al ejecutar la prueba de salto en el día siguiente a una severa prueba de fondo. Faltas: - Derrumbe o falta en gran cantidad: 05 puntos Primer escape o desvío: 10 puntos Segundo escape o desvío: 20 puntos Tercer escape o desvío: eliminado Retraso de Caballo/Jinete: 30 puntos Error en el recorrido no rectificado: eliminado Penalidad por exceso de tiempo: 0.25 puntos por segundo iniciado además del tiempo máximo concedido. (BORJAILLE, 1997). 22 1.5. PARTICIPACIÓN DE LOS CABALLOS Un caballo sólo puede competir en un CCN o CNC desde el principio del año en el que llega a la edad de cuatro años en el nivel promoción. Para el nivel dos estrellas (**) deberán tener cinco años en adelante, para el nivel tres estrellas (***) deberán tener seis años en adelante y para el nivel cuatro estrellas (****), de siete años en adelante (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN). 1.6. CATEGORÍAS Y NIVELES DE LA COMPETICIÓN COMPLETA DE EQUITACIÓN 1.6.1. Niveles Los concursos completos de equitación propiamente dichos se clasifican en cinco niveles de dificultades progresivas. A su vez, dentro de cada uno de los niveles se prevén dificultades mayores o menores en cuanto a distancias, velocidad, número de obstáculos, inclusión o no de las fases de "marchas" y prueba de obstáculos o "steeple-chase" con la finalidad de que los Comités Organizadores puedan escoger y proponer, y la RFHE pueda aprobar el tipo de dificultades idóneo en relación con las características de los terrenos en que el Concurso se dispute, época del año más o menos avanzada de la temporada de competición y otras circunstancias. Por tanto, es de gran importancia detallar en el avance de programa las características concretas que se establezcan para el concurso de que se trate (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). Los Concursos Completos de Equitación podrán ser: - CNC: Pruebas Combinadas sin Marchas ni prueba de obstáculos (Steeple-chase). - CCN: Pruebas de Concurso Completo (con Marchas y prueba de obstáculos opcionales). (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). Tanto los CNC como los CCN, estarán normalmente limitados a jinetes nacionales. Un CNC o CCN, puede ser abierto a un máximo de 6 participantes no residentes, pertenecientes a no más de dos naciones extranjeras (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). La categoría del concurso quedará definida por el nivel de la prueba de mayor dificultad que en él se celebre. Para jinetes que tengan certificada su competencia con el grado de “GALOPES” requerido por la RFHE (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). 23 TABLA 2. Muestra los niveles y condiciones de participación en cada uno de los concursos de CCE, en cada una de las categorías. P Promoción: Iniciación al Concurso Completo Iniciación al CC de participantes y caballos Participantes y caballos con poca experiencia. Mínimo haber terminado, con los resultados calificativos (RC), definidos en el Art. 506, de los concursos de categoría de 0 estrellas Para participantes y caballos con experiencia en pruebas de ** Dos estrellas: una estrella. Mínimo haber terminado, con los resultados calificativos (RC), definidos en el Art. 506, de los concursos de categoría de 1 estrella. Para participantes y caballos experimentados en pruebas dos *** Tres estrellas: estrellas. Mínimo haber terminado, con los resultados calificativos (RC), definidos en el Art. 506, de los concursos de categoría de 2 estrellas. **** Cuatro estrellas Para conjuntos de participantes y caballos con experiencia y éxitos incluso en CCI o CIC. Mínimo haber terminado, con los resultados calificativos (RC), definidos en el Art. 506, un concurso de categoría de 3 estrellas. Tomada de Reglamento de Concurso Completo de Equitación, 2007. 0* * Cero estrellas: Una estrella: Arreo De acuerdo con la modalidad de las pruebas y reglamento de la FEI y CBH. Uniforme De acuerdo con las modalidades de las pruebas y reglas de la FEI y CBH., siendo que para el Campo traviesa y Prueba de obstáculos es obligatorio el uso de chaleco protector, y casco con fijación de tres puntos. (REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN, 2007). 24 TABLA 3. Muestra altura y anchura de los obstáculos. DRESSAGE O DOMA CCN Y CNC Una Estrella (*) 2005 CCI/CIC 1*A (aprox 4 ¼min) o 2005 CCI/CIC 1*B (aprox 4 ¼min) PRUEBA DE FONDO OBSTÁCULOS Alturas/Steeple Fijo Seto Alturas/Cross Fijo seto Anchuras / Steeple & Cross Punto mas alto Base Zanjas Caídas al vacío / Cross Dos Estrellas (**) 2005 CCI/CIC 2* A (aprox 5 ¼ min) o 2005 CCI/CIC 2* B (aprox 5 ¼ min) Tres Estrellas (***) 2005 CCI/CIC 3* A (aprox 5 min) o 2005 CCI/CIC 3* B (aprox 5 min) Cuatro Estrellas (****) 2005 CCI 4* (aprox 5 min) o 2005 CCI 4* B (aprox 5 min) Una Estrella (*) Dos Estrellas (**) Tres Estrellas (***) Cuatro Estrellas (****) 1.00 m 1.40 m 1.00 m 1.40 m 1.00 m 1.40 m 1.00m 1.40 m 1.10 m 1.30 m 1.15 m 1.35 m 1.20 m 1.40 m 1.20 m 1.40 m 1,40 m 2.10 m 2.80 m 1.60 m 1,60 m 2.40 m 3.20 m 1,80 m 1,80 m 2.70 m 3.60 m 2,00 m 2,00 m 3.00 m 4.00 m 2,00 m Tres Estrellas (***) 1.25 m Cuatro Estrellas (****) 1.25 m SALTO DE OBSTACULOS Una Estrella (*) Altura Anchura Punto mas alto Base en triple barra 1.15 m Dos Estrellas (**) 1.20 m 1.40 m 1.50 m 1.60 m 1.60 m 1.90 m 2.10 m 2.30 m 2.30 m Tomada de Reglamento de Concurso Completo de Equitación, 2007. 25 TABLA 4. esfuerzos. Muestra tiempos, distancias, número de obstáculos número de obstáculos y CNC / CAMPO TRAVIESA Velocidad Máxima Distancias Una Estrella (*) 520 mpm 3,000 - 4,160 m Dos Estrellas (**) 550 mpm 4,200 – 4,950 m Tres Estrellas (***) 570 mpm 5,000 – 6,840 m Nº máximo de esfuerzos 30 35 40 Tomada de Reglamento de Concurso Completo de Equitación, 2007. 2. FISIOLOGÍA DEL EJERCICIO La capacidad atlética de un individuo refleja la eficiencia para lograr la velocidad deseada y/o resistencia requerida para realizar un trabajo determinado y depende de los efectos combinados de factores genéticos y ambientales como es el entrenamiento (CARDINET, 1989). El conocimiento sobre la fisiología del ejercicio es realmente la llave para un entrenamiento exitoso de atletas, incluyendo el caballo, las funciones del cuerpo cambian en respuesta a varias situaciones y según las actividades del animal, la función cambia de manera que permite la adaptación favorable a nuevas situaciones, éstos cambios pueden ser bastante dramáticos y eficaces pero están limitados por factores genéticos, nutricionales y de entrenamiento (MUTIS et al., 2005). El ejercicio físico produce diversos cambios en la composición y distribución de los constituyentes sanguíneos, dirigidos a aumentar el aporte de O2, tanto al músculo esquelético como al cardíaco, con el fin de sostener el aumento del metabolismo y facilitar la remoción de los productos metabólicos de desecho (HARRIS et al., 1988). Por lo tanto, el proceso de obtención, transporte y utilización de la energía por el músculo en trabajo, constituye la base de la respuesta fisiológica al ejercicio (MOREHOUSE et al., 1974). La preparación de un caballo para cualquier tipo de competencia involucra una combinación de acondicionamiento y enseñanza. El acondicionamiento produce adaptaciones fisiológicas y estructurales que llevan a maximizar el desarrollo atlético y mantener la aptitud física, mientras que la instrucción desarrolla la coordinación neuromuscular y la disciplina mental. El entrenador diestro integra ejercicios de acondicionamiento con la enseñanza para producir un caballo que es físicamente apto, mentalmente fresco y totalmente preparado para las demandas de la competencia (CLAYTON, 1991). 26 Desde el punto de vista atlético, uno de los principales objetivos del entrenamiento es aumentar la capacidad de consumo de oxígeno, el cual en el equino en ejercicio, puede aumentar hasta 35 veces su valor de reposo (ENGELHARDT, 1977; MARTINEZ, 1989). Este mayor consumo de oxígeno se manifiesta, no solo como una intensificación del metabolismo en el ejercicio, sino también, por cambios adaptativos que se traducen en modificaciones de los niveles de algunos metabolitos sanguíneos en respuesta al ejercicio (MILLER et al., 1986). El entrenamiento, además de incrementar la capacidad del sistema respiratorio y cardiovascular produce un aumento de la masa muscular favoreciendo el rendimiento físico del caballo (RIVERO et al., 1993). Mediante la medición de los constituyentes sanguíneos, es posible determinar las modificaciones fisiológicas y bioquímicas que ocurren como respuesta al ejercicio y entrenamiento al cual son sometidos los caballos. Estudios sobre las adaptaciones hematológicas y bioquímicas en caballos pura sangre de carreras durante y después del ejercicio, han demostrado que la frecuencia cardiaca, la concentración de ácido láctico sanguíneo, el volumen total de glóbulos rojos y la concentración de hemoglobina pueden ser indicadores confiables para evaluar la aptitud física y el nivel de entrenamiento que presenta un caballo para realizar un determinado ejercicio (EVANS et al., 1993; PERSSON, 1983); además, el aumento de enzimas musculares ha sido propuesto como índice de aptitud, donde aquellos animales físicamente menos acondicionados debieran presentar mayores incrementos en la actividad enzimática que aquellos que presentan una mejor condición física (MILNE, 1982). 2.1. BASES ENERGÉTICAS DEL EJERCICIO EN EL CABALLO 2.1.1. Contracción Muscular, Regulación del Mecanismo Contráctil En los mamíferos los músculos comprenden un conjunto de células altamente especializadas que transforman energía química en mecánica como respuesta a acontecimientos excitadores que ocurren en la membrana celular. Esta característica básica determina que los músculos se contraigan generando tensión y produciendo movimiento, lo que permite al animal realizar actividades tan opuestas como estar parado o correr, así como sustentar la función de los diferentes sistemas orgánicos. El caballo es un animal con el doble de capacidad para el trabajo físico que el hombre, lo que le ha permitido en el pasado sobrevivir a sus depredadores. A pesar de esto, sus mecanismos fisiológicos básicos son esencialmente los mismos que en el hombre y otros animales, y solamente los aspectos fisiológicos cuantitativos hacen del caballo un ser físicamente superior (DE LUCA, 2000). El mantenimiento de la contracción muscular durante el ejercicio requiere de la provisión de grandes cantidades de energía química. La fuente inmediata de energía para la locomoción es el ATP. El desdoblamiento de ATP en ADP + Pi proporciona la 27 energía necesaria para la contracción muscular. Cuando la energía se usa para el movimiento; sólo aproximadamente un 25 % de esta energía genera energía mecánica, el resto se pierde en forma de calor. Como resultado de esto, durante el movimiento se produce el desdoblamiento de gran número de moléculas de ATP. (GARCÍA et al, 1995). 2.1.2. Cambios Metabólicos Para realizar un eficaz desempeño en una competencia el individuo depende de la capacidad de su metabolismo para convertir energía química en energía mecánica, lo cual se realiza a nivel muscular. Los componentes de esta conversión son: - Una completa y eficaz interacción entre metabolismos aeróbicos y anaeróbicos en el músculo. - El suministro y la utilización de sustratos disponibles. (DE LUCA, 2000) Otro factor que interviene en el desempeño es el proceso de fatiga, el cual comienza a tomar importancia cuando se agota el combustible intramuscular a pesar de que los sustratos son provistos vía circulación. Así que la capacidad de trabajo físico depende del valor del metabolismo aeróbico y la capacidad del metabolismo anaeróbico de suministrar energía para la continua contracción muscular (GOODMAN et al., 1995). 2.1.3. Producción de Energía por la Célula Muscular Un buen rendimiento durante la carrera depende de que se mantenga el adecuado aporte energético al músculo. Una forma de mejorar el rendimiento es aumentar el ritmo de utilización de energía, por ejemplo, cuando se hace un adecuado uso en la transición del paso al trote y del trote al galope se consigue la máxima eficacia en la locomoción. La cantidad de ATP almacenada en el músculo es muy limitada. Se ha calculado que con estos depósitos solamente se podría mantener la actividad muscular durante unos segundos (GARCÍA et al, 1995). La fuente inmediata para que la célula pueda desarrollar actividad está representada por el ATP, cuyo lugar de síntesis es la Mitocondria. El ATP es hidrolizado en ADP y Pi mediante la Miosina ATP asa (Ver figura No.1). ATP --------------------ATP asa ADP + Energía (Calorías) Un mol de ATP desdoblado proporciona un mol de ADP + 7000 calorías. 28 + Pi Es importante considerar el grado de actividad del músculo que determinará el predominio de un metabolismo aeróbico o anaeróbico, con la consecuente variación en los productos finales de estas vías metabólicas. Por esto durante el reposo o en ejercicios moderados intervienen mecanismos aeróbicos con gran eficiencia en la producción de ATP. A medida que se va intensificando un déficit en el aporte de oxígeno, como consecuencia de una mayor actividad, se producen una serie de mecanismos anaeróbicos que deprimen la eficiencia en la producción de ATP y tiene como producto final el ácido láctico (DE LUCA, 2000). Para que continúe la actividad muscular es necesario que las moléculas de ATP sean resintetizadas. El ritmo al cual se produce esta síntesis debe acoplarse al ritmo con el que se desdoblan las moléculas iniciales de ATP en el músculo para producir energía. Por tanto, cuanto más rápido se mueva el animal, más rápido necesita ser el proceso de regeneración de ATP (GARCÍA et al, 1995). El lugar del cual obtenga el ATP el músculo que trabaja dependerá de la duración y la intensidad del esfuerzo. El caballo Cuarto de milla corre 400 metros con una velocidad máxima de hasta 1200 m/min. Para recorrer esta distancia emplea menos de 20 segundos, y cabe suponer que el 80% del ATP lo obtiene del fosfato de creatinina, el 18% de la degradación anaerobia de la glucosa y solamente el 2% procede del metabolismo aerobio (ver tabla 5). Los caballos Pura sangre, para recorrer la distancia de un derby de 2400 metros necesitan algo más de 2 minutos; cabe suponer que solamente el 5% del ATP necesario procede del fosfato de creatina, el 70% del metabolismo anaerobio y hasta el 25% del metabolismo aerobio de ATP; con el esfuerzo prolongado la fracción aumenta, en las pruebas de concurso completo, en la que los esfuerzos son variables, la fracción aerobia es del orden del 50%; en las marchas de largas distancias llega al 94%. (ENGELHARDT et al., 2004). TABLA 5. Síntesis del ATP necesario para el esfuerzo muscular a partir del fosfato de creatina (PC) mediante el metabolismo anaerobio y aerobio en distintos tipos de esfuerzo del caballo. ESFUERZO PC FORMACIÓN DE ATP ANAEROBIA AEROBIA Carreras Cuarto de milla (400 mt) Derby de PSI (2400 mt) 80% 5% 10% CCE 1% Largas distancias Tomado de ENGELHARDT et al., 2004. 18% 70% 40% 5% 29 2% 25% 50% 94% 2.1.4. Procesos de Abastecimiento Intracelular de ATP Tabla 6. Componentes de los mecanismos aeróbico y anaeróbico. MECANISMO AERÓBICO MECANISMO ANAERÓBICO A) FOSFORILACIÓN OXIDATIVA Sustratos: B) FOSFORILACION ANAERÓBICA Sustratos: a) Ácidos Grasos No Esterificados (AGL) b) Glucosa c) Glucógeno Intramuscular d) Triglicéridos Intramusculares CICLO DE KREBS NIVEL MITOCONDRIA Tomada de GARCÍA et al (1995) a) Fosfocreatina (CP) b) Glucosa Plasmática c) Reservas de Glucógenos locales GLUCÓLISIS NIVEL CITOPLASMÁTICO CELULAR 2.1.4.1. Fosforilación Oxidativa La mayor fuente de energía para la producción de ATP se basa en la oxidación de Ácidos Grasos e Hidratos de Carbono, en la que intervienen enzimas mitocondriales específicas incorporadas en la cadena respiratoria. Esta oxidación conduce a la producción de Átomos de Hidrógeno que serán captados por Coenzimas tales como Nicotinamida Adenindinucleótido (NAD) y Flavín Adenindinucleótido (FAD) para la producción de ATP (ENGELHARDT, et al., 2004). Las fuentes de hidrógeno están dadas por los ácidos grasos y la glucosa. En la lipólisis se liberan ácidos grasos libres (AGL) que serán captados por el músculo esquelético a través de un gradiente de concentración (DE LUCA, 2000). 1. Ya dentro de la célula sufren el proceso de la Beta Oxidación intramitocondrial dando átomos de hidrógeno que entran en la cadena respiratoria y dos carbonos destinados al ciclo del Ácido Cítrico como Acetil CoA; la cantidad de energía obtenida de esta forma depende del número de átomos de carbono que presenta el ácido graso (DE LUCA, 2000). La importancia de la glucosa como fuente de iones hidrógeno está dada en la medida que se incrementa la actividad muscular, la utilización de este azúcar se ve favorecida por la presencia de exoquinasa activada por la Insulina, los procesos finales de la glucólisis son: dos iones hidrógeno y dos moléculas de piruvato (GOODMAN et al., 1995). 30 2.1.4.2. Fosforilación Anaeróbica Ante la instauración de un ejercicio donde el transporte de oxígeno es insuficiente se ponen en marcha una serie de mecanismos anaeróbicos como fuente de producción de ATP. Estos mecanismos son: 1) Fosfocreatina (CP). 2) ADP 3) AMP 4) Glucólisis anaeróbica (DE LUCA, 2000) 1) FOSFOCREATINA (CP) o SISTEMA FOSFAGENO (Sistema de recambio) Órganos como cerebro, corazón y músculo esquelético contienen además de ATP otro compuesto de alta energía denominado fosfocreatina, que no intervendría en forma directa como fuente de energía para la actividad muscular, sino que contribuiría a mantener una concentración adecuada de ATP, cuando éste se está utilizando (DE LUCA, 2000). En este sistema la energía necesaria para la resíntesis de ATP proviene del desdoblamiento del fosfato de creatina (GARCÍA et al, 1995): ADP + ENERGIA + Pi = ATP CP + ADP (Creatinina Fosfato) CPK (Creatinina fosfoquinasa) ATP + C (Creatinina) De esta forma se obtiene una reserva adicional de compuesto de alta energía que es utilizada para episodios repentinos de intensa actividad muscular. (DE LUCA, 2000); estos depósitos pueden mantener un ejercicio durante unos 10 segundos sin el aprovisionamiento de ATP por otras fuentes (GARCÍA et al, 1995). 2) y 3) REACCIÓN DE LA MIOQUINASA (MK) Esta enzima cataliza la condensación de dos moléculas de ADP en un mol de ATP y un mol de AMP. 31 *Es valido aclarar que esta reacción se encuentra en un equilibrio hacia ambos lados en condiciones de reposo. (DE LUCA, 2000). 4) GLUCÓLISIS ANAERÓBIA En este sistema está implicado el desdoblamiento incompleto de un carbohidrato hasta ácido láctico; de ahí que también se denomine “sistema del ácido láctico”. El ácido láctico producido difunde desde el músculo a la sangre, y por medio de la circulación es transportado al hígado donde se convierte en glucógeno; el láctato también puede ser utilizado como sustrato energético por otras fibras o por el miocardio en presencia de oxígeno (GARCÍA et al, 1995). Cuando existe una disminución del aporte de oxígeno tisular se produce una transferencia de los iones hidrógeno producidos por la Glucólisis al Piruvato, que daría como producto final el Ácido Láctico. La finalidad de esto es la liberación del NAD (Nicotinamida Adenindinucleótido) para ser reducido nuevamente. Por cada mol de glucosa degradada en forma anaeróbica se obtienen dos moles de ATP utilizable. Es de destacar que el gradual acumulo de Ácido Láctico intracelular y la concomitante disminución del pH resultan en una inhibición enzimática con una menor producción de ATP (Mecanismo de autorregulación) (DE LUCA, 2000). 2.1.5. Velocidad de Producción de Energía a las Cambiantes Necesidades de la Célula Muscular Cuando la actividad celular se incrementa, la energía adicional proviene del desdoblamiento del ATP, como resultado aumenta la concentración de ADP estimulando el consumo de oxígeno mitocondrial con el consiguiente incremento en la producción de ATP (mecanismos aeróbicos), por intermedio de la fosforilación oxidativa de la cadena respiratoria (GOODMAN et al., 1995). La mayor actividad glucolítica resulta en un aumento de la producción de Ácido Pirúvico para ser incorporado también al Ciclo de Krebs. Es importante destacar que del pool enzimático que interviene en la glucólisis, se considera a la enzima fosfofructoquinasa (PFK) como limitante en esta vía metabólica (DE LUCA, 2000). La estimulación de esta enzima, tiene como consecuencia acelerar la glucólisis, dentro de los mecanismos activadores se consideran: 32 a) Disminución de la concentración de ATP b) Disminución de la concentración de Acido Cítrico. c) Aumento de la concentración de ADP. d) Aumento de la concentración de Fósforo Inorgánico intracelular* * Este punto es esencial ya que una disminución en la concentración de fosfatos dentro del sarcoplasma disminuye la velocidad de la reacción y como consecuencia la producción de ATP es más lenta (acción positiva del 1530 PSC el cual incorpora rápidamente Fosfato inorgánico intracelular) (DE LUCA, 2000). 2.2. TRANSMISIÓN SINÁPTICA, UNIÓN NEUROMUSCULAR Es sumamente importante para comprender las patologías neuromusculares comprender la fisiología de la transmisión neuromuscular. La actividad muscular es controlada por el sistema nervioso central por medio de la inervación motora de las miofibrillas; cada fibra nerviosa motora se desdobla en varias ramas que toman contacto con la superficie de las fibras musculares individuales a través de varias terminaciones en forma de bulbo; estas terminaciones se hallan dispuestas en grupo, y con una estructura especializada de la superficie de la fibra muscular, forman una entidad a la que se denomina unión neuromuscular, unión mioneural, o placa motora terminal (ENGELHARDT et al., 2004). FIGURA 1. Muestra la obtención de energía para la contracción muscular. GLUCOSA GLUCOLISIS ENERGÍA ATP LACTATO PIRUVATO ENERGÍA ENDOXIDACIÓN ENERGÍA Contración Muscular ADP CO2 H2O CREATINA FOSFOCREATINA (Depósito de energía – Sistema de recambio) Tomada de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 33 Como se observa en la Figura 2, la invaginación de la membrana plasmática (sarcolema) de la fibra muscular forma el agujero sináptico del cual sobresale la terminal del axón; el espacio entre la membrana plasmática de la terminal del axón y el sarcolema invaginado se denomina hendidura neuromuscular o espacio sináptico, el sarcolema invaginado (membrana postunión o postsináptica) tiene muchos pliegues (hendiduras subneurales) que aumentan apreciablemente su área de superficie (DE LUCA, 2000). La acetilcolina se acumula en las vesículas sinápticas (sinaptosomas) localizadas en la terminal del axón. La proteína receptora de acetilcolina y la acetilco-linesterasa están asociadas con la membrana posináptica. El potencial de acción conducido a lo largo de la fibra nerviosa favorece la liberación endocítica en la “hendidura” neuromuscular de acetilcolina (Ac) desde los paquetes (vesículas) localizados en las terminales nerviosas; cada una de estas vesículas contiene la misma cantidad de Acetilcolina (aproximadamente 104 moléculas) y que un pequeño número de ellas libera su contenido en forma intermitente desde las terminaciones nerviosas no estimuladas, a ello se deben los Potenciales Mínimos de Placa Terminal (PMPT) por debajo del umbral (DE LUCA, 2000). FIGURA 2. Muestra la placa motora Terminal y sus componentes. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 34 Cuando un potencial de acción llega a las terminales nerviosas de la región de una placa motora terminal hay una mayor permeabilidad a los iones Ca++ que incrementa la liberación endocítica de acetilcolina desde varios centenares de vesículas que se hallan sobre la membrana presináptica de modo tal que el número de moléculas de Ac que se difunde a través del intervalo de unión para que reaccione con proteína receptora de Ac específica en la membrana posináptica, es igual o excede de la cantidad umbral necesaria para la inducción de un potencial de acción en la fibra muscular; el exceso de Ac es rápidamente inactivado por hidrólisis por la acetilcolinesterasa que se encuentra en la superficie de la membrana posináptica. La molécula de Ac está compuesta por seis subunidades (cada uno de ellas con un peso molecular de 40.000) y que una molécula de Ac interactúa con una molécula del receptor para producir un aumento unitario de la conducción de Na+ en la membrana posináptica (ENGELHARDT et al., 2004). En reposo, la diferencia de potencial eléctrico a través de la membrana de la célula muscular (potencial de reposo) alcanza aproximadamente a –90mv. Debido a la diferencia de concentración de los iones Na+ (muy elevada en el exterior de la fibra) e iones K+ (elevada en el interior de la fibra) y al hecho de que la formación de un complejo Ac-Receptor provoca el incremento de la permeabilidad de la membrana posináptica, la liberación de cantidades umbral de Ac en la hendidura de la unión neuromuscular da origen a una entrada repentina de iones Na+, y a la salida de iones K+ a través de la membrana plasmática (GARCÍA et al., 1995). 2.2.1. Cationes en la Función Neuromuscular La función del mecanismo neuromuscular depende en un alto grado de la distribución de los cationes Na+, K+, Ca++ y Mg++ en los fluidos intra y extracelulares. Estos cationes son los responsables de establecer la excitabilidad de reposo normal a estas estructuras (DE LUCA, 2000). Los iones Ca++, K+, Na+, son los responsables del potencial de acción y de la normal contracción del músculo esquelético, los iones Ca++, y Mg++ controlan la transmisión de la actividad desde la fibra nerviosa hacia las fibras musculares, por lo tanto es lógico que una distribución anormal de estos iones entre el fluido intra y extracelular resulte en un mal funcionamiento del mecanismo neuromuscular. Cuatro tipos de anormalidades son producidos por disturbios en la distribución de estos cationes: 1. Las membranas celulares de los nervios y músculos se tornan hiperpolarizadas por lo tanto es muy dificultoso excitarlas (paresias). 2. Estas membranas se tornan despolarizadas por lo tanto hay una hiperexitabilidad con tetania muscular seguida con pérdida de excitabilidad y parálisis del músculo esquelético. 35 3. La transmisión de la actividad a través de la unión neuromuscular puede estar interrumpida y esto resulta en parálisis. 4. El mecanismo de la contractibilidad puede estar interferido directa o indirectamente, esto resulta en parálisis. (GOODMAN et al., 1995). Estos mecanismos serán analizados para poder diagnosticar distintos síndromes paréticos en los equinos y bovinos. El normal funcionamiento de las células nerviosas y musculares depende de los cambios en el carácter de su membrana. Comprender las propiedades de estas membranas y su relación con varios iones entre los fluidos intra y extracelulares sirve como base para explicar varios desórdenes neuromusculares. Las células nerviosas y musculares tienen una propiedad en común: la excitabilidad, que no es más que los cambios bioeléctricos que se producen en respuesta a alteraciones en el medio que las rodea. Las células musculares también poseen la habilidad de contraerse y acortarse. Las propiedades de excitabilidad y contractibilidad son dependientes de la característica de la membrana celular y de varios iones entre el fluido intra y extracelular (IC y EC) (GARCÍA et al., 1995). 2.2.1.1. Potencial de membrana en reposo (PMR) Todas las membranas excitables poseen una separación de cargas a través de su membrana celular llamada potencial de membrana en reposo (Ver Figura 3). En las células de nervios y músculos, el Potencial de Membrana de Reposo (PMR) es tal que el compartimiento intracelular es negativo relativo al extracelular en una magnitud de cerca de –80 mv (DE LUCA, 2000). Si examinamos el medio ambiente de la membrana celular y algunas de sus propiedades relativas a los iones, veremos la forma por la cual el PMR es establecido y mantenido. Dentro de las células hay grandes concentraciones de K+ y de A- (aniones orgánicos) y pequeñas concentraciones de Na+ y Cl-. Fuera de la membrana celular, en el líquido extracelular, (LEC) se encuentran grandes concentraciones de Na+ y Cl- y bajas concentraciones de K+, estos iones juegan un rol significativo para establecer y mantener el PMR (DE LUCA, 2000). La membrana celular es altamente permeable al K+, levemente impermeable al Na+ y Cl, y completamente impermeable a los A-. Entonces, en condiciones de reposo, debido a la diferencia de concentración a través de la membrana celular, las células nerviosas y musculares esqueléticas están continuamente perdiendo K+ desde el fluido IC al EC, por lo tanto, como los grandes aniones orgánicos no pueden difundir hacia fuera de las células y teniendo los mismos cargas negativas, generan un estado electronegativo por dentro de la membrana celular, mientras que el K+ difunde hacia el LEC produciendo cargas positivas en el lado EC. La difusión de iones Na+ y Cl- en las células en reposo es insignificante, por lo tanto, no contribuyen sustancialmente al establecimiento del PMR 36 que es establecido primariamente por la difusión del ión K+ fuera de la célula generando el denominado “Potencial de Difusión del ión K+” (GARCÍA, 1995). El rango por el cual el ión K+ difunde a través de las membranas está determinado por tres factores: 1. La permeabilidad de la membrana al K+. 2. La diferencia de concentración del K+ entre compartimientos IC y EC. 3. La magnitud de PMR. La permeabilidad de la membrana al ión K+ está determinada en gran medida por la concentración del ión Ca++ extracelular. Cuando la concentración del ión Ca++ está aumentada, la membrana se torna menos permeable al K+, por el contrario, disminuyendo la concentración de Ca++ EC la membrana se hace más permeable al K+ (DE LUCA, 2000). FIGURA 3. Distribución del K+, Na+, Cl- y grandes aniones orgánicos. Distribución del K+ (baja concentración EC, alta concentración IC), Na+ (alta concentración EC, baja concentración IC), Cl- (alta concentración EC, baja concentración IC) y grandes aniones orgánicos (A-) (limitados al espacio IC). La dirección de la difusión producida por la diferencia de concentración a través de la membrana está ilustrada por las flechas. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 37 El Ca+ juega un rol significativo en la determinación del rango de la difusión del K+ hacia el exterior y, por lo tanto, contribuye al PMR de las células nerviosas y musculares. La diferencia de concentración de K+ entre el interior y el exterior de la membrana determina el rango con el cual éste ión difunde a través de la misma; esta diferencia genera la fuerza de difusión (GARCÍA et al., 1995). 2.2.1.2. Potencial de Equilibrio iónico de K+ Cuando la difusión hacia afuera de la célula iguala a la difusión hacia la célula, se dice que la membrana está en equilibrio de K+. El Potencial de Equilibrio del músculo esquelético y de los nervios es cercano a los –90 mv. A este nivel, el Potencial de Membrana ejerce una fuerza sobre el K+ que tiende a conducirlo hacia el interior de la célula al mismo rango al cual la difusión de concentración tiende a conducir K+ hacia afuera. Entonces, el equilibrio está establecido. (Ver Figura 4) (DE LUCA, 2000). Figura 4. Muestra el potencial de equilibrio iónico del K+. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 38 2.2.1.3. Potencial de acción de la membrana (PA) Cuando el Potencial de Membrana de una célula muscular o nerviosa es reducido, hay un punto en el cual ocurren cambios espontáneos en el mismo (referido como potencial de Acción) (DE LUCA, 2000). Figura 5. Muestra el potencial de acción de la membrana. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 Los cambios en el Potencial de Membrana (Ver Figura 5), una vez que el estímulo llega al umbral siguen la ley del “todo o nada”, es decir, se tiene una respuesta, sea cual fuera la intensidad del estímulo usado para despolarizar la célula. Inmediatamente, como el PA está establecido, hay un importante aumento en la permeabilidad de la membrana de Na+. Entonces, el ión Na+ se mueve desde el fluido EC hacia el fluido IC, disminuyendo el Potencial de Membrana establecido, como se ha dicho anteriormente, por la difusión hacia el exterior del ión K+ (DE LUCA, 2000). El rango de difusión hacia el interior del Na+ está gobernado por las mismas propiedades que influencian la difusión del K+: 1. La permeabilidad de la membrana al Na+ 39 2. La difusión de concentración del Na+ entre el compartimiento EC e IC 3. La magnitud del Potencial de Membrana (GARCÍA et al., 1995). Los cambios de permeabilidad que ocurren con el Na+ durante el PA están gobernados en gran medida por la concentración EC de Ca++. La fuerza que conduce al Na+ dentro de la célula es, como en el caso del K+, la diferencia de concentración. Cuando el ión Na+ entra en la célula, genera que el interior de la célula se torne positivo. La amplitud de este cambio en el Potencial de Membrana está determinada por el rango en el cual el ión Na+ difunde dentro de la célula, y la longitud de tiempo durante el cual esta difusión ocurre. El aumento de la positividad dentro de la célula y de negatividad en el exterior tiende a disminuir la capacidad de difusión de Na+ (ENGELHARDT et al., 1995). El Potencial de Membrana en el cual la fuerza de conducción del ión Na+ dentro de la célula (diferencia de concentración entre el fluido IC y EC) y la fuerza de conducción hacia fuera de la misma (adentro positiva y afuera negativa) son iguales, se denomina “Potencial de Equilibrio del ión Na+”; este último, es cercano a los +60 mv. En el interior positivo, (Ver Figura 5). Entonces, durante el período de aumento de permeabilidad al ión Na+, el Potencial de Membrana tiende hacia el Potencial de Equilibrio para el ión Na+, y la membrana está “Despolarizada”. El aumento de permeabilidad al ión Na+ producido por un umbral de despolarización es de corta vida, y la permeabilidad al ión Na+ retorna rápidamente a los niveles de reposo (DE LUCA, 2000). Durante el tiempo en el cual la permeabilidad del ión Na+ retorna a niveles de reposo, hay un aumento en la permeabilidad de membrana para el K+. Entonces, el K+ es más efectivo en ocasionar el PM, y tiende hacia el “Potencial de Equilibrio del ión K+”; el aumento efectivo de la difusión del ión K+ y la disminución de la difusión del Na+ provoca que el Potencial de membrana retorne rápidamente hacia el Potencial de Reposo, el PA producido por la membrana de la célula excitable, es propagado desde una porción de la membrana a la otra; esto ocurre porque la despolarización producida por el rápido influjo de ión Na+ causa un flujo de corriente que despolariza la membrana adyacente, la cual aumenta su permeabilidad al Na+ y produce el PA, (Ver Figura 6) (DE LUCA, 2000). 40 Figura 6. Muestra la propagación del potencial de acción de membrana. Fig. 11 Propagación del potencial de acción de membrana Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 El “nuevo” PA en este punto, genera, a su vez, otros PA en la membrana adyacente. Así, el PA original se mueve a lo largo de la superficie de la membrana celular. La velocidad a la cual se mueve el PA está determinada por diversos factores, uno de los más importantes es el rango al cual la membrana pueda cambiar su permeabilidad al Na+ y al K+. Esto está gobernado en alto grado por la concentración de ión Ca++ extracelular (DE LUCA, 2000). Con aumentos de Ca++ extracelular, los cambios de permeabilidad al Na++ y K++ ocurren realmente en poca medida; con disminución del Ca++ extracelular, los cambios de permeabilidad al Na+ y K+ ocurren muy rápidamente y la velocidad de conducción está aumentada. En definitiva, con aumentos de Ca++ extracelular la membrana celular tiene menor excitabilidad, y con disminución de Ca+ extracelular la membrana tiene un alto nivel de excitabilidad. (HOUDGSON et al., 1994). 2.3. TRANSMISIÓN NEUROMUSCULAR El PA no es producido espontáneamente en el músculo esquelético, está siempre precedida por un PA en la fibra nerviosa que inerva la célula muscular; el PA dentro de 41 la fibra nerviosa no es conducido directamente sobre la membrana del músculo esquelético, sino que produce una actividad sobre esta membrana a través de la acción de la Unión Neuromuscular (Ver Figura 2) (DE LUCA, 2000). La Unión Neuromuscular, (Placa Terminal), es un mediador de actividad entre el nervio y el músculo. Cuando el PA de una fibra nerviosa llega a la placa terminal, causa una descarga de Acetil-Colina (producida y depositada en las vesículas postsinápticas). La Acetil-Colina, entonces, entra a la unión entre el nervio terminal y el músculo esquelético, se difunde a través de las vellosidades y se une a la superficie externa de la membrana muscular. Esta unión produce un aumento en la permeabilidad al Na+, Cl- y K+. Todos estos iones difunden muy rápidamente hasta igualar su diferencia de concentración a través de la membrana celular (GARCÍA et al., 1995). El Potencial de Membrana, a este punto, sobre la superficie de la membrana tiende a ser cero, y la misma es, entonces, despolarizada; esta despolarización local causa un flujo de corriente que produce despolarización en la membrana muscular adyacente, cuando la membrana muscular adyacente es despolarizada hacia el umbral el PA se produce y se propaga por todo el músculo. La capacidad de esta transmisión neuromuscular a través de la placa motora terminal depende de la facilidad de descarga de la Acetil-Colina por el nervio terminal, la disminución de la concentración de Ca++ resulta en una disminución de la descarga de Acetil-Colina y una mayor dificultad de transmisión. Si la concentración de Ca++ extracelular disminuye suficientemente, la transmisión del nervio al músculo se bloquea y se produce parálisis del músculo esquelético. El ión Mg+ también juega un rol en la descarga de Acetil-Colina desde el nervio terminal a la unión neuromuscular; una alta concentración de Mg+ extracelular resulta en una disminución de la descarga de Acetil-Colina y provoca un bloqueo parcial de la transmisión. El aumento puede ser aún mayor, y en ese caso, puede provocar una parálisis del músculo-esquelético por un bloqueo total de transmisión. Una baja concentración de Mg++ extracelular resulta en un aumento de la descarga de AcetilColina y un aumento de actividad del músculo esquelético, llevando a una tetania por una continua presencia de Acetil-Colina sobre la superficie de la membrana celular. El ión Ca+ y Mg+ ejercen efectos opuestos sobre la transmisión neuromuscular y pueden producir tetania o parálisis, dependiendo de las concentraciones relativas de estos iones (DE LUCA, 2000). 2.3.1. Anormalidades en la Distribución Catiónica 2.3.1.1. Calcio Moderadas elevaciones del nivel de Ca++ en el fluido EC puede no tener influencias clínicas detectables sobre la función neuronal. Cuando la hipercalcemia es extrema, la excitabilidad de estos tejidos está disminuida, pues ante un aumento del Ca ++ se produce una reducción de la permeabilidad al Na+ y K+. Al disminuir la salida de K+, se genera un estado de despolarización por una gradual pérdida del Potencial de Reposo (Potencial 42 de Equilibrio del K+). El efecto concomitante del Ca++ sobre la difusión del Na+, previene el rápido aumento de permeabilidad de este ión que es responsable del PA; esto produce una disminución del PA y hay una depresión de la excitabilidad celular (DE LUCA, 2000). Una leve disminución de Ca++ EC resulta en un marcado aumento en la excitabilidad de células nerviosas y musculares, llevando al estado tetánico, seguido de paresias y luego parálisis de la función neuromuscular. Estos signos están producidos por el aumento en la permeabilidad de la membrana celular de nervios y músculos a los iones Na+ y K+, lo cual resulta en una despolarización en bloque de estas membranas, con un estado final de hiperexcitabilidad. Como la membrana celular permanece despolarizada más allá del umbral por un prolongado período de tiempo, la misma se torna hiperexcitable e incapaz para producir un PA, derivando esto en una parálisis. El signo hipocalcémico está aumentado en condiciones en que el K+ EC aumenta su concentración (HOUDGSON et al., 1994). TABLA 7. Trastornos en la locomoción causados por desbalances minerales. Bajo Ca++ Alto K+ Paresia (Alert Downer Síndrome o síndrome de vaca caída). Parálisis en equinos en entrenamiento. El animal es más fácilmente excitable debido a una hiperpotasemia, pero parética debido a una hipocalcemia. Bajo Ca++ Bajo K+ Paresia Alto Ca++ Alto K+ Paresia con tetania. Alta descarga de acetil-colina: Alto K+ (tetania focal) Bajo umbral de excitabilidad: alto K+ Bajo Ca++ Bajo Mg++ Convulsiones seguidas por parálisis, (a no ser que el animal haya muerto en convulsiones). Una marcada caída del Mg++ solo causa un espontáneo aumento de descarga de acetil-colina, con una consecuente tetania. Una pequeña caída del Mg++ solo no tiene efecto; sin embargo una moderada disminución de Ca++ cuando el Mg++ cae muy poco, dispara una serie de convulsiones debido al PMR combinado con el efecto de hipomagnesemia sobre la descarga de acetil-colina. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 Esto tiende a disminuir la difusión del K+ desde el interior de las células, y reduce el Potencial de Membrana en las células en reposo. Entonces, se observa despolarización debido a un aumento de K+ EC y los signos clínicos ocurren más rápidamente. Este tipo 43 de síndrome está ejemplificado por algunas paresias parturientas o Síndrome de Fiebre Vitular, en la cual la concentración de ión Ca++ EC está disminuida y la del ión K+ EC está aumentada (Ver Tabla 7) (DE LUCA, 2000). 2.3.1.2. Magnesio La hipermagnesemia o aumento de la concentración de Mg++ EC raramente ocurre en los animales domésticos pero puede estar inducida por una administración impropia de sales de magnesio, particularmente en animales con deficiencias renales. Altas concentraciones de Mg++ resultan en depresión del SNC (coma), disminuyendo la transmisión neuromuscular y la contracción muscular. Entonces, ocurre parálisis y lleva todo esto a un fallo respiratorio y muerte. No se tiene diagnosticada una real hipermagnesemia que resulte en un síndrome parético en vacas, pero sí es muy común y lo vemos en el 80% de los casos de Fiebre Vitular Comatosa (Coma del puerperio) una hipocalcemia con normo- o hipermagnesemia e hipopotasemia (DE LUCA, 2000). La hipomagnesemia ha sido incriminada en severos síndromes paréticos en el ganado, como es la “Tetania de los Pastos” o “Mal de los Avenales”. Una disminución en la concentración de Mg++ EC inicia una pérdida de K+ desde las células con acumulación de K+ en el fluido EC. Una simple hipomagnesemia puede ir asociada, y así lo es usualmente, a un aumento en la concentración de los iones Ca++ y K+ EC. El aumento de Ca++ y K+ EC resulta en una despolarización de las membranas celulares de nervios y músculos. Los signos clínicos son una inicial hiperexcitabilidad que puede estar manifestada como tetania seguida por parálisis de la función neuromuscular (GARCÍA et al., 1995). 2.3.1.3. Potasio Un aumento de la concentración de K+ está reportado en algunos síndromes paréticos en el ganado (Ver tabla 7); la alta concentración EC de K+ disminuye la difusión de este ión desde el interior de la célula al exterior, el mayor e importante factor responsable de establecer y mantener el PMR. Si las membranas de las células musculares y nerviosas están despolarizadas e hiperexcitables los signos son convulsiones y tetania, la espasticidad muscular o tetania es comúnmente seguida por una parálisis flácida; la espasticidad del músculo esquelético está producida por despolarización de las terminales nerviosas en la unión neuromuscular y una continua descarga de AcetilColina la cual causa rápidas producciones de PA en el músculo esquelético (DE LUCA, 2000). 44 Tabla 8. Efecto del desbalance catiónico sobre la función neuromuscular. Catión Estado Ca++ Hipercalcemia Ca++ Hipocalcemia Mg ++ Mg++ K+ Na+ Potencial de reposo Membrana celular en reposo Alta excitabilidad debido al efecto sobre la permeabilidad del K+; luego baja excitabilidad debido al bloqueo catodal Alta excitabilidad debido al efecto sobre la permeabilidad del Na+ y K+, luego disminuye Impulso nervioso Unión contaractiblidad Efectos neuromuscular muscular Baja Alta descarga Fuerte excitabilidad de Acetilcolina contracción Parálisis debido a tetania. Mas tarde paresia Alta Baja descarga Débil excitabilidad de Acetilcontracción , luego baja Colina Paresia Baja, interfiere Baja descarga con la interacción de AcetilParesia Ca++Colina Actinomiosina Hipermagnese mia Alta excitabilidad debido al efecto Hipomagnesem Alta sobre la ia excitabilidad permeabilidad del Na+ y K+ Alta Alta excitabilidad, excitabilidad seguida por baja seguida por excitabilidad si la Hiperpotasemia baja Hiperpotasemia se excitabilidad mantiene (bloqueo (bloqueo catodal) catodal) Baja excitabilidad Bajaexcitabi Hiposodemia PMR aumentado lidad Alta descarga de Acetil- Alta Colina Tetania seguida por paresia Alta descarga Paresia Alta y luego baja de Acetilcolina tardía Bajadescarga Baja excitabilidad Paresia Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 No es raro observar en estos animales que algunos músculos presentan una serie de rápidas contracciones musculares (fibrilación) y otros músculos están contraídos espásticamente. En condiciones de alta concentración EC de K+ y con bajas concentraciones de ión Ca++ EC la parálisis muscular es el signo más común (GARCÍA et al, 1995). La caída EC de K+; deriva en una disminución de la excitabilidad de las células musculares y nerviosas. Esta disminución lleva a una más rápida difusión desde el 45 interior de la célula, lo que causa que el Potencial de Membrana se establezca cerca del Potencial de Equilibrio para el ión K+ y produce una hiperpolarización; sin embargo, el PMR está más lejos del PU y, por lo tanto, hay más dificultad para iniciar la actividad en ambas membranas, nerviosa y muscular. El síndrome producido por un descenso en la concentración del ión K+; está caracterizado por debilidad seguida de parálisis flácida. Esta hipopotasemia generalmente acompaña de otras alteraciones catiónicas como Hipocalcemia hiper-magnesémicas (Coma Vitular) (ENGELHARDT et al., 2004). 2.4. EVALUACIÓN DE LOS MÚSCULOS La evaluación necesita de la aptitud deportiva y de la eficiencia del entrenamiento del caballo, puede ser realizada, objetivamente, por la tipificación y morfometría de las fibras musculares. Se sabe que la tipificación y la morfometría, revelan los tipos de fibras, sus porcentajes y las áreas relativas, permitiendo estimar la tendencia de este atleta en tener o no un buen desempeño deportivo (DE LUCA, 2000). El volumen total del músculo es constituido de 75 a 90% de miofibras, además de células adiposas, fibroblastos, vasos capilares, nervios y tejido conjuntivo, cuya composición proporcional puede variar conforme el músculo. Las miofibras son compuestas de miofibrillas que constituyen las unidades básicas necesarias para la contracción muscular (GARCÍA et al., 1995). Las miofibras poseen dos tipos de fibras, a saber: - Fibras de tipo I, de contracción lenta, altamente oxidativas. Fibras de tipo II, de contracción rápida, presentando subtipos IIA, IIB y IIC; siendo las de tipo IIA altamente oxidativas, y las de los tipos IIB y IIC con baja propiedad oxidativa. (DE LUCA, 2000). Estas características, aliadas al porcentaje de cada fibra y su área relativa posibilitan estimar el perfil de la capacidad de trabajo del atleta. La tipificación por exámenes histoquímicos y morfometría del músculo es realizada en muestras cogidas por biopsia de los músculos glúteo medio derecho e izquierdo, sin perjuicio estético o funcional del caballo (DE LUCA, 2000). Caballos de carreras en entrenamiento, presentan una alta concentración de fibras de tipo IIA y menores de tipo IIB, cuanto a los exámenes de sus fragmentos de biopsia son comparados a los de animales de carreras mantenidos por largos períodos sin ejercicio (sedentarios). En cuanto a las fibras de tipo I, estas no presentan diferencias significativas en el proceso comparativo, demostrando una dependencia estricta del desarrollo en la producción de energía aeróbica en los músculos locomotores. Es una prueba que caballos de carreras con mejores índices de desarrollo poseen mayores áreas de las fibras de tipo IIA, en relación a las del tipo IIB, y menores áreas de las fibras de 46 tipo I, y en un mayor potencial oxidativo en el tejido muscular. Por otro lado, caballos que actúan en pruebas de resistencia, por tanto sometidos a trabajo aeróbico y con excelente desempeño atlético, poseen los más altos porcentajes y áreas relativas de fibras de tipo I y IIA, y menores porcentajes y áreas relativas de fibras de tipo IIB (GARCÍA et al., 1995). Con base en las características histoquímicas y morfométricas de la fibra muscular, es posible establecerse casi con precisión, un índice músculo fisiológico para cada caballo, demostrando su aptitud deportiva y posibilitando la incorporación de modelos de entrenamiento que estimulen las modificaciones de las características de las células musculares, de forma a que atiendan a la demanda de contracción y relajamiento, conforme sea el ejercicio aeróbico o anaeróbico (THOMASSIAN, A., 2000). 2.4.1. Adaptación Muscular al Ejercicio y al Entrenamiento La masa muscular del equino comprende la tercera parte del peso corporal total. Esta es parte integral que permite mantener el desempeño durante el ejercicio. Por otro lado el músculo esquelético es uno de los tejidos más plásticos del cuerpo, lo que le permite adaptarse a más rápidos cambios durante una actividad física (DE LUCA, 2000). Dentro del sistema locomotor la mayoría de los músculos están compuestos por un conjunto de “unidades motoras” de propiedades contráctiles diferentes. Dentro de ellas se consideran: a) El tiempo necesario para llegar al pico de tensión máxima en una contracción nerviosa. b) La estrecha relación del tiempo necesario para llegar a la hemirrelajación que le sigue al inicio de un ciclo contráctil simple. c) Esto nos permite identificar dos tipos de fibras musculares y por ende dos clases de “unidades motoras”: 1.) “Unidad Motora” que requiere un tiempo relativamente largo para alcanzar el pico de tensión máxima y que se conoce como “Fibra de Contracción Lenta”. (FCL) 2.) “Unidad Motora” que requiere un tiempo relativamente corto para alcanzar el pico de tensión máxima y se conoce como “Fibra de Contracción Rápida”.(FCR). Las FCL y las FCR, se han denominado fibras de tipo 1 y 2 respectivamente. (GARCÍA et al., 1995). 47 2.4.2. Bases Moleculares para las Propiedades Contráctiles Una de las mayores determinantes de la contractilidad es la velocidad en que la Miosina desdobla el ATP; esto es conocido como la actividad ATPásica. Se ha establecido una correlación lineal entre la actividad ATPasa de la Miosina (Miofibrillas) y la velocidad de la contracción de la fibra muscular. Las diferencias en la actividad ATPasa específicas son atribuibles a la presencia de formas multimoleculares proteicas denominadas “Isoenzimas” (DE LUCA, 2000). Como método de identificación de las isoenzimas de la Miosina, consiste en la pérdida de la actividad ATPasa de la misma como respuesta a los cambios de pH. La Miosina de las FCR son estables a pH alcalino y lábiles ante la presencia de un ácido; mientras que ocurre lo opuesto con las FCL. A pH 10,5 se pierde la tinción ATPasa dependiente de fibras FCL, con la consiguiente tinción de las FCR, inversamente cuando se incuban a pH 4,35 hay pérdida de tinción dependiente de la FCR y se tiñen las FCL. Igualmente algunas fibras se tiñen de diferentes tonos de acuerdo a cambios de pH, o de concentración iónica, lo que permitiría establecer subgrupos. Para las fibras FCR existen Subgrupo A, B y C, estas últimas encontradas en equinos adultos (GARCÍA et al., 1995). 2.4.3. Propiedades Metabólicas de la Unidad Motora En el estudio de las fibras musculares esqueléticas se ha demostrado que las FCL poseen elevadas concentraciones de enzimas asociadas al Ciclo de Krebs (Ciclo de Acido Cítrico), y a la cadena respiratoria, con una gran capacidad de captación de oxígeno y son pobres en enzimas involucradas en la degradación anaeróbica de hidratos de carbono, glucógeno muscular y glucosa sanguínea a lactato. En contraste las FCR se pueden separar en aquellas que poseen un potencial relativamente alto en consumo de oxígeno, considerándose a estas FCR sub A, por poseer un alto número de mitocondrias, y las que poseen un número relativamente bajo de mitocondrias las FCR sub B. Igualmente todos los tipos de fibras pueden alterar su capacidad metabólica encontrándose en algunos individuos FCR sub B de elevada capacidad oxidativa. Tanto las FCR sub A y las FCR sub B son ricas en enzimas glucolíticas (ENGELHARDT et al., 2004). Es interesante notar que existe un incremento en la relación FCR sub A/ FCR sub B observado en equinos con distintos programas de entrenamiento. Los cambios observados precedentemente ocurren en forma paralela a un aumento en la capacidad oxidativa del músculo (aumento del número de enzimas oxidativas). Consecuentemente sería posible entonces que la fibra muscular no solo aumente su capacidad oxidativa, sino que exista una interconversión del subtipo de fibras en respuesta al tipo de entrenamiento, siendo esta característica metabólica directamente relacionada a diferentes metabolismos energéticos (GARCÍA et al., 1995). 48 2.4.4. Cambios del Músculo Esquelético Durante el Ejercicio Los estudios efectuados para evaluar la depleción de glucógeno durante el ejercicio han demostrado que diferentes unidades motoras o combinaciones de ellas, se restablecen o reabastecen en un grado que depende del ejercicio realizado. El control sobre estos patrones se basa en el principio general de la diferencia de tamaño de la motonerurona que inerva la fibra. Las de menor diámetro serían las más fáciles de activar. Las FCL están inervadas por las motoneuronas más pequeñas y son siempre las primeras en activarse (DE LUCA, 2000). Por el tipo de disposición le sigue a esta activación, la de nuevas unidades motoras que se van agregando de una manera sistemática para proveer un ordenado incremento en la capacidad del músculo de desarrollar una fuerza. En los equinos existe un reclutamiento sistemático de las unidades motoras durante diferentes condiciones de ejercicio. En prolongados ejercicios submaxilares (ejemplo: cabalgata continua) se produce un reactivamiento que involucra al principio solamente FCL y algunas FCR sub A. En la medida que la duración o la intensidad del ejercicio aumenta, se incrementa el número de FCR sub A, a las que le sigue el reclutamiento de las FCR sub B, y cuando nos aproximamos al agotamiento todas las unidades motoras independientemente del tipo, han sido utilizadas. Esto ocurre sin que se observen cambios en la fuerza desarrollada y en la energía producida durante el curso de la actividad muscular, lo que sugiere que en ejercicios submaxilares prolongados, algunas unidades motoras se agotan no participando en el proceso contráctil, mientras otras nuevas se van agregando. A diferencia de lo que ocurre en condiciones de ejercicio con una producción de tensión máxima, donde es necesaria la participación de todos o casi todos los tipos de fibras musculares desde el momento mismo de iniciado el ejercicio (DE LUCA, 2000). 2.4.5. Adaptación de la Fuente de Energía al Tipo de Trabajo que se Realiza Cuando un caballo trabaja puede utilizar más de una fuente de energía al mismo tiempo. La cantidad relativa de las diferentes fuentes de energía para resíntesis de ATP depende de factores como la intensidad del ejercicio, sudoración y el estado de forma del caballo (DE LUCA, 2000). 2.4.5.1. Reposo En condiciones de reposo alrededor de 2/3 partes del sustrato energético lo proporcionan las grasas y el otro tercio restante los carbohidratos. En estas condiciones, el único sistema energético que opera es el sistema aeróbico, ya que el sistema de transporte de oxígeno es capaz de suministrar a cada célula suficiente oxígeno para suplir las necesidades de ATP en un estado de reposo (GARCÍA et al., 1995). 49 2.4.5.2. Ejercicio a) Ejercicio de corta duración. En este tipo de ejercicio el principal sustrato energético son los carbohidratos y en menor proporción las grasas. El sistema metabólico predominante es el anaerobio. Como consecuencia el ATP debe suministrarse vía Fosfágeno y Glucólisis Anaerobia; como el único sustrato energético en este tipo de ejercicio es el glucógeno muscular, al mismo tiempo que se produce su depleción, ocurre acumulación de ácido láctico. Estos dos hechos causan fatiga muscular. Niveles de 4 mMol/L se consideran concentraciones en las que se produce una acumulación de lactato significativa en un ejercicio inducido y, por lo tanto, niveles de umbral anaerobio (ENGELHARDT et al., 2004). b) Ejercicios prolongados Para este tipo de ejercicio los substratos energéticos empleados son los carbohidratos y las grasas. En un ejercicio prolongado (2 horas) el principal sustrato energético al comienzo del ejercicio es el glucógeno, mientras que al final son las grasas. El cambio de sustrato se hace de forma gradual, a la vez que se vacían los depósitos de glucógeno del hígado y los músculos. A medida que el ejercicio se hace más intenso aumenta el porcentaje de glucosa utilizado y disminuye el de ácidos grasos, hasta que se llega a un nivel de intensidad de trabajo en que solo se utiliza la glucosa. Este cambio de sustrato energético, de los ácidos grasos a la glucosa, se hace gradualmente, y se produce porque las células musculares de contracción rápida (FCR) no pueden obtener energías de los ácidos grasos y porque la glucosa proporciona un mayor rendimiento, una disponibilidad dada de oxígeno. Por lo tanto, en velocidades lentas, como el paso y el trote, cuanto más se prolongue el ejercicio, mayor será la proporción de ácidos grasos utilizados. La proporción de ácidos grasos utilizados a una velocidad dada es mayor en caballos con mayor entrenamiento (GARCÍA et al., 1995). Uno de los efectos del entrenamiento es aumentar la cantidad de enzimas responsables del desdoblamiento de los ácidos grasos. La ventaja es que permite de esta manera ahorrar glucógeno durante el ejercicio, lo cual es muy importante cuando se consideran las causas de la fatiga. La mayor parte del ATP proviene del metabolismo aeróbico. Los sistemas Anaeróbicos y Fosfágeno participan, pero solamente al principio del ejercicio, antes de que el consumo de oxígeno alcance el estado estacionario. Durante este tiempo se aprecia un déficit de oxígeno. Una vez que el consumo de oxígeno alcanza el estado estacionario, es suficiente para suministrar todo el ATP requerido para el ejercicio. Una vez que se alcanza el estado estacionario de consumo de oxígeno, la glucólisis anaeróbica se detiene, pero las pequeñas cantidades de ácido láctico acumuladas anteriormente se mantienen relativamente constantes hasta el final del ejercicio (DE LUCA, 2000). La fatiga experimentada por esta actividad se debe a factores como: niveles bajos de glucosa por depleción de los depósitos de glucógeno hepático, fatiga muscular local por 50 depleción de glucógeno muscular, deshidratación por pérdida de agua y electrolitos, con lo que se aumenta la temperatura corporal. La capacidad de producir energía por el metabolismo aeróbico depende de la cantidad de oxígeno que pueda utilizar la mitocondria que es la cámara de combustión de las células, lo que depende que se haya liberado suficiente oxígeno a las células musculares. Como el oxígeno proviene del aire que el caballo respira, los factores que pueden influir en este aporte se pueden resumir en: 1) Ventilación pulmonar. 2) Paso del oxígeno de los pulmones a la sangre. 3) Capacidad de transporte de oxígeno por la sangre. 4) Paso del oxígeno de la sangre al músculo. (DE LUCA, 2000). La cantidad de oxígeno que utiliza el organismo se denomina “consumo de oxígeno”. Se mide como el número de mililitros consumidos por kilogramos de peso por minuto (ml/KPV/min.) El consumo se expresa como VO2 y la cantidad máxima que puede ser utilizada se denomina VO2máx. El VO2 máx está determinado genéticamente, dependiendo fundamentalmente del entrenamiento y del tamaño corporal. Cuando un caballo realiza un ejercicio, la cantidad de oxígeno que consume aumenta proporcionalmente a la velocidad del trabajo realizado, hasta alcanzar un nivel por encima del cual no hay aumento. A partir de una velocidad de 40 Km/h el empleo de oxígeno no se incrementa al aumentar la velocidad. En estos la VO2 máx es de 64,2 litros de O2 / min (GARCÍA et al., 1995). 2.4.6. Interacción de los Sistemas Aerobios y Anaerobios Durante el Ejercicio Existen evidencias físicas que no pueden encuadrarse claramente en una de las dos categorías expuestas anteriormente, sino que requieren una mezcla de metabolismo aeróbico y anaerobio. Tomemos como ejemplo la carrera de los 2500 ó 3000 metros en el caballo. En estos tipos de carrera, el metabolismo anaerobio suministra la mayor proporción de ATP durante el “sprint”, tanto al principio como al final de la carrera, mientras que el sistema aeróbico predomina durante el “período estacionario” de la misma (GARCÍA et al., 1995). En el caballo los procesos glucolíticos no llegan al máximo hasta los 30 segundos. El metabolismo aeróbico es un proceso mas lento y no entra en un máximo de producción hasta los 60 segundos. El equilibrio entre las vías aeróbicas y anaeróbicas depende del tiempo y la potencia de ejecución de la prueba, de las reservas de oxígeno de la célula, y de las disponibilidades de enzimas mitocondriales (GARCÍA et al., 1995). En reposo y en ejercicio de poca intensidad, como el paso y el trote, está implicada principalmente la vía aeróbica. Durante este tipo de ejercicio, la concentración celular de ATP será alta y la de ADP baja. Al incrementarse la velocidad se empieza a acumular 51 ADP en la célula, con lo que se estimula la participación cada vez mayor de las vías anaerobias respecto a las aeróbicas. Como resultado, a medida que el caballo incrementa su velocidad, aumenta el porcentaje de energía que proviene de la producción de lactato. El lactato pasa a la sangre, se elevan los niveles plasmáticos y aumenta paulatinamente al aumentar la velocidad de la carrera. Por último, en los ejercicios que requieren una gran velocidad, como son las carreras entre 400 y 800 metros que realizan los caballos cuarto de milla el sistema de energía que predomina es el sistema ATP-PC o sistema Fosfágeno (GARCÍA et al., 1995). 2.4.6.1. Recuperación Del Ejercicio Durante el período de recuperación del ejercicio las necesidades de oxígeno son considerablemente menores que cuando se está realizando un ejercicio. Sin embargo, el consumo de oxígeno continúa a un nivel relativamente altos durante un cierto tiempo, dependiendo de la intensidad con que se ha realizado el ejercicio (DE LUCA, 2000). 2.4.7. Retirada del Ácido Láctico de la Sangre y del Músculo Cuando se acumula ácido láctico en la sangre y en el músculo, por un aumento en la actividad metabólica, se produce la fatiga muscular. Por lo tanto, una total recuperación muscular no tiene lugar hasta que no se produce la total retirada del ácido láctico. En general, luego de un ejercicio máximo se requieren, al menos 25 minutos de recuperación para la retirada de la mitad del ácido láctico acumulado, y 1 hora 15 minutos para la retirada del 95%. Cuando se realiza un ejercicio submáximo, en el cual la acumulación del ácido láctico no es tan grande, se requiere menos tiempo para la retirada total del total acumulado. El período de recuperación puede tener lugar en estado de reposo absoluto (inactividad), o en estado de actividad ligera (GARCÍA et al., 1995). La retirada del ácido láctico se ha estudiado en tres tipos de actividad: 1) reposo, 2) ejercicio ligero continuado, 3) ejercicio ligero intermitente. Se ha observado un aumento sustancial del ritmo de retirada de ácido láctico en los períodos de ejercicio en comparación con el de reposo. También se observa que el ritmo de retirada es más rápida con el ejercicio continuado que con el intermitente (DE LUCA, 2000). En presencia de O2 el ácido láctico es convertido primero en ácido pirúvico y luego en CO2 y H2O en el ciclo de Krebs y en la cadena de transporte de electrones, respectivamente. El empleo de ácido láctico como carburante metabólico se da para la mayor parte del mismo retirado durante el período de recuperación. La mayor parte de los procesos oxidativos del ácido láctico tiene lugar en las fibras de contracción lenta (FCL) y solo algunos en los de contracción rápida (FCR). Esta es la razón de que la retirada del ácido láctico durante la recuperación sea más rápida cuando se realiza un ejercicio ligero (GARCÍA et al, 1995). 52 2.4.8. Contracción del Músculo Esquelético 2.4.8.1. Características de los filamentos contráctiles Los filamentos que integran miofibrillas son los elementos decisivos en la contracción muscular, ya que poseen las proteínas fundamentales (actina y miosina) para el desarrollo de este proceso. Los filamentos gruesos están integrados mayoritariamente por Miosina (200 moléculas por filamento) (DE LUCA, 2000). Además de ésta existen otras proteínas, como la conectina que une el filamento grueso a la línea Z colaborando de esta forma al mantenimiento de una disposición ordenada de los filamentos, y la proteína C, cuya función no es clara. La miosina representa el 45% del componente proteico total de la miofibrilla. Es una proteína compleja (480.000 de peso molecular) formada por seis cadenas polipeptídicas, dos cadenas pesadas y cuatro cadenas livianas. Cada cadena pesada presenta una estructura alfa-helicoidal que termina en un extremo globular. Las dos cadenas pesadas se entrelazan formando una espiral en uno de cuyos extremos, proyectándose lateralmente, se encuentra la doble cabeza globular. Las cadenas livianas se asocian de dos en dos con el extremo globular de cada cadena pesada. (GARCÍA et al., 1995). La Miosina tiene gran capacidad de hidrólisis del Adenosil trifosfato ATP produciendo energía (actividad ATPasa) y una gran afinidad por la actina (constituyente de los filamentos finos). Estas características residen en la doble cabeza de la Miosina (ENGELHARDT et al, 2004). Las moléculas de Miosina se polimerizan de una manera muy específica en el citoplasma para formar el Filamento Grueso. Las moléculas se orientan en direcciones opuestas (orientación bipolar) uniéndose a través de sus colas, mientras que las zonas que engloban a la doble cabeza y a la unión con la cola se proyectan lateralmente. El resultado final es un filamento grueso, con una serie de prominencias laterales y una zona central desnuda que carece de ellas. Las prominencias laterales tienen la capacidad de articularse y se denominan “puentes de unión”, ya que a través de ellos los filamentos gruesos se unen a los filamentos finos. (Ver figura 7) (DE LUCA, 2000). Los filamentos finos están integrados por una proteína contráctil, la Actina, y dos proteínas reguladoras, Tropomiosina y Troponina. La Actina que forma parte de los filamentos finos, Actina F “Actina Filamentosa”, es una proteína dispuesta en una doble cadena enrollada helicoidalmente de 1 micrómetro de longitud (GARCÍA et al., 1995). Se origina por la polimerización en el citoplasma de monómeros de Actina G “Actina Globular”, los cuales se disponen de tal manera que cada banda de la hélice integra a 14 monómeros. Cada monómetro de Actina G presenta un lugar de unión activo a través del cual los puentes de unión de los Filamentos Gruesos interaccionan con los Filamentos Finos (DE LUCA, 2000). 53 FIGURA 7. Estructura del sarcomero y de proteínas contráctiles. LÍNEA Z BANDA H FILAMENTO GRUESO (Integrado por moléculas de miosina) las FILAMENTO FINO (Actina, troponina, tropomiosina Tropomiosina PUENTES DE UNIÓN Actina Troponina Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 La Actina se caracteriza por unirse estrechamente a la Miosina. La Tropomiosina es una proteína alargada (40nm de longitud) que está formada por dos cadenas polipeptídicas de estructura alfa-helicoidales enrolladas entre sí (ver Figura N° 2) (DE LUCA, 2000). En el filamento fino la Tropomiosina se coloca a lo largo del surco que forman las cadenas que integran la Actina F, extendiéndose el espacio comprendido por siete monómeros de Actina G. Cuando el músculo está en reposo, la disposición de la Tropomiosina en el Filamento Fino impide la interacción de la Actina y la Miosina (GARCÍA et al., 1995). La Troponina es una proteína globular que está integrada por tres subunidades: T, C e I. La molécula de Troponina se sitúa sobre la de Tropomiosina, uniéndose a ésta a través de la subunidad T. (ver figura 8). La Troponina C, colocada entre las subunidades T e I, tiene la capacidad de unirse con el Ca++, de tal manera que puede captar cuatro iones, aunque dos de los lugares de unión pueden ser ocupados también por el Mg++ (que en esos lugares compiten con el Ca++); la Troponina I (Troponina inhibitoria) actúa en reposo, inhibiendo la unión de la Actina con los “Puentes de Unión” de la Miosina, debido a que impide a la Tropomiosina dejar libres los lugares unión de la Actina (DE LUCA, 2000). 54 2.4.9. Mecanismo de la Contracción Muscular La contracción muscular es el resultado de la interacción molecular que se produce entre las proteínas (Actina y Miosina) que forman los filamentos contráctiles, lo que lleva a un deslizamiento de los Filamentos Finos sobre los Filamentos Gruesos (DE LUCA, 2000). La disposición de los Filamentos Finos anclados en las líneas Z (ver Figura N°2) determina que su deslizamiento se produzca hacia el centro de sarcómero, aproximando las líneas Z y acortando la longitud sarcomérica (aproximadamente 1 micrómetro) (GARCÍA et al.., 1995). Como cada miofibrilla está formada por numerosos sarcómeros, el resultado final de la contracción, es el acortamiento de las miofibrillas, la fibra muscular y el músculo. (Ver figura 8) (DE LUCA, 2000). FIGURA 8. Muestra el ordenamiento de los filamentos gruesos y finos en el estado de reposo y durante la contracción. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 El deslizamiento de unos filamentos sobre otros no modifica su longitud. Cuando se produce la contracción, la banda A se mantiene constante mientras que las bandas I y H se estrechan, lo que indica que solo se incrementa el grado de solapamiento entre los filamentos permaneciendo constante su longitud. El movimiento de los Filamentos Finos hacia el centro de sarcómero se debe a que, entre las cabezas de los puentes de unión de la Miosina y la Actina se forman y se destruyen, de manera repetida, unas uniones denominadas enlaces cruzados (DE LUCA, 2000). 55 FIGURA 9. Muestra el esquema del mecanismo de deslizamiento de los filamentos finos sobre los gruesos. a) FILAMENTO FINO (ACTINA) CABEZA DE MIOSINA Z b) ATP ADP FILAMENTO GRUESO (Miosina) c) d) ADP P ATP e) ATP Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 La cabeza de un puente de unión, una vez adosada a la Actina, sufre un cambio de conformación (gira 45°) que empuja al Filamento Fino hacia el centro del sarcómero. A continuación, el enlace cruzado se rompe, la cabeza recupera su conformación primaria, vuelve a unirse con la Actina en otro punto mas alejado de ella, y sufre un nuevo cambio de conformación empujando de nuevo el Filamento Fino más hacia el centro (Ver figura 9) (GARCÍA et al., 1995). La energía para este proceso se obtiene de la hidrólisis del ATP (Figura 9a). El ATP se adhiere a la doble cabeza, la cual, debido a su gran actividad ATPasa, lo hidroliza en adenosindifosfato (ADP) y Fósforo inorgánico (Pi) (Figura 9b). El ADP y el Pi permanecen unidos la cabeza. La hidrólisis del ATP proporciona a la Miosina transformándola en Miosina Activada. En esta situación la cabeza de la Miosina se une perpendicularmente (90°) con la actina (Figura 9 b). Como consecuencia de la unión la Miosina sufre un cambio de conformación que se traduce en un giro de la cabeza (aproximadamente 45°), el cual crea un impulso mecánico que tira del Filamento de Actina llevándolo hacia el centro del sarcómero generando una tensión o fuerza (Figura 9c) (DE LUCA, 2000). La energía que produce el impulso es la que se encontraba almacenada en la cabeza, proveniente de la hidrólisis del ATP, y que como consecuencia de la unión con la Actina se libera. Así mismo, la unión de la Actina con la Miosina produce la liberación del ADP y del Pi, que permanecían unidos a la cabeza de la Miosina, permitiendo que una 56 nueva molécula de ATP se adhiera a la cabeza (Figura 9d). La unión de ATP produce la ruptura del enlace, separándose la Actina de la Miosina, transformándose esta en Miosina “desactivada” (Figura 9e). Esta separación permite que el ATP unido a la cabeza sea de nuevo hidrolizado, con lo cual la Miosina vuelve a “activarse” y estar dispuesta para unirse de nuevo a otro lugar de la Actina más alejado del anterior, de este modo el ciclo vuelve a comenzar y el Filamento Fino es desplazado nuevamente hacia el centro del sarcómero (GARCÍA et al., 1995). La fuerza o tensión que desarrolla el músculo va a estar relacionada con el número de enlaces que se forman entre la Actina y la Miosina. En este esquema el ATP desempeña un papel crucial ya que, con su disociación proporciona la energía para el movimiento del Filamento Fino, y por otro lado, provoca la ruptura de la unión Actina - Miosina. Ello determina que cuando el nivel de ATP desciende por debajo de un límite, los enlaces cruzados se transforman en permanentes (GARCÍA et al., 1995). 2.4.9.1. Regulación Del Mecanismo Contráctil De lo que hemos desarrollado podemos definir que la interacción entre la Actina y la Miosina, es decir el mecanismo de deslizamiento, se puede realizar siempre que haya ATP en concentración suficiente en el interior del sarcolema. De todas maneras existe un control sobre el mecanismo de deslizamiento que va a determinar su puesta en marcha únicamente cuando hay una demanda de contracción sobre el músculo, ya que de lo contrario la formación y disolución de enlaces cruzados entre Actina y Miosina sería continua (DE LUCA, 2000). La llave controladora del mecanismo de deslizamiento es la concentración de Ca++ en el líquido intracelular; el incremento en la concentración de Ca++ hasta 10 µM o más, determina el inicio y posterior desarrollo del mecanismo de deslizamiento. Por el contrario la disminución de la concentración hasta 0,1µM provoca el cese de la interacción entre la Actina y la Miosina lo que lleva a la fibra muscular a su estado de reposo. El papel regulador del Ca++ se pone de manifiesto gracias a la capacidad que tiene este ión para activar un mecanismo molecular, que sin su presencia, impide la interacción de la Actina y la Miosina (GARCÍA et al., 1995). El mecanismo que inhibe la interacción de los filamentos está representado por las proteínas reguladoras Tropomiosina y Troponina; cuando los niveles de Ca++ intracelular son bajos (0,1µM), la fibra está relajada, la Tropomiosina se coloca en el Filamento Fino de tal manera que bloquea los lugares de unión que tiene la Actina, por lo que las cabezas de los puentes de unión de la Miosina no pueden interactuar con ellos (Ver figura 10) (DE LUCA, 2000). 57 FIGURA 10. Muestra el efecto de los iones calcio en la interacción actina – miosina. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 En esta labor de bloqueo, la tropomiosina es “ayudada” por la troponina, la cual se dispone de tal manera que, a través de su fracción inhibidora (Troponina) obliga a aquella a mantenerse sobre los lugares de unión de la actina. Cuando el Ca++ intracelular aumenta, los iones se unen a la Troponina C (fracción de la Troponina unida al Ca++). Esta unión determina un cambio de conformación en la molécula de la Troponina de tal forma que deja de actuar sobre la Tropomiosina, la cual se desliza hacia el fondo del surco que forman las dos cadenas de polímeros de Actina G, con lo cual quedan al descubierto los lugares de unión de ésta. De este modo los puentes de unión de la miosina pueden unirse a la Actina provocando el movimiento de los filamentos (Ver figura 10) (DE LUCA, 2000). En el músculo esquelético el Ca++ que participa en el proceso contráctil proviene de un depósito intracelular denominado retículo sarcoplásmico, que se halla dispuesto como una red tubular membranosa rodeando cada sarcómero y cada miofibrilla, orientada longitudinalmente, y que en sus extremos presenta unas dilataciones, en forma de saco, “las cisternas terminales” (DE LUCA, 2000). ++ El retículo sarcoplásmico almacena Ca en una concentración incluso 10.000 veces mayor que la del citoplasma. La mayor parte del Ca++ almacenado está débilmente unido a la proteína calsecuestrina que tiene la capacidad de unir 40 iones de Ca++ por molécula. La importancia funcional del retículo sarcoplásmico radica en que suministra el Ca++ 58 para la contracción (a través de los canales de calcio de su membrana) y, cuando ésta cesa, lo capta de nuevo a su interior (GARCÍA et al., 1995). La labor de la recaptación del ión la realiza gracias a que posee una bomba de Ca++ en su membrana que captura y transfiere al interior iones de calcio. La energía para su funcionamiento se la proporciona el ATP, de tal manera que la hidrólisis de una molécula de ATP sirve para transportar dos iones de Ca++ al interior (DE LUCA, 2000). El importante papel del retículo sarcoplásmico de iones suministrados de Ca++ para la contracción se pone de manifiesto por el hecho de que una fibra muscular esquelética sumergida en una solución carente de ión puede contraerse varias veces, lo que indica que la fuente de Calcio activador no proviene del espacio extracelular, sino de los depósitos intracelulares, fundamentalmente del retículo sarcoplásmico. El determinante fundamental de la liberación de Calcio por el retículo sarcoplásmico constituye la génesis de un potencial de acción en la fibra muscular; el potencial de acción del músculo tiene características similares al del nervio, aunque su duración (2-10 ms) y velocidad de conducción (2-5 ms) son mayores que en las fibras nerviosas (DE LUCA, 2000). Este potencial es el último eslabón en una cadena de acontecimientos que se inician con la creación de un potencial en la motoneurona que inerva la fibra muscular (GARCÍA et al., 1995). La llegada del potencial de acción nervioso a la unión neuromuscular provoca la liberación de acetilcolina, la cual a su vez origina un potencial de acción que induce la liberación de Ca++ del retículo sarcoplásmico, desencadenándose el fenómeno contráctil. El sarcolema de la fibra muscular está relativamente alejado de las miofibrillas y por ello su despolarización no es suficiente para provocar la contracción, por lo tanto debemos conocer que el potencial de acción generado en el sarcolema, llega a la profundidad de la fibra muscular gracias a las invaginaciones estrechas del sarcolema denominadas túbulos transversales o Tubos T que en su conjunto forman el sistema tubular transverso (HOUDGSON et al., 1994). Los Tubos T se proyectan desde el sarcolema al interior de la fibra formando redes a través del citoplasma de tal forma que rodean a las miofibrillas. En el músculo esquelético de los mamíferos cada sarcómero tiene dos redes de Tubos T situados cerca de los dos extremos de los filamentos de miosina (DE LUCA, 2000). Los Tubos T conducen el potencial de acción desde el sarcolema hacia el interior de la fibra ya que su luz es una continuación del espacio extracelular y de esta forma la despolarización puede viajar alrededor de cada sarcómero (GARCÍA et al., 1995). En el interior de la fibra los Tubos T están en contacto con el retículo sarcoplásmico a través de las cisternas terminales, los cuales se sitúan a ambos lados del Tubo T constituyendo la tríada; a lo largo de la zona de contacto, las cisternas terminales emiten proyecciones o pies que aproximan más a ambas estructuras (DE LUCA, 2000). Esta disposición determina que los acontecimientos eléctricos del Tubo T sean los controladores de los movimientos de Ca++ del retículo sarcoplásmico. Así la 59 despolarización de la membrana del Tubo T inicia la liberación de Ca++ del retículo sarcoplásmico y la repolarización la detiene. El mecanismo que acopla la despolarización tubular con la liberación de Calcio reticular se realiza por un “mensajero” denominado Inositol 1,4,5-trifosfato (IP3), formado en la membrana del Tubo T por acción enzimática (GARCÍA et al., 1995). La repolarización de la fibra trae aparejado el cese de la contracción y la recapturación del Ca++ por el retículo sarcoplásmico debido a la actividad de la bomba de calcio de su membrana. (DE LUCA, 2000). El mantenimiento de los niveles basales de Ca++ intracelular en estado de reposo (0,1µM) se debe a la bomba de Ca++ y al intercambiador Na+ / Ca++ del sarcolema de la fibra muscular que actúan bombeando Ca++ al exterior en contra de su gradiente de concentración. De esta forma el sistema de almacenamiento reticular controla la distribución del Ca++ dentro de la fibra, mientras que el contenido celular de Ca++ es regulado por los sistemas situados en el sarcolema que determinan los niveles homeostáticos celulares del ión (DE LUCA, 2000). 2.4.10. Control de la Actividad Muscular La función primaria de los músculos esqueléticos es la de contraerse, permitiendo a los animales realizar actividades tan opuestas como moverse o permanecer quietos. Esto requiere que la contracción pueda realizarse a diferente velocidad o nivel de fuerza, en períodos cortos o largos, pero siempre con gran precisión (DE LUCA, 2000). Los músculos esqueléticos son entidades muy especializadas que están controladas por unidades nerviosas hacia y desde el Sistema Nervioso Central (SNC). Los músculos esqueléticos están inervados por motoneuronas cuyos cuerpos celulares se localizan en la médula espinal, de tal manera que cada una de ellas establece contacto con varias fibras musculares, a través de uniones neuromusculares, situadas en el centro de cada fibra muscular (GARCÍA et al., 1995). El conjunto que forma la motoneurona con las fibras musculares inervadas por ella se denomina unidad motora; la actividad de una motoneurona produce un potencial de acción que se propaga por el axón y sus ramas hasta llegar a las uniones neuromusculares en las fibras. La transmisión neuromuscular despolariza el sarcolema e inicia un potencial de acción que se propaga en ambas direcciones por cada una de las fibras que constituyen la unidad motora, provocando, tras un período de latencia de 2 a 3 milisegundos (ms) la contracción de las fibras musculares inervadas (DE LUCA, 2000). El SNC controla la fuerza total de músculo por dos mecanismos: 1. Modificando el número total de unidades motoras. 60 2. Incrementando el número (frecuencia) de potenciales de acción en una unidad motora. (DE LUCA, 2000). Un músculo esquelético está inervado por un número variable de motoneuronas, cada una de las cuales forma una unidad motora con las fibras que inerva; al incrementar el número de motoneuronas activas, el número de unidades motoras aumenta en la misma proporción, lo que determina una mayor tensión en el músculo. Ello se debe a que la tensión originada por la actividad individual de una unidad motora, se suma a la tensión creada por las otras unidades, produciendo la tensión final muscular; este reclutamiento de unidades motoras presenta características derivadas de la actividad para la cual se demanda un aumento de tensión (DE LUCA, 2000). FIGURA 11. Muestra la respuesta contráctil a una serie de potenciales de acción en el músculo esquelético. * A medida que aumenta la frecuencia de los potenciales de acción, la tensión aumenta hasta un nivel máximo o tétano. Tomado de www.engormix.com/s_articles_view.asp?AREA=CAB&art=365 En acciones que implican locomoción o llevar carga, el reclutamiento se produce en función del tamaño (número de fibras inervadas) de las unidades motoras, siendo las más pequeñas las primeras en activarse, de esta forma se asegura la graduación progresiva del incremento de la tensión (DE LUCA, 2000). Otra característica importante del mecanismo del reclutamiento se pone de manifiesto cuando se requiere el 61 mantenimiento de una tensión muscular, por ejemplo el sostenimiento de la postura corporal (GARCÍA et al., 1995). Ante dicha situación se produce la activación asincrónica de las diferentes unidades motoras, alternándose de esta manera períodos de actividad con períodos silentes de las unidades, con lo cual se mantiene una tensión relativamente elevada, pero suave que evita la fatiga del músculo (HOUDGSON et al., 1994). El control nervioso de la tensión muscular también se ejerce a través del incremento del número de potenciales de acción que se generan en las motoneuronas que forma la unidad motora, con lo cual aumenta el número de potenciales de acción que se producen en las fibras musculares de la unidad. (Ver figura 11) (GARCÍA et al., 1995). Ante un único potencial de acción en la motoneurona, la unidad motora responde con una sola contracción (DE LUCA, 2000). Si a continuación se produce otra despolarización, en un espacio de tiempo lo suficientemente grande, la respuesta contráctil consiguiente es similar a la primera. Sin embargo cuando aumenta la frecuencia de descarga de potenciales de acción (incremento del número de potenciales en la unidad de tiempo) las respuestas contráctiles se suman, produciéndose una contracción de mayor intensidad que la producida por una despolarización aislada (DE LUCA, 2000). Cuanto mayor sea la frecuencia, mayor será la tensión producida, hasta alcanzar una respuesta máxima en la que no se puede desarrollar mayor tensión. (Ver figura 11); a este estado, resultante de la suma de las contracciones se le denomina tétanos, contracción tetánica o tetanización (GARCÍA et al., 1995). Este efecto contráctil sumatorio se debe a la imposibilidad del retículo sarcoplásmico para recaptar el Ca++ liberado por la llegada continua de potenciales de acción, con lo que se mantiene una elevada concentración intracelular del ión que hace imposible la relajación hasta que cese la llegada de potenciales (DE LUCA, 2000). 2.5. FACTORES LIGADOS AL DESEMPEÑO ATLÉTICO Independiente de la actividad deportiva o de la especie, la habilidad atlética es determinada por 4 factores principales: - Genética Ambiente Salud Entrenamiento De los cuatro factores antes mencionados, después de los factores genéticos, el entrenamiento sería el factor más importante para determinar el suceso deportivo del atleta. De esta forma, los programas de entrenamiento de equinos deben tener en cuenta los siguientes aspectos: 62 - Aumentar la capacidad del caballo al ejercicio Aumentar el tiempo de inicio de la manifestaciones de fatiga - Aumentar el desempeño, por el aumento: De la destreza De la fuerza De la velocidad De la resistencia - Disminuir los riesgos de lesiones (THOMASSIAN, A., 2000) 3. RESPUESTAS FISIOLÓGICAS DEL ORGANISMO AL EJERCICIO Según GARCÍA, et al. (1995) como resultado del ejercicio, se producen una serie de cambios en el funcionamiento corporal que afectan sobre todo a los sistemas músculo – esquelético, sanguíneo, cardiovascular y respiratorio. TABLA 9. Ensayo de desempeño realizado a equinos atletas de la modalidad de concurso completo de Equitación. Caballo 1 Examen (Reposo) 2 examen Calentamiento (Inmediato) 3 examen (10min) 4 Examen (20min) FC TºC FC FC TºC FC TºC FC Garimpeiro 36 37 54 72 39,8 48 38,6 Chocolate 50 36,8 72 132 39,5 90 Faca 28 37,8 54 100 39 Fita 32 37,5 78 132 Fértil 28 35,5 120 Festim * * * Yapejú 32 37,8 Floresta 22 Ganador 5 Examen (2 horas) TºC FC TºC 36 38 32 37,4 39,3 72 39 36 37,5 96 39,3 66 38,7 32 37,7 38,9 60 38,2 54 37,9 40 37,5 72 37,5 60 38,1 42 38 32 37,7 * * * * * * * * 84 90 39 72 38,8 54 38,3 36 37 37,7 60 82 38,6 58 38,6 42 37,6 36 37 28 37,2 60 72 38,6 54 38,2 42 38,1 36 36,7 Filó 31 37,7 60 86 38,8 72 38,3 69 38,4 36 37,6 Gartok 32 37,7 48 72 38 48 38,5 42 38,4 36 37,9 Rio de Janeiro: Brasil. Se indican la frecuencia cardiaca (FC), y temperatura (T° C), de las muestras tomadas a los caballos en reposo, calentamiento previo al CCE, inmediatamente después de la prueba, 10 minutos, 20 minutos, y 2 horas después de finalizar la prueba. En la tabla anterior se muestra un aumento significativo de la FC, y temperatura post ejercicio, aunque, como se observa a lo largo del muestreo las variables comienzan a disminuir y a estabilizarse, posiblemente como respuesta al ejercicio. 63 3.1. ANIMALES EN REPOSO Teniendo en cuenta los siguientes valores hematológicos y fisiológicos en reposo, expuestos por QUEIROZ, (2006) de equinos atletas en la modalidad de Competición Completa de Equitación, se encuentra algunas variaciones después del ejercicio físico, las cuales se van a describir a continuación: TABLA 10. Valores hematológicos mínimos medios de equinos de competición completa de equitación. PARÁMETROS VALORES ENCONTRADOS VALORES DE EVALUADOS REFERENCIA MEDIO MÍNIMO MÁXIMO 33.5 29.5 37.5 32 – 53 Hematocrito (%) 6.0 5.2 6.8 5.3 – 7.4 PPT (g/dl) 347.4 149.2 545.6 150 – 380 Fibrinógeno (mg/dl) 10.5 9.2 11.8 11 – 19 Hemoglobina (g/dl) 58.4 56.9 56.9 37 – 59 VCM (fl) 33.4 32.5 34.3 31 – 38.6 CHCM (g/dl) 5.4 4.7 6.1 6.8 12.9 Eritrocitos (x106) 3 6800 4831 8769 5400 – 13300 Leucocitos (/mm ) Se indica el hematocrito (%), proteína plasmática total (g/dl), fibrinógeno (mg/dl), hemoglobina (g/dl), volumen corpuscular medio (f/l), concentración de hemoglobina corpuscular media (g/dl), eritrocitos (x106) e leucocitos (/mm3). Tomada de QUEIROZ (2006). Algunos de los valores encontrados por MARLIN et al. (1995), son: hematocrito 36,0 ± 1.0 %, hemoglobina 12.8 ± 1.4 g/dl, eritrocitos 5.4 ± 0.7 x 106, leucocitos 6800 ± 1100 /mm3. TABLA 11. Valores bioquímicos mínimos, medio y máximos observados en los equinos de competición completa de equitación en reposo. PARÁMETROS VALORES ENCONTRADOS VALORES DE EVALUADOS REFERENCIA MEDIO MÍNIMO MÁXIMO 88.9 Glucosa (mg/dl) 0.6 Lactato (mmol/L) 38.3 Triglicéridos (mg/dl) 103.5 Colesterol (mg/dl) 27.4 Urea (mg/dl) 11.3 GGT (U/L) 336 AST (U/L) 78 Creatin kinasa (U/L) 1.4 Creatinina (mg/dl) Tomada de QUEIROZ (2006). 79.8 0.4 26.7 79.4 23.4 6.5 271.1 14 1.1 98.1 0.7 49.9 127.6 31.4 16.1 400.3 142 1.6 75 – 115 <1 75 – 150 40 – 60 4 – 13.4 226 – 366 86 – 140 1.2 – 1.9 ANDREWS et al. (1995), encontraron valores de PPT en reposo de 7.2 ± 0.3 g/dl. 64 De acuerdo con QUEIROZ (2006), los valores encontrados para frecuencia cardiaca (FC), frecuencia respiratoria (FR) y temperatura (T°) en reposo son, los siguientes respectivamente: 36, 12.5 y 37. 3.2. RESPUESTA FISIOLÓGICA AL EJERCICIO 3.2.1. Función Cardiaca La capacidad del corazón de bombear suficiente cantidad de sangre para subvenir a las necesidades del animal en ejercicio, y la redistribución efectiva de sangre hacia el músculo esquelético, son las dos circunstancias clave para que el caballo proporcione un buen rendimiento (GARCÍA et al., 1995). Las mediciones de la frecuencia cardiaca durante el ejercicio en caballos atletas son empleadas para cuantificar la intensidad de la carga de trabajo, monitorear el acondicionamiento físico y para estudiar los efectos del ejercicio sobre el sistema cardiovascular. Este responde al ejercicio con un aumento de la frecuencia cardiaca, de la fuerza de contracción, del volumen sistólico y del trabajo cardiaco; estas respuestas cardiovasculares son rápidas y concomitantes a la vasoconstricción y vasodilatación arterial para un trabajo muscular adecuado a las exigencias del ejercicio. Durante la actividad física, se observa un aumento lineal de la frecuencia cardiaca, proporcional al aumento de la velocidad del ejercicio hasta cegar a valores de 210 bpm, y frecuentemente llega a un valor máximo, el cual no se eleva con el aumento de la intensidad de trabajo, esta característica esta denominada de la frecuencia cardiaca máxima (FCmáx), que para caballos de carreras se sitúa en torno de 240 – 250 bpm (THOMASSIAN, 2000). La medición de la velocidad del ejercicio en la cual la frecuencia cardiaca llega el valor de 200 bpm, que corresponde al V200, que da información útil para evaluar la capacidad de trabajo aeróbico de los caballos, y posee buena relación con el consumo máximo de oxigeno (VO2max) en las pruebas en caminadores de alta velocidad. La frecuencia cardiaca máxima no se altera con la condición del entrenamiento, de forma que la velocidad en la cual es obtenida puede ser mayor en animales con mejor acondicionamiento y menor en aquellos que presentan, por ejemplo, enfermedad pulmonar obstructiva crónica, hemorragia pulmonar inducida por ejercicio o enfermedad cardiaca. La elevación de el V200 durante el entrenamiento sugiere un aumento del máximo poder aeróbico y su disminución puede sugerir perdida del acondicionamiento cardiovascular, enfermedad pulmonar o cardiaca, o la presencia de claudicación (THOMASSIAN, 2000). Se ha demostrado que la frecuencia cardiaca constituye un elevador confiable para estimar el nivel de esfuerzo que realiza un caballo durante el trabajo muscular en 65 competencia, cualquiera sea la naturaleza del ejercicio (ENGELHARDT, 1977; EVANS, 1985). Por ejemplo, existe una relación estrecha entre el aumento de la velocidad y los cambios observados en los valores de frecuencia cardiaca (EVANS, 1985), la que puede ser modificada por las condiciones del suelo, el diámetro de la pista y el peso del jinete (ENGELHARDT, 1977). Es conocido que tanto en el hombre como en los animales la recuperación de la frecuencia cardiaca en el post-ejercicio está determinada principalmente por la intensidad del ejercicio y por el nivel de acondicionamiento físico del individuo (CARDINET et al., 1963; AITKEN et al., 1973; ASTRAND & RODAHL, 1986). Es por ello que se ha utilizado para evaluar el rendimiento y la aptitud física de los caballos en las competencias (EVANS, 1985; ENGELHARDT, 1977). Así por ejemplo, en caballos de carreras se ha demostrado que aquellos que presentan un buen rendimiento competitivo muestran una recuperación más rápida de la curva de frecuencia cardiaca que aquellos de bajo rendimiento (MILNE et al., 1976; MARTÍNEZ et al., 1994). Explican, GOMIDE et al. (2006), que luego de finalizar la prueba del CCE, los animales presentan una elevación persistente de la frecuencia cardiaca, acompañada por aumento de la frecuencia respiratoria, temperatura rectal, dilatación anal y rigidez muscular. Estos datos son acompañados por la incapacidad de reducir la concentración sanguínea de lactato 10 minutos después de finalizar la fase de cross-country. GARCIA et al. (1999), realizaron una evaluación de caballos criollos chilenos de rodeo, y en su trabajo se describe un aumento de la frecuencia cardiaca observada en los caballos antes y después del rodeo. La FC aumenta desde un valor de reposo de 42.0 ± 1.0 lat/min a valores de 110.0 ± 4.0 lat/min y de 62.0 ± 3.0 lat/min a los 5 y 15 min postejercicio. A las 6 y 24 h postjercicio la FC mantiene promedios similares al reposo. Se observó en este trabajo que a los 45 días de entrenamiento la FC disminuyó notablemente en el post-ejercicio, los cual señala que el sistema cardiovascular manifiesta los cambios más rápidos que el sistema muscular en respuesta a un programa de entrenamiento. Además es conocido que el individuo bien entrenado trabaja a una frecuencia cardiaca más baja que el no entrenado o con insuficiencia circulatoria (PERSSON, 1983). GOMEZ et al. (2006), describen los valores obtenidos en equinos de salto Holsteiner en su trabajo, el cual encontró aumentos significativos entre los valores en reposo y los valores post – ejercicio durante el período de estudio. Se observa además, que los valores obtenidos a partir de los 30 días de entrenamiento comienzan a disminuir. 66 TABLA 12. Muestra la media desviación estándar (DE) de la frecuencia cardiaca (Latidos / minuto) en reposo y post – ejercicio y, carga cardiovascular (CC) (%) en 10 equinos de salto Holsteiner. DÍAS ENTRENAMIENTO 0 15 30 45 60 REPOSO (PROMEDIO ± DE) 43.8 ± 4.5 42.0 ± 3.8 41.0 ± 2.9 42.0 ± 0.9 40.8 ± 1.9 POST-EJERCICIO (PROMEDIO ± DE) 81.9 ± 8.7a 76.6 ± 7.3* 75.2 ± 8.9b 74.6 ± 4.3b 74.6 ± 4.1b CC (%) 21.6 19.4 19.1 18.3 17.9 *Indica diferencia post-ejercicio (P<0.06). a, b: Letras diferentes en sentido vertical indican diferencias significativas (P<0.05) entre períodos. Tomada de GÓMEZ, et al. (2006). En la tabla 7, GÓMEZ et al. (2006) describen que se presenta una recuperación de la FC, medida cada 5 minutos hasta completar los 15 minutos después del ejercicio. La frecuencia cardiaca fue más rápida en los 3 últimos muestreos del estudio (días 30, 45 y 60). TABLA 13. Muestra la media y desviación estándar (DE) de la frecuencia cardíaca (latidos / minuto) a los 5, 10 y 15 minutos después de realizar el ejercicio en 10 equinos de salto Holsteiner. DÍAS ENTRENAMIENTO 0 15 30 45 60 5 MINUTOS 10 MINUTOS 15 MINUTOS 67.4 ± 6.1a 64.6 ± 3.9 57.2 ± 6.2b 59.8 ± 8.0b 57.4 ± 3.6b 57.4 ± 7.1a 55.6 ± 7.0 50.6 ± 3.8 49.4 ± 4.1b 47.4 ± 3.1b 53.8 ± 6.4a 51.6 ± 5.6a 45.2 ±4.1a 44.6 ±2.7b 40.0 ± 2.8b A, b: Letras diferentes en sentido vertical indican diferencias significativas (P<0.05) entre períodos. Tomada de GÓMEZ, et al. (2006). Relatan GARCÍA et al. (1995), que al comienzo del ejercicio la frecuencia cardiaca aumenta rápidamente para hacerse constante entre 2 ó 3 minutos después; esta constancia permanece mientras el animal esté sometido a un ejercicio submáximo, aumentando progresivamente con la velocidad o la duración del esfuerzo (Ver gráfica 1). Puede producirse un aumento inicial de la frecuencia cardiaca por encima de estos valores constantes de ejercicio submáximo debido a un retraso en la movilización de la sangre por esplenocontracción. Después del ejercicio, la recuperación de la FC es inicialmente muy rápida, por descender enseguida durante el primer minuto, haciéndolo después más lentamente. La rapidez con que disminuye la FC depende de la forma física del animal, pero también de las condiciones climáticas, raza y esfuerzo realizado; los caballos en mal estado tienen FC post-ejercicio muy altas. 67 LATIDOS/min 250 200 150 100 50 0 0 15 20 25 30 Km/h Km/h Km/h Km/h Rep. 10' Rep. 30' -ARABE+ANGLOARABE*ESPAÑOL GRÁFICA 1. Valores medios de frecuencia cardiaca, obtenidos en caballos de distinta raza sometidos a un ejercicio de intensidad creciente y en la recuperación. Tomado de GARCÍA et al., 1995. En el estudio de QUEIROZ (2006), describe datos desde un valor de 36 en reposo, aumentando paulatinamente a medida que el esfuerzo físico también aumenta, mostrando luego un retorno a los valores normales, como se observa: fase de calentamiento 54, inmediatamente después del ejercicio 72, 10 minutos pos-ejercicio 58, 20 minutos pos-ejercicio 36, y 2 horas pos-ejercicio 32. 3.2.2. Función Respiratoria La función primaria del sistema respiratorio es el intercambio de oxígeno y dióxido de carbono con una frecuencia que esté en concordancia con las necesidades metabólicas. Así, en el caballo, durante el ejercicio intenso, el consumo de oxígeno se incrementa de 25 a 36 veces con relación al consumo en reposo. De tal forma, que el sistema respiratorio debe establecer este incremento de flujo, pero sin que el costo metabólico sea muy elevado, ya que sería insostenible que este aumento de ventilación llevará consigo el consumo de un porcentaje elevado del oxígeno que se introduce en el organismo (GARCÍA, et al., 1995) Tanto en humanos como en caballos, en el aire expirado durante el ejercicio pueden ser medidos los contenidos de oxigeno y dióxido de carbono, posibilitando, de esa forma, el cálculo de la tasa de consumo de oxigeno para diferentes intensidades de ejercicios. El valor del consumo máximo de oxigeno (VO2max), que es definido como la cantidad máxima de oxigeno utilizada por el individuo durante un ejercicio máximo hasta que el animal este exhausto, es determinado por el aumento de la carga de trabajo o de la velocidad del caminador, y sobre el monitoreamiento constante de la tasa de consumo de oxigeno. El consumo de oxigeno aumenta lealmente con el aumento de la velocidad, 68 hasta el momento en el que se observa que el aumento en la velocidad no es acompañado por un aumento proporcional en el consumo de oxigeno (HOUDGSON, et al., 1994). El volumen del aire es expirado durante un ciclo respiratorio normal, es llamado de volumen corriente (Vc). Este valor en caballos saludables y en reposo es de aproximadamente 12 ml/kg de peso corporal. Multiplicándose el volumen corriente por la frecuencia respiratoria (8 a 15 movimientos respiratorios por minuto), tendremos la ventilación por minuto (VE), que es de 80 l/min, pudiendo llegar durante el ejercicio máximo, a valores de 1800 l/min. En humanos hay una tendencia en los mejores atletas (de elite), de presentar valores altos de VO2max, variando entre 69 y 85 ml de O2/kg/min, mientras que los caballos PSI de carreras tienen valores dos veces mayores, cerca de 160 ml O2/kg/min. Los ejercicios realizados en altas velocidades, en los cuales las cargas de trabajo están entre 65% a 85% del consumo máximo de oxigeno (VO2max), las células mantienen el requerimiento energético de ATP para la contracción muscular a través del metabolismo anaeróbico de la glucosa, resultando en acumulo de ácido láctico en las células musculares, con consecuente desarrollo de acidemia arterial (GARCÍA et al., 1995). La evaluación de los cambios gaseosos pulmonares puede ser basada en la medición de las tenciones parciales de oxigeno (PaO2) y dióxido de carbono (PaCO2). Con relación a esas presiones parciales, se observa el desarrollo de “hipoxemia fisiológica” con valores menores de 80-84 mmHg, durante ejercicios de alta intensidad. Se sabe que valores de PaCO2 mayores de 46-50mmHg, son suficientes para el desarrollo de hipercapnia cuando la carga de trabajo es superior a 85% do VO2max (medido por la máscara de evaluación de gases respiratorios), en equinos sometidos a las pruebas de ejercicios progresivos en caminadores. La ocurrencia de la hipoxemia puede proceder de la limitación de flujo aéreo para los pulmones, asociada con la alta frecuencia respiratoria, en virtud del sincronismo de la frecuencia respiratoria con cada “galón” (un movimiento respiratorio por paso completo en el galope), luego que caballos en ejercicio en altas velocidades (>10,0m/s) en superficies con inclinación por encima de 10%, presenten frecuencias respiratorias mayores de 110 mpm (QUEIROZ et al., 2006). El intercambio gaseoso requiere: ventilación, distribución de los gases en los pulmones, perfusión de la sangre a través de los capilares, acoplamiento de la ventilación y el flujo sanguíneo, difusión de los gases entre el aire y la sangre, y transporte de los gases desde y hacia los músculos. En cada tipo de marcha (aire) del caballo, existe una velocidad óptima en la que el consumo de oxígeno por metro recorrido es mínimo (ver figura 12). Las curvas que relacionan la velocidad y el consumo de oxígeno en los diferentes tipos de marcha se cruzan, y estas intersecciones es donde los animales cambian de aire; este cambio evita que el consumo de oxígeno por metro se incremente en exceso. A pesar de dicha selección para minimizar el consumo de oxígeno, éste aumenta linealmente a medida que se incrementa la velocidad; para acomodar este consumo de oxígeno, el caballo aumenta la ventilación por minuto, el gasto cardiaco y la cantidad de hemoglobina en sangre. A cada estadio del intercambio gaseoso aumenta la extracción 69 de oxígeno, de modo que el incremento de consumo de oxígeno, que es 30 veces mayor durante el ejercicio intenso, se lleva a cabo porque la ventilación-minuto aumenta 33 veces, mientras que el gasto cardiaco sólo es de 5 a 8 veces mayor. Además, se da una redistribución de flujo sanguíneo tisular, de modo que los músculos que trabajan reciben la mayor parte de este aumento del gasto cardíaco (Ver gráfica 2). (GARCÍA et al., 1995). FIGURA 12. Consumo de oxígeno por metro corrido. 28 CAMBIO DE AIRE PASO A TROTE ml O2 CONSUMIDO/METRO 24 CAMBIO DE AIRE TROTE A GALOPE 20 16 12 8 DE PASO VELOCIDAD NATURAL DE TROTE DE GALOPE 4 0 PASO GALOPE TROTE VELOCIDAD DE CARRERA (m . s-1) Los ponys fueron entrenados para mantener cada aire sobre treadmill con aumento de velocidad. En cada cambio de aire, la relación entre la velocidad y el consumo de O2/m fue parabólica. La velocidad media de cada aire se presentó aproximadamente con el consumo mínimo de O 2/m. Los ponys, normalmente, cambiaron de aire donde se produjo la intersección de las curvas; así se minimiza el incremento de consumo de O2/m. Tomado de GARCÍA et al., 1995. 70 De acuerdo con GOMIDE et al. (2006), los animales después de la prueba de CCE, presentan un aumento de la frecuencia respiratoria persistente, mostrando señales de cansancio físico. Según QUEIROZ et al. (2006), los equinos atletas del CCE, muestran un incremento significativo, pero luego de un acondicionamiento físico, o aquellos caballos que tienen un mejor entrenamiento y desempeño físico la frecuencia respiratoria tiende a disminuir. GARCIA et al. (1999), describen en su trabajo y para caballos criollos chilenos de rodeo un incremento significativo desde un valor en reposo de 15 ± 1.0 a 92.0 ± 5.0 resp / min post-ejercicio, aumento que persiste a los 15, 30 y 45 días de entrenamiento. 10 8 6 REPOSO 4 EJERCICIO 2 0 VO2 GASTO CARDIACO Hb (a-v) O2 GRÁFICA 2. Incremento relativo en el consumo de O2 (VO2), gasto cardíaco, Hb y diferencias arteriovenosas de O2, entre el reposo y un ejercicio extenuante. Un aumento aproximado de 33 veces en VO2 se acompaña de un incremento de 5 veces en el gasto cardiaco, un 50 por 100 en la hemoglobina y 4,5 veces en las diferencias arteriovenosas de O2. Tomado de GARCÍA et al., 1995. En un estudio realizado en Río de Janeiro – Brasil en 2006, con equinos atletas en la modalidad de CCE se encontraron valores promedio: en reposo 12.5, en la fase de calentamiento 16, inmediatamente después de la prueba física 19, 10 minutos posejercicio 16.5, 20 minutos pos-ejercicio 15 y 2 horas después 13. GOMEZ et al. (2006), relatan un aumento en los valores post – ejercicio con respecto a los valores en reposo durante el período de estudio. A partir del día 15 y se mantiene durante el período. 71 TABLA 14. Valores de la frecuencia respiratoria en caballos de salto Holsteiner. DÍAS REPOSO (PROMEDIO ± POST – EJERCICIO (PROMEDIO ± ENTRENAMIENTO 0 15 30 45 60 DE) DE) 13.4 ± 1.3 12.6 ± 2.1 12.3 ± 1.5 12.4 ± 0.8 10.8 ± 1.4 Tomado de GÓMEZ, et al. (2006). 96.8 ± 6.9 84.2 ± 13.1 78.8 ± 10.0 89.8 ± 9.1 65.2 ± 5.1 GARCÍA, et al. (1999), relata un aumento en la frecuencia respiratoria en sus valores pos-ejercicio con respecto a los valores promedio en reposo, durante todas las etapas del entrenamiento. TABLA 15. Promedios de Frecuencia respiratoria (FR) en Caballos Chilenos de Rodeo, antes y después del ejercicio en un período de entrenamiento de 45 días. FRECUENCIA RESPIRATORIA (Resp/min) 1.50 ± 1.0 Reposo DÍA 0 92.0 ± 5.0 Pos-ejercicio 17.0 ± 1.0 Reposo DÍA 15 7.0.0 ± 6.0 Pos-ejercicio 17.0 ± 1.0 Reposo DÍA 30 77.0 ± 7.0 Pos-ejercicio 16.5 ± 1.0 82.0 ± 5.0 Reposo DÍA 45 Pos-ejercicio Tomado de GARCÍA, et al. (1999). 3.2.3. Temperatura El gran incremento del metabolismo durante el esfuerzo significa que el cuerpo debe desprender grandes cantidades de calor. Para que el caballo pueda sobrevivir es imprescindible que este calor se desprenda rápidamente durante y después del esfuerzo; en el equino ésta función se cumple sobre todo gracias al sudor, cuando el esfuerzo es breve esto es posible sin ninguna dificultad especial, cuando los esfuerzos son más prolongados, por ejemplo, durante una marcha de más de 80 km, se calcula que un caballo de 500 kg de peso necesita una producción de 37 litros de sudor. (ENGELHARDT et al., 2004). GOMIDE et al. (2006), relatan que después de 10 minutos de terminada la prueba del Campo traviesa, ocurrió reducción de la temperatura rectal de los animales. Pero estos datos son contrariados por los hallados por WHITE, et al. (1995), quienes relatan aumento de la temperatura rectal en todos los animales estudiados hasta 10 minutos después del ejercicio físico. Explican GOMIDE et al. (2006), que probablemente está caída de temperatura se debe al enfriamiento de los animales con agua fría después de la 72 fase D, indicando que este procedimiento es altamente benéfico para la disipación de calor producido durante el ejercicio. Tras un esfuerzo intenso la temperatura rectal del caballo puede sobrepasar brevemente los 41 °C, mientras que la temperatura de la propia musculatura ejercitada puede llegar a medir temperaturas de hasta 43 °C; si tras un esfuerzo intenso se limita el desprendimiento de calor, rápidamente puede aparecer un colapso térmico. (ENGELHARDT et al., 2004). QUEIROZ (2006), encontró valores promedio en reposo de 37 °C, en fase de calentamiento 39 °C, inmediatamente después del ejercicio físico 39,8 °C, 10 minutos pos-ejercicio 38,6 °C, 20 minutos pos-ejercicio 38 °C, y 2 horas pos-ejercicio 37,4 °C. 3.3. RESPUESTA HEMATOLÓGICA AL EJERCICIO Durante el ejercicio se ponen en juego dos factores principales: esplenocontracción e hipoxia tisular. El bazo es el principal reservorio de eritrocitos del caballo, perro y gato. Su capacidad de almacenamiento y movilización es, en el caballo, superior a la de otros animales domésticos, pudiendo llegar a almacenar de la tercera parte a la mitad del volumen total de eritrocitos. La sangre esplénica es una o dos veces más rica en eritrocitos que la sangre circulante. (GARCÍA et al., 1995). La contracción del bazo se va a producir no solamente como consecuencia del ejercicio, sino también debido a la liberación de adrenalina por la estimulación simpática, que se origina incluso antes de realizar el esfuerzo, como consecuencia de la más ligera manipulación, la excitación síquica, o la menor actividad muscular producida antes de la carrera. Junto al momento que se produce la eritropoyesis (control de la producción de eritrocitos por la médula ósea), con la actividad muscular debido a la hipoxia tisular (Figura 13), el organismo, frente a un esfuerzo máximo, acude al reservorio esplénico de hematíes y lo dispersa a la circulación, dando lugar a un incremento notable en la capacidad portadora de oxígeno de la sangre, que salva con esta “autotransfusión” el peligro de hipoxia con el subsiguiente problema de una insuficiencia cardíaca aguda. (GARCÍA et al., 1995). Hace más de 50 años se demostró la relación entre el grado de entrenamiento y el número de células rojas por milímetro cúbico de sangre, así como el contenido de hemoglobina y valor hematocrito, con un aumento significativo después del entrenamiento para ambos parámetros, respondiendo mejor al entrenamiento los caballos atletas (HOUDGSON, et al., 1994). 73 Figura 13. Factores que participan durante el ejercicio: Esplenocontracción e hipoxia tisular. a) Esplenocontracción Órgano de depósito Estrés BAZO Actividad muscular Contracción del bazo b) Hipoxia tisular Eritrocitos Célula madre Suministro de O2 bajo Eritropoyetina Eritrogenia Globulina a) La contracción del bazo origina un incremento del número de eritrocitos circulantes en la sangre. b) Durante el ejercicio aumenta la demanda de oxígeno a los tejidos. La disminución de oxígeno al riñón hace aumentar la producción de eritrogenia, y con ella el número de eritrocitos. Tomado de GARCÍA et al., 1995. 3.3.1. Electrolitos Sanguíneos Las pérdidas de líquidos a través del sudor pueden ser muy importantes, en las marchas de largas distancias se pierde en promedio de 7 – 8 litros de sudor por hora; eso significa que en un plazo de unas 5 horas los animales llegan a perder hasta el 8% de su peso corporal a causa del sudor. En carreras muy rápidas en climas calientes se han llegado a medir tasas de secreción de sudor de hasta 15 litros por hora, por eso durante los esfuerzos prolongados el caballo debe tener la posibilidad de beber agua. En los caballos la concentración de electrolitos y por lo tanto la pérdida con el sudor es mucho más elevada que en las personas, mientras que los humanos elaboran un sudor esencialmente hipotónico, el de los caballos es ligeramente hipertónico; es decir, con cada litro de sudor de los caballos pierden 3 o 4 veces más sodio, cloro y potasio que las 74 personas, al comienzo de la secreción, el sudor del caballo es rico en glucoproteínas; éstas sirven para reducir la tensión superficial, es lo que provoca la rápida producción de espuma y brillo de la superficie del pelo, lo que en otras cosas mejora la reflexión de la radiación solar. (ENGELHARDT et al., 2004). Durante ejercicios de alta intensidad, alteraciones en las concentraciones plasmáticas de iones fuertes son consecuencia del aumento del volumen globular y de la concentración de proteínas plasmáticas. Durante la prueba de ejercicio progresivo, hay una disminución del contenido y de la concentración de sodio eritrocitario, indicando el reflujo de sodio de la célula. Sin embargo, el intenso aumento de las concentraciones de potasio y lactato que no pueden ser justificadas apenas por los aumentos del hematocrito y de la concentración de proteína plasmática, indicando que hay un significante reflujo de potasio y de lactato de las células musculares para la circulación sanguínea. Una reducción en la concentración plasmática venosa puede ser consecuencia del movimiento de cloruro para dentro de las células musculares y de los eritrocitos. Este proceso es revertido en los pulmones con consecuente aumento en la concentración arterial de cloreto. Si ocurre, en situaciones de estrés en ejercicio de alta intensidad o en los de larga duración en condiciones de clima caliente, agravan las perdidas de electrolitos, especialmente sodio. (HOUDGSON et al., 1994). TABLA 16. Valores promedios de electrolitos sanguíneos en caballos chilenos en reposo y posterior a la competencia de rodeo. REPOSO GI (n=70) GII (n=40) 89.4 ± 7.6 86.8 ± 6.0 Cl (mEq/L) 3.1 ± 0.47 3.02 ± 0.34 Ca (mEq/L) 135.1 ± 5.9 138.0 ± 5.3 Na (mEq/L) 3.92 ± 0.67 4.16 ± 1.24 K (mEq/L) Tomado de PEREZ, et al. (1997). POS - EJERCICIO GIII (n=12) GIV (n=19) 90.0 ± 5.8 87.1 ± 6.1 2.95 ± 0.35 3.11 ± 0.36 135.6 ± 5.9 136.0 ± 6.2 3.12 ± 0.76 3.57 ± 0.52 GARCÍA et al. (1999) relatan que la concentración de Ca sérico post-ejercicio disminuyó significativamente los días cero y 15 de entrenamiento, posteriormente los promedios post-ejercicio se mantienen en valores similares al reposo que indicaría una menor pérdida de Ca, y refleja en parte, una adaptación de los caballos al tipo de ejercicio que realizaron. 75 TABLA 17. Valores de C, Ca y Na, en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, en un período de 45 días. DÍAS 0 15 DÍAS Reposo Post Reposo Post – ejercicio ejercicio 89,8 ± 88.4 ± 89.6 ± 88.3 ± 1.5 1.3 1.1 1.2 35 ± 1.0 3.3 ± 01 3.6 ± 0.1 3.2 ± 0.1 C (mEq/L) Ca (mEq/L) 150.1 ± 149.1 ± 142.5 ± Na 1.9 3.8 (mEq/L) 3.4 Tomado de GARCÍA., et al. (1999). 145.3 ± 5.2 30 DÍAS Reposo Post ejercicio 87.7 ± 89.6 ± 0.9 1.2 3.5 ± 3.4 ± 0.1 0.1 147.8 ± 146.2 ± 1.8 2.6 45 DÍAS Reposo Post – ejercicio 90.8 ± 89.6 ± 1.0 1.3 3.5 ± 3.4 ± 02 0.1 153.4 ± 144.2 ± 2.0 2.6 3.3.2. Serie Roja El sexo influye en la respuesta hematológica al ejercicio, con un incremento en los valores de la serie roja (eritrocitos, hemoglobina y hematocrito) mayor en las hembras que en los machos, debido a la mayor capacidad de almacenamiento de eritrocitos por parte del bazo (GARCÍA, et al., 1995). En las gráficas 3, 4 y 5 se puede observar que la extraña diferencia en el aumento del porcentaje, entre el recuento eritrocitario (RE) y el hematocrito (Ht), refleja una disminución del 13 por 100 en el VCM. Por tanto, se puede decir que estas células rojas movilizadas por la contracción del bazo crean una población de eritrocitos en movimiento, caracterizada por células de un tamaño medio más pequeño (hipovolémicas) que las observadas en la población de eritrocitos en caballos en reposo. (GARCÍA et al., 1995). Las células hipovolémicas aparecen, al microscopio como unas células hinchadas que presentan una serie de prolongaciones cortas o espículas, recibiendo el nombre de equinocitos; éstas células son glóbulos rojos anormales que aparecen en la sangre periférica de caballos de cualquier raza, después de haber efectuado un ejercicio tanto aeróbico como anaeróbico. Su proporción aumenta con la intensidad del ejercicio, de tal forma que una contracción fuerte del bazo provocaría mayor cantidad de equinocitos, con la aparición de equinocitos más pequeños (GARCÍA et al., 1995). 76 56% 16 ERITROCITOS 15 14 13 12 11 10 9 R E GRAFICA 3. Recuento de eritrocitos (RE), de caballos en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. Tomado de GARCÍA, et al., 1995. HEMATOCRITO (%) 65 35% 62 59 56 53 50 47 44 R E GRÁFICA 4. Recuento de hematocrito (Ht) de caballos pura sangre en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. Tomado de GARCÍA et al., 1995. 77 48 V.C.M. (fl) 46 44 42 40 137% 38 36 R E GRÁFICA 5. Recuento del volumen corpuscular medio en caballos pura sangre en reposo (R) e inmediatamente después de un ejercicio corto de velocidad (E). Se muestran los valores ± SD y el porcentaje medio del cambio. Tomado de GARCÍA et al., 1995. 3.3.2.1. Eritrocitos El volumen de eritrocitos presenta un acentuado aumento durante la realización del ejercicio en los caballos, debido, inicialmente, a la contracción esplénica y a la redistribución de fluidos corporales circulantes, resultante del aumento de la presión arterial, y, posteriormente, por la reducción del volumen plasmático consecuente de la deshidratación. Este fenómeno es resultante del 50 – 60% de afinidad por el O2. Eso representa un ajuste compensatorio para la caída en la presión parcial de O2 arterial y de la saturación de hemoglobina. Un gran aumento en el volumen de eritrocitos (hipervolemia eritrocitaria), puede ser perjudicial a la hemodinámica durante el ejercicio, una vez que hay un consecuente aumento de la viscosidad de sangre. El aumento del volumen eritrocitario es un factor importante que contribuye para las elevaciones de la presión sanguínea y de la circulación sistémica durante el ejercicio, posibilitando las condiciones para el desarrollo de hemorragia pulmonar inducida por ejercicio en caballos. Como el volumen eritrocitario total (VT) en la circulación es uno de los mayores determinantes de la capacidad de transporte de oxigeno en los caballos, mediciones de volumen eritrocitario total pueden proveer algún índice de la capacidad del ejercicio. La medición del VT es frecuentemente basado en la utilización de Azul de Evans, un colorante que posibilita la medición del volumen plasmático utilizándose la técnica de la dilución del colorante (THOMASSIAN, 2000). 78 Como describen ARROYO et al. (2004) el eritrograma se ve afectado por el ejercicio físico como han observado muchos de los autores como Boucher, et al. (1981), Smith, et al. (1989), Escribano, et al. (1995), Arroyo (2003), Gouveia, et al. (2003) produciéndose un aumento en el número de eritrocitos, hematocrito y hemoglobina. Varios estudios relatan la correlación positiva entre la capacidad del ejercicio en razas de trote y volúmenes totales de hemoglobina y eritrocitos. Valores normales de volumen total de eritrocitos varían dependiendo de la edad, con valores menores de 44 ml/kg en potros de hasta 1 año, aumentando para valores medios de 63 ml/kg para animales de 3 años de edad es de 74 ml/kg para aquellos con 4 años de edad. Valores de 89 9 ml fueron determinados en PSI adultos y valores en torno de 78 a 102 ml/kg en PSI en entrenamiento (THOMASSIAN, 2000). Sobre condiciones de PO2 bajo en sangre, tales como, la disminución de la presión barométrica en grandes altitudes, ocurre un aumento del número de eritrocitos y de hemoglobina, como ayuda compensatoria de la deficiencia de oxigeno (DUKES, 1984). Se ha mencionado que el ejercicio estimula el conocido mecanismo de la contracción del bazo, expulsando células rojas a la circulación; por tanto, se produce una policitemia con un aumento del recuento medio de eritrocitos y del valor hematocrito. No obstante, se propone que en concentraciones muy altas de células rojas esta ventaja puede ser parcialmente contrarrestada por alteraciones en la dinámica del flujo sanguíneo, debido a un incremento en la viscosidad de la sangre, pudiendo llegar a tener efectos adversos, si existe además una gran pérdida de líquido por sudoración, como ocurre en las pruebas de resistencia (GARCÍA et al., 1995). 3.3.2.2. Índices eritrocitarios En la actualidad, se presta gran atención al estudio de los índices volumétricos (VCM, HCM y CHCM), como respuesta hematológica al ejercicio, reflejándose en valores anormales para estos índices. Se considera que las variaciones en los valores de VCM representan un indicador valioso de la potencia en la carrera (GARCÍA, et al., 1995). Una característica peculiar de la especie equina es la estabilidad del VCM, que se mantiene dentro de los límites aún cuando se presenta enfermedad (QUEIROZ, 2006). El VCM indica el volumen de un eritrocito por término medio, expresado en µm3 o fentolitros (fl = 10-15 litros), y se calcula dividiendo el volumen de células comprimidas o hematocrito (en ml/lt de sangre) por el recuento celular (en millones/mm3). El HCM es la medida de la cantidad media de hemoglobina de cada célula (µµg o picogramos = 10 12 g), y se calcula dividiendo la concentración de hemoglobina (en gr/lt de sangre) por el recuento celular (en millones/mm3). (GARCÍA, et al., 1995). 79 Según GARCÍA et al. (1995) encontraron un valor para el VCM que oscila entre 39 – 47 Fl, para caballos Pura Sangre Inglés ganadores de carreras, considerando que para esta raza un VCM > 47 Fl indicaría un entrenamiento deficiente, mientras que un VCM < 39 Fl indicaría fatiga por sobreentrenamiento, recuperándose estos animales con el descanso. La CHCM refleja la concentración media de hemoglobina sin tener en cuenta el volumen celular, y se expresa, en unidades de porcentaje. Se calcula dividiendo la concentración de hemoglobina (en gr/100 ml de sangre) por el volumen de células comprimidas (en ml / 100 ml de sangre). (GARCÍA et al., 1995). 3.3.2.3. Hemoglobina Según GARCÍA et al. (1999), en caballos criollos chilenos de rodeo, los incrementos significativos de hemoglobina, volumen Corpuscular Medio y Proteínas Totales reflejan una hemoconcentración de carácter relativo que puede estar determinada por la movilización de eritrocitos hasta el bazo (PERSSON, 1967), y por la salida de líquidos hacia el espacio extravascular con respuesta al ejercicio (CARLSON, 1987). Los valores obtenidos por GARCÍA et al. (1999), son de 11.9 ± 0.3 mg/dl en reposo a 15.3 ± 0.2 mg/dl post-ejercicio. TABLA 18. Valores de hemoglobina (Hb) en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 HEMOGLOBINA (mg/dl) 11.0 ± 0.3 Reposo 15.3 ± 0.2 Pos-ejercicio 11.6 ± 0.4 Reposo 15.2 ± 0.4 Pos-ejercicio 11.6 ± 0.3 Reposo 15.2 ± 0.3 11.7 ± 0.2 15.5 ± 0.5 Pos-ejercicio Reposo Pos-ejercicio Tomado de GARCÍA, et al. (1999) TABLA 19. Valores promedios de hemoglobina (Hb) en caballos chilenos en reposo y posterior a la competencia de rodeo. HEMOGLOBINA (g/dl) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 12.7 ± 1.8 14.2 ± 2.5 11.3 ± 1.2 12.2 ± 1.1 Tomada de PEREZ, et al. (1997). 80 3.3.3. Serie Blanca La cantidad de leucocitos aumenta de 10 a 30%, dependiendo de la intensidad del ejercicio, pero no es tan intenso como la de los eritrocitos. Durante ejercicios realizados por largas distancias y con baja a moderada intensidad, se observa leucocitosis resultante de la acción de liberación de cortisol, y también neutrofilia y linfopenia. En los ejercicios de rápida aceleración y alta intensidad, la leucocitosis es consecuente de la contracción esplénica. Además, como el ejercicio estimula la liberación de catecolaminas y los neutrófilos presentes en las paredes de los vasos son arrastrados para la circulación (THOMASSIAN, 2000). Respecto al Leucograma, partiendo de unos valores medios sanguíneos en reposo algo superiores en potros, según ARROYO, et al (2004) existe una mayor respuesta al ejercicio que en los adultos, con un predominio de linfocitos, frente a los adultos, donde el mayor porcentaje corresponde a los neutrófilos segmentados. El aumento de la frecuencia cardiaca y de la contractibilidad como resultado del esfuerzo muscular provoca el flujo de leucocitos que se encuentran detenidos en el lecho vascular hacia los vasos de mayor calibre (GARCÍA et al., 1995). La mayoría de los autores señala que el ejercicio es un factor de estrés en la prestación de los caballos, y produce en ellos una respuesta leucocítica típica, caracterizada por un incremento de leucocitos en la sangre. Existen diferencias importantes cuando se somete a los animales a distinto grado de ejercicio; durante el ejercicio de intensidad máxima, aparece una leucocitosis con neutrofilia y linfocitosis, por la movilización celular sanguínea, consecuente al estímulo simpático. Se observa un cierto grado de eosinopenia como respuesta al ejercicio, puesto que en situaciones estresantes los eosinófilos tienden a retirarse a sus lugares de reserva (mucosa gástrica, pulmones, tejido linfático). (HOUDGSON et al., 1994). Se considera que el bazo puede ser un lugar de producción importante de linfocitos; por lo que el alto nivel conseguido por estas células, justo después del ejercicio máximo, se explicaría por la liberación esplénica inducida por el mismo. Cuando el ejercicio es menos intenso y constante durante largos períodos (ejercicio de resistencia), los cambios en el leucograma son diferentes, con una marcada leucocitosis; ésta es debida a la neutrofilia, ya que en este tipo de ejercicio se aprecia una disminución de número de linfocitos, debido probablemente a los altos niveles de cortisol encontrados. Se ha comprobado que el cortisol produce una disminución en la migración de neutrófilos intravasculares y que estimula su producción en la médula ósea e induce la disminución de eosinófilos que acontece en este tipo de ejecicio.(GARCÍA et al., 1995). Con el ejercicio intenso se produce una trombositosis fisiológica (aumento del número de plaquetas), ya que la actividad muscular produce una movilización de dichas células desde el bazo y otros compartimentos corporales, como el pulmón. En caballos P.S.I., 81 sometidos a un ejercicio intenso, se ha observado un incremento de 205000 plaquetas en reposo, a 247500 tras el ejercicio (GARCÍA et al., 1995). 3.3.4. Bioquímica Sanguínea Las enzimas mas utilizadas comúnmente para indicar lesión muscular son aspartato aminotransferasa (AST), creatin kinasa (CK) y lactato deshidrogenasa (LDH), aunque el lactato deshidrogenasa sea menos específica que las demás enzimas anteriormente mencionadas. Niveles séricos de CK y AST elevados son indicativos de lesión muscular, una vez, que son observados en caballos con rabdomielosis. Entre tanto, la ocurrencia de aumentos moderados de esas enzimas en caballos considerados hígidos, sometidos a ejercicios de moderada a alta intensidad, pueden ser encontrados regularmente. Algunos autores sugirieron que las elevaciones moderadas de las enzimas musculares después al ejercicio son resultantes de alteraciones de la permeabilidad de la membrana celular, y no propiamente de lesión en las células musculares. Solamente altos niveles de actividad plasmática de CK (>10000 U/L) pueden ser indicativos de ocurrencia de lesión muscular. TABLA 20. Valores de AST y LDH en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 Reposo Pos-ejercicio Reposo Pos-ejercicio Reposo AST (U/L) 196 ± 19 224 ± 21 225 ± 29 238 ± 25 206 ± 27 LDH (U/L) 310 ± 30 358 ± 30 310 ± 24 375 ± 29 299 ± 18 Pos-ejercicio Reposo Pos-ejercicio 238 ± 28 177 ± 15 208 ± 20 345 ± 22 298 ± 20 349 ± 24 Tomado de GARCÍA, et al. (1999). Las enzimas medidas para la evaluación de la función hepática son la gamaglutamiltransferasa (GGT) y la fosfatasa alcalina (FA). En los casos de alteración hepatocelular y compromiso de los canales biliares, los valores séricos de esas enzimas estarán aumentados. En caballos de carreras en entrenamiento, se puede encontrar aumento significativo de la actividad enzimática de la GGT sin que el caballo presente señales clínicas de lesión hepática y sin estar asociado con la caída del desempeño atlético (THOMASSIAN, 2000). 82 TABLA 21. Valores encontrados de GGT y AST (U/L) en equinos atletas de Competición Completa de Equitación. ANIMAL 1 2 3 4 5 6 MÉDIA REPOSO GGT 17 9 9 4 19 9 11 AST 420 350 280 210 350 280 315 IMEDIATAMENTE 10 min POSPOS-EJERCICIO EJERCICIO GGT 17 11 13 9 24 13 15 AST 210 420 350 350 420 420 362 GGT AST 13 420 13 420 11 420 11 350 26 350 11 350 14 385 20 min POSEJERCICIO GGT 21 13 9 7 21 15 14 AST 350 420 350 210 420 350 350 2 horas POSEJERCICIO GGT 15 11 11 7 21 11 13 AST 350 350 350 210 420 350 338 Datos obtenidos el primer día del Concurso completo de Equitación, en reposo y después del recorrido por caminos y senderos; realizado en Río de Janeiro – Brasil (2006). TABLA 22. Valores promedio de AST y LDH en caballos chilenos en reposo y posterior a la competencia de rodeo. AST (U/L) LDH (U/L) REPOSO GI (n=70) GII (n=40) 208.8 ± 89.0 234.2 ± 142.7 268.2 ± 77.3 346.1 ± 147.8 POS – EJERCICIO GIII (n=12) GIV (n=19) 155.0 ± 41.4 339.8 ± 146.5 265.7 ± 50.2 201.4 ± 67.2 Tomada de PEREZ, et al. (1997). De los glucocorticoides, el nivel de cortisol presenta la condición de estrés, y es una de los principales hormonas que se presenta alterada en el ejercicio; se observa valores de dos a tres veces mayores que en reposo, retornando a los valores basales después de aproximadamente 4 horas de la finalización de la actividad física. En caballos de resistencia, durante la prueba, los valores de cortisol pueden ser hasta 30% más (THOMASSIAN, 2000). 3.3.4.1. Lactato Las mediciones de las concentraciones de lactato en sangre en caballos de deporte reflejan su condición muscular, es decir, se tiene como referencia el umbral de lactato en la sangre (V4), revelan las condiciones reales del metabolismo aerobio y anaerobio del sistema músculo-esquelético (THOMASSIAN, 2000). 83 TABLA 23. Ensayo de desempeño en caballos atletas de la competición completa de equitación. ANIMAL REPOSO IMEDIATAMENTE 10 min POS- 20 min POS- 2 horas POSPOS-EJERCICIO EJERCICIO EJERCICIO EJERCICIO 0,41 8,31 8,32 8,01 1,72 1 0,59 4,00 1,85 2,14 0,73 2 0,67 5,34 4,28 3,55 1,08 3 0,49 5,59 3,52 1,98 0,45 4 0,60 7,16 6,55 5,73 1,03 5 0,79 2,96 1,84 1,40 0,97 6 0,59 5,56 4,39 3,08 1,00 MÉDIA Se observan los valores de ácido láctico medido en mmol/L en cada uno de los individuos y el promedio entre el grupo de animales; en reposo, inmediatamente después del ejercicio, 10 minutos, 20 minutos y 2 horas después del ejercicio. Estudio realizado en Río de Janeiro – Brasil, con caballos de la Escuela de Caballería Andrade Neves (2006). El lactato es producto del metabolismo muscular en cualquier tipo de ejercicio y el aumento de su concentración es consecuente de la limitación de la disponibilidad de oxígeno para la oxidación del piruvato en la mitocondria. De esta forma, la relación entre la concentración de lactato es la velocidad de ejercicio obtenida en las pruebas de ejercicio, ilustra la situación en la cual hay un aumento exponencial de sus concentraciones sanguíneas cuando la contribución de energía aeróbica comienza a ser insuficiente frente a los requerimientos energéticos totales. La intensa producción de lactato resulta en la disminución del pH, el cual puede limitar la capacidad para el trabajo por interferir en la actividad enzimática muscular. El término V4 representa la velocidad en m/s, en la cual la concentración de lactato en sangre es de 4mmol/L, y es considerado un valor repetitivo y confiable para la determinación del nivel de acondicionamiento. Por lo tanto, podemos afirmar que la velocidad en la cual la concentración de lactato alcanza el valor de 4 mmol/L de sangre (V4), es utilizada para determinarse la aptitud atlética de un caballo (THOMASSIAN, 2000). Las mediciones de lactato permiten la adopción de conductas preventivas a la salud atlética del caballo, como la modificación del programa de entrenamiento. Siendo así, el conocimiento de los valores de lactato sanguíneo auxilia en la evaluación de la capacidad atlética de un caballo sometido a determinado programa de entrenamiento, de modo tal, que alteraciones en este entrenamiento puedan mejorar su desempeño y prevenir lesiones, que a veces pueden pasar desapercibidas, o observadas tardíamente, y que estén limitando su capacidad funcional (THOMASSIAN, 2000). El acumulo de lactato en el músculo, y la consecuente acidosis intracelular puede perjudicar la glucosa, la capacidad respiratoria de la mitocondria (COUROUCÉ, 1998) y estar relacionado a una falla en el equilibrio homeostático ADP/ATP en el sitio de ligación miosina – actina. El aumento de ADP local puede causar pérdida del desarrollo por fatiga muscular, siendo el principal impedimento para la continuidad del trabajo (HARRIS & HARRIS, 1998). 84 Uno de los efectos del entrenamiento es aumentar la intensidad del ejercicio en el cual el lactato comienza a acumularse (umbral anaeróbico), después de mejorar la capacidad cardio-respiratoria del animal (EATON et al., 1999; COUROUCÉ, 1998). El hecho de que las concentraciones sanguíneas de lactato presentan elevaciones significativas durante el Campo traviesa indica que el esfuerzo al cual los animales fueron sometidos durante esta fase fue mas intenso. Otros autores (AGUILERA-TEJERO et al., 1998) demostraron que los equinos de salto, a pesar de que realicen pruebas con intensidad y duración baja, presentan acumulo de lactato y una pequeña perdida de líquido después del ejercicio, indicando que para pasar los obstáculos, los animales son sometidos a un gran esfuerzo. La reducción de las concentraciones de lactato entre las fases B y D muestra que la fase C del CCE es esencial para la recuperación cardiovascular y para la disipación del lactato acumulado durante la fase B (WILLIAMSON et al., 1996; WHITE et al., 1995), permitiendo que el animal comience la fase D, que es mas extenuante, en mejores condiciones metabólicas. QUEIROZ (2006), relata valores promedio de lactacto (mmol/L) de 12 en reposo, 18 inmediatamente después del ejercicio físico, 17 diez minutos pos-ejercicio, 16,5 veinte minutos pos-ejercicio, 13,4 dos horas pos-ejercicio. Los datos obtenidos (GOMIDE et al., 2006) muestran que la determinación de las concentraciones de lactato pueden ser utilizadas para distinguir diferentes tipos de ejercicio y comprender de una mejor forma la fisiología de los equinos durante el ejercicio, conforme lo citado por DESMECHT et al. (1996). A pesar de la variedad de razas y sus cruzamientos utilizados en pruebas de CCE, PRINCE et al. (2002) demostraron que, aunque hay diferencias metabólicas entre las razas Pura Sangre Inglés, y Pura Sangre Árabe, cuando estos son sometidos a la misma prueba, los animales no presentaron diferencias significativas en las concentraciones de lactato plasmático después del ejercicio. La concentración de lactato sanguíneo o sérico viene siendo utilizado con tanta frecuencia cuanto los parámetros clínicos y las informaciones adicionales sobre el acondicionamiento actual del atleta (LINDNER, 2000). 85 TABLA 24. Valores de Ácido láctico en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 ÁCIDO LÁCTICO Reposo Pos-ejercicio Reposo Pos-ejercicio Reposo 1.3 ± 0.1 7.8 ±1.7 1.8 ± 0.4 6.7 ± 1.3 1.3 ± 0.1 Pos-ejercicio Reposo Pos-ejercicio 5.7 ± 1.0 1.3 ± 0.2 9.6 ± 2.2 Tomado de GARCÍA, et al. (1999) Según MARLIN & NANKERVIS (2002), las pruebas de desarrollo en el campo son más específicos y realistas, principalmente si son similares a las condiciones de competición. La concentración de lactato sanguíneo es una variable que se afecta fácilmente en condiciones de campo (COUROUCÉ, 1998) y está relacionada a la intensidad del ejercicio, posibilitando evaluar el sistema de producción energética más utilizado (DESMECHT et al., 1996). La concentración de lactato es una variable que presenta mejor correlación con el desarrollo competitivo del animal (LINDNER, 2000). TABLA 25. Valores promedio de ácido láctico en caballos chilenos en reposo y posterior a la competencia de rodeo. ÁCIDO LÁCTICO (mmol/L) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 2.68 ± 0.92 18.7 ± 12.9 3.3 ± 2.5 2.9 ± 1.03 Tomada de PEREZ, et al. (1997). GOMIDE, et al. (2006) evaluaron las concentraciones sanguíneas de lactato durante la prueba de fondo del CCE. En su trabajo utilizó 13 equinos de raza, edad y sexo variados, durante una prueba de Competición Completa Internacional (CCI ***), selectiva para los Juegos Olímpicos de Atenas 2004, realizada en el estado de Sao Paulo – Brasil: Se tomaron muestras de sangre por la mañana con los animales en reposo, inmediatamente antes de las fases de Obstáculos y Campo traviesa y 10 minutos después de la fase Cross-country. El animal 12 fue el único que consiguió concluir la fase D de la prueba, los animales del Grupo I presentaron respuestas fisiológicas semejantes (Ver tabla 26 y gráfica 6). 86 TABLA 26. Media de la concentración de lactato sanguíneo (mmol/L). MOMENTO GRUPO I (media ± EPM) Animal 12 a Basal 15.0 ± 0.05 1.06 Pre – D 1.40 ± 0.10de 1.20 be Pos – B 6.95 ± 1.54 7.83 Pre – D 2.36 ± 0.18a 1.83 a Pos – D 11.57 ± 0.84 21.51 10 min Pos - D 8.74 ± 0.87b 24.96 Basal = antes de la prueba de fondo; Pre – B = antes del steeple-chase; Pos – B = después al steeple-chase; Pre – D = antes del Cross – country; Pos – D = después del cross-country; 10 min Pos – D = 10 minutos después a la preuba de fondo. Medidas seguidas de letras diferentes en la misma columna difieren por la preuba 1-Student (P<0.05) Tomado en los diferentes tiempos y fases estudiadas del grupo GI y concentración de lactato sanguíneo del animal 12 en la Competición Completa de Equitación, Sao Paulo: Sao Carlos, 2004. Tomado de GOMIDE, et al. (2006). GRÁFICA 6. Media de la concentración de lactato sanguíneo (mmol/L-1) en los diferentes tiempos y fases estudiadas, del grupo GI y del animal 12, en la Competición Completa de Equitación, Sao Paulo: Sao Carlos, 2004. Basal: antes de la prueba de fondo; Pre-B: antes del steeple-chase; Pos-B: después del steeplechase; Pre-D: antes del cross-country; Pos-D: después del cross-country; 10̀ minutos después de la prueba de fondo. Tomado de GOMIDE, et al. (2006). Encontraron en este estudio, aumento en los valores de lactato sanguíneo al final de la fase B, después de la fase C se observó una disminución significativa en las concentraciones de lactato. Al término de la fase D, hubo un aumento significativo, con 87 valores superiores obtenidos después de la fase B. Aunque en los animales del grupo GI, hubo una disminución significativa de lactato diez minutos después del final de esta fase. El animal 12 presentó elevación persistente de concentración sanguínea de lactato 10 minutos después de la fase D. Después de la fase D, algunos autores relatan valores diferentes a los de GOMIDE, et al. (2006), como WILLIAMSON, et al. (1996), que encontró valores plasmáticos medios de 18, 8 mmol/L; ANDREWS, et al. (1995), 18,4 mmol/L; MARLINS, et al. (1995), 22.4 mmol/L; WHITE, et al. (1995), 19.1 – 21.3 mmol/L. ACIDO LACTICO (mg/dl) Relatan MUTIS y PEREZ (2005), que los datos obtenidos en equinos atletas de salto en Bogotá, muestran desde el valor inicial un marcado aumento, por ejemplo entre el tiempo 0 (reposo) y el tiempo 1 (inmediatamente después del ejercicio) hay un aumento significativo (estadísticamente), pero entre el tiempo 1 y el tiempo 2 (entre ½ hora y 1 hora) este aumento es aún mayor, y entre el tiempo 2 y el tiempo 3 (entre 1 hora y 1 hora y media) sigue aumentando pero no tanto como en el margen anterior. Tomado como valor de referencia 3.6 – 14.5 mg/dl. Este parámetro es muy representativo a la hora de determinar el desempeño del caballo y la condición atlética en la que se encuentra. 40 35 30 25 20 15 10 5 0 34,12 29,44 20,6 15,98 T0 T1 T2 T3 TIEMPO GRÁFICA 7. Variación del ácido láctico en atletas equinos en diferentes tiempos de muestreo. Tomado de MUTIS y PEREZ (2005). TABLA 27. Valores promedio de ácido láctico en caballos chilenos en reposo y posterior a la competencia de rodeo. ÁCIDO LÁCTICO (mmol/L) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 2.68 ± 0.92 18.7 ± 12.9 3.3 ± 2.5 2.9 ± 1.03 Tomado de PEREZ, et al. (1997). 88 3.3.4.2. Proteína Plasmática Total La Proteína Plasmática Total (PPT) es importante para averiguar el nivel nutricional o una posible deshidratación. ANDREWS et al. (1995) encontró un valor de PPT en reposo de 7,2 ± 0,3 gr/dl, concordando con el valor encontrado por QUEIROZ et al. (2006) de 6,0 ± 0,8 gr/dl, dentro de los parámetros normales 5,3 – 7,4 gr/dl, en equinos de la modalidad de CCE. TABLA 28. Valores de proteína plasmática total en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 PROTEÍNA PLASMÁTICA TOTAL 7.5 ± 0.2 Reposo 8.0 ± 0.2 Pos-ejercicio 7.9 ± 0.2 Reposo 8.8 ± 0.2 Pos-ejercicio 7.9 ± 0.1 Reposo 8.6 ± 0.1 7.5 ± 0.3 8.4 ± 0.1 Pos-ejercicio Reposo Pos-ejercicio Tomado de GARCÍA, et al. (1999) TABLA 29. Valores promedio de proteínas plasmáticas totales en caballos chilenos en reposo y posterior a la competencia de rodeo. PROTEÍNAS PLASMÁTICAS TOTALES (g/L) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 71.4 ± 6.3 76.1 ± 9.2 70.5 ± 6.2 70.1 ± 5.2 Tomada de PEREZ, et al. (1997). 3.3.4.3. Glucosa Es sabido que la concentración de glucosa sanguínea observada durante el ejercicio refleja el balance entre la captación por el músculo en trabajo y su liberación desde el hígado por glucogenolisis (DELDAR et al., 1982). La demanda energética de caballos atletas aumenta en función del tipo y la duración de la actividad física. La producción y la utilización apropiadas de energía son esenciales para el equino atleta y posee una función crítica para el óptimo desempeño (EATON, 1994; HARRIS, 1998). La glucosa es una importante fuente de energía para la actividad muscular. Con el aumento de la intensidad del ejercicio, gran parte de la energía es generada a través de la glucosa anaerobia, con consecuente producción de ácido láctico. Cuanto mayor es la intensidad del ejercicio, mayor es la cantidad de lactato e H+ producidos (EATON, 89 1994). MUÑOZ et al. (1999) relatan que la energía muscular durante el cross-country es originada tanto por el proceso oxidativo cuanto por la glucosa anaeróbica, con consecuente producción de lactato. TABLA 30. Hallazgos hematológicos de los niveles de glucosa (mg/dl) en equinos de Concurso Completo de Equitación. ANIMAL REPOSO IMEDIATAMENTE 10 min POS- 20 min POS- 2 horas POSPOS-EJERCICIO EJERCICIO EJERCICIO EJERCICIO 86 105 97 96 88 1 90 12 97 83 90 2 70 79 72 63 82 3 83 74 80 91 105 4 90 85 80 91 95 5 96 69 85 89 89 6 86 80,7 85 86 92 MÉDIA Se observan valores individuales y el promedio en el grupo de animales, tomando muestras sanguíneas cuando el animal se encuentra en reposo, y después de la actividad física en diferentes tiempos de muestreo (inmediatamente terminado el esfuerzo físico, 10 minutos, 20 minutos y 2 horas pos-ejercicio). Este estudio fue realizado en Río de Janeiro – Brasil, en la Escuela de Caballería del Ejercito Brasilero Andrade neves. TABLA 31. Valores de glucosa en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 GLUCOSA Reposo Pos-ejercicio Reposo Pos-ejercicio Reposo 5.3 ± 0.1 5.6 ± 0.1 5.1 ± 0.1 5.5 ± 0.1 5.1 ± 0.1 Pos-ejercicio Reposo Pos-ejercicio 5.5 ± 0.1 5.4 ± 0.1 5.7 ± 0.1 Tomado de GARCÍA, et al. (1999) De otro lado MUTIS y PEREZ (2005), relatan en su trabajo una disminución marcada de los niveles de glucosa entre el tiempo 0 (reposo) y el tiempo 1 (inmediatamente después del ejercicio), en equinos atletas de salto, en la ciudad de Bogotá; esto es debido al enorme gasto energético presentado por el animal cuando comienza una actividad física. En el tiempo 2 (entre ½ hora y 1 hora después del ejercicio) se ve un ascenso del valor cercano al tiempo 0, y mostrando un retorno hacia los valores normales en el tiempo 3 (entre 1 hora y 1: ½ después del ejercicio). Tomando un valor de referencia de 90 – 114 mg/dl). Una vez el sistema aerobico comienza a ser insuficiente para suplir los 90 requerimientos energéticos totales, entonces la energía obtenida para el músculo esquelético proviene del sistema de recambio, de tal forma que se observa las siguientes variaciones: GLUCOSA (mg/dl) 110 107,05 105 105,5 100,06 100 95 92,35 90 85 T0 T1 T2 T3 TIEMPO GRÁFICA 8. Variaciones de la glucosa en equinos en diferentes tiempos de muestreo. Tomado de MUTIS y PEREZ (2005). QUEIROZ (2006), describe valores promedio de 85,8 mg/dl en reposo, 80,6 mg/dl inmediatamente después del ejercicio, 85,1 mg/dl 10 minutos pos-ejercicio, 85,5 mg/dl 20 minutos pos-ejercicio, 91,5 mg/dl 2 horas pos-ejercicio. TABLA 32. Valores promedio de glucosa en caballos chilenos en reposo y posterior a la competencia de rodeo. GLUCOSA (mmol/L) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 5.1 ± 0.7 5.7 ± 1.2 5.2 ± 1.3 5.3 ± 0.6 Tomada de PEREZ, et al. (1997). 3.3.4.4. Urea y creatinina Los niveles de urea y creatinina son utilizados para la evaluación de la función renal, y sus concentraciones están aumentadas en respuesta a la deshidratación y al ejercicio. Después de un ejercicio de alta intensidad se puede observar aumento en la concentración de creatinina, que se mantiene por aproximadamente 60 minutos después de finalizar el ejercicio. Las alteraciones de la función renal consecuente de la actividad atlética son temporales, por consiguiente, en los casos de ejercicio de larga duración, en 91 el cual normalmente ocurren grandes pérdidas de líquidos corporales por el sudor, se puede observar la manutención de altos niveles de urea y creatinina por una probable lesión renal aguda, como complicación común en caballos sometidos a prueba de entrenamiento (THOMASSIAN, 2000). 3.3.4.5. Nitrógeno Ureico Sanguíneo (BUN) Según MUTIS y PEREZ (2005), para equinos atletas de salto el BUN muestra un descenso leve entre el tiempo 0 (reposo) y el tiempo 1 (inmediatamente después del ejercicio), manteniéndose alto en el tiempo 2 (entre ½ hora y 1 hora después del ejercicio) y regresando casi a su valor normal en el tiempo 3 (entre 1 hora y 1: ½ después del ejercicio; tomando como valor de referencia 12 – 26 mg/dl. BUN (mg/dl) 17,8 17,65 17,6 17,58 17,55 17,4 17,2 17,09 17 16,8 T0 T1 T2 T3 TIEMPO GRÁFICA 10. Valoraciones del BUN en equinos en diferentes tiempos de muestreo. Tomado de MUTIS y PEREZ (2005). En el mismo estudio MUTIS y PEREZ (2005), relatan que en equinos atletas de salto de bajo desempeño, se arroja un comportamiento diferente. Es así como se describe que entre el tiempo 0 y el tiempo 1 el valor es igual, lo que puede indicar que el cuerpo del animal todavía no tiene respuesta o ningún tipo de cambio fisiológico que haga que el BUN aumente. Pero entre el tiempo 1 y el tiempo 2 el valor aumenta, lo que es esperado. Entre el tiempo 2 y el tiempo 3 el valor desciende rápidamente, que puede ser que el cuerpo respondió satisfactoriamente y reestableció de manera eficiente el agua corporal y el valor regreso a su margen normal. 92 18 17,87 BUN (mg/dl) 17,8 17,6 17,6 17,5 17,4 17,28 17,2 17 16,8 T0 T1 T2 T3 TIEMPO GRAFICA 11. Variación del BUN en atletas equinos de bajo desempeño atlético en varios tiempos de muestreo. Tomado de MUTIS y PEREZ (2005). 3.3.4.6. Creatin Kinasa (CK) CREATIN KINASA (mg/dl) MUTIS y PEREZ (2005) realizaron el muestreo de equinos atletas de salto, en los cuales describe un marcado aumento entre los tiempos 0 (reposo) y tiempo 1 (entre ½ hora y 1 hora), y dice que estos resultados indican lo sensible que esta enzima puede llegar a ser en momentos de ejercicio fuerte. Tomando como valor de referencia 60 – 330 UI/L). 160 140 120 100 80 60 40 20 0 145,58 98,07 T0 T1 TIEMPO GRAFICA 12. Variación de la CK en el grupo de atletas equinos en los tiempos T0 y T1. Tomado de MUTIS y PEREZ (2005). 93 QUEIROZ (2006), relata valores promedio de CK medido en U/L en equinos atletas de CCE de 56 en reposo, 93,2 inmediatamente después del ejercicio físico, 87,5 diez minutos pos-ejercicio, 102 veinte minutos pos-ejercicio, y 117 dos horas pos-ejercicio. TABLA 33. Valores de creatin kinasa (CK) en Caballos Criollos Chilenos de Rodeo, antes y después del ejercicio físico, durante un período de entrenamiento de 45 días. DÍA 0 DÍA 15 DÍA 30 DÍA 45 CREATIN KINASA 63 ± 8 Reposo 79 ± 10 Pos-ejercicio 81 ± 8 Reposo 100 ± 11 Pos-ejercicio 87 ± 24 Reposo 112 ± 30 57 ± 5 70 ± 6 Pos-ejercicio Reposo Pos-ejercicio Tomado de GARCÍA, et al. (1999). TABLA 34. Valores promedio de creatin kinasa (CK) en caballos chilenos en reposo y posterior a la competencia de rodeo. CREATIN KINASA (U/L) REPOSO POS – EJERCICIO GI (n=70) GII (n=40) GIII (n=12) GIV (n=19) 62.4 ± 27.1 102.5 ± 77.1 85.2 ± 42.2 67.8 ± 24.5 Tomada de PEREZ, et al. (1997). 94 METODOLOGÍA Se realizó la recolección de la información existente acerca de respuestas hematológicas y fisiológicas de los caballos de la competición completa de equitación. Se hizo una recopilación de los datos hematológicos que han encontrado muchos autores en estudios y experimentos hechos en equinos atletas de Competición Completa de Equitación, en reposo y sometidos a pruebas físicas, en este caso divididas en tres días, las cuales corresponden respectivamente a una prueba de adiestramiento, Campo traviesa y prueba de salto. Para eso se asistió a una Competición Completa de Equitación realizada en la Escuela de Equitación del Ejercito Brasilero, en el Regimiento de Caballería Andrade Neves, ubicada en Río de Janeiro – Brasil. Además se obtuvo información de algunos estudios que han hecho y han sido publicados, en diferentes países, tales como Chile, Argentina, Brasil y Colombia. A continuación se puede observar una tabla donde se describe, los sitios y el mes de donde fue recopilada la información para la monografía (Ver tabla 19): Tabla 35. Sitios y el mes donde fue recopilada la información de libros, artículos e Internet. 2006 2007 MES 2 3 4 5 6 7 8 9 10 11 12 01 02 Escuela de Caballería – Rio X X X X de Janeiro (Brasil). Universidad Federal de X Minas Gerais (UFMG) – Belo Horizonte (Brasil). Universidad Federal Rural X X X X X X X X X X X de Rio de Janeiro (UFRRJ) Universidad Federal X X X Fluminense (UFF), Niteroi – Rio de Janeiro (Brasil). Universidad Federal de X X Viçosa (UFV), (Brasil). Universidad Nacional de X Colombia, Bogotá. Hemeroteca, BogotáX X Colombia Universidad de Ciencias Aplicadas y Ambientales (U.D.C.A.), Bogotá. X X X Se pretende difundir por medio del texto escrito (monografía), y se tiene pensado hacer una página web de mediano a largo plazo donde se hable específicamente del Concurso 95 Completo de Equitación, de tal forma que los usuarios puedan consultar el tema, bajar artículos, preguntar y contribuir con la consolidación de dicha página. IMPACTO ESPERADO Con este trabajo se espera, conseguir la mayor información posible sobre equinos atletas en la modalidad de Competición Completa de Equitación, y las respuestas hematológicas y fisiológicas que presentan los animales antes y después del ejercicio. Al realizar esta recopilación se hará un análisis y con ello hacer un estudio de esta modalidad ecuestre que en nuestro país es poco estudiada, y con una visión a largo plazo contribuir en investigaciones y/o experimentos en los cuales se determine el desempeño atlético de los animales tomando como base una dieta alimenticia determinada, para mejorar su capacidad atlética y acondicionamiento físico. 96 DISCUSIÓN Los datos recolectados con respecto a la frecuencia cardiaca de los diferentes estudios hechos en equinos sometidos al CCE, a salto y a rodeo concuerdan en un aumento significativo después del ejercicio físico; lo que indica que todo tipo de ejercicio produce un aumento de la frecuencia cardiaca como mecanismo adaptativo para facilitar el aporte de sangre a los tejidos y así satisfacer el mayor requerimiento de oxígeno del músculo esquelético. Como se observa en la literatura consultada, los datos concuerdan con el aumento de la frecuencia cardiaca, señalando que el sistema cardiovascular manifiesta cambios más rápidos que el sistema muscular en respuesta a un programa de entrenamiento. GOMEZ, et al. (1999) relatan que los valores de la frecuencia respiratoria mostraron aumentos significativos, pero luego de algunos días de entrenamiento comienza a disminuir; lo que representa que a lo largo del entrenamiento hay una adaptación al ejercicio que se explica por: 1) Una adaptación física pulmonar ya que un entrenamiento no puede desarrollar el volumen respiratorio, pero puede incrementar la elasticidad pulmonar, con esto el tejido elástico pulmonar se optimiza, se acelera la velocidad de recambio de aire alveolar y por tanto aumenta la amplitud respiratoria. 2) Una mayor cantidad de glóbulos rojos y de hemoglobina que va en relación directa con un mayor transporte de oxígeno hacia los tejidos y una mayor eliminación de CO2 desde la sangre, “ambos fluidos gaseosos permiten mantener en equilibrio a los quimiorreceptores ubicados en grandes arterias como la aorta sensibles a los cambios de la presión parcial de O2, y los quimiorreceptores ubicados en la arteria carótida que son más sensibles a los cambios de la presión parcial de CO2, de tal forma que mantiene la frecuencia suficiente para permitir el intercambio gaseoso y suplir los requerimientos metabólicos de O2 durante el entrenamiento (ROBINSON, 1994)”. El aumento de los índices eritrocitarios, puede ser una consecuencia de la movilización esplénica de eritrocitos hacia la circulación, producido por el aumento de las catecolaminas circulantes debido a la activación del sistema nervioso simpático desencadenada por el ejercicio, o en una pequeña parte a la hemoconcentración resultante de un paso de fluidos fuera del compartimento intramuscular. La diferencia respecto a la concentraciones sanguíneas de lactato, encontradas por GOMIDE, et al. (2006) y diferentes a las encontradas por WILLIAMSON, et al. (1996), ANDREWS, et al. (1995), MARLIN, et al. (1995), WHITE, et al. (1995), puede estar relacionada a la intensidad del ejercicio, al acondicionamiento de los animales. Además ésta diferencia entre los datos de los diferentes autores antes mencionados, puede deberse al momento en el cual se hizo la colecta ya que en el estudio de GOMIDE, et al (2006) fue realizado en el segundo día del CCE, en contraste los otros estudios fueron 97 realizados en el primer día de competición, lo que quiere decir que los animales se encontraban en reposo más tiempo antes de la prueba física, por otro lado el segundo día del CCE es el más exigente y extenuante para los animales que los otros dos días de concurso. Según los datos obtenidos por GOMIDE, et al. (2006), las concentraciones sanguíneas de lactato presentan elevaciones significativas durante el cross-country, lo que indica que el esfuerzo al cual son sometidos los animales durante esta fase es más intenso que en el resto de la competencia; y aunque según este estudio los animales denominados GI presentaron disminución de los valores de lactato 10 minutos después de finalizar el ejercicio, no indica que el grupo GI tenga un mejor acondicionamiento físico ya que el equino 12 fue sometido a mayor esfuerzo, siendo el único que terminó la fase del crosscountry. Además la gráfica 6 muestra claramente que la fase Pre-D (antes del crosscountry) es indispensable para la recuperación y descanso del animal antes de iniciar la siguiente fase. Otros autores como MUÑOZ, et al. (1999); MARLIN, et al. (1995) y WHITE, et al. (1995) evaluaron solamente la fase D del concurso completo de equitación, demostrando un aumento de lactato significativo durante ésta fase, lo cual quiere decir que durante la prueba del cross-country ocurre una elevada tasa de metabolismo anaeróbico para suplir las demandas energéticas durante el ejercicio, con un consecuente acumulo de lactato y acidosis metabólica. “El lactato es uno de los parámetros que más variaciones presentan ya que es tal vez uno de los más indicativos para los caballos de deporte (MUTIS et al., 2005)”; estas variaciones pueden indicar que el acumulo de lactato en la sangre es alto (como es observado en los diferentes estudios realizados) debido al ejercicio de alta intensidad que realizan los equinos atletas, esto se debe a que a velocidades altas todos los caballos deben usar más de las vías de suministro de energía anaerobia para apoyar los requerimientos energéticos del ejercicio, y ocurre metabolismo anaerobio acelerado del glicógeno. Los datos obtenidos para glucosa por GOMEZ, et al. (1999) muestran una disminución marcada de este parámetro a lo largo del entrenamiento, lo que concuerda con el primer tiempo de muestreo de MUTIS y PEREZ (1995) quienes relatan una disminución al comienzo del ejercicio pero luego se observa un aumento en los demás tiempos de muestreo. La disminución notable en el estudio de GOMEZ, et al. (1999) es el resultado del balance entre el aumento del consumo condicionado por el aumento del trabajo muscular, asociados a una glucogenólisis y gluconeogénesis insuficiente para suplir la demanda del músculo (mecanismo aerobio) dependiendo casi en su totalidad de sus depósitos de glucosa, por eso el animal se fatiga, indicando depleción de los depósitos de glucosa a nivel muscular; lo que explica también la disminución de la glucosa al comienzo del ejercicio en el estudio de MUTIS y PEREZ (1995). Cuando se comienzan a restaurar y a equilibrar los depósitos de glicógeno del músculo y del organismo, se activa el mecanismo anaerobio y la energía utilizada es dada por el mecanismo de recambio donde actúa la fosfocreatina. 98 En el estudio hecho por QUEIROZ (2006); y MUTIS y PEREZ (2005) se observa al comienzo del muestreo un aumento en los valores de la creatin kinasa (CK), lo que indica que en este momento el caballo utiliza su principal fuente de energía que es la glucosa en el sistema aerobio, luego ésta energía química es transformada en energía mecánica dando paso al mecanismo anaerobio, lo que explica claramente la disminución de la CK en cuanto el ejercicio se intensifica y se torna más exigente para el animal. La CK aumenta en relación con la intensidad del ejercicio y del tiempo que dure el mismo ya que es específica del músculo y es indicativa de la actividad que este realice; esto se ve reflejado en los estudios hechos, ya que se observa el aumento y la variación de la enzima. Con respecto al BUN se observa un descenso leve, seguido de un marcado aumento, que puede deberse en gran parte a que el animal se encuentra haciendo un gran esfuerzo fisiológico, ya que hay una disminución del flujo sanguíneo a través del riñón lo cual es secundario al proceso de deshidratación (pérdida de fluidos por el sudor), que es una de las causas de la azotemia. En este mismo estudio se describe una respuesta un poco diferente en equinos de bajo desempeño atlético, y puede indicar que al comienzo el animal no consigue dar respuesta o tener algún tipo de cambio fisiológico, pero luego se obtiene una respuesta provocando el aumento en las concentraciones de BUN, a continuación hay un descenso rápido del BUN indicando que el cuerpo respondió satisfactoriamente y reestableció de manera eficiente el agua corporal, regresando el valor a la normalidad. 99 CONCLUSIONES La Competición Completa de Equitación o Prueba de los Tres días, es un deporte ecuestre bastante exigente y riguroso, que requiere de un buen desempeño atlético del animal, ya que comprende varias fases y por la complejidad de la prueba es realizada en tres días, aunque dependiendo de las condiciones y siguiendo el reglamento impuesto está prueba puede realizarse en un solo día con algunas modificaciones. Donde observamos algunos cambios fisiológicos y hematológicos que ocurren durante cada fase de está prueba, diferentes a otros deportes ecuestres, pero se puede decir que en general los caballos atletas independiente de la raza, edad o sexo sufren cambios adaptativos en respuesta al esfuerzo físico. Por otro lado está modalidad ecuestre anteriormente mencionada es poco desarrollada en nuestro país, y la mayoría de los datos obtenidos son realizados en estudios hechos en Brasil, donde este deporte es común para las escuelas de caballería de las diferentes organizaciones militares de este país. En el caballo al igual que el atleta humano, la frecuencia cardiaca y magnitud de la acumulación de lactatos sanguíneos y/o plasmáticos inducidos por el ejercicio son indicadores utilizados frecuentemente para evaluar la tolerancia al ejercicio y estimar el potencial rendimiento competitivo (PERSSON et al., 1995). También constituye uno de los parámetros más utilizados para evaluar el grado o nivel de aptitud física y para optimizar el nivel de entrenamiento, donde aquellos mejor entrenados o más atléticos tienen niveles más bajos de ácido láctico luego de completar un ejercicio estándar (BAYLY et al., 1987). Todo tipo de ejercicio produce un aumento de la frecuencia cardiaca como mecanismo adaptativo para facilitar el aporte de sangre a los tejidos y así satisfacer el mayor requerimiento de oxígeno del músculo esquelético (CLAYTON, 1991). El ejercicio produce una serie de cambios fisiológicos que se traducen, en primera instancia, en un aumento de la frecuencia cardiaca y respiratoria post – ejercicio como mecanismo adaptativo inmediato. Posteriormente, dichos valores van descendiendo paulatinamente en respuesta a la optimización del metabolismo energético aeróbico dado por el aumento de VCM y Hb post – ejercicio a lo largo del entrenamiento, permitiendo al individuo adaptarse al nivel de exigencia impuesto por el programa de entrenamiento. El coeficiente neutrófilos/linfocitos es de gran ayuda a la hora de evaluar la respuesta al ejercicio; ya que se produce una disminución en el cociente N/L típico de un ejercicio máximo a corto plazo, debido a la mayor liberación de linfocitos a la circulación, a pesar de aumentar también el número de neutrófilos. Por el contrario, en el ejercicio de larga duración, se produciría un aumento en el cociente N/L, por la disminución en el número de linfocitos circulantes. 100 El ejercicio físico provoca un incremento de los valores medios del eritrograma, leucograma y de unas células espiculadas que aparecen en sangre periférica llamados equinocitos. (ARROYO, S. F., 2004). La Creatin Kinasa y Ácido Láctico son parámetros muy importantes para ser analizados en la medicina deportiva, son muy específicos en este campo de trabajo porque indican variaciones y alteraciones muy específicas que se presentan en los equinos atletas. En contraste el BUN no es un parámetro muy específico para la medicina deportiva ya que no brinda información muy aplicada concerniente a alteraciones fisiológicas del ejercicio. 101 BIBLIOGRAFÍA - AGUILERA-TEJERO, E.; COUROCE, A.; PRINCE, A. (1998) Acid-base balance after exercise in show jumpers. In: CONFERENCE ON EQUINE SPORTS MEDICINE AND SCIENCE, (1998), Cordoba, Espanha. Anais… The Netherlands: Wageningen Pers. p.43-45, 272. - AITKEN, M.M.; J. SANFORD; G. MCKENZIE (1973) Factors influencing deceleration of heart and respiratory rates after exercise in the horse. Equine Veterinary Journal, v. 20, n.5, p. 8-14. - ANDREWS, F. M.; GEISER, D. R.; WHITE, S. L.; WILLIAMSON, L. H.; MAYKUTH, P. L.; GREEN, E. M. (1995) Haematological and biochemical changes in horses competing in a 3 Star horse trial and 3-day-event. Equine Veterinary Journal, v. 27, n. 20, p. 57-63. - ARROYO, S.F. (2003) Fisiología del ejercicio en el caballo: Generalidades. Escrito, disponible en: Departamento de Biología celular, Fisiología e Inmunología. Edificio C-1. Campus de Rabanales. CP: 14071. Universidad de Córdoba – España. - ARROYO, S. F.; DURAN, E.; BUENDÍA, A.; LUQUE, R. (2004) Fisiología del ejercicio en el caballo: Respuesta sanguínea - Equine exercise physiology: haematologic response. Escrito, disponible en: Departamento de Biología Celular, Fisiología e Inmunología. Edificio C-1. Campus de Rabanales. CP: 14071. Universidad de Córdoba – España. - ASOCIACIÓN COLOMBIANA DE CRIADORES DE CABALLOS P.S.I. – ASOCRIADORES (2007). Disponible en www.unaga.org.co/asociados/psi.htm. Con acceso el 4–02 /2007. - ASTRAND, P. O.; K. RODAHL (1986) Fisiología del trabajo físico: Bases fisiológicas del ejercicio. Editorial Médica Panamericana, Buenos Aires. Cap. 3, p. 112-118. - BORJAILLE, L. MARCELO (1997) Concurso Completo de Equitaçäo, CCE. Disponible en www.lechevar.br/deportes/eqüinos_brasil/provashipicas.htm. Con acceso el 28-11/2006. - BOUCHER, J. H.; FERGUSON E. W.; WILHELMSEM, C. L. (1981) Erythrocyte alterations during endurance exercise in horses. Journal Application Physiological, v7, n. 51., p. 32-34. 102 - CARDINET, G. H.; FOWLER, G. H.; TYLER, W. S. (1963). Heart and respiratory rates for evaluating performance in horses during endurance trail ride competition. Journal America Veterinary Medical Association, n. 143, p. 1303 – 1309. - CARDINET, G. H. (1989) Skeletal Muscle Function. In: KANEKO, J. Clinical Biochemistry of domestic animals. Cuarta Edición. Academic. Press. Inc., p. 932. San Diego. - CARLSON, G. P. 1987. Blood chemistry, body fluids and hematology. En: Equine Exercise Physiology 2. J.R. GILLESPIE and N.E. ROBINSON (eds.), ICEEP Publications. Davis, CA. (EEUU), p. 393-425. - CLAYTON, H. (1991) Conditioning sport horses. Sport Horses Publications, Saskatoon. Journal American Veterinary Medical Association, v.17, n. 201, p. 86 – 88. - COUROUCÉ, A. (1998) Endurance and sprint training. In: CONFERENCE ON EQUINE SPORTS MEDICINE AND SCIENCE. Cordoba, Espanha. Anais… The Netherlands: Wageningen Pers., p.190-202, 272. - DELDAR, A.; FREGIN, F. G.; BLOOM, J. C.; DAVANIPOUR, Z. (1982). Changes in selected biochemical constituents of blood collected from horses participating in a 50 – mile endurance ride. American Journal Veterinary Research, n. 43, p. 2239 – 2243. - DE LUCA, Leonardo J. (2000) Fisiología del Ejercicio (Laboratorio Burnet). Disponible en www.engormix.com/s_articles_view.asp?AREA=CAB&art=365. Con acceso el 09-11/2006. - DESMECHT, D.; FATON, M.; ROSE, J. (1996) Relationship of plasma lactate production to cortisol release following completion of different types of sporting events in horses. Veterinary Research Communications, v. 20, n. 4, p. 371-379. - DUKES, H. H. (1984) Fisiologia dos Animais Domésticos. Propriedades fisiológicas e Constituintes Celulares e Químicas do Sangue. Cap. 2, p. 13 – 72. - EATON, M. D. (1994) Energetics and performance. In: HODGSON, D. R., ROSE, R. J. The athletic hosr: principles and practice of equine sports medicine. Philadelphia. Edit. Saunders. Cap. 5, p. 49 – 62. - ENGELHARDT, W. V. (1977) Cardiovascular effects of exercise and training in horses, Advance Veterinary Science & Compendium Medical., v. 18, n. 21, p. 173205. 103 - ENGELHARDT, Wolfang V.; BREVES Gerhard (2004) Fisiología Veterinaria. Editorial Acribia S.A. España. Cap. 22, p. 511 – 518. - ESCRIBANO, B.; MILLER, H., ZAR, M. D. (1995) Observations on body weight and condition of horses. Equine Veterinary Science, n. 13, p. 310. - ESPERANZA, José María (2000). Concurso Completo de Equitación. Disponible en www.relichando.com/Didacticos/Deportes%20Ecuestres/Concurso%20Completo .htm. Con acceso el 31-01/2007. - EVANS, D.L. (1985) Cardiovascular adaptations to exercise and training, Veterinary Clinical North America, Equine Practice, n. 1, p. 513-527. - EVANS, D. L.; HARRIS, R. C.; SNOW, D. H. (1993) Correlation of racing performance with blood lactate and heart rate after exercise in Thoroughbred horses. Equine Veterinary Journal, n. 25, p. 441-445. - GARCÍA SACRISTAN, A.; CASTEJÓN MONTIJANO, F.; DE LA CRUZ PALOMINO, L. F.; GONZÁLES GALLEGO, J.; MURILLO LÓPEZ, M.; SALIDO RUIZ, G. (1995) Fisiología Veterinaria. Interamericana Mc Graw Hill. Madrid España. Cap. 75, p. 1016 – 1048. - GARCIA, M.; GUZMAN, R.; CABEZAS, M.; MERINO, B.; PALMA, C.; PEREZ, R. (1999) Evaluación del entrenamiento tradicional del caballo criollo chileno de rodeo mediante el análisis de variables fisiológicas y bioquímicas sanguíneas. Archivos de medicina veterinaria, Valdivia. Chile. V. 31, n. 2, p. 38 – 42. - GOODMAN, Nancy L.; ARTHUR, RICK M.; BAKER K. Bart; BLEVINS WILLIAM E.; COPELAN, Robert W. (1995) Clinicas Veterinarias de Norteamerica: Práctica equina. Inter-médica. Buenos Aires. Cap. 8, p. 309 – 352. - GOMEZ, C.; et al.(2006) Endocrinologic, hematologic and heart rate changes in horses, American Journal Veterinary Research, n. 47, p. 47 – 50. - GOMIDE, L. M. W.; MARTINS, C. B.; OROZCO, C. A. G. (2006) Concentrações sangüínea de lactato em eqüinos durante a prova de fundo do Concurso Completo de Equitação. Ciência Rural, v. 36, n. 2, p. 509 – 513. - GOUVEIA, A.; HARKINS, H.; PAGAN, M. N. (2003) Blood and muscle metabolic responses to draught work of varying intensity and duration in horses, Research Veterinary Science, n. 47, p. 102-109. - HARRIS, P. A.; HARRIS, R. C. (1998) Nutritional ergogenic aids in the horse – uses and abuses. In: CONFERENCE ON EQUINE SPORTS MEDICINE AND 104 SCIENCE, 1998, Cordoba, Espanha. Anais… The Netherlands: Wageningen Pears. p.203-218., 272. - HARRIS, P.; D. H. C. C. (1988) The effects of high intensity exercise on the plasma concentration of lactate, potassium and other electrolytes. Equine Veterinary Journal, n. 20, p. 109 – 113. - HOUDGSON, David R.; ROSE, R. Reuben (1994) The athletic hourse: Principles and practice of equine sport medicine. Hematology and Biochemistry. Edit. W.B. Saunders. Philadelphia. Cap. 5, p. 64-67. - JONES William (1995). Equine Sports Medicine. Philadelphia. Edit. Lea & Febiger. Cap 1., p. 1 – 2. - JONES William (2002). Exercise Physiology. Queensland – Australia. Disponible en: www.equinevetnet/veterinarian/sportmed/physiology.html. Con acceso el 0412/2006. - LINDNER, A. (2000) Use of blood biochemistry for positive performance diagnosis of sports horses in practice. Revue Medicine Veterinary, v.151, n.7, p.611-618. - MARLIN, D. J. ; HARRIS, P. A.; SCHROTER, R. C.; HARRIS, R. C.; ROBERTS, C. A.; SCOTT, C. M.; ORME, C. E.; DUNNETT, M.; DYSON, S. J.; BARRELET, F.; WILLIAMS, B. M.; CELIA, M.; CASAS, I. (1995) Physiological, metabolic and biochemical responses of horses competing in the speed and endurance phase of a CCI**** 3-day-event. Equine Veterinary Journal, n 20, p. 37-46. - MARTINEZ, R.; E. GONZALEZ; B. CAMPOS (1987). Lactacidemia post-trabajo supramaximal en equinos F.S.C. de alto rendimiento, Archive Medicine Veterinary n.19, p. 57-62. - MARTINEZ, R. (1989). Bases fisiológicas para el manejo hípico del equino F.S.C., Monografías Medicas Veterinarias. Chile; n. 11, p. 20 – 41. - MARTINEZ, R.; G. FILGUEIRA; R. CARRILLO; A. WHITE (1994) Registro continuo de frecuencia cardiaca en equinos de diferente aptitud competitiva sometidos a ejercicio, Monografías Medicina Veterinaria, n.16, p. 81-86. - MARLIN, D.; NANKERVIS, K. (2002) Indicators of performance. In: MARLIN, D.; NANKERVIS, K. Equine exercise physiology. Great Britain: Blackwell. Cap. 8, p. 245-260. - MILLER, P. A.; LAWRENCE L. M. (1986) Changes in equine metabolic characteristics due to exercise fatigue. American Journal Veterinary Research, n. 47, p. 2184 – 2186. 105 - MILNE, D. W.; R. T. SKARDA; A. A. GABEL; L. G. SMITH; K. AULT (1976). Effect of training on biochemical values in standard bred horses, American Journal Veterinary. Research, n.37, p. 285-290. - MILNE, D. W. (1982) Biochemical parameters for assessment of conditioning in the horse. Proceeding American Equine Practice, n. 28, p. 49 – 53. - MOREHOUSE, L. E.; J. R. MILLER (1974) Fisiología del ejercicio. El Ateneo, tercera edición. Buenos Aires. Cap. 6, p. 146 – 156. - MUÑOZ, A.; RIBER, C., SANTIESTEBAN, R; LUCAS, R. G.; CASTEJON, F. M. (1999) Cardiovascular and metabolic adaptations in horses (Equus caballus) competing in cross – country events. Journal of Veterinary Medical Science, v. 61, n. 1, p. 13 – 20. - MUTIS, C. A. & PÉREZ T. E. (2005) Determinación y análisis de valores de nitrógeno ureico en sangre (BUN), glucosa, creatin kinasa (CK) y ácido láctico pre y post ejercicio en una población de atletas equinos de salto en Bogotá, D.C. REDVET. Colombia. v 6, n. 2. Disponible en: www.veterinaria.org/revistass/redvet/ n202065.htm. Con acceso en 23/08/2006. - PEREZ, M. V.; GARCÍA, M. V.; CABEZAS, M. V.; GUZMÁN, M. V.; MERINO, B. Q.; VALENZUELA, B. Q.; GONZALES, C. (1977) Actividad física y cambios cardiovasculares y bioquímicos del caballo chileno a la competencia de rodeo. Archivos de Medicina Veterinaria. Valdivia – Chile. V. 29, n. 2, p. 126 – 130. - PERSSON, S. G. B. (1967) On blood volume and working capacity in horses. Studies of methodology, physiological and pathological variations. Act veterinary seand, n. 19, p.1189. - PERSSON, S. G. B. (1993) Evaluation of exercise tolerance and fitness in the performance horse. En: D. H., PERSSON, S. G. B., ROSE, E. J. Equine Exercise Physiology. Granta Editions, Cambridge. Cap. 14, p. 441 – 456. - PERSSON, S.G.B.; B. Essen-Gustavsson; P. FUNKQUIST; L. BLANCOROMERO (1995) Plasma, red cell and whole blood lactate concentrations, during prolonged treadmill exercise at VLA4, Equine Veterinary Journal, n.18, p.104-107. - PRINCE, A.; PRAT, M.; COLAND, S. B.; REJ, U. (2002) Comparison of the metabolic responses of trained Arabians and Thoroughbreds during high- and low intensity exercise. Equine Veterinary Journal, n. 34, p.95-99. 106 - QUEIROZ DE ALMEIDA, Fernando. (2006) UNIVERSIDADE FEDERAL DE VICOSA. SAEG – Sistema de analises estatísticas e genéticas. Versão 8.0. Viçosa, MG. P. 141. - REGLAMENTO DE CONCURSO COMPLETO DE EQUITACIÓN (2007). Fedecuarg. Disponible en: http://72.14.209.104/search?q=cache:ZNuiXAoWGpIJ: www.rfhe.com/Reglamentos%2520Propuesta/NUEVO%2520REGLAMENTO%252 DE%2520CONCURSO%2520COMPLETO%2520DE%2520EQUITACI%C3%93N .doc+Competici%C3%B3n+Completa+de+Equitaci%C3%B3n&hl=es&gl=co&ct=cl nk&cd=6. Con acceso el 20-01/2007. - RIVERO, J. L.; RUZ, M. C.; SERRANO, A.; GALISTEO, A. M. (1993) Efecto del entrenamiento y desentrenamiento sobre la proporción de los tipos de fibras musculares en diferentes razas de caballos. Avances en Ciencias Veterinarias, n. 8, p. 110 – 118. - ROBINSON, E. (1994) Fisiologia veterinaria. Editorial McGraw-Hill. México. Cap. 5, p. 716. - SILVEIRA, J. M. (1988) Patologia Clínica Veterinária, Teoria e Interpretação. Hematologia Clínica, Cap. 1, p. 2-14. - SIN AUTOR (2006) Concurso Completo de Equitação. Disponible em www.hipismobrasil.com.br/modalidades/cce.asp. Con acceso el 30-01/2007. - SIN AUTOR (2006) Competición Completa de Equitación o Prueba de Tres días. Disponible en www.paginaswebz.com/directorioweb-deportes/equitaciónar/deportes .html. Con acceso el 28-01/2007. - SMITH, P. B.; PERRONE, K.; RUDOLPH, L. B.; BAKER, B. (1989) Large Animal Internal Medicine. Ed. WB Saunders Company. Philadelphia. Cap. 9, p. 365-370. - SNOW, D. H.; M. G. KERR; M. A. NIMMO; E. M. ABBOTT (1992). Alterations in blood, sweat, urine and muscle composition during prolonged exercise in the horse, Veterinary Record, n. 110, p. 377-384. - THOMASSIAN, Armen (2000) Medicina Esportiva Eqüina: Da inspeção ao computador: Parte 1. Documento, disponible em: Departamento de Cirurgia e anestesiologia – FMVZ – UNESP – BOTUCATU. Brasil. - WHITE, S.L.; ROSE, W. B.; MARR, L.; EADES, L. M. (1995). Heart rate response and plasma lactate concentrations of horses competing in the cross-country phase of combined training events. Equine Veterinary Journal, n.20, p.47-56. 107 - WILLIAMSON, L.H.; WITTWER, J.; ANDREWS, K. I. (1996). Biochemical changes in three-dayevent horses at the beginning, middle and end of Phase C and after Phase D. Equine Veterinary Journal, n. 22, p. 92- 98. 108