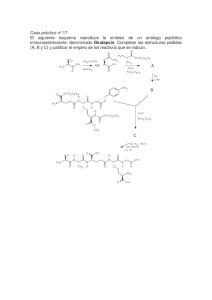
Serie de Problemas 2ºCuat 2016 Archivo
Anuncio

Serie de Problemas Cátedra de Química Orgánica Química Orgánica 63.14 Reglas de Nomenclatura IUPAC de Compuestos Orgánicos 1) Alcanos a) Se determina la cadena principal que contenga la secuencia de carbonos más larga. Si dos cadenas tienen la misma longitud se elige la más ramificada como principal. Dicha cadena recibe el nombre de hidrocarburo base. b) El nombre del hidrocarburo base según el número de carbonos comienza con: met, et, prop, but, pent, hex, etc . que corresponde a C1,C2,C3,C4,C5,C6 ,etc respectivamente más sufijo o terminación “ano” c) Las cadenas laterales se consideran sustituyentes que reemplazan los hidrógenos de la cadena principal. (ver item 4.- Radicales y Radicales complejos) El nombre del sustituyente alquilo se antepone al nombre del hidrocarburo base, junto con un número que indique el carbono de la cadena principal al que está unido dicho sustituyente. Los números de posición son separados de los nombres de los radicales o de la cadena mediante un guión. Ejemplo: d) Los carbonos de la cadena principal pueden enumerar en dos sentidos, según se elija un extremo u otro de la cadena para comenzar la numeración. Se escoge el sentido de numeración que le asigne al sustituyente en menor número posible. Ejemplo: e) Si hay varios sustituyentes en la cadena principal se ordenan alfabéticamente. Si dos sustituyentes están en el mismo carbono, a ambos se les asigna el mismo número. Ejemplos: Si hay dos o más sustituyentes idénticos, en el mismo o en distintos carbonos, se usan los prefijos “di”, “tri”, “tetra”. Los números de los sustituyentes se separan con comas. Estos prefijos no se alfabetizan. Tampoco se alfabetizan los prefijos n-, sec-, ter- etc , según corresponda. Los números se ordenan en orden creciente de magnitud. Ejemplo: Debe tenerse en cuenta que en un nombre debe haber tantos números como sustituyentes haya. 2/80 Química Orgánica 63.14 2) Alquenos y Alquinos Los alquenos y los alquinos se identifican usando prácticamente las mismas reglas que se emplearon para asignar nombres a los alcanos pero con algunas modificaciones. a) Se selecciona como cadena principal del hidrocarburo base la cadena continua más larga que contenga al doble (C=C) o triple (C≡C) enlace. Ejemplo: b) El nombre del hidrocarburo base se caracteriza por la terminación eno si tiene un enlace C=C y por la terminación ino si tiene un enlace C≡C. c) Se enumera la cadena principal de átomos de carbono que contiene el enlace múltiple, comenzando por el extremo más cercano a dicha unión. De esta forma, se asigna el número más bajo posible a la posición del enlace múltiple. Ejemplo: d) Delante del nombre del alqueno o alquino y separado por un guión se coloca el número que indica en que lugar de la cadena principal se inicia esta unión. Ejemplo: e) Los sustituyentes se nombran según las mismas reglas que los alcanos Ejemplo: f) Si existen dos o más enlaces idénticos en la misma cadena ,se usan los prefijos “di”,”tri”,”tetra”, y la terminación eno o ino según el elace que corresponda y el número de enlaces debe coincidir con los números que indicarán sus posiciones en la cadena principal separados por comas. Ejemplo: g) Cuando en el mismo compuesto existen enlaces dobles y triples, se escoge como cadena principal aquella que contenga el número máximo de estas uniones. Los dobles enlaces tienen precedencia sobre los triples al asignar el nombre. 3/80 Química Orgánica 63.14 Ejemplo: 3) Compuestos que contienen grupos funcionales a) Los compuestos orgánicos que contienen grupos funcionales se suelen representar genéricamente como R-X, donde X representa al grupo funcional y R a la cadena carbonada. b) Identificar según la Tabla Nº 1 adjunta al grupo funcional y adicionar al hidrocarburo base la terminación correspondiente. c) Cuando existen dos o más grupos funcionales en un compuesto se debe determinar cuál es el grupo principal, según la Tabla N°2 que indica el orden de prioridad de grupos funcionales. El grupo que está más arriba en este orden es considerado como grupo principal, y el resto como sustituyentes. d) Se escoge como cadena principal a la cadena contínua más larga que contiene al grupo principal. Ejemplo: Si se presenta más de una posibilidad, decidir tener en cuenta la siguiente secuencia de selección 1) La que contenga el mayor número de grupos principales 2) La que tenga el número máximo de enlaces múltiples. 3) La de mayor longitud 4) La de mayor número de enlaces dobles. Ejemplo: 4/80 Química Orgánica 63.14 e) Se enumera la cadena principal en tal forma que se usen los números más Bajos posibles para indicar la posición del grupo principal 1) Si la cadena principal es saturada se coloca un número que indica la posición del grupo funcional principal en la cadena (omitiendo la “o” final si el sufijo comienza con vocal) y por último el sufijo. Ejemplos: butanal, 2-butanol, 2-butanotiol. 2) Si la cadena principal contiene un enlace C=C se coloca un número que indica la posición del doble enlace, luego el nombre del alqueno (omitiendo la “o” final si el sufijo comienza con vocal) y por último el sufijo,que indica la posición y nombre del grupo principal . Ejemplo: 3-buten-2-ol, 4-penten-2-ona. 3) Si la cadena principal contiene un enlace C≡C, se coloca un número que indica la posición del triple enlace, luego el nombre del alquino, (omitiendo la “o” final si el sufijo comienza con vocal ) y por último el sufijo,que indica la posición y nombre del grupo principal . Ejemplo: 3-butin-2-ona f) Los grupos funcionales que no se escogieron como función principal son nombrados como sustituyentes según la Tabla Nº1, sus posiciones deben indicarse con la notación adecuada, ordenados alfabéticamente, los números se separan por medio de comas y de las palabras por medio de guiones. Ejemplo: 2,4-dibromo-3-pentanol 4) Radicales y Radicales Complejos i) Radicales alquilo, alquenilos y alquinilos. Tal como se mencionó anteriormente, un tipo de sustituyentes de las cadenas principales son las cadenas laterales, también conocidas como radicales. Pueden provenir de un alcano,alqueno o alquino y reciben el nombre de radical alquilo, alquenilo o alquinilo respectivamente. 5/80 Química Orgánica 63.14 ii) Radicales complejos a) Para dar nombre a un radical complejo, escoja la cadena continua mayor dentro del grupo, comenzando por el carbono ligado a la cadena principal. Cualquier grupo unido a esta cadena que se escogió se identificará como sustituyente de esta cadena en la forma usual. Ejemplo: b) La numeración del radical complejo se realiza a partir del carbono que está unido a la cadena principal o hidrocarburo base .Los números de los otros carbonos de esta cadena se colocan de acuerdo a éste. Ejemplo: c) El nombre completo del grupo complejo se encierra entre paréntesis y el número que denota su posición en la cadena principal del hidrocarburo base se coloca antes del primer paréntesis. Ejemplo: . 6/80 Química Orgánica 63.14 5) Nomenclatura de Aminas Las aminas pueden considerarse como derivados del amoníaco en las cuales uno o más de los hidrógenos han sido reemplazados por radicales alquílicos o arílicos, dando origen así a las aminas primarias, secundarias y terciarias. a) Para las aminas primarias (se ha reemplazado sólo un hidrógeno por una cadena alquílica o arílica) se las nombra tomando el nombre del radical sin la letra “o” final y agregando la palabra “amina”. Ejemplo: En caso de que el grupo amino no se encuentre en la posición terminal de la cadena ,se tomará como C1 el carbono en el cual se encuentra el grupo amino ,nombrándose la cadena como un radical compuesto. Ejemplo: b) Las aminas secundarias y terciarias se nombran como si fueran derivados de aminas primarias , precedidas por los nombres del o los grupos alquilos adicionales. Estos grupos alquilos se nombran anteponiendo la letra N– para indicar que se encuentran sustituyendo los hidrógenos de la amina y no la cadena principal. Ejemplo: 6) Nomenclatura en derivados del Benceno El anillo bencénico puede encontrarse en la molécula ya sea como sustituyente de una cadena principal (en cuyo caso se lo nombrará como radical, es decir fenilo), o bien como parte principal o base de la estructura .Las reglas de nomenclatura a adoptar en caso de que el benceno sea la estructura principal son las siguientes: a) Si el benceno está monosustituído, se le asigna el número 1 al carbono que porta la sustitución y el nombre se construye ligando el nombre del sustituyente con la palabra benceno, no siendo necesario citar el número del localizador. Ejemplo: etilbenceno. b) Si el benceno está polisustituído se debe elegir una numeración que le otorgue los menores números a todos los sustituyentes del anillo. Si varias de esas secuencias numéricas son iguales, se elige la que le asigna el menor número al sustituyente que precede por orden alfabético. El nombre se forma enunciando los sustituyentes por orden alfabético precedidos por sus números localizadores a los que le sigue la palabra benceno. Ejemplo: 1-etil-3,5-dimetilbenceno (los multiplicadores no se alfabetizan) c) Si el benceno está disustituído, siguiendo las reglas anteriores se puede obtener sólo tres tipos de sustituciones: 1,2- , 1,3- ; y 1,4-. A la sustitución 7/80 Química Orgánica 63.14 1,2- se la conoce como sustitución orto y se la puede abreviar con una odelante del nombre. Ejemplo: o-dinitrobenceno o 1,2-dinitrobenceno. De manera análoga, la sustitución 1,3 recibe el nombre de sustitución meta y la 1,4- sustitución para, abreviándose con una m y una p respectivamente. Ejemplo: m-nitroclorobenceno, p-dietilbenceno. Existen estructuras derivadas del benceno que poseen nombres propios que se utilizan comúnmente y son aceptados por la IUPAC. Los más comunes son: 8/80 Química Orgánica 63.14 Tabla 1 Prefijos y Subfijos para los Grupos Funcionales más Comunes Según la Nomenclatura de la IUPAC Grupo Funcional Prefijo O (carboxi-) OH (sulfo-) (alcoxicarbonil-) (haloformil-) O N R R (carbmoil-) (ciano-) (formil-) Subfijo -oico -carboxílico -sulfónico -oato -carboxilato -oilo -carbonilo -amida -carboxamida -nitrilo -carbonitrilo -al -carbaldehído (oxo-) -ona hidroxi- -ol amino- -amina En los casos en que hay dos subfijos para el mismo grupo funcional, el segundo se utiliza cuando el grupo funcional está ligado a un sistema cíclico. Los prefijos encerrados entre paréntesis rara vez se emplean en el nombre de los compuestos sencillos, apareciendo de forma casi exclusiva como subfijos. 9/80 Química Orgánica 63.14 Tabla 2 Prioridades para los Grupos Funcionales más Comunes Según la Nomenclatura de la IUPAC Prioridad Grupo Funcional 1 Nombre onio (ej: trimetilamonio) O 2 ácido carboxílico OH 3 ácido sulfónico 4 éster O 5 N R R amida 6 nitrilo 7 Aldehído 8 Cetona 9 alcohol 10 fenol 11 amina 12 alqueno 13 alquino 14 halógeno 15 nitro 16 fenilo 17 alquilo 10/80 Química Orgánica 63.14 Serie Nº 0 Nomenclatura Problema 1 Señale y nombre los grupos funcionales. a) b) CH3CH(OH)COOH e) c) d) OH HOCH2CHCHO O CH3CCOH O h) H HO HO H HC CHCH3 g) f) O CH3CH2COCH2CH2C N CH3CH2C CH i) CH3 O H2N C H OH OCH3 H3C CH CH3 CHO C OH C H C H C OH CH2OH j) OH CH3 l) m) CH3 H3C C C CH3 OH n) k) H2C O COR HC O COR H2C O COR H3C N H3C Br CH2 O H3C CH3 C C H C O O O NHCH3 H3C o) = N O H OH H H H Problema 2 a.- Reconozca y nombre los diferentes radicales unidos al anillo bencénico. 11/80 Química Orgánica 63.14 b.- Indicar como se denomina el siguiente radical: a) b) c) d) Iso-butilo Ter-butilo Sec-butilo 2-metilpropilo CH2 H3C C H CH3 Problema 3 A partir de las denominaciones de la siguiente lista, seleccione el nombre correcto para el siguiente radical y justifique por que descarta los demás. i.ii.iii.iv.- 2-metil-2-propilbutilo 4-etil-4-metilpentilo 4,4-dimetilhexilo 2-etilisohexilo Problema 4 Nombrar los siguientes compuestos utilizando las reglas de nomenclatura de la IUPAC. Problema 5 Dibujar las estructuras moleculares correspondientes a los siguientes nombres: a) 1-metil-3-n-propilciclohexano b) 1-isobutil-1-isopropilciclopentano c) 2-terbutil-1,5-dietilciclooctano Problema 6 Los compuestos de la siguente lista están erróneamente nombrados. Señale el error en cada uno e indique cuál sería el nombre correcto. a) b) c) d) e) 2,4-dietilpentano 2-isopropilbutano 1,5-dietilciclopentano 2,2-dibromo-4,4,5,5-tetrametilhexano 3-pentino 12/80 Química Orgánica 63.14 Problema 7 Formular las estructuras de los siguientes compuestos. j) Dimetil eter a) 2-aminoetanol k) Metiletil éter b) Propenal l) Ácido 3-aminopropanoico c) Butirato de isopropilo m) Diclorodifluormetano d) 2,4-pentanodiona n) Propanona e) Ácido 3-cloro-2,3-dimetilo) Ácido 2-butenoico butanoico p) 1,4-ciclohexadieno f) 2-bromo-3-clorobutilbenceno q) sec-butanol g) 2-bromoetanol r) 1,2,3-propanotriol h) Ciclohexilamina s) Fenol i) Ácido metanoico o ácido fórmico a) b) c) d) e) f) g) h) i) j) k) l) m) n) o) Problema 8 Formular las estructuras para los siguientes compuestos. 3-etil-3,4-dimetilhexano p) N,N-dimetil-4-vinilciclohexilamina 2,4,5-trimetiloctano q) 1,2-dietilbenceno cis-2-buteno r) p-terbutiltolueno trans-1,2-dicloroeteno s) m-dinitrobenceno 3-trans-3,4-dicloro-9-metildeceno t) benzoato de ter-butilo o benzoato de t-butilo 5-cloro-3-metil-3-hexen-2-ol u) heptanoato de sec-butilo 1-etinil-1-ciclohexanol v) benzamida 1,4-dimetoxi-2-penteno w) N-metilbenzamida ácido 3-cloropropanoico x) N-vinilformamida ácido 3-trans-2-etilpentenoico y) N,N-dibencilpropanamida 3-cloro-1-pentanol z) ácido acético 8-isopropoxi-6-vinil-3-nonanona aa) ácido benzoico 4-metil-2-pentanona ab) tolueno N-etilpentilamina ac) anilina 2-isobutilciclohexilamina Problema 9 Nombrar los siguientes compuestos utilizando las reglas de nomenclatura de la IUPAC. b) a) H3C CH3 CH CH2 CH3 H C CH2 CH CH2 CH3 CH3 d) CH3 CH3CH2CHCH2 C CH3 CH CH3 CH2 g) CH3 c) H2CCH3 CH2 CH2 CH2 C OH CH2 CH3 H3C CH2 CH2 CH2 e) O f) CH3(CH2)8 COOCH3 i) h) Cl O OH k) j) Cl O NH2 O OH H NH2 13/80 Química Orgánica 63.14 Serie Nº 1 Hibridización y Propiedades Problema 1 a) Formule las moléculas de propano, propeno y propino, utilizando fórmulas de Lewis, fórmulas desarrolladas y condensadas. b) Señale los enlaces y en cada una de las moléculas. c) Indique a partir de qué orbitales se forman dichos enlaces, cuáles son los ángulos de enlace y la hibridización de cada carbono. Problema 2 En los siguientes compuestos indicar la hibridización de los átomos, los enlaces y y la geometría de la molécula. Problema 3 En cada grupo, ordene los compuestos según la longitud creciente de los enlaces señalados. a) H3C C b) 1 2 CH H3C CH2 CH3 c) 1 2 H 3 H 1 C HC N C f) CH CH CH2 d) 3 1 Br C C C H 2 H3C Br H 2 CH3 1 H2C H3C 2 H 1 e) 3 CH3 H2C N 3 CH3 2 CH3 OH CH3 NH2 3 CH3 NH2 Problema 4 Indique la hibridización de los C, N y O presentes en los siguientes compuestos y establezca la geometría de la molécula. 14/80 Química Orgánica 63.14 Problema 5 a.- Completar el siguiente cuadro indicando el número de uniones presentes en la molécula. Sustancia Uniones s-s 3 3 sp -sp 3 sp -s 3 2 sp -sp 2 2 sp -sp 2 sp -s 3 sp -sp sp-sp sp-s H2CO CH3CCH CH2NCH3 CH3CHO CH3-COOH CH3CH2OH CHCNH2 Uniones π Sustancia Electrones n Totales Doble Triple H2CO CH3CCH CH2NCH3 CH3CHO CH3-COOH CH3CH2OH CHCNH2 b.- Indicar la geometría de cada una de las moléculas, analizar la presencia de uniones polarizadas y momento dipolar resultante y señalar las zonas de densidad de carga positiva y negativa. Problema 6 En la siguiente tabla se indican los puntos de ebullición, a 1 atmósfera de presión, de algunos hidrocarburos (alcanos) y los combustibles típicos en donde se los pueden encontrar. 15/80 Química Orgánica 63.14 Nombre Nº de átomos de C PEb (ºC) Combustible Metano 1 -162 Gas Natural Butano 4 -0,5 Gas Licuado (garrafas) Octano 8 126 Nafta Tetradecano 14 254 Gasoil Tricontano 30 446 Parafina (velas, vaselina) Explicar las secuencias de punto de ebullición observada. Problema 7 Indique cuáles son las interacciones intermoleculares existentes en cada uno de los siguientes grupos de compuestos y asigne los valores de punto de ebullición que correspondan a cada uno en las siguientes ternas: Puntos de ebullición Compuestos a) 118 ºC, 35 ºC , 99,5 ºC 2-butanol, 1-butanol, dietiléter b) 168 ºC, 36 ºC, 77 º C Pentano, acetato de etilo, ácido butanoico c) 49 ºC, 3 º C, -0,5 ºC Butano, trimetilamina, propilamina Problema 8 Justificar los siguientes hechos experimentales: a) El metanol es soluble en agua. b) El decanol es insoluble en agua c) Las sustancias no polares son solubles en CCl4 Problema 9 Ordenar las sustancias siguientes en forma decreciente de su solubilidad en agua: a) 1-dodecanol, etanol, 1-octanol. b) CH3CH2CH2CH2OH, CH3CH2CH2Cl, CH3CH2COOH, CH3OCH2CH3 Problema 10 Las etiquetas de 3 frascos con productos químicos líquidos se han desprendido, las etiquetas dicen: Los tres frascos se marcan con A, B y C y con los tres líquidos se hicieron las siguientes pruebas para identificarlas. Líquido Peb ( ºC ) (20ºc) , gcm-3 A B C 81 157 91 0,690 0,820 0,744 agua ins. sol. poco sol. Solubilidad etanol Éter etílico sol. muy sol. muy sol. muy sol. muy sol. muy sol. En función de los datos anteriores, determinar la identidad de los líquidos contenidos en los frascos A, B y C. 16/80 Química Orgánica 63.14 Problema 11 a.- Explique la variación de los puntos de ebullición de los siguientes compuestos Compuesto n-butanol iso-butanol ter-butanol Peb(ºC) 117 107 83 b.- Justifique el siguiente hecho experimental: El punto de ebullición del n-hexano es 68,7ºC mientras que el de su isómero 2,2dimetilbutano es 49,7ºC. c.- En la siguiente serie de compuestos, explique el comportamiento de los puntos de ebullición y la variación de las densidades. Compuesto Peb (ºC) (20ºc) , g/cm-3 63,3 0,664 60,3 0,653 58,0 0,662 49,7 0,649 Problema 12 El ácido oleico (C18H34O2) tiene un punto de fusión de 14 °C y es un contribuyente mayoritario del aceite de oliva, bajo la forma de un triester. Un isómero del ácido oleico, el ácido elaídico, tiene un punto de fusión de 43°C. Explique las diferencias de punto de fusión observadas entre ambos isómeros. O OH Acido elaidico (pf. 43°C) O OH Acido oleico (pf. 13°C) Problema 13 Indique si las siguientes moléculas pueden actuar como: a) b) c) d) Ácido de Lewis Base de Lewis Ácido y base de Lewis Ni ácido, ni base de Lewis 1) CH3OCH3 2) CH3COCH3 3) CH3CH2NHCH3 4) BH3 5) CH3COOH Justificando claramente su respuesta. 17/83 Química Orgánica 63.14 Problema 14 Justifique los siguientes hechos experimentales: a.- El propano es un gas a temperatura ambiente, mientras que el dietileter, con un M comparable, es un líquido. b.- Las aminas son básicas pero las amidas son neutras. c.- La solubilidad en agua del n-butanol es de 7g/100 mL, la del sec-butanol es de 12.5 g/100 mL mientras que la del ter-butanol es de 98 g/100 mL. d.- El etanol y el ácido adípico (ácido 1,6-hexanodioico) son solubles en soluciones de bicarbonato al 20 %. e.- El amoníaco es básico, pero el agua es neutra. Problema 15 Indique cuáles de las siguientes mezclas podrán ser separadas por el proceso de extracción ácido base con un solvente orgánico. Justifique su respuesta. a) OH O OH b) SO3H O NH2 NH2 c) d) NH2 CH3-(CH2)12-CH2OH COOH CH3CH2OH 18/83 Química Orgánica 63.14 Serie Nº 2 Estereoquímica Problema 1 a.- Escriba todos los isómeros de la fórmula molecular C5H12 e indique que tipo de isomería existe entre cada uno de los integrantes de la serie. b.- Idem que a.- pero con la fórmula C4H8. Problema 2 Para cada uno de los siguientes pares indique si son isómeros y en ese caso establezca que tipo de isomería presentan. Problema 3 Asigne prioridades relativas a cada conjunto de sustituyentes según las reglas de Cahn, Ingold y Prelog. a) -Br, -I , -OH, -CH3 b) -CH2CH2OH, -OH, -CH2Cl, -CH=CH2 c) -C6H5, -C≡N, -CH2I, -COOH, -CH2NH2, -CO-CH3, -CONH2 Problema 4 Escriba las fórmulas estereoquímicas de los siguientes compuestos. Nómbrelos por el sistema de nomenclatura E-Z. 19/83 Química Orgánica a) 63.14 HOH2CH2C CH HC CH2CH3 C CH2 b) CH2 d) Cl c) Cl H3CCH CClCH2CH3 Cl OH e) f) CH3 HO Cl H H H O H Problema 5 Nombre a los siguientes compuestos según las reglas de nomenclatura IUPAC. Problema 6 Dibuje los caballetes y las proyecciones de Newman para los siguientes compuestos e indique cuál o cuáles son los confórmeros más estables. a) butano; b) 1,2-etanodiol y c) ácido 3-cloropropanoico. Problema 7 1.-Represente las siguientes moléculas en poyecciones de Fischer. a) CN H H OH b) I COOH H H3C Br CHO c) H COOH CH3 H3C CH3 H2N H H Cl NH2 2.-Represente las siguientes moléculas en sus estructuras de caballete. a) b) H OH H3C H3C Br CH3 H2N H c) Cl H COOH H H CHO NC NH2 CH3 H 3.-Represente las siguientes moléculas en sus proyecciones de Newman. CONH2 a) CHO H Br H3C CONH2 H b) H2N COOH CH3 NC HO H c) H3CH2C H3C Cl H COOCH3 20/83 Química Orgánica 63.14 4.-Represente las siguientes moléculas en su representaciones de cuñas. a) H3CH2C b) CH3 H3C Br H CH=CH2 H HS H3C c) COOCH3 CH2CH3 CH3 SO3H H Br HO H CH3 Problema 8 Identifique los átomos de carbonos asimétricos en las siguientes sustancias. a) b) c) d) e) CH3-CH(Br)-CH2-CH3 CH3-CH(NH2)-COOH C6H5-CH(OH)-COOH CH3-CH(OH)-CH3 CH3-CH(Cl)-CH(OH)-CH3 Problema 9 El colesterol es una molécula orgánica de origen biológico presente en organismos del reino animal. En humanos, su presencia es esencial para asegurar un correcto funcionamiento de las membranas celulares y está vinculado a diversos procesos de síntesis hormonal, pero su excesiva concentración en sangre genera alto riesgo de enfermedades cardiovasculares. H H a.-Determine la cantidad de carbonos asimétricos existentes en la molécula de H H colesterol. HO b.-Discuta qué cantidad de enantiómeros y qué cantidad de diastereómeros tiene. Problema 10 Considerando el compuesto: HOOC-CH(OH)-CH(Cl)-COOH ¿Cuántas configuraciones son posibles? Indicar las relaciones entre ellos. Problema 11 Nombre los siguientes compuestos según la nomenclatura IUPAC mencionando la configuración R o S de los carbonos asimétricos cuando sea necesario. Problema 12 a.- Dadas las siguientes fórmulas estereoquímicas, indique cuáles corresponden a moléculas idénticas y cuáles a enantiómeros. 21/83 Química Orgánica 63.14 b.- Indique si existe alguna relación entre los compuestos A, B, C y D, justificando su respuesta y determine la configuración de los centros asimétricos como R o S. H H3CH2C COOH OH Cl CH3 A Cl CH3 OH H3C HOOC H B COOH H OH H3CH2C CH3 Cl C COOH Cl CH2CH3 HO H CH3 D Problema 13 En caso de existir dibuje el enantiómero de las siguientes moléculas: Problema 14 a) Nombre según IUPAC los siguientes compuestos: b) Escriba la estructura de los siguientes compuestos indicando todos los estereoisómeros posibles: i) 2-metilciclohexanol; ii) 1-metilciclohexanol; iii) 1,2-dimetilciclohexeno; iv) 1,3-dimetilciclohexeno; v) 1,3-dibromobenceno. Problema 15 Dados los siguientes compuestos, indique cuál de sus posibles confórmeros es el más estable. a) trans-1,2-dimetilciclohexano b) cis-1,2-dimetilciclohexano c) trans-1,4-diclorociclohexano d) cis-1-ter-butil-3-metilciclohexano h) CH2OH O e) trans-1-ter-butil-3-metilciclohexano f) cis-1,4-diisopropilciclohexano g) 1-metil-1-propilciclohexano OH OH OH OH 22/83 Química Orgánica 63.14 Problema 16 Explique el siguiente hecho experimental: el trans-1,3-dimetilciclohexano no tiene una conformación preferencial mientras que el isómero cis si la tiene. Problema 17 En los siguientes casos, de el nombre correcto de cada estructura, incluyendo la configuración R,S. a) OH b) c) HO COOH CH3 CH3 Br NH2 Problema 18 ¿Cuáles de las siguientes fórmulas representan compuestos meso? a) H H H CH3 OH OH OH CH3 b) c) H3C CH3 HO H HOOC d) COOH HO H Br Br Problema 19 Dados los siguientes pares de estructuras, indique si se trata de moléculas distintas, isómeros estructurales, enantiómeros, diastereoisómeros o moléculas idénticas. ¿Cuáles presentarán actividad óptica? 23/83 Química Orgánica 63.14 j) NH2 H COOH NH2 HOOC NH2 HOOC H H Problema 20 Explique la modificación del poder rotatorio observada en la siguiente serie de reacciones: CH3 H CH2OH ZnCl2/HCl CH2CH3 S-(-)-2-metil-1-butanol []D = -5,7 CH3 H Zn/H+ CH2Cl CH2CH3 S-(+)-1-cloro-2-metilbutano []D = 1,61° CH3 H CH3 CH2CH3 2-metilbutano []D = 0 Problema 21 El poder rotatorio del (S)-2-butanol es de +13,9°. Formule el compuesto. Indique el poder rotatorio del enantiómero y formule el mismo. ¿Qué puede decir de la composición de un 2-butanol de poder rotatorio nulo? Problema 22 a.- El mentol presenta una rotación óptica de +2,46° en una disolución que contiene 50 mg de mentol en 100 mL de solución etanólica, cuando se mide utilizando un tubo de 10 cm de longitud con lámpara de Na. A partir de estos datos, calcule la rotación específica del mentol. b.- La rotación óptica se utiliza en la industria como un método rápido para controlar la concentración jugos extraídos de caña de azúcar. Cuando 200 mg de azúcar de caña (sacarosa) se disuelven hasta completar 100 mL, la disolución resultante arroja una medición de +53.2° a 20 °C en un tubo de 40 cm. ¿Cuál es la concentración de otra disolución, medida en idénticas condiciones, si la rotación óptica medida es de +13.3°? c.- Se le encomienda controlar la producción de suero glucosado utilizando el poder rotatorio. Describa claramente el protocolo que utilizaría para realizar dicho control. Calcule cuál sería el valor esperado para las muestras de dicho suero, si se debe fabricar con una concentración de glucosa del 5% y se mide con un tubo de 10 cm. DATO: []D glucosa en equilibrio = +52.3° 24/83 Química Orgánica 63.14 Serie Nº 3 Reacciones Orgánicas – Mecanismos de Reacción Problema 1 a.- Discuta los diferentes tipos de reacciones orgánicas, desde el punto de vista de: i.-La ruptura de los enlaces ii.-El proceso que tiene lugar sobre el producto de partida b.- En qué consiste un “mecanismo de reacción”. Discuta la utilidad práctica de éste conocimiento. Problema 2 a.- ¿Qué es un intermediario de reacción? b.- ¿Qué tipos de intermediarios conoce y cómo se relacionan con la ruptura del enlace? Analice su geometría y disposición orbital. c.- ¿Qué es un estado de transición? Establezca las diferencias entre éstos y los intermediarios de reacción. Problema 3 a.- Ordene los siguientes radicales según su estabilidad creciente. b.- ¿Cuál de los siguientes carbocationes se formará más rápido? Justifique. CH2+ CH3 H3C C+ CH3 CH H3C + C H3C A CH3 CH3 CH H3C CH2+ CH2 H B C D c.- Si fuese factible obtener todos los carbocationes del ejemplo anterior en una reacción de sustitución, ¿dónde entraría el nucleófilo Nu en cada caso? d.- Idem que c.- pero en una sustitución radicalaria con los radicales del punto a.e.- Discuta por qué existe una mayor selectividad en la formación de los cationes que en la formación de los radicales. Problema 4 a.- Discuta las diferencias entre un mecanismo de reacción concertado y uno por pasos. b.- A que se llama el “paso lento” o “paso determinante de la velocidad de reacción”. c.- ¿A qué se denomina “orden de la reacción” y qué se entiende por “molecularidad de la reacción”. d.- Escriba de forma genérica las ecuaciones que rigen la velocidad de reacción en una reacción concertada y en una reacción en etapas. Para la reacción en etapas considere los siguientes casos: i) k1 << k2, k3 ii) k2 << k1, k3 iii) k3 << k1, k2 25/83 Química Orgánica 63.14 Problema 5 Para el siguente gráfico de energía vs. coordenada de reacción, responda: i.- ¿Es un proceso endotérmico o exotérmico? ii.- ¿Es un proceso concertado o es un proceos en etapas? iii.- ¿Existe un paso determinante de la velocidad de reacción? En caso de existir, señale cuál sería y como lo identifica. iv.- ¿Cómo se modificaría el gráfico cuando se acelera la velocidad de la reacción? ¿y cuando se desacelera? v.- ¿Cómo se modifica la velocidad de reacción si se usa el doble de concentración de reactivo? E Coordenada de reacción Problema 6 a.-Dibuje un gráfico de energía vs. coordenada de reacción para una transformación concertada endotérmica. b.-Dibuje un gráfico de energía vs. coordenada de reacción para una transformación en 3 etapas exotérmica, donde el paso determinante de la velocidad de reacción es el segundo. c.-Indique cómo se modificaría este último gráfico y la velocidad de reacción si: i.- El solvente estabiliza el primer intermediario de reacción ii.- El solvente estabiliza el segundo intermediario de reacción. 26/83 Química Orgánica 63.14 Serie Nº 4 Alcanos, Alquenos, Alquinos Problema 1 a.- ¿Cuáles son las fuentes de obtención de alcanos? Describa brevemente los procesos de obtención. b.- Indique cuál o cuáles son los productos de reacción que provienen del tratamiento del propano con exceso de oxígeno. ¿Es una reacción endotérmica o exotérmica?. ¿Es cinéticamente viable? Discuta su utilidad. Problema 2 a.- Escriba el mecanismo de reacción de la halogenación del metano. ¿Cuál es el paso determinante de la velocidad de reacción? b.- Explique el siguiente hecho experimental: la cloración es más rápida pero menos selectiva que la bromación. Problema 3 Prediga cuál será el principal producto de la monobromación en los siguientes ejemplos. Justifique su respuesta Problema 4 Formule los productos de las siguientes reacciones. En función del mecanismo de la reacción, indique la estereoquímica de los mismos y diga si presentan o no actividad óptica. a.- A M KMnO4 / OHH2O (frÍo) B HCl H2 / Pd Br2 / CCl4 HBr / ROOR L C O3 D K Br2 / H2O H2SO4 H2O 1.-B2H6 2.-H2O2 1.-Hg(OAc)2 2.-NaBH4 J Zn / H+ E+F H2O2 / OH- E+G H I 27/83 Química Orgánica 63.14 b.- A HCl Br2 / CCl4 H B Br2 / H2O H C Problema 5 Formule los productos de las siguientes reacciones indicando claramente su estereoquímica. a) b) H2 / Pt c) Br2 / H2O 1.-B2H6 2.-H2O2 d) Br2 / CCl4 Problema 6 Formule los productos de ozonólisis reductiva y oxidativa de los siguientes compuestos: a) b) c) d) e) Problema 7 Explique la diferente acidez de los siguientes hidrocarburos PKa CH3CH3 CH2=CH2 CH≡CH 49 44 25 Problema 8 Formule los productos de las siguientes reacciones A G+H 1.- O3 2.- Zn / H+ F B H2 / Pt desactivado 2 H2 / Pt 2 Cl2 / CCl4 H3C D+E 1.- O3 2.- H2O2/ HO- C CH 1.- O3 2.- Zn / H+ NaNH2 C D+E 28/83 Química Orgánica 63.14 Problema 9 Formule la siguiente reacción. Discuta el mecanismo de la transformación. H+ / H2O ? HgSO4 Problema 10 Deduzca las estructuras de los siguientes compuestos, conociendo el producto de la ozonólisis y apertura reductiva Fórmulas Moles de H2 consumidos C10H20 1 C6H12 1 Productos O O H H O O C6H10 2 H H O H O H O O C8H14 1 C13H24 2 C11H12 2 H H O O O O O O OH OH Problema 11 El y el -felandreno son terpenos que guardan entre si la relación de isómeros constitucionales y poseen una fórmula molecular C10H16. Con el objeto de establecer la estructura de ambos isómeros, se realizó una ozonólisis reductiva de los mismos, con los siguientes resultados: En función de los productos de ozonólisis y sabiendo que ambos consumen 2 moles de H2, determine la estructura de ambos productos naturales. 29/83 H Química Orgánica 63.14 Serie Nº 5 Halogenuros de Alquilo – Sustitución y Eliminación Problema 1 a.- Formule el mecanismo de la sustitución del bromuro por hidroxilo sobre el 2bromopentano, en concidiones de una SN2. Dibuje el diagrama de energía versus coordenadas de reación, indicando a que corresponde cada punto b.- Discuta la siguiente observación: El CH3Br reacciona con el KSCN en una concentración 0,1M en DMF, la velocidad inicial de formación del producto es de 2x10-8 M/seg. Experimentalmente se observa que al duplicar la concentración de ambos reactivos se cuadruplica dicha velocidad. Cuando la misma reacción se aplica sobre bromuro de terbutilo en etanol, al se duplicar la concentración, la velocidad se duplica. Problema 2 a.- Ordene los siguientes compuestos según su reactividad creciente frente a la SN2. Justifique. b.- Idem que a.-, pero con respecto a la SN1. Br Br Br Br B A C D Br Br Br Br E F G H Problema 3 a.-Prediga el producto principal de las siguientes reacciones, teniendo en cuenta su estereoquímica. b.-¿Se hubiese obtenido el mismo producto si la reacción se hubiese hecho en caliente? ¿Operaría el mismo mecanismo? Problema 4 Cómo obtendría el (R)-2-hexanol a partir del (R)-2-clorohexano? Problema 5 Justifique las siguientes observaciones: Experimento 1 CH3Cl + HO - CH3OH + Cl- CH3Cl + H2O CH3OH2 + Cl - + rápido muy lento 30/83 Química Orgánica 63.14 Experimento 2 CH3CH2Br + - NH2 CH3CH2Br + HO - CH3CH2NH2 + BrCH3CH2OH + Br- muy rápido rápido Experimento 3 La reacción del (3S)-3-bromo-4-metilhexano con carbonato en etanol/agua da como producto mayoritario el (3R)- y el (3S)-3-metil-3-hexanol. Experimento 4 La reacción del (2R,4S)-2-bromo-4-cloropentano con exceso de CN- en etanol da un producto ópticamente inactivo. Experimento 5 El bromometano se convierte en iodometano por reacción con INa en acetona a una velocidad superior que en metanol. ¿Cómo serían los diagramas de energía en cada caso? Experimento 6 La velocidad de la reacción de obtención de terbutanol a partir de bromuro de terbutilo se modifica muy poco si se cambia el halogenuro por cloruro de terbutilo. Experimento 7 CH3 CH2 OEtOH Br 10% O + 90% O- O + t-BuOH 85% 15% Problema 6 a.-Formule los productos principales en las siguientes reacciones, justificando a través del mecanismo de reacción involucrado. ¿Qué puede decir de la estereoquímica de los productos? OH H A H2SO4 / HCl / EtOH B b.-Explique por qué el (3R)-5-metil-3-hexanol retiene su actividad óptica en presencia de base acuosa pero se racemiza fácilmente en presencia de ácido acuoso. Problema 7 Postule los reactivos necesarios para preparar los siguientes compuestos a partir de halogenuros de alquilo por SN2: a) dietiléter b) (1R, 3R)-3-metilciclopentanol c) Fenilisopropiléter Problema 8 ¿Cuáles de los siguientes compuestos darán más rápidamente la reacción E2? 31/83 Química Orgánica 63.14 a) I I b) Br Br c) Cl I Problema 9 Prediga los productos de las siguientes reacciones CO32- / EtOH / H2O CO32- / EtOH / H2O A A Br Br Na+EtO- / EtOH B Na+EtO- / EtOH B Problema 10 i.-Para la reacción del 1-bromobutano con hidróxido de sodio en etanol en caliente, indique si las siguientes afirmaciones son verdaderas o falsas: a) El producto de sustitución predomina sobre el de eliminación. b) El 2-buteno es el producto mayoritario. c) Si se aumenta la concentración de base, aumenta la velocidad de reacción. ii.-Para la reacción del 2-bromo-3-metilbutano con carbonato de sodio en agua y etanol en caliente, indique si las siguientes afirmaciones son verdaderas o falsas: a) El producto de la eliminación predomina sobre el de sustitución b) El 3-metil-1-buteno es el producto mayoritario c) Si se aumenta la concentración de base, aumenta la velocidad de reacción. Problema 11 Complete las siguientes reacciones. Justifique la obtención del producto C formulando el mecanismo de la reacción. Indique cuantos estados de transición y cuantos intermediarios de reacción existen en dicha transformación. Problema 12 Explique el siguiente hecho experimental: El cloruro de mentilo reacciona con Na+EtO- / EtOH y calor 200 veces más lento que el cloruro de iso-mentilo. 32/83 Química Orgánica 63.14 Problema 13 a) En las siguientes transformaciones, complete los reactivos y/o productos, según corresponda. Ph B Ph Br Ph E Br A KOH calor + C Br2/hv C17H16 Br Ph Br OH D NaCN Ph Ph F KOH calor x b) Si se partiera del isómero de A, ¿qué ocurriría con las reacciones realizadas en el esquema anterior? ¿Qué productos se obtienen? Problema 14 Dado el siguiente esquema de reacciones: a.- Determine la identidad de los compuestos A, B y C. b.- ¿Qué tipo de reacción tiene lugar en cada caso? Nómbrelas y clasifíquelas según el mecanismo interviniente. c.- Analice la estereoquímica del/los producto/s resultante/s e indique si A, B y C tendrán o no actividad óptica. EtO- / EtOH / calor A Br NaCN / DMSO O2N B H 2O C Problema 15 La trementina es un producto que se obtiene por destilación con vapor de la resina de coníferas, y se suele usar como disolvente en pinturas, como aromatizante en diversos productos de limpieza, etc. Uno de los principales componentes de la trementina es el -pineno, de fórmula C10H16. La reacción del -pineno con O3/Zn/H+ da como producto la molécula que se muestra a continuación: H O O a.- Sabiendo que la hidrogenación catalítica del -pineno consume un mol de H2 por mol de sustancia, formule la molécula del -pineno. 33/83 Química Orgánica 63.14 b.- Formule las siguientes reacciones del -pineno: 1.-B2H6 2.-H2O 2 B -pineno H2SO4 (dil) frío A H2SO4 (c) caliente ¿Cómo justificaría la obtención de -pineno a partir de B? ¿Es la reacción inicialmente esperada? Justifique. c.- En la reacción del pineno con Br2/H2O se observa la formación de un único compuesto C, ópticamente activo. Justifique la formación de C formulando el mecanismo de la reacción. 34/83 Química Orgánica 63.14 Serie Nº 6 Hidrocarburos Aromáticos Problema 1 K+MnO4- / HO- K+MnO4- / HO- A D (diluido y frío) Complete la siguiente serie de reacciones: H2 / Pt / 20 atm. 350°C H2 / Pt 80°C B C Problema 2 a.- Escriba el mecanismo de la Sustitución Electrofílica Aromática (SEA) sobre una molécula de benceno, y utilizando un electrófilo genérico E+. b.- Dibuje un gráfico de energía vs. coordenada de reacción para la SEA. Problema 3 En cada uno de los casos, formule la obtención del electrófilo. a.- Cl2 / FeCl3 c.- SO3 / H2SO4 d.- HNO3 / H2SO4 b.- CH3Cl / AlCl3 Problema 4 a.- De los siguientes compuestos, indique el orden de reactividad frente a la reacción de nitración: O COOH A B NH OH NO2 Cl C D E F b.- Formule la racción de bromación con los compuestos A, C y F, indicando claramente a través del mecanismo, cuál es la o las orientacione relativas de la segunda sustitución. Problema 5 Formule los productos de las siguientes reacciones. Justifique mediante el uso del mecanismo de la reacción. a.- A K+MnO4- / HO- Br2 / CCl4 Br2 / h Br2 / FeBr3 B D CH3COCl / AlCl3 D C 35/83 Química Orgánica 63.14 b.Cl A HNO3 / H2SO4 B AlCl3 K+MnO4- / HO- ? c.1.-K+MnO4- / HO- A B HNO3 / H2SO4 2.- H+ C + D Problema 6 a.- Determine la estructura de un hidrocarburo aromático A, de fórmula C9H12. El compuesto A da sólo 2 isómeros por nitración y cuando se trata con permanganato caliente y posterior acidificación produce un ácido dicarboxílico. b.- Idem que a.- pero que de un único isómero de monocloración y producza por oxidación un ácido tricarboxílico. c.- Formule un hidrocarburo aromático polisustituído con fórmula C10H14 que de dos isómeros de monocloración. Problema 7 Indique cómo llevar a cabo las siguientes transformaciones: COOH ? NO2 ? Cl Cl Cl COOH ? O2N ? NO2 COOH Problema 8 ¿Qué producto esperaría obtener de la cloración del paracetamol? ¿y de la cloración de la aspirina? Justifique. O HN COOH O Paracetamol O OH Aspirina 36/83 Química Orgánica 63.14 Problema 9 En una planta se utiliza Dowtherm A (producto comercial que es una mezcla eutéctica de bifenilo (C12H10) y difeniléter (C12H10O)) como agente de transferencia de calor, el cual circula por una serpentina dentro de un reactor. Durante la reacción de sulfonación del octilbenceno se produce una filtración del agente calefactor al medio de reacción, contaminándose el fluído y el producto de la reacción. En función de los datos anteriores responda: a.-¿Cuál es el producto final de la reacción de sulfonación del octilbenceno? b.-¿Qúe impurezas espera encontrar en el producto de la sulfonación? Justifique. c.- Prediga los productos obtenidos por nitración seguida por bromación del difeniléter. Dowthem O Difeniléter Bifenilo Problema 10 Indique cómo llevaría a cabo las siguientes transformaciones: OH Cl A G N N+ CN Br F B C E F D I Problema 11 En las siguientes transformaciones, complete los reactivos y/o productos, según corresponda. a.Br NO2 ? Br2 / FeBr3 Br ? Zn/HCl ? NH2 Cl b.NH2 Ac2O/Py O NH2 ? CH3 ? ? O CH3 F 37/83 Química Orgánica 63.14 c.- Problema 12 Proponga los reactivos necesarios para la obtención de los siguientes colorantes: a.b.N H2N N NH2 COOH N N N N N ROJO DE METILO + Na-O3S c.- ROJO CONGO d.OH N O SO3-Na+ SO3-Na+ O N + N O- SO3-Na+ ALIZARINA O-Na+ N N OH + Na-O3S ESCARLATA SG CH3 Problema 13 Cuando se quiere investigar cualitativamente la presencia de nitrógeno en una molécula, se suele llevar a cabo el ensayo de Griess. En un tubo de ensayo se colocan la muestra y una cierta cantidad de MnO2 y se calienta a la llama del mechero. Como consecuencia de la descomposición del material orgánico en presencia de un oxidante, si hay nitrógeno se genera NO (óxido nítrico). Si se acerca a la boca del tubo un papel de filtro embebido en una solución ácida de naftilamina y -naftol, se observará la formación de una coloración rojo-rosada al tomar contacto con los vapores de la pirólisis. Justifique este comportamiento y formule la reacción que tiene lugar. 38/83 Química Orgánica 63.14 Serie Nº 7 Alcoholes, Aldehídos y Cetonas Problema 1 Discuta qué reactivos utilizaría para llevar a cabo las siguientes transformaciones. a) b) ? OH ? + OH ? c) OH Cl ? d) OH Cl Br ? Problema 2 Complete las siguientes reacciones. a.- PCC A c.- OH b.- CHO B HgSO4 / H+ / H2O O d.- K2Cr2O7 / H+ CHO C NaBH4 D Problema 3 a.- Indique a partir de que alcoholes y con qué reactivos se obtendrán los siguientes productos: O A H B O H O OH COOH O C D E b.- Indique a partir de que carbonilos y con qué reactivos se obtendrán los siguientes alcoholes: Problema 4 Indique cómo llevaría a cabo las siguientes transformaciones: 39/83 Química Orgánica a) 63.14 b) ? O ? OH O ? c) d) O O O ? OH Problema 5 a.-Justifique el siguiente hecho experimental: O OH + H2O O H 0.1 % de hidrato OH OH H + H2O 99.9 % de hidrato OH H H b.-Prediga el desplazamiento del siguiente equilibrio: O Cl3C OH + H2O H Cl3C OH H Problema 6 Complete las siguientes reacciones, incluyendo sus mecanismos de reacción. E EtO- / EtOH CH3OH / H+ O A NaCN / pH 5 I2 / HOPhNHNH2 D B C Problema 7 ¿Cómo distinguiría los siguientes compuestos utilizando ensayos químicos simples? Formule las reacciones e indique cuál sería la señal esperada en cada caso. a) O H y O O b) O c) O H y y O H Problema 8 a.- Un compuesto A, de fórmula molecular C5H10O reacciona con el metanol para dar un producto de adición. A da negativo el test de Tollens y el ensayo de iodoformo. Proponga una estructura para el compuesto A, justificando claramente su respuesta. 40/83 Química Orgánica 63.14 b.- Un compuesto A de fórmula C6H12 da dos productos por ozonólisis: B y C. Se realizan los siguientes ensayos con los productos obtenidos y los resultados se resumen en la tabla que se muestra a continuación: Productos B C 2,4-DNFH + + I2/OH+ + Tollens + i) ¿Qué condiciones de ozonólisis se utilizaron? Justifique. ii) Proponga estructuras de A, B y C, que sean coherentes con los datos suministrados, justificando su respuesta y escriba todas las reacciones involucradas. Problema 9 Distinga mediante reacciones sencillas, asegurándose un resultado positivo para cada una de ellas. En cada caso formule el producto de la reacción y discuta el cambio observado que corresponde a una reacción positiva. a.- acetaldehído y propanaldehído b.- 1-pentanol, 3-pentanol y 2-metil-2-butanol c.- 1-propanol, etanol y terbutanol d.- butanal, 2-pentanona, 3-pentanona y benzaldehído Problema 10 Cuando se la trata acetona con medio básico fuerte, se obtiene un producto X que al calentarlo da Y. a.- Formule la reacción de la acetona en medio básico. b.- Proponga una estructura de X e Y y formule las reacciones de reconocimiento c.- Discuta la aplicación de esta reacción al benzaldehído. 2,4-dinitrofenilhidrazina + + X Y iodoformo + + Lucas + - Br2/CCl4 + Problema 11 Formule los productos obtenidos a partir de las siguientes reacciones, indicando su mecanismo. c) O O H NaOH / EtOH + H A B A B d) O O + 2 H NaOH / EtOH 41/83 Química Orgánica 63.14 Problema 12 Discuta cómo realizaría las siguientes transformaciones a) b) ? O O COOCH3 CH2Cl H HO ? O O OCH3 O c) O ? O OH O2 N O O ? H O OH H O2 N O 42/83 Química Orgánica 63.14 Serie Nº 8 Aminas, Ácidos Carboxílicos y Derivados Problema 1 a.-Ordene los siguientes compuestos según la basicidad creciente. i.- pKa: 9.25, 12.1, 10.7, 10.8, 11.0, 11.2. N NH2 A N H C B N NH D E NH3 F ii.- pKa: 4.6, 5.1, 1.0, 0.8 NH2 NO2 NH2 N H N C B A D b.-Explique las diferencias de pKa entre los siguientes compuestos: NH2 N H N H pKa = -2 NH2 N 0 4.6 5.2 10.7 Problema 2 a.-Justifique la acidez de los ácidos carboxílicos b.-Asocie las siguientes estructuras con los respectivos pKa i.- O O O I OH OH Cl B A O Br OH OH Cl OH OH F E D Cl C O O F pKa: 1.26, 2.59, 2.87, 2.90, 3.17, 4.75 ii.- O O O OH F A OH OH F F Cl C B O O O Cl OH Cl OH Cl D E Cl Cl Cl Cl O OH F OH G pKa: 0,23; 0,64; 1,26; 2,84; 4,06; 4,52; 4,82. Problema 3 Ordene los siguientes productos según su acidez creciente a.OH O b.OH O OCH3 NO2 A B OH O O C CH3 OH OH OH O2N A NO2 NO2 NO2 B C 43/83 Química Orgánica 63.14 Problema 4 Ordene los siguientes compuestos carbonílicos según su reactividad creciente con respecto al ataque de un Nu y justifique claramente su respuesta. a.b.O O A O O C B B A H Cl OH NHCH3 H OCH3 O O O D C O OCH3 O O E Problema 5 Indique el o los productos obtenidos en cada una de las siguientes reacciones. Justifique su respuesta formulando el mecanismo correspondiente. 1.- O H+ OH 2.- + CH3CH2OH O O + Cl 3.- O Py O-Na+ OCH3 NH2 + CH3OH 4.LiAlH4 O OCH3 O NaBH4 5.- LiAlH4 O N H NaBH4 Problema 6 Justifique los siguientes hechos experimentales: a.-La hidrólisis del propanoato de R-secbutilo en medio básico conduce a un producto con actividad óptica. 44/83 Química Orgánica 63.14 b.-Se puede obtener un éster a partir de un anhídrido, pero no a partir de una amida c.-El hexanoato de propilo es un compuesto insoluble en agua. Tratado con hidróxido de sodio en caliente produce un sistema de una sola fase. d.-Cuando el cloruro de acetilo se disuelve en agua disminuye el pH de la solución. Problema 7 a.-Explique brevemente qué es un jabón y como se obtiene. b.-¿A que se le llama “corte” del jabón? c.-¿Cuál es la mayor diferencia entre los jabones y los detergentes? Problema 8 En la siguiente serie de reacciones, formule los compuestos A, B, C, D, E y F. ¿Qué reactivo o reactivos utilizaría para volver a obteener E a partir del propanal? Problema 9 Indique cómo llevaría a cabo las siguientes transformaciones, utilizando el menor número de etapas. Problema 10 Un compuesto A de fórmula molecular C9H10O dió positivo el test del iodoformo. Si A se trata con KMnO4 en medio alcalino y luego se acidifica el medio de reacción, puede aislarse B, de fórmula molecular C8H6O4, insoluble en medio ácido. Por calentamiento de B puede obtenerse anhídrido ftálico. Por otra parte, si A es tratado con 2,4dinitrofenilhidracina, se obtiene un compuesto anaranjado cristalino, C. Indique las estructuras de A, B y C, y el mecanismo de la reacción de 2,4-dinitrofenilhidracina. 45/83 Química Orgánica 63.14 Problema 11 Indique cómo realizaría la siguiente transformación en uno o más pasos. Para cada paso de la reacción, exponga las O O posibles reacciones coleterales y/o dificultades que pueda presentar el camino sintético propuesto. OH En función de las reacciones utilizadas, indique si el producto final tendrá o no actividad óptica. 46/83 Química Orgánica 63.14 Serie Nº 9 Lípidos Problema 1 a.- De acuerdo a sus estructuras, indique si los siguientes compuestos pertenencen o no al grupo de los lípidos. En caso de pertenecer, clasifíquelos de acuerdo a su estructura química dentro de cada familia. O O H H O H3C(H2C)12 H O O B HO A O C O H3C(H2C)12 E O F D O OH O(CH2)8CH3 COOH O (CH2)4CH3 OH OH O H HO G HO O H O HO O J H3C(H2C)12 O H3C(H2C)14 O O O P OH OH O I b.- Defina qué se entiende por el “insaponificable” de una grasa. Problema 2 a.- Calcule cuantos moles de KOH serán necesarios para saponificar totalmente 0.3 g de triesterarato de glicerilo, y en función de ello, obtenga el índice de saponificación de dicho triglicérido. b.- 10 g de un triglicérido requieren 7,7 g de KOH para su saponificación. Calcule el índice de saponificación y el peso molecular de dicha grasa. Problema 3 Discuta la utilidad del índice de iodo y calcule su valor para el trioleato de glicerilo. Problema 4 a.- El grado de hidrólisis de una grasa puede expresarse en mg KOH/g grasa (lo que se conoce como índice de acidez) o como porcentaje de hidrólisis p/p. Calcule el índice de acidez de una muestra de trimiristato de glicerilo extraído de nuez moscada, el cual presenta un porcentaje de hidrólisis del 0.3%. b.- Calcule el porcentaje de hidrólisis de una muestra de aceite de soja que requirió 25mg de KOH para neutralizar 15 g de grasa y expresarlo en porcentaje de ácido oleico. Problema 5 Del aceite de soja se aisló, entre otros, un monoglicérido A ópticamente inactivo. Su I.S. resultó ser 158. Por hidrólisis de A se obtiene un ácido B que decolora el Br2/Cl4C. Por 47/83 Química Orgánica 63.14 ozonólisis oxidativa de B se obtienen tres compuestos C, D y E, de fórmulas C9H16O4, C6H12O2 y C3H4O4 respectivamente. a) ¿De qué monoéster se trata? Formule las reacciones indicando los productos A y B. b) Formule las reacciones indicando los productos B, C, D y E. Problema 6 Un diglicérido A, ópticamente activo y que decolora la solución de Br2 en Cl4C, tiene un I.S. = 181. Si se lo trata con una solución de KOH (aq) en etanol en caliente, se acidifica y se extrae con éter, se obtiene un sólo producto (B) en la fase etérea y otro en la fase acuosa (C). B decolora el Br2/Cl4 y reacciona con KMnO4/ para dar dos productos B1 y B2, uno de los cuales tiene f'órmula molecular C9H16O4. Indique la estructura de los compuestos A, B, B1, B2 y C. Problema 7 a.- Formule la reacción entre el trilinoleato de glicerilo y una solución de KOH metanólico en ausencia de agua. b.- El índice de acidez de una muestra de aceite de soja es del 1.5% (con respecto al ácido oleico). A partir de estos datos, discuta si es factible utilizar la muestra para la obtención de biodiesel, justificando claramente su respuesta. 48/83 Química Orgánica 63.14 Serie Nº 10 Espectroscopia Problema 1 a.- Para las siguientes sustancias, indique que transiciones posibles existen en la región ultravioleta del espectro. Prediga si las siguientes sustancias presentarán absorción en la zona útil del mismo. O NH2 C B A E D b.- ¿Podría diferenciar los siguientes compuestos utilizando espectroscopía ultravioleta? Justifique. A D C B c.- Indique qué máximo de absorción (max) corresponde a cada uno de los siguientes compuestos. C9H19 O C9H19 C8H17 O H3CCO H3CCO HO Absorciones: 275 nm, 304 nm, 356 nm. Problema 2 En un laboratorio se perdieron los rótulos de cinco frascos, los que, se sabe, contenían las siguientes sustancias: OH O NH NH2 O Cl A B C D E a.- Discuta si es posible diferenciarlos utilizando espectroscopía ultravioleta. b.- Discuta si los podría diferenciar utilizando espectroscopía IR Problema 3 Se cuenta con los siguientes grupos de compuestos, indique que método/s espectroscópico/s utilizaría para diferenciarlos. Justifique su respuesta. a.- b.Cl Cl Cl 49/83 Química Orgánica 63.14 c.- O OH O d.CHO e.- COOH HO Br OH OH Cl CH3 Problema 4 Se cuenta con dos compuestos isómeros A y B, de fórmula molecular C6H12O. Ambas dan reacción positiva con el reactivo de Jones y no incorporan hidrógeno por hidrogenación catalítica ni absorben en el UV. El compuesto A tiene un espectro de IR que presenta una banda de absorción fuerte alrededor de 1700 cm-1 mientras que el compuesto B tiene un fuerte absorción como una banda ancha con máximo a 3450 cm-1. Proponga una estructura para A y otra para B que se consistente con todas las observaciones anteriores, justificando su respuesta. Problema 5 El linalool es un producto natural aislado a partir de la lavanda. A partir de su estructura responda: a.- ¿Podría utilizar luz ultravioleta para ubicar la posición del linalool en una CCD del extracto natural? OH b.- ¿Qué característica o características distintivas espera encontrar en el IR del linalool? c.-Prediga que se obtendría si somete el linalool al siguiente Linalool tratamiento: 1.-NaNH2 / ICH3; 2.-O3/Zn/H+. Problema 6 Para los siguientes compuestos responda justificando su respuesta: a.- ¿Cuáles son hidrógenos equivalentes en el RMN-1H? b.- ¿Cuántas señales se observarán en el espectro de RMN-1H de cada uno y cuál será la multiplicidad de cada una? c.- ¿Observaría alguna banda característica en el IR? Cl OH OH D C B A CHO CHO E Cl CHO H CH3 O F H3C CH3 G H CH3 I Problema 7 ¿Cuáles de los protones señalados en cada molécula está más desprotegido? Justifique. a) CH3CH2Cl b) CH3COCH2CH3 50/83 Química Orgánica c) 63.14 d) H _ CH3 CH OH CH3 Señale en cada caso la posición relativa y la multiplicidad de todos los hidrógenos en el espectro de RMN-1H. CH2 CH3 Problema 8 a.- ¿Podría distinguir el 2-metilpropanoato de etilo del propanoato de isopropilo utilizando RMN? Justifique. b.- Idem que a) pero con acetato de propilo y propanoato de etilo. Problema 9 Se desea determinar la identidad de un solvente industrial sin identificación. Para ello se toma una muestra y se le realizan espectros de RMN e IR, observándose que no presenta absorción en la zona útil de UV. En función de estos datos determinar la identidad del solvente y justifique utilizando tablas. 33 33 22 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 51/83 Química Orgánica 63.14 Problema 10 Se cuenta con un producto orgánico A extraído de fuentes naturales y se desea conocer su identidad. El microanálisis indica que su fórmula molecular es C5H10O. Proponga la identidad de A en función de los datos espectroscópicos. 6 2.90 2.80 2.70 2.60 2.50 2.40 2.30 2.20 2.10 2.00 1.90 1.80 1.70 1.60 1.50 1.40 1.30 1.20 1.10 1.00 0.90 0.80 0.70 0.60 0.50 2 1 1 9.0 8.5 8.0 7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 Problema 11 Se cuenta con un producto orgánico que presenta una fuerte absorción en UV y es soluble en soluciones de bicarbonato. Determine su identidad en función de los datos de IR, RMN y masa. 52/83 Química Orgánica 63.14 M+ 4 1 12.0 . 11.5 11.0 10.5 10.0 9.5 9.0 8.5 8.0 7.5 7.0 Problema 12 Se cuenta con dos isómeros A y B. Sabiendo que ambos absorben en el UV indique cuál es la identidad de cada uno. Espectros de A M+ . 53/83 Química Orgánica 63.14 3 5 7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 Espectros de B 54/83 Química Orgánica 63.14 3 4 1 9.5 9.0 8.5 8.0 7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 Problema 13 En una muestra de PVC se detecta la presencia de un plastificante, el cual se aísla y se analiza espectroscópicamente. Indique qué evidencias aporta cada espectro, deduzca la identidad de este producto a partir de los datos espectroscópicos y justifique los valores de desplazamiento utilizando tablas. 3 2 42 8 .0 7.5 7.0 6.5 6.0 5 .5 5.0 4.5 4.0 3 .5 3.0 2.5 2.0 1.5 1 .0 0. 55/83 Química Orgánica 63.14 Problema 14 Se cuenta con tres producto isoméricos (A, B y C) que tienen la siguiente forma molecular C4H9NO. Proponga la identidad de cada isómero en función de los datos espectroscópicos. Justifique. A 1 A 1 3.0 1 2.5 2.0 1.5 B 56/83 Química Orgánica 63.14 2 B 3 2 2 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 C 3 C 3 1 2 2.5 7.5 7.0 2.0 6.5 6.0 5.5 1.5 5.0 4.5 4.0 1.0 3.5 3.0 2.5 2.0 1.5 1.0 57/83 Química Orgánica 63.14 Problema 15 A partir de un quitaesmalte de uso habitual en cosmética, se obtuvo por destilación fraccionada, un producto puro X, el cual se analizó espectroscópicamente. Se observó además que el espectro de IR de X como compuesto puro y el obtenido por disolución de X en CCl4 mostraron ligeras diferencias. a.- ¿Qué iformación obtiene de los espectros de IR? b.- ¿Qué datos obtiene del espectro de RMN? c.- Indique cuál es la identidad de compuesto X asignando cada uno de las señales del espectro de RMN utilizando las tablas. d.- Justifique las diferencias observadas en los espectros de IR. 3 3 1 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 58/83 Química Orgánica 63.14 Problema 16 Se cuenta con un producto orgánico A, soluble en agua, cuyos espectros son los que se muestran a continuación. La disolución de A en clorhídrico acuoso produce luego de unos minutos, un sistema de dos fases. Se recupera la fase orgánica encontrándose que la misma corresponde a un compuesto B cuyos espectros se indican. Determine la identidad de los compuestos A y B. A 9 3 A 1 1 3.0 2.5 2.0 1.5 1.0 0.5 B 59/83 Química Orgánica 63.14 B 3.5 3.0 2.5 2.0 1.5 1.0 0.5 B . M+ - 15 Problema 17 Un compuesto A es sensible a soluciones de Br2/Cl4C, KMnO4 (dil) e incorpora un mol de H2 bajo condiciones de hidrogenación catalítica. Proponer una estructura para A que sea compatible con los datos espectroscópicos y su comportamiento químico. Justifique usando tablas. 60/83 Química Orgánica 6.90 12.0 11.5 63.14 6.80 11.0 6.70 6.60 10.5 6.50 10.0 6.40 6.30 9.5 6.20 6.10 9.0 6.00 8.5 5.90 5.80 8.0 5.70 5.60 7.5 5.50 7.0 6.5 61/83 6.0 5.5 Química Orgánica 63.14 Serie Nº 11 Polímeros Sintéticos Problema 1 Indique cuáles son los monómeros que dan origen a los siguientes polímeros y clasifíquelos según su mecanismo de reacción. ¿Cuál es el nombre de cada uno de estos materiales? O Ph Ph Ph O O CN CN CN OH O O COOMe COOMe COOMe O O O O O OH OH OH O O O OH Problema 2 Describa las diferentes etapas de una polimerización en cadena. ¿Cuáles son las mayores diferencias con respecto a una polimerización por pasos? Problema 3 a- Nombre un reactivo que le permita iniciar una polimerización radicalaria, uno con el que iniciar una polimerización catiónica y otro para iniciar una polimerización aniónica. b.- ¿Qué características debe reunir el monómero en cada tipo de iniciación en cadena? c.- ¿Podría utilizar ácido bromhídrico para iniciar una polimerización catiónica? Justifique su respuesta. Problema 4 ¿Qué tipo de polímero tiene mejores propiedades mecánicas, un polietileno o una poliamida? Justifique. Problema 5 a.- Defina un polímero isotáctico, sindiotáctico y atáctico. b.- Formule cada uno de ellos a partir de estireno como monómero. c.- Existe alguna relación entre la tacticidad y la cristalinidad de un polímero. d.- ¿Qué diferencia existe entre un monómero y una unidad repetitiva dentro de un homopolímero? 62/83 Química Orgánica 63.14 Problema 6 a.- Formule la unidad estructural repetitiva del PET y el Kevlar. b.- ¿Cómo diseñaría un poliéster resistente a la hidrólisis? ¿Y uno para uso en exteriores? Problema 7 Justifique los siguientes hechos experimentales: a.- Para lograr poliésteres y poliamidas con buenas propiedades debe controlarse la proporción estequiométrica. b.- La polimerizaciones con monómeros de funcionalidad superior a dos deben realizarse en exceso de alguno de los componentes. Problema 8 a.- ¿Qué es el Nylon 6,6? ¿y el Nylon 6,12? b.- Discuta como influye la naturaleza de los monómeros en las propiedades del Nylon. Problema 9 Discuta las características de los aminoplásticos e indique cuales son los monómeros involucrados. Problema 10 ¿Cuáles son los componentes de una resina epoxy? Discuta sus principales usos y su comportamiento de solubilidad y resistencia a la temperatura. 63/83 Química Orgánica 63.14 Serie Nº 12 Hidratos de Carbono Problema 1 En el nombre “D (-)-arabinosa” indique el significado de la letra “D” y el del signo (-). Discuta cuántos estereoisómeros posee la D-arabinosa en su forma aldehídica y en su forma hemiacetálica. Problema 2 a.-Formule la estructura de Fischer para la D-glucosa en su forma aldehídica. b.-Formule la estructura de Fischer para la D-glucosa en su forma hemiacetálica piranósica (-D-glucopiranosa) y su correspondiente fórmula de Haworth. c.-Dibuje el enantiómero y nómbrelo. d.-Dibuje el anómero y nómbrelo. e.-Dibuje un epímero de la -D-glucopiranosa. f.-Dibuje un glicósido de la D-glucopiranosa y determine su conformación más estable. g.-Formule la estructura de Fischer para la la D-glucosa en su forma hemiacetálica furanósica (-D-glucofuranosa) y su correspondiente fórmula de Haworth. Problema 3 Formule las reacciones indicadas a continuación, dando los nombres de los productos: Problema 4 Un producto A, tratado con ácido nítrico da como resultado un ácido tartárico (ácido 2,3-dihidroxibutanodioico) que no posee actividad óptica. ¿Cuál es la identidad de A y con qué otro nombre se conoce al ácido tartárico obtenido? Problema 5 Qué diferencias hay entre: a.- Un hidrocarburo y un carbohidrato b.- Un anómero y un epímero c.- Un enantiómero y un epímero d.- Un carbohidrato reductor y uno no reductor e.- Acido glucónico y ácido glucárico f.- Metilglucósido y tetra-O-metilglucósido Problema 6 Grafique las estructuras de los siguientes compuestos en fórmulas de: Fischer, Haworth y cuando sea posible, en la conformación silla más estable: a.- -L-Glucopiranosa b.- -D-Ribofuranosa c.- Metil -D-manopiranósido d.- -D-fructofuranosa 64/83 Química Orgánica 63.14 Problema 7 En el siguiente cuadro, marque la opción que resulte correcta. Los hidratos de carbono son… Todos Algunos Dextrógiros Insolubles en agua Reactivos con Jones Activos en el UV Sintetizados por vegetales Separables por ccd de sílica Reactivos con el reactivo de Tollens Problema 8 Formule: los productos formados y los moles de periodato consumidos al tratar los siguientes compuestos con periodato: Ninguno CH2OH CH2OH HO O O O CH2 OH a) metil -D-manopiranósido O OCH3 O HO b) OH OH HO OH OH Problema 9 Al medir la rotación óptica de una solución de -D-glucopiranosa a distintos tiempos se observa que esta va disminuyendo desde +112 a +53 . Si la experiencia se realiza con una solución de -D-glucopiranosa, se observa que la rotación aumenta de +19 a +53. a.-¿A qué se debe este fenómeno? b.-Calcule gráficamente y usando ecuaciones las proporciones de ambos anómeros en el equilibrio. c.-Dibuje las conformaciones silla correspondientes, indicando la más estable. d.-¿Podría esperar el mismo fenómeno realizando la experiencia con metil -Dglucopiranósido? Problema 10 Un trisacárido A no reacciona con el reactivo de Tollens. Por hidrólisis total de A se obtuvieron dos aldohexosas diferentes, que tratadas con un exceso de fenilhidracina dieron un único producto. Por tratamiento de A con maltasa (-glucosidasa) se obtuvo glucosa y un disacárido no reductor B. Por tratamiento de A con emulsina (glucosidasa) se obtuvo glucosa y un disacárido reductor C. La metilación de A y posterior hidrólisis ácida dio dos productos: 2,3,4,6-tetra-O-metilD-hexosa y 2,3,6-tri-O-metil-D-hexosa. a) Proponga una estructura para A que sea compatible con todos los resultados experimentales anteriores. Justifique su respuesta. b) ¿Cuáles son los disacáridos B y C? c) Formule la reacción de una aldohexosa con exceso de fenilhidracina. d) Explique qué información proporciona la reacción de metilación seguida por hidrólisis. 65/83 Química Orgánica 63.14 Problema 11 Se aisló un trisacárido A cuya hidrólisis ácida dio solamente D-glucosa y D-manosa. Para establecer su estructura se realizaron los siguientes ensayos: a.-Con reactivo de Fehling dio positivo. b.-Con NaBH4 y posterior hidrólisis se obtuvo D-glucosa y D-manitol. c.-Con SO4(CH3)2 /OH- y posterior hidrólisis ácida se obtuvo 2,3,4,6-tetra-O-metil-Dglucosa, 2,3,6-tri-O-metil-D-glucosa y 2,3,6-tri-O-metil-D-manosa. d.-Por hidrólisis de A con maltasa se obtenía D-glucosa y un disacárido B. e.-Por hidrólisis de A con emulsina se producía D-manosa y un disacárido C. Proponga una estructura para: A, B y C. Formule las reacciones mencionadas. Problema 12 Se desea determinar la estructura de un disacárido A para lo cual se lo somete a la siguiente serie de reacciones: D-Glc + D-Gal H3O+ A 1.-SO4(CH3)2 2.-H3O+ 1.-NaBH4 2.-H3O+ -galactosidasa 2,3,5,6-tetra-O-metil-D-galactosa + 2,4,6-tri-O-metil-D-glucosa D-galactosa + D-glucitol NO REACCIONA a.- Qué información obtiene de cada una de las experiencias anteriores. b.- Proponga la estructura de A en fórmulas de Haworth. Problema 13 Un disacárido A dio por hidrólisis ácida D-Glucosa como único producto. Sobre A se realizaron los siguientes ensayos: i.- Por reducción con borohidruro de sodio y posterior hidrólisis se obtiene D-glucosa. ii.- La oxidación de A con periodato consume 4 moles de oxidante y produce dos moles de fórmico por mol de A. iii.- Por tratamiento tanto con una -glicosidasa como con una -glicosidasa se obtiene únicamente D-glucosa. a.- Indique qué información obtiene de cada ensayo y proponga una estructura para A. b.- Dibuje A en fórmulas de Haworth. Problema 14 Una sustancia A dio por hidrólisis ácida D-glucosa, D-galactosa y D-manosa en relación 2:1:1. La reacción con NaBH4 seguida de hidrólisis produjo la aparición de: D-glucosa, D-manosa y galactitol. La acción de -glucosidasa sobre A originó dos productos B y C ambos reductores. La hidrólisis de B originó únicamente D-glucosa. Una enzima que hidroliza únicamente enlaces beta manosídicos permitió aislar galactosa a partir de A. Sabiendo que todos los azúcares estaban en la forma piranósica y que un mol del metil glicósido de A consumió 2 moles de periodato de sodio, formule en estructuras de Haworth la estructura de A y esquematice las de B y C. 66/83 Química Orgánica 63.14 Serie Nº 14 Aminoácidos y Proteínas Problema 1 a.- ¿Qué es un -aminoácido? Discuta la importancia de estos compuestos y mencione sus principales características. b.- ¿Qué puede decir acerca de la estereoquímica de la mayoría de los aminoácidos naturales? c.- ¿A qué se denomina “aminoácido esencial”? Problema 2 a.- Clasifique los siguientes aminoácidos según sus características. O O OH O H2N OH H2N H Fenilalanina N Prolina OH Lisina H2N H H O O O O H OH H2N H HO Glutámico H2N H Valina H O HS H2N OH H2N H Cisteína C Glicina O OH OH H2N H NH H2N H O N OH OH N H2N H H Triptofano Arginina b.- Los aminoácidos del ítem anterior, ¿están correctamente formulados? Justifique. Problema 3 Los aminoácidos son compuestos asimétricos. ¿El ácido L-aspártico es dextrorrotatorio, podría decir lo mismo para la L-asparagina? Justifique. O HOOC Aspártico H Asparagina O- N+H3 O O- H2NOC H N+H3 Problema 4 a.- Defina lo que es un péptido y un enalce peptídico. b.- Formule un tetrapéptido formado exclusivamente por glicina y alanina, conservando la estereoquímica correspondiente y conservando una carga negativa neta. Señale los enlaces peptídicos. c.- Idem que b).-, pero a pH =1. Problema 5 a.- ¿Qué diferencia existe entre péptidos y proteínas? b.- Defina el punto isoeléctrico para aminoácidos y para proteínas. c.- Calcule el punto isoeléctrico para los siguientes aminoácidos: Alanina (pKa1= 2.34 , pKa2= 9.69); Fenilalanina (pKa1= 1.83 , pKa2= 9.13) y Acido Aspártico (pKa1= 1.88 , pKa2= 3.65, pKa3 = 9.60). 67/83 Química Orgánica 63.14 Problema 6 A partir de los datos de la siguiente tabla: Aminoácido Alanina (Ala) Prolina (Pro) Ácido aspártico (Asp) Arginina (Arg) Fenilalanina (Fen) Glutamina (Gln) pKa1 2,34 1,99 1,88 2,17 1,83 2,17 pKa2 9,69 10,60 3,65 9,04 9,13 9,13 pKa3 9,60 12,48 a.- Dibuje la estructura del hexapéptido Ala-Pro-Gln-Asp-Fen-Arg a pH = 1,5 b.- Señale los grupos ionizables del hexapéptido, indicando sus respectivos pKa y estime su punto isoeléctrico. ¿Cuál es la carga neta del hexapéptido a pH = 13? c.- ¿Cuál sería el comportamiento electroforético esperado para las condiciones anteriores? Problema 7 a.- Defina estructura primaria, secundaria, terciaria y cuaternaria de las proteínas b.- Asocie las funciones de las proteínas de acuerdo con su estructura. Problema 8 a.- Mencione los pasos a seguir para la determinación de la composición de una proteína. b.- La secuencia de aminoácidos de un péptido puede determinarse en forma automática. Formule la reacción química utilizada en los secuenciadores de péptidos. c.- Indique un método enzimático y uno químico para la determinación de aminoácidos C-terminales. Compare ambos métodos. Problema 9 Formule el dipéptido glicilalanina y las reacciones correspondientes a un método no enzimático que permita determinar el aminoácido N-terminal y otro no enzimático que permita determinar el aminoácido C-terminal de dicho dipéptido. Problema 10 Dados los siguientes péptidos A y B: Gli Arg Péptido A Ala Ala Gli Arg Gli Fen Péptido B Gli Fen a.- ¿Cómo distinguiría entre ambos por un método enzimático? b.- ¿Cómo los distinguiría por un método químico? c.- Enuncie todos los dipéptidos que se pueden obtener por hidrólisis parcial a partir de A y de B. Problema 11 La síntesis eficaz de péptidos comenzó con la llamada Síntesis de Merrifield. Discuta los diferentes pasos de dicha síntesis y su aplicabilidad en sintetizadores automáticos. 68/83 Química Orgánica 63.14 Problema 12 Se le encarga analizar un péptido A que tiene un M+· de 715 tiene un pI de 9.96. Su hidrólisis total y posterior separación con una columna de intercambio iónico arroja la presencia de glicina, alanina, fenilalanina y lisina. Cuando se lo trata con el reactivo de Sanger se obtiene fenilalanina marcada en el amino y lisina marcada en el amino . La aplicación del reactivo de Edman indica una alta concentración inicial de la tiohidantoína de la fenilalanina, seguida por las de la alanina y glicina. El tratamiento de A con quimotripsina (enzima que hidroliza uniones peptídicas de aa aromáticos) produce fenilalanina, lisina y un tripéptido B que absorbe en el UV, mientras que el tratamiento con tripsina (enzima que hidroliza las uniones peptídicas de los aa básicos) no produce cambios en A. A partir de los datos anteriores, responda: a.-¿Qué información le brinda cada uno de los datos anteriores? Justifique brevemente cada una de sus afirmaciones. b.-Formule la reacción involucrada en el ensayo de Sanger usando como sustrato la alanina. c.-¿Qué diferencia existe entre la información que se desprende del ensayo de Sanger y el de Edman? d.- Proponga una estructura para el péptido B que sea consistente con todos los datos y formúlelo a pH = 3 teniendo en cuenta su estereoquímica. e.-Proponga una estructura para el péptido A que sea consistente con todos los datos y formúlelo A pH = 12 teniendo en cuenta su estereoquímica. pKa ala: 2.34; 9.69. pKa fen: 1.83; 9.13. pKa gli: 2.34; 9.60. pKa lis: 2.18; 8.95; 10.79. 69/83 Química Orgánica 63.14 Parciales Resueltos 1C 2013 Cátedra de Química Orgánica 70/83 Química Orgánica Examen Parcial (1ra. Parte) 63.14 03-05-13 Problema 1 (20 puntos) a.-Se cuenta con dos sustancias orgánicas A y B miscibles al estado líquido (PfA = 110°C y PfB = 30°C). Se desea obtener el compuesto A puro a partir de una muestra de 10g de una mezcla que contiene 95% de A. Solubilidad de B Solubilidad de A (g/100mL) (g/100mL) En frío En caliente En frío En caliente 1 210 2.50 7.50 0.50 0.70 2 100 0.30 8.30 0.30 5.50 3 94 0.02 0.40 0.20 4.00 i) A partir de los datos anteriores, seleccione un solvente de recristalización y discuta por qué descartó los otros. ii) Indique cuántas recristalizaciones son necesarias para obtener A puro y calcule el rendimiento sobre la masa total inicial. b.-A partir de los datos suministrados a continuación, construya un gráfico de temperatura de fusión versus composición para los compuestos A y B e indique el rango de fusión para la mezcla del item a. 80% A = 50-100°C; 60% A = 50-75°C; 50% A = 50°C; 30% A = 50-95 °C; 10% A = 50-120 °C. Solvente P. eb. (°C) Problema 2 (20 puntos) a.-Se cuenta con una mezcla de dos líquidos miscibles en todas las proporciones, M, de punto de ebullición 77°C y O, que ebulle a 95 °C. Una mezcla de 300 g con 60% de O se destila con una columna de fraccionamiento ideal, obteniéndose una fracción de 100 g a 95°C y 200 g de una fracción a 115 °C. En función de los datos anteriores responda: i.-¿Cuál es la composición de las fracciones destiladas? ii.-Dibuje un gráfico de masa vs. temperatura que represente los resultados de la destilación ideal. iii.-¿Qué puede decir de la composición de una mezcla de M y O que al destilarse produce primero una fracción a 77°C y luego otra a 115°C? b.-Discuta por qué se secan las sustancias líquidas antes de su destilación y por qué debe separase el desecante por filtración antes de destilar el líquido. c.-Elija la opción correcta o complete donde corresponda: “Al realizar una destilación de una solución binaria, el vapor se enriquece en el compuesto MÁS/MENOS volátil. Por lo tanto, si hago pasar este vapor a través de una superficie fría (tubo refrigerante), el vapor condensará y el líquido obtenido en el extremo del refrigerante será el del compuesto de MAYOR/MENOR punto de ebullición”. Problema 3 (10 puntos) Indique si las siguientes afirmaciones son verdaderas o falsas y justifique su respuesta: a.-Una sustancia se puede considerar pura si después de dos recristalizaciones sucesivas se obtiene por CCD una única mancha. b.-El n-butanol y el ter-butanol pueden diferenciarse mediante ensayos químicos sencillos al igual que el n-butanol del 2-buten-1-ol. c.-Una sustancia Y que en hexano tiene un Rf = 0.2 en placa de silicagel, en CH2Cl2MeOH tiene un Rf = 0.9. 71/83 Química Orgánica 63.14 d.-Un compuesto X que recristaliza de agua y posee una apreciable presión de vapor puede separarse de una mezcla compleja por arrastre con vapor de agua. e.-El método más conveniente para separar una mezcla 1:1 de naftilamina y naftaleno es usar extracción. Problema 4 (25 puntos) Para la reacción planteada en el siguiente esquema responda: a.-Sabiendo que A y B son estereoisómeros, proponga estructuras para A, B y C que sean consistentes con los datos experimentales y deduzca la identidad del reactivo 1. b.-Justifique la formación de dos isómeros (A y B) como consecuencia de la reacción con Br2/ CCl4. c.-¿A qué atribuye el hecho de que B reaccione y A no? d.-Indique las condiciones necesarias para obtener exclusivamente el producto C a partir de A. En las mismas condiciones aplicadas a B, ¿obtendría D? Br2 / H2O A + B 1 KMnO4 / HO(dil. frío) C + NR D CH3 OH Problema 5 (25 puntos) En la reacción del E-2-fenilbuteno con HBr (gaseoso) se obtiene una mezcla de dos productos que no posee actividad óptica y la velocidad se cuadruplica si se reduce el volumen de solvente a la mitad. Si la reacción se lleva a cabo en presencia de peróxidos, la mezcla de productos tampoco tiene actividad óptica, pero está compuesta por cuatro isómeros. En función de los datos anteriores responda: a.-Formule el mecanismo de la reacción del alqueno con HBr (gaseoso), indicando la identidad de los productos, estados de transición e intermediarios de reacción si los hubiese. b.-¿A qué atribuye la falta de actividad óptica en la reacción anterior? c.-Justifique la variación observada en la velocidad de reacción. d.-¿A qué se debe que la reacción con peróxidos de cuatro productos en lugar de dos? Justifique claramente su respuesta. H3C CH3 Ph E-2-fenilbuteno 72/83 Química Orgánica 63.14 Respuestas Problema 1 a.- i) El solvente 1 se descarta por tener una alta solubilidad en frío para A y se perderían más de 2.5 g de muestra. Además tiene muy alto punto de ebullición, lo que no permitiría secar adecuadamente los cristales. El solvente 3 posee una muy pobre solubilidad de A en caliente, por lo que se requeriría un gran volumen de solvente para la disolución total de la muestra. El solvente 2 es el más adecuado ya que tiene una buena solubilidad de A en caliente, una moderada solubilidad de A en frío y un adecuado comportamiento de la solubilidad de B (moderadamente soluble en frío. ii) Volumen necesario para solubilizar la muestra: (100/8.30)x9.5 = 114.5 mL B: totalmente soluble en caliente. Solubilidad en frío: (0.3/100)x114.5 = 0.34 g, restan 0.16 g de B luego de la primera recristalización. Pérdida de A por solubilización en frío: (0.30/100)x114.5 = 0.34 g => Masa obtenida = 9.16 g de A+ 0.16 g de B. Volumen necesario para la segunda recristalización: (100/8.30)x9.16 = 110.4 mL Pérdida de A por solubilización en frío: (0.3/100)x110.4 = 0.33 g => se obtienen 8.83 g de A puro. B => máxima solublilidad en frío: (0.3/100)x110.4 = 0.33 g => TODA LA IMPUREZA PERMANECE EN SOLUCIÓN EN LA SEGUNDA RECRISTALIZACIÓN => SÓLO SE NECESITAN DOS RECRISTALIZACIONES Rendimiento sobre la masa total inicial: (8.83/10) x100 = 88.3 %. b.130°C Muestra con 95%A funde a 50108°C (aprox., el valor dependerá del gráfico que haya trazado cada alumno) 110°C 50°C 100% A 50% 100% B Problema 2 a.- i: La composición inicial de la mezcla es de 120g de M y 180g de O. La composición de las fracciones desiladas es: 100g a 95°C = compuesto O puro; 200g a 115°C azeótropo de máxima, compuesto por los 120g de M y 80g de O (60% de M). 73/83 Química Orgánica 63.14 ii.- 115°C 95°C 100 g 300 g iii: Puede decirse que en su composición tiene más de un 60% de M por lo cual, destila primero M en exceso y luego el azeótropo. b.-Las sustancias líquidas deben secarse antes de destilarse para que el agua no interfiera el proceso de purificación contaminando el destilado, sobre todo cuando lo líquidos son inmiscibles con el agua y codestilan. El desecante debe removerse porque el calor de la destilación haría que perdiese el agua que retuvo, invalidando el proceso de secado. c.-“Al realizar una destilación de una solución binaria, el vapor se enriquece en el compuesto MÁS volátil. Por lo tanto, si hago pasar este vapor a través de una superficie fría (tubo refrigerante), el vapor condensará y el líquido obtenido en el extremo del refrigerante será el del compuesto de MENOR punto de ebullición”. Problema 3 a.-Una sustancia que ha sido recristalizada y muestra una única mancha en diferentes solventes de desarrollo en ccd tiene altas posibilidades de ser una sustancia pura, pero debería corroborarse la constancia del punto de fusión. b.-El n-butanol puede diferenciarse del terbutanol por tratamiento con ácido clorhidrico concentrado: el alcohol terciario forma rápidamente dos fases por obtención del halogenuro de aluquilo via una SN1. Su diferenciación del 2-buten-1-ol se puede hacer aplicando la reacción de bromo en tetracloruro de carbono o bien usando permanganato diluido. Br2/CCl4 HCl OH Cl NR OH dos fases HCl OH NR Br2/CCl4 OH decoloración Br OH Br c.-Una sustancia debe forzosamente tener mayor Rf en CH2Cl2-MeOH que en hexano ya que este último es menos polar, por lo que la afirmación en ese sentido es verdadera, aunque el valor de Rf no sea exactamente 0.9. d.-Si un compuesto recristaliza de agua, eso indica que el mismo es soluble en agua caliente, por lo tanto no cumple con la condición de insolubilidad para ser una sustancia arrastrable con vapor de agua. 74/83 Química Orgánica 63.14 e.-Cuando una mezcla tiene altas proporciones de ambos componentes, ya demás poseen características ácido-base diferentes, la extracción suele ser el método más apropiado para su separación, aunque dependiendo de la cantidad de muestra, no puede desecharse el uso de la cromatografía. Problema 4 a.- OH C CH3 OH OH OH CH3 D KMnO4 / HO(dil. frío) Br2 / H2O CH3 OH OH Br 2 OH C CH3 Br A B 1 CH3 NR OH CH3 OH Como en la reacción de B desaparece el bromo, la reacción es una deshidrohalogenación. Como A no reacciona y la E1 no tiene mayores restricciones, el proceso debe ser una E2. Identidad de 1 = terbutóxido de sodio en terbutanol caliente o alguna otra buena base con calor. b.-Por reacción con Br2/H2O se obtiene la bromohidrina. La adición del bromo y el posterior ataque del agua como nucleófilo se producen en anti, por lo que ambos aparecen en caras diferentes del ciclo. Si bien el bromonio cíclico puede formarse por ambas caras del alqueno, la regioquímica es siempre la misma, adicionándose el nucleófilo en el carbono que soporta mejor la carga positiva. Por todo lo expuesto, se obtienen sólo dos isómeros y no más. Br+ Br OH H2O: OH Br+ Br c.-A no reacciona porque el mecanismo de la eliminación bimolecular exige que exista un H en posición anti, y A no lo posee (de un lado tiene metilo, del otro hidroxilo). d.-La obtención de C a partir de A implica el reemplazo de un Br por HO con inversión de la configuración, por lo que el reactivo 2 debe producir una SN2, o sea HO- en DMSO. 75/83 Química Orgánica 63.14 Problema 5 a.H3C H3C H H3C + H H H H H3C H3C Ph Ph H3C + Br H H3C Ph Br- Ph Br H H3C H H H3C H3C H Ph H H H3C H3C H Ph Br H3C H3C Ph H Br b.-En la reacción anterior, la adición genera un nuevo centro asimétrico. La falta de actividad óptica está dada por el mecanismo via catión intermediario por adición del protón al C menos sustituído (genera el carbocatión más estable). El ataque del Nu se puede producir por ambas caras y el nuevo centro asimétrico generado poseerá ambas configuraciones. c.-En este caso particular, el paso determinante de la velocidad de reacción es la formación del carbocatión, y para ello es necesario tanto el alqueno como el protón, por lo tanto, la concentración de ambos entra en la ecuación de velocidad. Si el solvente se evapora a la mitad, la concentración de ambas especies se duplica => se cuadruplica la velocidad de la reacción. v = k [=][H+] => v’ = k 2[=] 2[H+] = 4k [=][H+] => v´= 4v d.-En la reacción con peróxidos el mecanismo de adición se altera: se adiciona Br al doble enlace, dejando el radical más estable, pero cambiando la regioquímica de la adición con respecto al caso anterior. Ahora se generarán 2 centros asimétricos en lugar de uno. Como existe la posibilidad de ataque por ambas caras en los dos casos, se obtendrán cuatro productos. 76/83 Química Orgánica 63.14 Examen Parcial (2da. Parte) 28-06-13 Problema 1 (20 puntos) Se cuenta con cuatro compuestos, A, B, C y D, los cuales tienen las siguentes fórmulas moleculares: C7H6O, C7H6O2, C8H8O y C7H8O respectivamente. Se sabe que el RMN-1H de todos ellos presenta una señal alrededor de las 7 ppm. Los compuestos A-D se sometieron a las siguientes pruebas: Test/ Comp Sol H2O Sol NaHCO3 aq. A i i Tollens Iodoformo 2,4-DNP Cr2O7-2/H+ + + + B i s (burbujeo) - C i i D i i + + - - a.-Proponga una estructura para cada uno de los compuestos A-D que sea consistente con los ensayos indicados, justificando brevemente su proceso deductivo. b.-Formule cada una de las reacciones mencionadas incluyendo la solubilización en bicarbonato. c.-Indique cuál es la composición del reactivo de Tollens y establezca cuál es la función de cada uno de sus componentes. ¿Qué diferencia existe entre el reactivo de Tollens y el reactivo de Fehling?¿qué información aporta cada uno de ellos? Problema 2 (20 puntos) a.-La trimiristina es el triglicérido del ácido mirístico (C-14), presente en la nuez moscada. En un balón de 250 ml se colocan 600 mg de trimiristina y se agregan 50 ml de KOH 7% en etanol/agua y piedra porosa y se refluja por 45 minutos. La solución se deja enfriar y se divide en dos partes iguales (porción 1 y 2). La porción 1 se vierte sobre 75 ml de agua y se acidifica con HCl (c) hasta pH < 4. Se observa la formación de un precipitado blanco (Sólido A), que se filtra y se lava con 5 ml de agua fría. Por otra parte, la porción 2 es diluída con 20 ml de agua, se agrega NaCl sólido, en pequeñas porciones con agitación y se enfría en un baño de hielo-agua hasta que aparezca otro sólido precipitado (Sólido B), el cual se filtra y se seca. i) Dibuje la estructura de la trimiristina. ii) Nombre y formule la reacción que tiene lugar en el balón. iii) Indique cuál es la identidad de los compuestos A y B. iv) Justifique por qué es necesario agregar HCl para obtener A y por qué se agrega NaCl y se enfría para obtener B. v) Si se obtuvieron 0.240 g de A, indique cuál fue el rendimiento de la reacción. vi) Enuncie dos ensayos que podría realizar en el laboratorio, para comprobar las propiedades de B. Justifique. b.-¿Qué modificaciones debería hacerle a la técnica anterior para obtener biodiesel a partir de la trimiristina? Formule el producto de la reacción. Problema 3 (10 puntos) a.-Discuta que efectos espera obtener si en la síntesis de Nylon 66 por condensación interfacial, reemplaza el tolueno por metanol anhidro. b.-Se desea obtener el siguiente colorante: 77/83 Química Orgánica 63.14 SO3H O N N N O N i.-Elija los reactivos necesarios para sintetizar este colorante, justificando su elección. ii.-Discuta, si es necesario, qué precauciones HO 3S experimentales debe tomar para llevar a cabo esta síntesis. Problema 4 (25 puntos) a.-Dada la siguiente serie de reacciones: i.- Deduzca la identidad de los reactivos 1, 2 y 3 y de los productos A, B y C. ii.- Justifique la formación de A formulando el mecanismo de la reacción. iii.- Justifique la elección de los reactivos 2 en función de la estrategia sintética. iv.- A partir de los datos espectroscópicos de D, deduzca su identidad y naturaleza de los reactivos empleados (4), indicando claramente su razonamiento deductivo. ¿Qué significa la doble flecha en esta reacción? 3 2 5 Problema 5 (25 puntos) Se desea conocer la identidad de un emulsificante natural A, extraído de la corteza de un árbol africano, por lo que, una vez aislado se sometió a los siguientes ensayos: a.-Por hidrólisis de A en medio ácido se pudo obtener manosa (epímero de la glucosa en C-2)y glucosa (en una relación 2:1), ácido palmítico (C-16) y glicerol. b.-El tratamiento de A con reactivo de Tollens dio una reacción negativa. c.-La acción de una -glicosidasa sobre A produce un trisacárido B y un diglicérido ópticamente activo. 78/83 Química Orgánica 63.14 d.-El trisacárido B, tratado con NaBH4 seguido de hidrólisis, da manosa, glucosa y manitol. e.-El tratamiento de B con IMe/HO- y posterior hidrólisis, produce 2,4,6-tri-O-metil-Dglucosa, 2,3,4,6-tetra-O-metil-D-manosa y 2,4,6-tri-O-metil-D-manosa. En función de los datos anteriores responda: i.-¿Qué información obtiene de cada uno de los ensayos anteriores? ii.-¿Qué indica que el diglicérido sea ópticamente activo? Proponga una estructura para el diglicérido. iii.-Formule una estructura para B que sea consistente con todos los datos experimentales, utilizando fórmulas de Haworth. iv.-Formule la estructura del emulsificante A. 79/83 Química Orgánica 63.14 Respuestas Problema 1 a.-Todos los compuestos tienen señales en el RMN em la zona de 7 ppm => todos tienen un anillo aromático. -A partir de sus fórmulas moleculares se deduce que todos tienen 5 insaturaciones, excepto D que tiene 4 => A, B y C tienen uma insaturación adicional además del aromático. -Todas son insolubles en agua y B se solubiliza en biarbonato => B es un ácido carboxílico (además, es el único que tiene 2 oxígenos). -A y C tienen C=O porque dan positivo 2,4-DNP. Además A se oxida com Jones y da (+) Tollens => A = Benzaldehído. O H O OH O CH 3 -C da (-) Tollens y (+) iodoformo => es metil cetona => C = Acetofenona. -D da todo (-) y no tienen más insaturaciones => debe ser un B C A éter => D = fenilmetil éter. O H O b.- OH H+ + Cr (VI) O CH 3 O2N 2,4-DNP + Cr (III) NO 2 A N H N CH 3 C O + Ag / NH3 - O NH4 + I2 /HO - + Agº O O+ HCI 3 O OH O O - Na + + NaHCO 3 + CO2 (burbujas) B c.-Opción 1: AgNO3 + HO-; redisolución con NH3. Opción 2: [Ag(NH3)2]+ La plata es el agente oxidante, el medio básico es necesario para que se lleve a cabo la redox y el amoníaco se agrega para mantener la plata en solución en un medio básico por formación del complejo diaminplata. El reactivo de Fehling es similar, ya que utiliza Cu2+ como agente oxidante en medio básico. Para mantener en solución el cobre se forma un complejo con tartrato de K y Na. La diferencia entre ambos es que el reactivo de Tollens da reacción positiva con aldehídos alifáticos y aromáticos, mientras que el de Fehling solo da positivo con aldehídos alifáticos. Problema 2 a.- i) O H3 C(H 2C)12CO O OC(CH 2) 12 CH 3 O C(CH2)12CH3 O ii) La reacción que tiene lugar en el balón se denomina “saponificación”, o hidrólisis básica de ésteres. 80/83 O CH 3 D Química Orgánica 63.14 La reacción en el balón es: iii) A = CH 3(CH 2 )12COOH B = CH 3(CH 2 )12COO- K+ iv) La obtención del compuesto A requiere del agregado de HCl para neutralizar el medio y que el miristato se transforme en mirístico. De esta manera se vuelve insoluble en agua y precipita del medio acuoso. Dado que B es un jabón (sal potásica del ácido mirístico), es compuesto soluble en agua, y por lo tanto su precipitación requiere de una reducción de dicha solubilidad, lo que se consigue tanto por el descenso de la temperatura como por el aumento de la concentración salina (efecto “salting-out”). v) M del miristato de glicerilo = 772, M del mirístico = 228. 0.600g => 0.78 mmoles de grasa => (0.78x3) = 2.34 mmoles de mirístico. Dado que se tomó sólo la mitad de la mezcla, el 100% de rendimiento correspondería a la obtención de 1.17 mmoles, es decir (1.17 10-3 x 228)= 0.267g de ácido mirístico. Rendimiento en A = (0.240x100)/0.267 = 89.9 %. vi) Capacidad Emulsificante: agregar una gota de aceite a un tubo con agua y a otro con una solución de B y verificar la prevención de la formación de una segunda fase. Disminución de Tensión Superficial (agente tensioactivo): sumergir el extremo de un capilar en agua destilada y comparar con otro sumergido en una solución de B. La cantidad de líquido en el primer capilar es superior a la del segundo. Formación de sales insolubles con cationes divalentes (corte de jabón) y pérdida de su capacidad emulsificante. b.-Se debe excluir en lo posible toda traza de agua para evitar la formación del anión hidroxilo en lugar del metoxilo, que es el que lleva a cabo la transesterificación. El agua que se forma junto con el metóxido es irrelevante debido al gran exceso de metanol. Problema 3 SO3 H a.-Dado que el metanol es soluble en agua, no se tendría un sistema bifásico, pero además, el cloruro de ácido reaccionaría H 2N con el metanol dando el metil éster en lugar del polímero. b.-i) Para la obtención de este colorante se debe sintetizar la sal A de diazonio sobre la diamina A y copularla con el fenilmetil HO 3S éter. La elección de la diamina está fundamentada en el hecho de que la misma debe estar desactivada para la SEA, mientras que el reactivo para la copulación debe estar activado. Esta elección garantiza un buen rendimiento en la obtención del colorante y un grado de pureza, ya que si la sal de diazonio se realizara sobre una amina activada para la SEA podría copular con sí misma, dando más de un colorante. 81/83 NH 2 Química Orgánica 63.14 ii) Para llevar a cabo esta síntesis es necesario trabajar a bajas temperaturas mientras se está formando la sal de diazonio, ya que un aumento de la temperatura provocaría un ataque por parte del agua con la consiguiente destrucción de la sal de diazonio. Problema 4 Reactivo 1: a)KMnO4/HO-/calor; b) H+ Reactivo 2: AlCl3 + acetanilida Reactivo 3: a)NaNO2 / H+; b) CuCl O OH O Cl Br A NO2 ii.- O NO2 B NO2 C H 2N Br iii.-En el paso 2, se utilizó la acetanilida en lugar de la anilina porque: a.-En presencia de un cloruro de acilo, la formación de la amida sería una reacción competitiva muy importante. b.-La presencia del grupo acetato protege las posiciones orto, y por lo tanto favorece la acilación en posición para. c.-la acetilación disminuye la activación del anillo para la SEA, si bien no es habitual que se produzca más de una acilación. iv.-D es un derivado del ácido benzoico que conserva su grupo carbonilo (IR = 1715 cm-1) y es monosustituído porque la señal de H aromáticos (7.2-8.3 aprox) integra para 5 protones => los cambios se han realizado en el carbono carbonílico. Cuarteto, 4.4(aprox.), integra para 2H => -CH2- vecino a 3H. Triplete, 1.4 (aprox.), integra para 3H => CH3- vecino a 2H. Grupo etilo. Como el metileno está desprotegido (desplazado a altos) debe estar unido a átomo electronegativo o aromático. Por Tabla 2, -CH2- vecino a Ph = 2.59-2.63 ppm; -CH2- vecino a –O-COPh = 4.25-4.37 ppm=> 82/83 Química Orgánica O OCH2 CH3 D 4 = CH3CH2OH / H+ 63.14 La doble flecha implica que la reacción de esterificación en medio ácido en realidad es un equilibrio Problema 5 i.- a) A es un glicolípido, pues está constituído por azúcares (dos manosas y una glucosa), glicerol y un ácido graso. b) A es no reductor, por lo que el oxhidrilo anomérico está bloqueado, probablemente con el lípido. c) Existe una unión entre el oxhidrilo anomérico del hidrato de carbono del extremo reductor y el diglicérido. El resto de las uniones entre azúcares debe ser . Dado que el único ácido graso obtenido es el palmítico y el diglicérido es ópticamente activo, las posiciones 1 y 2 de la glicerina están ocupadas por el palmítico, mientras que la tercera es la que se une al azúcar. d) El extremo reductor de B está constituído por manosa. e) Todos los azúcares son piranosas porque todos tienen metilado el OH de C-4. 2,3,4,6tetra-O-metil-D-manosa indica que el extremo no reductor está constituído por manosa. 2,4,6-tri-O-metil-D-glucosa, y 2,4,6-tri-O-metil-D-manosa indican que todas las uniones son 13 y el orden definitivo es: manp(13)glup(13)manp(13 del diacilglicerol). O ii.- Si el diglicérido es ópticamente activo => o tiene distintos H 3C(H2 C) 14 CO ácidos grasos o bien está sustituído en las posiciones 1 y 2. Como sólo se aisló palmítico, la segunda opción es la correcta. OH O C(CH 2) 14 CH 3 O iii.- iv.- 83/83