Guía N° 6
Anuncio
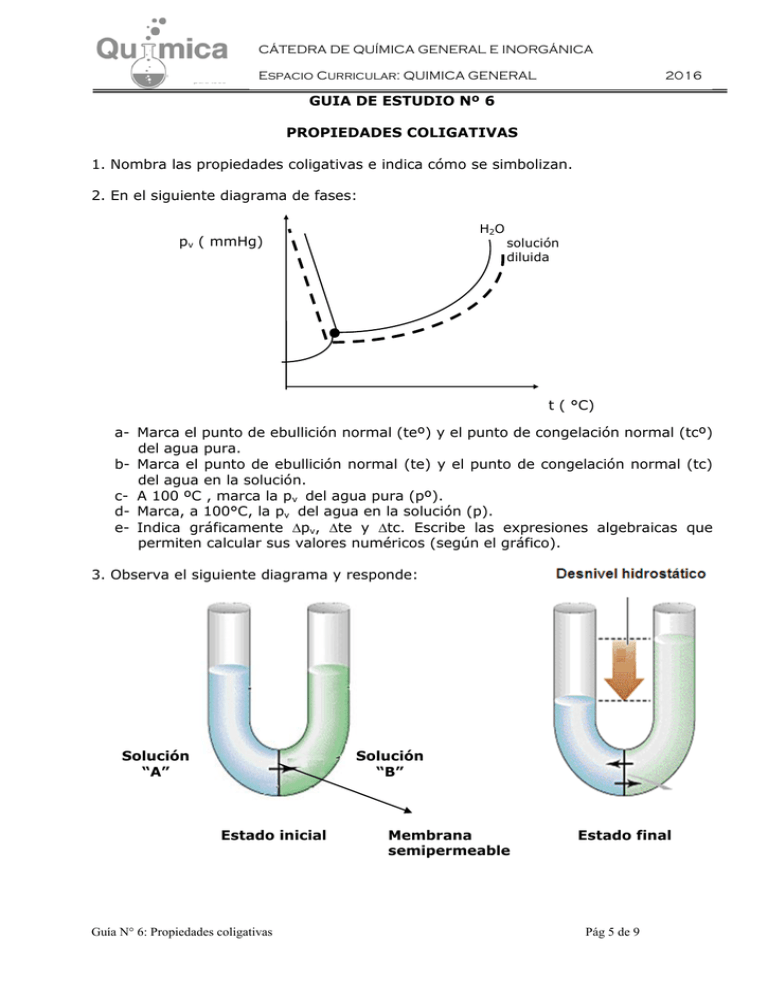
CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 GUIA DE ESTUDIO Nº 6 PROPIEDADES COLIGATIVAS 1. Nombra las propiedades coligativas e indica cómo se simbolizan. 2. En el siguiente diagrama de fases: H2O pv ( mmHg) solución diluida t ( °C) a- Marca el punto de ebullición normal (teº) y el punto de congelación normal (tcº) del agua pura. b- Marca el punto de ebullición normal (te) y el punto de congelación normal (tc) del agua en la solución. c- A 100 ºC , marca la pv del agua pura (pº). d- Marca, a 100°C, la pv del agua en la solución (p). e- Indica gráficamente pv, te y tc. Escribe las expresiones algebraicas que permiten calcular sus valores numéricos (según el gráfico). 3. Observa el siguiente diagrama y responde: Solución “A” Solución “B” Estado inicial Guía N° 6: Propiedades coligativas Membrana semipermeable Estado final Pág 5 de 9 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 a) ¿Cuál de las disoluciones tiene menor concentración? b) ¿Por qué el nivel del líquido en una de las ramas del tubo en U aumenta? c) ¿Cómo se denomina la presión que ejerce el desnivel hidrostático? d) ¿Qué sucede cuando el nivel en ambas ramas del tubo en U se mantiene constante? 4. Define ósmosis y presión osmótica 5. Enuncia las leyes de Raoult para el descenso de la presión de vapor, el ascenso ebulloscópico y el descenso crioscópico. 6. Enuncia la ley de Van’t Hoff para la presión osmótica. 7. ¿Qué condiciones debe tener una disolución para que cumpla las leyes de Raoult y de Van’t Hoff? 8. Completa la siguiente tabla: Propiedad coligativa Expresión matemática de la Ley de Raoult Expresión matemática de la ley de Van’t Hoff Significado de cada uno de los términos de la expresión Descenso de la presión de vapor Ascenso ebulloscópico Descenso crioscópico Presión osmótica Guía N° 6: Propiedades coligativas Pág 6 de 9 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 9. Desde el punto de vista biológico, los líquidos intra y extracelulares, por su presión osmótica, se clasifican según el siguiente esquema (indica el sentido del flujo osmótico): Ce Ci Ce Ce > Ci pVe < pVi e ... Ci Ce Ce = Ci Ce pVe = pVi i El disolvente fluye desde ............. a ............... El medio es: .................................. e Ci ... pVe e i ..... hay flujo de disolvente El sistema está en ............ > pVi ... i El disolvente fluye desde ................ a .............. El medio es: ................................. < Ci El medio es: ................................. El fenómeno se llama : El fenómeno se llama : ........................... ................................ 10. a) ¿Qué es un electrolito? b) ¿Qué sustancias se comportan como electrolitos? c) Define grado de disociación e indica cómo se simboliza. d) Los electrolitos pueden clasificarse como fuertes o débiles. Indica para los mismos a qué valores tiende el grado de disociación en cada caso y nombra algún ejemplo de cada tipo. e) Para un mismo electrolito, ¿puede variar el grado de disociación?, ¿de qué depende? Guía N° 6: Propiedades coligativas Pág 7 de 9 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 11. Si el soluto presente en una disolución es un electrolito, las leyes de Raoult y Van’t Hoff se ven afectadas por el factor de corrección “i” . Escribe las expresiones de dichas leyes utilizando el factor de corrección correspondiente. 12. ¿Cómo se relaciona el factor de corrección “i”con el grado de disociación? a) Para cualquier electrolito: b) Para electrolitos binarios: 13. a) ¿En qué condiciones el factor de corrección “i” tiende a un valor máximo entero? b) Indica el valor máximo del factor de corrección que tendrían soluciones de los siguientes electrolitos: a) Fosfato de potasio; i = ….. b) Nitrato de cinc; i = ….. c) Cloruro de amonio; i = ..... d) Sulfato cúprico; i = ..... 14. Indica los valores que tendrán el factor de corrección que tendrían las soluciones de los electrolitos indicados en el punto anterior si el grado de disociación de esos solutos fuera del 80%. a) Fosfato de potasio; i = ….. b) Nitrato de cinc; i = ….. c) Cloruro de amonio; i = ..... d) Sulfato cúprico; i = ..... 15. Indica el procedimiento que utilizarías para calcular el grado de disociación a partir de la determinación experimental de una propiedad coligativa. a) en forma general b) para una solución acuosa de cloruro de potasio, de concentración 1 molal, y cuyo punto de ebullición normal es de 101ºC (Ke = 0,512ºC. kgº/mol). Guía N° 6: Propiedades coligativas Pág 8 de 9 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 16. RESUELVE 16.1. El radiador de un automóvil contiene 5 kg de agua. a) Calcula cuántos g de glicerina hay que añadir para que la disolución no congele hasta -10 ºC. La masa molar de la glicerina es 92 g/mol. (kc= 1,86 ºC kgo/mol) R: 2473 g b) El cálculo realizado, ¿será exacto? Justifica tu respuesta. 16.2. En las regiones climáticas frías es frecuente echar sal en las carreteras para derretir la nieve. Indica cuál de las siguientes afirmaciones es la explicación correcta: a- La nieve en contacto con la sal aumenta su Pv y se calienta fundiéndose. b- Se produce un desprendimiento de calor al disolverse la sal. c- La disolución que se forma disminuye su Pv y toma más calor del entorno. d- Se forma una disolución concentrada que disminuye su Pv y su punto de congelación. 16.3. ¿Qué volumen ocupará 1 mol de una sustancia disuelta en agua para ejercer una = 1 atm a 0 ºC. R: 22,4 L 16.4. Se dispone de dos disoluciones acuosas de monosacáridos: A (C6H12O6) y B (C3H6O3) que contienen igual número de gramos de soluto y la misma cantidad de disolvente. a) ¿En cuál será mayor el descenso crioscópico? -En B, porque el soluto tiene menos masa molecular. - En A, porque el soluto tiene más masa molecular - En las dos igual, porque tienen igual número de gramos de soluto. - No se puede determinar con los datos conocidos. b) ¿En cuál será mayor el ascenso ebulloscópico? - En las dos igual, pues su molalidad es igual. - En B, porque su molalidad es mayor. - En A, porque existe un mayor número de partículas de soluto. - En A, porque su molalidad es mayor. 16.5. La lisozima es una enzima que rompe las paredes de las células bacterianas. Una solución acuosa que contiene 150 mg de esta enzima en 210 mL de solución tiene una presión osmótica de 0,95 torr a 25 ºC ¿cuál es la masa molar de esta sustancia? R: 1,39 104 g/mol 16.6. Calcula la masa de urea CO(NH2)2 que se debe disolver en 300 mL de agua para que la Pv de la solución disminuya en 0,36 mm Hg. Pº = 16,477 mm Hg a 19 ºC R: 22,35 g 16.7. Una solución acuosa de un no electrolito no volátil hierve a 100,62 ºC. ¿A qué temperatura congela? Ke = 0,512 ºC.kgo / mol Kc = 1,86 ºC.kgo / mol. R: - 2.25ºC Guía N° 6: Propiedades coligativas Pág 9 de 9 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 16.8. Una disolución al 9,1 % en masa de un compuesto de fórmula (C6H5P)4 en benceno,C6H6, a 26,1ºC, produce disminución de la presión de vapor del disolvente. Determina: a) fracción molar de solvente b) la disminución de la presión de vapor c) la temperatura de congelación de la solución. ( pº benceno (26,1ºC) = 100 mmHg; Kc = 5,12 ºC kgo/mol , tºc = 5,5ºC ) R: X0 = 0,983 ; pv = 1,7 mmHg tc = 4,3 ºC 16.9. Averigua la masa de cloruro de potasio que se debe disolver en 400 mL de agua, para que la solución hierva a 100,5 º C, si = 98 %. (Ke = 0,512 ºC.kgo / mol) R: 14,7 g 16.10. Determina la presión osmótica de una solución de cloruro de calcio, que contiene 3,2 g de cloruro de calcio en 150 mL de solución a 30 ºC, si el soluto se encuentra disociado en un 80 %. R: 12,4 atm Guía N° 6: Propiedades coligativas Pág 10 de 9








