Solucionario del libro de quimica de 2 de
Anuncio
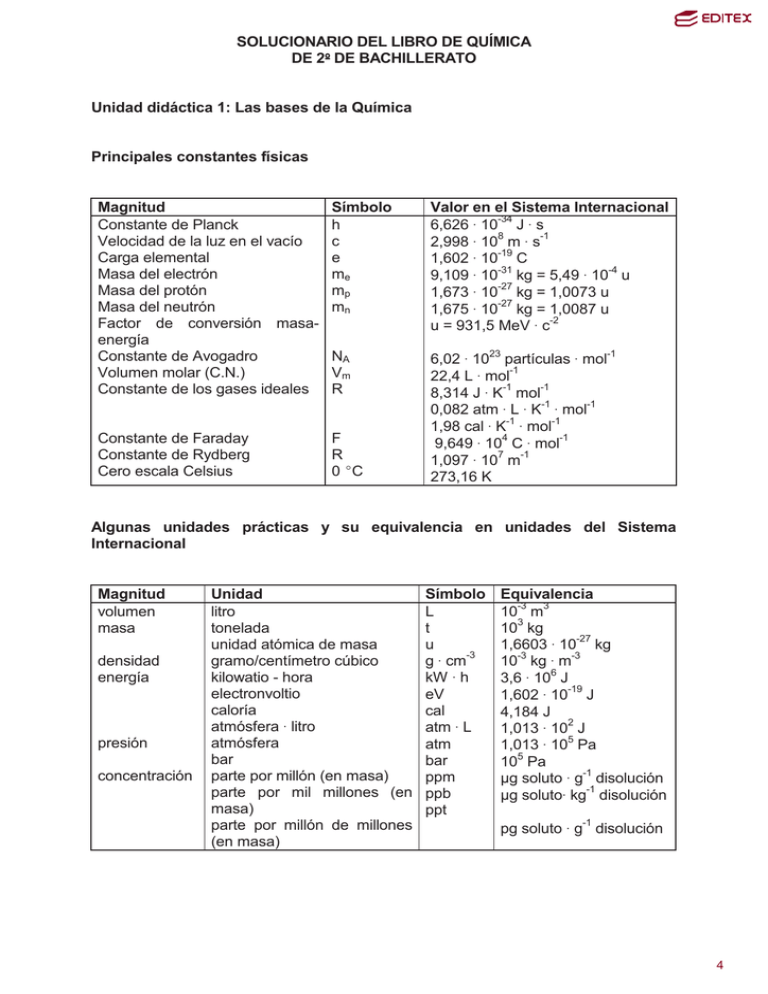
SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE BACHILLERATO Unidad didáctica 1: Las bases de la Química Principales constantes físicas Magnitud Constante de Planck Velocidad de la luz en el vacío Carga elemental Masa del electrón Masa del protón Masa del neutrón Factor de conversión masaenergía Constante de Avogadro Volumen molar (C.N.) Constante de los gases ideales Símbolo h c e me mp mn Valor en el Sistema Internacional 6,626 $ 10-34 J $ s 8 -1 2,998 $ 10 m $ s 1,602 $ 10-19 C -31 -4 9,109 $ 10 kg = 5,49 $ 10 u 1,673 $ 10-27 kg = 1,0073 u 1,675 $ 10-27 kg = 1,0087 u u = 931,5 MeV $ c-2 NA Vm R Constante de Faraday Constante de Rydberg Cero escala Celsius F R 0 (C 6,02 $ 1023 partículas $ mol-1 22,4 L $ mol-1 8,314 J $ K-1 mol-1 0,082 atm $ L $ K-1 $ mol-1 1,98 cal $ K-1 $ mol-1 9,649 $ 104 C $ mol-1 1,097 $ 107 m-1 273,16 K Algunas unidades prácticas y su equivalencia en unidades del Sistema Internacional Magnitud volumen masa densidad energía presión concentración Unidad litro tonelada unidad atómica de masa gramo/centímetro cúbico kilowatio - hora electronvoltio caloría atmósfera $ litro atmósfera bar parte por millón (en masa) parte por mil millones (en masa) parte por millón de millones (en masa) Símbolo L t u -3 g $ cm kW $ h eV cal atm $ L atm bar ppm ppb ppt Equivalencia 10-3 m3 103 kg 1,6603 $ 10-27 kg 10-3 kg $ m-3 3,6 $ 106 J 1,602 $ 10-19 J 4,184 J 1,013 $ 102 J 1,013 $ 105 Pa 105 Pa ȝg soluto $ g-1 disolución ȝg soluto$ kg-1 disolución pg soluto $ g-1 disolución 1 4 Z 89 13 51 18 33 85 16 56 4 83 5 35 48 20 6 58 55 30 40 17 27 29 36 24 21 50 38 9 15 87 31 32 72 2 1 26 49 77 57 Elementos químicos más utilizados y sus masas atómicas en u Símbolo Nombre masa Z Símbolo Nombre Masa Ac Actinio 227 3 Li Litio 6,491 Al Aluminio 26,98 12 Mg Magnesio 24,31 Sb Antimonio 121,8 25 Mn Manganeso 54,94 Ar Argón 39,95 80 Hg Mercurio 200,6 As Arsénico 74,92 42 Mo Molibdeno 95,94 At Astato 210 60 Nd Neodimio 144,2 S Azufre 32,07 10 Ne Neón 20,18 Ba Bario 137,3 28 Ni Níquel 58,69 Be Berilio 9,012 7 N Nitrógeno 14,01 Bi Bismuto 209,0 102 No Nobelio 253 B Boro 10,81 79 Au Oro 197,0 Br Bromo 79,90 76 Os Osmio 190,2 Cd Cadmio 112,4 8 O Oxígeno 16,00 Ca Calcio 40,08 46 Pd Paladio 106,4 C Carbono 12,01 47 Ag Plata 107,9 Ce Cerio 140,1 78 Pt Platino 195,1 Cs Cesio 132,9 82 Pb Plomo 207,2 Zn Cinc 65,39 94 Pu Plutonio 242 Zr Circonio 91,22 84 Po Polonio 210 Cl Cloro 35,45 19 K Potasio 39,10 Co Cobalto 58,93 59 Pr Praseodimio 140,9 Cu Cobre 63,55 91 Pa Protoactinio 231 Kr Criptón 83,80 88 Ra Radio 226 Cr Cromo 52,00 86 Rn Radón 222 Sc Escandio 44,96 45 Rh Rodio 102,9 Sn Estaño 118,7 37 Rb Rubidio 85,47 Sr Estroncio 87,62 34 Se Selenio 78,96 F Flúor 19,00 14 Si Silicio 28,09 P Fósforo 30,97 11 Na Sodio 22,99 Fr Francio 223 81 Tl Talio 204,4 Ga Galio 69,72 43 Tc Tecnecio 99 Ge Germanio 72,59 52 Te Telurio 127,6 Hf Hafnio 178,5 22 Ti Titanio 47,88 He Helio 4,003 90 Th Torio 232,0 H Hidrógeno 1,008 74 W Volframio 183,9 Fe Hierro 55,85 92 U Uranio 238 In Indio 114,8 23 V Vanadio 50,94 Ir Iridio 192,2 54 Xe Xenón 131,3 La Lantano 138,9 53 I Yodo 126,9 2 5 Cuestiones iniciales 1. Se realiza la autopsia a una víctima de asesinato. En su pelo se obtiene una cantidad de arsénico igual a 0,2 mg en una muestra de 15 g de cabello. Calcula el % de arsénico que contiene ese cabello. g 10 mg · 100 = 1,33 · 10 −3 % 15 g 0,2 mg · %= 3 2. La concentración de CO, gas venenoso, en el humo de un cigarrillo es del 2 %. Calcula el volumen de este gas en 1 litro de humo procedente de un cigarrillo. V = 1 L humo · 2 de CO = 0,02 L de CO 100 de humo 3. El medicamento alucol, utilizado como antiácido estomacal, contiene hidróxido de aluminio y verifica la siguiente reacción química con el ácido clorhídrico del estómago: Al(OH)3 + HCl ĺ AlCl3 + H2O. a) Ajusta la ecuación química de la reacción química anterior. b) Si cada comprimido contiene 375 mg de hidróxido de aluminio, calcula la cantidad de ácido clorhídrico que reacciona con un comprimido. a) Al(OH)3 + 3 HCl ĺ AlCl3 + 3 H2O b) Por la estequiometría de la ecuación química ajustada se verifica: m m de HCl de Al (OH ) 3 n de Al (OH ) 3 n de HCl = e igualmente: M = M 1 3 1 3 Como la masa molar del Al(OH)3 es 78 g g y la del HCl 36,5 , entonces: mol mol 0,375 g m de Al (OH ) 3 de HCl g g 78 36,5 mol mol = m de HCl = 0,526 g de HCl 1 3 Actividades finales 1. Un recipiente cerrado contiene oxígeno. Después de vaciarlo se llena de gas amoníaco a la misma presión y temperatura. Razona cada una de las siguientes afirmaciones: a) El recipiente contiene el mismo número de moléculas de ambos gases. b) La masa del recipiente lleno es la misma en los dos casos. c) En las dos situaciones, el recipiente contiene el mismo número de átomos. 3 6 a) Verdadera: Para los gases según la hipótesis de Avogadro, dos recipientes de igual volumen, en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas, independientemente del tipo de sustancia contenida en ellos. b) Falsa: Aunque existe el mismo número de moléculas, la masa molar de cada gas es diferente y la masa del recipiente también lo será. c) Falsa: Ya que aunque existe el mismo número de moléculas, la molécula de O2 contiene distinto número de átomos que la de NH3. 2. Se dispone de 200 L de gas hidrógeno medidos en condiciones normales de presión y temperatura. Halla: a) La cantidad de hidrógeno que hay en mol y en g, así como el número de moléculas y de átomos del mismo. b) El volumen que 2 ocuparía el gas a 294 K y 98000 N/m y su volumen molar en dichas condiciones. a) n = V = Vm 200 L = 8,93 mol L 22,4 mol Como la masa molar del H2 es 2 n= g , entonces: mol m g m = 8,93 mol · 2 = 17,86 g M mol Igualmente: n = N moléculas N = 8,93 mol · 6,02 · 10 23 = 53,75 · 10 23 moléculas NA mol Como cada molécula de H2 contiene 2 átomos, entonces: 23 53,75 · 10 moléculas · 2 átomos = 107,50 · 10 23 átomos molécula b) p · V = n · R · T, luego: 98000 N m2 N · V = 8,93 mol · 0,082 atm · L · 294 K V = 222,53 L mol · K 2 101300 m atm Y Finalmente: n = 222,53 L V L Vm = = 24,92 Vm mol 8,93 mol 3. Una bombona de butano contiene 12 kg de este gas. Calcula: a) la cantidad, en mol, de gas existente en la bombona. b) El número de átomos de carbono y de hidrógeno que contiene. c) La composición centesimal del butano. a) La masa molar del butano de fórmula C4H10 es 58 g g mol 4 7 Por tanto: n = b) n = m 12000 g = = 206,9 mol g M 58 mol N moléculas N = 206,9 mol · 6,02 · 10 23 = 1,25 · 10 26 moléculas NA mol De la fórmula del butano se deduce: 26 1,25 · 10 moléculas · 4 26 átomos de C 26 = 4,98 · 10 átomos de C molécula 1,25 · 10 moléculas · 10 átomos de C 27 = 1,25 · 10 átomos de H molécula c) Como la masa molar atómica del C es 12 g g y la del H 1 , del dato del valor mol mol de la masa molar del butano se deduce que en 58 g de butano hay: 4 · 12 g = 48 g de C y: 10 · 1 g = 10 g de H, luego: % de C = 48 g · 100 = 82,76 % 58 g % de H = 10 g · 100 = 17,24 % 58 g 4. Al quemar totalmente 2,371 g de carbono se forman 8,688 g de un óxido gaseoso de este elemento químico. Si en condiciones normales, 1 L de este óxido tiene una masa de 1,9768 g, halla la fórmula empírica y molecular de dicho compuesto químico. Como el óxido sólo contiene carbono y oxígeno, resulta que en el óxido contiene: 2,371 g de C y 8,688 g – 2,371 g de O = 6,317 g de O Por tanto: 2,371 g · 100 = 27,29 % 8,688 g 6,317 g % de O = · 100 = 72,71 % 8,688 g % de C = Las masas molares atómicas del C y el O son, respectivamente: 12 g/mol y 16 g/mol. Al conocer los tantos por ciento de cada elemento químico, se calcula la cantidad de cada elemento químico, en mol, en el compuesto químico de la siguiente forma: 27,29 g = 2,27 mol de C ; 12 g/mol 72,71 g = 4,54 mol de O 16g/mol Es decir, la proporción del número de átomos de cada elemento químico en el óxido de carbono es de 2,27 de C por cada 4,54 de O, o cualquier múltiplo o submúltiplo de esta relación. Puesto que la fórmula química de un compuesto químico expresa esta relación en números enteros, se toma como dato de referencia el menor de los cocientes obtenidos anteriormente y se divide el otro valor entre él. Con ello se obtiene la proporción relativa en la que se encuentran los átomos de los dos elementos químicos en el óxido de carbono. De forma que: 5 8 2,27 mol = 1 de C ; 2,27 mol 4,54 mol = 2 de O ; 2,27 mol Luego la fórmula empírica del óxido de carbono es: CO2 , o mejor: (CO2)n Para hallar la fórmula molecular se sabe que: p · V = n · R ·T, luego: n de óxido = 1,9768 g = M 1 atm · 1 L g = 0,80 mol M = 44,3 atm · L mol 0,082 · 273 K mol · K Como la masa molar de CO2 es 44 g/mol, entonces: g mol n= w1, luego la fórmula molecular es CO2, que coincide con la fórmula g 44 mol 44,3 empírica en este caso. 5. Un compuesto orgánico está formado únicamente por carbono, hidrógeno y azufre. a) Determina la composición centesimal y su fórmula empírica, si cuando se queman 3,00 g del mismo se obtienen 6,00 g de dióxido de carbono y 2,46 g de agua. b) Establece su fórmula molecular, si cuando se vaporizan 1,50 g de dicho compuesto ocupan un volumen de 1,13 L, medidos a 120 °C y 0,485 atm. a) En la combustión completa todo el C pasa a CO2 y todo el H a H2O. Sabiendo que g g g , la del S 32 y la del H 1 y las masas mol mol mol g g y del H2O 18 , entonces. molares del CO2 44 mol mol la masa molar atómica del C es 12 n de CO2 que se obtiene = 6,00 g , de forma que: g 44 mol m de C existente en el CO2 obtenido = 12 g 6,00 g · = 1,636 g de C g mol 44 mol Igualmente para el H: 2,46 g , de forma que: g 18 mol g 2,46 g m de H existente en el H2O obtenido = 2 · 1 · = 0,273 g de H g mol 18 mol n de H2O que se obtiene = Asimismo 1,636 g de C es la masa de C que hay en la muestra inicial del compuesto del que se desea averiguar su fórmula molecular y 0,273 g es la de H. Por tanto, la masa de S se halla a partir de la diferencia: 3,00 g – (1,636 g + 0,273 g) = 1,091 g. 6 9 Por tanto: 1,636 g · 100 = 54,53 % 3,00 g 0,273 g % de H = · 100 = 9,10 % 3,00 g 1,091 g % de S = · 100 = 36,37 % 3,00 g % de C = Como las masas molares atómicas del C, H y S son, respectivamente: 12 g/mol, 1 g/mol y 32 g/mol. Al conocer los tantos por ciento de cada elemento químico, se calcula la cantidad de cada elemento químico, en mol, en el compuesto químico de la siguiente forma: 9,10 g 54,53 g = 4,54 mol de C ; = 9,10 mol de H ; 12 g/mol 1 g/mol 36,37 g = 1,14 mol de S 32 g/mol Es decir, la proporción del número de átomos de cada elemento químico en el compuesto químico original es de 4,54 de C por cada 9,10 de H y 1,14 de S, o cualquier múltiplo o submúltiplo de esta relación. Puesto que la fórmula química de un compuesto químico expresa esta relación en números enteros, se toma como dato de referencia el menor de los cocientes obtenidos anteriormente y se divide los otros dos valores entre él. Con ello se obtiene la proporción relativa en la que se encuentran los átomos de los tres elementos químicos en el compuesto químico original. De forma que: 4,54 mol = 3,98 de C ; 1,14 mol 9,10 mol = 7,98 de H ; 1,14 mol 1,14 mol = 1,00 de S 1,14 mol Redondeando, resulta que la fórmula empírica del compuesto químico es: C4H8S, o mejor: (C4H8S)n b) Para hallar la fórmula molecular se sabe que para el vapor de dicho compuesto químico se cumple: p · V = n · R ·T, luego: 0,485 atm · 1,13 L = n · 0,082 Por tanto: 0,017 mol = atm · L · 393 K n = 0,017 mol mol · K 1,50 g g M = 88,2 M mol Como la masa molar correspondiente a la fórmula empírica es: M = 4 · 12 g mol + 8 · 1 g g g + 32 = 88 , resulta que este valor es mol mol mol prácticamente igual que el obtenido a partir de la ecuación general de los gases, por lo que la fórmula molecular es: C4H8S 6. Prepara 250 cm3 de una disolución de ácido clorhídrico 2 molar, si el frasco comercial del laboratorio tiene las siguientes indicaciones: densidad 1,18 3 g/cm y riqueza del 35 %. Como la masa molar del HCl es 36 g , entonces: mol 7 10 m g mol mol m = 18,3 g de HCl 2 = L 0,250 L 36,5 18,3 g de HCl es la masa de HCl requerida para preparar una disolución de dicho ácido, supuesta una riqueza del 100 %, pero como la riqueza es del 35 %, la cantidad de HCl necesaria es: m impuro = 18,3 g · 100 = 52,1 g 35 Como en los líquidos es más fácil medir volúmenes, entonces: d= 52,3 g m impuro V = = 44,2 cm 3 , que es el volumen que ocupa 52,1 g de HCl g V 1,18 cm 3 7. Se dispone de 100 mL de una disolución de ácido clorhídrico 0,5 molar y se desea preparar 100 mL de otra disolución del mismo ácido pero de concentración 0,05 molar. Cómo se prepara y se realiza en el laboratorio. En 100 mL de HCl 0,05 molar hay: n = C M · V = 0,05 mol L · 100 mL · = 5 · 10 −3 mol de HCl puro L 1000 mL Esta cantidad se debe tomar del HCl más concentrado, de molaridad 0,5 molar, y para ello se necesita un volumen de: n = C M · V 5 · 10 −3 mol = 0,5 mol · V V = 0,01 L L De esta forma el procedimiento a realizar en el laboratorio es el siguiente: 1º. Se pipetea (nunca con la boca) 10 mL de la muestra original de HCl de concentración 0,5 molar. 2º. Se vierten los anteriores 10 mL con la pipeta en un matraz aforado de 100 mL 3º. Se enrasa con agua destilada el matraz hasta los 100 mL de capacidad y así se obtienen finalmente 100 mL de una disolución de HCl de concentración 0,05 molar. 8. Se toman 100 mL de una disolución de ácido nítrico del 42 % de riqueza en masa y densidad 1,85 g/mL y se diluyen hasta un volumen de 1 L de disolución. La disolución resultante tiene una densidad de 0,854 g/mL. a) Calcula la fracción molar del ácido nítrico resultante. b) Determina la molalidad de la disolución resultante. a) Los 100 mL de la disolución inicial del ácido nítrico tienen una masa de: 8 11 m disolución inicial = d · V = 1,85 g · 100 mL = 185 g de disolución de HNO3. mL Luego m puro de HNO3 = 185 g · 42 = 77,7 g 100 Como la masa molar del HNO3 es 63 g 77,7 g , entonces: n de HNO3 = = 1,23 mol g mol 63 mol Al diluir los 100 mL hasta 1 L tendremos esta cantidad de HNO3 y otra de agua que hay que calcular. m disolución final = d · V = 0,854 g · 1000 mL = 854 g de disolución final de HNO3. mL Como al final existen 77,7 g de HNO3, entonces de agua habrá: m de agua = 854 g – 77,7 g = 776,3 g Como la masa molar del H2O es 18 n de H 2O = 776,3 g = 43,13 mol g 18 mol De esta forma: x de HNO3 = b) m = g , entonces: mol 1,23 mol = 0,028 1,23 mol + 43,13 mol n de HNO3 1,23 mol mol = = 1,58 masa de disolvente en kg 0,7763 kg kg 9. Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1,84 g/cm3 y riqueza en masa 96 %. a) Calcula e indica cómo prepararías 100 mL de una disolución 7 M de dicho ácido. b) ¿Hay que tomar alguna precaución especial? a) C M = n mol L n=7 · 100 mL · = 0,7 mol V L 1000 mL g , entonces la masa de H2SO4 puro que mol m g hace falta es: n = m = 0,7 mol · 98 = 68,6 g M mol Como la masa molar del H2SO4 es 98 De esta forma de la botella de H2SO4 de riqueza del 96 % hay que tomar una cantidad de: m disolución de H2SO4 = 68,6 g de H2SO4 · 100 g disolución de H 2 SO 4 = 71,46 g 96 g de H 2 SO4 9 12 pero lo que se toma es un volumen, luego: d disolución = Por tanto: V = m disolución V 71,46 g = 38,84 cm 3 g 1,84 cm 3 De esta forma hay que realizar los siguientes pasos: 3 1º. Pipetear (nunca con la boca) de la botella un volumen de 38,84 cm de la disolución de dicho ácido. 2º. Sobre un matraz aforado de 100 mL se vierte aproximadamente 50 mL de agua destilada y sobre el agua y de forma lenta se echan los 38,84 cm3 del ácido sulfúrico y se agita el matraz con la mano para favorecer la disolución. 3º. Se enrasa el matraz, añadiendo lentamente más agua destilada hasta alcanzar los 100 mL de disolución. b) Sí, pues nunca se debe verter agua sobre el ácido sulfúrico concentrado, pues se pueden producir sobrecalentamientos locales con proyección de ácido hirviendo e incluso hasta violentas explosiones en algunos casos. Por ello siempre se debe echar el ácido sobre el agua. 10. La presión de vapor del agua a 20 °C es de 17,5 3 mm de Hg. Se disuelven 36 3 g de glucosa en 400 cm de agua a 20 °C. Halla: a) La presión de vapor de la disolución. b) Las temperaturas de solidificación y de ebullición de la disolución. Datos: constante crioscópica y ebulloscópica del agua 1,86 °C/molal y 0,512 °C/molal, respectivamente. a) Sabiendo que la masa molar de la glucosa de fórmula C6H12O6 es 180 agua 18 g y la del mol g g y admitiendo que la densidad del agua a 20 °C es 1 , resulta que: mol cm 3 n de glu cos a = x de agua = 36 g = 0,2 mol y n de agua = g 180 mol 400 cm 3 · 1 18 g mol g cm 3 = 22,22 mol 22,22 mol = 0,99 22,22 mol + 0,2 mol De esta forma: 0 p disolución = p · x de agua = 17,53 mm de Hg · 0,99 = 17,35 mm de Hg b) La molalidad de la disolución es: m= n de glu cos a 0,2, mol mol = = 0,5 masa de disolvente en kg 0,4 kg kg 10 13 0 ∆tc = Kc · m = 1,86 C mol · 0,5 = 0,93 °C mol / kg kg Ahora: 0,93 °C = 0°C – t solidificación t solidificación = - 0,93 °C 0 ∆te = Ke · m = 0,512 C mol · 0,5 = 0,25 °C mol / kg kg Ahora: 0,25 °C = t ebullición – 100 °C t ebullición = 100,25 °C 11. Al tratar dióxido de manganeso con ácido clorhídrico se obtiene cloruro de manganeso, agua y cloro. Halla: a) la cantidad de dióxido de manganeso, en g, y b) el volumen de disolución de ácido clorhídrico 1 molar, que se precisan para obtener 20 L de cloro a la temperatura de 15 °C y p resión de 720 mm de Hg. Primero hay que ajustar la ecuación de la reacción química que tiene lugar, para ello se procede de la siguiente forma mediante el método algebraico: La ecuación química de la reacción se puede escribir mediante: a MnO2 + b HCl c MnCl2 + d Cl2 + e H2O El ajuste consiste en determinar los coeficientes estequiométricos: a, b, c, d, e, aplicando balances de materia a cada elemento químico, resultando: Para el Mn: a=c Para el O: 2a=e Para el H: b=2e Para el Cl: b=2c+2d Sistema de cuatro ecuaciones con cinco incógnitas Dado que los coeficientes estequiométricos muestran la proporción existente entre las diversas sustancias que intervienen en la reacción química, por simplicidad de cálculos se puede admitir que, por ejemplo: a = 1. Luego: c = 1 y de esta forma resulta que: e = 2 y b = 4. Y por último: d = 1 Por tanto la ecuación química ajustada es: MnO2 + 4 HCl MnCl2 + Cl2 + 2 H2O A continuación, se identifican los reactivos y los productos de la reacción química que describe el proceso: Ecuación química ajustada Cantidades que intervienen en la reacción Datos e incógnitas MnO2 (s) + 4 HCl MnCl2 (aq) (aq) n de MnO2 1 n de HCl 4 ¿m MnO2? CM = 1 M ¿V HCl? n de MnCl 2 1 + Cl2 (g) n de Cl 2 1 + 2 H2O (l) n de H 2O 2 20 L a t = 15 ºC p = 720 mm 11 14 Se determina la masa molar de la sustancia que interviene en el proceso a partir de la información que proporciona la tabla periódica, de forma que la del MnO2 es 87 a) En este caso: g mol n de MnO2 n de Cl 2 = y, además, se cumple para el gas Cl2 que: 1 1 720 mm · 20 L mm 760 atm p · V = n · R · T, luego: n de Cl 2 = = 0,80 mol atm · L 0,082 · 288 K mol · K Como: n de MnO2 n de Cl 2 = n de MnO2 = 0,80 mol 1 1 Y, por tanto: 0,80 mol de MnO2 = b) Para el HCl resulta que: m g m = 0,80 mol · 87 = 69,6 g de MnO 2 M mol n de HCl n de Cl 2 = , luego: 4 1 n de HCl 0,80 mol de Cl 2 = n de HCl = 4 · 0,80 mol = 3,20 mol 4 1 Y el volumen de la disolución de dicho ácido es: 1 mol 3,20 mol V = 3,20 L = L V 12. El dicromato de potasio reacciona con el cloruro de estaño (II), en ácido clorhídrico, para producir cloruro de estaño (IV), cloruro de cromo (III) y agua. a) 3 Escribe y ajusta la ecuación química de la reacción que tiene lugar. b) Si 45 cm de una disolución de cloruro de estaño 0,05 molar reaccionan completamente con 60 cm3 de una disolución de dicromato de potasio, halla la molaridad de esa disolución. a) La ecuación química de la reacción química que ocurre es: a K2Cr2O7 (aq) + b SnCl2 (s) + c HCl (aq) ĺ ĺ d KCl (aq) + e SnCl4 (aq) + f CrCl3 (aq) + g H2O (l) El ajuste consiste en determinar los coeficientes estequiométricos: a, b, c, d, e, f, g, aplicando balances de materia a cada elemento químico, resultando: Para el K: 2a=d Para el Cr: 2a= f Para el O: 7a=g Para el Sn: b=e Para el Cl: 2 b + c = d + 4 e + 3 f Para el H: c=2g Sistema de seis ecuaciones con siete incógnitas 12 15 Dado que los coeficientes estequiométricos muestran la proporción existente entre las diversas sustancias que intervienen en la reacción química, por simplicidad de cálculos se puede admitir que, por ejemplo: a = 1. Luego: d = 2, f = 2, g = 7, c= 14, b = 3, e = 3 Por tanto la ecuación química ajustada es: K2Cr2O7 (aq) + 3 SnCl2 (s) + 14 HCl (aq) ĺ ĺ 2 KCl (aq) + 3 SnCl4 (aq) + 2 CrCl3 (aq) + 7 H2O (l) b) Según la estequiometría de la ecuación química resulta que: n de K 2Cr 2O7 n de SnCl 2 = , e igualmente: 1 3 C de K 2Cr 2O7 · V de K 2Cr 2O7 C de SnCl 2 · V de SnCl 2 = , luego: 1 3 3 C de K 2Cr 2O7 · 60 cm = 1 0,05 mol · 45 cm 3 mol L C de K2Cr2O7 = 0,0125 3 L 13. Se descomponen totalmente 3,16 mol de clorato de potasio hasta que se libera todo el oxígeno de dicho compuesto químico. El oxígeno se utiliza para oxidar arsénico y producir pentaóxido de diarsénico. Calcula la cantidad, en mol, de pentaóxido de arsénico que se obtiene. Al descomponerse el clorato de potasio se origina: KClO3 (s) ĺ KCl (s) + 3/2 O2 (g) Por lo que: n de KClO3 n de O2 3,16 mol de KClO3 n de O2 = = n de O2 = 4,74 mol de O2 1 3/2 1 3/2 Ahora: 5/2 O2 (g) + 2 As (s) ĺ As2O5 (s) y se cumple que: n de O2 n de As 2O5 4,74 mol de O2 n de As 2O5 = = n de As2O5 = 1,90 mol 5/2 1 5/2 1 14. La reacción química de obtención del amoníaco a partir del hidrógeno y el nitrógeno tiene lugar con una extensión al término de la misma del 32 %, si las cantidades iniciales de hidrógeno y nitrógeno presentes son 0,200 mol y 0,500 mol, respectivamente. Halla: a) El rendimiento de la reacción y el avance máximo. b) El avance de la reacción y la cantidad de NH3 que se obtiene realmente, en mol. a) La extensión al término de la reacción es lo mismo que rendimiento de la reacción, por lo que éste tiene el valor del 32 %. 13 16 Reacción química Relación estequiométrica 3 H2 (g) + 3 mol Estado inicial (en mol) Avance (en mol) Avance máximo (en mol) 0,200 x 0,200 - 3x xmáx = 0,067 0,000 N2 (g) → 2 NH3 (g) 1 mol 2 mol 0,500 0 0,500 – x 2x 0,433 0,133 ya que como: 0,200 - 3x ≥ 0 x ≤ 0,067 mol y también: 0,500 - x ≥ 0 x ≤ 0,250 mol. Por lo que ambas inecuaciones son satisfechas para: x ≤ 0,067 mol o bien: xmáx = 0,067 mol. Hay que tener en cuenta que si la reacción ocurriese con una extensión del 100 % y como en este caso el reactivo limitante es el H2, resulta: n de H 2 n de NH 3 0,200 mol de H 2 n de NH 3 = = n de NH3 = 0,133 mol 3 2 3 2 b) 32 = x · 100 x = 0,021 mol 0,067 mol La cantidad de NH3 que se obtiene es: 2x = 2 · 0,021 mol = 0,043 mol de NH3. 15. La reacción del amoníaco con el ácido nítrico origina nitrato de amonio. Si se parte de 1 t de amoníaco y de 2 m3 de ácido nítrico puro de densidad 1520 kg/m3. Calcula: a) El reactivo limitante de la reacción. b) La masa de nitrato de amonio que se puede obtener. c) Este nitrato es utilizado para abonar un terreno que va a ser cultivado para obtener patatas y se necesitan 130 kg de nitrato de amonio por hectárea, ¿qué superficie se podrá abonar? a) La ecuación química de la reacción es: NH3 (g) + HNO3 (aq) ĺ NH4NO3 (aq) La cantidad de HNO3, en kg, de que se dispone es: d= m kg m = 1520 3 · 2 m 3 = 3040 kg V m Como la masa molar del NH3 es 17 g g y la del HNO3 es 63 , entonces la mol mol estequiometría de la reacción indica que: m m de NH 3 de HNO3 n de NH 3 n de HNO3 = M = M , luego: 1 1 1 1 m 3040 kg de NH 3 de HNO3 g g 63 17 mol mol = m de NH3 = 820,3 kg de NH3 que reacciona. 1 1 Como se parte de 1 t de NH3 hay exceso de amoníaco y el reactivo limitante es el HNO3, pues se consume todo él. 14 17 b) Aplicando la ley de Lavoisier se cumple que: 820,3 kg de NH3 + 3040 kg de HNO3 = 3860,3 kg de NH4NO3 c) La superficie total a abonar es: S = 3860,3 kg = 29,7 hectáreas kg 130 hectárea 3 16. En un recipiente de 1 dm hay una mezcla de oxígeno e hidrógeno, sometida a una presión de 0,1 atm y a 300 K. Sabiendo que en la mezcla hay 20 % en masa de hidrógeno. a) Determina la presión parcial de cada componente en la mezcla. b) Si se hace saltar la chispa, la mezcla reacciona para originar vapor de agua. Calcula la masa de agua que se forma y la composición en porcentaje de la mezcla final. a) La cantidad total, en mol, que hay en el recipiente suponiendo un comportamiento ideal se obtiene a partir de: p · V = n · R · T, luego: 0,1 atm · 1 L = n · 0,082 atm · L · 300 K n = 4,07 · 10-3 mol mol · K Sabiendo que la masa molar del H2 es 2 g g y la del O2 32 , entonces: mol mol Del porcentaje del 20 % en masa del H2 se concluye: 0,2 · x g H 2 0,8 · x g O2 + = 4,07 · 10 −3 mol x = 0,033 g. Por tanto: g g 2 32 mol mol n de H 2 = 0,2 · 0,033 g H 2 0,8 · 0,033 g O2 = 3,30 · 10 −3 mol y n de O2 = = 8,25 · 10 − 4 mol g g 2 32 mol mol De esta forma: p H2 = 3,30 · 10 −3 mol 4,07 · 10 −3 mol · 0,1 atm = 0,08 atm y p O 2 = 8,25 · 10 −4 mol 4,07 · 10 −3 mol · 0,1 atm = 0,02 atm b) La ecuación química ajustada de la reacción es: H2 (g) + ½ O2 (g) ĺ H2O (g) Los reactivos no se encuentran en proporciones estequiométricas, ya que: Ecuación H2 (g) química ajustada Cantidades que n de H 2 intervienen 1 en la reacción Datos e 3,30 · 10-3 mol incógnitas + ½ O2 (g) H2O (g) n de O 2 1/ 2 n de H 2O 1 8,25 · 10-4 mol ¿m vapor? De los valores de las cantidades existentes de H2 y O2 se deduce que el O2 es el 15 18 reactivo limitante, ya que: 8,25 · 10 −4 mol de O 2 n de H 2 n de O2 n de H 2 = = , luego: 1/ 2 1 1/ 2 1 n de H2 que reacciona es:1,65 · 10-3 mol. Además se cumple: n de O2 n de H 2O 8,25 · 10 −4 mol = n de H 2O = = 1,65 · 10 −3 mol que se obtiene. 1/ 2 1 1/ 2 Como la masa molar del agua es 18 g , entonces: mol m de H 2O = n · M = 1,65 · 10 −3 mol · 18 g = 29,7 · 10 −3 g mol La cantidad, en mol, de H2 que queda sin reaccionar es: 3,30 · 10-3 mol - 1,65 · 10-3 mol = 1,65 · 10-3 mol Por tanto al final se consume todo el oxígeno y hay: 1,65 · 10-3 mol de H2O y 1,65 · 10-3 mol de H2 Luego: n total = 1,65 · 10-3 mol de H2O + 1,65 · 10-3 mol de H2 = 3,30 · 10-3 mol % de H 2O = 1,65 · 10 −3 mol 3,30 · 10 −3 mol · 100 = 50 % y % de H 2 = 1,65 · 10 −3 mol 3,30 · 10 −3 mol · 100 = 50 % 17. El cloro se puede obtener según la reacción: óxido de manganeso (IV) más ácido clorhídrico para originar cloruro de manganeso (II), agua y cloro. Calcula: a) La cantidad de óxido de manganeso (IV), en mol, necesaria para obtener 100 L de cloro medidos a 15 °C y 720 mm de Hg. b) El volu men de ácido clorhídrico de concentración 2 molar que se usa. a) La ecuación química ajustada de la reacción que tiene lugar es: MnO2 + 4 HCl ĺ MnCl2 + Cl2 + 2 H2O Se verifica: n de MnO2 n de Cl 2 = 1 1 Para el Cl2 se cumple que: 720 mm atm · L · 100 L = n de Cl 2 · 0,082 · 288 K mm mol · K 760 atm de donde n de Cl2 = 4,0 mol. Por tanto: n de Cl2 = n de MnO2 = 4,0 mol b) En este caso: n de MnO2 n de HCl = n de HCl = 4 · 4,0 mol = 16,0 mol 1 4 16 19 Por tanto: C M = n 16,0 mol V = =8L mol V 2 L 18. Una muestra de 0,56 g está formada por bromuro de sodio y bromuro de potasio y se trata con una disolución acuosa de nitrato de plata. Suponiendo que todo el bromo presente en la muestra precipita en forma de bromuro de plata y se obtiene 0,97 g de este compuesto químico. a) Calcula la fracción molar del bromuro de potasio presente en la mezcla inicial. b) Halla el volumen de la disolución de nitrato de plata 1 M que se necesita para realizar dicha transformación. a) Las ecuaciones químicas ajustadas de las reacciones que tienen lugar son: NaBr + AgNO3 ĺ AgBr + NaNO3 KBr + AgNO3 ĺ AgBr + KNO3 Si se llama x a la masa en g que hay de NaBr en la muestra, entonces 0,56 g – x es la masa que existe de KBr en la misma. Sabiendo que la masa molar del AgBr es 187,8 g , entonces la cantidad, en mol, mol que se obtiene de AgBr es: n de AgBr = 0,97 g = 5,17 · 10 −3 mol g 187,8 mol En este caso: n de NaBr n de KBr n de AgBr + = 1 1 1 Como la masa molar del NaBr es 103 g g y la del KBr 119 , entonces: mol mol xg (0,56 − x ) g de NaBr de KBr g g 103 119 5,17 · 10 −3 mol de AgBr mol mol + = x = 0,36 g 1 1 1 Es decir la muestra inicial contiene 0,36 g de NaBr y 0,56 g – 0,36 g = 0,20 g de KBr 0,20 g g 119 mol = 0,32 De esta forma: x de KBr = 0,20 g 0,36 g + g g 119 103 mol mol b) En este caso: n de AgNO3 n de AgBr = n de AgNO3 = 5,17 · 10-3 mol 1 1 17 20 Como: C M = 5,17 · 10 −3 mol n V = = 5,17 · 10 −3 L = 5,17 mL mol V 1 L 19. Una muestra impura de óxido de hierro (III) sólido, reacciona con ácido clorhídrico comercial de 1,19 g/mL de densidad y 35 % de riqueza en masa. a) Escribe y ajusta la ecuación química de la reacción que se produce, si se obtiene cloruro de hierro (III) y agua. b) Calcula la pureza del óxido si 5,0 g de este compuesto reaccionan exactamente con 10 mL de ácido. c) Determina la masa de cloruro de hierro que se obtiene. a) La ecuación química de la reacción que tiene lugar es: a Fe2O3 + b HCl ĺ c FeCl3 + d H2O El ajuste consiste en determinar los coeficientes estequiométricos: a, b, c, d, aplicando balances de materia a cada elemento químico, resultando: Para el Fe: Para el O: Para el H: Para el Cl: 2a=c 3a=d b=2d b=3c Dado que los coeficientes estequiométricos muestran la proporción existente entre las diversas sustancias que intervienen en la reacción química, por simplicidad de cálculos se puede admitir que, por ejemplo: a = 1. Luego: c = 2 y de esta forma resulta que: d = 3, b = 6. Y por último: c = 2 Por tanto la ecuación química ajustada es: Fe2O3 + 6 HCl ĺ 2 FeCl3 + 3 H2O b) La cantidad, en mol, de HCl puros que hay en 10 mL de disolución de HCl se calcula de la siguiente forma: m de los 10 mL de disolución de HCl = 1,19 g · 10 mL = 11,9 g de disolución mL Como la disolución contiene 35 % en masa de ácido puro, la masa de HCl puro gastada en la reacción es: m puro de HCl = 11,9 g · 35 = 4,165 g 100 Como la masa molar del HCl es 36,5 n de HCl = g , entonces: mol 4,165 g = 0,114 mol g 36,5 mol De la estequiometría de la reacción se cumple que: n de Fe2O3 n de HCl 0,114 mol = n de Fe2O3 = = 0,019 mol 1 6 6 18 21 Como la masa molar del Fe2O3 es 159,6 g , entonces: mol m que reacciona de Fe2O3 = 0,019 mol · 159,6 g = 3,03 g mol Dado que se parte de 5,0 g de Fe2O3 entonces: pureza = 3,03 g · 100 = 60,6 % 5,0 g c) De la estequiometría de la reacción se cumple que: n de HCl n de FeCl 3 1 = n de FeCl3 = · 0,114 mol = 0,038 mol 6 2 3 Como la masa molar del FeCl3 es 162,3 g , entonces: mol m que se obtiene de FeCl3 = 0,038 mol · 162,3 g = 6,17 g mol 20. El ácido sulfúrico puede obtenerse por el siguiente proceso: ZnS + O2 + H2O ĺ ZnO + H2SO4 Si el rendimiento de la reacción es del 75 %, calcula: a) La cantidad de ZnS, en mol, necesaria para obtener 1 t de ácido. b) El volumen de aire consumido, medido a 20 °C y 1 atm de presión, para producir es a cantidad de ácido, sabiendo que el contenido en O2 del aire es del 20 % en volumen. a) La ecuación química ajustada es: ZnS + 2 O2 + H2O ĺ ZnO + H2SO4 Sabiendo que la masa molar del H2SO4 es 98 g y que 1 t = 106 g , entonces la mol cantidad, en mol, de H2SO4 que se debe obtener es: n de H 2 SO 4 = 10 6 g = 1,02 · 10 4 mol g 98 mol Si el rendimiento fuese del 100 %, por la estequiometría de la reacción: n de ZnS n de H 2 SO 4 = n de ZnS = 1,02 · 104 mol 1 1 Pero como el rendimiento de la reacción es del 75 %, entonces: n de ZnS = 1,02 · 10 4 mol · b) En este caso: 100 = 1,36 · 10 4 mol que hace falta 75 n de ZnS n de O 2 1,36 · 10 4 mol de ZnS n de O 2 = = 1 2 1 2 19 22 4 de donde n de O2 = 2,72 · 10 mol Suponiendo un comportamiento ideal para el oxigeno, entonces: 1 atm · V = 2,72 · 10 4 mol · 0,082 atm · L 3 3 · 293 K V = 653,5 · 10 L = 653,5 m de O2 mol · K Dado que el porcentaje del oxígeno en el aire es del 20 %, resulta: 3 V aire = 653,5 m de O2 · 100 m 3 de aire 3 20 m de O2 3 = 3267,5 m de aire 21. Se añade exceso de ácido clorhídrico sobre 75 g de cinc con un 7 % de impurezas inertes. a) ¿Qué volumen de hidrógeno, medido en las condiciones de 27 °C y presión de 740 mm de Hg se obtiene? b) ¿ Qué cantidad, en g, de cloruro de cinc se obtiene? a) La ecuación química ajustada de la reacción que tiene lugar es: 2 HCl + Zn ĺ ZnCl2 + H2 A continuación, se identifican los reactivos y los productos de la reacción química que describe el proceso: Ecuación química ajustada Cantidades que intervienen en la reacción Datos e incógnitas 2 HCl + Zn (s) (aq) n de HCl 2 ZnCl2 (aq) + H2 (g) n de Zn 1 n de ZnCl 2 1 n de H 2 1 75 g y 7 % impurezas ¿m de ZnCl2? ¿V a t = 27 ºC p = 740 mm? Se determina las masas molares de las sustancias que intervienen en el proceso a partir de la información que proporciona la tabla periódica, de forma que la del Zn es 65,4 g g y la del ZnCl2 136,4 . mol mol En este caso: n de Zn n de H 2 = 1 1 m , pero m es la masa de Zn que realmente M (100 − 7) reacciona, por tanto: m = 75 g · = 69,75 g de Zn que reaccionan realmente, 100 Igualmente se cumple que: n de Zn = luego: 69,75 g de Zn g 65,4 n de H 2 mol n de H2 = 1,07 mol = 1 1 20 23 y, además, se cumple para el gas H2 que: p · V = n · R · T luego: 740 mm atm · L · V = 1,07 mol · 0,082 · 300 K mm mol · K 760 atm b) Además se cumple: V = 26,95 L n de Zn n de ZnCl 2 = , luego: 1 1 69,75 g 69,75 g m de Zn de Zn de ZnCl 2 g g g m 65,4 65,4 136,4 de ZnCl 2 mol mol mol = M = 1 1 1 1 m de ZnCl2 = 145,47 g 22. Se dispone de 20 g de nitrato de plata que reaccionan con el gas cloro para originar óxido de nitrógeno (V), cloruro de plata y oxígeno. Cuando la reacción ha tenido lugar con una extensión del 30 %, calcula: a) La cantidad de óxido de nitrógeno obtenido, en mol. b) El volumen de oxígeno producido, medido en las condiciones de 20 °C y 620 mm de Hg. a) La ecuación química ajustada de la reacción que tiene lugar es: 2 AgNO3 + Cl2 ĺ N2O5 + 2 AgCl + ½ O 2 De esta forma: Reacción química 2 AgNO3 + Cl2 → N2O5 + 2 AgCl + ½ O 2 Relación estequiométrica 2 mol 1 mol 1 mol 2 mol ½ mol Estado inicial (en mol) a b 0 0 0 a – 2x b–x x 2x ½x 2xmáx ½ xmáx Avance (en mol) Avance mol) máximo x (en xmáx = 0,059 0 b - xmáx xmáx Sabiendo que la masa molar de AgNO3 es 169,9 g , entonces la cantidad inicial en mol mol de AgNO3 que hay es: a= m = M 20 g 169,9 g mol = 0,118 mol Suponiendo que las condiciones de la extensión de la reacción fuesen del 100 % se consumiría todo el nitrato de plata y en este caso: 21 24 0,118 - 2xmáx = 0 xmáx = 0,059 mol Por tanto: 30 = x · 100 x = 0,035 mol, luego: 0,118 mol n de N2O5 = x = 0,035 mol b) n de O2 = ½ x = ½ · 0,035 mol = 0,018 mol Luego: atm · L 620 mm · 293 K V = 0,53 L · V = 0,018 mol · 0,082 mm mol · K 760 atm 23. Una mezcla de propano y butano de 100 cm3 se quema en presencia de suficiente cantidad de oxígeno, obteniéndose 380 cm3 de dióxido de carbono y se considera que los volúmenes de todos los gases se han medido en las mismas condiciones de presión y temperatura. Calcula: a) El % en volumen de propano y butano en la mezcla inicial. b) El volumen de oxígeno necesario para efectuar la combustión. a) Las reacciones de combustión completas del propano y del butano vienen descritas por las siguientes ecuaciones químicas ajustadas: C3H8 + 5 O2 ĺ 3 CO2 + 4 H2O C4H10 + 13/2 O2 ĺ 4 CO2 + 5 H2O Como todas las especies químicas que intervienen son gases y están en las mismas condiciones de presión y temperatura, las cantidades estequométricas se pueden referir también a los volúmenes de los mismos, por lo que: 3 Si llamamos x al volumen inicial de propano en cm , entonces 100 – x es el volumen del butano que hay en la mezcla inicial. Por tanto: V de propano V de CO2 = V de CO2 originado por el propano= 3 x en cm3 1 3 V de bu tan o V de CO2 = V de CO2 originado por el butano= 4 (100 – x) en cm3 1 4 El volumen total obtenido de CO2 es 380 cm3, luego: 3 x cm3 + 4 (100 – x) cm3 = 380 cm3 x = 20 cm3. Es decir la mezcla contiene 20 cm3 de propano y 80 cm3 de butano. El % en volumen es: 20 cm 3 100 cm 3 80 cm 3 100 cm 3 · 100 = 20 % de propano · 100 = 80 % de butano b) Según la estequiometria de las reacciones: 22 25 V de propano V de O2 3 V de O2 que reacciona con el propano= 5 · 20 cm = 1 5 V de bu tan o V de O2 13 3 = V de O2 que reacciona con el butano= · 80 cm 1 13 / 2 2 Luego el V de O2 necesario es: 5 · 20 cm3 + 13 · 80 cm3 = 620 cm3 2 INVESTIGA 1. Pon un título alternativo a la lectura anterior y explica el significado de los términos: fertilizante, genoma humano, Biología molecular e impacto ambiental. Se pueden poner varios títulos alternativos semejantes tales como los beneficios de la Química para la humanidad, la Química en el avance del conocimiento científico y sus beneficios para la sociedad, el uso positivo de la Química, etc. Fertilizante: Es una sustancia o mezcla de diversas sustancias, de origen natural o sintético, que se utiliza para enriquecer el suelo y favorecer el crecimiento vegetal. Las plantas no necesitan compuestos complejos, del tipo de las vitaminas o los aminoácidos esenciales en la nutrición humana, pues sintetizan todos los que precisan. Sólo exigen una docena de elementos químicos, que deben presentarse en una forma que la planta pueda absorber. Dentro de esta limitación, el nitrógeno, por ejemplo, puede administrarse con igual eficacia en forma de urea, nitratos, compuestos de amonio o amoníaco puro. Genoma humano: Es el genoma del Homo sapiens y está formado por 24 secuencias cromosómicas distintas (22 autosomas + 2 cromosomas sexuales: X e Y) con un tamaño total aproximado de 3200 millones de pares de bases de ADN (3200 Mb) que contienen unos 20.000 -25.000 genes. De las 3200 Mb unas 2950 Mb corresponden a eucromatina y unas 250 Mb a heterocromatina. El Proyecto Genoma Humano produjo una secuencia de referencia del genoma humano eucromático, usado en todo el mundo en las ciencias biomédicas. La secuencia de ADN que conforma el genoma humano contiene codificada la información necesaria para la expresión, altamente coordinada y adaptable al ambiente, del proteoma humano, es decir, del conjunto de proteínas del ser humano. Las proteínas, y no el ADN, son las principales biomoléculas efectoras; poseen funciones estructurales, enzimáticas, metabólicas, reguladoras, señalizadoras..., organizándose en enormes redes funcionales de interacciones. En definitiva, el proteoma fundamenta la particular morfología y funcionalidad de cada célula. Asimismo, la organización estructural y funcional de las distintas células conforma cada tejido y cada órgano, y, finalmente, el organismo vivo en su conjunto. Así, el genoma humano contiene la información necesaria para el desarrollo básico de un ser humano completo. Biología molecular: Es el estudio de la vida a un nivel molecular. Esta área esta relacionada con otros campos de la Biología y de la Química, particularmente Genética y Bioquímica. La Biología molecular concierne principalmente al entendimiento de las interacciones de los diferentes sistemas de la célula, lo que 23 26








