FÍSICO - QUÍMICA: 2do año
Anuncio

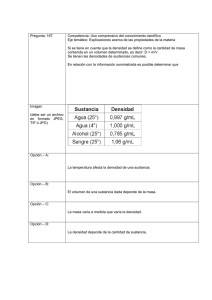
FÍSICO - QUÍMICA: 2do año TEÓRICO 2: EL CALOR Y ENERGÍA. La idea de que el calor está relacionado con la energía fue investigada por varios científicos en el siglo XIX, particularmente por un cervecero inglés James P. Joule (1818 – 1889), este efectuó vatios experimentos que fueron cruciales para establecer nuestra concepción actual de que el calor, como el trabajo, representa una transferencia de energía y además determinó que una cantidad dada de trabajo hecho es siempre equivalente a una cantidad de particular de calor de entrada. Cuantitativamente se encontró que 4.186 joules (J) de trabajo son equivalentes a 1 caloría (cal) de calor. Esto se conoce como el equivalente mecánico del calor: Por estos experimentos y otros, los científicos interpretaron que el calor es la energía transferida debido a una , es decir, cuando fluye calor de un objeto caliente a otro más frío, es energía lo que se está transfiriendo del objeto caliente al frío. Así entonces, el calor es energía que se está transfiriendo de un cuerpo a otro debido a una diferencia de temperatura. La cantidad de calor se define de acuerdo al calor necesario para producir algún cambio en alguna sustancia elegida como patrón (el agua). Se demuestra que la cantidad de calor de un cuerpo es función de la masa del cuerpo y de su temperatura, o lo que es lo mismo, del número de moléculas que lo componen y de su nivel de intensidad térmica o velocidad molecular. Para determinar la cantidad de calor se ha establecido un valor característico, que depende de las particularidades de cada cuerpo, que se denomina calor específico. Se define como calor específico a la cantidad de calor necesario para elevar en 1 la temperatura de la unidad de masa de una sustancia. El calor específico, si bien depende de la temperatura en forma muy leve, puede suponerse constante para cada sustancia en particular, a los fines de su aplicación práctica. Como unidad se usa el agua a presión atmosférica normal, considerándose una temperatura normal de 15 que está dentro del entorno de las aplicaciones prácticas. De esa manera, el calor específico igual a 1, sería la cantidad de calor necesaria para elevar la temperatura de 1 de agua en 1 (14,5 a 15,5) a presión atmosférica normal. A esta cantidad de calor se la denomina (kcal) kilocaloría, y sería entonces la unidad de cantidad de calor. Para ello, la unidad de calor específico valdrá: Calor sensible y calor latente Cuando definimos la unidad de calor, mencionamos que el agregado de dicha energía provocaba un aumento de la temperatura, sin alterar el estado de agregación de la materia, a ese estado calórico cuya variación de nivel puede determinarse mediante un termómetro, que es sensible a ella, se denomina calor sensible. Se representa por la fórmula: es la cantidad de calor entregada o recibida por un cuerpo (Kcal) es la masa del cuerpo (Kg) es el calor específico de la sustancia (Kcal/Kg.°C) 1 es la temperatura inicial del cuerpo (°C) es la temperatura final del cuerpo (°C) Ejemplo 1: Calentar 1 kg de agua de 10 a 100 agregado? . ¿Qué cantidad de calor sensible se le ha Sin embargo, sucede que cuando se está materializando un cambio de estado físico, se verifica que el agregado o sustracción de calor no origina variación de temperatura. En efecto, por ejemplo, si se tiene agua en ebullición, durante todo el proceso que esta dura, la temperatura se mantiene constante en los 100 , aunque se le agregue calor continuamente. A ese calor que agregado a una sustancia no origina cambio de nivel térmico o temperatura, se lo denomina calor latente, o sea, como su nombre lo indica, ese calor se encuentra latente, y se consume en la acción de transformación física. es el calor latente del proceso y sustancia particular es la masa del cuerpo (Kg) El calor requerido para cambiar una sustancia de la fase líquida a la de vapor se llama calor de vaporización. El calor de vaporización del agua . El calor requerido para cambiar una sustancia del estado sólida al líquido se llama calor de fusión. El calor de fusión del agua . Curva de calentamiento 2