Capítulo TEP
Anuncio
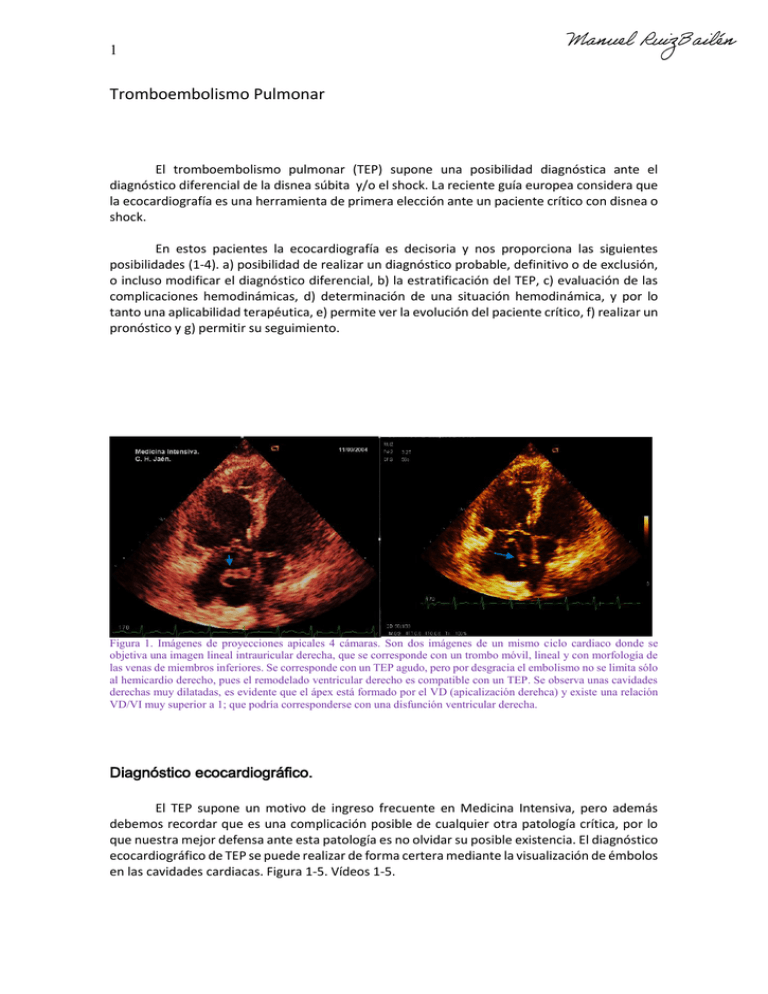
1 Tromboembolismo Pulmonar El tromboembolismo pulmonar (TEP) supone una posibilidad diagnóstica ante el diagnóstico diferencial de la disnea súbita y/o el shock. La reciente guía europea considera que la ecocardiografía es una herramienta de primera elección ante un paciente crítico con disnea o shock. En estos pacientes la ecocardiografía es decisoria y nos proporciona las siguientes posibilidades (1-4). a) posibilidad de realizar un diagnóstico probable, definitivo o de exclusión, o incluso modificar el diagnóstico diferencial, b) la estratificación del TEP, c) evaluación de las complicaciones hemodinámicas, d) determinación de una situación hemodinámica, y por lo tanto una aplicabilidad terapéutica, e) permite ver la evolución del paciente crítico, f) realizar un pronóstico y g) permitir su seguimiento. Figura 1. Imágenes de proyecciones apicales 4 cámaras. Son dos imágenes de un mismo ciclo cardiaco donde se objetiva una imagen lineal intrauricular derecha, que se corresponde con un trombo móvil, lineal y con morfología de las venas de miembros inferiores. Se corresponde con un TEP agudo, pero por desgracia el embolismo no se limita sólo al hemicardio derecho, pues el remodelado ventricular derecho es compatible con un TEP. Se observa unas cavidades derechas muy dilatadas, es evidente que el ápex está formado por el VD (apicalización derehca) y existe una relación VD/VI muy superior a 1; que podría corresponderse con una disfunción ventricular derecha. Diagnóstico ecocardiográfico. El TEP supone un motivo de ingreso frecuente en Medicina Intensiva, pero además debemos recordar que es una complicación posible de cualquier otra patología crítica, por lo que nuestra mejor defensa ante esta patología es no olvidar su posible existencia. El diagnóstico ecocardiográfico de TEP se puede realizar de forma certera mediante la visualización de émbolos en las cavidades cardiacas. Figura 1-5. Vídeos 1-5. 2 Figura 2. Imágenes de proyecciones bicava modificada, donde se obserba trombo lineal en aurícula derecha. Las flechas señalan el trombo. En la segunda imagen se observa un catéter de embolectomía (flecha verde). Figura 3. Imágenes de proyecciones bicava modificada, donde se observa trombo lineal en aurícula derecha. En la primera imagen se observa un gran trombo en vena cava superior. Si bien en los enfermos estables la presencia de trombos es casi indetectable, su visualización en áreas de medicina intensiva suelen ser frecuente, pudiéndose objetivarse en el 18% (5). Sin embargo realizar el diagnóstico de certeza mediante ecocardiografía no es siempre posible siendo lo habitual la visualización de signos indirectos y por lo tanto establecer un diagnóstico sugerente de TEP. No obstante este diagnóstico sugerente ya es supone “un gran paso”, pues ante la existencia de un paciente en shock con signos de sobrecarga de presión derecha nos capacita a la reperfusión inmediata, aunque no se pueda realizar un TAC. Figura 4. Imágenes de proyecciones subxifoidea de grandes vasos. En la vena cava se observa trombo móvil, de igual modo se observan trombos en arteria pulmonar. Figura 5. Imágenes de proyecciones ETE de grandes vasos, donde se puede visualizar trombo en arteria pulmonar derecha. Las dos últimas son imágenes ETE 3D, donde se observa el trombo intravascular. Los hallazgos ecocardiográficos más habituales en un tromboembolismo pulmonar son los siguientes. El hallazgo más típico es la dilatación de las cavidades derechas secundaria a sobrecarga de presión, aunque esta dilatación no es patognomónica de TEP, pues suele verse en remodelados de pacientes con infarto ventricular, sobrecarga aguda de volumen, o patología respiratoria aguda como un síndrome de distrés respiratorio agudo (SDRA), o crónica (6,7). La ausencia de dilatación ventricular no descarta la existencia de TEP, aunque sí que minimiza su riesgo, siendo además este hallazgo es muy sugerente de buen pronóstico y corroborándose baja obstrucción vascular (6,7) El ventrículo derecho suele hacer un remodelado con dilatación global, disfunción global y segmentaria. Figura 6-10. Figura 6-10. 3 Figura 5. Imágenes de proyecciones ETE de grandes vasos, donde se puede visualizar trombo en arteria pulmonar derecha. Las dos últimas son imágenes ETE 3D, donde se observa el trombo intravascular. Figura 6. Imágenes de proyecciones apical 4 cámaras de 3 TEP distintos. En la primera imagen se aprecia una clara dilatación del ventrículo derecho, siendo mayor que el izquierdo. Las otras dos imágenes parecen ser de diámetros normales, hasta que se realizan mediciones. No obstantes las dos últimas imágenes muestran dilatación ligera ventricular derecha no severa, siendo muy poco probable que el TEP de esos pacientes sea de alto riesgo. Típicamente se produce una dilatación del tracto de salida proximal y distal (visualizables en paraesternal eje largo, eje corto de grandes vasos), dilatación basal, media e incluso apical (eje apical 4 cámaras, 4 cámaras modificado, 2 cámaras, paraesternal de ventrículo derecho). Esa dilatación puede modificar el eje cardiaco de tal modo que el ápex cardiaco se corresponda al ventrículo derecho (apicalización derecha). En el TEP la relación entre el diámetro telediastólico ventricular derecho y el telediastólico ventricular izquierdo suele ser superior a 0,6 y también la relación “área telediastólica ventricular derecha / área telediastólica ventricular izquierda” suele exceder el límite superior de lo normal (0,6); habiéndose llegado a sugerir que una relación mayor o igual de 0,9 ó 1, evaluada mediante ecocardiografía o TAC, podría ser diagnóstica de disfunción ventricular derecha (8-10). No obstante, debemos recordar que ello podría ser válido para un TEP agudo, pero no para pacientes con remodelado crónico. Figura 7. Imágenes de proyecciones apical 4 cámaras y paraesternales eje largo, donde se objetiva mayor diámetro de cavidades derechas. Ante un TEP agudo, es muy probable la existencia de disfunción ventricular derecha. Probablemente se debería hacer un estudio concienzudo de la función ventricular. La última imagen muestra mediciones del TSVD y del VI. 4 Figura 8. Imágenes de proyecciones apical 4 cámaras donde se objetiva mayor diámetro de cavidades derechas, modificación septal, disminución de las cavidades izquierdas; o sea el remodelado típico de TEP. AD AD AD Figura 9. Imágenes de proyecciones apical 4 cámaras y TAC con contraste. En todas se observa el remodelado típico de un TEP severo, tratándose de tres pacientes con TEP de alto riesgo. En el primero se trata de una imagen con análisis “off-line” mediante Speckle Tracking. En la imagen central, correspondiente a TAC con contraste, se observa el mismo remodelado que aparece en las imágenes ecocardiográficas. En las tres imágenes se observa dilatación severa de cavidades derechas con disminución de las cavidades izquierdas. Movimiento “paradójico septal” (flecha azul). La flecha verde señala el ventrículo izquierdo. La flecha roja señala la aurícula izquierda. Además de la dilatación ventricular derecha, el TEP, mediante el incremento de la postcarga, genera una remodelación aguda con alteración severa de la geometría ventricular derecha, forjando cambios espaciales de las distintas fibras miocárdicas y en los distintos segmentos; ello se traduce en alteraciones segmentarias de la contractilidad, de su motricidad, de la sincronía intraventricular e interventricular, de sus desplazamientos, de sus velocidades y de sus deformidades. Esa alteración de la geometría no se limita a las cavidades derechas, sino que podría afectar al lado izquierdo, más allá del fenómeno de interdependencia interventricular; pudiendo generar insuficiencias valvulares funcionales e incluso alteraciones de la función diastólica. El ventrículo derecho puede presentar tras el TEP una disfunción sistólica global y segmentaria, variable que conlleva implicaciones pronósticas(11-21), y que podría correlacionarse con el grado de embolismo pulmonar (22). Esta dilatación ventricular aguda suele ir acompañada de disfunción ventricular, la cual representa un criterio de mal pronóstico, y suele considerarse ante una relación VD/VI ≥ de 0,9 - 1, evaluada mediante ecocardiografía o TAC (8,9). En general se estima que la disfunción ventricular derecha se produce, al menos, en el 30% de los pacientes con TEP, no obstante es importante evaluar el grado de dicha disfunción. Lo más típico es encontrar una hipoquinesia de la pared libre (segmento lateral) del VD que se observa en el 90 % de los pacientes cuando el embolismo pulmonar afecta al tercio de la circulación pulmonar. Esta podría ser la razón por la que TEP menores pudieran no dar semiología ecocardiográfica, y que al mismo tiempo estratificarían al paciente para un riesgo bajo. 5 La relación VD/VI es una de las formas más utilizadas para evaluar la disfunción ventricular derecha. Sin embargo esta relación podría verse muy afectada por cambios en la carga. El desplazamiento del plano anular tricuspídeo “Tricuspid Annular Plane Systolic Excursion” (TAPSE) ha sido propuesto como un método muy sensible para detectar una disfunción miocárdica, observándose que valores ≤15 mm son muy específicos para detectar disfunción ventricular derecha, mientras valores ≥ 20 mm, excluyen la disfunción ventricular derecha (23,24). El problema de esta medida es que se limita al segmento lateroinferior, pudiendo infravalorar los cambios en el resto de segmentos y en especial en el tracto de salida ventricular derecho. A pesar de ello el TAPSE se considera una medida de primera elección para evaluar la disfunción ventricular por TEP, teniendo valor pronóstico, pudiendo incluso correlacionarse con el BNP (25). Figura 10. Imágenes de proyecciones apical donde se observa el TAPSE. Su medición requiere un mínimo entrenamiento, siendo bastante reproducible. Habitualmente se realiza trazando modo M sobre el anillo tricúspide lateral, de forma que esté lo más perpendicular posible. Mediande colorización tisular se puede mejorar de forma notable la visión de la curva de desplazamiento del anillo tricuspídeo. Realmente el TAPSE es el desplazamiento sistólico de las fibras longitudinales basales. El doppler tisular tiene un gran valor en el ventrículo derecho, pudiendo detectar disfunción sistólica y diastólica ante patología derecha de etiología diversa. De igual modo en el TEP su uso ofrece una gran información, diagnóstica y pronóstica. Su estudio nos aporta información sistólica y diastólica. Se aceptan que velocidades de la onda “s” inferiores a 10 cm/s; son muy sugerentes de disfunción ventricular derecha (26). Figuras 11-13. El problema de la velocidad sistólica u onda “s” es la dependencia de la precarga. No obstante valores muy inferiores a 9 cm/s sugieren una disfunción sistólica ventricular derecha severa. El índice de aceleración del tiempo de contracción isovolumétrica (IVA) es precarga independiente (o menos carga dependiente) y se muestra muy eficaz en detectar disfunción ventricular derecha, y valores inferiores a 2 (m/s2), son muy sugerentes de disfunción ventricular derecha (26-28). Figuras 14 y 15. 6 TCIV S S E A Figura 11. Imagen de doppler tisular sobre el anillo tricuspídeo. Es recomendable realizarlo lo más perpendicular posible, pues una de las limitaciones sabidas del doppler tisular es “depender del ángulo”. Este paciente con TEP tiene una velocidad sistólica de 19,3 cm/s; lo que descarta la disfunción sistólica ventricular derecha. TCIV: Tiempo de contracción isovolumétrica. S: Onda sistólica (pico sistólico). E: Velocidad onda E. A: Velocidad onda A. Figura 12. Se muestran 4 imágenes de doppler tisular sobre el anillo tricúspide. Las 4 se corresponden a TEP agudos. La primera imagen presenta buenas velocidades sistólicas y diastólicas. La segunda y tercera imágenes mantienen una buena velocidad sistólica (onda S), pero su velocidad E’ está reducida considerablemente. La cuarta imagen muestra una velocidad sistólica en torno a 10 cm/s y una velocidad E` muy baja, no pudiéndose descartar la existencia de un TEP que genere restricción derecha y por lo tanto de muy mal pronóstico. 7 TCIV S TRIV T E´ A´ Figura 13. Imagen de doppler tisular. El punto amarillo señala el pico de velocidad del TCIV, el IVA sería la resultante entre la división de la velocidad máxima del TCIV por el tiempo que tarda en alcanzarlo (T). Esta imagen muestra además una disminución de la onda E’, que nos debería hacer sospechar una disfunción diastólica derecha severa. Figura 14. Imagen de doppler tisular. El triángulo amarillo muestra parte del espectro de la onda del TCIV, la base roja reflejaría el tiempo para alcanzar el pico de velocidad o T. En este caso la velocidad sería de 0,157 m/s, y el T es de 40 ms, por lo tanto el IVA sería: 𝐼𝑉𝐴 = 0,157 = 3,925 𝑚/𝑠2 0,04 8 Figura 15. Cálculos de la función sistólica mediante métodos volumétricos, y de igual modo se podrían realizar mediante áreas. La primera imagen se corresponde a un TEP, tras 24 horas de ser realizada trombolisis sistémica. La siguiente imagen es un paciente con hipertensión pulmonar crónica. Figura 16. Cálculos de la función sistólica mediante el método del “área de acortamiento fraccional” (FAC), La primera imagen se corresponde a un TEP evolucionado, con buen remodelado cardiaco, y el segundo con un TEP agudo. Figura 17. Cálculos de la función sistólica mediante el método del “área de acortamiento fraccional” (FAC), La primera imagen se corresponde a un TEP agudo, y el segundo tras un año, en el que existe una hipertensión pulmonar crónica. Otras medidas como la Dp/Dt, el índice TEI, métodos volumétricos o las áreas de acortamiento fraccional, etc; que resultan válidas para evaluar la disfunción ventricular derecha, también son aplicables en el TEP (4). Estas medidas suelen realizarse en la proyección apical 4 cámaras, sin embargo el ventrículo derecho cambia radicalmente su geometría, por lo que zonas menos evaluadas como el tracto de salida ventricular derecho podrían verse muy afectadas, aunque pudieran reflejar mejor la disfunción ventricular derecha. Por ello la evaluación de la fracción de acortamiento del tracto de salida ventricular derecha tiene aquí especial interés en el TEP y ante un valor menor al 30% estaríamos ante una disfunción ventricular derecha severa 9 (29). La relativa rápida incorporación de la imagen cardiaca 3D y del Speckle Tracking, además de darnos información anatómica, funcional (sistólica y diastólica), y pronóstica(30); así el grupo de Jenab observó que los pacientes que requirieron trombolisis presentaban un strain global ventricular derecho menor a (-10), subiendo a (-19) tras la trombolisis (30). Desgraciadamente aún no existe ningún punto de corte en ninguno de estos valores que nos asegure por sí sólo, la necesidad de trombolisis. Figura 14 – 18. Figura 18. Estudio mediante Speckle Tracking. La imagen a y b se corresponde con las velocidades de las fibras longitudinales longitudinales y radiales, respectivamente. En ambas se evidencia una disminución de dichas velocidades. En las imágenes c,d,e y f, se muestran el strain, strain rate, deformidad longitudinal y deformidad radial. En todas ellas se muestra disminución severa de los valores normales. Además se puede objetivar que el ventrículo derecho muestra una asincronía manifiesta, al haber un retraso en las distintas velocidades pico, del strain, del strain rate y del desplazamiento. Entre los trastornos segmentarios de la contractilidad destaca el signo de McConnell, que se caracteriza por una contractilidad mantenida del segmento apical ventricular derecho, que se hace más evidente, ante la disfunción existente en los segmentos medio y basal laterales. Presenta una sensibilidad 77 %, una especificidad 94 %, un valor predictor positivo del 71% y un valor predictor negativo del 96 %. (11,12). Figuras 19-22. Recientemente mediante Strain y Strain rate se ha podido comprobar que la deformidad en el segmento apical derecho se mantiene, a pesar de un claro deteríoro de los demás segmentos que pueden ser reversibles tras el tratamiento trombolítico o mediante embolectomía. De igual modo la velocidad de la excursión de las fibras longitudinales, y su desplazamiento disminuye marcadamente cuando se mide el tercio medio de la pared libre VD, sin embargo la excursión mejora progresivamente cuando se miden los segmentos próximos al ápex ventricular derecho (13-18). De igual modo la asincronía generada en el ventrículo derecho parece ser menor en la zona apical (17), efecto que podría contribuir a dicho signo. 10 Actualmente sigue sin ser explicada la fisiopatología de este signo, existiendo varias teorías, entre las que destacan: a) Isquemia localizada ventricular derecha; la zona apical suele ser irrigada por la arteria descendente anterior, pero el resto de la cara lateral ventricular derecha suele ser irrigada por la arteria coronaria derecha y circunfleja; habiéndose descrito mediante modelos experimentales caninos que ante un TEP se produce isquemia de la arteria coronaria derecha (17). b) la adherencia del ápex ventricular derecho al ápex ventricular izquierdo, en el que pudiera existir un movimiento translacional, c) una disminución del estrés parietal del ápex derecho con respecto al de la cara lateral, d) alteraciones de la geometría de la cara lateral inducida por el incremento rápido de la postcarga. En cualquier caso, esta característica disfunción regional ventricular derecha parece ser altamente específica para el TEP agudo, por lo podría ser un test de screening útil para ayudar a distinguir entre TEP e hipertensión pulmonar crónica, u otras causas de dilatación y disfunción ventricular derecho donde la hipoquinesia de los segmentos derechos no respeta a los segmentos apicales. Figura 19. Imagen ecocardiográfica apical 4 cámaras. La flecha señala la zona apical. El signo de MacConell se caracteriza por un “adecuado movimiento” de dicho segmento, con hipoquinesia o aquinesia del resto de segmentos. La siguiente imagen representa un aumento del recuadro amarillo en diástole, y la última imagen en sístole, entre ambas imágenes se observa una clara movilización de dicho segmento. Figura 20. Imagen ecocardiográfica apical 4 cámaras mediante “Speckle Tracking”, de dos pacientes con TEP. En el modelo de 6 segmentos el Speckle Tracking demuestra incremento de la contractilidad de los segmentos apicales. La dilatación ventricular es el resultado de una alteración severa y aguda de la geometría ventricular derecha, que se continúa con una dilatación del anillo tricúspide, generando tracción de las cuerdas tendinosas y modificación del anillo tricúspideo; con aparición de insuficiencia tricúspide, cuyo grado se correlaciona con la motilidad de los músculos papilares, con el área telediastólica del VD y con la presión arterial pulmonar (18). Sin embargo se debe tener en cuenta que el grado de IT podría alterar los valores de gradiente auriculoventricular, de tal modo 11 que ante una IT severa se tiende a supraestimar la presión arterial pulmonar sistólica (18,19). Otro hallazgo de interés es la posible dilatación del seno coronario (Figura ), habiéndose mostrado mediante TAC que un punto de corte de 12,5 mm se correlaciona con disfunción ventricular derecha (20). El diámetro del seno coronario ha sido correlacionado con el tamaño de la aurícula derecha (r = 0,60; p <0,001) y con la presión de la arteria pulmonar sistólica (r = 0,59; p <0,001)(21). Figura 21. Imagen ecocardiográfica apical 4 cámaras donde se observa un corazón normal, con un diámetro de seno coronario de unos 7 mm. La segunda imagen muestra un seno conario discretamente dilatado. La tercera imagen se corresponde con un TAC donde se observa un seno coronario de unos 13 mm. Otro hallazgo bastante frecuente y que debemos explorar es la posible aparición de un aneurisma interauricular “abombado” y desplazado hacia la aurícula izquierda, con una posible apertura del foramen oval, que pudiera condicionar un shunt derecha izquierda que pudiera participar en la hipoxemia refractaria. Sin embargo el único tratamiento posible frente a esta complicación sería la disminución de la presión intrauricular derecha (fundamentalmente mediante la trombolisis o la embolectomía) (32). Además del shunt intracardiaco, el foramen oval permeable también podría generar embolismos paradójicos, al cruzar los trombos el septo interauricular; pues un foramen oval permeable mayor de 4 mm aumenta el riesgo de eventos embólicos cerebrovasculares y tromboembólicas arteriales (32,33). Además se asocia su presencia a un mal pronóstico, pues podría aumentar 10 veces el riesgo de muerte y 5 veces el riego de eventos adversos mayores. Por lo tanto en pacientes con TEP y dilatación auricular derecha debería evaluarse la presencia de un foramen oval permeable mediante doppler color y solución salina agitada. 12 AI AI FOP FOP AD VD VD VI Figura 22. Imagen de ETE donde se observa septo interauricular abombado y desplazado hacia la izquierda con foramen oval permeable (flecha amarilla) y en la segunda insuficiencia tricúspide (flecha roja). En la imágenes inferiores se observa un trombo que se exitiende desde el ventrículo derecho hasta la aurícula izquierda, atravesando el foramen oval (flecha blanca) última imagen se observa un trombo que pasa, a través del trombo interauricular, desde la aurícula derecha hacia la aurícula izquierda. Durante el TEP, la aurícula derecha sufre una dilatación drástica, con una caída en su fracción de eyección y con alteración en su fisiología. Habitualmente la vena cava inferior suele estar dilatada sin cambios respirofásicos. Inicialmente existe una sobrecarga de presión, pero ante el mantenimiento de la postcarga se produce una sobrecarga de volumen, que viene agravada por el desarrollo de una insuficiencia tricúspide. Figuras 22-24. Figura 23. Imágenes de un ciclo cardiaco de una proyección apical 4 cámaras de un TEP, iniciándose la secuencia en telediastóle y acabando en mesodiástole. Durante dicho ciclo cardiaco se puede observar los cambios que realiza el tabique interventricular e incluso el intraauricular. En la imagen tercera se puede observar que el septo interventricular se mantiene abombado en sístole, debido a la sobrecarga de presión. El TEP además podría llevar acompañado una alteración de la distensibilidad, evidenciable por la existencia de disfunción diastólica. Obviamente la alteración de la detorsión apical, la modificación de las fibras longitudinales, radiales y circunferenciales van a modificar la distensibilidad, con notables implicaciones pronósticas y potencialmente terapéuticas (33). 13 Figura 24. Imágenes de un ciclo cardiaco de una proyección subcostal 4 cámaras de un paciente con sobrecarga de volumen por una comunicación interventricular apical. El septo se aplana hasta telediástole pero en sístole recupera su posición. Habitualmente el ventrículo derecho presenta una relación E/E’ entre 1 a 3. La presencia de una relación E/E’ derecha ≥6 se correlaciona con mal pronóstico. De igual modo el flujo de llenado sistólico auricular derecho normal, medido en la vena hepática (en especial en la derecha), suele ser predominantemente sistólico, con una relación sistólico/diastólico > 50% (fracción de llenado sistólico auricular). Ante una insuficiencia tricúspide severa podríamos encontrarnos inversión de flujo sistólico en la vena cava y en las venas hepáticas. Cuando esta fracción de llenado sistólico de venas hepáticas se invierte (se hace de predominio diastólico) estaremos ante una disfunción diastólica ventricular derecha. Ante la presencia de una relación E/E’ derecha ≥6 y una FLS <30; estaremos ante una disfunción diastólica ventricular derecha “restrictiva”, lo cual supone un marcador de muy mal pronóstico (3,40). Figura 25. Imágenes en telediástole y en telesístole de una proyección eje corto. Se observa aplanamiento septal sistólico. Se ve imagen en “D” en sístole. A pesar que el TEP representa un duro golpe al ventrículo derecho debido a una gran sobrecarga de volumen, también se produce un cambio agudo de la geometría ventricular y auricular izquierda; por lo tanto todo ello se genera cierta disfunción ventricular izquierda. En principio aparece un ventrículo izquierdo con un área habitualmente reducido, con un septo interventricular que presenta un movimiento paradójico, que condicionaría una desviación del septo hacia el ventrículo izquierdo (Figura 25), mostrando en el eje corto una imagen en “D”, manteniendo el aplanamiento septal durante la sístole(). Ese remodelado ventricular agudo modificaría la esfericidad ventricular izquierda, por lo que la evaluación de la función sistólica mediante la cuantificación de la fracción de eyección mediante el método de discos o área-longitud no son adecuados, soliendo infravalorar dicha función contráctil. Mediante Strain y Strain rate se ha detectado la presencia de disfunción izquierda, explicable por las alteraciones geométricas sufridas, que mejoran tras la lisis del trombo. Además se modificaría la situación geométrica de los músculos papilares, con tracción 14 y tenting mitral, modificación del anillo mitral; situaciones que podrían producir una insuficiencia mitral funcional. Además una hipercontractilidad de segmento basales y la modificación del anillo mitral podrían modificar el tracto de salida ventricular izquierdo induciendo un gradiente dinámico.El trastorno de motilidad segmentario más típico es el movimiento septal paradójico que se manifiesta como una “agitación" dinámica, con disminución de la curvatura local del tabique, con una menor correlación positiva entre el movimiento de la pared libre del VD y el movimiento del tabique, con una menor tasa de cambio de área fraccional RV; y con una disminución de la estabilidad, particularmente en el centro del tabique, pudiendo generar un llenado biventricular competitivo. Figura 26. Flujo transmitral. La primera imagen muestra un patrón de alteración de la relajación, con velocidad de la onda E baja, sugestivo de bajas presiones telediastólicas izquierdas. Sin embargo en las otras dos imágenes aparecen flujos transmitrales que reflejan presiones telediastólicas izquierdas muy elevadas. La segunda imagen muestra alternancia entre un patrón de alteración de la relajación con presiones telediastólicas elevadas y el tercero de un patrón restrictivo. La función diastólica ventricular izquierda, en principio, no debería estar alterada, soliendo encontrar estimaciones de las presiones telediastólicas ventriculares izquierdas bajas. Mediante doppler pulsado, el flujo diastólico mitral muestra aumento de la onda A, con disminución de la relación E/A, y con una probable contribución incrementada de la contracción auricular al llenado VI. Cho detectó que existe disfunción diastólica en el 21,5% de los pacientes con TEP, presentando una OR para el resultado de muerte de 2,7. No obstante un remodelado patológico podría generar una disfunción diastólica que podría inducir un pronóstico infausto (43).En esta línea nuestro grupo ha demostrado que la existencia de un patrón pseudonormal o restrictivo izquierdo en el seno de un TEP conlleva una mortalidad del 100%. Figura 26. Hemodinámica derecha La arteria pulmonar suele dilatarse, soliendo evidenciarse con facilidad su división y ambas arterias pulmonares. Mediante ecocardiografía transtorácica y ETE podemos ver la presencia de émbolos en más de un 20% de los TEP. Ante ventanas sónicas inadecuadas el uso de contraste nos puede facilitar su visualización. Un hallazgo, afortunadamente infrecuente, puede ser la disección de la arteria pulmonar, ya sea como consecuencia de un TEP o causante de un TEP. Figura 27. Figura 27. Diámetro de arteria pulmonar en 2 y 3D 15 Es obligado intentar estimar mediante ecocardiografía la presión arterial pulmonar. La presión arterial pulmonar sistólica (PAP s) se suele estimar basándose en la velocidad pico de la insuficiencia tricúspide y la presión arterial pulmonar sistólica diastólica (PAP d) se estima a través de la velocidad pico telediastólica de la insuficiencia pulmonar. La presión de arteria pulmonar media (PAP m) suele estimarse de varias formas. La estimación de las distintas presiones debe realizarse con cautela, pues al basarse en velocidades picos, podrían ser infravalorada (al no visualizar de forma adecuada el doppler espectral), e incluso magnificarla, en especial mediante ante la existencia de una insuficiencia tricúspide severa. La velocidad máxima de la insuficiencia tricúspide puede explorarse en las proyecciones: apical 4 cámaras, eje largo paraesternal ventricular derecho, eje corto de grandes vasos e incluso en la ventana subxifoidea. La insuficiencia pulmonar y la arteria pulmonar suelen verse típicamente en la proyección paraesternal eje corto de grandes vasos, pero también podría ser evaluada en la ventana subxifoidea. Figura 27-30. En el TEP el flujo de la arteria pulmonar debe ser siempre evaluado de forma cuidadosa, pues nos va a dar una información primordial. Su ITV nos da información del gasto cardiaco derecho; su valor normal oscila entre 0,15 – 0,30 m y ante ITV menores a 0,11 m debemos sospechar la existencia de shock y un bajo gasto cardiaco derecho, en definitiva un TEP de muy mal pronóstico. La morfología espectral de este flujo también nos da información, su forma normal es monofásico y con un único pico sistólico. Ante la aparición de un flujo bifásico, una escotadura mesosistólica o de una morfología en “W”, nos suele expresar la presencia de una hipertensión pulmonar severa. Otro parámetro de interés es el tiempo de aceleración del flujo pulmonar, medido sobre la curva de dicho flujo, su valor normal suele ser superior a 120 ms. El TEP agudo suele tener típicamente un TAFP < 60 ms. Valores entre 60 y 100 ms, se corresponden con hipertensión pulmonar, cuando es superior a 100 ms la probabilidad de TEP es muy baja y ante valores superiores a 120 ms, hace muy improbable la presencia de TEP agudo. Figura 28. Flujo de arteria pulmonar bifásico (las flechas amarillas señalan el pico precoz y el tardío. El TAFP se obtiene cuantificando el tiempo desde el inicio de su flujo hasta alcanzar el pico sistólico. Esta morfología del flujo sugiere hipertensión pulmonar severa y al tener un TAFP de 60 ms (flecha azul), insinúa un TEP agudo. En el TEP existe un signo de alto valor predictivo positivo, llamado “signo 60/60”, que consiste en la existencia de un gradiente auriculoventricular derecho menor a 60 mmHg y de un TAFP <60 ms. La existencia de este signo es altamente específico para el TEP (3,4). 16 Figura 29. Imagen del flujo de la arteria pulmonar. Las tres imágenes sugieren hipertensión pulmonar severa, al presentar una muesca mesosistólica, e incluso una imagen en “W”. La ITV del flujo de la arteria pulmonar de la primera imagen es de 24 cm, en la segunda es de 12,4 cm, y en la tercera de 9 cm. El único paciente que se encuentra en shock es el tercero. Una ITV del tracto de salida VD y de la arteria proximal proximal menor a 11 cm es compatible con bajo gasto cardiaco derecho. Durante la fase aguda del TEP podemos encontrarnos grados variables de presiones sistólicas pulmonares. Una presión media de arteria pulmonar igual o mayor de 20 mmHg sugiere un TEP masivo agudo, mientras que una presión arterial pulmonar media mayor de 40 mmHg sugiere TEP masivo subagudo. En pacientes con TEP menor, la presión pulmonar permanece normal. Se cree que presiones iniciales menores a 45 mmHg no desarrollan hipertensión pulmonar severa (34). La existencia de una hipertensión pulmonar severa es una de las variables descritas asociadas a mortalidad. Su descenso significativo (> 20 mmHg) tras la trombolisis o embolectomía es un signo de buen pronóstico, por lo que su valor también nos da información pronóstica y estratificadora. Por otro lado la elevación severa de las resistencias vasculares pulmonares (> 3 UI Woods –W-) y en especial el hallazgo de más de 6 unidades Woods internacionales nos hablan de una hipertensión pulmonar severa fija de muy mal pronóstico. La insuficiencia tricúspide se presenta en más del 80% de los pacientes con una PAP sistólica > 35 mmHg y aproximadamente en el 90% de aquellos con PAP sistólica > 50 mmHg (35). El método más fácil para estimar la PAP sistólica es mediante la medición de la velocidad pico de la insuficiencia tricúspide. Figura 30. Imagen del flujo de la insuficiencia tricúspide. Las dos primeras imágenes se corresponden con proyecciones apicales 4 cámaras, y la tercera de una imagen transesofágica. En la primera la insuficiencia tricuspídea es severa, por lo cual el gradiente ventriculo auricular no se corresponde adecuadamente con la PAPs. Sin embargo en las otras dos imágenes si se correlacionaría de forma adecuada, siempre que mediante el doppler contínuo se observe una imagen espectral adecuada. Aunque la severidad de la IT no se correlaciona necesariamente con el grado de HTP, el manejo quirúrgico adecuado de la patología derecha o izquierda suele descender la HTP y el grado de IT. Ello suele deberse a remodelados adecuados del ventrículo derecho, con disminución de la tracción de los velos tricuspideos y disminución del anillo mitral. La velocidad de la IT refleja la diferencia de presión durante la sístole entre el VD y la aurícula derecha (AD). En ausencia de estenosis pulmonar u obstrucción al tracto de salida del VD, la PAP sistólica es igual a la presión sistólica del VD. Así la PAP sistólica se determina a partir del pico del gradiente de presión sistólica desde el VD a la AD, calculado mediante la ecuación de Bernoulli simplificada 17 (4 x V2), donde V es la velocidad sistólica pico de la IT medida con el Doppler continuo al que se le ha de añadir la presión de la AD, que es estimada mediante el diámetro de la vena cava. Figura 31. Tabla 1. Figura 31. Ambas figuras exploran la vena cava inferior. Mediante modo M se puede realizar una medición de su diámetro máximo y mínimo, de modo que mediante su comportamiento podemos hacer una estimación de la presión auricular derecha. Diámetro de Vena cava inferior (mm) < 15 mm < 20 mm < 20 mm >20 mm >20 mm Índice de Colapso Colapso >50% > 50% < 50% > 50% Presión auricular derecha 0–5 5 – 10 10– 15 15- 20 >20 Tabla 1. Estimación de la presión auricular derecha mediante el diámetro de la vena cava inferior. Figura 32. Imágenes de flujos obtenidos mediante doppler contínuo del gradiente ventrículo auricular derecho. Este flujo se obtiene evaluando mediante doppler contínuo el flujo de la insuficiencia tricúspide. La PAPs se estima calculando la velocidad máxima de la IT mediante doppler contínuo. Es importante ver adecuadamente el espectro del doppler contínuo. En la imagen 1 la IT tiene una velocidad de 3,98 m/s, suponiendo un gradiente ventrículo atrial de 63,3 m/s; dicho paciente tiene una vena cava inferior de 18 diámetro no modificable con un diámetro de 25 mm (PAD estimada ≈ 20 mmHg). La PAPs estimada para ese paciente sería 4(3,98)2 + 20 ≈ 83 mmHg. PAP sistólica = 4VIT2+ presión AD La Presión de arteria pulmonar media también puede estimarse de varios modos, el más clásico es mediante la velocidad pico del flujo regurgitante “protodiastólico” de la insuficiencia pulmonar en eje corto de grandes vasos. PAP media = 4VIP2 + presión AD Más recientemente se ha logrado correlacionar la PAM con el TAFP y mediante la presión arterial pulmonar sistólica. PAP media = 80 – TAFP/2 PAP media = 79 – (0,45 × TAFP) PAP media = 0,61 × PAP sistólica + 2 mm Hg La PAP diastólica suele ser estimada de igual manera, mediante la velocidad pico del flujo telediastólico de la insuficiencia pulmonar (VIPTD) y basada en la ecuación de Bernoulli, de tal modo. Figura 33. PAP diastólica = 4VIPTD2+presión AD Figura 33. Proyección eje corto de grandes vasos. El doppler pulsado está localizado sobre la válvula pulmonar, quien nos permite ver el espectro del flujo diastólico de insuficiencia pulmonar y el sistólico eyectivo ventricular derecho. Sobre el flujo regurgitante de la insuficiencia pulmonar la flecha roja marca el flujo protodiastólico y la amarilla el telediastólico. Considerando que la velocidad protodiastólica de este paciente es 2 m/s, y su presión auricular derecha de 12; su PAP media sería: 4𝑥22 + 12 = 28 𝑚𝑚𝐻𝑔. Su presión pulmonar diastólica sería: 4𝑥1,32 + 12 = 18,76 mmHg. En el flujo sistólico podemos observar la ITV del TSVD, mediante la cual podríamos estimar además la PAP media y las RVP . Es sumamente importante la concordancia de los datos, por ello la evaluación de las resistencias vasculares pulmonares (RVP) ofrece un valor sobreañadido. Se considera normal un valor de 1 UI Woods (W), entre valores de 1 a 3 son indeterminados y valores por encima de 3 se consideran resistencias muy elevadas. Actualmente es muy fácil estimar las resistencias pulmonares vasculares, pudiendo realizarse con métodos fáciles como la relación entre los flujos pulmonares y de regurgitación tricuspídea; hasta por métodos más novedosos como el tiempo de tránsito de contraste intracardiaco (36). La estimación de la RVP suele basarse fundamentalmente en la relación entre la velocidad máxima de la IT y la ITV del tracto de salida del ventrículo derecho (37). Un valor de 0,175 para el cociente VIT/ITVTSVD tiene una sensibilidad del 77% y una especificidad del 81% 19 para asegurar unas RVP > 2 UI W. Basados en las relaciones de la velocidad pico de la insuficiencia tricuspídea y de la ITV del flujo pulmonar se exponen dos fórmulas validadas para la estimación de las resistencias vasculares pulmonares. RVP = 10 × (VIT/ITVTSVD) + 0,16 (unidades internacionales Woods) RVP = 187 + (VIT/ITVTSVDx128) Valores mayores de 7,5 del cociente VIT/ITVTSVD indican un muy mal pronóstico (39). Además existen variantes de estas fórmulas que incluyen a la frecuencia cardiaca, pero en realidad siguen basándose la estimación de las RVP en los flujos de la IT y de la ITV del tracto de salida pulmonar, y de la frecuencia cardiaca (38,39). RVP = PAP s/(Frecuencia cardiaca X ITVTSVD) Este estudio hemodinámico debe completarse con la estimación de las presiones de llenado izquierdas, lo que nos ayudará a optimizar el manejo terapéutico. Diagnóstico diferencial Ningún hallazgo expuesto hasta ahora se considera totalmente patognomónico de TEP, por lo que además de hacer mediante ecocardiografía, un diagnóstico anatómico y funcional, tendremos que hacer un diagnóstico diferencial. El diagnóstico diferencial ecocardiográfico de TEP agudo debería realizarse fundamentalmente con las patologías expuestas en la tabla 2. Hipertensión pulmonar crónica El remodelado ventricular de la hipertensión pulmonar crónica y del TEP suele ser similar, en ambos existe una dilatación ventricular con disfunción ventricular derecha. En el cor pulmonale crónico existe una disfunción crónica que puede empeorar y que se ha llegado a correlacionar el TAPSE con la PaO2 (40)). Aunque en ambos suele existir un remodelado parecido, el TEP suele tener más trastornos de contractilidad segmentarios que la hipertensión pulmonar crónica. Así el TSVD se ve más afectado pues soporta de forma hiperaguda el TEP, por lo que suele tener una mayor disfunción sistólica que la hipertensión pulmonar crónica, que viene reflejada por una disminución de la contractilidad evidenciada por su excursión sistólica y por su área de acortamiento fracciona (41). El strain longitudinal ventricular derecho también podría ayudar a diferenciar ambos, Park et al (42) encontraron que un Strain en el segmento medio mayor de (-12,2) tiene una sensibilidad, especificidad y valor predictive positive del 83.3, 78.6, and 80.8%, respectivamente para el TEP. Otro trastorno de contractilidad típico del TEP agudo e inhabitual de la hipertensión pulmonar crónica es el signo de McConell. La asincronía intra e interventricular inducen insuficiencia cardiaca, en la hipertensión pulmonar aguda y crónica se producen ambos (43), sin embargo el proceso agudo podría llevar una mayor asincronía. 20 El septo presenta signos de sobrecarga de presión en ambos, pero en el TEP agudo puede haber un movimiento mayor que produjese con más frecuencia una escotadura septal evidenciable mediante modo M. Sin embargo el ventrículo derecho del TEP agudo no suele presentar hipertrofia ventricular, salvo que existiera patología preexistente, en cuyo caso el espesor de la pared lateral ventricular derecha suele ser superior a 4-5 mm; pudiendo este dato discriminar en la agudeza del evento. La hipertrofia ventricular derecha refleja un fenómeno crónico, suele detectarse en miocardiopatías, como la hipertrófica o displasias. Pero una hipertrofia ventricular derecha también puede ser inducida por una hipertensión pulmonar crónica. Un ejemplo típico es el TEP de repetición que genera hipertrofia ventricular, que suele ser especialmente acentuado en la banda moderadora y en zona apical, constituyendo además un marcador de mal pronóstico (41). Un leve incremento del espesor VD, frecuentemente cerca de 6 mm, con clara visualización de la trabeculación muscular VD puede ser sugerente de TEP subagudo; con espesores superiores a 6 mm tendríamos que pensar en hipertensión pulmonar crónica o TEP de repetición. Figuras 34 – 37. Figura 34. Strain longitudinal ventricular derecho promedio de (-12), se puede observar que el segmento medio de la pared lateral ventricular derecha tiene un strain de (-19), lo que apoya el diagnóstico de TEP agudo versus hipertensión pulmonar crónica 21 Figura 35. La primera imagen muestra un ventrículo derecho en 3D con hipertensión pulmonar crónica y el segundo muestra un estudio mediante Speackle Tracking de una hipertensión pulmonar crónica, con strain longitudinal global de (-12) y un strain longitudinal del segmento medio lateral de (-9). En ambos puede y suele haber insuficiencia tricúspide, pero su velocidad pico no suele ser superior a 3,5 m/s en el TEP (soliendo estar entre 3 y 3,8 m/s), mientras que suele ser muy superior a 3,8 m/s en la hipertensión pulmonar crónica. Una relación VD/VI mayor de 0,6 junto a la presencia de insuficiencia tricuspídea con una velocidad máxima entre 3 y 3.5 m/s tiene una S de 93 % y una E de 81 % para TEP. Ello se traduce en el alto valor predictivo positivo del signo 60/60 para el TEP agudo. Tabla 2. Diagnóstico diferencial de TEP agudo. Diagnóstico diferencial TEP agudo Hipertensión pulmonar crónica SDRA a Cor pulmonale agudo Infarto agudo de miocardio Sobrecarga de volumen agudo Miocardiopatías Trauma cardiaco En el TEP agudo, mediante ETE o ultrasonidos intravasculares pueden verse trombos móviles en hemicardio o en arteria pulmonar, sin embargo en la hipertensión pulmonar crónica esto no suele ocurrir, y si se evidencian trombos suelen estar adheridos a la arteria pulmonar y no son móviles. En la HTP crónica suele haber una disfunción diastólica, con aurículas crónicamente dilatadas e incluso pudiéndose detectar restricción. Además estos pacientes suelen cursar con fibrilación auricular (44,45). La medición de la vena cava inferior es muy utilizada en medicina intensiva, sin embargo sólo refleja la capacidad de carga del ventrículo derecho y es muy modificable, a pesar de ello suele no producir colapso en el TEP, produciéndose en torno al 40% en la hipertensión pulmonar crónica. La etiología más frecuente de hipertensión pulmonar es la disfunción ventricular izquierda diastólica. En este caso el remodelado es distinto al del cor pulmonale crónico clásico obedeciendo a la etiología de dicha disfunción, en la que solemos encontrar un patrón restrictivo o pseudonormal. 22 Figura 36. Imágenes ecocardiográficas de pacientes con hipertensión pulmonar crónica, con hipertrofia ventricular derecha. La primera imagen se corresponde con un plano paraesternal de un paciente con TEP de repetición y con hipertrofia biventricular. La flecha amarilla señala la hipertrofia septal ventricular derecha. La segunda imagen es una proyección paraesternal de ventrículo derecho con caracterización tisular que muestra hipertrofia de los segmentos basales. La tercera imagen es una proyección apical de una hipertensión pulmonar primaria que muestra hipertrabeculación apical e hipertrofia ventricular derecha. La cuarta imagen es una proyección transesofágica de grandes vasos con hipertrofia del tracto de salida ventricular derecho (flecha azul). En estados avanzados de la hipertensión pulmonar crónica podría llegar a existir derrame pericárdico, que no suele generarse en el TEP. Otro remodelado que podría hacer sospechar un TEP sería la sobrecarga de volumen, sin embargo esta generaría una morfología septal distinta a la sobrecarga de presión, pues en la primera el aplanamiento septal se normaliza en sístole, sin embargo en la sobrecarga de presión (TEP), el aplanamiento septal se mantiene en sístole. Tabla 3. Figura 37. Remodelado cardiaco de un paciente con hipertensión pulmonar crónica de mal pronóstico, en el que se observa un derrame pericárdico ligero. Cor Pulmonale Agudo La sobrecarga de volumen puede producir un remodelado similar al del TEP y su aparición es frecuente en medicina intensiva donde puede haber grandes sobrecargas de volúmenes o elevadas precargas. Sin embargo no existe elevación de la presión de artera pulmonar, por lo que no existiría aplanamiento septal en sístole, el aplanamiento septal se mantiene sólo durante la diástole, pero se recupera en sístole. Ello no descarta el fenómeno de interdependencia ventricular y la constricción generada por el pericardio, producida por la dilatación aguda y severa de las cavidades derechas. La sobrecarga de volumen puede ser generada además de por incremento de la precarga, administración “exagerada” de volumen, por una insuficiencia tricuspídea o pulmonar, por una fístula coronaria a AD o VD, por un drenaje anómalo, fístulas o por una comunicación interauricular o interventricular. Tabla 3. Tabla 3. Parámetros ecocardiográficos diferenciales entre TEP e hipertensión pulmonar crónica. Cor pulmonale crónico TEP agudizado Gradiente ventrículo auricular (mmHg) TAFP (ms) 30 – 60 < 60 > 60 > 60 (80-100) 23 Signo 60/60 Escotadura septal Vena cava inferior (mm) Colapso inspiratorio Hipertrofia ventricular derecha Asincronía Intraventricular Disfunción del TSVD McConell Strain longidudinal medialateral Derrame pericárdico Cor Pulmonale Agudo Sí No ++ +/-- +/> 20 ++/- (< 40%) No ++++ ++++ ++++ > (-12) ---- Si ++ +/+/--< (-12) +++/-- > 20 El SDRA o la lesión pulmonar aguda suele producir un remodelado que podría recordar al TEP (46-47), generando una dilatación ventricular derecha que podría modificarse de acuerdo a las presiones ventilatorias, soliendo existir permeabilidad del foramen oval, signos de sobrecarga de presión e incluso disfunción ventricular derecha. Sin embargo el remodelado no es igual, pues no suelen existir trastornos de contractilidad segmentarios, no suele existir el signo de McConell, ni suele existir el signo 60/60. Infarto Agudo de Miocardio Ventricular derecho El infarto agudo de miocardio es una causa de dilatación ventricular derecha y de disfunción, pero no suele existir signos de sobrecarga sistólica, además son muy típicos los cambios de contractilidad segmentarias. En el caso de la afectación de una coronaria derecha suele ser frecuente la aquinesia de la cara lateral ventricular derecha, sin embargo la zona apical, dependiente de la arteria descendente anterior, podría ser normo o hipercontráctil en la proyección apical 4 cámaras. En el eje corto se observaría aquinesia de cara inferior ventricular derecha y normoquinesia o hiperquinesia anterior derecha. De igual modo existen trastornos de contractilidad segmentarias en el tracto de salida ventricular derecho menos evidentes que en el TEP. Ante una afectación de la arteria descendente anterior podría existir una hipoquinesia apical ventricular derecha, e incluso afectación de la banda moderadora e incompetencia papilar, con génesis de insuficiencia tricúspide y sobrecarga de volumen ventricular derecha. Miocardiopatías La existencia de miocardiopatías, en especial la displasia arritmogénica ventricular derecha también podría entrar en su diagnóstico diferencial, sin embargo en ésta última no siempre existe hipertensión pulmonar, y sin embargo suele ser frecuente la aparición de pseudoaneurismas ventriculares derechas o del tracto de salida ventricular derecho. Otras miocardiopatías frecuentes en medicina intensiva son las de estrés, que aunque pueden afectar al ventrículo derecho, también afectan al ventrículo izquierdo y la hipertensión pulmonar no suele ser frecuente. Pronóstico del TEP 24 La estratificación ecocardiográfica del TEP agudo es prioritaria, pues la detección de disfunción miocárdica derecha estratifica hacia un incremento de mortalidad. No obstante aún no existe un parámetro único que indique la necesidad de realizar trombolisis. Siendo esta última decisión apoyada sobre una estratificación clínica, a la que habría que aunar criterios respiratorios, situación hemodinámica, episodios de síncopes, elevación de biomarcadores e incluso el riesgo de sangrado. Tabla 4 y 5. Tabla 4. Hallazgos ecocardiográficos sugerentes de mal pronóstico Relación diámetro basal VD/VI 1 Relación área telediastólica VD/VI1 Área de acortamiento fraccional en apical 4 cámaras < 0,4 FEVD <0,4 Fracción de acortamiento del tracto de salida ventricular derecho < 0,3 TAPSE < 16 mm Índice TEI derecho > 0,8 Velocidad onda sistólica de doppler pulsado en anillo tricúspide < 9 cm/s Strain longitudinal derecho < (- 15) Strain Rate longitudinal derecho (- 1,5 s-1) Diámetro de seno coronario > 12,5 mm Bamboleo cardiaco Aleteo sistólico del septo intraventricular, sugerente de llenado competitivo biventricular IT severa con sobrecarga sobreañadida de volumen Gradiente Auriculoventricular derecho > 50 mmHg Visión de trombo en cavidades cardiacas Shunt intrapulmonar Shunt intracardiaco, en especial por apertura de foramen oval. Disfunción ventricular izquierda Elevación de presiones telediastólicas ventriculares izquierdas Asincronía interventricular con aparición de insuficiencia tricúspide o mitrales diastólicas Relación E/E’ derecha > 6 Hipertrofia ventricular derecha Indice de Esfericidad > 1,8 Tabla 5. Hallazgos ecocardiográficos sugerentes de buen pronóstico 25 Ausencia de aleteo septal Ausencia de permeabilidad de foramen oval Seno coronario < 7 mm FAC > 0,4 TAPSE > 20 mm Índice TEI derecho < 0,5 Ausencia de dilatación de cavidades derechas Apicalización izquierda Relación E/E’ derecha < 5 Ausencia de trombos intracavitarios Gradiente auriculoventricular derecho 45 mmHg S longitudinal > (-19) Al igual que no existen dudas en la necesidad de usar trombolisis o embolectomía en un paciente en shock; en los pacientes que no presentan hipotensión persisten las dudas sobre el manejo. En estos pacientes un reciente metanálisis demuestra que la disfunción ventricular derecha muestra una OR frente a la muerte de 2,3; por lo que el planteamiento podría modificarse en un futuro. Además muchos de estos pacientes pueden desarrollar una hipertensión pulmonar severa crónica y que marcaría el pronóstico vital e incluso limitar su calidad de vida. De hecho la presencia de hipoquinesia VD moderada o severa e hipertensión pulmonar persistente mayor a 50 mm Hg, tras 6 semanas del TEP, induce una disminución de 5 años de vida en comparación con pacientes con función VD normalizada y presión sistólica pulmonar normal. Por el contrario aquellos cuyo gradiente basal es menor de 45 mmHg tienen menor riesgo de presentar hipertensión pulmonar al año (45). En los pacientes sin shock la estratificación mediante el “BOVA” score podría ser útil. Dicho score estratifica los pacientes con TEP y con la presión arterial sistólica> 90 mm Hg en grupos de riesgo mediante la asignación de puntos por cuatro variables: hipotensión (presión arterial sistólica 90-100 mm Hg, 2 puntos), taquicardia (frecuencia cardíaca ≥110 latidos por minuto, 1 punto), elevación de troponina (2 puntos) y disfunción ventricular derecha en la tomografía o la ecocardiografía (2 puntos) calculada. 4% en los pacientes con una puntuación ≤2 puntos, 18% en aquellos con 3-4 puntos, y el 42% en aquellos con> 4 puntos. La puntuación tuvo una sensibilidad del 26% y una especificidad del 97% para la predicción de complicaciones relacionadas con el TEP. Además la mortalidad a los 30 días fue un 3,1% en la clase 1, un 6,8% en la clase 2 y un 10,5% en la clase 3 (48).. A pesar de la existencia de múltiples parámetros sugerentes de mal pronóstico, en la actualidad no existe ninguno que ofrezca una estratificación directa frente a la necesidad de utilizar trombolisis (48-51). El grupo de Khemasuwan (52) encuentra que las variables ecocardiográficas aociadas a mortalidad en los pacientes con TEP son la relación telediastólica VD/VI, la velocidad de regurgitación tricúspide, el TAPSE y la colapsibilidad de la vena cava menor al 50%; parámetros fáciles de estudiar y sin embargo son válidos para predecir mortalidad (46). A pesar de la falta de estudios de alto nivel de evidencia, la coexistencia de varios de estos signos que sugieren un alto riesgo de muerte, nos debería de hacer pensar en realizar un tratamiento más agresivo. Básicamente en un paciente con inestabilidad hemodinámica y sospecha de TEP, los signos inequívocos de sobrecarga por presión y disfunción del VD justifican 26 (o visión de trombos) el tratamiento de reperfusión de urgencia para TEP si no es factible una angio-TC inmediato. La ETE además nos puede permitir realizar embolectomía aspirativa, con o sin trombolisis local, e incluso fragmentación de trombos. La visión de los trombos durante la intervención facilita el éxito de la técnica, que se basa en enfrentar el catéter aspirativo junto al trombo. Figura 38. No basta con realizar el diagnóstico, sino que la ecocardiografía permite ver la respuesta al manejo, y la evolución precoz, pudiendo ayudarnos en la decisión del manejo (aporte de volumen, utilización de inotropos, etc). Entre los parámetros ecocardiográficos que estratifican hacia mal pronóstico inicial destacan. . Figura 38. Imagen transesofágica de una fragmentación de trombo y embolectomía. Puntos Claves 1. –Ante la presencia de shock y de signos sugerentes de dilatación y disfunción ventricular derecha y signos de sobrecarga de presión estaría recomendado el uso de trombolisis sistémica. 2. – Los signos clásicos más sugerentes de TEP son: dilatación auricular y ventricular derecha, disfunción sistólica ventricular derecha, movimiento paradójico septal, signo de McConell, apicalización derecha, signo 60/60. 3. – Una relación entre el área o los diámetros VD/VI ³1 podría ser indicativo de disfunción ventricular derecha. Un valor del TAPSE < 16 mm se correlaciona con una disfunción ventricular derecha severa y con muy mal pronóstico. 4. – Una FAC < 0,3 en el TSVD se correlaciona con muy mal pronóstico. 5. – Ante presencia de trombos en hemicardio, la trombolisis debería ser planteada. 6. – Ante pacientes con TEP y con estabilidad hemodinámica la estratificación ecocardiográfica debe realizarse y ante la presencia de marcadores de mal pronóstico debe plantearse la trombolisis o la embolectomía. 27 7. - La ecocardiografía no descarta la existencia de un TEP, pero la ausencia de dilatación, disfunción derecha y de hipertensión pulmonar, sólo se observarían en TEP de muy bajo riesgo. 8. – Ante valores de TAPSE entre 16 y 20 mm, evaluar la presencia de otros marcadores de disfunción ventricular derecha. 9. - Un TAPSE > 20 mm descarta la disfunción ventricular derecha. 10. – Ante hipertrofia ventricular derecha, gradiente ventrículo auricular mayor de 60 mmHg, o derrame pericárdico; podríamos estar ante una hipertensión pulmonar crónica. Referencias 1. Agnelli G, Becattini C. Acute pulmonary embolism. N Engl J Med 2010;363:266–74 2. Ten Wolde M, Söhne M, Quak E, Mac Gillavry MR, Büller HR. Prognostic value of echocardiographically assessed right ventricular dysfunction in patients with pulmonary embolism. Arch Intern Med 2004;164:1685–9. 3. Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005;18:1440–63. 4. Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685–713 5. Casazza F, Bongarzoni A, Centonze F, Morpurgo M. Prevalence and prognostic significance of right-sided cardiac mobile thrombi in acute massive pulmonary embolism. Am J Cardiol. 1997;79:1433–5 6. Torbicki A, Kurzyna M, Ciurzynski M, Pruszczyk P, Pacho R, Kuch-Wocial A, Szulc M. Proximal pulmonary emboli modify right ventricular ejection pattern. EurRespir J. 1999;13:616–21. 174 7. Bova C, Greco F, Misuraca G, Serafini O, Crocco F, Greco A, Noto A. Diagnostic utility of echocardiography in patients with suspected pulmonary embolism. Am J Emerg Med. 2003;21:180–3 8. TenWolde M, Sne M, Quak E, Mac Gillavry MR, . Prognostic value of echocardiographically assessed right ventricular dysfunction in patients with pulmonary embolism. Arch Intern Med. 2004;164:1685–9. 226. 9. Coutance G, Cauderlier E, Ehtisham J, Hamon M, Hamon M. The prognostic value of markers of right ventricular dysfunction in pulmonary embolism: a metaanalysis. Crit Care. 2011;15:R103. 10. Becattini C, Agnelli G, Vedovati MC, Pruszczyk P, Casazza F, Grifoni S, Salvi A, Bianchi M, Douma R, Konstantinides S, Lankeit M, Duranti M. Multidetector computed tomography for acute 28 pulmonary embolism: diagnosis and risk stratification in a single test. Eur Heart J. 2011;32:1657–63. 11. McConnell MV, Solomon SD, Rayan ME, Come PC, Goldhaber SZ, Lee RT. Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol 1996;78:469–73 12. López-Candales A, Edelman K, Candales MD. Right ventricular apical contractility in acute pulmonary embolism: the McConnell sign revisited. Echocardiography 2010;27:614–20 13. Sugiura E, Dohi K, Onishi K, Takamura T, Tsuji A, Ota S, Yamada N, Nakamura M, Nobori T, Ito M. Reversible right ventricular regional non-uniformity quantified by speckle-tracking strain imaging in patients with acute pulmonary thromboembolism. J Am Soc Echocardiogr. 2009 Dec;22(12):1353-9 14. Ichikawa K, Dohi K, Sugiura E, Sugimoto T, Takamura T, Ogihara Y, Nakajima H, Onishi K, Yamada N, Nakamura M, Nobori T, Ito M. Ventricular function and dyssynchrony quantified by speckle-tracking echocardiography in patients with acute and chronic right ventricular pressure overload. J Am Soc Echocardiogr. 2013 May;26(5):483-92 15. Tajbakhsh N, Wu H, Xue W, McMahon EM, Belohlavek M, Liang J. Motion analysis of right ventricular dysfunction under mild or moderate pressure overload caused by acute pulmonary embolism. Ultrasound Med Biol. 2013 Nov;39(11):2066-74 16. Takamura T, Dohi K, Onishi K, Sakurai Y, Ichikawa K, Tsuji A, Ota S, Tanabe M, Yamada N, Nakamura M, Nobori T, Ito M. Reversible left ventricular regional non-uniformity quantified by speckle-tracking displacement and strain imaging in patients with acute pulmonary embolism. J Am Soc Echocardiogr. 2011 Jul;24(7):792-802 17. Kerbaul F, Gariboldi V, Giorgi R, Mekkaoui C, Guieu R, Fesler P, Gouin F, Brimioulle S, Collart F. Effects of levosimendan on acute pulmonary embolism-induced right ventricular failure. Crit Care Med. 2007 Aug;35(8):1948-54 18. Spinner EM, Lerakis S, Higginson J, Pernetz M, Howell S, Veledar E, Yoganathan AP. Correlates of tricuspid regurgitation as determined by 3D echocardiography: pulmonary arterial pressure, ventricle geometry, annular dilatation, and papillary muscle displacement. Circ Cardiovasc Imaging. 2012 Jan;5(1):43-50. 19. Özpelit E, Akdeniz B, Özpelit EM, Tas S, Alpaslan E, Bozkurt S, Arslan A, Badak Ö. Impact of Severe Tricuspid Regurgitation on Accuracy of Echocardiographic Pulmonary Artery Systolic Pressure Estimation. Echocardiography. 2015 Mar 3. doi: 10.1111/echo.12912. [Epub ahead of print] 20. Staskiewicz G1, Czekajska-Chehab E, Przegalinski J, Tomaszewski A, Torres K, Torres A, Trojanowska A, Maciejewski R, Drop A. Widening of coronary sinus in CT pulmonary angiography indicates right ventricular dysfunction in patients with acute pulmonary embolism. Eur Radiol. 2010 Jul;20(7):1615-20. doi: 10.1007/s00330-009-17021. 21. Mahmud E, Raisinghani A, Keramati S, W Auger, Blanchard DG, DeMaria AN. Dilation of the coronary sinus on echocardiogram: prevalence and significance in patients with chronic pulmonary hypertension. J Am Soc Echocardiogr. 2001 Ene; 14 (1): 44-9. 22. Varol K, Gumus C, Yucel H, Sezer F, Seker E, Inci MF, Yucel S, Kaya H, Berk S, Yilmaz MB Correlation of right ventricular dysfunction on acute pulmonary embolism with pulmonary artery computed tomography obstruction index ratio (PACTOIR) and comparison with echocardiography. Jpn J Radiol. 2015 Jun;33(6):311-6 29 23. Pruszczyk P, Goliszek S, Lichodziejewska B, Kostrubiec M, Ciurzyński M, Kurnicka K, DzikowskaDiduch O, Palczewski P, Wyzgal A. Prognostic value of echocardiography in normotensive patients with acute pulmonary embolism. JACC Cardiovasc Imaging. 2014 Jun;7(6):553-60 24. Lobo JL, Holley A, Tapson V, Moores L, Oribe M, Barrón M, Otero R, Nauffal D, Valle R, Monreal M, Yusen RD, Jiménez D; PROTECT and RIETE investigators. Prognostic significance of tricuspid annular displacement in normotensive patients with acute symptomatic pulmonary embolism. J Thromb Haemost. 2014 Jul;12(7):1020-7. 25. Park JH, Kim JH, Lee JH, Choi SW, Jeong JO, Seong IW. Evaluation of right ventricular systolic function by the analysis of tricuspid annular motion in patients with acute pulmonary embolism. J Cardiovasc Ultrasound. 2012 Dec;20(4):181-8. doi: 10.4250/jcu.2012.20.4.181. Epub 2012 Dec 31 26. Rodrigues AC, Cordovil A, Monaco C, Guimarães L, Cury A, Naccarato GA, Lira-Filho E, Fischer CH, Vieira ML, Morhy S. Right ventricular assessment by tissue-Doppler echocardiography in acute pulmonary embolism. Arq Bras Cardiol. 2013 Jun;100(6):524-30 27. Selcuk M, Sayar N, Demir S, Rodi Tosua A, Aslan V. The value of isovolumic acceleration for the assessment of right ventricular function in acute pulmonary embolism. Rev Port Cardiol. 2014 Oct;33(10):591-6 28. Cetiner MA, Sayin MR, Yildirim N, Karabag T, Dogan SM, Kucuk E, Aydin M. Right ventricular isovolumic acceleration in acute pulmonary embolism. Echocardiography. 2014 Nov;31(10):1253-8 29. Lopez-Candales A. Marked reduction in the ratio of main right ventricular chamber to outflow tract function in patients with proximal bilateral acute pulmonary embolism. Int J Cardiol. 2013 Sep 20;168(1):592-3 30. Vitarelli A, Barillà F, Capotosto L, D'Angeli I, Truscelli G, De Maio M, Ashurov R. Right ventricular function in acute pulmonary embolism: a combined assessment by three-dimensional and speckle-tracking echocardiography. J Am Soc Echocardiogr. 2014 Mar;27(3):329-38 31. Jenab Y, Saheb Jam M, Safir-Mardanloo A, Ashraf H, Ejmalian G, Bozorgi A, Sadeghian H, Zoroufian A, Ghaffari-Marandi N. Strain imaging for evaluating response to thrombolytic therapy in pulmonary thromboembolism. Acta Cardiol. 2014 Feb;69(1):23-8. 32. Goliszek S, Wiśniewska M, Kurnicka K, Lichodziejewska B, Ciurzyński M, Kostrubiec M, Gołębiowski M, Babiuch M, Paczynska M, Koć M, Palczewski P, Wyzgał A, Pruszczyk P. Patent foramen ovale increases the risk of acute ischemic stroke in patients with acute pulmonary embolism leading to right ventricular dysfunction.Thromb Res. 2014 Nov;134(5):1052-6. doi: 10.1016/j.thromres.2014.09.013. Epub 2014 Sep 21. 33. Ruiz-Bailén M, Ramos-Cuadra JA, Machado-Casas J, Rucabado-Aguilar L.Successful administration of alteplase in a venous thromboembolism crossing through a patent foramen ovale. Interact Cardiovasc Thorac Surg. 2009 Oct;9(4):712-3 34. Casazza F, Bongarzoni A, Forgione C, Cuccia C, Imperadore F, Arrigo G, Floriani I, et al. Echocardiographic evolution of pulmonary artery pressure after acute pulmonary embolism. Results from IPER registry.Thromb Res. 2014 Dec;134(6):1224-8 35. Berger M, Haimowitz A, Van Tosh A, Berdoff RL, Goldberg E. Quantitative assessment of pulmonary hypertension in patients with tricuspid regurgitationusing continuous wave Doppler ultrasound. J Am Coll Cardiol. 1985 Aug;6(2):35965. 30 36. Choi B, Sanai R, Yang B, Young BA, Mazhari R, Reiner J, et al. Estimation of cardiac output and pulmonary vascular resistance by contrast echocardiography transit time measurement: a prospective pilot study Cardiovasc Ultrasound. 2014; 12: 44-49. 37. Abbas AE, Fortuin FD, Schiller NB, Appleton CP, Moreno CA, Lester SJ. A simple method for noninvasive estimation of pulmonary vascular resistance. J Am Coll Cardiol 2003, 41:1021– 1027. 38. Pande A, Sarkar A, Ahmed I, Naveen Chandra G, Patil SK, Kundu CK, Arora R, Samanta A. Noninvasive estimation of pulmonary vascular resistance in patients of pulmonary hypertension in congenital heart disease with unobstructed pulmonary flow. Ann Pediatr Cardiol. 2014 May;7(2):92-7 39. Haddad F1, Zamanian R, Beraud AS, Schnittger I, Feinstein J, Peterson T, Yang P, Doyle R, Rosenthal D.A novel non-invasive method of estimating pulmonary vascular resistance in patients with pulmonary arterial hypertension. J Am Soc Echocardiogr. 2009 May;22(5):523-9. 40. Kouzu H1, Nakatani S, Kyotani S, Kanzaki H, Nakanishi N, Kitakaze M.Noninvasive estimation of pulmonary vascular resistance by Doppler echocardiography in patients with pulmonary arterial hypertension. Am J Cardiol. 2009 Mar 15;103(6):872-6 41. Terzano C, Romani S, Gaudio C, Pelliccia F, Serao M, Vitarelli A. Right heart functional changes in the acute, hypercapnic exacerbations of COPD. Biomed Res Int. 2014;2014:596051 42. López-Candales A, Edelman K. Right ventricular outflow tract systolic excursion: a distinguishing echocardiographic finding in acute pulmonary embolism. Echocardiography. 2013 Jul;30(6):649-57 43. Park JH, Park YS, Kim YJ, Lee IS, Kim JH, Lee JH, Choi SW, Jeong JO, Seong IW. Differentiation between acute and chronic cor pulmonal with midventricular systolic strain of the right ventricle in the emergency department. Heart Vessels. 2011 Jul;26(4):435-9 44. Ichikawa K, Dohi K, Sugiura E, Sugimoto T, Takamura T, Ogihara Y, Nakajima H, Onishi K, Yamada N, Nakamura M, Nobori T, Ito M. Ventricular function and dyssynchrony quantified by speckle-tracking echocardiography in patients with acute and chronic right ventricular pressure overload. J Am Soc Echocardiogr. 2013 May;26(5):483-92 45. Terzano C1, Romani S, Conti V, Paone G, Oriolo F, Vitarelli A. Atrial fibrillation in the acute, hypercapnic exacerbations of COPD. Eur Rev Med Pharmacol Sci. 2014 Oct;18(19):2908-17. 46. Steiner J, Wu WC, Jankowich M, Maron BA, Sharma S, Choudhary G.Echocardiographic predictors of mortality in patients with pulmonary hypertension and cardiopulmonary comorbidities. PLoS One. 2015 Mar 16;10(3):e0119277 47. Repessé X, Charron C, Vieillard-Baron A. Acute cor pulmonale in ARDS: rationale for protecting the right ventricle. Chest. 2015 Jan;147(1):259-65 48. Legras A, Caille A, Begot E, Lhéritier G, Lherm T, Mathonnet A, et al; . Acute respiratory distress syndrome (ARDS)-associated acute cor pulmonale and patent foramen ovale: a multicenter noninvasive hemodynamic study. Crit Care. 2015 Apr 17;19:174. 49. Fernández C, Bova C, Sanchez O, Prandoni P, Lankeit M, Konstantinides S, Vanni S, FernándezGolfín C, Yusen RD, Jiménez D. Validation of a Model for Identification of Patients at Intermediate to High Risk for Complications Associated WithAcute Symptomatic Pulmonary Embolism. Chest. 2015 Jul 1;148(1):211-8 50. Cho JH, Kaw R, Chhabra J, Kola S, Mahata I, Shahani S et al. Prognostic implications of diastolic dysfunction in patients with acute pulmonary embolism. BMC Researdh Not 2014;7:610-615 31 51. Cho JH, Kutti Sridharan G, Kim SH, Kaw R, Abburi T, Irfan A, Kocheril AG. Right ventricular dysfunction as an echocardiographic prognostic factor in hemodynamically stable patients with acute pulmonary embolism: a meta-analysis. BMC Cardiovasc Disord. 2014 May 6;14:64 52. Casazza F, Bongarzoni A, Forgione C, Cuccia C, Imperadore F, Arrigo G, Floriani I, et al. Echocardiographic evolution of pulmonary artery pressure after acute pulmonary embolism. Results from IPER registry.Thromb Res. 2014 Dec;134(6):1224-8 53. Khemasuwan D, Yingchoncharoen T, Tunsupon P, Kusunose K, Moghekar A, Klein A, et al. Right ventricular echocardiographic parameters are associated with mortality after acute pulmonary embolism. J Am Soc Echocardiogr. 2015 Mar;28(3):355-62