INTRODUCCIÓN AL LABORATORIO 2014 CLASES 1 Y 2
Anuncio

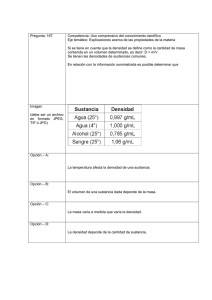
0 INTRODUCCIÓN AL LABORATORIO 2014 CLASES 1 Y 2 CAPITULO 1 : NOCIONES BASICAS La Química es la ciencia que estudia la materia, su estructura, sus propiedades y transformaciones, y los estados y cambios energéticos involucrados. (Materia/Energía). Se apoya en la matemática y la física, y sirve de basamento a la biología, y la fisiología, conformando un conjunto epistemológico sustentado en los principios del método científico. Superada la Edad Media, la química, al evolucionar y separarse de la alquimia, sentó sus bases sobre las matemáticas y la física, adecuándose paulatinamente al rigor del método científico. Evidentemente, este aserto evidencia que muchas de las afirmaciones teóricas y fundamentalmente prácticas, de la química, están basadas en sistemas numéricos. Esos números, están asociados a unidades que deben ser expresadas de manera inequívoca, a los efectos de evidenciar con rigurosidad la realidad en que intervienen y que intentan representar. En razón de las diferencias observadas históricamente entre países que utilizaban sistemas de unidades diferentes, o nomenclaturas discordantes, se fueron construyendo consensos internacionales, con el fin de hacer compatibles la comunicación y la interpretación de los trabajos científicos. Así nació la IUPAC 1 (Internacional Union of Pure and Aplyed Chemistry) y el Sistema Internacional de unidades (SI). El sistema SI, está formado por unidades básicas y derivadas; estas resultan de la combinación de más de una de aquellas. 1 Unión Internacional de Química Pura y Aplicada 1 De las unidades básicas, se derivan las de superficie, velocidad, y todas las que resulten necesarias a partir de la interrelación de diferentes magnitudes que se relacionan entre sí. Además, es muy común que de acuerdo con la realidad, en muchos casos se deba utilizar una gran cantidad de ceros, tanto a la derecha como a la izquierda de las cifras significativas. En estos casos, para minimizar su utilización, resulta conveniente utilizar la notación científica. En razón de la gran amplitud dimensional que abarca el universo físico, desde el mundo subatómico hasta el macrocosmos, resulta imprescindible emplear una gran cantidad de ceros, para poder representar adecuadamente esa realidad. Por ello, y a los efectos de simplificar el despliegue de números con gran cantidad de dígitos, se aplica la notación científica, a los efectos de resolver ese problema. Este sistema de notación se fundamentó en el hecho de que la numeración decimal se basa en el número 10. Esto significa que las siguientes cifras, se pueden representar también de forma exponencial, con b ase 10, a los efectos de no recurrir a una excesiva cantidad de ceros. Esa escala se representa más abajo: 1 x 101 = 10 1 x 102 = 100 1 x 103 = 1.000 1 x 104 = 10.000 1 x 105 = 100.000; En la expresión exponencial, el exponente representa la cantidad de ceros luego de la primera cifra significativa. 2 Con el mismo razonamiento, los exponentes negativos expresan la cantidad de ceros delante de la primera cifra significativa 2, como se muestra a continuación: : 1 x 10-1 = 0,1 1 x 10-2 = 0,01 1 x 10-3 = 0,001 1 x 10- 4 = 0,0001 1 x 10 -5 = 0,00001 En consecuencia, se puede generalizar, que una forma de representarlos, es de acuerdo con: a.10n En donde “a” vale entre 1 y 9,99 , y n la cantidad de cifras significativas; a manera de ejemplo, podemos observar: 5.510 = 5,51 x 103 205.000 = 2,05 x 105 10.000.000 = 1 x 107 0,00112 = 1,12 x 10-3 0,0000008936 = 8,94 x 10-7 2 Inclusive el cero que precede a la coma. 3 Existen exponenciales típicos que representan valores desde la escala cósmica, hasta los del mundo subatómico; Por lo expuesto, y en vista de la gran diversidad de medidas que requiere para su expresión un sistema científico, resulta aconsejable aplicar un sistema de prefijos, a los efectos de asignar, de manera convencional, un sistema de medición. Se resumen a continuación los prefijos más comúnmente utilizados y que indican el exponencial del que se trate: Así, un picosegundo es 10-12 segundos, un femtolitro es 10-15 litros, un gigabite corresponde a 109 bites, etc. RESOLUCION DE PROBLEMAS La gran mayoría de los problemas que derivan de los procedimientos químicos que aquí se desarrollarán, se basan en ecuaciones lineales, lo que pone de manifiesto la proporcionalidad equivalente, (directa o inversa) entre las variables relacionadas. Es por ello, que en base a esa relación, resulta conveniente utilizar el razonamiento que nos brinda el uso de la reconocida “regla de tres simple”. Por ejemplo, si quisiéramos averiguar, cuánto pesan dos moles de Cloruro de Sodio (NaCl), razonamos así: Si un mol de NaCl pesa 58, 5 gramos, “2 moles pesarán…. “x””: 1 mol _________________ 58,5 gr. 2 moles _______________ x En donde x será: 2 moles. 58,5 gr X = ---------------------------- = 117 gr. 1 mol 4 Otro procedimiento útil para la resolución de problemas lo constituye el “Método del Factor Unitario”, ampliamente conocido como “análisis dimensional”. El análisis dimensional utiliza un método fraccionario, en el que se determina un factor unitario, colocando en numerador y denominador, valores equivalentes en diferentes unidades, y luego multiplicando este factor unitario por el dato que debemos resolver. Un ejemplo puede orientarnos acerca del uso del mismo: Si se nos pidiera transformar 7,44 m. a cm. Buscamos una equivalencia entre m. y cm. que nos convenga, Sabemos que un metro es igual a 100 cm., por lo que el factor unitario será: 1m ------------ = 1; 100 cm Entonces, lo multiplicamos por la incógnita: 1m ------------ x 744 cm = 7,44 m. 100 cm Vemos así que se cancelan las unidades que no deseamos (en ese caso centímetros, cm.), quedando el resultado en metros. que son las requeridas en la consigna. El factor unitario permite entonces multiplicar por 0,01 y obtener las unidades correctas, en base a que la fracción representa una igualdad entre numerador y denominador. Si en otro ejemplo se nos pidiera averiguar el peso en grs. de 3,5 moles de NaCl, estableceríamos el factor unitario de manera tal que se cancelen las unidades que no se nos requiere (moles) y que deje las necesarias para resolver el problema; esto es, gramos: El factor unitario será: 5 58,5 gr. NaCl 1 = --------------------------, 1 mol NaCl entonces : 58,5 gr. NaCl -------------------------- X 3,5 moles = 204,75 gr. 1 mol NaCl Podemos expresar entonces que 3,5 moles de NaCl pesan 204,75 gr. Este análisis dimensional, permite rápidamente y con poco esfuerzo, establecer las relaciones unitarias entre dos sistemas, constituyendo una metodología de sencilla resolución. CAPITULO 2 MATERIA y ENERGIA Se denomina materia a todo lo que posee masa y por lo tanto presenta peso y ocupa un espacio en el universo, como un constituyente de todo lo concreto conocido. No obstante, comparte esa definición con la antimateria y la materia oscura, y además posee partículas de masa 0, como los fotones. En definitiva, llamamos materia a todo lo que forma el universo y es capaz de impresionar nuestros sentidos o instrumentos. La materia está sometida y responde a las cuatro fuerzas de la naturaleza: gravedad, electromagnetismo, fuerza nuclear fuerte y fuerza nuclear débil. 6 Mientras tanto la energía es la capacidad de producir trabajo o calor y su interrelación con la materia se evidencia a través de la fórmula de Einstein 3: E = m. c2 Resulta evidente que la materia y la energía se encuentran relacionadas a través del valor de la velocidad de la luz (en este caso al cuadrado). Sabiendo que la velocidad de la luz es de 289.000 km/ seg., podemos denotar que un gramo de materia es capaz de producir un número extraordinario de unidades de energía, fundamento de las bombas de fisión atómica, donde al transformar la materia radiactiva, se produce una imponente liberación de energía Propiedades de la materia: La materia presenta diferentes propiedades, que permite identificar a cada sustancia. Las propiedades de la materia pueden clasificarse, inicialmente en: Propiedades Extensivas Propiedades Intensivas Las propiedades extensivas son aquellas que dependen de la cantidad y no de la identidad de las sustancias, como lo son el volumen, el peso, la superficie, Mientras tanto, las propiedades intensivas, no dependen de la cantidad de materia analizada y son características de cada tipo de sustancia, por lo cual resultan útiles para identificar una sustancia particular. Ejemplo de propiedades intensivas son: entre otras, la densidad, el punto de fusión, el punto de ebullición, etc. Si consideramos, por ejemplo, el punto de ebullición queda demostrado que éste no varía con la cantidad de materia. Esto es: 1 litro de la sustancia 3 En donde E, representa energía, m, masa y c, la velocidad de la luz. 7 agua hierve a 100 º C y 5 litros de sustancia agua, también hierven a 100 º C en condiciones normales de Presión y temperatura. La diferencia estriba en que en el segundo caso será necesario entregar 5 veces más energía calórica al sistema, pero la temperatura de ebullición será la misma (100 °C). La DENSIDAD de una sustancia, es una propiedad intensiva, a pesar de que es la razón entre la masa y el volumen que ocupa, ambas de carácter extensivo. Podemos observar en este caso que al colocar una en función de la otra, se establece una proporcionalidad que determina que su razón origine un valor constante, demostrando que la densidad es una propiedad intensiva. La materia es la constituye de todas las sustancias conocidas, en sus diferentes estados; las propiedades intensivas son los indicadores que caracterizan su identidad. Además, todas las sustancias están constituidas por partículas indivisibles llamadas “átomos”. A lo largo de los años, los estudios demostraron que los átomos no eran las partículas “últimas” de la materia, y que además estaban muy relacionadas con la electricidad. Los átomos poseen un núcleo central, y nubes electrónicas negativas en diferentes niveles de energía, a su alrededor. Por definición, la antimateria es todo lo que está formado por átomos de carga inversa a la materia, es decir núcleos negativos y orbitales positivos, como se grafica más abajo: Materia: átomo núcleo con protones (+) y orbitales con electrones (-) 8 Antimateria: antiátomo núcleo con antiprotones (-) y orbitales de positrones (+). Importante: la materia no puede convivir con la anti materia. El contacto entre ambas produce un aniquilamiento mutuo, con liberación de grandes cantidades de energía. Por ello, los cosmólogos deducen que en el universo existen zonas con predominancia de materia, y otras zonas con prevalencia de antimateria. Las zonas de contacto entre ambas regiones, serían las responsables de la generación y emisión de ingentes cantidades de energía cósmica. En los últimos años se demostró además, la existencia de otro tipo de materia, denominada “ materia oscura”, que existe solamente a nivel del macrocosmos y es la que está regida por energía ANTIgravitatoria que contribuye, por acción de esa fuerza, a la expansión del universo. Su nombre obedece a que resulta muy difícil de observar directamente por lo que se la determina por métodos indirectos. Su cantidad es determinante sobre el comportamiento expansivo del universo, y el destino final de éste. 1 Cuerpo: Se denomina cuerpo a una determinada porción de materia formada por una o más sustancias, que presenta límites y formas definidos. Cualquier objeto es un cuerpo, como ser, una pirámide hecha con la sustancia “piedra”, una esfera conformada por la sustancia “madera”, un cilindro de “plomo”, una silla de “plástico”. A veces alcanza definiciones más complejas y evolucionadas, como el cuerpo humano, el cuerpo de un animal, o el “cuerpo del delito”. Por estar un cuerpo formado de sustancias que ocupan un espacio en el universo, en razón de la condición de impenetrabilidad de todo cuerpo físico, ese espació no puede ser ocupado por otro, al mismo tiempo. Los cuerpos poseen masa, y la masa de un cuerpo se correlaciona con el peso, a través de la influencia de la gravedad, Peso = Masa x Aceleración de Gravedad, es decir que el peso es la fuerza (atracción) que ejerce un cuerpo sobre otro. La tierra, en razón de su tamaño respecto de los objetos que se encuentran en ella, semeja una “caída” de los demás cuerpos sobre su superficie, de “ arriba hacia abajo”, como la Manzana de Newton. Aun cuando el manzano se encuentre en el hemisferio sur, vemos en el mundo ordinario que la manzana “cae” hacia abajo, cuando en realidad se trata de la atracción entre dos cuerpos (Uno de gran masa: la tierra, otro de pequeña masa: la manzana) De acuerdo con las leyes físicas, todos los cuerpos ejercen atracción gravitatoria entre sí. Dos Cuerpos, A y B, se van a atraer con una fuerza directamente proporcional a sus masas e inversamente proporcional a su distancia al cuadrado. --> F mA . mB = ----------------------d2 Sustancia: es el tipo de materia que constituye un cuerpo.(Ej.: Barra de sustancia Aluminio, barra de sustancia acero, barra de sustancia hierro, barra de sustancia hielo, barra de sustancia chocolate, agua destilada contenida en un vaso, alcohol absoluto en su botella cerrada, etc.) La forma del cuerpo es una barra, o en el caso de un líquido, el del recipiente que lo contiene, pero la sustancia resulta diferente en cada caso, en virtud de presentar distintas propiedades físico- químicas. Todas las sustancias están sometidas a transformaciones físicas, químicas y nucleares. Una transformación física es un proceso durante el cual una sustancia cambia su forma, volumen, estado de movimiento o estado de agregación, pero sigue siendo la misma sustancia. Ejemplo: evaporación del agua, dilatación térmica del cobre.(no se modifica la sustancia: el agua sigue siendo agua, en otro estado, y el cobre mantiene su identidad y sólo modificó su volumen). En una transformación o reacción química, en cambio, una sustancia se convierte en otra u otras diferentes. Ejemplo: transformación de vino en vinagre, fermentación del azúcar, etc. En una transformación nuclear, no hay modificaciones químicas de la molécula, sino modificaciones en el núcleo del átomo. Estas no se verifican en los laboratorios comunes, sino que corresponde a los centros nucleares, y no caen bajo el campo de estudio de la química, sino de la física. Involucran emisiones radiactivas, transmutaciones, fisión nuclear, y requiere la participación de grandes cantidades de energía. SISTEMAS MATERIALES Se denomina Sistema Material a toda porción del universo, que posee masa y que es aislada para su estudio. Todo lo que rodea al sistema material, y sobre el que puede influir, se denomina “ambiente”. 2 Si se pretende estudiar un pez en su pecera, el pez es el objeto de estudio (sistema material) y lo que lo rodea (pecera), y le genera condiciones particulares que inciden sobre el sistema material será el medio ambiente. De acuerdo a la relación que el sistema material establece con su ambiente, se pueden objetivar tres situaciones: El sistema material y el medio intercambian materia y energía : SISTEMA ABIERTO El sistema material intercambia sólo energía, pero no materia: SISTEMA CERRADO El sistema material no intercambia ni materia ni energía con el ambiente: SISTEMA AISLADO O ADIABÁTICO. En un sistema abierto, el Sistema Material (SM), puede intercambiar materia y energía libremente con el medio. Un recipiente con agua en ebullición y sin tapa corresponde a un sistema de éste tipo: escapa materia en forma de vapor, y energía en forma de calor hacia el medio. Si al recipiente del ejemplo anterior se lo dota de una tapa, de manera que el vapor no pueda escapar, se transformará en un sistema cerrado: el calor escapará a través de las paredes del recipiente (intercambio de energía con el medio), pero la materia no sale. En el caso que se conforme una capa aislante, como la de un termo alrededor del recipiente, el sistema alcanzará a contener, además de la materia, a la energía: Esto constituye el caso de un ejemplo de sistema ADIABATICO. No obstante, cabe hacer la salvedad de que no existe un sistema adiabático perfecto en el mundo ordinario, tratándose más bien de una definición teórica, ya que con el tiempo, la energía finalmente escapa. De acuerdo son su aspecto, los sistemas materiales se pueden clasificar en: Sistemas Heterogéneos : Sistemas formados por más de una fase Sistemas homogéneos: Sistemas formados por una sola fase Sistemas inhomogéneos: Una sola fase con propiedades variables de manera paulatina. SISTEMAS HETEROGENEOS: Si analizamos un sistema constituido por agua y aceite en un vaso, comprobaremos que presenta una capa de aceite en la zona superior y otra de agua, debajo de aquella. Si no consideramos al aire, podemos decir que el sistema está formado por una fase agua y una fase aceite. El sistema en su conjunto presenta disparidad de propiedades ya que es evidente que el agua y el aceite presentan propiedades diferentes. Decimos en ese caso que el sistema es BIFASICO, ya que está formado por dos fases: fase agua y fase aceite, con una clara delimitación entre ellos, llamada interfase. En cambio, si estudiamos un vaso de agua salada, decimos que es monofásico, ya que presenta una sola fase, ya que el agua salada no muestra diferencias entre un punto y otro, si lo observamos a simple vista o con el ultramicroscopio. 3 Aire Agua salada Entonces : Sistema heterogéneo es aquel que presenta distintas propiedades intensivas en por lo menos dos de sus puntos, con una delimitación entre ellos, llamada interfase. Decimos además que los Sistemas heterogéneos están formados por más de una fase. Otros sistemas heterogéneos son, por ejemplo, muestras de agua con benceno, arena con limaduras de hierro, el granito, el mármol, etc. Cada fase constituyente del sistema heterogéneo, es un sistema homogéneo en sí mismo, denominado fase. Las fases pueden presentar cualquiera de los tres estados físicos, y estar formadas por uno o más componentes. Están separadas entre sí por superficies netas y definidas, Por ejemplo un sistema heterogéneo de tres fases es agua, hielo y vapor de agua. (La misma sustancia agua en tres estados diferentes). Ese sistema tiene tres fases ( agua líquida, vapor de agua y hielo), y un solo componente: agua. Tres fases y un componente: Si nuestro sistema está formado por agua salada, un trozo de madera y gas hidrógeno, tiene Tres fases y cuatro componentes: Ttambién hay tres fases ( fase agua salada, fase maderas y fase hidrógeno), pero en vez de un componente, hay cuatro: sustancia agua, sustancia sal, sustancia madera y sustancia hidrógeno. Mezclas: Cuando dos o más sustancias se reúnen en un sistema disperso, en proporciones variables y no definidas y sin que se produzca una interacción química, decimos que se ha formado una mezcla. Las fases que están en mayor cantidad, se llaman fases dispersantes, y las que se encuentran en menor proporción, fase dispersa. Se clasifican en: - Dispersiones: son sistemas heterogéneos - Soluciones: son sistemas homogéneos De acuerdo con su apariencia visual, las mezclas pueden ser A) observables: Macroscópicamente: Se aprecian a simple vista, por ejemplo, el granito es una mezcla heterogénea, en el que se pueden distinguir cuarzo, feldespato y mica. Cada fase presentan distintas propiedades, correspondientes a cada sustancia. Son las mezclas heterogéneas macroscópicas. Microscópicamente : Para poder observar las diferencias entre fases, se debe recurrir a herramientas ópticas como la lupa, el microscopio óptico o el ultramicroscopio. Son las denominadas mezclas heterogéneas microscópicas o coloidales. (Ej.: Leche, tinta china) B) No observables : ni aún con el más potente microscopio se pueden observar las distintas fases constituyentes. Esto corresponde al caso de las soluciones, en el cual el soluto, disuelto en el solvente, no 4 puede ser observado por ningún instrumento. Su clasificación corresponde a los sistemas HOMOGENEOS. En un sistema homogéneo, puede haber sustancias puras o mezclas que presentan una sola fase Una sustancia es pura cuando posee un solo tipo de moléculas: agua pura, alcohol absoluto, benceno, ácido nítrico, etc. En estos casos, son sustancias puras moleculares, ya que sus partículas están formadas por más de un tipo de átomo. El cobre, hidrógeno, plata, hierro, son sustancias puras, pero en este caso elementales, ya que están formados por un sólo tipo de átomos. Sistemas Homogéneos Un sistema es Homogéneo cuando presenta una sola fase, ya que sus propiedades son idénticas en todos los puntos del sistema. Un sistema homogéneo se presenta con iguales propiedades en todos sus puntos (una sola fase). Si observamos un recipiente con agua, esta es homogénea , ya que sus propiedades intensivas son idénticas en cada punto del sistema: presenta una sola fase. Si al agua, le agregamos sal, ésta se disuelve y constituye agua salada, también homogénea, con una sola fase. Todos los puntos del sistema resultan iguales. En el primer caso se trata de una sola sustancia ( agua) y en el segundo, de dos (agua y sal) En el primer caso hablamos de sustancia pura y en el segundo de solución. Si en lugar de agua, observamos un recipiente con mercurio, también estamos frente a un sistema homogéneo constituido por una sustancia pura. En el caso del agua, se trata de una sustancia pura compuesta, ya que su molécula posee átomos de hidrógeno y de oxígeno; el mercurio en cambio, es homogéneo y sustancia pura simple, ya que posee exclusivamente átomos de mercurio En síntesis, se puede expresar que cuando el sistema material es homogéneo a simple vista, con microscopio óptico y aún con ultramicroscopio(se observa una sola fase), puede ser A: B: C: sustancia pura simple; una sola sustancia – átomos iguales - (Mercurio) sustancia pura compuesta – moléculas iguales – (Agua) solución: más de un tipo de moléculas ( agua salda) Sistemas Inhomogéneos: Se trata de sistemas materiales que presentan una modificación gradual y paulatina de sus propiedades, bajo la conformación de un matiz. A simple vista pueden pasar inadvertidamente como de naturaleza homogénea, pero al estudiar sus propiedades, se puede apreciar su carácter gradual. Ejemplos de estos sistemas lo constituye la atmósfera: a simple vista parece homogénea, pero la mezcla gaseosa se va modificando al variar la altura. Los sistemas con gradiente de concentración, constituyen otro claro ejemplo de estos sistemas. Los sistemas dispersos son heterogéneos y están formados por partículas pequeñas de una sustancia (fase dispersa) distribuida uniformemente en el seno de otra sustancia (fase dispersante). 5 Dispersión Fase Dispersante Fase Dispersa Tinta china Agua Negro de humo Niebla Aire Agua Arcilla en agua Agua Arcilla Sistemas Coloidales Son sistemas heterogéneos cuya fase dispersa posee un tamaño muy pequeño (0,1 μ > p > 0,001 μ) y que solo son visibles al ultramicroscopio. Las partículas de la fase dispersa se denominan micelas. Los sistemas coloidales son importantes por sus propiedades físico-químicas y biológicas. Participan activamente en los sistemas biológicos, merced a sus actividades eléctricas, mecánicas y ópticas. Ejemplos: gelatina, agar, clara de huevo en agua, citoplasma de una célula. Los sistemas coloidales pueden hallarse en dos estados: Estado micelar sol: se forma cuando las micelas están dispersas en suficiente cantidad de dispersante. Estado micelar gel: se produce cuando las micelas interaccionan entre sí como consecuencia de la precipitación, coagulación o desecación, lo que produce el acercamiento de esas micelas. En síntesis, resulta adecuado integrar los sistemas materiales, según la siguiente clasificación. Nota: véase la diferencia entre FASE y COMPONENTE. Que un sistema contenga más de un componente NO significa que sea un sistema heterogéneo, así lo comprobamos por ejemplo con el agua salada que forma una solución compuesta por agua y sal (dos componentes) pero sin dejar de ser un sistema homogéneo, una sola fase.