IED SAN JOSÉ DE CASTILLA.
“UN CAMINO PARA LA CONVIVENCIA Y LA COMUNICACIÓN EN RED CON EL MUNDO”
AREA CIENCIAS NATURALES Y EDUCACION AMBIENTAL J. M Docente Stella Vásquez Ávila
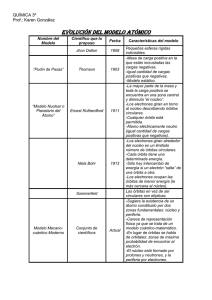
ESTRUCTURA DEL ATOMO; SU DESARROLLO HISTORICO. Tercera parte.
Arnold Sommerfeld, 1919 modifico el modelo de N. Bohr y represento el
átomo con un núcleo alrededor del cual existen niveles y subniveles
energéticos circulares y elípticos, estos últimos propuestos para explicar las
anteposiciones de las líneas espectrales, que se observaban al estudiar los
espectros discretos de algunos elementos.
Intentando paliar los dos principales defectos del modelo de Bohr eso introdujo dos modificaciones
básicas: Órbitas casi-elípticas para los electrones y velocidades relativistas. En el modelo de Bohr
los electrones sólo giraban en órbitas circulares. La excentricidad de la órbita dio lugar a un
nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se lo
representa con la letra l y toma valores que van desde 0 hasta n-1. Las órbitas son:
l = 0 se denominarían posteriormente orbitales s o sharp
l = 1 se denominarían p o principal.
l = 2 se denominarían d o diffuse.
l = 3 se denominarían f o fundamental.
Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postuló que
el núcleo del átomo no permanece inmóvil, sino que tanto el núcleo como el electrón se mueven
alrededor del centro de masas del sistema, que estará situado muy próximo al núcleo al tener este
una masa varios miles de veces superior a la masa del electrón.
Para explicar el desdoblamiento de las líneas espectrales, observando al
emplear espectroscopios de mejor calidad, Sommerfeld supuso que las órbitas del electrón pueden
ser circulares y elípticas. Introdujo el número cuántico secundario o azimutal, en la actualidad
llamado l, que tiene los valores 0, 1, 2,…(n-1), e indica el momento angular del electrón en la órbita
en unidades de
, determinando los subniveles de energía en cada nivel cuántico y la
excentricidad de la órbita. Apoyado en la teoría de la relatividad de Albert Einstein, hizo las
siguientes modificaciones al modelo de Bohr:
1. Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
2. A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel.
3. El electrón es una corriente eléctrica minúscula.
En consecuencia, el modelo atómico de Sommerfeld es una generalización del modelo atómico de
Bohr desde el punto de vista relativista, aunque no pudo demostrar las formas de emisión de las
órbitas elípticas, solo descartó su forma circular.
IED SAN JOSÉ DE CASTILLA.
“UN CAMINO PARA LA CONVIVENCIA Y LA COMUNICACIÓN EN RED CON EL MUNDO”
AREA CIENCIAS NATURALES Y EDUCACION AMBIENTAL J. M Docente Stella Vásquez Ávila
Louis de Broglie: en 1923, estableció un paralelismo entre la concepción
ondulatoria de la luz y la estructura a de la materia, considero a los electrones
y demás partículas en movimiento dotados de propiedades, como si cada
partícula, al moverse, presentara un carácter ondulatorio.
Dirac y Jordan, al igual que Erwin Schoroedinger, 1926, elaboraron un modelo
atomico incorporando una ecuacion matematica, el principio de insertidumbre de Heisenber y la
concepcion del electron como una onda estacionaria.
Hoy día este es elmodelo con más exactitud. Ya que describela distribucion de los electrones
alrededor del nucleo. Para tal efcto, propusieron la existencia de regiones en el espacio, con
energias definidas, en las cuales es más probable encontrar los electrones. A estas regiones se les
conoce como orbitales atomicos.
ACTIVIDAD. Analiza y responde la siguiente rejilla.
1
2
d
4
5
10 e-
7
3
orbita
2 e6
s
8
6 e9
n
Pauli
p
a. ¿En qué casilla se presenta la letra que representa un subnivel de forma esférica?
b. Relaciona con una frase, la información de las casillas 3 y 8.
c. ¿en qué casilla se encuentra el máximo número de electrones que puede tener el subnivel
de la casilla 5?
d. ¿Cuántas y cuáles son las orientaciones que puede tomar el subnivel enunciado en la
casilla 9?
e. Relaciona la información de las casillas 1 y 4 con una frase
f. ¿En qué casilla se encuentra el nombre del espacio alrededor del núcleo donde es más
probable encontrar un electrón?