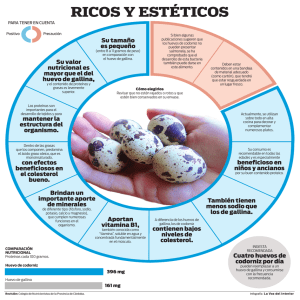
COMPARATIVO DEL CONTENIDO DE COLESTEROL OK
Anuncio

Ley N° 30035 Ley que regula el Repositorio Nacional Digital de Ciencia, Tecnología e Innovación de Acceso Abierto UNIVERSIDAD NACIONAL JOSÉ FAUSTINO SÁNCHEZ CARRIÓN FACULTAD DE INGENIERÍA AGRARIA, INDUSTRIAS ALIMENTARIAS Y AMBIENTAL ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ZOOTECNICA “Comparativo del contenido de Colesterol y Triglicéridos del Huevo de Gallina Negra Huachana con la Gallina Comercial Hy-Line” TESIS Para optar el título profesional de INGENIERO ZOOTECNISTA PRESENTADO POR EL BACHILLER: ADOLFO RAFAEL BLAS HUACHO - PERÚ 2012 UNIVERSIDAD NACIONAL JOSÉ FAUSTINO SÁNCHEZ CARRIÓN FACULTAD DE INGENIERÍA AGRARIA, INDUSTRIAS ALIMENTARIAS Y AMBIENTAL ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ZOOTECNICA “Comparativo del contenido de Colesterol y Triglicéridos del Huevo de Gallina Negra Huachana con la Gallina Comercial Hy-Line” TESIS Para optar título profesional de: INGENIERO ZOOTECNISTA PRESENTADO POR EL BACHILLER: ADOLFO RAFAEL BLAS PRESIDENTE ________________________________ Mg. Carlomagno R. Velásquez Vergara SECRETARIO ________________________________ M.V. Oscar S. Torres Mejía VOCAL ________________________________ Blgo. Huberto W. Noriega Córdova ASESOR ________________________________ Dr. Jaime F. Vega Vilca AGRADECIMIENTO Agradezco Dr. Q.F. Zoila Honorio Durand, por facilitar el laboratorio de Bromatología y Nutrición de la UNJFSC para la realización de este trabajo y especialmente por su sugerencia en el procedimiento del análisis para la realización de las pruebas. Al Dr. Jaime Vega Vilca, por su apoyo en las diferentes etapas de desarrollo de este trabajo. Al Mg. Carlomagno Velásquez Vergara, por su amistad, y sobre todo, por compartir sus conocimientos conmigo e interés siempre presentes. A la Escuela Profesional de Zootecnia por las facilidades otorgadas para el uso de las instalaciones de la Granja Experimental de Aves (GEA) de la Universidad Nacional José Faustino Sánchez Carrión (UNJFSC). A todas aquellas personas que de alguna u otra forma estuvieron conmigo y contribuyeron a la culminación de este trabajo, a todos ellos muchas gracias. i INDICE AGRADECIMIENTO .................................................................................................... i LISTA DE CUADROS ................................................................................................ iv LISTA DE FIGURAS .................................................................................................. iv LISTA DE GRAFICOS ................................................................................................ v RESUMEN ................................................................................................................. vi I.- INTRODUCCIÓN ................................................................................................ 1 II.- REVISION DE LITERATURA ............................................................................. 2 2.1.- Generalidades .............................................................................................. 2 2.2.- La gallina criolla............................................................................................ 3 2.3.- Características de la gallina criolla ............................................................... 4 2.3.1. Características generales ..................................................................... 4 2.3.2. Características reproductivas y productivas ......................................... 6 2.4.- Características de la Gallina Hy-Line ........................................................... 8 2.4.1. Características generales ..................................................................... 8 2.4.2. Características reproductivas y productivas ......................................... 9 2.5.- Requerimientos nutricionales de la gallina ................................................. 10 2.5.1. Proteínas y aminoácidos .................................................................... 10 2.5.2. Energía ............................................................................................... 11 2.5.3. Minerales ............................................................................................ 13 2.6.- El huevo ..................................................................................................... 14 2.6.1. Proceso de Formación ...................................................................... 14 2.6.2. Composición química de los componentes del huevo de gallina de postura comercial .......................................................... 17 2.7.- El colesterol ................................................................................................ 19 2.7.1. El colesterol y el riesgo cardiovascular ............................................... 20 2.7.2. Mitos sobre el colesterol ..................................................................... 22 2.7.3. Niveles a considerar en el consumo de colesterol.............................. 23 2.7.4. Ensayos realizados para reducir colesterol en el huevo ..................... 24 2.8.- Triglicéridos ................................................................................................ 26 2.8.1. Asociación de triglicéridos con el colesterol ....................................... 27 ii 2.8.2. Factores de riesgo para altos niveles de triglicéridos ......................... 27 2.9.- La muda en la gallina ponedora ................................................................ 28 III.- MATERIALES Y METODOS ....................................................................... 31 3.1.-Materiales .................................................................................................... 31 3.1.1. Lugar de ejecución y análisis.............................................................. 31 3.1.2. Material biológico experimental .......................................................... 31 3.1.3. Material de laboratorio ........................................................................ 32 3.1.4. Equipos .............................................................................................. 32 3.2.- Métodos...................................................................................................... 33 3.2.1. Procedimiento de la muda .................................................................. 33 3.2.2. Procedimiento y análisis de los huevos .............................................. 33 A. Recolección de los huevos .............................................................. 33 B. Procesamiento de las muestras ...................................................... 34 C. Cuantificación de colesterol y triglicéridos ....................................... 35 3.3.- Manejo de los animales .............................................................................. 36 A. Instalaciones ............................................................................................ 36 B. Alimentación ............................................................................................. 36 3.4.- Variables en estudio ................................................................................... 37 A. Variable independientes ........................................................................... 37 B. Variable dependientes.............................................................................. 37 3.5.- Parámetros a evaluar ................................................................................. 38 3.6.- Distribución de los tratamientos ................................................................. 38 3.7.- Evaluación estadística ............................................................................... 39 IV.- RESULTADO Y DISCUSION ......................................................................... 40 4.1.Colesterol .................................................................................................... 40 4.2. Triglicéridos ................................................................................................ 42 V.- CONCLUSIONES ............................................................................................... 45 VI.- RECOMENDACIONES ...................................................................................... 46 VII.- BIBLIOGRAFÍA ................................................................................................ 47 VIII.- ANEXOS ......................................................................................................... 56 iii LISTA DE CUADROS Cuadro 01. Composición química del huevo 18 Cuadro 02. Composición de los lípidos del huevo 19 Cuadro 03. Composición porcentual de insumos usados en la ración 37 Cuadro 04. Distribución de los tratamientos 38 Cuadro 06. Contenido de colesterol de la yema de huevo (mg/g) 41 Cuadro 07. Contenido de triglicéridos de la yema de huevo (g) 43 LISTA DE FIGURAS Figura 01. Diagrama de selección 9 Figura 02. Proceso de formación del huevo 16 Figura 03. Estructura del colesterol 20 Figura 04. Estructura del triglicérido 26 Figura 05. Mecanismo endocrino del proceso de muda 30 Figura 06. Material biológico en estudio 60 Figura 07. Muestras de yema de huevo 61 iv Figura 08. Crecimiento de nuevas plumas luego de la muda en la Gallina Negra Huachana 62 Figura 09. Crecimiento de nuevas plumas luego de la muda en la Gallina Comercial Hy-Line 62 INDICE DE GRAFICOS Grafico 01. Variación promedio del colesterol 40 Grafico 02. Variación promedio de triglicéridos 43 v RESUMEN La presente investigación se realizó en la Granja Experimental de Aves de la Escuela Académico Profesional de Zootecnia, con el objetivo de evaluar el contenido de colesterol y triglicéridos en la yema de huevo de la Gallina Comercial Hy-Line (T1) y compararlos con los de la Gallina Negra Huachana (T2); durante los meses de Enero a Mayo del 2009. Los datos se evaluaron mediante un diseño de bloques completamente al azar (DBCA). Se encontró diferencias significativas (P<0.05) entre el contenido de colesterol entre los tratamientos T1 y T2 (17.39 ± 0.29 mg/g vs 15.58 ± 0.29 mg/g) respectivamente. No se encontraron diferencias (P>0.05) entre los tratamientos T1 y T2 en el contenido de triglicéridos (5.857 ± 0.1314 g vs 5.918 ± 0.1314 g) respectivamente. Se concluye que los huevos de Gallina Negra Huachana presentaron un contenido similar de triglicéridos pero diferente en el contenido de colesterol en comparación a los huevos de Gallina Comercial Hy-Line. Palabras Clave: Huevo de gallina negra huachana, huevo comercial, triglicéridos, colesterol vi I. INTRODUCCIÓN En las zonas rurales de nuestro país, principalmente en la campiña de la provincia de Huaura; existen crianzas a nivel extensivo con baja o nula tecnología de diversos animales criollos, entre estos encontramos aves de corral de gran rusticidad y de bajo nivel productivo. Dentro de la gran variedad de gallinas, encontramos a aquellas que producen huevos de color blanco, marrón y verde. De estas aves, destacan la gallina criolla negra huachana de huevos verdes que representa el patrimonio cultural de la región y del Perú. Este recurso zoogenético el cual debe ser revalorado para así evitar que se pueda ir perdiendo, sino lo conservamos y aprovechamos. Las familias de pequeños y medianos productores tiene la posibilidad incrementar sus ingresos dado que el huevo verde de Gallina Negra Huachana se comercializa al doble de precio en relación al huevo comercial. En la actualidad existe escasa información publicaciones y reportes sobre el contenido lipídico en el huevo de gallinas criollas así como su comparación con el huevo de las gallinas comerciales de colesterol y triglicéridos. El objetivo del presente estudio fue determinar el contenido de colesterol y triglicéridos en los huevos de gallinas negras Huachanas (verde) y gallinas comerciales Hy-Line (marrón). 1 II. REVISIÓN BIBLIOGRAFICA 2.1 - GENERALIDADES La avicultura es una rama de la zootecnia que se encarga de la cría, mejora y explotación de las aves en general (Oteiza y Carmona 1985). En la actualidad tiene mucha importancia debido a que ha sobrepasado en desarrollo industrial a casi todas las otras especies, por lo que ocupa un lugar preferencial en todo el mundo. De igual modo en nuestro país se ha convertido en una industria desarrollada y organizada. Éste logro se debe al incremento masivo en el consumo de huevos y carne, siendo las fuentes proteicas más asequibles en la población (Zunino, 1999). El consumo del huevo de gallina negra huachana se ha incremento en su consumo, por las peculiares características del huevo y el sabor agradable. Siguiendo con la tendencia del consumo de alimentos naturales, este tipo de alimento tiene un gran atractivo en los mercados por lo que es posible esperar un incremento en la demanda, que favorecerá la consolidación y el incremento de su crianza de granjas familiares y despertar el interés por parte de los productores avícolas. 2 2.2 .- LA GALLINA CRIOLLA La primera llamada de la FAO recomendando la preservación de los recursos genéticos de los animales autóctonos se registra en 1974. Esto debido a la importancia de estos recursos desde la perspectiva científica, económico-productiva y cultural (FAO, 2002). Según Castro y Chavarría (1996), en la actualidad este término comprende a todas las gallinas de diferentes razas y tipos que se crían libres en el patio y que las familias campesinas las han clasificado por el aspecto del plumaje y tamaño. Las líneas impuestas por el programa global de la FAO para la conservación de los recursos autóctonas de aves están sensibilizando a toda América Latina en pro de la conservación de su propio patrimonio zoogenético (Sierra y col., 1998). Esto ha sido denunciado por esta misma organización; a través de la Lista Mundial de Vigilancia publicada en el año 2000. Según esa lista, 1.350 de las 6.300 razas registradas corren peligro de extinción o ya se han extinguido (Beate, 1997). El cambio climático, la presencia de enfermedades pecuarias nuevas y los cambios de cambios de factores socioeconómicos destacan la importancia de mantener la capacidad de adaptar nuestros sistemas de producción agrícola. Mantener esta diversidad genética de la aves es la llave que puede permitir a futuras generaciones, seleccionar las razas y/o desarrollar nuevas para hacer frente a situaciones de emergencia (FAO, 2002). 3 Globalmente, las gallinas domésticas aportan más proteínas (huevos y carne) en la alimentación humana que cualquier otra de las especies animales y sin embargo, el conocimiento de los recursos genéticos de estas aves es fragmentario y lejos del disponible en otras especies de ganado, particularmente los bovinos y los ovinos (Crawford, 1992). 2.3 .- CARACTERÍSTICAS DE LA GALLINA CRIOLLA 2.3.1. Características generales Las gallinas criollas, por definición, son aquellas propias del lugar donde han desarrollado sus características para su supervivencia y adaptación, se clasifican como semipesadas ya que no corresponden al patrón de las aves de postura ni de engorde (Segura y López, 1994). Según Castro y Chavarría (1996) en la actualidad este término comprende a todas las gallinas de diferentes razas y tipos que se crían libres en el patio y que las familias campesinas las han clasificado por el aspecto del plumaje y tamaño. Estas características le confieren una gran importancia para la economía familiar en el medio rural (Juárez y col., 2000). Las gallinas son estrictamente diurnas, gregarias y polígamas. El color del plumaje de las diversas aves de corral puede ser blanco, gris, amarillo, azul, rojo, castaño y negro. Por lo que se refiere a su tamaño y forma, las diferentes razas muestran gran diversidad (Mendiola, 2002). 4 La forma de cresta, color de tarsos, presentación de plumaje, constituye una garantía de que las aves conservan un estado de pureza de raza aceptable, esto da lugar a la aparición de programas de conservación, definición, caracterización y mejora genética de las razas de gallinas criollas nativas (Barrantes, 2008). Según sea el objetivo o características considerados mientras que el fenotipo es la expresión que manifiesta cierto genotipo frente a un ambiente dado (Orozco, 1991). En Brasil en 1940, en la ciudad de Sao Paulo, la familia Bianchi formo un plantel con 11 razas de aves criollas (entre ellas la carajo y la rajada ), y con un intenso mejoramiento genético se logró la ponedora criolla Brasilera “Rubro Negra”, con características de producción y eficiencia alimentaria superior a la gallina criolla de patio. Con características típicas del huevo como la yema rojiza, variedad de colores de cáscara, formas y tamaño. En 1976, en Cataluña investigaciones (España), en se razas inició la autóctonas conservación como la e Prat, Pendescencia y Emporanesa, y desde el 1983, se ofrece un paquete de producción de aves de carne (con estas razas), obteniéndose un ave de carne de 2.1 kg a las siete semanas (Segura-Correa, 1989). Por otra parte Soto (2002) menciona que en la provincia de Villa Clara (Cuba), se vienen realizando investigaciones para determinar características morfológicas cualitativas y cuantitativas del exterior (colores de plumaje oscuros), logrando pesos de machos de 2 a 4 kg y la hembra con pesos de 1.250 a 2.050 kg. 5 En el valle del Cauca (Colombia), se evaluaron caracteres productivos y reproductivos en diversos tipos genéticos como el Tufus, Tapuncho, Carioco y Chusco, nacidos mediante dos sistemas de incubación (natural y artificial), logrando a las 12 semanas de edad, una ganancia de peso/día de 184 g para los machos, y de 129 g para las hembras, así mismo se determinó la madurez sexual a las 24 semanas de edad, con una producción de 40 huevos por año (de 25 a 75 huevos/año), con periodos de cloquera (64 a 80 días) en promedio de 71 días (Rodríguez y col., 1996). Según Cerdán (2001) en Chile entre los años 1914 y 1915 fue vista, por Salvador Castelló, una gallina que “da huevos de color azul o azul-verdoso”. Sin embargo, desconocía en un principio, que el dueño de esas gallinas había obtenido aquellos y otros muchos ejemplares, uniendo dos tipos de gallinas chilenas (colloncas o francolina y quetros). Esta gallina fue oficialmente presentada en el Primer Congreso Mundial de Avicultura celebrado en La Haya como Gallus inauris Castelloi o comúnmente como Gallina Araucana (Castelló, 1924). 2.3.2. Características Reproductivas y Productivas Debido a los pocos trabajos de investigación realizados, sobre la explotación de esta especie en condiciones extensivas, se posee poca información en la producción y manejo de las gallinas criollas. Como consecuencia es normal observar: altos índices de mortalidad, bajas tasas de postura, bajos índices de producción de huevo y de reproducción, así 6 como también una alta consanguinidad en los animales (Juárez y Ortiz, 2001; Corrales y Gámez, 2008 y Barrantes, 2008). La mayoría de los estudios realizados acerca de las aves criollas, son descriptivos (Juárez y Ortiz, 2001). Recientemente Jerez y col. (2009) en un sistema de producción de traspatio, donde no se evalúa con rigurosidad el desarrollo de los distintos órganos, se alcanzó la madurez sexual en promedio a las 24 semanas de edad a las gallinas negras, 25 semanas a las gallinas rojas, 27 semanas a los de cuellos desnudos y 36 semanas de edad a las gallinas multicolores, por estar de bajo peso corporal; teniendo un sistema alimenticio basado en maíz, trigo y alfalfa; y para la gallinas criollas en general se determinó a 28 y 30 semanas en las mismas condiciones de producción, con un sistema alimenticio en base a maíz y pastoreo (Vignon y Santiago, 1996; Juárez y Pérez, 2003). Rodríguez Da Silva citado por Mendiola. (2002) manifiestan que los primeros huevos son pequeños y de escasa capacidad fecundante, mientras que después de 1518 días de iniciada la puesta, los huevos adquieren un tamaño normal y se encuentran aptos para ser incubados. Después de que las hembras ponen su primer huevo, es necesario aguardar 15 días antes de iniciar el apareamiento. Se recomienda seleccionar a las hembras que ponen más de 25 huevos por mes. En investigaciones de gallinas criollas la producción varia de 0.9 a 2.8 huevos/ave/semana, se evaluaron diferentes genotipos como gallinas rojas, negras cuello desnudo y 7 multicolores (Vignon y Santiago 1996; Juárez y Pérez, 2003; Jerez y col., 2009) y en trabajos de gallinas camperas se reportaron 4.93 a 5.74 huevos/ave/semana (Juárez, 1995; Pampin y Esperanza, 2000; Godinez y col., 2006; SeguraCorrea, 2007). Resultados obtenidos por Castro y Chavarría, (1996) señalan que el porcentaje de producción es muy variable y durante el año generalmente ponen más en verano que en el invierno. En la época de verano el porcentaje de producción osciló entre 20.17 a 34.86% y su promedio de 28.72% de producción, y en invierno el porcentaje de producción osciló entre 16.84 a 36.91% y su promedio de 26.76% .En relación al porcentaje de postura, Sánchez (2009) manifiesto que luego de una muda se obtuvo 26.23 a 42.21 % en gallinas negras huachanas con 2 a 3 años de edad. 2.4.- CARACTERISTICAS DE LA GALLINA HY-LINE 2.4.1. CARACTERÍSTICAS GENERALES Las principales aves reproductoras que dieron origen a las gallinas de postura fueron de la raza Rhode Island Rojo y Leghorn Blanca; como resultado de las cruzas su descendencia alcanzó un alto potencial para la producción de huevos, al igual que una excelente capacidad para adaptarse a diversos ambientes (Mendiola, 2002). Tal como se muestra en la figura 01. 8 FIGURA 01. DIAGRAMA DE SELECCIÓN Fuente: Isa Internacional (2007) 2.4.2. Características Reproductivas y Productivas En las gallinas sólo el ovario izquierdo es activo, pues el derecho está atrofiado. Ocupan en el cuerpo una posición casi idéntica a la de las glándulas testiculares en el gallo, más exactamente delante del riñón derecho. En pollas jóvenes parece un racimo de globitos grises (óvulos) de distintos tamaños, pero cuando estos evolucionan en la madurez se hacen amarillos. Durante la maduración del óvulo, el núcleo de éste se hincha, constituyendo la vesícula germinativa, mientras que el protoplasma forma la masa vitelina. Sucede la 9 caída del óvulo en la trompa por rotura de su membrana de envoltura o más exactamente por rotura del estigma de esa membrana. Esto es lo que se llama "puesta interna del huevo" que acontece 24 horas antes de la salida real del huevo al exterior (Magaldi, 1995). El primer huevo fértil es puesto dentro de las 28 a 76 horas después de la unión sexual. Como promedio 53 horas, se consideran aceptables aquellos huevos después de tres días post fecundación. El último huevo fértil es puesto entre once a dieciocho días, después de la unión sexual. En la práctica se considera como promedio los 15 días. El número de huevos fértiles que se obtiene con una sola unión sexual es de 5 a 11, y como promedio 8 (Magaldi, 1995). Las líneas comerciales de postura (aves livianas), con alimentación balanceada alcanzan la madurez sexual entre 17 y 18 semanas de edad (Hy-Line Internacional, 2007). Existen mejores producciones de huevos en líneas comerciales de postura los cuales varían entre 6.5 a 6.7 huevos/ave/semanas (Hy-Line Internacional, 2007; Isa Internacional, 2007) 2.5.- REQUERIMIENTOS NUTRICIONALES DE LA GALLINAS 2.5.1. Proteínas y aminoácidos Las necesidades de las proteínas y aminoácidos de las gallinas ponedoras al igual que las aves en crecimiento, suelen expresarse como concentración en la ración; estas dependen fundamentalmente del contenido en energía de la 10 ración, la relación energía/proteína es importante en la eficiencia de utilización de la ración (Rojas, 1979; García y col., 2004). En las gallinas ponedoras los requerimientos en aminoácidos son relativamente altos, lo que guarda relación con el hecho de que la proteína del huevo encabeza a la de todas las proteínas por su composición en aminoácidos, si la ingestión de proteína se reduce por debajo del nivel necesario o un determinado aminoácido se hace limitante la composición en aminoácidos de los huevos no cambia, pero la cantidad total de huevos puestos y la eficiencia de la ración se reduce (Buxade, 1987; Bondi, 1989). Asimismo (Bondi,1989; Keshavarz y Nakajima, 1995), determinaron que si se suplementan a las gallinas ponedoras con raciones bajas en proteína con aminoácidos (metionina, lisina, triptófano e isoleucina), se mejoran la eficiencia alimentaria, el tamaño de huevos y la producción de huevos desde 68 a 74%, el aumento en el contenido de metionina en los típicas raciones a base de maíz-soya mejoró la conversión alimenticia; sin embargo el exceso en la ración de uno o más aminoácidos esenciales puede tener efectos perjudiciales sobre los rendimientos. 2.5.2. Energía Según la NRC (1994) indica que la energía no es un nutriente, puesto que este proviene de la oxidación de los nutrientes en el metabolismo. El consumo de energía puede variar con la edad del animal, etapa de producción y con la temperatura ambiental. 11 El nivel energético constituye el aspecto más importante en la formulación de dietas para aves y es que determina el consumo de alimento, siendo menor cuando el contenido de energía es alto, y mayor cuando es bajo (North y Bell, 1993). El requerimiento diario de energía por ave, varía según el peso corporal del ave, temperatura ambiental, actividad del ave, variaciones en la producción del huevo, tamaño del huevo, edad y cobertura de plumas (Shimada, 1993). Un incremento en el nivel de energía de la dieta por encima del requerimiento del animal, no solo puede ocasionar la disminución del consumo de alimento, sino también el déficit de proteínas, aminoácidos, minerales y vitaminas contenidas en el huevo, ya que se calculan a partir del consumo de alimento esperado y debido a que no se incrementa la densidad de los mismos en la dieta (Rojas, 1979). La eficiencia de utilización de la energía para producción de huevos habría de mejorar con incrementos de energía en la dieta, es decir, menor consumo de alimento para una mayor producción (Grobas y Mateos, 1999) En un estudio en gallinas ponedoras para comparar el efecto del consumo diario de energía, utilizando niveles bajos, intermedios y altos de energía en la dieta (de 2.5 a 3.0 Mcal de EM/Kg), no se observaron incrementos en la producción, peso o masa de huevo producida con ninguno de los niveles de energía utilizados, así como lo indican Grobas y Mateos (1999), los cuales concuerdan usando los mismos niveles con (Leeson y Summers, 1989; Keshavarz y Nakajima, 1995 y 12 García y col., 2004). Sin embargo, al emplear grasa para incrementar el nivel energético, puede confundir los efectos de la misma con los del incremento de la energía (Zhang y col., 1993). 2.5.3. Minerales En dietas para gallinas se debe prestar atención a: Calcio, Fósforo, Sodio, Cloro, Yodo, Manganeso y Zinc; el calcio se debe complementar en forma de carbonato de calcio o piedra caliza. En general, el valor de estas fuentes es similar. Algunas otras fuentes de calcio contienen fósforo, como las harinas de hueso y las rocas fosfóricas. Otros ingredientes que son fuentes importantes de calcio y fósforo en las dietas cuando se emplean en la formulación, lo constituyen las harinas de pescado y las harinas de carne y hueso (Ávila, 1997). La formación de una cáscara que contiene 2.0 a 2.2 g de calcio requiere la ingestión de 3.5 a 4.0 g de calcio, ya que la absorción es del 50 a 60%. El consumo voluntario de alimentos es aproximadamente 25% mayor los días en que se forma el huevo que los días en que no se forma. La cascara contiene pequeñas cantidades de fósforo: 20 mg en comparación con los 120 mg del huevo. Estas necesidades, así como las correspondientes a numerosas funciones pueden cubrirse con niveles muy bajos de fósforo en la ración (aproximadamente 0.3 g de fósforo al día). Los niveles excesivos de fósforo dan lugar a una reducción en el grosor de la cascara, ya que parece que los iones fosfato ejercen un 13 efecto inhibidor sobre la precipitación del fosfato cálcico (Bondi, 1989). El sodio y el cloro se proporcionan en forma de sal común, siendo el nivel más común de complementación entre 0.4 y 0.5%. Los minerales traza como el manganeso se suplementan en la forma de sulfato u óxido y el zinc en forma de carbonato u óxido de zinc; el yodo como yoduro de potasio, en caso de que el hierro y el cobre requieran ser complementados, se harán en forma de sulfato o cloruro, cuya disponibilidad para el ave es mucho mayor, de ser necesario, también, el selenio se adiciona como el selenito de sodio (Avila, 1997). 2.6.- EL HUEVO Del latín Ovum. Es un cuerpo redondeado, de diferente tamaño y dureza, que producen las hembras de las aves o de otras especies animales, y que contiene el germen del embrión y las sustancias destinadas a su nutrición durante la incubación (Oteiza y Carmona 1985). 2.6.1. Proceso de Formación El fenómeno de formación del huevo entraña el transporte de grandes cantidades de material a través de innumerables membranas biológicas y la formación de sustancias nuevas en particular proteínas y lípidos específicos (Hafez, 1993, citado por Mendiola, 2002). El huevo necesita unas 25 horas para atravesar el oviducto, durante este trayecto, el infundíbulo, mágnum, istmo 14 y el útero contribuyen distintamente a la composición del huevo, mientras que la vagina actúa esencialmente como un conducto. El huevo en desarrollo tarda unos 20 minutos en atravesar el infundíbulo, en el magnun su velocidad media es de unos 2 mm/min; por lo tanto tarda unas 3 horas (Sisson y Grossman, 1990; Sauveur y De Riviers, 1992). La entrada del huevo en el istmo se hace gradualmente, después de que ingresa, hay una pausa y luego continúa a 1.4 milímetros por minutos, el tiempo total para atravesarla es de 75 minutos. En él se forma la membrana cascarógena adicionando también proteínas y agua al albumen. Unas 20 horas de su tiempo total en el oviducto (cerca de 26 horas) las pasa en el útero; la función aquí es la de la formación de cáscara el paso a través de la vagina es de unos cuantos segundos (Sisson y Grossman, 1990). Es este segmento que actúa como reflejo para que ocurra la ovoposición. Además tiene una sección (unión utero-vaginal) el cual sirve de almacenamiento de esperma, viables por unos 10 días (Sauveur y De Riviers, 1992). El proceso de formación del huevo, aún dentro de su complejidad, sigue el siguiente detalle de la figura 02. 15 FIGURA 02. PROCESO DE FORMACIÓN DEL HUEVO Fuente: Adaptado de Sauveur y De Riviers (1992) 16 2.6.2. Composición química de los componentes del huevo de gallina de postura comercial La distribución de la proteína en las distintas fracciones del huevo es la siguiente: 12.8% en término promedio en el huevo, 41.9% de la misma en la yema, 53.6% en el albumen, 2.1% en las membranas de la cascara (interna y externa) y 2.4% en la cascara (Bondi, 1989). El huevo de gallina sin cáscara contiene 74,4% de agua y se pone a dos de los principales nutrientes: proteínas (12,3%, 6,7 g / huevo, 30% de las necesidades diarias de hombre 100 g huevo comestible) y una cantidad equivalente de grasa 11,9% (Nys y Sauveur, 2004). Además se debe señalar la gran diferencia en el contenido de agua entre la yema y la clara: la clara contiene 88% de agua y la yema 49%. Como se muestran en los cuadros 01 y 02. El huevo de gallina consiste de 57% de clara, 32% de yema y 12% de cascara. La participación relativa de cada componente en proporciones varía dependiendo de la edad de la gallina y, en menor medida, entre los individuos, dependiendo de las condiciones ambientales y las deficiencias nutricionales de la gallina (Sauveur 1988, Burley y Vadehra 1989, Gutiérrez y col., 1997). 17 CUADRO 01. COMPOSICIÓN QUÍMICA DEL HUEVO Componente Total Cascara Albumen Yema Agua 1.6 87 - 89 46.5 - 49.0 74.0 - 75.5 Proteína 3.3 9.5 - 11.5 16.0 - 17.0 12.0 - 12.8 Lípidos - - 33.0 - 34.0 11.8 - 12.3 Saturados - - 11.2 - 11.7 4.3 - 4.5 Insaturados - - 18.2 - 19.0 6.7 - 7.0 - - 1.31 - 1.38 0.47 - 0.50 químico (%) Colesterol comestible Fuente: Grobas y Mateos (1999). Toda la grasa del huevo (6 g por huevo) se encuentran en la yema. Están asociados con las proteínas en la proporción de 2:1. Los lípidos representan entre el 33 y el 35% en peso de yema fresco y el 65% de su materia seca. Los lípidos están constituidos por dos terceras partes de triglicéridos (65%), fosfolípidos (31%) y colesterol (4%). La digestibilidad de los triglicéridos es excelente (98%) y de los fosfolípidos muy satisfactorio (90%). 18 CUADRO Nº 02. COMPOSICIÓN DE LOS LÍPIDOS HUEVOS Entero a Albumen Yema Triglicéridos (g) 4.327 - 4.428 Acidos grasos saturados (g) 1.550 - 1.585 1.905 1.736 0.014 - 1.949 1.776 0.014 0.692 0.574 0.017 0.071 0.002 0.018 213 1.15 0.23 - 0.698 0.587 0.017 0.073 0.002 0.019 213 1.11 0.219 Lípidos Acidos grasos monoinsaturados Total (g) 18:1 Acido oleico (g) 20:1 Acido eicosanoico (g) Ácidos grasos poliinsaturados Total (g) 18:2 Acido linoleico (g) 18: 3 Acido linolenico (g) 20:4 Acido araquidonico (g) 20:5 Acido ecosapentaenoico (g) 22:6 Acido docosahexaenoico (g) Colesterol (mg) Lecitina (g) Cefalina (g) Composición del huevo peso total 58 g (cáscara 8 g; clara 33.4 g; 16.6 g) a: Porción comestible. Fuente: USDA national Nutrient Database for Standard Reference (2008). 2.7.- EL COLESTEROL El colesterol es el principal esterol en los tejidos animales. En la molécula de colesterol se puede distinguir una cabeza polar constituida por el grupo hidroxilo y una cola o porción apolar formada por el carbociclo de núcleos condensados y los sustituyentes alifáticos (son compuestos orgánicos constituidos por carbono e hidrógeno). Como se muestra en la figura Nº 03. 19 El colesterol en el organismo se obtiene de la dieta (exógeno), o bien puede ser sintetizado por el mismo cuerpo (endógeno) (McNamara y Nicolosi, 1999). FIGURA Nº 03. ESTRUCTURA DEL COLESTEROL Fuente: Murray y col. (1997) Las células de todo el cuerpo utilizan colesterol para producir una serie de hormonas importantes e imprescindibles para el crecimiento y la reproducción. El colesterol es el componente vital para la formación de nuevas paredes celulares en diferentes partes del cuerpo. Además, también es un ingrediente esencial de la bilis producida en el hígado, que más adelante pasa al intestino para ayudar a digerir las grasas (Nelson y Cox, 2001). 2.7.1. El colesterol y el riesgo cardiovascular Las enfermedades cardiovasculares son responsables del 31 % del total de muertes a nivel mundial; son la principal causa de mortandad en los países desarrollados y se está convirtiendo en un importante problema de salud pública en los países en desarrollo, llegando a ser la principal causa de 20 muerte en Perú y en otros países como Argentina, Chile, Uruguay, entre otros (World Health Statistics, 2000). Las restricciones en el consumo de huevos y la con sideración de este alimento como “peligroso” por su contenido en colesterol, no están avaladas por los numerosos y exhaustivos estudios científicos realizados en las dos últimas décadas. Para reducir el riesgo cardiovascular, es mucho más importante limitar la ingesta de grasas totales y saturadas, combatir la obesidad y modificar los estilos de vida característicos de sociedades occidentales, especialmente el sedentarismo (Sastre, 2000). Los resultados de los estudios en epidemiología nutricional realizados en los últimos años (con 118.000 varones y mujeres jóvenes sanos), indican la débil elevación del colesterol plasmático con los cambios del colesterol dietético (Ortega y col.,1997). Por otra parte, el estudio de (Kerver y col., 2000); las personas que tomaban más de cuatro huevos por semana tenían cifras inferiores de colesterol sérico que los que consumían uno (o menos) huevos por semana. El efecto del consumo de 3, 7 y 14 huevos semanales después de 5 meses de dieta controlada, no hubo diferencias significativas en el nivel de los lípidos plasmáticos (Vorster y col., 1993). El mismo ensayo llevado a cabo en adultos sanos, con adicción de 2 huevos/día a su dieta habitual, puso de relieve que a las 6 semanas el colesterol HDL había aumentado un 10%, el colesterol total un 4% y la relación colesterol total / HDL-colesterol no se había modificado (Hopkins, 1992). 21 2.7.2. Mitos sobre el colesterol El huevo tiene una enorme riqueza nutricional, y su inclusión en la dieta representa cuantiosos beneficios nutricionales y sanitarios (Ortega y col., 1997). Sin embargo, en la década de los setenta comenzó a extenderse en todo el mundo un exagerado temor al colesterol, por su implicación en el riesgo de padecer enfermedades cardiovasculares. El huevo, como alimento de elevado contenido en colesterol, comenzó a ser desacreditado y su consumo a decrecer considerablemente (Applegate, 1998). Posteriormente, los estudios realizados sobre el tema han puesto de relieve que sólo un 20% de la población responde con elevaciones de colesterol plasmático a ingestas relativamente elevadas de colesterol dietético. Causas genéticas, y otros factores como el tránsito intestinal rápido o lento, el sedentarismo y la obesidad pueden influir también en la modificación de la colesterolemia (Ortega y col., 1997). En un estudio que publicó la revista médica JAMA (Journal of the American Medical Association) donde explica que: ”La reducción del consumo de huevo ha sido ampliamente recomendada para disminuir los niveles de colesterol sanguíneo y prevenir la enfermedad cardíacovascular, pero con este estudio realizado en 117.000 hombres y mujeres llevado a cabo por más de 10 años, no se hallaron evidencias significativas de una asociación total entre el consumo de huevo y el riesgo de enfermedad 22 cardíacovascular o accidente cerebro-vascular ni en hombres ni en mujeres" (Hu y col., 1999). 2.7.3. Niveles a considerar en el consumo de colesterol Una vez en la corriente sanguínea, el colesterol pasa por todo el organismo. El exceso de colesterol sigue circulando por la sangre y puede llegar a alcanzar niveles demasiados elevados. Personas que poseen un alto nivel de colesterol corren un mayor riesgo de sufrir un infarto de miocardio, angina de pecho o trastornos circulatorios. El exceso de colesterol se adhiere paredes de a las las arterias obstruyendo el flujo de la sangre a los diferentes órganos (corazón o cerebro). La cantidad de colesterol dietético no tiene relación clara con los niveles de colesterol en la sangre. En el lumen intestinal se producen de 300 a 500 mg de colesterol, a partir de los productos de origen animal consumidos; mientras que el colesterol biliar aporta diariamente de 800 a 1200 mg (McNamara y Nicolosi, 1999). Las recomendaciones actuales en países desarrollados indican la conveniencia de reducir el consumo de colesterol a menos de 200-250 mg diarios (SerraMajem y col., 1999). Igualmente, Bourges (2001) sugiere que la ingestión diaria de colesterol no sea mayor a 120-130 mg/1000 Kcal en la dieta. El huevo tiene un alto contenido de colesterol, por lo que a muchas personas les preocupa consumirlo, a pesar de su alto valor nutritivo y su bajo precio. 23 Sin embargo, se recomienda a las personas limitar el consumo de huevos debido a su alto colesterol (208 mg/ huevo) contenido (Kritchevsky y Kritchevsky, 2000). Para prevenir debemos reducir la ingesta de una menor cantidad de grasas, especialmente saturadas, ya que son éstas las que el hígado transforma en colesterol (Smith.1998). 2.7.4. Ensayos realizados para reducir colesterol en el huevo Según Salma y col., (2007), sería beneficioso para la salud poder ofrecer un huevo bajo en colesterol y, los esfuerzos de investigación deben ser dirigidas hacia este objetivo. Por lo tanto, varios investigadores están abocados en la tarea de reducir el contenido de colesterol en el huevo, especialmente en la yema, se ha centrado principalmente en la dieta y la intervención farmacológica (Hargis y Wilcox, 1963). Recientemente, se han realizado investigaciones sobre la suplementación de cromo (Uyanik y col., 2002), sulfato de cobre pentahidratado (Pesti y Bakalli, 1998), ajo (Chowdhury y col., 2002) y el tamarindo (Chowdhury y col., 2005) a la dieta de la gallina. Otros han empleado ingredientes naturales como harina de alfalfa (McNaughton, 1978) y harina de cebada (Beyer y Jensen, 1993), pero no detectaron efectos significativos sobre el contenido de colesterol en yema. El ácido orótico usado en gallinas disminuyó el colesterol en el huevo pero también 24 redujo significativamente el peso de las aves (Beyer y Jensen, 1991). Mengue y col. (1974), adicionaron celulosa pura a las dietas para gallinas pero no se detectó disminución en el contenido del colesterol. García y Albalá (1998), observaron que los huevos obtenidos de gallinas alimentadas con harina de pescado y grasas marinas, contienen significativamente menos colesterol, más triglicéridos que aquellos provenientes de gallinas alimentadas solo con productos de origen vegetal; también notaron que se modificó el perfil de los ácidos grasos en el huevo. Algunos han intentado disminuir el colesterol en el huevo a través de fármacos como el Lovastatin (Elkin y Rogler, 1989), Probucol (Waldroup y col., 1986) y Triparonol (Weiss y col., 1967), pero a pesar de que con el empleo de estos productos farmacéuticos las reducciones de colesterol han sido interesantes, tienen poca probabilidad de ser útiles en la producción comercial debido a su elevado costo y a la posibilidad de dejar residuos en el huevo. En las aves, la reducción del colesterol de la yema de huevo es una tarea difícil porque el colesterol regulan casi todo el sistema fisiológico incluyendo la ovoposición, el desarrollo embrionario, el crecimiento, la inmunidad, el desarrollo de huesos, la termorregulación y el comportamiento (Klasing, 1998). 25 2.8.- TRIGLICÉRIDOS Los lípidos más sencillos obtenidos a partir de los ácidos grasos son los triglicéridos, están compuestos de tres ácidos grasos unidos por enlace éster con un glicerol. Recibe el nombre de su estructura química. Tal como se muestra en la figura 04. FIGURA 04 ESTRUCTURA DE UN TRIGLICÉRIDO Fuente: Mahan y Arlin (1995) Luego de comer, el organismo digiere las grasas de los alimentos y libera triglicéridos a la sangre. Estos son transportados a todo el organismo para dar energía o para ser almacenados como grasa. El hígado también produce triglicéridos y cambia algunos a colesterol. El hígado puede cambiar cualquier fuente de exceso de calorías en triglicéridos (Nelson y Cox. 2001). 2.8.1. Asociación de triglicéridos con el colesterol. Cuando la persona come, los triglicéridos se combinan con una proteína en su sangre para formar lo que se llama lipoproteínas de alta y baja densidad. Estas partículas de lipoproteínas contienen colesterol (Berkow, 1994). 26 Para formar triglicéridos en el hígado el proceso es similar; el hígado toma los carbohidratos y proteínas sobrantes de la comida y los cambia a grasa. Esta grasa entonces se combina con proteína y colesterol para formar lipoproteínas de muy baja densidad, que son liberadas al torrente circulatorio (Semenkovich, 2007). 2.8.2. Factores de riesgo para altos niveles de triglicéridos. Según Semenkovich (2007) menciona que puede tener varias causas: Exceso de peso: Aumentan generalmente a medida que aumenta el peso Consumo excesivo de calorías: Se elevan a medida que se aumenta de peso o se ingieren demasiadas calorías, especialmente provenientes de azúcar y del alcohol. El alcohol aumenta la producción de triglicéridos en el hígado. Edad: Los niveles de triglicéridos aumentan regularmente con la edad. Enfermedades: La diabetes, el hipotiroidismo, las enfermedades renales y hepáticas están asociadas con niveles altos de triglicéridos. Entre los grupos que deben vigilar con mayor cuidado su nivel de triglicéridos se encuentran los diabéticos y las mujeres después de la menopausia. Herencia: algunas formas de altos niveles de triglicéridos ocurren entre miembros de una misma familia. 27 2.9.- LA MUDA EN LA GALLINA PONEDORA Wells, (1980) y Buxade, (1987), mencionan que una muda se inicia cuando se rompe el equilibrio hormonal, merced a la acción de factores originarios de situaciones de estrés (reducción del fotoperiodo, ayuno, alimentación inadecuada, etc.). La muda depende de mecanismos neuro hormonales desde un punto de vista fisiológico (Buxade, 1987). Este tipo de acciones producen una serie de alteraciones en la gallina, que conducen a una nueva situación hormonal, que merecen ser destacadas (figura 05). Incremento de la actividad tiroidea. Aumento de la actividad de las glándulas adrenales. Reducción de la actividad sexual, parada de la puesta. Atresia de los caracteres sexuales externos. Atrofia considerable del intestino. Caída de plumas. Formación de nuevas plumas. Regeneración del aparato genital. Bell y Kuney (2004) realizaron estudios sobre la muda basadas en varias investigaciones por lo cual mencionan que: Las diferentes estirpes se desempeñan de maneras diversas con los mismos procedimientos de muda. Las aves responden de diferente forma a la muda dependiendo de la estación y del control del ambiente. Las aves se desempeñan en su segundo ciclo con relación al desempeño del primero. 28 Grieve (2006), manifiesta que a medida que la edad de la gallina aumenta disminuye la producción de huevos, la calidad de la albúmina y la resistencia de la cáscara, esta pérdida pueden ser revertidas al incluir una muda. 29 FIGURA 05. MECANISMOS ENDÓCRINOS DEL PROCESO DE MUDA Fuente: Buxade (1987) 30 III. MATERIALES Y METODOS 3.1.- MATERIALES 3.1.1. Lugar de ejecución y análisis La presente investigación se realizó en la “Granja Experimental de Aves”; de la Escuela Profesional de Zootecnia, Facultad de Ingeniería Agraria, Industrias Alimentarias y Ambiental, y en el Laboratorio de Bioquímica de la Facultad de Bromatología y Nutrición de la Universidad Nacional José Faustino Sánchez Carrión; ubicada en el Distrito de Huacho, Provincia de Huaura. Región Lima Provincias. Entre los meses de Enero – Mayo 2009. 3.1.2. Material biológico experimental Se usaron 20 gallinas de postura distribuidos en dos grupos de 10 Gallinas Comerciales Hy-Line (78 semanas de edad) y 10 Gallinas Criollas Negras Huachanas (80 semanas de edad). Para el estudio, se propició un nuevo ciclo de postura en ambos grupos a través de la muda forzada (Wells, 1980; Buxade, 1987). 31 3.1.3. Material de laboratorio o Kits para la determinación enzimática de Colesterol y Triglicéridos® o Cronometro o Tubos de ensayo o Gradilla de metal o Vaso Erlenmeyer de 50 y 100 ml o Agitador de vidrio o Tubos Eppendorf o Pipetas de 10 y 25 ml o Propipetas de embolo o Goteros o Micropipetas de 20 µl o Pipetas Pasteur o Centrifuga o Agitador o Espectrofotómetro (Genesys 5) o Balanza de gramo 3.1.4. Equipos. o Balanza de gramo (500 g) o Balanza de kilo (10 kg) o Batería de madera de dos pisos, con divisiones individuales para cada ave ____________________________________________________________ ® Marca Registrada de Laboratorio Valtek. 32 3.2.- MÉTODOS 3.2.1. Procedimiento de la Muda Se realizó la muda para iniciar un nuevo periodo de postura de ambos grupos de gallinas. Se aplicó la técnica de reducción de alimento y agua en un lapso de 7 a 15 días, con la finalidad de reducir el peso corporal, entre 15 a 20 % del peso vivo (Wells, 1980; Buxade, 1987). Los pasos fueron: Al de inicio de la muda se procedió a desparasitar todas las aves. Días 1, se sometió a todas las aves a un ayuno total de agua y alimento y eliminar la luz artificial, quedando solo luz natural. Días 2 a 12, se ofreció calcio granulado durante unos 4 ó 5 días a razón de 10 gr/ave. Días 13 a 15, se ofreció maíz 20 gramo/ave aumentándose 20 gramos por día respectivamente. A partir del día 16, pienso correspondiente de ponedoras hasta 100 gr/ave. 3.2.2. Procedimiento y análisis de los huevos A. Recolección de los huevos El recojo de los huevos fue diario y los cuales se almacenaban en un refrigerador a temperatura promedio de 2-8 °C. Se utilizaron 40 huevos de Gallinas Comerciales HyLine y 40 huevos de Gallinas Negras Huachanas. 33 B. Procesamiento de las Muestras Para el análisis se usaron 5 huevos de cada grupo Gallinas Comerciales Hy-Line y Gallinas Negras Huachanas respectivamente (cuadro 04). Se extrajo manualmente las yemas de los 5 huevos en cada grupo de estudio obteniéndose dos pool de muestras. Se realizó el método de extracción de lípidos a través de la Técnica de Bligh y Dyer (A.O.A.C. 1975). Las yemas de las gallinas se analizaron de acuerdo al siguiente procedimiento. Se separó 250 mg la yema homogenizada en un tubo con tapa de goma, para lo cual se le agregó 0.4 ml de mezcla metanol y cloroformo en relación (2:1); esta mezcla se preparó en el momento de usarlo. Se agitó vigorosamente en un solo sentido por un minuto y luego se dejó reposar por 10 min. Se agregó 0.150 ml de cloroformo y 0.150 ml de agua. Con ayuda de unas pipetas en cada caso. (Se utilizó propipetas de embolo para mayor exactitud). Se mezcló vigorosamente. Se centrifugó por 2 minutos a 10 000 r.p.m. Luego se extrajo 200 µl de la base inferior (fase orgánica en la cual se encuentra el colesterol, triglicéridos y otros lípidos). Con ayuda de una micropipeta se transfirió a un tubo nuevo Eppendorf. Se midió 10 µl de la muestra con una micropipeta que corresponde a la fase orgánica de la yema y se colocó en un tubo Eppendorf. Para después dejar secar el solvente orgánico bajo una campana por 30 min. 34 C. Cuantificación de colesterol y triglicéridos Para obtener los resultados se utilizó el método enzimático utilizando los mismos métodos para ambos. Haciendo uso del kit de los laboratorios Valtek®. La técnica empleada para la cuantificación de colesterol en las muestras procesadas durante el desarrollo del experimento se basa el método empleado en los trabajos de Siedel y col. (1981). Procedimiento ♦ Se extrajo 0.01 ml de muestra, se le agrega 1 ml de solución reactivo de trabajo y se homogeniza. ♦ Se incubo por 5 minutos a 37ºC. ♦ Se lee en espectrofotómetro a 520 nm. ♦ Se obtuvo resultados por triplicado. Mientras que para la cuantificación de triglicéridos en las muestras procesadas durante el desarrollo del experimento, se fundamenta en el método empleado en los trabajos de Wahlefeld (1974). El procedimiento empleado se describe a continuación. Procedimiento ♦ Se extrajo 0.01 ml de muestra, se le agrega 1 ml de solución reactivo de trabajo, luego se homogeniza ♦ Se incubo por 5 minutos a 37ºC o a temperatura ambiente. ♦ Se lee en espectrofotómetro a 520 nm. ♦ Se obtuvo resultados por triplicado. ____________________________________________________________ ® Marca Registrada de Laboratorio Valtek. 35 3.3.- MANEJO DE LOS ANIMALES Las condiciones de manejo fueron iguales en ambos grupos, tal como se detalla a continuación: A. Instalaciones Se utilizaron una batería de dos pisos con 20 compartimientos colocándose un ave en cada una de ellas (10 para las Gallinas Negras Huachanas y 10 para Gallinas Hy-Line). Las jaulas fueron de las siguientes dimensiones. o Ancho: 31cm. o Largo: 35 cm. o Altura: 40 cm. B. Alimentación Ambos grupos fueron alimentados con raciones que contenían los mismos insumos alimenticios y agua proporcionada ad libitum. Usando una ración (Hy-Line International, 2007) lo cual se detalla a continuación. En el siguiente cuadro 03. 36 CUADRO 03. COMPOSICIÓN PORCENTUAL DE INSUMOS USADOS EN LA RACIÓN Insumos Maíz molido Torta de soya Harina integral de soya Carbonato de calcio Fosfato di cálcico DL-Metionina L-Lisina Cloruro de colina Premix de postura Secuestrante de micotoxinas Bicarbonato de sodio Total % 59.84 19.95 8.04 9.50 1.90 0.20 0.07 0.10 0.10 0.10 0.20 100 La ración contiene 2812 Kcal/Kg de Energía; 17.21 % de Proteína; 4.12 % de Calcio y 3.85 % de Grasa. 3.4. VARIABLES EN ESTUDIO En la presente investigación se distribuyeron las aves en 2 grupos de 10 aves cada uno. A. Variables independientes (X) X1: Gallina Comercial Hy-Line. X2: Gallina Criolla Negra Huachana. B. Variables dependientes (Y) Y1: Concentración de Colesterol en la yema de huevo. Y2: Concentración de Triglicéridos en la yema de huevo. 37 3.5. PARÁMETROS A EVALUAR Concentración de colesterol en la yema de huevo. Concentración de Triglicéridos en la yema de huevo. 3.6. DISTRIBUCIÓN DE LOS TRATAMIENTOS Los tratamientos fueron los tipos de huevos (verde y marrón), considerándose como bloques los días de puesta (8 bloques). En cada bloque y tratamiento se utilizó 5 huevos. Tal como se detalla en el Cuadro 04. CUADRO 04. DISTRIBUCIÓN DE LOS TRATAMIENTOS Días de puesta 15-24 25-34 35-44 45-54 55-64 65-74 75-84 85-94 T1 5 5 5 5 5 5 5 5 T2 5 5 5 5 5 5 5 5 Parámetros a evaluar colesterol y triglicéridos para cada tratamiento 38 3.7. EVALUACIÓN ESTADÍSTICA Para la evaluación se utilizó el Diseño de Bloques Completamente al Azar (Kuehl, 2001). En este diseño se usó 2 tratamientos, ocho bloques que representan los periodos de puesta, los tipos de gallinas son los tratamientos, siendo el modelo siguiente. Yij: µ + ti + βj + Yij: ij Es el valor o rendimiento en el i-ésimo tratamiento, j- ésimo bloque. µ: Es la media general. ti : Es el efecto del i-ésimo tipo de huevo. βj: Es el efecto del j-ésimo periodo de puesta. ij: Error experimental asociado a la i-ésimo tipo de huevo, j-ésimo periodo puesta. 39 IV. RESULTADOS Y DISCUSIÓN 4.1. Colesterol Los resultados se muestran en el cuadro 05. Se determinó que el contenido de colesterol en la yema de huevo de la Gallina Negra Huachana es 10.4% menor con respecto al huevo de Gallina Comercial Hy-Line. En relación a la variación de los niveles de colesterol en yema de huevo en ambos tratamientos se mantuvo durante todo el periodo de evaluación, se observó que el contenido de colesterol de las Gallina Comerciales Hy-Line tiene tendencia superior a mayores valores a las de las Gallina Negra Huachana (Grafico 01) en la segunda mitad del experimento. Contenido de Colesterol (mg/g) GRAFICO 01 VARIACIÓN PROMEDIO DEL COLESTEROL 24 21 18 15 12 9 6 3 0 1 2 3 4 5 6 7 8 Periodo Experimental Gallina Comercial Hy-Line Gallina Negra Huachana 40 Cuadro 05. Contenido de colesterol (mg/g) en la yema de huevo de la gallina negra huachana y la línea comercial Hy-Line Tratamientos T1 T2 Gallina Comercial Gallina Negra Hy-Line Huachana 17.39 ± 0.2867 a 15.58 ± 0.2867 b a, b = Promedios con diferentes superíndices difieren significativamente (p < 0.05). Los resultados obtenidos fueron inferiores a los reportados por Bartov y col., (1971), quienes hallaron niveles de colesterol en la yema de huevo de 11 a 15 mg/g en gallinas Araucanas; Salma y col., (2007), quienes trabajaron con gallinas Hy-Line de 23 semanas de edad, el contenido de colesterol fue de 14 mg/g en yema de huevo; con Sotelo y González, (2000); quienes reportaron niveles de 12.38 mg/g en la yema de huevo de gallinas comerciales con similar edad. Valores de colesterol por encima de lo hallado en la presente investigación fueron hallados por Harris y Wilcox, (1963), quienes reportaron valores más altos, que van desde 22 a 26 mg/g de colesterol en yema de huevo en gallinas White Leghorns; y en trabajos en huevos de gallinas Hy-Line se reportó 23 - 30 mg/g de contenido de colesterol (Rodríguez, 2000; García y Albalá, 1998). Los valores de colesterol obtenidos de la yema de huevo varían ampliamente en los diversos trabajos realizados y dependió de las condiciones experimentales, métodos de extracción utilizados y tipo de alimentación (North y Bell, 1993) y raza como afirma en los diferentes estudios que han mostrado resultados variados (Edwards y col., 1960). 41 García y Albalá, (1998), manifiestan que el contenido de colesterol total de la yema es significativamente menor en los huevos provenientes de gallinas alimentadas con productos marinos pero no mencionan durante cuánto tiempo se les suministraron dichos productos a las aves. También, existirían variaciones individuales en el contenido de colesterol entre gallinas, tal como lo demostró Edwards y col., (1960), quienes encontraron diferentes niveles de colesterol en gallinas del mismo peso vivo. 4.2. Triglicéridos El nivel de triglicéridos en ambos tratamientos fue similar (p> 0.05), tal como se muestra en el cuadro 06. Se observó que el contenido de triglicéridos del Huevo de Gallina Negra Huachana resulto siendo similar con respecto al huevo de la Gallina Comercial Hy-Line, no encontrándose una marcada diferencia entre ellas. En el periodo experimental se observó (Grafico 02) fluctuaciones irregulares del contenido de triglicéridos en la Gallina Negra Huachana como en la Gallina Comercial Hy-Line. 42 GRAFICO 02. VARIACIÓN PROMEDIO DE TRIGLICÉRIDOS Contenido de Triglicerido (g) 8 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 8 Periodo Experimental Gallina Comercial Hy-line Gallina Negra Huachana CUADRO 06. CONTENIDO DE TRIGLICÉRIDOS DE LA YEMA DE HUEVO (g) Tratamiento T1 T2 Gallina Comercial Gallina Negra Hy-Line Huachana a 5.857 ± 0.1314 a 5.918 ± 0.1314 a Promedios con iguales superíndices son similares significativamente (p > 0.05) Los resultados obtenidos en el estudio son superiores a los obtenidos por (Sauveur 1988; Gittins y Overfield, 1991) el cual publica 3.74 g de triglicéridos en la yema de huevo. En un estudio realizado en España por García y Albalá col., (1998) y García y col., 43 (2004), en aves de postura comercial reporta 3.78 - 3.89 g de triglicéridos en la yema de huevo. En trabajos de investigación realizados por Reyes y col. (2009) el cual público en el Perú 3.28 g triglicéridos en la yema de huevo. Menchú y Méndez, (2007) quien realizó sus estudios en Centro América y Panamá cuyo contenido de triglicéridos en la yema de huevo es de 3.88 g. Por otra parte Herrera y col., (2002) publica que el contenido de triglicéridos encontrado en la yema huevo fue de 3.74 g en Uruguay. En estudios realizados para determinar contenido triglicéridos en la yema de huevo García y col., (2004), fue realizado en huevos 1,2 de el estudio de gallinas comerciales a nivel europeo reporto de la siguiente manera en España 4.92 g, Dinamarca 4.38 g, Francia 4.08 g, Noruega 3.90 g, Suecia 3.96 g, Alemania 4.32 g, Italia 3.36 g, Holanda 3.84 g y en el Reino Unido 4.26 g. La USDA National Nutirent Database for Standard, (2008) manifiesta que en su composición de lípidos del huevo hay 4.43 g triglicéridos presentes en la yema de huevo. ____________________________________________________________ 1. Huevo org. El Huevo y su Contenido nutricional del huevo [Internet]. España: Organización Interprofesional del Huevo y sus Productos (INPROVO) desde 1998. Disponible en: http://www.huevo.org.es/el_huevo_composicion_lipidos_grasas.asp. [consultada 12 dic 2011]. 2. Instituto del Huevo. El Huevo y la Nutrición. Explica las características del huevo y sus componentes nutricionales [Internet]. España: Instituto de Estudios del Huevo desde 1996. Disponible en: http://www.institutohuevo.com. [consultada 10 ene 2010]. 44 V. CONCLUSIONES Según las condiciones de la presente investigación nos permiten establecer las siguientes conclusiones: Se encontró una concentración menor (p< 0.05) de colesterol en los huevos de Gallina Negra huachana en comparación a los de la Gallina Comercial Hy-Line. La concentración de triglicéridos en los huevos de Gallina Negra huachana es similar que lo encontrado en los huevos de Gallina Comercial Hy-Line. 45 VI. RECOMENDACIONES Realizar estudios para determinar el perfil lipídico completo de la Gallina Negra Huachana. Realizar estudios de los componentes lipídicos en diversas etapas del ciclo de postura. 46 VII. BIBLIOGRAFIA AOAC. 1975. Oficial Methods of Analysis 15th Edition. Arlington. Applegate, E. 2000. Introduction: Nutritional and functional roles of eggs in the diet. J. Am. Coll. Nutr. 19:495-498. Arredondo, J. 1997. Productos del Huevo. Archivos latinoamericanos de nutrición. vol.50 p.32-35. Avila, E. 1997. Alimentación de las Aves. p.67. Editorial Trillas. México. Barrantes, M. 2008. Caracterización de la Gallina Criolla de la Región Cajamarca. Facultad de Medicina Veterinaria Tesis. UNC. Perú. Bartov, I.S. y P. Budowski, 1971. Variabilidad de la concentración de colesterol en el plasma y las yemas de los huevos de las gallinas y la evaluación del efecto de la dieta algunos aceites. Poultry Sci. 50:1357-1364 Beate, D.S. 1997. Lista mundial de vigilancia para la diversidad de los animales domésticos. 2da. Edición. FAO. http://www.fao.org/docrep/V8300S/V8300S00.htm. Bell, D.D. y D.R. Kuney. 2004. Farm evaluation of alternative molting procedures. Journal of Applied Poultry Research, 13:673-679. Berkow, R.; Fletcher, A.J. 1994. El Manual Merck de Diagnóstico y Terapeutica. Cap. Metabolismo y Nutrición. 9ª edición. España. pp 1161. Beyer, R.S. and Jensen, L.S. 1991. Influence of orotic acid performance, liver lipidcontent and egg cholesterol level of laying hens. Poultry Science 70(11):2322-2328. Beyer, R.S. and Jensen, L.S. 1993. Tissue and egg cholesterol concentrations on laying hens fed high-protein barley fluor-tocotrienol, and cholesterol. Poultry Science 72:1339-1348. Bondi, A. 1989. Nutrición Animal. Editorial Acribia Zaragoza, España 545 p. Bourges, R.H. 2001. Hacia el consenso en la prevención primaria de la aterosclerosis por medio de la dieta y el ejercicio. Arch Lat Nutr 24, 3:117124. Burley, R.W., Vadehra D.V. 1989. Huevo en la nutrición humana. En: El huevo aviar. Journal of Agricultural Science. 351-364. 47 Buxade, C.C. 1987. La gallina Ponedora: Sistema de Explotación y Técnicas de Producción. Edición Mundi-Prensa. Madrid. 520 p. Castelló, S. 1924. Etnología y noticia de razas nuevas y de otras ya conocidas: El Gallus inauris y la gallina que da el huevo azul. Libro del 2do. Congreso y Exposición Mundiales de Avicultura. 109 -114 p. Castro, Y.I. y Chavarria, F.A. 1996. Estudio preliminar de la cría de gallinas de patio en el municipio de Nindirí, Masaya. Tesis Universidad Nacional Agraria. Managua-Nicaragua, pp. 46, 47. Cerdán, I. 2001. Prospección y estudio de la Gallina Araucana en las Comunidades Mapuches de la Comuna de Villarrica. Tesis. UPNA. España Chowdhury, S.R., S.D. Chowdhury, and T.K. Smith. 2002. Effects of garlic on cholesterol metabolism in laying hens. Poult. Sci. 81:1856–1862. Chowdhury, S.R., D.K. Sarker, S.D. Chowdhury, T.K. Smith, P.K. Roy, and M.A. Wahid. 2005. Effects of dietary tamarind on cholesterol metabolism in laying hens. Poult. Sci.84:56–60. Corrales, L.E., A. Gámez. 2008. Determinación del manejo reproductivo y ciclo de puesta de las gallinas de patio en tres comunidades del municipio del Sauce, Tesis Bachiller. Zootecnia. Universidad Nacional Agraria. Nicaragua. Crawford, R.D. 1992. Una revisión global de los recursos genéticos de las aves de corral. En: Gestión de los recursos zoogenéticos mundiales. FAO. Roma, Italia. 205-214 p. http://www.fao.org/docrep/v8300s/v8300s1g.htm Edwards, H.Jr., J.C. Driggers, R. Dean y Carmon J.L., 1960. Estudios sobre el contenido de colesterol de los huevos de diferentes razas. Poultry Science. 39: 487 – 489 p. Elkin, R.G. y Rogler, J.C. 1989. Effect of lovostatin on laying hen performance and egg cholesterol content. Poultry Science 68 :49. FAO 2002. (Organización de las Naciones Unidas para la Agricultura y la Alimentación, IT). FAO anuario comercio 2002 García, V.; Ballester, R.; R. Villarroya. 2004. Estudio comparativo de varios piensos en una raza hibrida autóctona de gallina para la producción de huevos ecológicos. VI Congreso de la Sociedad Española de Agricultura Ecológica. Almería-España. 48 García C. y C. Albalá. 1998. Composición lipídica de huevos de gallina alimentadas con productos grasos y proteicos marinos. Archivos Latinoamericanos de Nutrición (48) 1:71-76. Gittins, J.E., Overfield D.N., 1991. El contenido de nutrientes de los huevos en Gran Bretaña. 4to. Simposio Europeo sobre la Calidad de los huevos y ovoproductos. Países Bajos, 113-116 p. Godínez, O., Fumero, J.E. y L.M. Plascencia. 2006. Comportamiento de las estirpes que dan origen al pollo campero cubano. Revista Cubana de Ciencia Avícola. Vol 30. Nº 2:113-117. Grieve, D. 2006. Muda en aves ponedoras comerciales: pasado, presente y futuro. Hy-Line Internacional. Vol. 4 n.4. www.Agriworld.nl. Grobas, S. y Mateos, G.G. 1999. Influencia de la nutrición sobre la composición nutricional del huevo. Dpto. Producción Animal. Universidad Politécnica de Madrid. España 3-9p. www.etsia.upm.es/fedna/capitulos/96capituloXII_1.pdf. Gutiérrez, M.A., Takahashi, H., Juneja, L.R. 1997. Evaluación nutritiva de los huevos de gallina. En: Los huevos de gallina, su ciencia básica y aplicada, World's Poultry Science Journal. 25-35p Harris, P.C. y H. Wilcox, 1963. Estudios sobre la yema de huevo colesterol. Poultry Science. 42: 178 -182 Herrera, M.; Tor, E.; Betancourt, C.M. y L. Saravia. 2002. Tabla de Composición de Alimento del Uruguay. Instituto Nacional de Alimentación y Universidad Nacional de la Republica. 1ª edición. Montevideo – Uruguay. 25 p. Hopkins, P.N. 1992. Effect of dietary choresterol on serum cholesterol: a meta-analysis and review. Am. J. Clin. Nutr.; 55: 1066-1070. Hu, B.F.; M.J. Stampfer; E.B. Rimm; J.E. Manson; A. Ascherio; G.A. Colditz; B.A. Rosner; D. Spiegelman; F.E. Speizer; F.M. Sacks; Ch.H. Hennekens; W.C. Willett. 1999. Un estudio prospectivo de consumo de huevo y el riesgo de enfermedad cardiovascular en hombres y mujeres. JAMA. 281(15):1457-1458. http://jama.amaassn.org/content/281/15/1387.abstract Hy Line International. 2007. Guía de Manejo Comercial 2007-2008, HyLine variedad Brown. Avícola San Fernando. Lima-Perú. 49 Isa International. 2007. Guía de Producción de huevo Comercial 20072008, Isa Brown. Avícola del Norte. Trujillo- Perú Jerez, S.M.P.; Reyes, S.M.; Carrillo, R. J. C.; Villegas, A. y C. J. Segura. 2009. Indicadores productivos de gallinas criollas en un sistema de producción avícola alternativo. OAXACA- México. 1-9 p. Juárez, C.A. 1995. Estudio de la Producción de huevo, calidad de cascaron y balance de calcio en gallinas criollas cuello desnudo, en condiciones ambientales del Trópico seco. Tesis Grado de Doctor Universidad de Colima. Facultad de Ciencias Biológicas y Agropecuarias. México. Juárez, C.A., Manríquez A.J., Segura C.J., 2000. Rasgos de la apariencia fenotípica en la avicultura rural de los municipios de la Rivera del Lago de Pátzcuaro, Michoacán, México. Juárez, C.A., Ortiz M.A. 2001. Estudio de la incubabilidad y crianza en aves criollas de traspatio. Vet. Mex. 32. Juárez, C.A. y T.J. Pérez. 2003. Comportamiento de la parvada de gallinas criollas en condiciones naturales del medio rural. Instituto de Investigación Avícola, Revista Cubana de Ciencia Avícola. Vol 27 nº 1:7 – 12 p. Kerver, J.M.; Bianchi, L.J.; Mcnamara, D.J.; Song, W.O. 2000. The nutritional contribution of eggs to the American diet in the 90’s. FASEB J; 14:220. Keshavarz, K. and S. Nakajima. 1995. The effect of dietary manipulations of energy, protein, and fat during the growing and laying periods on early egg weight and egg components. Poultry Sci. 74:50-61. Khuel, R.O. 2001. Principios Estadísticos para el Diseño y Análisis de la Investigación. Diseño de Experimentos. 2da. edición. Editorial Thomson Learning. México. 666 p. Klasing, K.C. 1998. Comparative Avian Nutrition. CAB International. 350 p. Kritchevsky, S.B., and D. Kritchevsky. 2000. Egg consumption and coronary heart disease: An epidemiologic overview. J. Am. Coll. Nutr. 19:549–555. Leeson, S. y Summers, J. 1989. Comercial Poultry Nutrition. Ed. University Books. Canadá. 280p. 50 Magaldi, M.A. 1995. Explotación comercial de aves. Ed. Albatros. Mahan, K.M.L. and Arlin, M.T. 1995. Krausse. Nutrición y Dietoterapia. Editorial McGraw-Hill Ed.. 947 p. McNamara, D. J. and Nicolosi, R. 1999. Cholesterol: Sources absorption, function and metabolism. Encyclopedia of Human Nutrition. Vol. I. Academic Press 371-376. McNaughton, J.L. 1978. Effect of dietary fiber on egg yolk liver and plasma cholesterol concentrations on the laying hen. Journal of Nutrition 08:18421848 Menchú, M.T. y H. Méndez. 2007. Tabla de Composición de Alimentos de Centroamérica. Instituto de Nutrición de Centro América y Panamá y la Organización panamericana de la Salud. 2ª edición. 7-19p. Mendiola, Ch. 2002. Evaluación comparativa nutricional entre los huevos de codorniz japónica y Gallina criolla en la primera etapa de postura. Tesis Vet. UNMSM. Lima. Peru. Menge, H., Littlefield L.H., Frobish L.T. and Weinland B.T.1974. Effect of cellulose and cholesterol, blood and yolk lipids and reproductive efficiency of the hen. Journal of Nutrition 104:1554-1566. Murray, R.K.; Granner, D.K.; Mayes, P.A.; Rodwell, V.W. 1997. Bioquímica de Harper. Editorial El Manual Moderno S.A. 186p National Research Council (NRC). 1994. Nutrient Requeriments of Poultry. Ninth Revised Edition. Washington D.C. USA. Nelson, D.L. y Cox M.M. 2001. Lehninger Principios de Bioquimica Editorial. Omega. Cp 11,pp. 366-368;376- 380;804. North, M.O. y Bell, D. 1993. Manual de Producción Avícola. 3ra Edición. Editorial El Manual Moderno S.A. México. Nys, Y. y Sauveur B. 2004. Valor nutricional huevos. INRA Prod. Anim.17 (5), 385-393. http://www.inra.fr/productions-animales/spip.php?page=en auteur&id_auteur=592 Orozco, F. 1991. Mejora genética avícola. Agroguías mundi-prensa. Ediciones Mundi-Prensa. Madrid 51 Ortega, R.M.; Quintas, M.E.; Andres, P.; Gaspar, M.J.; Lopez-Sobaler, A.M.; Navia, B.; Requejo, A.M. 1997. Ingesta de alimentos, energía y nutrientes en jóvenes de sexo femenino en función de su consumo de huevos. Repercusión en los parámetros lipídicos cuantificados en suero. Nutr. Clin.;17: 31 37. Oteiza, F. y Carmona R. 1985. Diccionario de Zootecnia. Edit. trillas México. 37 p. Pampin, M.A. y Esperanza R. 2000. Caracterización de la Gallina Semirrustica Genotipo rojo (SRR). Instituto de Investigación Avícola, Revista Cubana de Ciencia Avícola. Vol 24 Nº 2:181- 186 p. Pesti, G.M., and R.I. Bakalli. 1998. Studies on the effect of feeding cupric sulfate pentahydrate to laying hens on egg cholesterol content. Poult. Sci. 77:1540–1545. Reyes, G.M.; I. P. Gómez-Sánchez; Bravo, F.; Ganoza, L., 2009. Tablas peruanas de composición de alimentos. Centro Nacional de Alimentación y Nutrición Instituto Nacional de Salud. 8ª edición. Lima-Perú. 44p. Rodríguez, J.C.; Allaway, C.L.; Wassink, G.J.; Segura, J.C. y T. Rivera. 1996. Estudio de la avicultura de traspatio en el municipio de Dzununcán, Yucatán. México. 27(3):215-219 p. Rodríguez, R.H., 2000. Manejo de alternativas alimenticias para aves de postura destinada a la obtención de huevos con bajo contenido de colesterol. Tesis Grado de Doctor. Universidad de Tolima México Rojas, S. 1979. Nutrición Animal Aplicada. UNALM. Lima-Perú. Salma U., A. G. Miah, K.M.A. Tareq, T. Maki, H. Tsujii., 2007. Efecto de la dieta Rhodobacter capsulatus en la yema de huevo. El colesterol y rendimiento de las gallinas ponedoras. Sastre, A. 2000. Tratamiento no farmacológico de la obesidad: dietas muy bajas en calorías. Clin. Invest. en Arterosclerosis; 12, supl. 2: 59-66. Sauveur, B. 1988. Estructura, composición y valor nutricional Huevo, la calidad del huevo, En: Aves de cría y producción de huevos. INRA (Eds), París. 449p. Sauveur, B. y M. De Rivies. 1992. Reproducción de las aves. Ed. Mundi Prensa, 191-266. 52 Segura-Correa, J.C. 1989. Rescate genético y fomento avícola de las aves indias o criollas en México; Memoria de la Reunión de Producción Animal Tropical. Tabasco, México 44-46p. Segura-Correa, J.C.; Jerez, M.P.; F. Sarmiento. 2007. Indicadores de Producción de huevos de gallinas criollas en el trópico de México. Instituto Tecnológico Agropecuario de Oaxaca. Archivos de Zootecnia. 56(215): 309317. Segura, C. y J.C. López. 1994. Crecimiento y producción de huevo de gallinas criollas bajo un sistema de manejo intensivo en Yucatán. XIX Convención nacional ANECA. Jalisco, México 285-287p. Semenkovich, C.F. 2007. Trastornos del metabolismo lipídico. En: Goldman L, Ausiello D, eds. Cecil Medicine. 23a ed. Philadelphia, Pa: Saunders Elsevier; cap 217. Serra-Majem, L., Ribas, L. y Ramon, J.M. 1999. Compliance with dietary guide lines in the spanish population. British Journal of Nutrition. Shimada, A. 1993. Fundamentos de Nutrición y Alimentación Animal Comparada. 1ra. Edición. México. 372 p. Siedel, J., H. Schlumberger, S. Klose, J. Ziegenhom y A.W. Wahlefeld. 1981. Boehringer Mannheim GmbH. J. Clin, Chem. Biochem 19. 838 p. Sierra, A.C., J.S. Hernández y C.J. Barba. 1998. Razas autóctonas de la mixteca oaxaqueña de México. Archivos de Zootecnia 47: 517-521. Sisson, S. y J.D. Grossman. 1990. Anatomía de los animales domésticos. Tomo II. 5ta Edición. Salvat Editores S.A. Barcelona, España. Smith, T; Last, P. 1998. Vivir mejor una obra sana, para una vida plena. Editorial Dorling Kinderley Gran Bretaña. Editora El Comercio S.A. Perú Sotelo A., Gonzalez l., 2000. Huevo en polvo con bajo contenido de colesterol. Características nutritivas y sanitarias del producto. Archivos Latinoamericano de Nutrición. México Soto, I.M.; Zavala, H.C.; J.E. Camacho. 2002. Análisis de dos poblaciones de gallinas criollas Utilizando RAPD´s (DNA polimórfico amplificado al azar) como marcadores moleculares. México. USDA 2008. National Nutrient Database for Standard Reference. 53 Uyanik, F., S. Kaya, A.H. Kolsuz, M. Eren, and N. Sahin. 2002. The effect of chromium supplementation on egg production, egg quality and some serum parameters in laying hens. Turk. J. Vet. Anim. Sci. 26:379–387. Vignon, C.L y D.H. Santiago. 1996. Características reproductivas de gallinas criollas en condiciones controladas y de traspatio en el Valle de Zaachila. Tesis Instituto Tecnológico Agropecuario. Oaxaca, México. 57 p. Vorster, H. H.; Benade, A.J.; Barnard, H.C.; Locke, M.M.; Silvis; Venter, C.S. 1993. Egg intake does not change plasma lipoprotein and coagulation profiles. Am. J. Clin. Nutr.; 55:480-410. Wahlefeld A.W. 1974. Method en der enzymatic chen analyse. En: H.U. Bergmeyer (Ed.) Method en der enzymatic chen analyse. 3ra. Edition. Waldroup P.M., Ndife L.I., and Helwing H.M. 1986. Influence of probucol on egg yolk cholesterol content and performance of laying hens. Poultry Science.65:1949-1954. Weiss, J.F., Johnson R. M., and Naber, E.C. 1967. Effect of some dietary factor and drugs on cholesterol in the egg and plasma on the hen. Journal Nutrition 91:119-128. Wells, R.G. 1980. Sciencie.83:193-199. Evaluación Fisiológica de la Muda. Poultry World Health Statistics 2000. World Health Statistics Annual. Zhang, Y.K. Koeikebech and C. Parson. 1993. Effect of dietary energy and protein levé is during the pullet rearing and production periods on performance of young laying hens. Poultry Science. Abstracts 121. 41p. Zunino, C.E. 1999. Comportamiento productivo de las gallinas Hy-Line Brown alimentadas con diferentes niveles de aceite acidulado de pescado. Tesis Bachiller. Fac. Zootecnia. Universidad Nacional Agraria La Molina. Lima. Perú. 54 VIII. ANEXOS Modelo lineal general: colesterol vs. TTT, Bloque Factor TTT Bloque Tipo fijo fijo Niveles 2 8 Valores 1, 2 1, 2, 3, 4, 5, 6, 7, 8 Análisis de varianza para colesterol, utilizando SC ajustada para pruebas Fuente TTT Bloque Error Total GL 1 7 39 47 SC sec. 39.386 37.071 76.926 153.382 S = 1.40444 SC ajust. 39.386 37.071 76.926 R-cuad. = 49.85% MC ajust. 39.386 5.296 1.972 F 19.97 2.68 P 0.000 0.023 R-cuad.(ajustado) = 39.56% Observaciones inusuales de colesterol Obs 40 colesterol 13.8000 Ajuste 16.4542 Ajuste SE 0.6081 Residuo -2.6542 Residuo estándar -2.10 R R denota una observación con un residuo estandarizado grande. Medias de cuadrado mínimo para colesterol mg/gr TTT 1 2 Bloque 1 2 3 4 5 6 7 8 Media 17.39 15.58 Media del Error estándar 0.2867 0.2867 15.73 16.45 15.85 15.06 17.92 17.36 16.46 17.07 0.5734 0.5734 0.5734 0.5734 0.5734 0.5734 0.5734 0.5734 Intervalos de confianza simultáneos de Tukey del 95.0% Variable de respuesta colesterol Todas las comparaciones de dos a dos entre los niveles de TTT TTT = 1 restado a: TTT 2 Inferior -2.632 Centrada -1.812 Superior -0.9916 ---+---------+---------+---------+--(---------*----------) ---+---------+---------+---------+---2.40 -1.60 -0.80 -0.00 Intervalos de confianza simultáneos de Tukey del 95.0% Variable de respuesta colesterol Todas las comparaciones de dos a dos entre los niveles de Bloque Bloque = 1 restado a: Bloque 2 3 4 5 6 7 8 Inferior -1.877 -2.477 -3.264 -0.404 -0.964 -1.864 -1.257 Bloque = 2 Bloque 3 4 5 6 7 8 Bloque 4 5 6 7 8 Bloque 5 6 7 8 Bloque 6 7 8 Centrada -0.600 -1.387 1.473 0.913 0.013 0.620 Superior 1.997 1.211 4.071 3.511 2.611 3.217 ----+---------+---------+---------+-(--------*--------) (-------*--------) (--------*--------) (--------*--------) (--------*--------) (--------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 Centrada -0.7867 2.0733 1.5133 0.6133 1.2200 Superior 1.811 4.671 4.111 3.211 3.817 ----+---------+---------+---------+-(-------*--------) (--------*--------) (--------*--------) (--------*--------) (--------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 Superior 5.457 4.897 3.997 4.604 ----+---------+---------+---------+-(--------*-------) (--------*-------) (--------*-------) (--------*-------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 Superior 2.037 1.137 1.744 ----+---------+---------+---------+-(--------*--------) (--------*--------) (--------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 restado a: Inferior 0.263 -0.297 -1.197 -0.591 Bloque = 5 ----+---------+---------+---------+-(-------*--------) (-------*--------) (--------*-------) (-------*--------) (-------*--------) (-------*--------) (-------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 restado a: Inferior -3.384 -0.524 -1.084 -1.984 -1.377 Bloque = 4 Superior 3.317 2.717 1.931 4.791 4.231 3.331 3.937 restado a: Inferior -3.197 -3.984 -1.124 -1.684 -2.584 -1.977 Bloque = 3 Centrada 0.7200 0.1200 -0.6667 2.1933 1.6333 0.7333 1.3400 Centrada 2.860 2.300 1.400 2.007 restado a: Inferior -3.157 -4.057 -3.451 Centrada -0.560 -1.460 -0.853 Bloque = 6 Bloque 7 8 restado a: Inferior -3.497 -2.891 Bloque = 7 Bloque 8 Centrada -0.9000 -0.2933 Superior 1.697 2.304 ----+---------+---------+---------+-(--------*--------) (--------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 Superior 3.204 ----+---------+---------+---------+-(--------*--------) ----+---------+---------+---------+--3.0 0.0 3.0 6.0 restado a: Inferior -1.991 Centrada 0.6067 Residuos vs. orden para colesterol Modelo lineal general: Triglicéridosr vs. TTT, Bloque Factor TTT Bloque Tipo fijo fijo Niveles 2 8 Valores 1, 2 1, 2, 3, 4, 5, 6, 7, 8 Análisis de varianza para Trigliceridos gr, utilizando SC ajustada para pruebas Fuente TTT Bloque Error Total GL 1 7 39 47 SC sec. 0.0450 10.8656 16.1623 27.0728 S = 0.643752 SC ajust. 0.0450 10.8656 16.1623 R-cuad. = 40.30% MC ajust. 0.0450 1.5522 0.4144 F 0.11 3.75 P 0.743 0.003 R-cuad.(ajustado) = 28.05% Medias de cuadrado mínimo para Trigliceridos gr TTT 1 2 Bloque 1 2 3 4 5 6 7 8 Media 5.857 5.918 Media del Error estándar 0.1314 0.1314 5.065 6.302 5.215 6.285 6.052 6.027 5.737 6.420 0.2628 0.2628 0.2628 0.2628 0.2628 0.2628 0.2628 0.2628 Intervalos de confianza simultáneos de Tukey del 95.0% Variable de respuesta Trigliceridos gr Todas las comparaciones de dos a dos entre los niveles de TTT TTT = 1 restado a: TTT 2 Inferior -0.3146 Centrada 0.06125 Superior 0.4371 ---+---------+---------+---------+--(--------------*--------------) ---+---------+---------+---------+---0.25 0.00 0.25 0.50 Intervalos de confianza simultáneos de Tukey del 95.0% Variable de respuesta Trigliceridos gr Todas las comparaciones de dos a dos entre los niveles de Bloque Bloque = 1 restado a: Bloque 2 3 4 5 6 7 8 Inferior 0.046 -1.041 0.029 -0.204 -0.229 -0.519 0.164 Bloque = 2 Bloque 3 4 5 6 7 8 Bloque 4 5 6 7 8 Bloque 5 6 7 8 -----+---------+---------+---------+(-------*-------) (-------*-------) (-------*-------) (-------*-------) (-------*-------) (------*-------) (-------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 Centrada -1.087 -0.017 -0.250 -0.275 -0.565 0.118 Superior 0.1039 1.1739 0.9405 0.9155 0.6255 1.3089 -----+---------+---------+---------+(-------*-------) (-------*-------) (-------*-------) (-------*-------) (-------*-------) (-------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 Superior 2.261 2.027 2.002 1.712 2.396 -----+---------+---------+---------+(-------*-------) (-------*-------) (-------*-------) (------*-------) (-------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 Superior 0.9572 0.9322 0.6422 1.3255 -----+---------+---------+---------+(------*-------) (-------*-------) (-------*-------) (-------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 restado a: Inferior -0.1205 -0.3539 -0.3789 -0.6689 0.0145 Bloque = 4 Superior 2.427 1.341 2.411 2.177 2.152 1.862 2.546 restado a: Inferior -2.277 -1.207 -1.441 -1.466 -1.756 -1.072 Bloque = 3 Centrada 1.2367 0.1500 1.2200 0.9867 0.9617 0.6717 1.3550 Centrada 1.0700 0.8367 0.8117 0.5217 1.2050 restado a: Inferior -1.424 -1.449 -1.739 -1.056 Centrada -0.2333 -0.2583 -0.5483 0.1350 Bloque = 5 Bloque 6 7 8 Inferior -1.216 -1.506 -0.822 Bloque = 6 Bloque 7 8 Centrada -0.0250 -0.3150 0.3683 Superior 1.1655 0.8755 1.5589 -----+---------+---------+---------+(-------*-------) (-------*-------) (------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 Superior 0.9005 1.5839 -----+---------+---------+---------+(-------*-------) (-------*-------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 Superior 1.874 -----+---------+---------+---------+(-------*------) -----+---------+---------+---------+-1.5 0.0 1.5 3.0 restado a: Inferior -1.481 -0.797 Bloque = 7 Bloque 8 restado a: Centrada -0.2900 0.3933 restado a: Inferior -0.5072 Centrada 0.6833 Residuos vs. orden para Trigliceridos gr Figura 06. Material biológico en estudio. Superior: Las Gallinas Comercial Hy-Line. Inferior: Las Gallinas Negras Huachanas. Figura 07. Muestras de yema de huevo. Izquierda: huevo verde de la Gallina Negra huachana. Derecha: huevo marrón de la Gallina Comercial Hy-Line Figura 08. Crecimiento de nuevas plumas luego de la muda en la Gallina Negra Huachana. En la parte inferior derecha se ve el desarrollo paulatino de las plumas. Figura 09. Crecimiento de nuevas plumas luego de la muda en la Gallina Comercial Hy-Line. En la parte inferior derecha se ve el desarrollo paulatino de las plumas.