Materia y cambios de estado
Anuncio

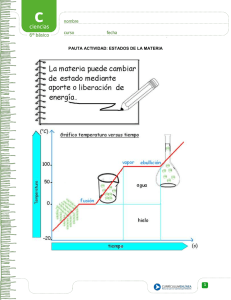
Materia y cambios de estado Los estados de la materia: generalmente, gases, líquidos, y sólidos y plasma como el que componen las estrellas. Los sólidos cambian a líquidos y los líquidos cambian a gases cuando se agrega suficiente energía para superar las fuerzas atractivas entre las partículas. En un sólido, fuerzas atractivas muy fuertes mantienen las partículas juntas. Están ordenadas en un patrón tan rígido que solo pueden vibrar lentamente en sus posiciones fijas. Esto da a un sólido una forma y volumen definidos. Para muchos sólidos, esta estructura rígida produce un cristal, como el caso de la amatista imagen 1 Imagen 1 En un líquido, las partículas tienen energía suficiente para moverse libremente en direcciones aleatorias. Todavía están cercanas unas a otras con fuertes atracciones para mantener un volumen definido, pero no hay estructura rígida. Por tanto, cuando aceite, agua y vinagre se vierten en un contenedor a otro, el líquido mantiene su propio volumen, pero toma la forma del nuevo contenedor imagen 2 Imagen 2 El aire que respira está hecho de gases, principalmente nitrógeno y oxígeno. En un gas, las moléculas se mueven a altas velocidades, lo que crea grandes distancias entre ellas. Este comportamiento permite a los gases llenar su contenedor. Los gases no tienen forma o volumen definidos por sí mismos; toman la forma y el volumen del contenedor. La tabla 1 compara algunas propiedades de los tres estados de materia. Tabla 1 Alguna propiedades de sólidos, líquidos y gases Algunos propiedades de los sólidos, líquidos y gases Propiedad Sólido Líquido Forma Tienen forma Toma la forma del definida contenedor Volumen Tiene volumen Tiene volumen definido definido Distribución de Fija, muy cercana Aleatoria, cercana partículas Interacción entre Muy fuerte Fuerte partículas Movimientos de Muy lento Moderado partículas Ejemplo Hielo, sal, hierro Agua, aceite, vinagre Gas Toma la forma del contenedor Llena el volumen del contenedor Aleatoria, muy separada En esencia ninguna Muy rápido Vapor de agua, helio, aire El estado plasma, es un estado fluido similar al estado gaseoso pero en el que sus partículas están ionizadas (cargadas eléctricamente) y no poseen equilibrio electromagnético. Cambios de estado La materia experimenta cambios de estado cuando pasa de un estado a otro. Cuando un cubo de hielo se funde en una bebida ocurrió un cambio estado. Cuando se agrega calor a un sólido, las partículas en la estructura rígida se mueven más rápido. A una temperatura llamada punto de fusión (pf), las partículas en el sólido ganan suficiente energía para superar la energía de las fuerzas atractivas que las mantienen juntas. Las partículas en el sólido se separan y se mueven en patrones aleatorios. Las sustancias se funden y cambia de sólido a líquido. Si baja la temperatura, tiene lugar el proceso inverso se pierde energía cinética, las partículas se frenan y las fuerzas atractivas las junta más. Las sustancias se congela un líquido cambia a sólido en el punto de congelación (pc), que es la misma temperatura que el punto de fusión. Cada sustancia tiene su propio punto de congelación (fusión): el agua se congela a 0°C; el hielo se funde a 0°C; el oro se congela (funde) a 1064°C; el nitrógeno se congela (funde) a -210 °C. Supón que tienes un vaso que contiene hielo y agua. A temperaturas cálidas, el hielo se funde y forma más líquido. A temperaturas frías, el calor se pierde y el líquido se congela. Sin embargo, en el punto de fusión (congelación) de 0°C, el hielo se funde a la misma velocidad que se congela el agua. Los procesos reversibles de fusión y congelación están en equilibrio. Fusión La fusión es la conversión de un sólido en un líquido al aumentar la temperatura. Por ejemplo, un helado, que es sólido se convierte en un líquido al aumentar la temperatura y conserva sus propiedades. El incremento de temperatura causa que las partículas aumenten su movimiento, lo cual genera separación entre ellas y una disminución de las fuerzas de atracción que las mantiene unidas. Calor de fusión Durante la fusión se necesita energía llamada calor de fusión para separar las partículas de un sólido. Por ejemplo, se necesitan 334 J de calor para fundir exactamente 1 g de hielo. Calor de fusión para el agua. 334 J/1g hielo El calor de fusión (334 J/g) también es el calor que se debe retirar para congelar un gramo de agua. A veces se rocía agua en los huertos frutales en climas muy fríos. Si la temperatura del agua cae a 0°C, el agua comienza a congelarse. En este cambio de estado se libera calor, que caliente el aire y protege la fruta. Para determinar el calor necesario para fundir una muestra de hielo, multiplica la masa del hielo por su calor de fusión. No hay cambio de temperatura en el cálculo por que la temperatura permanece constante en tanto el hielo se funde. Calculo de calor para fundir (o congelar) agua Ecuación: Calor (J) = masa (g) x calor de fusión (J/g) Sublimación En un proceso llamado sublimación, las partículas en la superficie de un sólido absorben suficiente calor para cambiar directamente a un gas sin cambio de temperatura. Por ejemplo, el hielo seco, que es dióxido de carbono sólido, se sublima a – 78 °C. Se llama “seco” porque no forma un líquido. En áreas muy frías, la nieve no se funde sino que se sublima directamente a vapor. En un refrigerador sin escarcha, el hielo en las paredes del congelador se sublima cuando el aire caliente circula a través del comportamiento durante el ciclo del deshielo. Los alimentos liofilizados, preparados mediante sublimación, son convenientes para el almacenamiento prolongado y para acampar o en excursiones. Un alimento se coloca en una cámara de vacío donde se seca conforme el hielo se sublima. El alimento seco conserva todo su valor nutricional, y solo necesita agua para ser comestible. Un alimento liofilizado, no necesita refrigeración por que las bacterias no crecen sin humedad. El proceso inverso de la sublimación se llama deposición. Evaporación y condensación El agua en un charco de lodo desaparece, un alimento destapado se seca, así como la ropa que cuelga de un tendedero. La evaporación tiene lugar cuando las moléculas de agua de rápido movimiento tienen suficiente energía para escapar de la superficie de un líquido imagen 3. La pérdida de las moléculas de agua “caliente” retira calor y deja el líquido más frío. Conforme las partículas de vapor de agua se enfrían, pierden energía cinética y se frenan. En la condensación, las moléculas de agua forman un líquido de nuevo conforme las fuerzas atractivas las juntan, un proceso inverso a la evaporación. Es posible que hayas notado que, cuando te bañas, se forma la condensación en el espejo. Puesto que se pierde calor conforma un líquido se condensa, es un proceso de calentamiento. Por eso, cuando una tormenta se acerca, notamos un calentamiento del aire conforme las moléculas del agua gaseosa se condensan en lluvia. Con suficiente tiempo, el agua en un contenedor abierto se evaporará. Sin embargo, si sobre el contenedor se coloca una cubierta de ajuste hermético, el nivel de agua bajará solo un poco. Al principio, las moléculas de agua se evaporaran de la superficie. Luego, parte de las moléculas de vapor comienzan a condensarse y regresan a líquido. Finalmente, el número de moléculas en evaporación es igual al número de las que se condensan. Los procesos inversos de evaporación y condensación se igualan. Como resultado, el nivel de agua no baja más. Imagen 3 Ebullición Conforme aumenta el calor que se agrega a un líquido, más o más partículas se evaporan. En el punto de ebullición (pe), las partículas en el líquido tienen la energía necesaria para cambiar el gas. La ebullición del líquido ocurre conforme se forman burbujas de gas en el líquido, luego se elevan a la superficie y escapa imagen 4. Imagen 4 Todos los cambios de estado se ilustran en la imagen 5 Imagen 5 Calor de vaporización La energía necesaria para vaporizar exactamente 1 g de líquido a gas se llama calor de vaporización. Para el agua se requiere 2260 J para convertir un gramo de agua a vapor. Calor de vaporización para el agua 2260 J/1 g H2O Cuando 1 g de agua se condensa, el calor de vaporización. 2260 J, es la cantidad de energía que debe retirar. Por tanto, 2260 J/g también es el calor de condensación del agua. Para calcular la cantidad de calor necesario para vaporizar (o condensar) una muestra de agua, multiplica la masa de la muestra por el calor de vaporización. Como antes, no ocurre cambio de temperatura para un cambio de estado Calculo de calor para vaporizar (o condensar) agua Calor (J)= masa (g) x calor de vaporización 2260(J/g) Diferentes sustancias tienen diferentes calores de fusión y vaporización, lo que generalmente aumenta con mayor polaridad de las partículas. El calor de vaporización siempre es más mayor que el calor de fusión. Esto ocurre cuando se necesita más energía para separar las partículas de un líquido en forma de gas, que la necesaria para superar las fuerzas atractivas en un sólido para formar un líquido. Curvas de calentamiento y enfriamiento Cuando se agrega calor a un sólido comienza a fundirse y formar un líquido. Mientras más calor se agrega, el líquido se calienta hasta que hierve y forma un gas. Cada uno de estos cambios de estado se puede ilustrar visualmente como un diagrama llamado curva de calentamiento En una curva de calentamiento, la temperatura se muestra en el eje vertical, la adición de calor se muestra en el eje horizontal. Cada uno de los segmentos representa un paso de calentamiento o un cambio de estado. Paso en una curva de calentamiento. La primera línea diagonal indica un calentamiento de un sólido conforme se agrega calor. Cuando se alcanza la temperatura de fusión, un sólido comienza a cambiar a líquido. No hay cambio de temperatura mientras el sólido cambia. Este proceso se muestra como una línea plana, o meseta, mientras la temperatura permanece constante hasta que todo sólido se funde imagen 6 Imagen 6 Después de que todas las partículas están en estado líquido, la temperatura comienza a subir otra vez. Conforme se agrega más calor, el líquido se calienta y las partículas se mueven más vigorosamente hasta que se alcanza el punto de ebullición. No hay cambio de temperatura en tanto el líquido cambia a gas. Después de que todo el líquido cambia a gas, calor adicional hará que la temperatura suba de nuevo. Pasos en una curva de enfriamiento. Cuando de una sustancia como el vapor de agua se retira calor, el gas se enfría y condensa. Una curva de enfriamiento es un diagrama de este proceso de enfriamiento imagen 7 Imagen 7 En la curva de enfriamiento, la temperatura se grafica en el eje vertical y la remoción de calor en el eje horizontal. Conforme un gas se enfría, se pierde calor y la temperatura cae. En el punto de condensación (mismo que el punto de ebullición), el gas se comienza a condensar y se convierte en líquido. Este proceso se indica mediante una línea plana (meseta) en la curva de enfriamiento en el punto de condensación. Después de que todo gas cambia a líquido, las partículas dentro del líquido se enfrían, como se indica mediante la línea con pendiente negativa que muestra la disminución de la temperatura enfriamiento. En el punto de congelación, las partículas en el líquido se enfrían tanto que comienza a formarse un sólido. Una segunda línea plana en el punto de congelación indica cambio de estado de líquido a sólido (congelación). Una vez que toda la sustancia se congela, se puede perder más calor, lo que baja la temperatura del sólido por debajo de su punto de congelación.