SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE
Anuncio
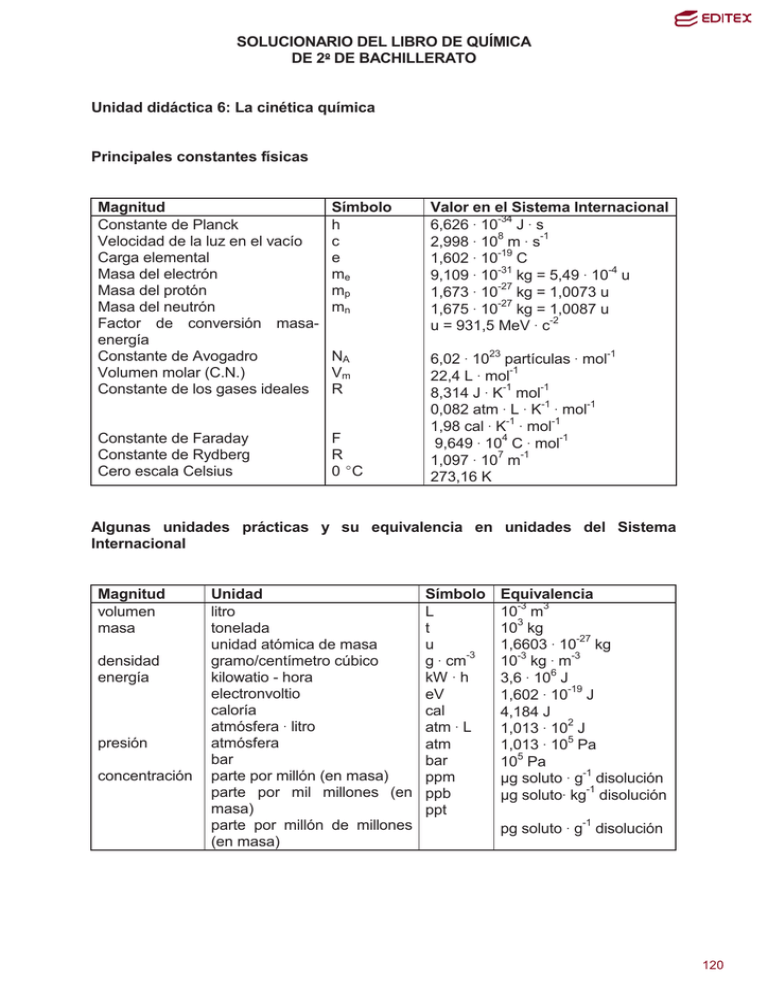
SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE BACHILLERATO Unidad didáctica 6: La cinética química Principales constantes físicas Magnitud Constante de Planck Velocidad de la luz en el vacío Carga elemental Masa del electrón Masa del protón Masa del neutrón Factor de conversión masaenergía Constante de Avogadro Volumen molar (C.N.) Constante de los gases ideales Símbolo h c e me mp mn Valor en el Sistema Internacional 6,626 $ 10-34 J $ s 8 -1 2,998 $ 10 m $ s 1,602 $ 10-19 C -31 -4 9,109 $ 10 kg = 5,49 $ 10 u 1,673 $ 10-27 kg = 1,0073 u 1,675 $ 10-27 kg = 1,0087 u u = 931,5 MeV $ c-2 NA Vm R Constante de Faraday Constante de Rydberg Cero escala Celsius F R 0 (C 6,02 $ 1023 partículas $ mol-1 22,4 L $ mol-1 8,314 J $ K-1 mol-1 0,082 atm $ L $ K-1 $ mol-1 1,98 cal $ K-1 $ mol-1 9,649 $ 104 C $ mol-1 1,097 $ 107 m-1 273,16 K Algunas unidades prácticas y su equivalencia en unidades del Sistema Internacional Magnitud volumen masa densidad energía presión concentración Unidad litro tonelada unidad atómica de masa gramo/centímetro cúbico kilowatio - hora electronvoltio caloría atmósfera $ litro atmósfera bar parte por millón (en masa) parte por mil millones (en masa) parte por millón de millones (en masa) Símbolo L t u -3 g $ cm kW $ h eV cal atm $ L atm bar ppm ppb ppt Equivalencia 10-3 m3 103 kg 1,6603 $ 10-27 kg 10-3 kg $ m-3 3,6 $ 106 J 1,602 $ 10-19 J 4,184 J 1,013 $ 102 J 1,013 $ 105 Pa 105 Pa ȝg soluto $ g-1 disolución ȝg soluto$ kg-1 disolución pg soluto $ g-1 disolución 1 120 Z 89 13 51 18 33 85 16 56 4 83 5 35 48 20 6 58 55 30 40 17 27 29 36 24 21 50 38 9 15 87 31 32 72 2 1 26 49 77 57 Elementos químicos más utilizados y sus masas atómicas en u Símbolo Nombre masa Z Símbolo Nombre masa Ac Actinio 227 3 Li Litio 6,491 Al Aluminio 26,98 12 Mg Magnesio 24,31 Sb Antimonio 121,8 25 Mn Manganeso 54,94 Ar Argón 39,95 80 Hg Mercurio 200,6 As Arsénico 74,92 42 Mo Molibdeno 95,94 At Astato 210 60 Nd Neodimio 144,2 S Azufre 32,07 10 Ne Neón 20,18 Ba Bario 137,3 28 Ni Níquel 58,69 Be Berilio 9,012 7 N Nitrógeno 14,01 Bi Bismuto 209,0 102 No Nobelio 253 B Boro 10,81 79 Au Oro 197,0 Br Bromo 79,90 76 Os Osmio 190,2 Cd Cadmio 112,4 8 O Oxígeno 16,00 Ca Calcio 40,08 46 Pd Paladio 106,4 C Carbono 12,01 47 Ag Plata 107,9 Ce Cerio 140,1 78 Pt Platino 195,1 Cs Cesio 132,9 82 Pb Plomo 207,2 Zn Cinc 65,39 94 Pu Plutonio 242 Zr Circonio 91,22 84 Po Polonio 210 Cl Cloro 35,45 19 K Potasio 39,10 Co Cobalto 58,93 59 Pr Praseodimio 140,9 Cu Cobre 63,55 91 Pa Protoactinio 231 Kr Criptón 83,80 88 Ra Radio 226 Cr Cromo 52,00 86 Rn Radón 222 Sc Escandio 44,96 45 Rh Rodio 102,9 Sn Estaño 118,7 37 Rb Rubidio 85,47 Sr Estroncio 87,62 34 Se Selenio 78,96 F Flúor 19,00 14 Si Silicio 28,09 P Fósforo 30,97 11 Na Sodio 22,99 Fr Francio 223 81 Tl Talio 204,4 Ga Galio 69,72 43 Tc Tecnecio 99 Ge Germanio 72,59 52 Te Telurio 127,6 Hf Hafnio 178,5 22 Ti Titanio 47,88 He Helio 4,003 90 Th Torio 232,0 H Hidrógeno 1,008 74 W Volframio 183,9 Fe Hierro 55,85 92 U Uranio 238 In Indio 114,8 23 V Vanadio 50,94 Ir Iridio 192,2 54 Xe Xenón 131,3 La Lantano 138,9 53 I Yodo 126,9 2 121 Cuestiones iniciales 1. Explica a qué se deben las siguientes observaciones: A la intemperie, los alimentos se conservan solamente unas horas; en las bandejas de un frigorífico, a 4 °C, se pueden mantener durante varios días y dentro de un frigorífico congelador, a - 20 °C, se pueden conservar hasta varios meses. Teniendo en cuenta las observaciones de Arrhenius de que para un sistema homogéneo la velocidad de reacción se duplica por cada 10 (C de aumento de la temperatura, no es de extrañar que un alimento que se conserva varios días a 4 (C y se conserve aún más durante varios meses a una temperatura de - 20 (C. La velocidad de reacción depende de la temperatura de dos formas. En primer lugar un aumento de la temperatura produce un aumento de la rapidez del movimiento de las partículas de los reactivos, con lo que los choques se hacen más frecuentes. En segundo lugar, un aumento de la temperatura supone que existan más partículas con energía próxima a la de activación y por tanto la probabilidad de un choque efectivo aumenta. La velocidad de reacción es proporcional a la constante de velocidad k y esta depende Ea de la temperatura mediante la ecuación de Arrhenius: k = A · e - R · T Por lo que un ascenso de la temperatura conlleva un aumento de la constante de velocidad k y con ello un crecimiento de la velocidad de reacción. 2. ¿Por qué se oxidan antes las limaduras de hierro que un clavo del mismo metal? Las reacciones químicas tienen lugar mediante colisiones entre las partículas (moléculas, átomos o iones) de los reactivos. Al disgregar al hierro en forma de limaduras se favorece la posibilidad de los choques, ya que la superficie en contacto entre los reactivos aumenta enormemente respecto a la superficie que presenta el clavo para el ataque por el oxígeno. 3. El papel está en contacto con el oxígeno atmosférico y sin embargo no entra en combustión hasta que se le aplique una cerilla encendida que, a su vez, tampoco se inflama hasta que se la frota contra una superficie áspera. Justifica estos hechos. El papel reacciona con el oxígeno atmosférico si se logra comunicar a dicho sistema la energía de activación necesaria para que tenga lugar la reacción y ello se logra con la cerilla encendida, que prende el papel y se inicia la combustión. El hecho de frotar la cabeza de la cerilla con la parte rugosa de la caja de cerillas sirve para alcanzar la energía de activación necesaria al fósforo para que entre en combustión. Este a su vez, con la energía desprendida en su propia combustión, es capaz de comunicar al papel la que necesita para vencer su energía de activación y originar la combustión de éste. INVESTIGA 3 122 Consulta una hemeroteca o en portales como www.ciencianet.com o semejantes y contesta las siguientes preguntas: 1. Amplia el concepto de airbag e indica cuál fue el origen del airbag. 2. ¿Se produce algún producto peligroso en la reacción química del airbag? 3. ¿Existe en el mercado un airbag para motoristas? 1. Amplia el concepto de airbag e indica cuál fue el origen del airbag. El airbag se compone de una bolsa o cojín inflable, fabricado con una fibra química sintética, generalmente nylon, que está plegado en el centro del volante, en el salpicadero o en cualquier otro lugar donde sea necesario introducir un efecto amortiguador del golpe. Dispone también de un detector de impacto que determina cuándo se produce un choque y que activa el inflado del airbag. El sistema de inflado se basa en una reacción química de descomposición de la azida de sodio que se produce de modo casi explosivo y provoca la expansión dentro de la bolsa de un gran volumen de gas nitrógeno. Esta reacción es activada por un sistema eléctrico que controla el detector de impacto. El gas nitrógeno producido alcanza suficiente presión como para inflar el airbag en 20 centésimas de segundo. La rapidez del proceso es tal, que el volumen de gas hace que el airbag salga a una velocidad de 300 km/h. Instantes después de que el airbag se infle, el gas comienza a disiparse paulatinamente por los pequeños orificios existentes en la tela. El airbag está diseñado para complementar a los cinturones de seguridad, no para sustituirlos ya que el cinturón ayuda a mantener al pasajero en la posición apropiada para lograr una mayor efectividad del airbag. El sistema del airbag fue registrado por primera vez el 23 de octubre de 1971 por la firma Mercedes-Benz, después de cinco años de desarrollo del nuevo sistema. El primer coche que lo incorporó fue el de clase S en 1981. El sistema de airbag se compone de: • Detectores de impacto situados normalmente en la parte anterior del vehículo, la parte que empezará a decelerarse antes en caso de colisión aunque cada vez se ponen más sensores, distribuidos por todo el vehículo de manera que no se produzcan errores en su activación. • Dispositivos de inflado, que gracias a una reacción química producen en un espacio de tiempo muy reducido gran cantidad de gas (de un modo explosivo). • Bolsas de nylon infladas normalmente con nitrógeno resultante de la reacción química. Su función es la de, en caso de colisión, amortiguar con las bolsas inflables el impacto de los ocupantes del vehículo contra el salpicadero en caso de los delanteros y ventanas laterales en los delanteros y traseros. Se estima que en caso de impacto frontal, su uso puede reducir el riesgo de muerte en un 30%. Las bolsas inflables suelen estar colocadas en el centro del volante, en el salpicadero 4 123 frente al asiento del acompañante, en los laterales de los asientos delanteros, en el techo, actuando de "cortina" y, en algunos casos, bajo el volante para proteger las rodillas de su impacto contra el salpicadero. Debido a la velocidad con la que en dispositivo de inflado genera los gases de la bolsa de aire, ésta tarda solamente en inflarse entre 30 y 40 milésimas de segundo, saliendo de su alojamiento a una velocidad cercana a los 300 km/h. La bolsa permanece sólo unas décimas de segundo inflada, ya que va expulsando el gas por unos orificios que tiene al efecto de dosificar la fuerza aplicada sobre el ocupante. La bolsa no impide por ello la movilidad de los ocupantes. A pesar de lo que pueda parecer, el airbag no evita más lesiones que los cinturones de seguridad. El cinturón de seguridad es el elemento de seguridad pasiva más efectivo, y el uso del airbag es más bien complementario. 2. ¿Se produce algún producto peligroso en la reacción química del airbag? El nitrógeno es un gas inerte, pero el sodio liberado en la descomposición térmica de la azida de sodio sí que es peligroso. Por ello, la mayoría de los airbag actuales funcionan mediante una reacción de tres etapas en donde intervienen la azida de sodio (NaN3), el nitrato de potasio (KNO3) y el dióxido de silicio (Si02). De esta forma se origina gas nitrógeno (N2), es decir a partir de la reacción química de un sólido se produce un gas que se expande hasta inflar el airbag. En la primera etapa la azida de sodio se descompone para formar gas nitrógeno: 1º NaN3 (s) → Na (s) + 3/2 N2 (g) El metal sodio obtenido como subproducto reaccionaría violentamente con cualquier tipo de humedad presente. La función del nitrato de potasio es evitar esto al reaccionar con el sodio: 2º 2 KNO3 (s) + 10 Na (s)→ K2O (s) + 5 Na2O (s) + N2 (g) Finalmente, los óxidos metálicos formados, fuertemente básicos, reaccionan con el dióxido de silicio para dar un nuevo producto vítreo: 3º K2O (s) + Na2O (s) + SiO2 (s) → vidrio 3. ¿Existe en el mercado un airbag para motoristas? Sí, y ha sido en Japón donde los usuarios de motocicletas han sido los primeros en estar de enhorabuena por la salida al mercado un nuevo dispositivo cuya misión y funcionamiento es similar al de un airbag de automóvil, aunque, en este caso, diseñado para los usuarios de motos. El dispositivo colocado en un chaleco que lleva el motorista dispone de un cilindro que contiene dióxido de carbono, de forma que la prenda se infla automáticamente cuando el motorista cae, amortiguando así el impacto. Test de evaluación 5 124 1. La velocidad de reacción se puede medir en: a) mol · s. b) mol · s-1 . c) mol · L-1 · s-1. d) dm3 · s-1. a) mol · s son unas unidades incorrectas, pues el tiempo debe estar elevado al exponente negativo -1. b) mol · s-1 .son unas unidades correctas para una variación de las sustancias en mol. -1 -1 c) mol · L · s . son unas unidades correctas para una reacción homogénea a través de la variación con el tiempo de la concentración en mol/L. d) dm3 · s-1.son unas unidades correctas, para el caso de una reacción en fase gaseosa. 2. Marca como V (verdadera) o F (falsa) cada una de las siguientes posibles respuestas a lo que se entiende por acción de un catalizador: a) Impide que ocurra la reacción inversa. b) Aumenta la energía cinética de las partículas de los reactivos. c) Hace que la variación de la entalpía de la reacción sea más negativa. d) Disminuye la energía de activación de la reacción. Teniendo en cuenta la definición de catalizador: a) Impide que ocurra la reacción inversa es una afirmación falsa. b) Aumenta la energía cinética de las partículas de los reactivos es una afirmación falsa. c) Hace que la variación de la entalpía de la reacción sea más negativa es también una afirmación falsa. d) Disminuye la energía de activación de la reacción es una afirmación verdadera. 3. Las sustancias A y B reaccionan para formar productos, siendo 3 el orden global de esta reacción. ¿Cuál de las siguientes ecuaciones de velocidad puede 2 3 ser no correcta para describir el proceso?: a) v = k · [A] · [B]. b) v = k · [A] . c) v = 2 3 k · [A]· [B] . d) v = k · [A]· [B] . a) v = k · [A]2 · [B] puede ser correcta. b) v = k · [A]3 puede ser también correcta. c) v = k · [A]· [B]2 también es válida. d) v = k · [A]· [B]3 es incorrecta. 4. Rellena los huecos en la siguiente frase: Los conceptos espontaneidad y rapidez _______ directamente relacionados entre sí. Uno es ____________ y el otro ________. La frase es la siguiente: 6 125 Los conceptos espontaneidad y rapidez no están directamente relacionados entre sí. Uno es termodinámico y el otro cinético. 5. Velocidad media y velocidad instantánea son: a) Iguales b) Diferentes. c) Valores constantes. d) Valores crecientes. a) Iguales es falso pues son conceptos diferentes. b) Diferentes es correcto. c) Valores constantes es incorrecto, pues ambos velocidades suelen variar con el tiempo de reacción. d) Valores crecientes es incorrecto, pues suelen disminuir al avanzar la reacción. 6. La representación gráfica de la concentración de un reactivo frente al tiempo en una reacción de primer orden es: a) Una recta de pendiente positiva. b) Una recta de pendiente negativa. c) Una parábola. d) Una hipérbola. La respuesta correcta es la d): Una hipérbola asíntota frente a los ejes X e Y. 7. Marca como V (verdadera) o F (falsa) cada una de las siguientes afirmaciones: a) La velocidad de reacción decrece al disminuir la concentración de los reactivos. b) La constante de velocidad disminuye al variar la concentración de los reactivos. c) El orden de reacción depende de los coeficientes estequiométricos. d) La entalpía de la reacción depende del valor de la energía de activación. a) La velocidad de reacción decrece al disminuir la concentración de los reactivos es una afirmación correcta b) La constante de velocidad disminuye al variar la concentración de los reactivos es una afirmación falsa. c) El orden de reacción depende de los coeficientes estequiométricos no necesariamente puede ser así, aunque lo normal es que no sea así. d) La entalpía de la reacción depende del valor de la energía de activación es una afirmación falsa. 8. Rellena los huecos de la siguiente definición: Molecularidad de una reacción química es el ______ de moléculas, átomos o iones que intervienen en una ______ _______. La definición es: Molecularidad de una reacción química es el número de moléculas, átomos o iones que intervienen en una etapa elemental. 3 9. Si la velocidad de reacción es 120 cm /min, también es: a) 0,02 L/s. b) 0,02 L/s. 7 126 c) 0,002 L/s. d) 0,0002 L/s. 3 v = 120 cm · min 10 −3 L cm 3 = 0,002 L s s 60 min Luego la respuesta correcta es la: c). 10. ¿Cómo es la energía de activación de la reacción química directa: A + 2 B → C + 2 D; ∆H = + 25 kJ?: a) – 25 kJ. b) + 25 kJ. c) Inferior a + 25 kJ. d) Mayor que + 25 kJ. La energía de activación siempre es una cantidad positiva y como: ∆H = Ea, reactivos – Ea, productos = + 25 kJ, resulta que: Ea, reactivos = ∆H + Ea, productos = 25 kJ + Ea, productos > 25 kJ Luego la respuesta correcta es la: d) Actividades finales: 1. ¿Qué diferencia hay entre las dos gráficas siguientes de la velocidad de una reacción?: Las dos representan el aumento de la concentración de un producto P frente al tiempo. La primera gráfica sirve para hallar la velocidad de reacción instantánea en el punto M, trazando la pendiente a la gráfica en dicho punto TM, a partir de los valores B y A, de forma que: v t = tM = [P] B - [P ] A tB − t A La segunda gráfica proporciona el valor de la velocidad de reacción media entre los puntos D2 y D1, de forma que: v media = [P] 2 - [P ]1 t 2 − t1 8 127 2. La reacción: 2 A + B → C es una reacción elemental. a) Escribe su ecuación de velocidad. b) Indica las unidades de la velocidad de reacción y de la constante cinética. c) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura a volumen constante. d) Justifica cómo afecta a la velocidad de reacción un aumento del volumen a temperatura constante. a) En este caso: v = k · [A]2 · [B] b) Al ser una reacción en fase gaseosa, y, por tanto, una reacción homogénea, -1 -1 entonces: las unidades de v son: mol · L · s . Para k, se tiene que: k = mol · L−1 · s −1 (mol · L−1 ) 2 · mol · L−1 v , luego sus unidades son: [ A ] · [B ] 2 = mol −2 · L−2 · s −1 c) La velocidad de la reacción aumenta al crecer la temperatura, pues se incrementan el número de choques efectivos que dan lugar a que los reactivos se transformen en productos y aumenta el valor de la constate k de la ecuación de Arrhenius. d) Al aumentar el volumen, la concentración de los reactivos disminuye y la velocidad de la reacción disminuye de acuerdo con la expresión de la ecuación de velocidad. En este caso la constante k no sufre variación alguna. 3. ¿Cuál de las siguientes gráficas se obtendrá cuando, una vez realizadas las experiencias oportunas, se representa la velocidad inicial de una reacción química de primer orden de descomposición del reactivo A, frente a la concentración inicial de éste? La ecuación de velocidad para una cinética de primer orden es. v = k · [A], lo que indica que la velocidad es directamente proporcional a la concentración del reactivo, y la gráfica correcta es la a). 4. La ecuación de velocidad de la reacción: X + Y → Productos es de primer orden tanto respecto de X como de Y. Si las concentraciones iniciales de X e Y -1 -1 son, respectivamente, 0,15 mol · L y 0,75 mol · L y la velocidad de reacción es 4,2 · 10-3 mol · L-1 · s-1. Calcula: a) El valor de la constante de velocidad. b) La velocidad de reacción cuando las concentraciones de X e Y son 0,5 mol · L-1. 9 128 a) En este caso: v = k · [X] · [Y] k = k= 4,2 · 10 −3 mol · L−1 · s −1 0,15 mol · L−1 · 0,75 mol · L−1 -1 -1 v , luego: [ X ] · [Y ] = 0,0373 mol −1 · L ·s −1 -1 -1 -3 -1 -1 b) v = 0,0373 mol · L · s · 0,5 mol · L · 0,5 mol · L = 9,3 · 10 mol · L · s 5. La velocidad de la reacción: A + B → C se duplica cuando también lo hace la concentración del reactivo A, mientras que se cuadriplica cuando la concentración del reactivo B se hace doble. ¿Cuál es la ecuación de velocidad de dicha reacción? Para la reacción: A + B → C, su ecuación de velocidad es: v = k · [A]α · [B]β Si la velocidad de reacción se duplica cuando lo hace también [A] es que: v2 = k · [2A]α · [B]β y solo puede ser igual a 2 v1, si α = 1. Por otro lado, al duplicarse [B] la velocidad se cuadriplica es porque: v2 = k · [A]α · [2B]β y solo puede ser igual a 4 v1, si β = 2. Luego: v = k · [A] · [B]2 6. Establece las unidades de la constante de velocidad de una reacción de orden global cero, cuando las concentraciones se expresan en mol · L-1 y el tiempo en s. -1 -1 En este caso: v = k y las unidades de k son mol · L · s . 7. Para la reacción: 2 NO2 (g) + F2 (g) → 2 NO2F (g), donde: v = k · [NO2] · [F2]. a) Escribe la expresión de la ecuación de velocidad en función de los reactivos y del producto de la reacción. b) Explica si el orden de reacción coincide con la molecularidad. c) Justifica cómo se lograría aumentar la velocidad de la reacción, bien duplicando la cantidad inicial de NO2 o bien duplicando la cantidad inicial de F2, manteniendo en ambos casos el volumen constante. a) v = − ∆[F2 ] 1 ∆[NO2 ] 1 ∆[NO2 F ] · =− =+ · 2 ∆t ∆t 2 ∆t b) Puesto que la ecuación cinética es: v = k · [NO2] · [F2], resulta que el orden de reacción es 1 +1 = 2. Se trata, por tanto, de una cinética de segundo orden. En este caso el orden parcial del F2 coincide con su coeficiente estequiométrico, pero no sucede así con el NO2. Se trata de una reacción no elemental, cuyo mecanismo de reacción se desconoce, pero en cualquier caso no coincide orden de reacción con molecularidad. c) En este caso por ser los ordenes de reacción del F2 y del NO2 iguales y de valor unidad, la velocidad de reacción aumenta lo mismo duplicando la concentración inicial de NO2 como de F2. 10 129 8. Muestra en la reacción general: a A + b B → c C + d D, que es exotérmica el diagrama energético con la energía de activación de la misma, sin y con catalizador. Sin catalizador es el siguiente: Con catalizador es el siguiente: 9. Si en el curso de una reacción química se añade un catalizador, razona si las siguientes frases son verdaderas o falsas: a) La entalpía de la reacción disminuye. b) El orden de reacción disminuye. c) La velocidad de reacción aumenta. a) Es falsa, un catalizador modifica la velocidad de reacción, pero no altera sus funciones termodinámicas. b) Falsa: El orden de reacción es la suma de los exponentes a los que están elevadas las concentraciones de los reactivos en la ecuación de velocidad. Dicha ecuación es función del mecanismo o etapas mediante la cual se realiza la reacción, y, en principio, no se ve afectada por la presencia de catalizadores. c) Verdadera, pues un catalizador lo que hace es aumentar la velocidad de reacción. 10. La energía de activación de la reacción directa: A + B → C + D es 32 kJ y para la reacción inversa 58 kJ. a) ¿Cómo será la reacción directa, endotérmica o exotérmica? b) Si la entalpía media de los productos es 30 kJ, ¿cómo es la de 11 130 los reactivos? a) ∆H = Ea, reactivos – Ea, productos = 32 kJ – 58 kJ = - 26 kJ, por lo que la reacción es exotérmica. b) Igualmente: ∆H = H productos – H reactivos = - 26 kJ, luego: H reactivos = H productos – ∆H reactivos = 30 kJ – (26 kJ) = 56 kJ 11. Sea la reacción endotérmica: A + B → C, dibuja el diagrama energético con la energía de activación, tanto para la reacción directa como la inversa. Es el siguiente: 12. Se han obtenido los siguientes datos, a una determinada temperatura, para la reacción: 2 A + B → C: Experiencia [A] inicial en mol ·L-1 [B] inicial en mol ·L-1 vinicial en mol · L-1 · s-1 1 0,2 0,2 5,4 · 10-3 2 0,4 O,2 10,8 · 10-3 3 0,4 0,4 21,6 · 10-3 Determina: a) El orden de reacción respecto de A y B y la ecuación de velocidad. b) La constante de velocidad. a) Para la reacción: 2 A + B → C, su ecuación de velocidad es: v = k · [A]α · [B]β Para determinar α se toman las dos experiencias en las que [B] es constante, la 1 y la 2 y observamos, que al duplicarse la concentración de A su velocidad también se duplica, por lo que α = 1. Repitiendo el procedimiento para β en las experiencias 2 y 3, vemos que la velocidad se duplica cuando también lo hace [B], por lo que β = 1. Luego la ecuación de velocidad es: v = k · [A] · [B] b) Para calcular k basta con tomar los valores de cualquiera de las tres experiencias, por lo que, por ejemplo, a partir de la primera resulta: k= 5,4 · 10 −3 mol · L−1 · s −1 −1 −1 0,2 mol · L · 0,2 mol · L = 0,135 mol −1 · L ·s −1 13. En la ecuación de la reacción: N2 + 3 H2 → 2 NH3, el N2 reacciona a la 12 131 -1 -1 velocidad 0,5 mol · L · min . Escribe la expresión de la ecuación de velocidad y determina cuál es la velocidad de formación de NH3 y la de desaparición de H2. Según la estequiometría de la reacción: N2 + 3 H2 → 2 NH3, cada mol de N2 reacciona con 3 mol de H2 y origina 2 mol de NH3. Luego: v =− d [N 2 ] 1 d [H 2 ] 1 d [NH 3 ] =− =+ · dt 3 dt 2 dt Por tanto, la velocidad con la que desaparece el H2 es: mol mol d [H 2 ] 1 d [H 2 ] v =− − = 3 · 0,5 L = 1,5 L 3 dt min min dt Y la velocidad con la que aparece el NH3 es: mol mol d [NH 3 ] 1 d [NH 3 ] v= · = 2 · 0,5 L = 1,0 L 2 dt dt min min 14. Con objeto de identificar la cinética de la reacción: A + B → Productos, se determinaron en el laboratorio las velocidades iniciales de la reacción para distintos valores de concentración de los reactivos, siempre en las mismas condiciones de presión y temperatura, de forma que la siguiente tabla muestra los valores de cada uno de los valores medidos: Experiencia [A]0 en mol ·L-1 [B]0 en mol ·L-1 vinicial en mol · L-1 · s-1 1 0,02 0,01 4,4 · 10-4 -4 2 0,02 O,02 17,6 · 10 3 0,04 0,02 35,2 · 10-4 4 0,04 0,04 140,8 · 10-4 Determina: a) El orden de la reacción respecto de A, de B y el global. b) La constante de velocidad. c) Sabiendo que la constante de velocidad se multiplica por 74 cuando la temperatura a la que se realiza la reacción pasa de 300 K a 400 K, halla la energía de activación. a) La ecuación de velocidad es: v = k · [A]α · [B]β Comparando las experiencias 2 y 1 se tiene que: 17,6 · 10-4 mol · L-1 · s-1 = k · (0,02 mol · L-1)α · (0,02 mol · L-1)β 4,4 · 10-4 mol · L-1 · s-1 = k · (0,02 mol · L-1)α · (0,01 mol · L-1)β Dividiendo miembro a miembro se obtiene: 17,6 17,6 = 2 β y como: = 4 = 2 2 , entonces: 2 β = 2 2 β = 2 4,4 4,4 Comparando ahora las experiencias 4 y 2 se tiene que: -4 -1 -1 -1 -1 140,8 · 10 mol · L · s = k · (0,04 mol · L )α · (0,04 mol · L )β 13 132 -4 -1 -1 -1 -1 17,6 · 10 mol · L · s = k · (0,02 mol · L )α · (0,02 mol · L )β Dividiendo miembro a miembro se obtiene: 140,8 140,8 = 2α · 2 β y como: = 8 = 2 3 , entonces: 2 3 = 2α · 2 β α = 1 17,6 17,6 Luego la ecuación de velocidad es: v = k · [A] · [B] 2 La reacción es de primer orden respecto a A, de segundo orden respecto a B y el orden global de la reacción es 3. b) Para hallar k se puede utilizar los valores de cualquiera de las experiencias, de forma que a partir de la primera se tiene: k= v 4,4 · 10 −4 mol · L−1 · s −1 = = 220 mol −2 · L2 · s −1 2 −1 −1 2 [ A ] · [B ] 0,02 mol · L · (0,01 mol · L ) c) Aplicando para las dos temperaturas la ecuación: k = A · e k1 = A · e − Ea R · T1 y k2 = A · e − Ea R ·T , resulta que: − Ea R · T2 Como k2 = 74 · k1, T1 = 300 K y T2 = 400 K, entonces al dividir miembro a miembro la segunda ecuación entre la primera se obtiene: − Ea − Ea R · 400 K 1 1 74 = e 74 = ( − ) − Ea R 400 K 300 K e R · 300 K e Tomando logaritmos neperianos resulta: ln 74 = − Ea 1 1 ( − ) Ea = R 400 K 300 K J · ln 74 mol · K 1 1 ( − ) 400 K 300 K − 8,314 = 42940,8 J mol 15. En la obtención del ácido nítrico, la etapa principal es la oxidación del óxido nítrico a dióxido de nitrógeno mediante la ecuación: 2 NO (g) + O2 (g) → 2 NO2 (g). Esta reacción es de orden 2 respecto del NO y de orden 1 respecto del O2 y la constante de velocidad a 250 °C es 6,5 ·10-3 mol-2 · L2 · s-1. Calcula: a) La velocidad de oxidación del NO a dicha temperatura cuando las concentraciones de los reactivos son: a) [NO] = 0,100 mol · L-1 y [O2] = 0,210 mol · L-1. b) [NO] = 0,200 mol · L-1 y [O2] = 0,420 mol · L-1. 2 La ecuación de velocidad es: v = k · [NO] · [O2] -3 -2 2 -1 -1 2 -1 a) v = 6,5 ·10 mol · L · s · (0,100 mol · L ) · (0,210 mol · L ) = -5 -1 -1 = 1,37 · 10 mol · L · s 14 133 b) v = 6,5 ·10-3 mol-2 · L2 · s-1 · (0,200 mol · L-1)2 · (0,420 mol · L-1) = -4 -1 -1 = 1,09 · 10 mol · L · s En este caso en el que se han duplicado las concentraciones, la velocidad es ocho veces mayor. 16. Determina el orden global de la reacción: CH3-Cl (g) + H2O (g) → CH3-OH (g) + HCl (g) a partir de los datos: -1 -1 -1 -1 Experiencia [CH3-Cl] en mol ·L [H2O] en mol ·L v en mol · L · s 1 0,25 0,25 2,83 2 0,50 O,25 5,67 3 0,25 0,50 11,35 La ecuación de velocidad es: v = k · [CH3-Cl]α · [H2O]β Tomando logaritmos resulta que: log v = log k + α log [CH3-Cl] + β log [H2O] Por lo que para las tres experiencias y teniendo en cuenta que se utilizan las unidades de las magnitudes físicas de la tabla, resulta que: log 2,83 = log k + α log 0,25 + β log 0,25 (1) log 5,67 = log k + α log 0,50 + β log 0,25 (2) log 11,35 = log k + α log 0,25 + β log 0,50 (3) De forma que si restamos dos ecuaciones en las que se mantenga constante uno de los reactivos, se puede obtener el orden de reacción parcial del otro. Así, al efectuar: (1) - (2) se elimina k y [H2O] y resulta: log 2,83 – log 5,67 = α log 0,25 - α log 0,50, por lo que: log 2,83 0,25 = α log α=1 5,67 0,50 Análogamente efectuando: (1) – (3) resulta: log 2,83 – log 11,35 = β log 0,25 - β log 0,50, por lo que: log 2,83 0,25 = β log β=2 11,35 0,50 Por lo que: v = k · [CH3-Cl] · [H2O]2 Y el orden global de la reacción es: 1 + 2 = 3 17. ¿Cuál es el valor de la energía de activación para una reacción química en la que la constante de velocidad se duplica cuando la temperatura aumenta de 15 °C a 25 °C? 15 134 Aplicando la ecuación: k = A · e k1 = A · e − Ea R · T1 y k2 = A · e − Ea R ·T , resulta que: − Ea R · T2 Como k2 = 2 · k1, T1 = 288 K y T2 = 298 K, entonces al dividir miembro a miembro la segunda ecuación entre la primera se obtiene: − Ea − Ea R · 298 K 1 1 2=e 2= ( − ) − Ea R 298 K 288 K e R · 288 K e Tomando logaritmos neperianos resulta: ln 2 = − Ea 1 1 ( − ) Ea = R 298 K 288 K J · ln 2 mol · K 1 1 ( − ) 298 K 288 K − 8,314 = 4,95 · 10 4 J mol 18. Una sustancia A se descompone mediante una cinética en la que su constante de velocidad es 5,2 · 10-2 en las unidades correspondientes y tiene -1 una concentración inicial de 2 mol · L . Halla el tiempo de semireacción, suponiendo que es de: a) Primer orden. b) Segundo orden. a) En este caso: A → Productos, y la ecuación de velocidad es: v = k · [A], donde: -2 -1 k = 5,2 · 10 s de forma que: t yt 1/ 2 1/ 2 = = ln 2 k ln 2 ln 2 = = 13,3 s k 5,2 · 10 − 2 s −1 2 b) En este caso: v = k · [A] y t -2 -1 1/ 2 = 1 k · [ A] 0 -1 Ahora: k = 5,2 · 10 L · mol · s de forma que: t 1/ 2 = 5,2 · 10 −2 1 = 9,6 s L · mol −1 · s −1 · 2 mol · L−1 16 135








