A. REACCIONES DE ADICIÓN diagrama-de-energia-en-la-sn1.html
Anuncio
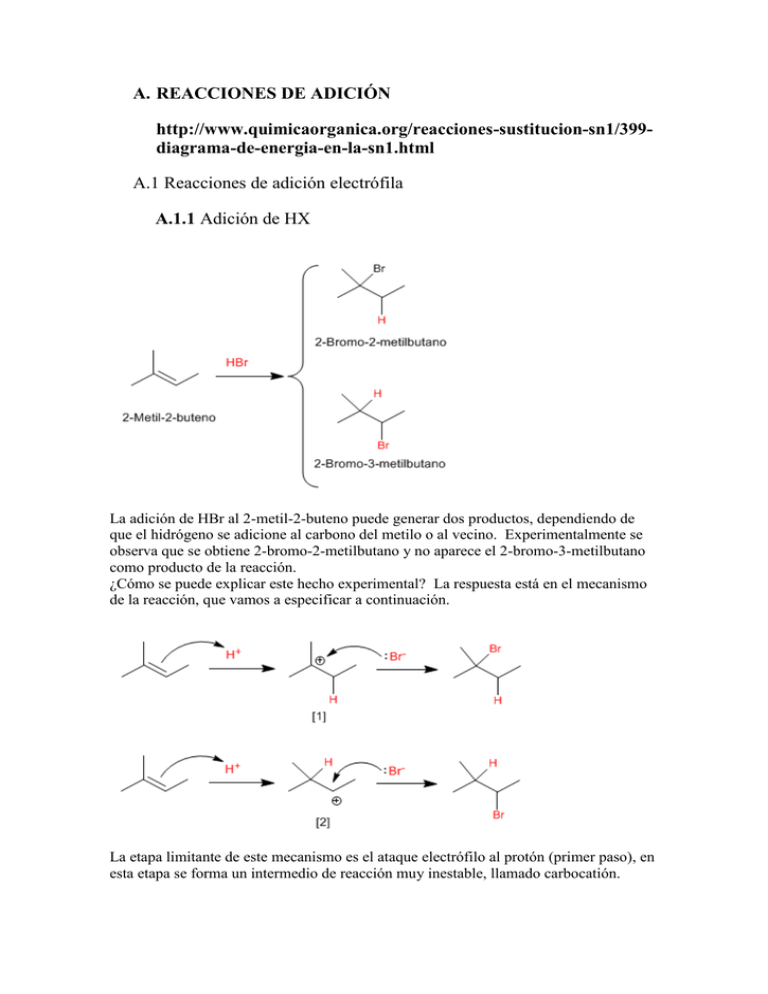
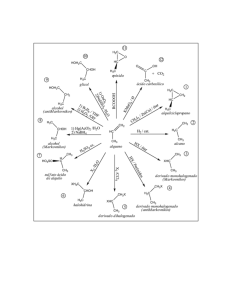
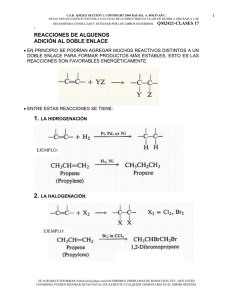
A. REACCIONES DE ADICIÓN http://www.quimicaorganica.org/reacciones-sustitucion-sn1/399diagrama-de-energia-en-la-sn1.html A.1 Reacciones de adición electrófila A.1.1 Adición de HX La adición de HBr al 2-metil-2-buteno puede generar dos productos, dependiendo de que el hidrógeno se adicione al carbono del metilo o al vecino. Experimentalmente se observa que se obtiene 2-bromo-2-metilbutano y no aparece el 2-bromo-3-metilbutano como producto de la reacción. ¿Cómo se puede explicar este hecho experimental? La respuesta está en el mecanismo de la reacción, que vamos a especificar a continuación. La etapa limitante de este mecanismo es el ataque electrófilo al protón (primer paso), en esta etapa se forma un intermedio de reacción muy inestable, llamado carbocatión. La mayor estabilidad del carbocatión [1] (terciario), comparada con la del carbocatión [2] (secundario), hace que el primer mecanismo sea más favorable que el segundo. A.1.2 Adición de halógenos El cloro y el bromo se adicionan a alquenos para dar 1,2-dihaloalcanos. Por ejemplo, el 1,2-dicloroetano es sintetizado por la adición de cloro a eteno. El F2 y el I2 no se emplean como reactivos en esta reacción. El Fluor reacciona de forma explosiva con alquenos y la adición de I2 es termodinamicamente desfavorable. El mecanismo de esta reacción involucra la formación del ion bromonio en una primera etapa. En el segundo paso, el Br- actúa como nucleófilo abriendo el ciclo del ion bromonio para formar un 1,2-dibromoalcano A.1.3 Hidrogenación de alquenos La hidrogenación es la adición de hidrógeno al doble enlace para formar alcanos. Platino y paladio son los catalizadores más comúnmente usados en la hidrogenación de alquenos. El paladio se emplea en forma de polvo absorbido en carbón (Pd/C). El platino se emplea como PtO2 (Catalizador de Adams). A.2 Reacciones de adición nucleófila A.2.1 Formación de cianhidrinas Las cianhidrinas [3] se forman por reacción de aldehídos o cetonas [1] con ácido cianhídrico [2] y son compuestos que contienen un grupo cinano y un hidroxi sobre el mismo carbono. El mecanismo de la reacción transcurre en dos etapas: Etapa 1. Los iones cianuro actúan como nucleófilos atacando al carbono carbonilo. El ácido cianhídrico es demasiado débil para generar cantidades importantes de cianuro, por ello, se añade cianuro de sodio o potasio al medio, garantizando la cantidad suficiente de cianuro para que la reacción transcurra en buen rendimiento. Etapa 2. En este paso el ión alcóxido [4] se protona arrancando hidrógenos al ácido cianhídrico. En esta etapa se regeneran los iones cianuro. Síntesis de alcoholes mediante SN1 Los sustratos secundarios y terciarios reaccionan con agua mediante mecanismo SN1 para formar alcoholes. La SN1 tiene un mecanismo por etapas. En el primer paso se ioniza el sustrato por pérdida del grupo saliente, sin que el nucleófilo actúe, formándose un carbocatión. En el segundo paso el nucleófilo ataca al carbocatión formado, obteniéndose el producto final. La etapa lenta del mecanismo es la formación del carbocatión, dependiendo la velocidad exclusivamente del sustrato. Síntesis de alcoholes mediante SN2 Los haloalcanos primarios reaccionan con hidróxido de sodio para formar alcoholes. Haloalcanos secundarios y terciarios eliminan para formar alquenos.