Trabajo Práctico N°2
Anuncio

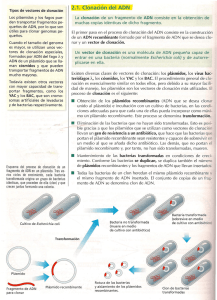
Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012- Trabajo Práctico N°2 VECTORES DE CLONADO Dr. Sergio Cuozzo 1- Objetivos • Que el alumno comprenda la importancia del uso de los vectores de clonado para la tecnología del ADN recombinante. • Que el alumno conozca las aplicaciones y usos de los vectores de clonado. • Que el alumno adquiera destrezas conducentes a la manipulación de vectores de clonado en el laboratorio. • Que el alumno pueda interpretar los resultados obtenidos en relación al objetivo del experimento planteado. 2- Introducción TECNOLOGIA DEL ADN RECOMBINANTE La tecnología del ADN recombinante constituye una suma de técnicas siendo las más importantes: • La rotura específica del ADN mediante nucleasas de restricción, que facilita el aislamiento y la manipulación de los genes individuales. • La secuenciación rápida de todos los nucleótidos de un fragmento purificado de ADN, que posibilita determinar los límites de un gen y la secuencia de aminoácidos que codifica. • La hibridación de los ácidos nucleicos que hace posible localizar secuencias determinadas de ADN o ARN, utilizando la capacidad que tienen estas moléculas de unirse a secuencias complementarias de otros ácidos nucleicos. • La clonación del ADN, mediante la cual se puede conseguir que un fragmento de ADN se integre en un elemento génico autorreplicante (vectores de clonado y expresión) que habita en una bacteria, de tal manera que una molécula simple de ADN puede ser producida generando muchos miles de millones de copias idénticas. • La ingeniería genética mediante la cual se pueden alterar secuencias de ADN produciendo versiones modificadas de los genes, los cuales se pueden insertar a células u organismos. VECTORES DE CLONADO Un Vector es un agente que lleva un fragmento de ADN foráneo a una célula huésped. Si se lo utiliza con el fin de reproducir el fragmento de ADN, se llama vector de clonado. Si se usa para expresar un gen de interés, se llama vector de expresión. Los vectores -1- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012comúnmente utilizados son plásmidos, fago Lambda, cósmidos y cromosoma artificial de levadura (YAC). Un típico vector de clonado. Contiene un sitio de policlonado( polilinker), un gen de resistencia a Ampicilina (ampr) como marcador y un origen de replicación (ORI). Modelo de clonado. Utilizando un plásmido se inserta y liga un fragmento con un gen de interés. Capacidad de almacenaje: hasta 25 Kb. Los plásmidos se utilizan en ingeniería genética como vectores de clonado por la facilidad con la que se manipulan. Un vector plasmídico se fabrica a partir de plásmidos naturales cuyos segmentos innecesarios son eliminados, agregándose en cambio secuencias esenciales. Para clonar una muestra de la ADN, se debe utilizar la misma enzima de restricción para cortar el vector y la muestra de ADN. Por lo tanto, un vector contiene generalmente una secuencia (polylinker) que pueda reconocer varias enzimas de restricción para poder utilizar el vector para clonar diversos fragmentos de ADN. PLÁSMIDOS. DEFINICIÓN. REPLICACIÓN. TAMAÑO Y NÚMERO. Son moléculas de ADN extracromosómico circular o lineal, independientes del ADN cromosómico. Están presentes normalmente en bacterias, y más raramente en organismos eucariotas. -2- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012Tienen capacidad de replicación autónoma, es decir, constituyen replicones propios. Todos los plásmidos bacterianos estudiados son de ADN de cadena doble. La inmensa mayoría son circulares cerrados covalentemente (C.C.C.) y superenrollados aunque en Borrelia y algunos actinomycetes existen plásmidos lineares. Algunos plásmidos poseen, además, la capacidad de integrarse reversiblemente en el cromosoma bacteriano: en esta situación se replican junto con el cromosoma (bajo el control de éste), y reciben el nombre de episomas. En cuanto al tamaño, existe una amplia gama: desde plásmidos muy pequeños (de unas 2 kb) hasta plásmidos muy grandes (ciertos plásmidos de Pseudomonas tienen 500 kb). Incluso existen “megaplásmidos” en ciertos Rhizobium que llegan a tener 1600 kb. Cada tipo de plásmido tiene un número medio de copias por célula característico. Por regla general, los grandes plásmidos tienen una o dos copias por célula (plásmidos con control estricto de la replicación), mientras que los pequeños suelen estar presentes como varias copias (>10), denominándose plásmidos de control relajado. En función de que los plásmidos sean o no transmisibles de una bacteria a otra por medio de contactos intercelulares, se pueden distinguir: • plásmidos conjugativos (autotransmisibles), que son aquellos que se transfieren entre cepas por medio de fenómenos de conjugación. Algunos de estos plásmidos no sólo se transfieren entre cepas de la misma especie, sino que son capaces de hacerlo entre especies y géneros muy diversos, recibiendo el muy apropiado nombre de plásmidos promiscuos o de amplio espectro de hospedadores, -3- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012- • permitiendo transferencia horizontal de información genética entre grupos bacterianos filogenéticamente alejados. plásmidos no conjugativos, carentes de esta propiedad de conjugación. Dentro de esta categoría existe un subgrupo, el de los plásmidos movilizables: son aquellos no autotransmisibles que pueden ser transferidos por la acción de un plásmido conjugativo coexistente en la misma bacteria. Los plásmidos no suelen ser indispensables para la viabilidad de la bacteria, y muchos de ellos se pierden en ausencia de una presión selectiva. Una bacteria puede ser “curada” de su(s) plásmido(s), cuando desaparecen de forma espontánea o por una serie de tratamientos experimentales (incubando las bacterias a temperaturas cercanas a la máxima o por agentes químicos como el naranja de acridina, que se insertan entre las bases del ADN). La razón de esta curación de los plásmidos es que esos tratamientos interfieren con su replicación sin afectar a la replicación del cromosoma. Esto hace que en sucesivas divisiones de una bacteria, el plásmido se vaya “diluyendo” en la población resultante. FENOTIPOS Y FUNCIONES DETERMINADOS POR PLÁSMIDOS Los plásmidos no suelen determinar productos esenciales para el crecimiento (por eso son dispensables), pero en la naturaleza parece que resultan favorecidas las bacterias con algún plásmido, quizá porque acarrean ventajas selectivas en determinados ambientes o en determinadas condiciones. Existe una variedad de fenotipos y funciones determinados por plásmidos: • • • • • • • • • Resistencia a antibióticos (plásmidos R; los estudiaremos en la sección de Genética). Resistencia a metales pesados (por ejemplo, resistencia a mercurio). Plásmidos de virulencia: producción de toxinas, factores de penetración en tejidos, adherencia a tejidos del hospedador, etc., en ciertas bacterias patógenas. Producción de bacteriocinas (proteínas tóxicas producidas por bacterias que matan a otras de la misma especie). Producción de sideróforos (quelatos para secuestrar iones Fe3+). Utilización de determinados azúcares. Utilización de hidrocarburos, incluyendo algunos cíclicos recalcitrantes (degradación de tolueno, xileno, alcanfor, etc.) en Pseudomonas. Inducción de tumores en plantas (plásmido Ti de Agrobacterium tumefaciens). Interacciones simbióticas y fijación de nitrógeno en ciertos Rhizobium. Hay plásmidos que, aunque se pueden evidenciar por métodos físicos (p. ej., electroforesis), no se ha podido demostrar que determinen ningún rasgo fenotípico: tales plásmidos se califican como crípticos, constituyendo un ejemplo de “ADN egoísta” (sólo se mantienen por su capacidad de replicación, sin necesidad de aportar ventaja selectiva clara a la bacteria que los alberga). -4- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012REPLICACIÓN Los plásmidos son replicones, es decir, unidades de replicación autónoma, pero no codifican toda la maquinaria para su propia replicación. La mayoría de los plásmidos sólo codifican unas pocas proteínas para este fin, y aprovechan la maquinaria de replicación de la bacteria huésped (ADN polimerasas, ligasas, primasas, etc), que actúa sobre unas secuencias del plásmido denominadas secuencias oriV, donde tiene lugar el inicio de esa replicación. Cada tipo de plásmido se replica por uno de dos principales tipos de mecanismos: • Modelo de replicación en θ (theta): comienza por la separación de las dos cadenas en el sitio oriV, creando una estructura que se parece a la letra griega θ (theta). En algunos plásmidos, la replicación es unidireccional (sólo hay una horquilla de replicación , que avanza a lo largo de la molécula, hasta que vuelve al sitio oriV, en el que las dos moléculas hijas se separan). Otros plásmidos se replican en θ por un modelo bidireccional (dos horquillas de replicación de sentidos opuestos, que se encuentran cerca de la mitad de la molécula). La replicación en θ es frecuente en plásmidos de bacterias Gram-negativas. • Modelo de replicación en σ (sigma), o modelo del círculo rodante: una de las dos cadenas es rota a nivel de oriV, de modo que el extremo 3’ suministra el cebador para la replicación de la “cadena adelantada”. La cadena desplazada (cadena “menos”) funciona como cadena retrasada (“lagging”) y debe ser replicada a partir de sitios de cebado especiales. Este tipo de replicación es frecuente en plásmidos de bacterias Gram-positivas. NÚMERO DE COPIAS Y SU REGULACIÓN La regulación del número medio de copias de cada plásmido en cada bacteria es una propiedad característica dependiente de cómo se controla el inicio de replicación, siendo diferentes los mecanismos en los plásmidos de alto número de copias (con control relajado) y en los plásmidos de bajo número de copias (de control estricto). En general, los plásmidos de control relajado tienen mecanismos que inhiben el inicio de replicación sólo cuando el número de copias ha llegado a un cierto nivel. En cambio, los plásmidos de control estricto tienen mecanismos que logran que sólo se repliquen una vez o un pequeño número de veces en cada ciclo celular. REPARTO DE LAS COPIAS A LAS CÉLULAS HIJAS Muchos plásmidos poseen sistemas de reparto (= partición), que tienden a asegurar que una vez que el plásmido ha sido replicado, cada una de las células hijas va a recibir al menos una copia. A falta de un tal sistema, y si el reparto fuera aleatorio, de vez en cuando, las propias fluctuaciones de la segregación aleatoria harían que parte de la progenie no recibiera una copia, con lo que quedaría curada de ese plásmido. -5- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012El reparto de las copias a las células hijas se suele deber a las llamadas funciones par, que están cerca de los genes rep y de la zona ori. Se trata de cortas secuencias de ADN que de alguna manera aún no aclarada, debe unirse a alguna zona de la membrana de la bacteria que se duplica durante la división celular, de modo que cada copia, unida a una de esas zonas, se segrega a una célula hija. INCOMPATIBILIDAD ENTRE PLÁSMIDOS Y GRUPOS DE INCOMPATIBILIDAD Cada plásmido, dentro de la amplia diversidad de los que se conocen, se suele clasificar según el grupo de incompatibilidad al que pertenece (los grupos de incompatibilidad se suelen denominar con las siglas Inc seguidas de una letra mayúscula (por ejemplo IncP, IncFII, etc.). Se dice que dos plásmidos son incompatibles cuando no pueden coexistir establemente en la misma bacteria en ausencia de una presión selectiva permanente. Grupo de incompatibilidad es el conjunto de plásmidos incompatibles entre sí. La incompatibilidad depende del hecho de que los distintos miembros de un mismo grupo poseen el mismo tipo de sistema de control del número de copias y de reparto de dichas copias a las células hijas. En cada célula con dos plásmidos distintos del mismo grupo de incompatibilidad, el número total de copias nA+nB = N (determinado por el sistema de control) no varía, pero por fluctuaciones aleatorias en el reparto, algunas células heredan más copias de uno de los plásmidos que del otro, y tras varias generaciones aparecen células carentes de uno o del otro plásmido (nA = 0 y nB = N, o viceversa). BACTERIÓFAGOS Los bacteriófagos (fago lambda) constituyen otra forma de transporte de secuencias de interés de un organismo a otro. En este caso, el gen es ligado con el ADN viral que luego se empaqueta y por el mecanismo de transducción, se introduce a una célula huésped. La ventaja principal del fago λ es su alta eficacia de transformación, cerca de 1000 veces más eficiente que el vector plasmídico. Las extremidades del ADN del fago lambda se conocen como sitios cos, cada uno simple cadena de 12 nucleótidos de largo. Debido a que sus secuencias son complementarias entre sí, las secuencias terminales del DNA del fago pueden aparearse, formando concatámeros. Los dos extremos del DNA del fago pueden también ligarse, formando una ADN circular. Capacidad de almacenaje: hasta 25 Kb. -6- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012- CÓSMIDOS Los cósmidos surgen de una combinación de vectores plasmídicos con fragmentos de ADN derivados del genoma del fago lambda que poseen un borde cohesivo (extremos cos). Estos extremos permiten que el ADN se circularice y asemeje un plásmido con capacidad de empaquetar fragmentos largos de ADN en el interior de un fago (hasta 45 kb). Otra ventaja lo constituye su alta eficiencia de transformación. -7- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012- Clonación usando cósmidos. (a) Además de Ampr, de ORI, y de polylinker como en el vector plasmídico, el cósmido también contiene un sitio cos. (b) Después de que los cósmidos son cortados con enzimas de restricción, se ligan con los fragmentos de ADN. Los pasos subsecuentes de ensamblaje y transformación son iguales que en la clonación con fagos λ. YACs Los cromosomas artificiales de levadura (YAC) son vectores capaces de llevar largos fragmentos de DNA (hasta 2 Mb) pero su eficiencia de transformación es muy baja. -8- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012Una vez ligado el ADN de interés con el vector se transforman células de levadura para obtener un gran número de copias. Secuencias esenciales en YAC o Centrómeros (CEN), telómeros (TEL) y secuencias de replicación autónomas (ARS) para proliferación in la célula huésped. o ampr para amplificación selectiva y marcadores tales como TRP1 y URA3 para identificar células conteniendo vectores YAC. o Sitios de reconocimiento de enzimas de restricción (por ej: EcoRI y BamHI) MARCADORES Los vectores de clonado deben llevar otros genes denominados marcadores, que sirven para identificar las células que contienen el vector de clonación. Se suelen utilizar como marcadores: • • • Genes de resistencia a antibióticos. Sirven para identificar bacterias que contienen el vector de clonación, porque estas bacterias serán resistentes al antibiótico del gen marcador. Genes de luminiscencia (GFP, EGFP).. En este caso, la célula que contenga el gen que se quiere clonar, tendrá la propiedad de emitir luz, ya que el marcador que se le incorpora determina que se exprese esa característica. Este sistema se emplea cuando la célula hospedadora es una célula eucariota. Gen lacZ (operón β glucosidasa). El gen lacZ’ presente en el plásmido contiene un sitio de policlonado. En ausencia de inserto, la bacteria en medio con el inductor IPTG y del sustrato X-gal, produce β-galactosidasa, que convierte el sustrato X-gal a una sustancia azul, por lo que las colonias aparecen de este color. Si hay un inserto interrumpiendo el gen lacZ’, la bacteria no produce β-galactosidasa, y las colonias aparecen blancas. • -9- Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012- 3- Actividades prácticas EXTRACCIÓN DE ADN PLASMIDICO SOLUCIONES PARA AISLAMIENTO Y PURIFICACIÓN DE ADN PLASMÍDICO. 1. Pellet obtenido a partir de 1 ml de medio de cultivo de E. coli overnight. 2. Solución I: glucosa 50 mM; Tris HCl 25 mM pH 8; EDTA 10 mM pH 8,0. 3. Solución II: SDS 1%; NaOH 0,2 N. 4. Solución III: Acetato de potasio, 5 M; ácido acético, pH 4,8 5. Fenol-cloroformo- alcohol isoamílico (25:24:1). 6. Cloroformo- alcohol isoamílico 24:1 (v/v). 7. Isopropanol. 8. 70 % etanol. PROTOCOLO PARA AISLAMIENTO Y PURIFICACIÓN DE ADN PLASMÍDICO. Se inocula 10 ml de un medio LB con una cepa de E. coli de interés y se incuba a 37º C durante toda la noche. - Las células se recuperan por centrifugación. El precipitado celular se resuspende en 200 µl de solución I fría. Se incuba 5 minutos en hielo. Se agrega 400 µl de solución II Se homogeneiza suavemente y se incuba 5 minutos en hielo. Esta solución produce lisis celular y desnaturaliza el ADN y las proteínas. Tiene el pH entre 12 y 12,5, en el cual el ADN cromosómico es selectivamente desnaturalizado, mientras que el ADN plasmídico covalentemente cerrado no es afectado. Las proteínas también son desnaturalizadas a este pH, reduciendo la posibilidad de degradación enzimática del ADN plasmídico. El SDS lisa las células y desnaturaliza las proteínas. Se agrega 300 µl de solución III fría. Se mezcla por inversión varias veces y se incuba 5 minutos en hielo. En este paso la mezcla es neutralizada por adición de la solución de acetato de sodio con un pH 4,8. Al descender bruscamente el pH, el ADN cromosomal forma un complejo insoluble, que junto con el complejo formado por la proteína y el SDS es precipitado en un medio con alta concentración salina. Se centrífuga a temperatura ambiente durante 5 a 7 minutos y se recupera el sobrenadante en un nuevo tubo. Se agrega un volumen de fenol, se mezcla, se centrífuga y se recupera la porción superior. El fenol desnaturaliza las proteínas y remueve selectivamente el ADN desnaturalizado a partir de la solución acuosa. Se agrega un volumen de cloroformo: alcohol isoamílico para extraer el fenol, se mezcla, se centrífuga y se recupera la parte superior. Este paso se repite dos veces. Al sobrenadante se le agrega un volumen de isopropanol frío. Se mezcla invirtiendo varias veces y se incuba en freezer a –20º C durante 2 horas. Se centrífuga 15 minutos y se elimina el sobrenadante. - 10 - Cátedra Biología Molecular Facultad de Ciencias Naturales e IML -2012Se agrega 500 µl de etanol 70%. Se deja a temperatura ambiente por 15 minutos y se centrífuga 30 segundos. Se seca al vacío y se resuspende en 20µl de TE ( Tris HCI 10 mM; EDTA 1 mM; pH 8,0 ) estéril. Se conserva en freezer a –20º C. Visualizar los plásmidos en gel de agarosa al 0,8%. Usar el marcador de peso molecular 1kb (Promega). Cuando se realizá la extracción los plásmidos pueden presentarse de tres formas (que coexisten o no): superenrollados (supercoiled), lineales (linear; con dos hebras cortadas)y circulares abiertos (open circular; con una hebra cortada). En la figura siguiente, se pueden observar los tres tipos de conformaciones que Ud. puede visualizar en el gel luego de la extracción y corrida de los plásmidos en el práctico: - 11 -