Química General e Inorgánica A - Facultad de Ciencias Biológicas
Anuncio

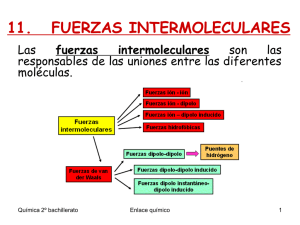
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS (Universidad del Perú, Decana de América) FACULTAD DE CIENCIAS BIOLÓGICAS ESCUELA ACADÉMICO PROFESIONAL DE MICROBIOLOGÍA Y PARASITOLOGÍA DEPARTAMENTO ACADÉMICO DE QUÍMICA INORGÁNICA (FQIQ) SYLLABUS SEMESTRE ACADÉMICO : 2015-I I. DATOS GENERALES 1.1 NOMBRE DEL CURSO : QUÍMICA GENERAL E INORGÁNICA A 1.2 CÓDIGO DEL CURSO : B03104 1.3 NÚMERO DE CRÉDITO : 4.0 1.4 DURACIÓN DEL 1.5 SEMESTRE AÑO DE ESTUDIOS : 17 semanas : 1er año 1.6 NÚMERO DE HORAS 1.6.1DE TEORÍA : 3 horas semanales 1.6.2 DE PRÁCTICA : 2 horas semanales 1.8 PROFESORA RESPONSABLE 1.9 HORARIO : Qca. María Hilda Carhuancho Acevedo : Teoría: Miércoles 14-17 p.m. Laboratorio: Miércoles 08:00. a 10:00 a.m. 10:00. a 12:00 a.m. 05:00 a 07:00 p.m. II. SUMILLA: El curso incluye contenidos sobre la materia, sistema de unidades, estructura atómica, propiedades periódicas, enlaces químicos, iones metálicos y sus ligandos en sistemas biológicos, estado gaseoso, líquido y soluciones, equilibrio químico, equilibrio de soluciones y sales escasamente solubles. III. OBJETIVOS. A) OBJETIVOS GENERALES: Proporcionar al alumno los conocimientos de la Química como ciencia básica, para la debida compresión y explicación de los cambios químicos que se producen en la naturaleza, orientando su aplicación a la Microbiología y Parasitología. Fomentar el sentido de responsabilidad, trabajo, espíritu de observación y complementar su formación científica. 1 B) OBJETIVOS ESPECÍFICÓS: Al término del curso el alumno será capaz de: Comprender e interpretar los principios y conceptos fundamentales de la Química. Comprender e interpretar las relaciones entre la materia y la energía. Preparar soluciones de diferente concentración, titular y estandarizar soluciones. Relacionar los conceptos y fundamentos de la química con los cursos de la especialidad. IV. SISTEMA DE EVALUACIÓN ler. Examen parcial 2d0. Examen parcial Promedio de Laboratorio E1 (Peso 1) E2 (Peso 1) L (Peso 1) NOTA: EL ALUMNO PODRÁ SUSTITUIR LA NOTA MÁS BAJA CORRESPONDIENTE A LA TEORÍA Y LA NOTA FINAL DEL CURSO SE OBTENDRÁ DE LA SIGUIENTE FORMA: P.F E1 E2 L 3 V. METODOLOGÍA DE LA ENSEÑANZA El curso se desarrollará a través de: a) Exposiciones teóricas — dialogadas a cargo del docente. Algunas veces usará como recursos: láminas, transparencias y diapositivas para la mejor visualización y compresión del tema. b) Discusión de ejercicios y problemas. c) Prácticas de laboratorio en los ambientes de la Facultad de Química e Ingeniería Química. d) Evaluaciones del curso de teoría así como de la parte experimental. VI. PROGRAMACIÓN Semana 1. 23 de Marzo al 28 de Marzo TEÓRIA ATÓMICA Base Experimental. Rayos catódicos y rayos canales, Radiactividad. Modelo Atómico de Rutherford. El átomo y sus constituyentes. La Luz, concepto de onda, efecto fotoeléctrico, espectros de absorción y de emisión. Series espectrales, ecuación de Balmer y de Rydberg. Ejercicios. Semana 2. 30 de Marzo al 4 de Abril MODELO ATÓMICO MODERNO Modelo Atómico de Bohr. Modelo de la Mecánica Cuántica. Números Cuánticos. Configuración Electrónica: Principio Aufbau, Principio de Exclusión de Pauling, Principio de Máxima Multiplicidad (Regla de Hund). Ejercicios. Semana 3. 6 de Abril al 11 de Abril TABLA PERIÓDICA Propiedades Periódicas: Radio atómico, Energía de Ionización, Electroafinidad, Electronegatividad. 2 Semana 4. 13 de Abril al 18 de Abril ENLACE QUÍMICO Definición del enlace químico, símbolos de Lewis. Regla del octeto. Clasificación del enlace, polaridad de los enlaces, estructuras de Lewis. Carga formal. Número de oxidación. Semana 5. 20 de Abril al 25 de Abril Teoría del enlace de valencia (TEV). Hibridización sp, sp2,sp3, sp3d, sp3d2. Geometría Molecular (TRPEV). Semana 6. 27 de Abril al 02 de Mayo Teoría del orbital Molecular (TOM). Moléculas Homonucleares. Orden de Enlace. Semana 7. PRIMER EXAMEN 4 de Mayo al 9 de mayo Semana 8. 11 de Mayo al 16 de Mayo QUÍMICA DE LA COORDINACIÓN Términos importantes, nomenclatura de los compuestos de coordinación. Iones metálicos y sus ligandos. Semana 9. 18 de Mayo al 23 de Mayo ESTEQUIOMETRIA Ley de la conservación de la masa. Concepto de mol. Número de Avogadro. Estequiometría y cálculos estequiométricos. Ejercicios Semana 10. 22 de Mayo al 30 de Mayo FUERZAS INTERMOLECULARES Y PROPIEDADES DE LOS LIQUIDOS Fuerzas Intermoleculares: dipolo — dipolo, London, Puente de Hidrógeno. Propiedades de los líquidos. Diagrama de fases. Ejercicios. Semana 11. 1 de junio al 06 de junio SOLUCIONES Solución: Definición y tipo de soluciones. Unidades de concentración. Ejercicios. Semana 12. 8 de Junio al 13 de Junio EQUILIBRIO QUÍMICO Definición, condiciones, constante de equilibrio químico: Kc y Kp. Factores que afectan el equilibrio químico. Principio de Le Chatelier. Ejercicios. Semana 13. 15 de Junio al 20 de Junio EQUILIBRIO DE SOLUCIONES Concepto ácido — base, soluciones iónicas. Ácidos y bases fuertes y débiles. Ionización del agua, pH y p0H. Constante de ionización. Variación del pH durante la titulación. Ejercicios. Semana 14. 22 de Junio al 27 de Junio SALES ESCASAMENTE SOLUBLES Solubilidad. Producto de Solubilidad. Formación y disolución de precipitados. Ejercicios. Semana 15. ESTADOS DE LA MATERIA 29 de Junio al 04 de Julio 3 Diferencias y similitudes entre los tres estados de la materia. Los gases y sus leyes. Presiones parciales. Ley de Dalton. Comportamiento ideal y real de los gases. Ejercicios. Semana 16. SEGUNDO EXAMEN. 6 de Julio al 11 de Julio Semana 17. EXAMEN SUSTITUTORIO. 13 de Julio al 18 de julio VII. BIBLIOGRAFÍA Teodore L. Brown, H. Eugene Lemay, Jr. Bruce E. Bursten. "Química. La Ciencia Central" 2004 Novena edición.Prentice May, México. Raymond Chang "Química", 2007, novena edición, McGraw Hill Interamericana México. Darrell D. Ebbing, Steven D, Gammon, "Química General", 2010, Novena edición, CENGAGE Learning editors, S.A., México. G.W.Daub, W.S. Seese, M. Carrillo, R. M. González, E. Nieto, M. C. Sanson, "Química" 2005 Octava edición. México M. Silberberg, "Química Naturaleza Molecular" 2002 Segunda edición. Mc Graw Hiil. México Johan W. Moore Conrad Stanitski, John C. Kotz, Melvin W. Joesten y James L. Wood. "El mundo de la Química: Conceptos y Aplicaciones", 2000 segunda edición, Addison Wesly Logran, México. Sidney W. Benson "Cálculos químicos" 1992, Noriega Editores. México Brescia, Arents. "Fundamentos de Químicas", 1966, CECSA, México. Chemical Bond Approach Project. "Sistemas Quimicos", 1966 Editorial Reverte. España. Recursos de Internet: http://cwx.prenhall.com/bookbind/pubbooks/blb la/ http://chemconnections.org/ http://www.quimiconceptos.blogspot.com/ http://www.indecopi.gob.pe http://campus.usal.es/zInorganica/zona-alumnos/erf-inorganica/ http://www.isftic.mepsvd.es/ http://www.educaplus.org/ http://www.nucleares.unam.mx/—vieyra/cuantl.html http://wps.prenhall.com/esm brown chemistry 9/ http://biblioteca.unmsm.edu.pe/aulavirtual/ 4