Módulo 1 - (Prof. Ana Caffiero) - Instituto Santa Cecilia
Anuncio

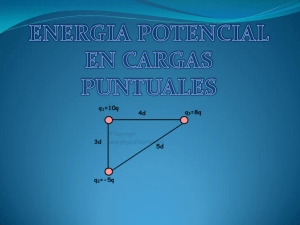
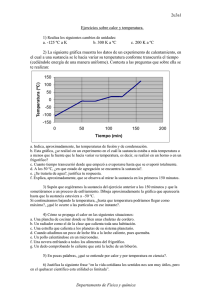
INSTITUTO SANTA CECILIA. ACTIVIDADES DE RECUPERACIÓN. INTRODUCCIÓN A LA QUÍMICA. 1. Resuelve siguientes problemas sobre el comportamiento de los gases: A) El señor Rodríguez compró una lata de aerosol de 490 ml que contiene un gas a presión. Si la etiqueta indica que ese gas a 1 atm rinde 7000 ml; ¿a qué presión está envasado el gas?. Grafica justificando con qué ley estudiada se relaciona. B) Un globo aerostático de aire caliente, a cierta altura contiene un volumen de 2,6 x 10 6 litros. El globo cae al mar, que se encuentra a una temperatura de 15°C, y en esas condiciones, su volumen es de 2,04 x 10 6 litros. ¿A qué temperatura se hallaba el aire antes de caer el globo?. 2. Responde a las siguientes cuestiones: ¿Por qué al hablar del volumen de una masa gaseosa se deben especificar la temperatura y la presión?. ¿Por qué se dice que el aire caliente es menos denso que el aire frío?. 3. Analiza la siguiente situación y luego responde: El diamante es un material transparente. Un diamante de 2 gramos ocupa un espacio de Es frágil y al ser tallado adquiere mucho brillo, lo que le da una gran belleza. Además se lo usa para cortar vidrio debido a su gran dureza. ¿Cuáles de las citadas son propiedades intensivas y cuáles extensivas?. Justifica. 1cm 3. 4. De la siguiente lista de propiedades subraya aquellas que sean propias del estado gaseoso y luego justifica tu elección desde el punto de vista de la teoría cinético-molecular: VOLUMEN PROPIO – EXPANSIBILIDAD – ALTA DENSIDAD – ELEVADA ENERGÍA CINÉTICA – BAJA DENSIDAD – FLUIDEZ – FORMA PROPIA. 5. Observa la siguiente tabla y responde a las preguntas: sustancia A B C D 660 232 44 961 2519 26002 280 2162 Punto de fusión (°C) Punto de ebullición (°C) A) ¿Se trata de la misma sustancia?. ¿Por qué?. B) ¿En qué estado de agregación se encontrará cada sustancia a temperatura ambiente?. C) ¿Qué significa que la sustancia B es más densa que la sustancia C?. D) Clasifica Las sustancias en dos grupos: las que se puedan comprimir mucho y las que no. 6. Justifica con un ejemplo cada una de las siguientes afirmaciones: A) En los sólidos predominan las fuerzas de atracción entre sus partículas. B) Cuanto más próximas estén las partículas entre sí, menor será el volumen final. C) Los líquidos y los gases son fluidos. D) El volumen y la temperatura de un gas son inversamente proporcionales. 7. Resuelve los siguientes problemas: A) Considerando una solución de ácido sulfúrico en agua al 32,7 %m/v, se pide: 1) Su concentración en % m/m sabiendo que la densidad de la solución es 1,23 g/ml. 2) la masa de ácido necesaria para preparar dos litros y medio de solución. B) En un recipiente de 350ml se encuentra un gas que ejerce una presión de 0,8 atm a T ambiente. Si se lo pasa a un recipiente de 0,5 litros; ¿a qué presión se lo debe someter si la temperatura se mantiene constante?. Indica la ley aplicada y grafica. 8. Responde verdadero (V) o falso (F) justifica en todos los casos: Un sistema con un solo componente debe ser homogéneo………………… Las soluciones pueden formarse con sustancias en cualquier estado de agregación siempre y cuando las condiciones de solubilidad lo permitan…………………………………….. Las soluciones con solutos gaseosos deben mantenerse tapadas, de lo contrario, formarían una mezcla heterogénea…………………………….……….. Un vaso de una bebida gaseosa helada contiene mayor cantidad de CO 2 disuelto que cuando está a temperatura ambiente……………………….. 9. Analiza la siguiente situación experimental y responde a las cuestiones planteadas: Se tienen 3 vasos de precipitados que contienen 3 muestras: el A) una solución, el B) una suspensión y el C) un coioide. De la siguiente lista, indica cuál cuáles de las siguientes características permitirán identificar cada una de las muestras colocando la letra que corresponda en los espacios punteados: Se pueden separar sus componentes por centrifugación…………………………….. Las sustancias no se pueden separar por filtración…………………………………….. No se pone de manifiesto el efecto tyndall……………………………………………… Las partículas que contiene disueltas son las más pequeñas………………............. Las partículas sólidas precipitan al dejar la muestra en reposo……………………… Son mezclas totalmente homogéneas………………………………………………….. 10. Las siguientes proposiciones se refieren a un sistema formado por 3 trozos de hielo en una solución acuosa de cloruro de sodio al que se le agregaron limaduras de hierro. Marca las correctas y justifica tu elección: Es un sistema homogéneo…………. El sistema tiene 2 interfases………………… El sistema tiene 3 fases sólidas y una líquida……………… El sistema tiene 3 componentes…………………. El sistema tiene 2 componentes………………… Los componentes se pueden separar por filtración……………….. Los componentes se pueden separar por destilación………….. 11. Diferencia los siguientes pares de conceptos y menciona ejemplos para cada caso: A) Solución diluida de sobresaturada. B) componente de fase. 12. Piensa y responde: ¿Por qué cuando agregamos sal al agua luego de un tiempo ya no vemos más ese soluto?.¿Cómo se explica esto a nivel molecular?. Explica.