Metales - Química I
Anuncio

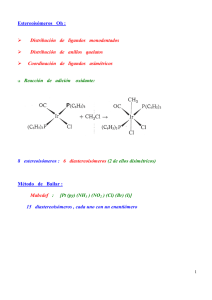
PROGRAMA DE QUÍMICA INORGÁNICA APLICADA AL MEDIO MARINO CURS O 2005-2006 Te ma 1. Intro duc c ió n. Conce pto de Química Inorgá nica . Abunda ncia y dis tribución de los e le me ntos químicos y compue s tos inorgá nicos e n e l me dio ma rino. P rincipa le s tipos de re a ccione s e n Química Inorgá nica . (Tie mpo e s tima do, 4 hora s ) Te ma 2. Hidró g e no . Es tudio de l hidróge no y s us compue s tos má s importa nte s pre s e nte s e n e l me dio ma rino. (Tie mpo e s tima do, 3 hora s ) Carac te rís tic as g e ne rale s de lo s me tale s . Ele me nto s de lo s g rupo s 1 y 2 . Te ma 3. Es tudio de las c arac te rís tic as g e ne rale s de lo s me tale s . Es tudio dos e le me ntos de los grupos 1 y 2 y s us compue s tos má s importa nte s e n e l me dio ma rino. (Tie mpo e s tima do, 3 hora s ) Te ma 4. Ele me nto s de l Grupo 17. Haló g e no s . Es tudio de los e le me ntos de l grupo 17 y s us compue s tos má s importa nte s e n e l me dio ma rino. (Tie mpo e s tima do, 3 hora s ) Te ma 5. Ele me nto s de l Grupo 16. Oxíg e no y Azufre . Es tudio de los e le me ntos O y S y s us compue s tos má s importa nte s e n e l me dio ma rino. (Tie mpo e s tima do, 3 hora s ) Te ma 6. Ele me nto s de l Grupo 15. Nitró g e no y Fó s fo ro . Es tudio dos e le me ntos N y P y s us compue s tos má s importa nte s e n e l me dio ma rino. (Tie mpo e s tima do, 3 hora s ) Metales Propiedades ¾Conductores: electricidad y térmicos ¾Dúctiles y maleables ¾Densos ¾Duros ¾Puntos de fusión y ebullición elevados Los tres tipos de celdas más comunes: a) Hexagonal compacta (HCP) Nº coord. 12 b) Cúbica centrada en las caras (FCC) Nº coord. 12 c) Cúbica centrada en el cuerpo (BCC) Nº coord. 8 (c) Estructuras 9Características: Basadas en empaquetamientos. ¾ Cada punto reticular está formado por un átomo de un metal ¾ Los electrones se encuentran deslocalizados en todo el cristal ¾Propiedades ¾ Resistentes debido a la deslocalización ¾ Debido a la movilidad de los electrones, buenos conductores de la electricidad ¾Ejemplos – Ca, Na, Fe Enlace Enlace covalente entre átomos iguales. Ej.: H2 Ej.: F2, O2, N2, etc Solapamiento σ Solapamiento π Solapamiento σ Enlace covalente entre TRES átomos iguales. Enlace covalente entre CUATRO átomos iguales. Dopado: tipo n y tipo p Química de Coordinación Conceptos útiles •Teoría ácido-base de Lewis •Enlace “covalente coordinado o dativo” H F N H B F F H H F F B N H F H “Aducto” Compuestos de coordinación Formados por •Un metal central •Los ligandos El metal central: “Ácido de Lewis” Los ligandos: “Bases de Lewis” El metal suele ser un metal de transición Los ligandos son moléculas, iones o átomos. Al átomo que usan para enlazarse al metal se le llama “átomo dador” Ejemplos H3N NH3 Ni H3N NH3 [Ni(NH3)4]2+ [Co(H2O)6]2+ Alfred Werner (Premio Nobel en 1913) • Compuestos que están formados por compuestos más sencillos • CoCl3 y NH3 “Compuestos amoniacales”. – CoCl3· (NH3)6 y CoCl3· (NH3)5. – Distinta reactividad con AgNO3. [Co(NH3)6]Cl3 → [Co(NH3)6]3+ + 3 Cl[CoCl(NH3)5]Cl2 → [CoCl(NH3)5]3+ + 2 Cl- Alfred Werner •Dos tipos de valencia o capacidad de enlace. –Valencia primaria, hoy llamado número o estado de oxidación. •Basada en el número de electrones que el átomo pierde para formar el ión metálico. –Valencia secundaria:hoy llamado número de coordinación. •Responsable del enlace con otros compuestos, denominados ligandos, al ión metálico central. ion [CoCl(NO2)(NH3)4]+ Ligandos, algunas clasificaciones Los ligandos son bases de Lewis: –Ceden pares de electrones a los átomos o iones metálicos centrales (que son ácidos de Lewis). Clasificación según denticidad •Ligandos monodentados: –Un ligando que utiliza un par de electrones para formar un punto de unión al átomo o ion metálico central. •Ligandos bidentados: –Un ligando que utiliza dos pares de electrones para formar dos puntos de unión al ion metálico. •Ligandos tridentados, tetradentados,…, polidentados. Ligandos monodentados Ligandos polidentados Ligandos, algunas clasificaciones Clasificación según Funcionalidad: •Terminal •Puente •Quelato •Ambidentado Clasificación según el átomo dador •H-dadores •Halógenos dadores F-, Cl-, Br- I-dadores •O- dadores, •S-dadores •N-dadores •ETC. Ligandos, algunas clasificaciones Clasificación según tipo de enlace: •Clásicos (σ-dadores) Ej. NH3, H2O, etc. •No clásicos (σ-dadores y π-aceptores) Ej. CO, PR3,.. •Otros (σ-dadores y π-dadores) Ej: Cl-, O2-, etc. Interacción σ Orbital dz2 del metal y pz del ligando Interacción π Orbital dxy del metal y py del ligando Quelato Dos ligandos. Nº de coordinación , 4. Geometrías Número de coordinación 2 y 3 Número de coordinación 4 Número de coordinación 5 Número de coordinación 6 Distorsiones del octaedro Número de coordinación 7 Número de coordinación 8 Número de coordinación 9 Enlace Campo Oh ¿De qué depende el campo? Serie espectroquímica ∆ grande Campo fuerte CO> CN- > NO2- > en > py = NH3 > EDTA4- > SCN- > H2O > ONO- > ox2- > OH- > F- > SCN- > Cl- > Br- > I∆ pequeño Campo débil Campo fuerte Campo débil Complejo de spin alto Complejo de spin alto SISTEMA OCTAÉDRICO. (E) t2g1 t2g2 t2g3 t2g3eg1 t2g3eg2 t2g4eg2 t2g5eg2 t2g6eg2 t2g6eg3 t2g6eg4 ↑_ __ __ ↑_ ↑_ __ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑↓ ↑_ ↑_ ↑↓ ↑↓ ↑_ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ __ __ __ __ __ __ ↑_ __ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑↓ ↑_ ↑↓ ↑↓ 1 2 3 4 5 4 3 2 1 0 -0.4 ∆o -0.8 ∆o -1.2 ∆o -0.6 ∆o -0.0 ∆o -0.4 ∆o -0.8 ∆o -1.2 ∆o -0.6 ∆o 0.0 ∆o 1.73 2.83 3.87 4.90 5.92 4.90 3.87 2.83 1.73 0 (M.B.)* µ Ti3+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ ⎯⎯⎯→ E.E.C.C. Ejemplo d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 Configuración electrónica Número de e- no apareados Sistema Campo Débil; Alto spin. * El momento magnético es considerado sólo de spin SISTEMA OCTAÉDRICO. t2g1 t2g2 t2g3 t2g4 t2g5 t2g6 t2g6eg1 t2g6eg2 t2g6eg3 t2g6eg4 ↑_ __ __ ↑_ ↑_ __ ↑_ ↑_ ↑_ ↑↓ ↑_ ↑_ ↑↓ ↑↓ ↑_ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 1 2 3 2 1 0 1 2 1 0 -0.4 ∆o -0.8 ∆o -1.2 ∆o -1.6 ∆o+ P -2.0 ∆o+ 2P -2.4 ∆o+ 2P -1.6 ∆o+ P -1.2 ∆o -0.6 ∆o -0.0 ∆o (M.B.)* __ __ __ __ __ __ __ __ __ __ __ __ ↑_ __ ↑_ ↑_ ↑↓ ↑_ ↑↓ ↑↓ µ Ti3+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ (E) ⎯⎯⎯→ E.E.C.C. Ejemplo d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 Configuración electrónica Número de e- no apareados Sistema Campo Fuerte; Bajo spin. 1.73 2.83 3.87 2.87 1.73 0 1.73 2.83 1.73 0 Campo tetraédrico Campo tetraédrico e1 e2 e2 t 21 e2 t 22 e2 t 23 e3 t 23 e4 t 23 d8 Ni2+ e4 t 24 d9 d10 Cu2+ Zn2+ e4 t 25 e4 t 26 __ __ __ __ __ __ ↑_ __ __ ↑_ ↑_ __ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ 1 2 3 4 5 4 3 -0.6 ∆t -1.2 ∆t -0.8 ∆t -0.4 ∆t -0.0 ∆t -0.6 ∆t -1.2 ∆t 1.73 2.83 3.87 4.90 5.92 4.90 3.87 ↑↓ ↑_ 2 -0.8 ∆t 2.83 ↑↓ ↑↓ ↑_ ↑↓ ↑↓ ↑↓ 1 0 -0.4 ∆t -0.0 ∆t 1.73 0 ⎯⎯⎯→ (E) ↑_ __ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑_ ↑↓ ↑_ ↑↓ ↑↓ ↑_ ↑↓ ↑↓ ↑_ ↑↓ ↑↓ ↑↓ ↑↓ (M.B.)* Ti3+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ µ Ejemplo d1 d2 d3 d4 d5 d6 d7 E.E.C.C. Sistema Configuración electrónica Número de e- no apareados SISTEMA TETRAÉDRICO. * El momento magnético es considerdo sólo de spin Campo SQ Campo SQ ∆ grande Campo fuerte CO > CN- > NO2- > en > py = NH3 > EDTA4- > SCN- > > H2O > ONO- > ox2- > OH- > F- > SCN- > Cl- > Br- > I∆ pequeño Campo débil T.O.M. Enlace π Aceptores π Dadores π