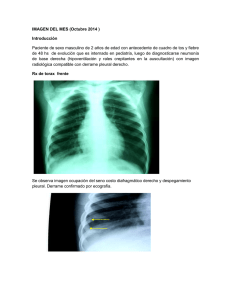
Detección y validación de marcadores de diagnóstico
Anuncio

Departamento de Bioquímica, Genética e Inmunología Área de Bioquímica y Biología Molecular DETECCIÓN Y VALIDACIÓN DE MARCADORES DE DIAGNÓSTICO DEL DERRAME PLEURAL MALIGNO Memoria presentada por Nuria Sánchez Otero Para optar al grado de Doctora por la Universidad de Vigo Vigo, Junio de 2012 Departamento de Bioquímica, Genética e Inmunología Área de Bioquímica y Biología Molecular Los DRES. MARÍA PÁEZ DE LA CADENA TORTOSA y FRANCISCO JAVIER RODRÍGUEZ BERROCAL, Catedráticos del Área de Bioquímica y Biología Molecular de la Universidad de Vigo, HACEN CONSTAR que la presente Tesis Doctoral titulada “Detección y validación de marcadores de diagnóstico del derrame pleural maligno”, ha sido realizada bajo su dirección por la Licenciada en Biología Dña. Nuria Sánchez Otero. Dicho trabajo se considera concluido, por lo que autorizan su presentación al Tribunal calificador. Y para que así conste a los efectos oportunos, firman en Vigo, a 18 de Junio de 2012. Dra. María Páez de la Cadena Tortosa Dr. Francisco Javier Rodríguez Berrocal VBº. Francisco Javier Rodríguez Berrocal. Director del Departamento de Bioquímica, Genética e Inmunología. A mi familia y esposo Porque lo han dado todo por mí, sin esperar nada a cambio Este trabajo de investigación ha sido parcialmente financiado mediante los siguientes Proyectos de investigación: - Título: “Desarrollo de un kit de detección múltiple de biomarcadores séricos para el diagnóstico del cáncer de pulmón no microcítico”, concedido por el Instituto de Salud Carlos III (Ministerio de Sanidad) (PS09-00405, 2009-2012). - Título: “Contribución a un mellor coñecemento das patoloxías dende unha perspectiva multidisciplinar (Agrupación estratégica INBIOMED)”, concedido por la Xunta de Galicia (DOGA_23jul2009. Proyecto 2009/63). Los resultados del trabajo han dado lugar a las siguientes publicaciones en revistas científicas: - Sánchez-Otero, N.; Rodríguez-Piñeiro, A.M.; Fernández-Villar, A.; Botana-Rial, M.I. y Páez de la Cadena, M. (2009). Análisis proteómico del derrame pleural para la obtención de nuevos marcadores del cáncer de pulmón. Investigación, Vol.1, Nº2. - Rodríguez-Piñeiro, A.M.; Blanco-Prieto, S.; Sánchez-Otero, N.; Rodríguez-Berrocal, F.J. y Páez de la Cadena, M. (2010). On the identification of biomarkers for non-small cell lung cancer in serum and pleural effusion. Journal of Proteomics, 73: 1511-1522. - Sánchez-Otero, N.; Blanco-Prieto, S.; Páez de la Cadena, M.; Vázquez-Iglesias, L.; Fernández-Villar, A.; Botana-Rial, M.I.; Rodríguez-Berrocal, F.J. (2012). Calprotectin: A novel biomarker for diagnosis of pleural effusion. British Journal of Cancer. En revisión. - Sánchez-Otero, N.; Blanco-Prieto, S.; Páez de la Cadena, M.; Vázquez-Iglesias, L.; Fernández-Villar, A.; Botana-Rial, M.I.; Rodríguez-Berrocal, F.J (2012). Levels of PEDF in pleural effusions from lung adenocarcinoma and benign disease patients. En preparación. Parte de los resultados del trabajo han dado lugar a la siguiente patente: - Rodríguez-Berrocal, F.J.; Sánchez-Otero, N.; Blanco-Prieto, S; Vázquez-Iglesias, L.; Páez de la Cadena, M.; Fernández-Villar, A; Botana-Rial, M.I.; Leiro-Fernández, V; Represas-Represas, C. (2011). Procedimiento para el diagnóstico del derrame pleural maligno mediante la determinación de la concentración de calprotectina en líquido pleural. Registrada P201101131. Los resultados del trabajo han dado lugar a las siguientes comunicaciones en congresos: - Nuria Sánchez-Otero, Sonia Blanco-Prieto, María Páez de la Cadena, Paula Álvarez-Chaver, María I. Botana-Rial, Alberto Fernández-Villar, Francisco J. Rodríguez-Berrocal. Proteomic approach to improve the diagnosis of malignant pleural effusions. Comunicación escrita al 3º Congreso de la Sociedad Española de Proteómica (SEPROT) y de la Latinoamerican Human Proteome Organisation (LAHUPO). Pamplona (España) 10- 13 de febrero de 2009. - Sonia Blanco-Prieto, Ana Mª Rodríguez-Piñeiro, Paula ÁlvarezChaver, Nuria Sánchez-Otero, Virginia Leiro, Vicenta S. Martínez Zorzano, Fco. Javier Rodríguez-Berrocal, María Páez de la Cadena. In the search of early stages biomarkers for non small cell lung cancer. Comunicación escrita al 3º Congreso de la Sociedad Española de Proteómica (SEPROT) y de la Latinoamerican Human Proteome Organisation (LAHUPO). Pamplona (España) 10- 13 de febrero de 2009. - Nuria Sánchez-Otero, Sonia Blanco-Prieto, Ana Mª RodríguezPiñeiro, Francisco J. Rodríguez-Berrocal, Vicenta S. MartínezZorzano, María I. Botana-Rial, Alberto Fernández-Villar, María Páez de la Cadena. Identification of biomarker candidates for non smallcell lung cancer in pleural effusions. Comunicación escrita al 3º Congreso de la European Proteomic Asociation (EuPA). Stockholm (Suecia) 14- 17 de junio de 2009. - Ana Mª Rodríguez-Piñeiro, Sonia Blanco-Prieto, Nuria SánchezOtero, Francisco J. Rodríguez-Berrocal, Vicenta S. MartínezZorzano, Virginia Leiro, María I. Botana-Rial, Alberto FernándezVillar, María Páez de la Cadena. 2D-DIGE como estrategia para la identificación de proteínas marcadoras en cáncer de pulmón no microcítico. Comunicación oral corta a las 2º Xornada de Investigación Biomédica de Vigo. 10 de junio de 2009. - Ana Mª Rodríguez-Piñeiro, Sonia Blanco-Prieto, Nuria SánchezOtero, Francisco J. Rodríguez-Berrocal, Vicenta S. MartínezZorzano, María I. Botana-Rial, María Páez de la Cadena. On the identification of biomarkers for non-small cell lung cancer: DIGE approach. Comunicación escrita al 5º Congreso de la Portuguese Proteomic Network (ProCura) y 1º International Congress on Analytical Proteomics (ICAP). Costa da Caparica (Portugal) 30 de septiembre al 03 de octubre de 2009. - Sonia Blanco-Prieto, Nuria Sánchez-Otero, Ana Mª RodríguezPiñeiro, María I. Botana-Rial, Francisco J. Rodríguez-Berrocal, María Páez de la Cadena. Validation of PEDF as a potential biomarker for NSCLC. Comunicación escrita a las 2º Jornadas de Jóvenes investigadores (SEProt). Córdoba (España) 11 y 12 de febrero de 2010. - Nuria Sánchez-Otero, Ana Mª Rodríguez-Piñeiro, Francisco J. Rodríguez-Berrocal, María I. Botana-Rial, María Páez de la Cadena. Calprotectin as a novel biomarker for the diagnosis of pleural effusions. Comunicación escrita al 4º Congreso de la European Proteomic Asociation (EuPA) y 6º Congreso de la Portuguese Proteomic Network (ProCura). Estoril (Portugal) 23 y 27 de octubre de 2010. Durante la realización de este trabajo Nuria Sánchez Otero ha disfrutado de la siguiente ayuda: - Beca de Tercer Ciclo de la Universidad de Vigo (31/12/200831/12/2010). Agradecimientos Agradecimientos Agradecimientos Parece mentira que ya haya llegado este momento. Espero ser capaz de reflejar con palabras la gratitud que siento por todo lo que he compartido durante estos años en el laboratorio. Empezaré agradeciendo este trabajo a todos los pacientes que han participado en este estudio, puesto que sin ellos nunca se hubiese podido realizar nada de lo aquí escrito. También me gustaría destacar la gran importancia de los profesionales que han recogido día a día las muestras y datos clínicos, gracias por haber depositado en el grupo de investigación vuestra confianza y apoyo. En la parte del CHUVI, quisiera agradecer al Dr. Alberto Fernández Villar, a María I. Botana Rial, y a su equipo, el haber confiado en mí durante el tiempo que trabajamos juntos. Y en cuanto a la parte del Meixoeiro y POVISA, gracias al Dr. Manuel Núñez Delgado y a la Dra. Dolores Corbacho Abelairas por haberme ofrecido su colaboración durante el verano de 2010, cediéndome semanalmente muestras de pacientes, lo que me permitió ampliar el estudio. Y cómo no, seguiré con mis tutores, gracias a los Drs. María Páez de la Cadena y Fco. Javier Rodríguez Berrocal, por haberme acogido en el laboratorio y haber confiado en mí para haber hecho el proyecto que hoy está recogido en estas líneas, gracias por vuestro apoyo y vuestro consejo. María, gracias por los momentos compartidos en el despacho, por tus consejos, y por toda la ayuda que me has dado durante todo este tiempo, porque has sido la “madre” del laboratorio, que me ha guiado en todo momento. Javier, gracias no solo por haber sido mi “padre” durante mis años de investigador en formación, sino también por haberme mostrado el mundo interno de la universidad a través de las diferentes comisiones y órganos. Agradecimientos Me gustaría también de un modo especial dar las gracias a la Dra. Vicenta S. Martínez Zorzano, gracias por las palabras de ánimo y consuelo, y tu apoyo incondicional día a día. También deseo agradecer el apoyo prestado por los demás profesores del Área de Bioquímica, especialmente a las Dras. Diana Valverde y Almudena Fernández, y al Dr. Emilio Gil, por estar dispuestos a resolver cualquier duda, siempre con un carismático sentido del humor, y empleando el apoyo de las “reuniones científico-gastronómicas”. Y no quería dejar de agradecerle también al Dr. Óscar Cordero la ayuda prestada estos últimos meses, gracias por tus consejos desde la lejanía. Y gracias como no a Mary, nuestra eterna consejera con el papeleo, las facturas, etc. Gracias por ser como eres. Y no quisiera olvidarme de darle las gracias a África y a su grupo de “inmunólogos” por la cantidad de veces que me han permitido usar el “perkin” (o lector de placas), y porque siempre que lo he necesitado han estado ahí para ayudarme. Pero quizás lo más importante durante este tiempo ha sido la convivencia mantenida en el laboratorio con los compañeros, puesto que hemos podido compartir muchos acontecimientos, hemos visto crecer a muchas personas a nuestro lado y hemos podido compartir muchas experiencias personales juntos. Con Sonia y Tere he compartido muchos momentos de mi vida en el laboratorio en los que juntas hemos podido aclarar dudas (sobre todo en mis inicios como novata), y siempre han estado ahí cuando lo he necesitado. Pero también he podido compartir con ellas momentos especiales de mi vida personal, que nunca se me borrarán de la mente. Espero que la relación que tenemos no se termine cuando nos marchemos del laboratorio. Para mí siempre habéis sido un gran ejemplo a seguir. Agradecimientos Con Susi he compartido muchas experiencias en los primeros años en el lab, gracias por esas comidas tan entretenidas, y por hacer que la vida en el laboratorio fuese tan amena. Gracias por esos consejos que hacen que cada día nuestra piel te lo agradezca. Espero que pueda pedirte consejo siempre que lo necesite, que lo máximo que nos pueda separar la vida sea un mensaje de correo electrónico. Paula, Loretta y Lorena, aunque siempre han sido las “mayores”, desde que llegué me acogieron como una integrante más del grupo, apoyándome cuando más lo necesitaba y aconsejándome cuando se lo pedía. Gracias por todo, por vuestra ayuda y vuestros consejos. Guille, qué decir de ti, si te conozco desde que estábamos en la carrera!! Espero que todo te vaya genial junto a Diana, y que cuando tengas alguna duda me llenes el correo con mensajitos. Que la relación que tenemos desde hace años se mantenga mucho más tiempo. Gracias por estar siempre a mi lado, y por apoyarme y escucharme. Y al resto de compañeros del grupo Andrés, Olalla, Leti, Óscar, Sheila y María, no hemos podido compartir muchos cafés juntos, pero a pesar de eso sí que he pasado el suficiente tiempo para darme cuenta del potencial que tenéis, tanto investigador como personal, muchas gracias por los ánimos y los consejos que siempre me habéis ofrecido (no os cabreéis por no haberos dedicado algo especial a cada uno, pero es que se me hacía esto larguísimo). Y a toda la gente que en algún momento ha estado en el grupo, Tamara, Cigdem, Lucía, Noelia, Carlos,… Gracias por los momentos divertidos que juntos hemos podido compartir. Y gracias también a Marisol, Bea y Ángel, porque ellos son los tres confidentes que tengo en la facultad, los que me asesoran, los que me guían y los que me hacen empezar cada día con una sonrisa en la cara. Agradecimientos Pero no quería terminar esta parte de agradecimientos sin hacer mención a Ana, gracias por estar ahí cuando más lo necesitaba, por haberme apoyado de manera incondicional desde hace años, por haberme demostrado que si quiero, soy capaz de hacer las cosas, y por ser mi directora desde la lejanía siempre que lo he necesitado. GRACIAS, porque sin tu fuerza quizás hoy no estaría aquí. Mi familia y mi marido merecen sin duda el agradecimiento más especial porque siempre me han apoyado en todo lo que he hecho, aconsejándome cuando lo he necesitado, y sintiéndose orgullosos de mí en todo momento, como yo lo he estado de ellos. A mi familia le tengo que dar las gracias por su dedicación y sacrificio; hoy puedo decir que soy así gracias a lo que ellos lucharon. Gracias también por haberme enseñado qué es lo que importa en la vida, y por ayudarme a luchar por conseguir mis metas, levantándome cuando lo he necesitado. Y a mi marido, gracias por tus consejos, por aguantarme día a día, por permitirme estar a tu lado, y por haberme regalado un cachito de ti. Gracias peque. Y para finalizar, esperando no haberme olvidado de nadie, gracias a todos los que compartiréis conmigo el día de la defensa, y a los que no podáis asistir, gracias también por la energía positiva que seguro que me enviareis desde la distancia. Índice Índice Índice Abreviaturas __________________________________________________ 27 Resumen ______________________________________________________ 33 1. Introducción _______________________________________________ 41 1.1. La pleura ________________________________________________ 43 1.2. Derrame pleural _________________________________________ 47 1.2.1. Cómo saber si un paciente presenta un derrame pleural ____________________________________________________________ 49 1.2.2. Exudados y trasudados ____________________________________ 49 1.2.3. Causas más frecuentes de derrame pleural ________________ 51 1.2.3.1. Insuficiencia cardíaca ________________________________________ 52 1.2.3.2. Derrame pleural tuberculoso _________________________________ 53 1.2.3.3. Derrame pleural paraneumónico ______________________________ 55 1.2.3.4. Derrame pleural miscelánea __________________________________ 57 1.2.3.5. Derrame pleural paramaligno _________________________________ 61 1.2.3.6. Derrame pleural de difícil diagnóstico _________________________ 61 1.2.3.7. Derrame pleural Neoplásico o derrame pleural maligno ________ 62 1.3. Características del derrame pleural ____________________ 65 1.3.1. Epidemiología _____________________________________________ 65 1.3.2. Patogénesis del derrame pleural ___________________________ 67 1.3.3. Diagnóstico ________________________________________________ 70 1.3.4. Metodologías diagnósticas ________________________________ 71 1.3.4.1. Olor y apariencia del fluido pleural ___________________________ 71 1.3.4.2. Contaje diferencial de células del fluido pleural _______________ 72 1.3.4.3. Citología del fluido pleural ____________________________________ 72 1.3.4.4. Cultivo del fluido pleural _____________________________________ 74 Índice 1.3.4.5. Niveles de marcadores bioquímicos en el fluido pleural ________ 75 1.3.4.6. Biopsia pleural mediante aguja o biopsia transparietal ________ 77 1.3.4.7. Toracocentesis _______________________________________________ 79 1.3.4.8. Broncoscopia ________________________________________________ 80 1.3.4.9. Toracoscopia ________________________________________________ 81 1.3.4.10. Técnicas radiológicas ________________________________________ 82 1.3.4.11. Análisis inmunológicos _______________________________________ 84 1.3.4.12. Fármacos ____________________________________________________ 85 1.3.5. Pronóstico _________________________________________________ 85 1.3.6. Tratamiento _______________________________________________ 86 1.3.7. Direcciones futuras para la investigación _________________ 87 1.4. Marcadores de diagnóstico de derrame pleural _________ 88 1.4.1. Marcadores usados en clínica ______________________________ 89 1.4.2. Marcadores en estudio para el derrame pleural maligno ___ 93 1.5. Proteómica _______________________________________________ 97 1.5.1. El concepto de “proteoma” ________________________________ 98 1.5.2. Proteómica en la búsqueda de marcadores moleculares ___ 99 1.6. Marcadores propuestos en este estudio ________________ 101 1.6.1. PEDF ______________________________________________________ 101 1.6.2. Calprotectina _____________________________________________ 103 1.7. Objetivos ________________________________________________ 107 2. Materiales y métodos _____________________________________ 111 2.1. Muestras biológicas _____________________________________ 113 2.1.1. Obtención de las muestras _______________________________ 113 Índice 2.1.2. Diagnóstico de los pacientes _____________________________ 114 2.2. Preparación de las muestras para electroforesis ______ 118 2.2.1. Cromatografía de afinidad a través de una columna de inmunoafinidad múltiple ___________________________________________ 119 2.2.2. Diálisis ___________________________________________________ 120 2.2.3. Liofilización ______________________________________________ 121 2.3. Determinación de la concentración de proteínas_______ 122 2.3.1. Método de Biuret _________________________________________ 122 2.3.2. Método de Bradford modificado __________________________ 123 2.4. Electroforesis monodimensional________________________ 124 2.4.1. Desnaturalización de la muestra _________________________ 124 2.4.2. Electroforesis desnaturalizante en geles de poliacrilamida (SDS-PAGE) _________________________________________ 125 2.5. Electroforesis bidimensional ___________________________ 127 2.5.1. Primera dimensión: Enfoque isoeléctrico ________________ 128 2.5.2. Equilibrado de las tiras IPG ______________________________ 130 2.5.3. Segunda dimensión: Electroforesis desnaturalizante en geles de poliacrilamida _________________________________________ 131 2.5.4. Electroforesis PAGE en condiciones nativas _____________ 134 2.6. Tinción de geles de poliacrilamida _____________________ 135 2.6.1. Tinción con azul brillante de Coomassie _________________ 135 2.6.2. Tinción con nitrato de plata compatible con espectrometría de masas ___________________________________________ 136 2.7. Transferencia de proteínas a membranas mediante Western Blot _________________________________________________ 137 Índice 2.7.1. Tinción con rojo Ponceau S _______________________________ 138 2.7.2. Inmunodetección de proteínas ___________________________ 139 2.7.2.1. Inmunodetección de la proteína PEDF _______________________ 140 2.7.2.2. Inmunodetección de la proteína S100-A9 ____________________ 140 2.8. Análisis de imagen _____________________________________ 140 2.8.1. Adquisición de la imagen _________________________________ 140 2.8.2. Análisis de patrones monodimensionales _________________ 141 2.8.3. Análisis de patrones bidimensionales ____________________ 143 2.9. Electroforesis diferencial en gel ________________________ 145 2.9.1. Preparación y marcaje de las muestras ___________________ 146 2.9.2. Electroforesis bidimensional _____________________________ 147 2.9.3. Adquisición de las imágenes ______________________________ 147 2.9.4. Análisis diferencial de intensidad ________________________ 148 2.10. Espectrometría de masas _____________________________ 149 2.10.1. Digestión de las proteínas y obtención de péptidos trípticos ___________________________________________________________ 149 2.10.2. Análisis por MALDI-TOF y MS/MS ________________________ 150 2.10.3. Búsqueda en bases de datos e identificación de proteínas ___________________________________________________________ 151 2.11. Determinación de la concentración de los marcadores en el fluido pleural _____________________________ 152 2.11.1. Determinación de los niveles de la proteína PEDF _______ 153 2.11.2. Valoración de los niveles de la proteína Calprotectina ___ 153 2.12. Tratamiento estadístico de los datos _________________ 153 2.12.1. Análisis estadísticos ______________________________________ 154 Índice 2.12.1.1. Análisis estadístico univariantes _____________________________ 154 2.12.1.2. Análisis estadísticos multivariantes __________________________ 155 2.12.1.3. Curvas ROC ________________________________________________ 157 2.12.1.4. Análisis de validación cruzada _______________________________ 158 3. Resultados ________________________________________________ 161 3.1. Búsqueda de marcadores en el fluido pleural __________ 163 3.1.1. Depleción de las proteínas abundantes del fluido pleural ___________________________________________________________ 163 3.1.2. Eficacia del prefraccionamiento del fluido pleural _______ 164 3.1.3. Obtención de mapas proteicos bidimensionales del fluido pleural _______________________________________________________ 166 3.1.3.1. Optimización del método ____________________________________ 166 3.1.3.2. Efecto del prefraccionamiento mediante Hu-6 sobre el patrón bidimensional de proteínas de fluido pleural humano _________________ 167 3.1.4. Comparación del proteoma del derrame pleural de pacientes con patologías malignas y benignas _____________________ 169 3.1.4.1. 3.1.5. Análisis de Componentes principales ________________________ 174 Identificación de proteínas con expresión diferencial en el DP de pacientes con patologías malignas y benignas_________ 177 3.2. Selección y caracterización bioquímica de proteínas con expresión diferencial en derrame pleural maligno y benigno ______________________________________________________ 181 3.2.3. 3.2.1.1. Caracterización de la proteína PEDF _____________________ 181 Inmunodetección de la proteína PEDF mediante immunobloting _____________________________________________________________ 182 3.2.1.2. Análisis de las isoformas de la proteína PEDF ________________ 185 Índice 3.2.2. Validación de la proteína PEDF como marcador de DPM ___________________________________________________________ 187 3.2.2.1. Valoración de los niveles de la proteína PEDF en el derrame pleural _______________________________________________________________ 187 3.2.2.2. Parámetros diagnósticos del PEDF como marcador del derrame pleural maligno _____________________________________________________________ 189 3.2.2.3. Relación de los niveles de PEDF con las caracteríticas clínicas y bioquímicas de los pacientes ______________________________________________ 190 3.2.2.4. Correlación de los niveles de PEDF con otras variables clínicas para la clasificación del derrame pleural maligno _____________________________ 191 3.2.3. 3.2.3.1. Caracterización de la proteína S 100 A9 _________________ 192 Inmunodetección de la proteína S 100 A9 mediante immunobloting ____________________________________________________________ 193 3.2.4. Validación de la proteína calprotectina como marcador de derrame pleural maligno ________________________________________ 198 3.2.4.1. Valoración de los niveles de la proteína calprotectina en el derrame pleural ____________________________________________________________ 198 3.2.4.2. Parámetros diagnósticos de la calprotectina como marcador del derrame pleural maligno ____________________________________________________ 202 3.2.4.3. Parámetros diagnósticos de otras variables para la clasificación del DPM _______________________________________________________ 205 3.2.4.4. Influencia de los niveles de calprotectina sobre la predicción del derrame pleural maligno _________________________________________________ 206 3.2.4.5. Comparación de la sensibilidad de la citología y la calprotectina en la detección del derrame pleural maligno _____________________ 208 3.2.4.6. Validación de los datos obtenidos. ______________________________ 209 4. Discusión _________________________________________________ 211 4.1. Búsqueda de marcadores en el fluido pleural __________ 213 4.1.1. Depleción de las proteínas más abundantes del líquido pleural ___________________________________________________________ 217 Índice 4.1.2. Detección e identificación de proteínas con expresión alterada ___________________________________________________________ 221 4.2. Selección y caracterización bioquímica de proteínas con expresión diferencial en derrame pleural maligno y benigno ______________________________________________________ 232 4.2.1. Caracterización de la proteína PEDF _____________________ 233 4.2.2. Validación de la proteína PEDF como marcador de derrame pleural maligno ___________________________________________ 235 4.2.3. Caracterización de la proteína Calprotectina ____________ 239 4.2.4. Validación de la proteína Calprotectina como marcador de derrame pleural maligno _____________________________ 242 4.2.4.1. Procedimiento a seguir para la utilización de la calprotectina para la detección del derrame pleural maligno en la práctica clínica diaria _____________________________________________________________ 249 5. Conclusiones ______________________________________________ 253 Bibliografía __________________________________________________ 257 Abreviaturas Abreviaturas Abreviaturas 1D: monodimensional, en una dimensión 1-DE: electroforesis monodimensional 2D: bidimensional, en dos dimensiones 2-DE: electroforesis bidimensional 3D: tridimensional, en tres dimensiones AcN: acetonitrilo ACP: análisis de componentes principales ADA: adenosina desaminasa APS: persulfato amónico AR: artritis reumatoide ARNm: ácido ribonucleico mensajero AUC: área bajo la curva ROC BCIP: 5-bromo-4-cloro-3-indolilfosfato CA: antígeno carbohidrato CEA: antígeno carcinoembrionario CHAPS: 3-[(3-colamidopropil) dimetilamonio]-1-propanolsulfonato CHUVI: complejo hospitalario universitario de Vigo CP: componente principal CPM: cáncer de pulmón microcítico CPNM: cáncer de pulmón no microcítico CYFRA 21-1: fragmentos de la citoqueratina 19 DIGE: diferential in-gel electrophoresis 29 Abreviaturas DP: derrame pleural DPB: derrame pleural benigno DPM: derrame pleural maligno DS: desviación estándar DTT: ditiotreitol EDTA: ácido etilendiaminotetracético ELISA: Enzyme-Linked ImmunoSorbent Assay HCl: ácido clorhídrico HU-6: columna de inmunoafinidad múltiple para la depleción de las 6 proteínas más abundantes del suero humano IAA: iodoacetamida ICAT: isotope-coded affinity tags IEF: isoelectroenfoque Ig: inmunoglobulina IL: interleuquina iTRAQ: isobaric tags for relative and absolute quantitation LDH: lactato deshidrogenasa LES: lupus eritematoso sistémico LMW: marcador de peso molecular LR: likehood ratio milli-Q: ultrapura MMP: metaloproteinasas de la matriz Mr: masa molecular MS: mass spectrometry MudPIT: multidimensional proteins identification technology 30 Abreviaturas NBT: azul de nitrotetrazolio NSE: enolasa neuroespecífica PBS: phosphate buffered saline PEDF: pigment epithelium derived factor PET: position emisión tomography pI: punto isoeléctrico PMF: peptide mass fingerprinting PMN: polimorfonucleares PVDF: floruro de polivinilideno ROC: receiver operating characteristic SDS: dodecil sulfato sódico SDS-PAGE: electroforesis desnaturalizante en geles de poliacrilamida SELDI: surface-enhanced laser desorption/ionization TAC: tomografía axial computarizada TCA: ácido tricloroacético TEMED: tetrametilendiamina TNF: factor de necrosis tumoral VIH: síndrome de inmunidad adquirida VPN: valor predictivo negativo VPP: valor predictivo positivo 31 Resumen Resumen Resumen El derrame pleural (DP) es una acumulación de fluido en la cavidad pleural, indicativa del desarrollo de una enfermedad de tipo pulmonar, pleural o extrapulmonar. En nuestro caso, el derrame pleural maligno (DPM) (secundario a neoplasias de tipo epitelial o a carcinomas) es la manifestación de una enfermedad neoplásica de tipo metastásico en estado muy avanzado. Generalmente se relaciona con una supervivencia media corta y una elevada tasa de morbilidad y mortalidad. Es por este motivo que una investigación exhaustiva de los marcadores que ocasionan este tipo de patología, aparte de contribuir a mejorar el diagnóstico y pronóstico de los pacientes, permitiría la obtención de un seguimiento más adecuado de esta patología. En la actualidad, la forma menos invasiva, más rápida y eficaz de establecer el diagnóstico de malignidad es el examen citológico del líquido pleural y, pese a que varía en función del tipo de tumor, el porcentaje medio de DPM que se diagnostican mediante esta metodología ronda el 60 %. A pesar de que se han analizado numerosos procedimientos bioquímicos, genéticos e inmunológicos para intentar mejorar la sensibilidad en el diagnóstico, ninguno de estos métodos es, hasta la fecha, aplicable en la práctica clínica diaria. Y puesto que a día de hoy se emplean metodologías muy agresivas para el establecimiento de un diagnóstico, sería importante encontrar un método de valoración que fuese más cómodo, rápido y preciso, y que permitiese evitar la realización de procedimientos agresivos como la biopsia pleural o biopsia por toracoscopia. En el ámbito de la investigación biomédica, la búsqueda de marcadores mediante el empleo de metodologías proteómicas ha dado origen a resultados bastante prometedores, por lo que en esta Tesis 35 Resumen Doctoral se han empleado este tipo de metodologías para detectar proteínas con utilidad clínica para el diagnóstico del DPM, y además se ha procedido a la posterior validación de las proteínas consideradas como candidatas a marcadores de la patología. En un primer momento se ha llevado a cabo un estudio proteómico de expresión diferencial con el objetivo de identificar y cuantificar proteínas que presentaban un nivel de expresión alterado como consecuencia del estado patológico. Como primer paso se empleó una estrategia que consiste en el uso de un método de prefraccionamiento de la muestra previo a la separación electroforética. Este método nos permitió enriquecer la muestra en un grupo de proteínas de interés, que en nuestro caso estaría compuesto por proteínas que aparecían de forma minoritaria en las muestras de DP, consiguiéndose una mejora en la resolución de los mapas, y pudiéndose detectar un mayor número de proteínas, incluyendo las denominadas proteínas de baja abundancia, que presentan especial relevancia en el descubrimiento de nuevos marcadores tumorales y dianas terapéuticas. Para iniciar la búsqueda de proteínas candidatas a marcadores de diagnóstico utilizamos la tecnología de electroforesis diferencial en gel (DIGE), que está basada en la electroforesis bidimensional, pero en este caso es una técnica de tipo multiplex en la que múltiples muestras marcadas con diferentes fluoróforos migran en un mismo gel. Tras el análisis estadístico de los mapas proteicos obtenidos mediante esta tecnología pudimos saber qué especies proteicas presentaban variaciones significativas entre las muestras a estudio, que serían posteriormente identificadas mediante espectrometría de masas (MS). Una vez realizado el análisis de los mapas proteicos y la identificación de las proteínas cuya expresión variaba entre la patología maligna y benigna del derrame, pudimos seleccionar aquellas proteínas que por sus características y sus funciones podían ser consideradas 36 Resumen potenciales candidatas a marcadores del DPM. Además, se corroboró que la metodología empleada en este trabajo era adecuada como herramienta para abordar la búsqueda de biomarcadores, ya que algunas de las proteínas cuya expresión se encontraba alterada en DPM habían sido propuestas previamente como candidatas a marcadores tumorales para las patologías que ocasionaban el derrame. Las especies proteicas que fueron seleccionadas para su validación como marcadores del DPM en esta tesis fueron sometidas a estudios de Western Blot e inmunoblot, para comprobar la alteración observada mediante la metodología DIGE, y a una posterior cuantificación proteica mediante el empleo de ELISAs específicos para cada una de las proteínas. Como primera proteína seleccionada como marcador se consideró al factor derivado del epitelio pigmentado (PEDF por su nombre en inglés Pigment epithelium-derived factor), cuyo patrón de expresión de las dos isoformas observadas en los geles DIGE permitía una clara separación entre el DPM y derrame pleural benigno (DPB). El PEDF es una glicoproteína que presenta una gran capacidad anti-angiogénica, mucho mayor que cualquier otro factor conocido de producción endógena. Por eso se procedió a comprobar la alteración de estas isoformas mediante Western Blot en una y dos dimensiones. Pese a que mediante la metodología DIGE ambas isoformas presentaban un ascenso en su expresión en pacientes con patología maligna, en los mapas monodimensionales apenas había diferencias entre los dos tipos de patologías, y en los mapas bidimensionales se detectaron diversas isoformas de masa molecular (Mr) y punto isoelétrico (pI) característico. El empleo de la metodología ELISA no ayudó a verificar los resultados puesto que existen múltiples isoformas cuya concentración hace que se enmascaren unas a otras a la hora de cuantificar la concentración total de la proteína. 37 Resumen Las otras proteínas candidatas fueron la S 100 A8 y S 100 A9, que son dos proteínas que presentan un gran potencial como marcadores tumorales y dianas terapéuticas del cáncer. Además, también están implicadas en reacciones inflamatorias. Tanto la proteína S 100 A8 como la proteína S 100 A9 presentaban un patrón de expresión disminuido en los pacientes con patología maligna cuando se analizaron mediante metodología DIGE. Aunque en un principio se decidió realizar su análisis mediante Western Blot por separado para valorar su expresión, el análisis de la concentración se decidió hacer en conjunto, teniendo en cuenta la particularidad que presentan ambas proteínas de formar el dímero denominado calprotectina. El análisis mediante inmunoblot de la proteína S 100 A9 reveló la existencia de una mayor concentración de proteína en los pacientes con DPB en relación a aquellos que presentaban DPM, lo que confirmaría los resultados del DIGE. Debido a que las diferencias estaban tan claras, se decidió realizar el ELISA de la calprotectina (dímero formado por las proteínas S 100 A8 y S 100 A9) directamente, sin haber realizado inmunodetección previa de la proteína S 100 A8, suponiéndose que se detectaría la proteína de la misma manera que se había detectado la S 100 A9. Después de realizar las determinaciones bioquímicas se compararon las concentraciones de la calprotectina en distintos tipos de muestras cedidas por el Complejo Hospitalario Universitario de Vigo (CHUVI). Para el análisis de los resultados se emplearon pruebas de significación bilateral con un límite de significación estadística p < 0,05, obteniendo un resultado significativo (p = 0,001) a la hora de clasificar a los pacientes con DPM de aquellos con DPB, con una probabilidad estadística del 95 %. La elaboración de curvas ROC (Receiver-Operating Characteristic) permitió la obtención de un punto de corte con el que se obtenía la 38 Resumen mayor eficiencia diagnóstica (545 ng/mL), y otro con el que se obtenía la mayor sensibilidad (736,4 ng/mL). Además, estos resultados permitían un diagnóstico clínico casi perfecto a la hora de clasificar a los pacientes entre DPM y DPB. A modo de conclusión, los resultados obtenidos en esta Tesis Doctoral han demostrado la utilidad y efectividad de la metodología empleada para llevar a cabo un estudio proteómico dirigido a la búsqueda de nuevos marcadores biomoleculares para el DPM. Entre las proteínas cuya expresión se encontró alterada y de las que se realizó un estudio en profundidad, consideramos que la proteína calprotectina podría ser de utilidad en clínica, y en concreto, ser utilizada como marcador complementario a la citología del fluido pleural. 39 1. Introducción Introducción INTRODUCCIÓN 1.1. La pleura La pleura es una membrana serosa de origen mesodérmico que recubre el parénquima pulmonar, el mediastino, el diafragma y la superficie interna de la pared torácica. A nivel histológico, la pleura está formada por una monocapa de células mesoteliales aplanadas y con microvellosidades en su superficie, que descansan sobre la lámina basal, con varias capas subyacentes de tejido conectivo que contienen vasos sanguíneos y linfáticos. Este tejido, de tipo conectivo, es una estructura compleja que también está relacionada con la inflamación en el espacio pleural (Jantz y Antony, 2008). Figura 1. Imagen representativa de las capas que componen la pleura pulmonar (tomado de http://www.beltina.org). La pleura se subdivide en pleura visceral y pleura parietal, quedando entre ambas un espacio cerrado denominado espacio o cavidad pleural (figura 1). La pleura visceral es la que recubre la 43 Introducción superficie del pulmón, mientras que la pleura parietal recubre la superficie interna de la pared torácica, la cara lateral del mediastino y la parte superior del diafragma, subdividiéndose a su vez en pleura parietal costal, mediastínica y diafragmática (Sahn, 1990) (figura 2). Figura 2. Imagen representativa de las capas que componen la pleura pulmonar (tomado de http://www.portalesmedicos.com/publicaciones/articles/2092/1/Cuidados-de- Enfermeria-en-paciente-con-drenaje-pleural-por-neumotorax-espontaneoPLEUREVAC.html#). Entre las dos hojas pleurales que forman la cavidad pleural existe una anchura de entre 10 y 20 mm, aproximadamente que, en condiciones normales, contiene una pequeña cantidad de líquido pleural (0.1-0.2 mL/Kg de peso corporal, en cada hemitórax) encargado de lubrificar y mantener independientes ambas membranas pleurales. La tasa de absorción y reabsorción de este líquido es de unos mililitros al día. El filtrado inicial de la circulación sistémica contiene aproximadamente una concentración de proteínas de entre 0.3 y 0.4 44 Introducción g/dL. Sin embargo, la mayor parte del líquido filtrado se reabsorbe rápidamente mediante las vénulas, por lo que se concentra en proteínas entre 1.0 y 1.5 g/dL (Sahn, 1990). Además, el volumen de líquido pleural se verá modificado ante la presencia de desajustes en la homeostasis pleural (Pérez-Rodríguez y Villena-Garrido, 2006; Villena-Garrido et al., 2006). En la tabla 1 se muestra la composición del líquido pleural en condiciones normales. Tabla 1. Composición y pH del líquido pleural en condiciones normales. Volumen 0.13 ± 0.06 mL/kg Células/mm3 1000-5000 Células mesoteliales 0-2 % Macrófagos 64-80 % Linfocitos 18-36 % CD4/CD8 0.6-1 Proteínas Albúmina 1-2 g/dL 50-70 % Glucosa Similar al plasma LDH < 50% del valor en plasma pH ≥ plasma CD: Cluster of differentiation, LDH: Lactato deshidrogenasa Por la arteria intercostal, localizada en la circulación sistémica, viaja el suministro de sangre arterial que se dirige a la pleura parietal y visceral. La pleura visceral está drenada por las venas pulmonares y bronquiales, y la pleura parietal por las venas intercostales y venas mamarias internas. El drenaje linfático de ambas pleuras difiere de forma considerable. El drenaje de la pleura parietal está realizado por la vía principal para el drenaje de líquido y células del espacio pleural, este 45 Introducción drenaje ocurre totalmente en la pleura parietal, en la cual los vasos linfáticos derivan en los nodos intercostales y a lo largo de la arteria torácica interna. Sin embargo, la pleura visceral presenta una red linfática dirigida hacia el hilio pulmonar, donde las estructuras que forman la raíz del pulmón entran y salen de la víscera, aunque no parece contribuir al drenaje de la cavidad pleural (Ferrer y Roldán, 2000). Únicamente la pleura parietal posee fibras nerviosas sensitivas en su capa de tejido conectivo, por lo que una irritación de la misma producirá sensación de dolor. En contraste con la pleura parietal, la pleura visceral no contiene fibras nerviosas sensitivas por lo que siempre que exista dolor pleurítico indicará afectación de la pleura parietal (Ferrer y Roldán, 2000). La función principal de la pleura es facilitar el movimiento de los pulmones en el interior de la caja torácica durante la respiración, porque la fina capa de fluido del espacio pleural y las microvellosidades del mesotelio son factores lubrificantes (Ferrer y Roldán, 2000). Para lograr este movimiento pulmonar, la pleura debe armonizar las fuerzas elásticas y no elásticas (tanto torácicas, como pulmonares), para disminuir el gasto energético de los movimientos de expansión y retracción pulmonar. Esto es posible debido a la existencia de una presión negativa intrapleural que es capaz de evitar el colapso del pulmón; debido a que las dos hojas pleurales se deslizan una sobre la otra gracias al líquido pleural; y debido a las microvellosidades que presenta su mesotelio (Jantz y Antony, 2008; Ferrer y Roldán, 2000) (figura 3). 46 Introducción Figura 3. Imágenes representativas de cómo ocurre la respiración pulmonar. Figura de la izquierda donde se puede observar cómo tres presiones importantes son las que están implicadas en la respiración: la presión alveolar (PA), la presión pleural (Ppl) y la presión transmural (Ptm). Hay dos presiones transmurales que cambian durante el llenado y vaciado de los pulmones: la presión transpulmonar (Pp) y la presión transmural en las vías aéreas (Ptva). Tanto la Pp como la Ptva pueden definirse cómo presión interior menos presión exterior. En ambos casos, la presión en el exterior es la Ppl. (Figura obtenida de http://163.178.103.176/Fisiologia/respiratorio/pracb_7/respi_pracb_1.html). En el caso de la figura de la derecha se puede observar como son los cambios en la presión durante la ventilación pulmonar (Figura obtenida de la siguiente página web http://163.178.103.176/Fisiologia/respiratorio/ejercicios/ejerc_6/respi_ejercicio_.html). 1.2. Derrame pleural El derrame pleural (DP) se define como la acumulación patológica de fluido en la cavidad pleural que rodea al pulmón, que impide que se produzca una correcta distensión pulmonar durante la inspiración, perjudicándose la respiración. Un DP es indicativo del desarrollo de una enfermedad de tipo pulmonar, pleural o extra pulmonar, por lo que se hace necesaria una aproximación sistemática a la investigación de las 47 Introducción causas que originaron el derrame, para así poder establecer un posible diagnóstico (Medford y Maskell, 2005). El fluido pleural puede originarse en los capilares pleurales (principalmente los parietales), en el espacio intersticial pulmonar, en los ganglios linfáticos, en los vasos sanguíneos intratorácicos, o en la cavidad peritoneal. La reabsorción de este fluido se realiza principalmente mediante los vasos linfáticos de la pleura parietal (figura 4). Los mecanismos por los que se origina el DP se relacionan con un aumento de la producción de fluido o una disminución de la reabsorción del mismo. Esto puede ser originado por cambios en las presiones hidrostáticas capilares, cambios en las presiones coloidosmóticas (tanto intra- como extravasculares), y cambios en las presiones negativas intratorácicas (Villena-Garrido et al., 2006). Sin embargo, una gran variedad de características clínicas pueden originar la acumulación de fluido en el espacio pleural (Gu et al., 2007). Figura 4. Imagen representativa del flujo de fluido pleural (imagen obtenida de http://www.pcca.net/PleuralEffusion.html). 48 Introducción 1.2.1. Cómo saber si un paciente presenta un derrame pleural Prácticamente todos los pacientes con DP deben someterse a una toracocentesis diagnóstica, excepto si existe una escasa cantidad de líquido pleural (< 1 cm de espesor en la radiografía realizada en decúbito ipsilateral), o cuando nos hallamos ante un cuadro clínico característico de insuficiencia cardíaca. Para poder cuantificar la cantidad de líquido pleural existente, se debe medir en una radiografía pectoral de la cara lateral del derrame la distancia al borde exterior del pulmón y al borde interior de la pared pectoral. Si esta distancia es menor de 10 mm, el diagnóstico mediante toracocentesis no debería realizarse (Light, 1995). 1.2.2. Exudados y trasudados El DP se divide clásicamente en derrame de tipo trasudado o de tipo exudado. El poder diferenciar entre ambos tipos es muy importante para poder decidir los estudios que deberán ser realizados a posteriori a los pacientes. Por definición, un trasudado se desarrolla cuando los factores sistémicos que influyen en la formación y absorción del fluido pleural se encuentran alterados, haciendo que este fluido se acumule. Fluido que puede ser originado en el pulmón, en la pleura, o en la cavidad peritoneal (Broaddus y Light, 1992). La zona del pulmón donde se da una acumulación de fluidos suele presentar una gran permeabilidad de los capilares a las proteínas; sin embargo, cuando se origina un DP de tipo exudativo se debe a una alteración en los capilares que están localizados donde el fluido esta alterado, lo que hace que se dé una acumulación excesiva de líquido. 49 Introducción La razón principal por la que conviene diferenciar entre trasudados y exudados es que, si el fluido es un trasudado no se necesitarían más procedimientos diagnósticos y su terapia sería directa (sobre todo de enfermedades como el fallo cardíaco congestivo, cirrosis, o nefrosis). Sin embargo, si se demuestra que el derrame es un exudado se requerirá una investigación diagnóstica más extensiva. Desde los años 70, los criterios que se emplean para el diagnóstico diferencial de los dos tipos de derrame son aquellos basados en la medida del fluido pleural, la cantidad de LDH sérica y pleural, y la concentración de proteínas, denominados “criterios de Light” (Light et al., 1972). Mediante los criterios de Light, el fluido pleural se clasificará como exudado si se cumple alguna de las siguientes características: - Proteínas del fluido pleural/proteínas del suero > 0.5 (unidades) - LDH del fluido pleural/LDH suero > 0.6 (unidades) - LDH fluido pleural > 2/3 el límite normal de la LDH sérica (el límite de corte del fluido pleural es 200 IU/L, normalmente) Otros autores han propuesto el empleo de diferentes criterios bioquímicos para el diagnóstico diferencial entre trasudados y exudados. Los más conocidos son la medida de los niveles de colesterol en el fluido pleural (Burgess, 2004; Costa et al., 1995), el empleo del cociente albúmina sérica/pleural (Atalay et al., 2005), y el empleo de la ratio bilirrubina del fluido pleural/suero (Meisel et al., 1990). Burgess, Romero, y sus respectivos colaboradores (Burgess et al., 1995; Romero et al., 1993) compararon los criterios de Light con otros test propuestos concluyendo que los criterios de Light son los que permiten separar los exudados de los trasudados con mayor sensibilidad y especificidad diagnóstica. 50 Introducción Burgess et al. (Burgess et al., 1995) también compararon la eficiencia de los criterios de Light y los niveles de colesterol, entre otras mediciones (como el gradiente de seroalbúmina), demostrando que los criterios de Light son más precisos, con una sensibilidad del 98 % (igual que la obtenida por Romero et al. (Romero et al., 1993) y una especificidad del 83 %, seguidos del gradiente de seroalbúmina, que presenta una sensibilidad del 87 % y una especificidad del 92 %. Por tanto, parece que los criterios de Light representan la mejor herramienta para separar los trasudados de los exudados. Cuando existe sospecha de que un paciente presenta trasudado pleural las únicas determinaciones que suelen realizarse son la determinación en suero y fluido pleural de LDH y proteínas. Sin embargo, cuando la sospecha es de exudado pleural es necesario determinar además el pH y los niveles de glucosa, realizar un recuento celular completo y diferencial, y estudiar su citología, entre otras valoraciones iniciales. Debemos destacar que las características del fluido pleural pueden cambiar ocasionalmente de trasudado a exudado, dificultando el diagnóstico, como en el caso de los pacientes que presentan diuresis (Broaddus, 2001; Broaddus y Light, 1992). 1.2.3. Causas más frecuentes de derrame pleural En España, la prevalencia del DP es ligeramente superior a 400 por cada 100.000 habitantes, siendo la causa más frecuente entre los trasudados la insuficiencia cardíaca congestiva, y entre los exudados el DP paraneumónico, el neoplásico, o el secundario a tromboembolia pulmonar (Villena-Garrido et al., 2006). Además, el número de nuevos casos (incidencia) de derrame pleural debido a enfermedades sistémicas 51 Introducción no es elevado cuando se revisan grandes series poblacionales, siendo en España del 1 % (Ferreiro et al., 2011). Se sabe que aproximadamente un 20 % de los derrames pleurales son causados por patologías malignas, y dentro de estos un 50 % se deben a cáncer de pulmón primario (Marel et al., 1995). 1.2.3.1. Insuficiencia cardíaca La insuficiencia cardíaca es la causa más frecuente de DP y, en particular, de los trasudados. Dos terceras partes de los pacientes con insuficiencia cardíaca congestiva desarrollan DP, y normalmente de tipo bilateral. En la insuficiencia cardíaca, el líquido pleural es de tipo trasudado y fácilmente diagnosticable mediante los criterios de Light. Aunque la concentración de proteínas, LDH y colesterol pleurales aumentan significativamente con el tratamiento diurético, pocas veces se alcanzan los valores propios de un exudado. Si la presentación clínica es atípica estaremos ante DP unilateral, DP bilateral con gran diferencia de tamaño entre un lado y otro, DP bilateral sin cardiomegalia, presencia de fiebre o dolor torácico y persistencia del DP a pesar del tratamiento diurético, por lo que deberíamos realizar una toracocentesis para el diagnóstico de esta patología (Kinasewitz, 1997). El tratamiento es el habitual de la insuficiencia cardíaca (diuréticos, inhibidores de la enzima conversora de la angiotensina, dioxina), aunque ocasionalmente puede ser beneficioso evacuar volúmenes de 0,5 a 1,5 litros de líquido pleural mediante toracocentesis para aliviar con mayor rapidez la disnea intensa de pacientes con DP cuantiosos (Shinto y Light, 1990). 52 Introducción 1.2.3.2. Derrame pleural tuberculoso La frecuencia del derrame pleural tuberculoso es muy variable y depende de la incidencia de tuberculosis en cada país. En España es un problema de primera magnitud, ya que se estima que la pleura está afectada en el 23,3 % de todos los pacientes con tuberculosis (VillenaGarrido et al., 2006). Los DP tuberculosos se originan debido a una infección pulmonar sub-pleural originada por el bacilo Mycobacterium tuberculosis. La tuberculosis pleural se desarrolla como un DP con características de exudado, y puede encontrarse aislada o asociada a tuberculosis pulmonar. El derrame pleural benigno (DPB) en la tuberculosis es el resultado de la ruptura del foco caseoso repleto del bacilo tras 6-12 semanas de la infección (figura 5), lo que provoca la entrada de antígenos micobacterianos en el espacio pleural, donde genera la respuesta de hipersensibilidad inmunológica (Evans, 2008; Wiwanitkit, 2011). Tras esta infección se desencadenan una serie de reacciones inmunológicas, en las cuales macrófagos y linfocitos T4 interaccionan entre sí mediante sus productos, interleucinas (IL) 1 y 2, interferón-γ y factor de necrosis tumoral-α (TNF-α), en los granulomas pleurales (Ferrer et al., 1999). Los pacientes con DP tuberculoso presentan sintomatología subaguda, como dolor pleural, fiebre y tos, siendo en algunos casos dolores agudos. Pacientes con síndrome de inmunodeficiencia adquirida (VIH) pueden mostrar manifestaciones más insidiosas y otros síntomas como disnea, tracnea, astenia y diarrea, e incluso otros menos frecuentes como hepatomegalia, esplenomegalia y linfadenopatías (Soriano et al., 1988). 53 Introducción Figura 5. Imagen representativa de las lesiones producidas por la patología tuberculosa en el pulmón (tomado de http://www.researchmalignantmesothelioma.com). El DP de los pacientes con DP tuberculoso normalmente ocupa menos de la mitad del hemitórax y raramente es masivo o bilateral. A estos pacientes se les suele realizar un test basado en la reactividad de su cuerpo al antígeno tuberculina. Normalmente es un test realizado sobre la piel y en el que los anticuerpos del paciente reaccionan contra el antígeno tuberculina. El test de la tuberculina positivo se obtiene en el 70 % de los pacientes inmunocompetentes y en un 40 % de los pacientes que presentan VIH (Ferrer, 1997) (figura 6). Figura 6. Imagen representativa del test de la tuberculina; si el paciente presenta el anticuerpo frente al antígeno suministrado, entonces aparecerá la reacción cutánea de tumefacción y coloración rojiza que se puede observar en la figura de la derecha. Imágenes obtenidas de http://www.tubesalud.com/pruebas-de-tuberculosis. 54 Introducción M.tuberculosis se localiza en un 10-25 % de los pacientes (Berger y Mejia, 1973) y en la biopsia pleural en el 40-65 % de los casos. Los granulomas, algunas veces con caseosis central, se encuentran en el 7077 % de las muestras obtenidas mediante biopsia por aguja (Klimiuk y Krenke, 2011). Existen otros parámetros diagnósticos para el fluido pleural tuberculoso. Por ejemplo, algunos estudios han demostrado que pacientes con tuberculosis tienen niveles de la enzima adenosina desaminasa (ADA) > 43 U/L (Aggarwal et al., 1999; Wong, 2005). Sin embargo, se detectan falsos negativos por ADA en pacientes inmunodeprimidos con infección por VIH (Shao et al., 2003). Además, los falsos negativos por ADA normalmente son un 5-10 % de los casos analizados, y en la mayoría de estos se deben a empiemas, linfomas, derrames de tipo reumatoide y, en algunas ocasiones, por otras neoplasias o infecciones (Orriols et al., 1992). La determinación de la subenzima ADA2 en el fluido pleural puede incrementar la especificidad del diagnóstico, puesto que pacientes con pleuritis tuberculosa presentan niveles elevados de esta subenzima (Ungerer et al., 1994). En una minoría de los casos, el DP tuberculoso puede manifestarse como una acumulación de líquido pleural purulento (empiema tuberculoso) en pacientes que recientemente han tenido una tuberculosis pleural (Villena-Garrido et al., 2006). 1.2.3.3. Derrame pleural paraneumónico Cualquier DP que se asocie con neumonía bacteriana, absceso pulmonar o bronquiectasias es un DP paraneumónico. Una complicación que suele aparecer relacionada con el DP paraneumónico es el empiema, que no es más que la presencia de pus en el espacio pleural. 55 Introducción En el desarrollo del DP paraneumónico existen 3 fases: exudativa, fibrinopurulenta y organizativa. En la fase exudativa se acumula un líquido pleural estéril que está relacionado con un aumento de la permeabilidad capilar originado por la liberación de diferentes citocinas [IL-6, IL-8, TNF-α, y factor estimulante del endotelio vascular] secretadas con el fin de eliminar al patógeno. En la fase fibrinopurulenta, la invasión bacteriana del espacio pleural induce daño endotelial, que conlleva la disminución de la respuesta fibrinolítica, y el depósito de fibrina en ambas superficies pleurales. El líquido pleural de los pacientes con DP paraneumónico contiene gran cantidad de células polimorfonucleares, bacterias y detritus celulares cuyo incremento de actividad metabólica local puede justificar la caída del pH y de glucosa, y el incremento de los valores de LDH, como consecuencia de un aumento de la glicolisis anaeróbica en este fluido. En la fase organizativa, aparecen diversos factores de crecimiento, entre ellos el de fibroblastos, el factor de crecimiento derivado de las plaquetas y el factor de crecimiento transformante β, estableciendo la fase final en la que hay un depósito de fibrina, siendo posterior la aparición del tejido fibroso de colágeno. Normalmente, tan pronto como se reconoce que el paciente presenta un DP paraneumónico, se recomienda la realización de una toracocentesis terapéutica y diagnóstica, y en caso de que el líquido pleural no purulento se reacumule, y la primera toracocentesis tuviese características indicativas de una posible mala evolución (cultivo positivo, pH < 7, glucosa < 40 mg/dL, LDH > 1000 UI/L), se optaría por la utilización a posteriori del tubo de drenaje (Light y Porcel, 2000). Cuando un fluido no es empiémico, se debería evaluar el pH, la glucosa y los niveles de LDH del mismo. Cuando el pH > 7,2, LDH < 1000 U/L y glucosa < 40 mg/dL, el fluido pleural se define como DP paraneumónico no complicado, y presenta un buen pronóstico médico al 56 Introducción tratamiento. Cuando el pH < 7, LDH > 1000 U/L y glucosa < 40 mg/dL, el derrame se define con DP paraneumónico complicado. Estos derrames de tipo complicado requieren el empleo de un tubo de toracotomía para su resolución. Cuando el valor del pH se localiza entre 7 y 7,2, la glucosa sobre 40 mg/dL y el LDH sobre 1000 U/L los pacientes deberían repetir la toracocentesis, y los análisis de laboratorio deberían realizarse cada 24-48h (Light, 1995). 1.2.3.4. Derrame pleural miscelánea a) Las DP por colagenosis colagenosis constituyen un grupo heterogéneo de enfermedades inflamatorias mediadas por el sistema inmunitario, que comparten características clínicas, como la afectación articular, afectación de las membranas serosas y afectación de los vasos sanguíneos. Desde el punto de vista anatomopatológico, se caracterizan por lesiones del tejido conectivo como la degeneración fibrinoide, la formación de granulomas y la fibrosis (Villena-Garrido et al., 2006). Las dos patologías más comunes en este grupo son el Lupus eritematoso sistémico (LES) y la artritis reumatoide (AR). El LES es una enfermedad autoinmune crónica que afecta al tejido conjuntivo. Se caracteriza por inflamación y daño de tejidos mediado por el sistema inmunitario de modo específico debido a la unión de anticuerpos a las células del organismo, y al depósito de complejos antígeno-anticuerpo. El LES puede afectar a cualquier parte del organismo, aunque los sitios más frecuentes son el aparato reproductor, las articulaciones, la piel, los pulmones, los vasos sanguíneos, los riñones, el hígado (el primer órgano que suele atacar) y el sistema nervioso. El curso de la enfermedad es impredecible, con periodos de crisis que alternan con periodos de remisión. 57 Introducción La AR es una enfermedad autoinmune sistémica, caracterizada por provocar inflamación crónica, principalmente de articulaciones, que produce destrucción progresiva, con distintos grados de deformidad, e incapacidad funcional. En algunas ocasiones, su comportamiento es extra-articular pudiendo afectar a diversos órganos y sistemas, como los ojos, pulmones y pleura, corazón y pericardio, piel o vasos sanguíneos. Aunque el trastorno es de causa desconocida, la autoinmunidad juega un papel primordial en el progreso de la enfermedad (sobre todo si se convierte en crónica). Aproximadamente el 1 % de la población mundial está afectada por la AR, siendo las mujeres tres veces más propensas a padecerla que los hombres. La aparición suele ocurrir entre los 40 y 50 años de edad; sin embargo, puede darse a cualquier edad. La AR puede llegar a ser una enfermedad muy dolorosa e incapacitante. Se diagnostica fundamentalmente por los signos y síntomas clínicos, así como con ciertos exámenes de laboratorio, incluyendo el análisis del factor reumatoide y las radiografías. b) DP por enfermedad cardíaca o vascular En este grupo incluimos el DP originado por insuficiencia cardíaca congestiva, el DP tras bypass aortocoronario, el DP y enfermedad pericárdica, el DP tras lesiones cardíacas (síndrome de Dressler) y el DP por tromboembolia pulmonar. El DP por insuficiencia cardíaca congestiva ya se ha descrito en apartados anteriores debido a que es la causa principal de DP. El DP tras bypass aortocoronario se da en la primera semana del post-operatorio de bypass coronario, donde la mayoría de los pacientes (89 %) presentan DP de pequeño tamaño (Light y Lee, 2008). Muchos de estos pacientes no tienen ninguna sintomatología, o únicamente cursan con disnea (VillenaGarrido et al., 2006). 58 Introducción En el caso del DP y la enfermedad pericárdica, más de una cuarta parte de los pacientes con este tipo de patología desarrollan DP. Normalmente se trata de trasudados relacionados con un aumento de las presiones pulmonares y sistémicas, o secundarios a la enfermedad que origina pericarditis (Tomaselli et al., 1989). El DP tras lesiones cardíacas (o síndrome de Dressler) se caracteriza por el inicio con fiebre, pleuropericarditis e infiltrados pulmonares 3 semanas después de haber sufrido una lesión miocárdica o pericárdica. Las lesiones tras las que se han descrito son: infarto agudo de miocardio, cirugía cardíaca (18 - 30 %), traumatismo torácico, implantación de marcapasos, angioplastia, y punción transtorácica del ventrículo izquierdo (Kim, Sahn 1996). Finalmente, en el DP por tromboembolia pulmonar, en su patogenia está implicado el aumento de la permeabilidad vascular. Los síntomas clínicos más frecuentes son la disnea y/o el dolor torácico pleurítico, presentes en más del 70 % de los pacientes (Villena-Garrido et al., 2006). c) DP postquirúrgico La mayoría de los pacientes sometidos a cirugía abdominal o cardíaca presentan un DP inmediato en el postoperatorio. Su incidencia varía entre el 60 y el 80 % según la técnica diagnóstica utilizada, y es algo menor (35 %) cuando la cirugía se realiza en la zona del abdomen inferior. Estos derrames suelen ocupar pequeñas porciones del tórax, además suelen ser asintomáticos, y suelen comenzar en el primer o segundo día tras la cirugía y desaparecer espontáneamente en un plazo de 2-4 semanas, aunque en ocasiones se prolonguen en el tiempo (Light et al., 2003). 59 Introducción d) DP por fármacos Algunos medicamentos son una causa demostrada, aunque no muy frecuente, de DP. Los mecanismos por los que se produce este efecto no son conocidos, pese a que se han postulado, entre otros, reacción de hipersensibilidad y toxicidad directa por vía inflamatoria u oxidativa. La lista de medicamentos causantes de DP crece día a día y en la actualidad abarca enfermedades un amplio cardiovasculares, espectro de agentes antiinflamatorias, utilizados en quimioterápicas, antibióticas, etc. Entre ellos, los más conocidos son la amiodarona, la nitrofurantoína, la metisergida, la bromocriptina, y los derivados ergolínicos (Villena-Garrido et al., 2006). e) DP por quilotórax y pseudoquilotórax El quilotórax se define como la presencia de linfa o quilo en la cavidad pleural. El quilo puede tener su origen en el tórax (por rotura del conducto torácico o sus afluentes) o en el abdomen. A diferencia del pseudoquilotórax, las superficies pleurales en el quilotórax son normales (Cortés-Télles et al., 2010). El quilotórax es una enfermedad infrecuente, y según el estudio realizado a pacientes de forma consecutiva en un servicio médico por Romero (Romero, 2000), afecta al 3 % de los pacientes con DP. Los síntomas más frecuentes del quilotórax no traumático en el adulto son disnea de esfuerzo y sensación de pesadez sobre el hemitórax afectado. La fiebre y el dolor torácico son raros, debido al efecto poco irritante del quilo (linfa). Su sospecha se produce generalmente tras la toracocentesis, por el aspecto del líquido pleural. 60 Introducción El pseudoquilotórax se produce por una rotura en casos de DP a largo plazo, y suele ocurrir en pacientes con tuberculosis o AR. El análisis de lípidos del fluido pleural es importante para distinguir entre quilotórax y pseudoquilotórax, y debería ser realizado en todas las muestras de fluido con apariencia lechosa y que, además, presentasen turbidez tras la centrifugación. Los quilotórax presentan niveles de triglicéridos > 110 mg/dL, que contienen también quilomicrones, aunque normalmente no se aprecian cristales de colesterol. Los pseudoquilotórax presentan niveles de triglicéridos < 110 md/dL y no contienen quilomicrones, además se caracterizan por niveles elevados de colesterol (> 200 mg/dL) (Huggins, 2010). 1.2.3.5. Derrame pleural paramaligno Existe también una clase de DP que se denomina DP paramaligno. Este tipo de derrame no es el resultado directo de neoplasias relacionadas con la pleura. Se relacionan con la presencia de un tumor primario pero, en este caso, el origen del DP no tiene relación con el tumor y se considera de tipo benigno. 1.2.3.6. Derrame pleural de difícil diagnóstico Nos referimos bajo este epígrafe a aquellos DP cuya causa es incierta después de una evaluación inicial que incluya el examen físico del paciente y el análisis del líquido pleural. Ferrer et al. (Ferrer et al., 1996) evaluaron, durante una media de 62 meses, a 40 pacientes con exudado pleural considerado idiopático después de un análisis exhaustivo del líquido pleural en todos los casos, y una biopsia pleural a ciegas en el 87 % de ellos. La mayoría de estos DP se resolvieron 61 Introducción espontáneamente, aunque en el 25 % de los casos lo hicieron después de un período prolongado o de varias recidivas. En 32 sujetos (80 %) no se encontró ninguna causa del DP durante el seguimiento, y sólo en 2 de ellos (5 %) se descubrió una neoplasia. En ningún caso se diagnosticó tuberculosis, a pesar de que 19 pacientes, todos con valores pleurales bajos de ADA, tenían la prueba de la tuberculina positiva. Los resultados de este estudio muestran que la mayoría de los DP idiopáticos tienen un curso benigno. No obstante, la toracoscopia estaría indicada en pacientes con un DP sin diagnóstico que no mejoran espontáneamente, y en los que consideremos que la neoplasia es una causa probable (Light, 2002). Existe otra tipología de DP de difícil diagnóstico, que se da en pacientes que presentan recurrencia de DP tras un seguimiento clínicoradiológico de 1 año de duración, el DP reactivo. 1.2.3.7. Derrame pleural Neoplásico o derrame pleural maligno El DP secundario a neoplasias o derrame pleural maligno (DPM) es la manifestación de una enfermedad neoplásica metastásica en estado muy avanzado, por lo que generalmente se relaciona con una supervivencia media corta (Sekine et al., 2008), y una elevada tasa de morbilidad y mortalidad (Khaleeq y Musani, 2008). En la mayoría de los estudios el cáncer de pulmón ha sido la neoplasia que ha originado este tipo de patología de un modo más frecuente, apareciendo en un 17 - 56 % de los casos (Sekine et al., 2008). El cáncer de mama es la segunda patología que ocasiona DP con mayor frecuencia, en un 18 % de los casos. Los linfomas, incluyendo el linfoma de Hodgkin y no Hodgkin, son también causas importantes de DPM. Tumores menos asociados con DPM son los de ovario, los de origen gastrointestinal y los de tipo urinario, que representan menos del 5 % (Heffner et al., 2000). 62 Introducción El diagnóstico certero de malignidad puede conseguirse sólo mediante la aparición de células tumorales en el líquido, o en muestras de tejido pleural detectadas mediante una técnica denominada citología. El rendimiento de la citología varía ampliamente dependiendo de la extensión del tumor en la cavidad pleural, y de la naturaleza de la neoplasia primaria. Así, el carcinoma epidermoide, cuyas células están unidas por abundantes puentes de unión, proporciona un peor rendimiento de la citología que otros tumores más laxos, como el microcítico. Además, los derrames malignos que cursan con pH bajo tienen un mayor rendimiento de la citología, debido a la estrecha relación entre pH bajo y extensa afectación tumoral de la pleura (Sahn y Good, 1988). Cuando un DP se sabe que es secundario a metástasis pleural se debe plantear la posibilidad de eliminar el espacio pleural mediante la unión de las capas pleurales, técnica denominada pleurodesis (que consiste en la inyección de un agente irritante que provoca una reacción pleural intensa capaz de fusionar las pleuras visceral y parietal) (PorcelPérez, 2002). Los pacientes que se someten a este procedimiento deben cumplir varios requisitos: en primer lugar el paciente no puede presentar un mal estado general, o una expectativa de vida muy corta (menos de 1 mes), ya que en estos casos es preferible optar por las toracocentesis terapéuticas periódicas (Antony et al., 2000). En segundo lugar, la disnea debe ser un factor limitante de la calidad de vida del paciente. En tercer lugar, debe mejorar, claramente, la disnea del paciente. Y finalmente, el pulmón debe estar completamente re-expandido para conseguir una unión pleural exitosa (Antunes y Neville, 2000). Una patología especial de la pleura es el mesotelioma pleural, que es la neoplasia maligna de origen pleural. Se desarrolla principalmente como consecuencia del contacto con asbestos (mineral de composición y características semejantes a las del amianto, pero de fibras duras y 63 Introducción rígidas que pueden compararse con el cristal hilado), de entre 20 a 40 años antes de desarrollar la neoplasia, y en España se asocia en la mayor parte de los casos con las profesiones relacionadas con la construcción de casas, barcos, o con otros medios de transporte (LópezAbente et al., 2005) (figura 7). Figura 7. Imagen de las fibras de asbestos en su estado mineral. Fotografías tomadas en el Museo de Historia Natural de Londres. Para su diagnóstico se precisan muestras de biopsia pleural y es importante diferenciarlo de la hiperplasia mesotelial benigna, y del adenocarcinoma metastásico de la pleura. Hoy en día, para su diagnóstico, se emplea un panel de marcadores inmunohistoquímicos cuya utilización es casi imprescindible. La positividad de calretinina, HBME-1, mesotelina y citoqueratina 5/6 sugieren mesotelioma, mientras que el antígeno carcinoembrionario (CEA), B72.3, el antígeno epitelial humano, MOC 31 o el BG8 sugieren adenocarcinoma metastásico (Villena-Garrido et al., 2006). En la tabla 2 aparece un resumen de las etiologías que suelen presentar los DP. 64 Introducción Tabla 2. Etiología del DP 1.3. Características del derrame pleural 1.3.1. Epidemiología En el análisis realizado por Marel (Marel, 2002) se demostró que la incidencia del derrame era del 0.32 % de los pacientes de su hospital, y que la insuficiencia cardíaca congestiva representaba el 50 % de los derrames. Además en su estudio se comprobó que la segunda causa más frecuente que originaba el DP era la malignidad (21,8 %), y la tercera causa la neumonía (17 %), seguida de la embolia pulmonar (5,6 %). Estos cuatro diagnósticos representaron, en el estudio de Marel, más del 90 % de todos los derrames encontrados. Sin embargo, Marel menciona que en países como España, la tuberculosis es una de las patologías más 65 Introducción frecuentes, y que los derrames paraneumónicos son frecuentes en países como Francia, República Checa o Japón. En España, como ejemplo de país desarrollado, el porcentaje de DPB debido a la presencia de Mycobacterium tuberculosis es del 23,3 % del total (Villena-Garrido et al., 2006; Ferrer-Roldán, 2000). Actualmente, un 30 % de los casos de DP se originan en pacientes jóvenes que presentan tuberculosis (Evans, 2008). Se sabe que en los países subdesarrollados la tuberculosis es una de las enfermedades que desencadenan DPB, y es una de las causas de muerte más importantes. Y en la población VIH-positiva mundial, puede llegar a observarse hasta en el 60 % de los pacientes (Evans, 2008). Según datos de la Organización Mundial de la Salud, 8 millones de nuevos casos de tuberculosis ocurren cada año en todo el mundo (Pérez-Rodríguez y Villena-Garrido, 2003). En lo referente al DPM, una de las características principales es que es un problema clínico común en pacientes con enfermedades neoplásicas. Pese a que no hay estudios sobre la epidemiología, destacamos como ejemplo que la incidencia del DPM en Estados Unidos está estimada en más de 150.000 casos anuales (Antony, 2003). A pesar de que el DPM ocurre con todos los tipos histológicos de cáncer de pulmón, se asocia frecuentemente al adenocarcinoma (PérezRodríguez y Villena-Garrido, 2006; Khaleeq y Musani, 2008). El otro tipo histológico asociado a DPM, el mesotelioma, tendrá una incidencia que variará de acuerdo con la localización geográfica (Antony et al., 2000) sabiendo, además, que un tumor maligno puede causar un DP directa o indirectamente. 66 Introducción 1.3.2. Patogénesis del derrame pleural El DPM se caracteriza por la presencia de células malignas en el líquido pleural o por su demostración en el tejido pleural, obtenido mediante el empleo de distintos procedimientos (biopsia percutánea, toracoscopia, toracotomía, autopsia, etc.) (Antony et al., 2000; Heffner y Klein, 2008), mientras que el DPB es una complicación asociada con una variedad de enfermedades locales y sistémicas. Figura 8. Imagen representativa de la formación de un derrame pleural maligno debido al crecimiento de una masa tumoral en la cavidad pleural, (tomado de http://viryabo.hubpages.com/hub/mesothelioma-victims_and-the-dreaded_asbestosillnesses). Cuando existe una relación directa del tumor con la pleura esto puede contribuir a la formación de DPM. Por ejemplo, cabe esperar que cambios en la inflamación local ocurridos como respuesta a una invasión tumoral pueden ocasionar un incremento de la permeabilidad capilar, que derivará como resultado final en un DPM (Antony et al., 2000). Además, la interferencia con la integridad del sistema linfático en algún lugar de la pleura parietal y de los nódulos linfáticos mediastinales 67 Introducción puede resultar en una deformación del fluido linfático (Antony et al., 2000; Meyer, 1966). Los estudios postmortem de pacientes afectos de DPM sugieren que la mayoría de las metástasis pleurales surgen de un émbolo producido por un tumor en la superficie de la pleura visceral (figura 8), o por contacto secundario en la pleura parietal (Heffner y Klein, 2008; Rodríguez-Panadero et al., 1989). Otros posibles mecanismos que pueden provocar este tipo de metástasis pleurales incluyen invasión directa del tumor (en cáncer de pulmón, neoplasia de la pared del pecho, o cáncer de mama), propagación de la hematogénesis a la pleura parietal, y participación linfática. En relación a los DPB, la causa más frecuente entre los trasudados es el fallo cardíaco congestivo, mientras que entre los exudados son las infecciones, la tuberculosis, y las enfermedades autoinmunes sistémicas (Salomaa et al., 1998). Un DPB, sea de la naturaleza que sea, puede ser producido por lesiones inflamatorias del tejido pleural o subpleural. El rasgo más importante de la afectación pleural, sobre todo en enfermedades del tejido conectivo, es el incremento de la permeabilidad capilar. Esta lesión puede producirse por una infiltración directa de la pleura o por un mecanismo inmune. Se ha demostrado que, en enfermedades como la AR o el LES, existen inmunocomplejos circulantes que pueden localizarse en el tejido pleural o en los capilares pleurales y activar el sistema del complemento: esto iniciaría un daño en el endotelio, que haría que un líquido rico en proteínas se acumulase en el intersticio pulmonar o en el espacio pleural (Halla et al., 1980). Adicionalmente, también se podrían producir reacciones complejas lideradas por la liberación de distintos enzimas proteolíticos desde los neutrófilos y citocinas desde los macrófagos, que no solamente afectarían a la permeabilidad capilar sino que también podrían ser capaces de modular la migración de los 68 Introducción fibroblastos, jugando un papel relevante en la extensión de la lesión pleural (Koster et al., 1971). La severidad y persistencia de la lesión determinarían si la evolución del DPB es hacia la resolución o hacia la fibrosis pleural. En procesos inflamatorios subpleurales localizados, como ocurre con la neumonía o con el infarto pulmonar, o en enfermedades con un daño difuso, como el síndrome del diestrés respiratorio agudo, el DP suele desarrollarse debido a que el líquido extravascular se mueve por un gradiente de presiones desde el intersticio pulmonar al espacio pleural, a través del mesotelio (Antony, 2003) (figura 3). Según Ferrer y Roldan (Ferrer y Roldán, 2000) se pueden producir acumulaciones del fluido pleural en la cavidad pleural y normalmente como resultado de los siguientes mecanismos: - Incremento en la filtración capilar de la pleura, que ocurre en pacientes con fallo cardíaco derecho o izquierdo. Y, por otro lado, incremento de la capilaridad pleural y de la permeabilidad del mesotelio (mecanismo común de derrame pleural exudativo derivado de infecciones). - Disminución del drenaje linfático pleural producido por una obstrucción a cualquier nivel del sistema linfático pleural. - Disminución de la presión pleural como consecuencia de la atelectasia pulmonar (disminución del volumen de la pleura) o paquipleuritis (adhesión de las dos hojas pleurales y engrosamiento de las mismas debido al desarrollo de tejido conjuntivo fibroso). - Paso del fluido acumulado a través de pequeñas aberturas en el diafragma del peritoneo de la cavidad pleural en pacientes con ascitis (acumulación de líquido en el abdomen). 69 Introducción 1.3.3. Diagnóstico Cuando un paciente acude al hospital es importante que se le realice un estudio clínico para poder establecer un diagnóstico de DP. Por ejemplo, a la hora de predecir un DPM, factores importantes que debemos tener en cuenta son: menos de un mes de presencia de los síntomas, y ausencia de fiebre (Ferrer et al., 2005). Puesto que se sabe que el DP, en muchas ocasiones, es una complicación frecuente de las infecciones pulmonares debido a una gran variedad de microorganismos, las siguientes fases son empleadas frecuentemente para la distinción de la patología de las infecciones pleurales: - Pleura seca. Puesto que es la causa de una extensión de la infección pulmonar contigua a la pleura. La pleura visceral empieza a inflamarse, pero no hay acumulación de líquido pleural. - Fase exudativa. La inflamación pleural ocasiona un incremento de la permeabilidad de los capilares y como resultado ocasiona una extravasación en la cavidad pleural del fluido rico en células inflamatorias, principalmente neutrófilos, proteínas y fibrinógeno. - Fibropurulenta. En esta fase, que puede desarrollarse muy despacio si el tratamiento adecuado no se aplica, el fluido pleural es rico en microorganismos, células polimorfonucleares y detritus celulares. La fibrina es depositada en la pleura parietal y visceral, y en algunos casos se puede adherir a la cavidad pleural. - Organizativa. Esta es la fase final del proceso. Se caracteriza por la invasión de la fibrina por la red de fibroblastos que se encargan de depositar colágeno. La pleura está cubierta de una capa rígida de tejido fibroso. Si no se procesa, el material purulento de la pleura puede drenar en los espacios bronquiales y causar una fístula broncopleural, o en el tórax en donde se originará un empiema. 70 Introducción Actualmente, se han desarrollado numerosas técnicas aplicables al estudio del fluido pleural, aunque en muchos casos son técnicas muy agresivas que pueden llegar a ocasionar múltiples transtornos a los pacientes (Ferrer y Roldán, 2000). 1.3.4. Metodologías diagnósticas 1.3.4.1. Olor y apariencia del fluido pleural El test más barato y que probablemente es el realizado con menor frecuencia es el diagnóstico mediante olor del fluido pleural. El olor que el fluido presenta puede servirnos para establecer dos diagnósticos de modo instantáneo (Light, 1997). Si el fluido tiene un olor putrefacto o fétido, entonces se trata de un empiema pleural, que normalmente está originado por bacterias anaeróbicas; mientras que si el fluido presenta un olor a derivados de amonio (orina), el paciente probablemente padece de urinotórax (Pérez-Rodríguez y Villena-Garrido, 2003). Pero no solo el olor debe ser una característica a apreciar, sino que la apariencia también debe ser considerada a la hora de establecer un diagnóstico rápido. Si un fluido pleural presenta una apariencia ensangrentada, se debe realizar un hematocrito del fluido para saber si es mucho mayor de lo esperado en un fluido normal. Si se diese esta situación, el paciente presentaría un hemotórax. Aunque, en ocasiones, la presencia de sangre en el líquido pleural también es indicativo de estos tres diagnósticos: malignidad, embolia pulmonar o trauma (PérezRodríguez y Villena-Garrido, 2003). En el caso de que el fluido pleural aparezca turbio o lechoso, se debe examinar el sobrenadante que se obtiene tras la centrifugación. Si el fluido pleural esta turbio antes de centrifugar, pero una vez centrifugado aparece claro, entonces la turbidez es debida a las células o 71 Introducción detritus presentes en este fluido. Pero si la turbidez persiste a pesar de haber centrifugado, entonces se debe a un elevado contenido lipídico en el líquido pleural. Ante esta situación, los pacientes presentarán un quilotórax o pseudoquilotorax. 1.3.4.2. Contaje diferencial de células del fluido pleural El contaje diferencial de células es útil para la determinación de la etiología del fluido pleural. Cuando existe predominancia de células polimorfonucleares, los pacientes son diagnosticados como derrames paraneumónicos, embolia pulmonar o carcinoma broncogénico (Porcel, 2011). Sin embargo, cuando las células mononucleares predominan en este fluido, estos pacientes presentan un proceso crónico en el que la pleura está implicada, como ocurre con la enfermedad maligna, la tuberculosis, la embolia pulmonar, y la pleuritis viral. Además, la localización de pequeñas cantidades de células mesoteliales en el fluido pleural será indicativo de DP de tipo tuberculoso (Hurwitz et al., 1980). Otra de las características de la diferenciación celular puede ser la aparición, de modo predominante, de pequeñas cantidades de linfocitos en el fluido pleural, característica común de los derrames de tipo tuberculoso o de DPM (Light et al., 1973). Finalmente, la existencia de más de un 10 % de eosinófilos en el fluido pleural será indicativo de la presencia de aire o sangre en el espacio pleural (Porcel, 2011) y, por consiguiente, del diagnóstico posible de neumo- o hemotórax. 1.3.4.3. Citología del fluido pleural Ante la presencia de malignidad de los pacientes, la posibilidad de realizar una citología del fluido nos permitirá obtener un diagnóstico 72 Introducción rápido, eficiente y no invasivo. Sin embargo el porcentaje de DPM diagnosticado mediante citología se sitúa entre un 40 - 87 % (Maskell y Butland, 2003; Aleman et al., 2007; Heffner, 2008), existiendo algunos factores que pueden influir en el diagnóstico mediante citología. Uno de estos factores es el tipo de tumor que presenta el paciente; puesto que la frecuencia de la citología resulta dependiente del tipo de tumor, el rendimiento de esta metodología es mucho peor cuando se trata del diagnóstico de carcinomas celulares de tipo escamoso, enfermedad de Hodgkin, o sarcomas (Light, 2002). Aunque, obviamente, existirá cierta dependencia del rendimiento del método con la habilidad del citólogo que lo está realizando. A) B) Figura 9. A) Célula mesotelial reactiva en un líquido pleural de un paciente que presentaba neumonía neumocónica. B) Imagen obtenida tras la citología de un paciente que presentaba células malignas (neoplasia de ovario) en un líquido pleural. Obtenido de http://www.anamerino.com/educacional.html Al hablar de diagnóstico de malignidad por citología sabemos que la sensibilidad de este método diagnóstico varia, según diferentes autores, entre un 39 % y un 80 % (Bueno et al., 1990; Nance et al., 1991; Pérez-Rodríguez y Villena-Garrido, 2003). Los falsos positivos son muy escasos, y en la mayoría de las series inexistentes. La citología pleural normalmente presenta una sensibilidad mayor para la afectación neoplásica que la biopsia pleural (Pérez-Rodríguez y Villena-Garrido, 2003), pero mejora cuando se realiza el diagnóstico mediante ambas técnicas (Emad y Rezaian, 1998). 73 Introducción Un 60 % de los casos de derrames carcinomatosos pueden ser diagnosticados de DPM mediante esta técnica pero, en el caso de los mesoteliomas, solo de un 20 a un 30 % de los casos son diagnosticados correctamente (Fouradarakis, 2008). Resultados positivos en la citología estándar nos pueden servir para diferenciar entre adenocarcinomas pleurales y mesoteliomas, o entre mesoteliomas y linfomas (y linfocitosis reactivos) sin necesidad de realizar otros estudios especiales (Heffner, 2008) (figura 9). El rendimiento diagnóstico de esta técnica es dependiente además de factores como la extensión de la patología, o la naturaleza del tumor primario (Antony et al., 2001), como ya hemos comentado anteriormente. Además, es importante destacar que el empleo de marcadores inmunohistoquímicos epiteliales y glandulares puede ayudar a confirmar la malignidad epitelial y a diferenciar mesoteliomas de adenocarcinomas aunque, normalmente, para la obtención de estos resultados se hace necesario el empleo de metodologías más agresivas (Johnston, 1985), como son las biopsias. 1.3.4.4. Cultivo del fluido pleural Las muestras obtenidas de pacientes diagnosticados como DP de tipo exudado y con características de probable DP paraneumónico deben ser teñidas mediante la tinción Gram positiva y cultivadas para el diagnóstico de bacterias (tanto aerobias como anaerobias), micobacterias, y hongos (Porcel, 2011). De manera rutinaria se deben oler para ver si existe presencia de bacterias de tipo anaerobio como ya se ha mencionado en el caso de los empiemas. Entre los microorganismos que pueden infectar al pulmón se incluyen bacterias, gérmenes atípicos, parásitos, hongos y protozoos, que pueden ocasionar DP paraneumónico. De hecho, en el caso de las 74 Introducción neumonías el 40 % de los casos son originadas por patologías bacterianas (Tayle et al., 1978; Reynolds et al., 2010). Los microorganismos más implicados son Mycoplasma pneumoniae y, en el caso de los virus, adenovirus y el virus influenza. Los síntomas clínicos más comunes que ocasionan, y que son indicativos de neumonía atípica, serán episodios de fiebre, dolor de cabeza, dolor de garganta y artromialgias (dolores musculares y de las articulaciones). Se pueden establecer diagnósticos basados en el cultivo de muestras respiratorias o el incremento de la titulación de anticuerpos específicos en dos determinaciones separadas al menos 15 días. Una alta titulación sugeriría un diagnóstico de Mycoplasma sp. Normalmente los pacientes con empiema muestran una sintomatología parecida a los pacientes con DP paraneumónico; sin embargo, en los empiemas se da una acumulación pleural de pus. Este es el motivo por el que suelen realizarse cultivos de bacterias Gram positivas o cultivos del fluido pleural para otros microorganismos que pueden ocasionar también esta patología. Sin embargo, y como ya se ha dicho anteriormente, la causa más frecuente son las bacterias y estudios recientes han descrito que las que con mayor frecuencia ocasionan esta patología son Streptococcus pneumoniae, Staphylococcus aureus y Hemophilus influenzae (Grijalva et al., 2011). 1.3.4.5. Niveles de marcadores bioquímicos en el fluido pleural a) Adenosina desaminasa (ADA) El poder medir los niveles de ADA en el fluido pleural resulta muy útil en el diagnóstico de pacientes con tuberculosis puesto que en estos se da un incremento de la concentración de este marcador, mayor al obtenido en otros exudados pleurales. Sin embargo hay otras dos 75 Introducción enfermedades que presentan elevados niveles de ADA, el empiema y la pleuritis reumatoide, aunque ambas son fáciles de distinguir de la tuberculosis pleural por el cuadro clínico que presentan. b) Glucosa La medida de los niveles de glucosa del fluido pleural resulta útil puesto que niveles bajos de este marcador (< 60 mg/dL) indican la presencia de alguno de estos cuatro desórdenes en el paciente: tuberculosis, patología maligna, patología reumatoide, o derrame paraneumónico complicado (Light, 1997). Además, una medida de la concentración de proteínas, glucosa, y LDH en el fluido pleural puede ser útil en la determinación de la naturaleza de los procesos inflamatorios (Utine et al., 2005). c) Amilasa La medición de los niveles de amilasa en el fluido pleural es indicativo de enfermedad de tipo pancreático, adenocarcinoma metastásico o perforación esofágica. Los niveles de amilasa del fluido pleural se elevan en aproximadamente el 10 % de los pacientes con DP maligno, y cuando el tumor primario no se localiza en el páncreas (HaroEstarriol et al., 2007). Además, puesto que esta enzima presenta diferentes isoformas con diferentes actividades, observar el patrón isoenzimático de la amilasa pleural puede servirnos para diferenciar la patología maligna de la enfermedad pancreática (Branca et al., 2001; Segura, 2004). Entre las diferentes afectaciones pancreáticas tenemos los DP originados por pancreatitis aguda, debidos probablemente a la inflamación originada por esta patología, y los derrames originados por enfermedades pancreáticas crónicas, que se presentan con 76 una Introducción extensión que se forma en el páncreas, pasa por el diafragma (dentro del mediastino) y finalmente termina en el espacio pleural (Villena et al., 2002). d) Lactato deshidrogenasa (LDH) Pese a que los niveles de LDH del fluido pleural se emplean en la caracterización de los dos tipos de derrame (criterios de Light), no resultan de gran utilidad para la separación de diferentes DP de tipo exudado (Vavetsi et al., 2009). Sin embargo, es recomendable la cuantificación de los niveles de esta proteína una vez realizada la toracocentesis, puesto que los niveles de LDH son indicativos del grado de inflamación pleural (Light, 1997). e) Marcadores tumorales de uso establecido en clínica En ocasiones, se utilizan en el diagnóstico clínico marcadores tumorales como el CEA, el antígeno carbohidrato (CA) 15-3, los fragmentos de la citoqueratina 19 (CYFRA 21-1), y el CA-125 medidos mediante electroquimioluminiscencia o enzimo-inmunoensayos. Sin embargo, y como ninguno de estos marcadores tiene suficiente potencia diagnóstica en la práctica clínica diaria, se hace necesaria la combinación de varios marcadores y varias técnicas para certificar el diagnóstico de cada uno de los pacientes (Heffner, 2008). 1.3.4.6. Biopsia pleural mediante aguja o biopsia transparietal Cuando la citología pleural no es capaz de diagnosticar a los pacientes con DPM, la técnica recomendada es la biopsia pleural. Esta suele realizarse tras la aspiración inicial, y se considera la clave del 77 Introducción diagnóstico. En general, la biopsia pleural es un método común de obtención de tejido pleural para su examen histológico y/o microbiológico. Es una técnica sencilla, que no precisa ser realizada en quirófano, se puede hacer de forma ambulatoria y tiene una morbilidad muy baja. Sin embargo debe realizarse por un especialista (PérezRodríguez y Villena-Garrido, 2003; Poe et al., 1994). Las patologías que suelen diagnosticarse con mayor frecuencia mediante biopsia pleural son el carcinoma y la tuberculosis pleural (Llorente-Fernández et al., 1984). La biopsia pleural o transparietal fue descrita en 1955, y desde entonces se han empleado diferentes tipos de agujas para su realización, que fueron modificándose a lo largo del tiempo introduciendo mejoras técnicas como las Vim Silverman (DeFrancis et al., 1955), las Abram (Abrams, 1958), las Cope (Cope, 1958), las Raja (Ogirala et al., 1993), etc. Actualmente, la técnica que se emplea es la biopsia computarizada mediante tomografía guiada, puesto que ha demostrado que presenta una sensibilidad del 87 % cuando la comparamos con la biopsia por aguja de Abram, que presenta una sensibilidad del 47 % (Kolditz et al., 2006). Al hablar de diagnóstico de malignidad por citología sabemos que la sensibilidad de este método diagnóstico varia, según diferentes autores, entre un 39 % y un 80 % (Bueno et al., 1990; Nance et al., 1991; Pérez-Rodríguez y Villena-Garrido, 2003). Los falsos positivos son muy escasos, y en la mayoría de las series inexistentes. Otros factores como el volumen del tejido pleural obtenido (Light, 1997), el número de veces que se realiza la biopsia pleural (Chang et al., 1991) y la obtención o no de técnicas de imagen (Pérez-Rodríguez y Villena-Garrido, 2003), determinarán el éxito en el diagnóstico patológico. De hecho, según diversos autores, el empleo de técnicas de imagen en la biopsia, junto con el análisis citológico, permite aumentar la rentabilidad diagnóstica, situándose el diagnóstico patológico entre un 78 Introducción 86 y un 93 % (Adams y Gleeson, 2001; Adams et al., 2001; PiquerasOlmeda et al., 1999). La obtención de tejido tumoral supone una ventaja respeto a la citología, no solo en la diferenciación entre tejido inflamado y tumoral, sino también a la hora de clasificar las células malignas, lo que será importante para la aplicación de un tratamiento correcto. La diferenciación de los linfomas, las metástasis de cáncer de ovario, y el carcinoma pulmonar de células pequeñas, son algunas de las patologías que se pueden diagnosticar al obtener este tejido tumoral (Screaton y Flower, 2000). Sin embargo, al tratarse de una técnica invasiva puede tener efectos secundarios, de entre los que podríamos destacar la aparición de pneumotórax, que se da en el 8 % de los pacientes a los que se le realiza, en otras ocasiones también se produce pérdida de sangre intrapleural, infección o fístula cutánea, debido a un mal uso de la técnica (Ferrer y Roldán, 2000). En algunos pacientes, la biopsia pleural con aguja solo detecta inflamación no específica o ausencia de patología y por ello, si el DP persiste o empeora, debería considerarse la realización de una toracoscopia. 1.3.4.7. Toracocentesis La toracocentesis es la extracción de líquido pleural con fines diagnósticos o terapéuticos. Es una técnica sencilla, rápida, con alto rendimiento diagnóstico y escasas complicaciones, que pueden evitarse con pre-medicación y un buen uso de las técnicas diagnósticas por parte de los clínicos. 79 Introducción Es la primera exploración que se realiza ante una sospecha clínica de derrame pleural, después de obtener radiografías de tórax en proyección postero-anterior y lateral que nos confirmen la existencia del mismo (Pérez-Rodríguez y Villena-Garrido, 2003). El fluido pleural se analiza normalmente mediante toracocentesis salvo cuando se sospecha de derrame secundario a una enfermedad subyacente (como el fallo cardíaco). La incidencia de enfermedades asociadas a la toracocentesis es baja cuando se realiza por una persona experimentada, aunque para la realización de la técnica es necesario que esta persona se guíe mediante ultrasonidos (Villena-Garrido et al., 2006). Las complicaciones comunes de esta metodología son la reacción vagal (10 - 14 %) y el neumotórax (3 - 8 %). Cuando se sospecha de la existencia de sangre (ej. hemotórax) o pus (ej. empiema) en el espacio pleural, debería realizarse con urgencia esta técnica. (Jones et al., 2003). En el caso de la aparición de células malignas, microorganismos, o cuando los DP trasudativos sean debidos a fallo cardíaco, el análisis del fluido pleural revelará información diagnóstica evaluable y nos servirá para establecer un diagnóstico de la causa del DP (Froudarakis, 2008; Porcel et al., 2004). Pese a que la toracocentesis es la prueba que se suele realizar para obtener un buen diagnóstico, la integración de otras variables clínicas, antecedentes, exploración física, pruebas analíticas básicas y las relacionadas con la sospecha clínica, permitirán elaborar un diagnóstico pre-toracentesis, y así poder solicitar los estudios pertinentes (Villena-Garrido et al., 2006). 1.3.4.8. Broncoscopia La broncoscopia es efectiva para el diagnóstico de pacientes con DP que tienen indicaciones específicas para esta técnica, como la 80 Introducción hemoptisis, atelectasia o lesiones radiológicas pulmonares sospechosas de malignidad (Sulu et al., 2011). En pacientes con derrame idiopático y ningún otro tipo de alteraciones, la broncoscopia ayuda a establecer un diagnóstico correcto (Macori et al., 1998). 1.3.4.9. Toracoscopia La toracoscopia (también denominada pleuroscopia) puede realizarse bajo anestesia general, comúnmente denominada toracoscopia video-asistida, o usando la sedación o anestesia local. La toracoscopia nos permite visualizar la cavidad pleural y no solo abastece de la colección de imágenes de biopsias de la pleura visceral y parietal, sino también del pulmón. El diagnóstico por toracoscopia en los derrames de etiología no conocida es de alrededor del 90 % (Schnyder y Tschopp, 2011). Además, la toracoscopia médica da información sobre el pronóstico de pacientes que presentan adhesiones, frente a aquellos cuyas adhesiones no son bastante visuales, y cuya media de supervivencia es menor (Bielsa et al., 2008) (figura 10). Figura 10. Esquema de toracoscopia (a) e imagen quirúrgica de una toracoscopia (b). Imágenes tomadas de Molina et al., 2003. 81 Introducción En las últimas décadas, con la aparición de la cirugía vídeoasistida por toracoscopia, se ha renovado el interés en el empleo de la toracoscopia para el diagnóstico del DP (Light, 1997). 1.3.4.10. Técnicas radiológicas La formación de imágenes es esencial para confirmar la presencia de DP (Mishra y Davies, 2010). Puesto que los DP pueden ser de distribución libre o loculados, de localización típica o atípica, y de cantidad de fluido pleural variable, será necesario el empleo de diferentes metodologías radiológicas para su clasificación (Villena-Garrido et al., 2006). Una radiografía pectoral era la técnica de imagen inicial que se solía realizar en aquellos pacientes que presentaban síntomas que sugerían DP, aunque en la actualidad la ultrasonografía torácica aumentó su importancia en la investigación y en el manejo del DP. Esta metodología no sólo es más sensible para la detección del DP que la radiografía pectoral, sino que permite distinguir entre la cantidad de fluido y el espesamiento del mismo, y sirve de guía para el drenaje durante la biopsia pleural, particularmente si el derrame es pequeño o loculado (Maskell y Butland, 2003). Dentro de las técnicas radiológicas más comunes tenemos la ecografía torácica, la tomografía axial computarizada o la resonancia magnética nuclear. La primera de ellas, o ecografía torácica, es un procedimiento no invasivo y de fácil realización, siendo de gran utilidad no sólo en la determinación del derrame, sino también en su utilización como guía para la realización de una toracocentesis diagnóstica o terapéutica. De entre las desventajas que presenta esta técnica, la más destacada es la incapacidad para la identificación de la patología que presenta el paciente, y la variabilidad en su resultado en función del 82 Introducción personal cualificado que la realice (Pérez-Rodríguez y Villena-Garrido, 2003). Mediante el empleo de la segunda de las técnicas, la tomografía axial computarizada, somos capaces de detectar pequeñas cantidades de líquido y podemos caracterizar la localización y disposición del derrame. De entre las características generales que presenta esta técnica las principales son el poder diferenciar la patología pleural de la pulmonar, poder determinar las características de la patología subyacente, definir el derrame como libre o loculado, servir como guía terapéutica, identificar la colocación de tubos de drenaje, y detectar las complicaciones de los derrames (Pugatch et al., 1978). La última de ellas, resonancia magnética nuclear, presenta un limitado papel en el diagnóstico del DP, aun teniendo una resolución ligeramente superior a la de la tomografía axial computarizada en la caracterización del líquido (figura 11). Una característica importante es que las patologías con presencia de acumulo de líquido, y los exudados complicados, presentan mayor intensidad de señal y son más brillantes que los trasudados (McLoud y Flower, 1991). A) Figura B) 11. RMN. A) Exploración normal del tórax (obtenido de http://www.zambon.es/servicios/atlas/fichas/3106.htm) B) Placas pleurales (PérezRodríguez y Villena-Garrido, 2003). 83 Introducción Una técnica útil para el diagnóstico rápido del DPM son los ultrasonidos. Se ha visto que son capaces de distinguir los DPM de otras causas de DP, con una sensibilidad del 73 % y una especificidad del 100 % (Qureshi et al., 2009). Pero hoy en día, una de las formas más precisas de obtener imágenes de los seres humanos es gracias al empleo de radioisótopos, mediante la tecnología denominada PET (por sus siglas en inglés position emision tomography). Esta técnica permite el estudio de la fisiología y la bioquímica del tejido, los efectos funcionales que las drogas presentan sobre los mismos (farmacodinámica), y la farmacocinética de estos tejidos. Además, este método proporciona herramientas para la medicina experimental puesto que permite investigar la biología de tejidos enfermos y permite obtener resultados de los mecanismos de acción, los efectos y la eficacia de las terapias, traduciendo estos resultados a la práctica clínica (Jones y Price, 2012). 1.3.4.11. Análisis inmunológicos Cuando se sospecha de colagenosis como causa del DP, debería realizarse análisis del complemento en el fluido pleural, o de anticuerpos anti-nucleares y del factor reumatoide. Un fluido pleural con una ratio del factor reumatoide del fluido pleural/suero > 1 puede confirmar el diagnóstico de un derrame de tipo reumatoide en pacientes con síntomas de la enfermedad (Halla et al., 1980). Pacientes con DPB causado por enfermedades sistémicas como el LES normalmente presentan una ratio en anticuerpos anti-nucleares del fluido pleural/suero > 1 (Porcel, 2011). Los niveles del complemento en el fluido pleural son menores en ambos DPB, tanto en el reumatoide como en LES. El 3 % de los pacientes con AR presentan DPB. La mayoría son varones de edad avanzada y con un largo registro de AR sintomática, que 84 Introducción generalmente presentan un derrame mínimo o moderado, y de carácter unilateral (Walker y Wright, 1967). El diagnóstico de estos pacientes se basa en el reconocimiento de la enfermedad reumática y en la exclusión de otras causas. En los pacientes que presentan patologías de tipo reumático debemos tener un mayor cuidado a la hora de manipular la cavidad pleural puesto que tienen un alto riesgo de infección. En la mayoría de los casos el derrame se resuelve de modo espontáneo; sin embargo, puede llegar a desarrollarse fibrosis pleural. 1.3.4.12. Fármacos En algunos casos, los DP secundarios a fármacos están asociados con el metotrexato, el dantroleno, el matisegido y otros fármacos dopaminérgicos, como la amiodarona y la nitrofurantoína entre otros (Morelock y Sahn, 1999). Estos datos no son fiables para el diagnóstico de los pacientes, por lo que deben tenerse en cuenta otras posibles causas para estar seguros de la retirada de la terapia. 1.3.5. Pronóstico En la mejora del pronóstico se evalúa la calidad de vida de los pacientes atendiendo a los síntomas relacionados con el diagnóstico de su derrame. Un primer objetivo es obtener un alivio en la disnea minimizando el malestar. Además se tendría que limitar el tiempo de hospitalización, sobre todo en los pacientes que presentan una supervivencia mínima. El alivio del dolor es otro de los factores a tener en cuenta para mejorar la calidad de vida de los pacientes. Esto es cierto sobre todo en pacientes afectos de mesotelioma, cuya queja principal es normalmente dolor en lugar de disnea. 85 Introducción Y aunque el DP en asociación con cáncer tiene un pobre pronóstico y una supervivencia media menor de un año, si se trata con tiempo los pacientes pueden llegar a mejorar bastante tanto su pronóstico como su supervivencia (Livingston et al., 1982). 1.3.6. Tratamiento Los principales objetivos en el tratamiento de los DPM son el control de los síntomas y la mejora de la calidad de vida de los pacientes. Los pacientes con derrame asintomático no requieren una intervención para comprobar cómo mejoran con el tiempo. Sin embargo, la mayoría de los pacientes bajo observación necesitan la realización de continuas aspiraciones pleurales para calmar la dificultad de la respiración y, en el 70 - 90 % de ellos, cuando ocurre una acumulación de fluido se requiere del empleo de un método de drenaje pleural para la eliminación del mismo (Mishra y Davies, 2010). Las tres estrategias que se suelen emplear para el tratamiento de los DPM recurrentes son la extracción del derrame pleural, la obstrucción del espacio pleural para evitar la reacumulación o la no formación de fluido, y posteriormente la quimioterapia. La quimioterapia sistémica es el tratamiento elegido en el cáncer de pulmón no microcítico (CPNM), donde el DP, con frecuencia, se resuelve sin la necesidad de un tratamiento local (Khaleeq y Musani, 2008). Para prevenir la recurrencia de DP sintomático suele llevarse a cabo la técnica denominada pleurodesis. Esta técnica se realiza inyectando una substancia irritante en el espacio pleural. Con aproximadamente el 75 % de los agentes empleados parece confirmarse que son efectivos al cabo de 30 días de haberse inyectado (Haddad et al., 2004). Es necesario saber que la pleurodesis sólo está indicada cuando 86 Introducción la quimioterapia no se aconseja, o cuando no es efectiva (Bouros et al., 2000). El tratamiento habitual de pacientes con derrame paraneumónico o empiema es a base de antibióticos. Normalmente se trata de antibióticos de amplio espectro, que cubren tanto a microorganismos anaeróbicos como aeróbicos; sin embargo es conveniente ajustar la terapia de acuerdo con los resultados microbiológicos. Si el fluido pleural cumple con los criterios de empiema, antes de comenzar con el tratamiento se debería colocar un tubo de drenaje para la extracción de fluido purulento. La extracción de este fluido por toracocentesis se recomendará solo cuando la cantidad de fluido sea muy pequeña. En el caso de que los principios clínicos sugieran que el derrame paraneumónico es secundario a una infección por Mycoplasma sp. se debería administrar eritromicina (500 mg/6 h) o claritromicina (500 mg/12 h) de forma oral durante 15 días. Pacientes con tuberculosis pleural recibirán el mismo tratamiento que pacientes con tuberculosis pulmonar. Éste consiste en un régimen durante 6 meses de una primera fase con isoniacida (5 - 10 mg/kg, máximo 450 mg), rifampicina (10 mg/kg, máximo 900 mg) y piracinamida (30 - 35 mg/kg, máximo 2.500 mg), administrados de modo oral durante aproximadamente 2 meses; y una segunda fase con las mismas dosis de isoniacida y rifampicina durante los siguientes 4 meses. 1.3.7. Direcciones futuras para la investigación Lo primordial en toda investigación futura, dada la cantidad de resultados que existen a día de hoy realizados por toda la comunidad científica, es la uniformización de los resultados obtenidos en DP por diversos investigadores para así poder enfocar los futuros estudios hacia vías únicas. Además, es necesario una mejoría de la situación que sufren 87 Introducción los pacientes a largo plazo, sobre todo en cuanto a los síntomas asociados con el derrame, como son la presencia de acumulación de fluido pleural, o el sometimiento del paciente a radiografías torácicas hasta el fallecimiento del mismo, situación que se da sobre todo en las patologías malignas. Además se pretende disminuir los problemas que ocasiona la disnea, y que son originados entre otras causas por la acumulación parcial de fluido (menor del 50 % de la evidencia radiográfica inicial). Intentando el diagnóstico sin necesidad del empleo de metodologías invasivas (Antony et al., 2000). 1.4. Marcadores de diagnóstico de derrame pleural Con frecuencia, establecer un diagnóstico del DP es un problema en la práctica clínica, como hemos visto en apartados anteriores, especialmente en términos de diferenciación entre patologías malignas y benignas, debido a las diferentes características existentes en el tratamiento que se debería llevar a cabo, y en el pronóstico que ambas debían presentar (Wagner et al., 2007). La malignidad es una de las causas principales del DP de tipo exudado, y más de un 90 % de los DPM son debidos a enfermedad de tipo metastásico. El carcinoma de cualquier órgano puede metastatizar la pleura, aunque los más frecuentes son el carcinoma pulmonar, el de mama y el linfoma; menos frecuentes son los carcinomas digestivos y de ovario. Es importante saber la etiología que presenta el derrame para poder diferenciar entre DPM y DPB. El diagnóstico citopatológico del fluido pleural es el método diagnóstico más empleado en la identificación del DPM, y presenta una 88 Introducción sensibilidad de aproximadamente el 60 %, que puede aumentar un 30 % con ayuda de la biopsia pleural por aguja (Romero et al., 1996). Debido a la baja sensibilidad del método, los resultados pueden llegar a ser fallidos en cuanto a la identificación de la malignidad, y por ello se hacen necesarios procesos más invasivos como la biopsia (Antony et al., 2000). Uno de los aspectos en los que se centra la investigación sobre el diagnóstico del DP es la búsqueda de nuevos marcadores, y en particular marcadores de DPM, que puedan ser utilizados como método no invasivo para complementar y mejorar la capacidad diagnóstica de las técnicas antes mencionadas (Pérez-Rodríguez y Villena-Garrido, 2003). En el siguiente apartado hablaremos de los distintos marcadores conocidos a día de hoy. Hablaremos en primer lugar de marcadores que se emplean en la práctica clínica diaria, a pesar de que están especializados en el diagnóstico de una tipología específica de cáncer y no del DPM. Posteriormente hablaremos de otros marcadores que están en estudio y que, a pesar de que se ha visto que son relativamente específicos para el DPM, todavía no se emplean en la práctica clínica debido a las controversias que hay entre los resultados clínicos obtenidos por los diferentes investigadores. 1.4.1. Marcadores usados en clínica En el intento de mejorar la identificación de los casos de malignidad, varios estudios han comentado la utilidad de los marcadores tumorales biológicos (Buccheri y Ferrigno, 2001; Miedouge et al., 1999; Sancho, 2000). Los marcadores tumorales son macromoléculas producidas por las células neoplásicas, en las que su producción se ve incrementada o disminuida en presencia de neoplasias (Wagner et al., 2007). Además, estos marcadores pueden ser detectados en varios 89 Introducción especímenes biológicos como la sangre, líquido seroso, y muestras de tejido (Sancho, 2000). Los marcadores presentan diferente sensibilidad y especificidad de acuerdo a los tipos histológicos del tumor primario. El CEA es el marcador más común y por ello ha sido estudiado extensamente. Este marcador además presenta significación diagnóstica en pacientes con patologías malignas (Liang et al., 2008). CEA es una glicoproteína que compone el glucocálix del epitelio endodérmico, y que está presente en altos niveles en una gran variedad de tumores. Fue descrito por Gold y Freedman (Gold y Freedman, 1965) a partir de un homogeneizado de cáncer colorrectal humano, y recibió su nombre debido a que también se aisló de células mucosas del intestino en su estadio fetal. Posteriormente se comprobó que también se localiza en tejidos adultos normales (intestino, pulmón, páncreas, bazo, etc.), así como en numerosas secreciones (salival, gástrica, biliar) y líquidos de lavado colónico y aspirado bronquial. Se consideran niveles anormales de concentración de CEA sérico valores superiores a 5 ng/mL (Bast et al., 2001), aunque en individuos sanos pertenecientes a los grupos de riesgo de alcohólicos y fumadores este valor se incrementa hasta 10 ng/mL. Su baja sensibilidad en el diagnóstico de estadios tempranos, junto con su baja especificidad, hacen que su utilidad se limite principalmente al ámbito del pronóstico (Bast et al., 2001) y de la monitorización. Se ha sugerido que los descensos en el drenaje linfático de la pleura, causados por una obstrucción de los vasos linfáticos debidos a células malignas, y a invasión pleural, pueden incrementar los niveles de CEA en el fluido pleural (Ferrer et al., 1999; Smith et al., 2002). Lee et al. (Lee y Chang, 2005) sugieren que CEA tiene una función en el diagnóstico del DPM, y que su sensibilidad y especificidad es del 68 % y 93 %, respectivamente. Sin embargo esa sensibilidad no concuerda con la encontrada en otros estudios (29 %), en los que no aconsejan el empleo del marcador (Porcel et al., 2004). 90 Introducción Otros marcadores, como por ejemplo el CYFRA 21-1, presentan buena sensibilidad para CPNM, especialmente el subtipo escamoso (Dejsomritrutai et al., 2001), aunque se sabe que esta molécula se expresa en todos los subtipos histológicos del cáncer de pulmón (Lai et al., 1999). Altos niveles de CYFRA 21-1 en el derrame pueden ser debidos a un drenaje linfático del tumor. Puesto que el 50 % de los DPM son derivados del cáncer de pulmón, algunos expertos sugieren que CYFRA 21-1 podría ser un marcador tumoral prometedor en este sentido (Dejsomritrutai et al., 2001; Paganuzzi et al., 2001). Sin embargo, como ocurre con CEA, CYFRA 21-1 parece presentar diferentes funciones según los estudios realizados. Porcel et al. (Porcel et al., 2005) han demostrado, en su estudio con 416 pacientes, una sensibilidad de CYFRA 21-1 del 22 % cuando la especificidad es del 100 %, por lo que el marcador no se considera demasiado bueno en el establecimiento del diagnostico de malignidad en los pacientes. CA 15-3 es un marcador que aparentemente presenta elevada especificidad para el cáncer de mama, pero no es evaluado de modo extenso en el diagnóstico diferencial del DPM como ocurre con el CEA. Algunos estudios han demostrado incrementos de los niveles de CA 15-3 en DPM, con una sensibilidad del 38 al 55 % y una especificidad del 97 al 100 % (Romero et al., 1996; Shimokata et al., 1988; Villena et al., 1996). La sensibilidad del CA 19-9 medido en el fluido es baja (24 %) pese a que presenta una alta especificidad (100 %) a la hora de distinguir DPM de DPB (Mezger et al., 1988). Shimokata et al. (Shimokata et al., 1988) compararon los niveles de CA 19-9 entre pacientes con DPM y pacientes con derrame tuberculoso, encontrando sensibilidades y especificidades del orden de 65 y 95 %, respectivamente. Alatas et al. (Alatas et al., 2001) detectaron que la sensibilidad y especificidad del CA 91 Introducción 19-9 en el diagnóstico diferencial de los DPM y DPB era más baja que la obtenida en el estudio hecho por Shimokata et al. (del 36 y 83 % respectivamente) (Shimokata et al., 1988). Se sabe, gracias a los estudios inmunoquímicos, que el CA-125 se relaciona con la pleura y el peritoneo (Kuralay et al., 2000). Lindgren et al. (Lindgren et al., 1988) observaron que los niveles de CA-125 fueron significativamente mayores en DPM secundario a adenocarcinoma pulmonar y mesoteliomas que los vistos en derrames benignos. Además, se ha observado también que concentraciones de CA-125 se ven incrementadas en el 70 % de los adenocarcinomas de pulmón, y en solo el 6 % de las mujeres con patología benigna (Canney et al., 1984). En lo referente a los niveles de la NSE (enolasa neuroespecífica), especialmente en tumores neuroendocrinos y en cáncer de pulmón microcítico, se ha visto que hay un incremento de la enolasa cuando se compara con pacientes benignos (Järvisalo et al., 1993; Lombardi et al., 1990). Los niveles en el fluido pleural de la NSE se incrementan en DPM, especialmente en el derivado del cáncer de pulmón microcítico. Sin embargo, hay estudios en los que se observan diferencias no significativas entre la citología negativa a cáncer de pulmón microcítico del derrame pleural y el DP tuberculoso (Shimokata et al., 1989). Otro de los inconvenientes en el análisis de esta proteína es el hecho de que la destrucción de células sanguíneas, como eritrocitos, plaquetas y linfocitos, que contienen NSE en su citoplasma, incrementan considerablemente los niveles de esta proteína en pacientes con DPB (Alatas et al., 2001). En contraste con otros marcadores tumorales, los niveles séricos de esta enolasa son mayores que los niveles en fluido pleural. Por lo tanto, se debería evaluar si los niveles de la NSE en muestras de suero son mejores que los encontrados en el líquido pleural (Alatas et al., 2001). 92 Introducción Sin embargo, a día de hoy no se ha encontrado un marcador tumoral con suficiente sensibilidad por lo que, como Ferrer et al. (Ferrer et al., 1999) comentan, se hace necesaria la combinación de marcadores para el establecimiento de un diagnóstico acertado. La combinación de marcadores tumorales normalmente se realiza para ver si en conjunto producen un incremento de la sensibilidad diagnóstica. Estudios recientes han demostrado que la combinación de los marcadores tumorales CEA y CYFRA 21-1 mejora la sensibilidad del diagnóstico del DPM. Sin embargo, la baja sensibilidad que estos marcadores presentan no es suficiente para poder diferenciar a los DPM de los DPB (Liang et al., 2008). En el diagnóstico diferencial de los DPM y DPB se ha visto que la mayor sensibilidad, especificidad y eficiencia se obtenían con la combinación de CA 15-3 y CYFRA 21-1, tanto en suero como en fluido pleural (Alatas et al., 2001). Y una combinación de CEA, CA 15-3 y CYFRA 21-1 incrementaba la sensibilidad y especificidad del diagnóstico maligno o benigno (Romero et al., 1996). Hoy en día la combinación es una práctica muy útil para el establecimiento de un posible diagnóstico patológico, y puede ir acompañada de la citometría de flujo (Iqbal et al., 2010). Esta metodología nos permite descubrir el fenotipo de las células del fluido pleural, a la vez que se valoran los marcadores. 1.4.2. Marcadores en estudio para el derrame pleural maligno Como ocurre con muchas otras moléculas, el ácido siálico presenta diferentes valores en función del científico que lo analice (Alatas et al., 2001; Imecik y Ozer, 1992; Kakari et al., 1991; Patel et al., 1989; Toumbis et al., 1992). En muestras de suero normales el 90 % del ácido siálico está unido a α- y β-globulinas; por esta razón, los niveles séricos 93 Introducción de ácido siálico pueden incrementarse debido a una elevación de los niveles de globulina sérica. Esta situación puede explicar la elevación de los niveles en pacientes con patología benigna (Carter y Martin, 1962). Los autores que comentan que los niveles de ácido siálico total en el fluido pleural se incrementan en patologías malignas (Alatas et al., 2001; Imecik y Ozer, 1992) puede que tengan también razón, puesto que los pacientes aquejados de patologías malignas presentan secreciones de ácido siálico originado por las células malignas implantadas en la pleura, y secreciones originadas por difusión desde el plasma al espacio pleural, mediante los capilares pleurales. Esta situación de controversia en los resultados científicos se dará en varias situaciones a la hora de analizar la bibliografía de un posible candidato a marcador. Otro marcador del DPM en estudio es la ferritina. Esta proteína pertenece a la familia de las proteínas isoméricas que presentan una función importante en el almacenamiento de iones, metabolismo y detoxificación (Williams et al., 1990). Los niveles de ferritina en suero y DP pueden ser útiles en la evaluación clínica y en el mantenimiento de algunas patologías malignas. El empleo de la ferritina en el líquido pleural evita las influencias del almacenamiento de iones en el cuerpo y la proliferación de células tumorales (Volpino et al., 1984). Kuralay et al. (Kuralay et al., 2000) han encontrado niveles de ferritina elevados en el 47,6 % de los DP malignos, y solo en el 4,7 % de los DPB. La proteína C reactiva es una proteína hepática de fase aguda que suele emplearse como marcador biológico de inflamación o daño tisular (Botana-Rial et al., 2011). Se ha encontrado que los niveles de esta proteína en el fluido pleural son mayores en pacientes que presentan DPB paraneumónico que en otro tipo de DP exudativos o trasudativos (Porcel et al., 2009). El receptor soluble de activación expresado en células mieloides pertenece a la superfamilia de las inmunoglobulinas y se encarga de 94 Introducción amplificar la respuesta inflamatoria, aunque se sobrexpresa y activa a neutrófilos y monocitos/macrófagos en respuesta a productos microbianos. También se ha demostrado que esta proteína se desprende de la membrana de los fagocitos activados y puede ser encontrada en forma soluble en los fluidos corporales (Porcel et al., 2009). Porcel et al. (Porcel et al., 2009) demostraron que los niveles de este marcador permitían la diferenciación entre patologías infecciosas y no infecciosas, con una sensibilidad del 73 % y una especificidad del 72 % [AUC (área bajo la curva ROC) 0.86]. La procalcitonina es una hormona de fase aguda que ha sido estudiada debido a su capacidad para diferenciar entre infecciones bacterianas e infecciones que no ocasionan inflamación. Se sabe que elevados niveles de esta proteína nos sirven para discriminar entre diferentes tipos de infecciones respiratorias, e incluso en la evaluación de infecciones severas y de respuesta a tratamientos (Ray y Kindler, 2009). Una concentración sérica de 0.5 ng/mL es indicativa de infección bacteriana para los clínicos (Christ-Crain y Müller, 2007), y esta medida será útil también para el diagnóstico del DP. De hecho, algunos estudios han mostrado que su eficacia como marcador de infección bacteriana no es mejor que la eficacia de la proteína C reactiva (Gaïni y Koldkajær, 2006). Sin embargo, como marcador nos va a permitir evaluar la severidad de la infección (Porcel et al., 2009). La proteína de unión a lipopolisacáridos es una proteína glicosilada de 58 kDa que se produce fundamentalmente en hepatocitos; además ha sido descrita como un marcador de diagnóstico de la infección bacteriana (Gaïni y Koldkjær, 2006). Pese a que no ha sido evaluada previamente, Porcel et al. (Porcel et al., 2009) observaron que niveles en el fluido < 7 µg/mL de esta proteína reducían la probabilidad de que la etiología del derrame fuese infecciosa (Likehood Ratio negativo 50.22), lo que podía tener implicaciones a la hora de diferenciar entre derrames malignos y benignos. Sin embargo, cuando esta proteína 95 Introducción presentaba niveles de > 17 µg/mL, los resultados se parecían más a los obtenidos en otros test ya usados a día de hoy por los clínicos, como son el análisis de la glucosa o el del pH (Porcel et al., 2009). La mesotelina es un antígeno de diferenciación de las células mesoteliales que está altamente expresado en mesoteliomas (Scherpereel y Lee, 2007). Además, la medida del péptido soluble relacionado con la mesotelina, una variante del splice de la mesotelina, puede predecir el desarrollo de mesoteliomas en individuos expuestos a asbestos (Ray y Kindler, 2009). En un estudio en el que se medían los niveles de mesotelina en suero y en derrame se ha demostrado una sensibilidad del 48 - 84 %, y una especificidad del 70 - 100 %, en el diagnóstico de mesoteliomas (Hooper et al., 2010). El factor de potenciación del megacariocito, una proteína soluble producida por una unión proteolítica de la mesotelina con la proteína precursora, es secretada por la línea celular mesotelioma (Onda et al., 2006). Ray y Kindler (Ray y Kindler, 2009) estudiaron los niveles en suero de esta proteína y observaron que en 51 de 56 pacientes con mesotelioma esta molécula estaba elevada, y no aparecía elevada en 70 de los sujetos control sanos estudiados, por lo que esta proteína podría ser útil para el diagnóstico de los DPM de tipo mesoteliomas. La glicoproteína osteopontina controla la adhesión celular. Los niveles de osteopontina en suero son mayores en pacientes con mesotelioma que en pacientes que presentan patologías relacionadas con asbestos, o patologías no malignas (Pass et al., 2005). Los niveles de la proteína osteopontina están elevados en pacientes con tipología epitelial o sarcomatosa, así como en otro tipo de patologías malignas y no malignas, y nos pueden servir para reflejar la duración de la exposición a asbestos (Price y Ware, 2004). Algunos marcadores han mostrado un incremento de su expresión en DPM al compararlos con lo que ocurre en los casos benignos, como 96 Introducción ocurre con la metaloproteinasa de la matriz (MMP) (Gaspar et al., 2008; Sack et al., 2005; Sumi et al., 2003; Vatansever et al., 2009). Entre estos marcadores, la mesotelina del derrame pleural parece que se muestra entre las proteínas más prometedoras, con una sensibilidad del 71 %, mayor que la citología, y una especificidad del 89 %, para el diagnóstico del mesotelioma maligno. Sin embargo la mesotelina es incapaz de diferenciar entre mesoteliomas de tipo epitelial, sarcomatosos y adenocarcinomas, pudiendo ocasionar falsos positivos (pacientes sin enfermedad que serían catalogados como positivos). En resumen, se podría decir que la medición de las proteínas propuestas podría ser útil como herramienta adicional en la evaluación de los DP y en el diagnóstico entre las diferentes patologías, de etiologías infecciosas o no infecciosas. Sin embargo, en muchas ocasiones el empleo de estos marcadores no aporta mayor información que el uso de otras metodologías diagnósticas del fluido pleural clásicas, como la medición del pH, glucosa, ADA o LDH. Por ello, se hace necesaria la búsqueda de nuevas moléculas que permitan obtener mayor información diagnóstica. 1.5. Proteómica Actualmente la proteómica, y concretamente las tecnologías de electroforesis y cromatografía bidimensionales (2D), y la MS, posibilitan el reconocimiento de numerosas moléculas (proteínas y derivados) específicas de una enfermedad, que podrían llegar a utilizarse como marcadores. Por este motivo haremos un breve repaso a la historia y desarrollo de la proteómica y, en particular, describiremos las metodologías que se emplean a día de hoy para la búsqueda de nuevos marcadores moleculares. 97 Introducción 1.5.1. El concepto de “proteoma” Tras la publicación del genoma humano se han realizado numerosos esfuerzos para poder asociar los datos obtenidos en los diferentes experimentos con las funciones de los seres vivos. La siguiente etapa de la investigación que se está llevando a cabo hoy en día consiste en el estudio de los RNA (ácido ribonucleico) mensajeros (RNAm) y de las proteínas. Se sabe que los genes pueden leerse por partes para generar diversos RNAm, y que las proteínas recién formadas sufren diferentes modificaciones postraduccionales (fosforilación, glicosilación, acetilación, ubiquitinación, etc.) que pueden alterar su función y sus características. Todo esto hace que adquiera gran importancia el estudio del transcriptoma (conjunto de RNAm que una célula produce en un momento dado) y del proteoma. Wilkins et al., en 1996 (Wilkins, 1996), fueron los encargados de proponer el término proteoma como un equivalente del concepto “genoma”, pero empleado para la descripción del conjunto de proteínas expresadas por el genoma completo de una célula a lo largo de toda su vida, o en un momento determinado. Actualmente se considera proteómica al estudio de la abundancia, interacciones, actividades o estructuras de las proteínas presentes en una muestra, y engloba al conjunto de isoformas, modificaciones y alteraciones que estas proteínas presentan (Tyers y Mann, 2003). Comparado con el genoma, el proteoma proporciona una visión más realista de una situación biológica y, por lo tanto, se espera que tenga mayor utilidad en el análisis genético para valorar, por ejemplo, la presencia de una enfermedad, su progresión y su respuesta al tratamiento (González-Buitrago et al., 2008). Inicialmente la técnica de preferencia era la electroforesis bidimensional (2-DE), pero en la actualidad se incluye cualquier procedimiento que sea capaz de caracterizar grandes conjuntos de proteínas (Timms y Cramer, 2008). 98 Introducción 1.5.2. Proteómica en la búsqueda de marcadores moleculares El poder analizar los mecanismos moleculares implicados en la carcinogénesis mediante la identificación y el estudio de la expresión global de las proteínas presentes en un tumor, en las células tumorales, o bien en los fluidos extracelulares de pacientes con cáncer, se conoce como “proteómica del cáncer” (Alaiya et al., 1999). Este tipo de proteómica, además de caracterizar las bases del proceso canceroso que las origina, presenta una importante aplicación en el ámbito clínico, puesto que el objetivo de la misma es la identificación y caracterización de las proteínas que aparecen expresadas diferencialmente, o que presenten una modificación química o estructural. Estas proteínas que aparecen de manera “diferencial” podrían constituir un patrón proteico de expresión diferencial y/o ser, de forma individual, nuevos marcadores con los que desarrollar métodos de predicción, diagnóstico, pronóstico o respuesta a fármacos de la enfermedad en estudio. Además, podrán considerarse candidatas a dianas terapéuticas contra las cuales poder desarrollar nuevas generaciones de fármacos, para tratar la enfermedad de una manera más eficaz y menos tóxica para el individuo (Desiderio y Nibbering, 2007). Desde su inicio, la proteómica se ha aplicado de forma muy intensa al estudio de diferentes patologías, tanto para la caracterización de las bases del proceso como para identificar nuevos marcadores. La proteómica está basada en el empleo de metodologías diversas como la 2-DE, la cromatografía multidimensional, la MS, los microarrays de proteínas, de anticuerpos o de tejido, el MudPIT (Multidimensional Protein Identification Technology), el ICAT (Isotope-Coded Affinity Tags), el SELDI (Surface-Enhanced Laser Desorption/Ionization), etc. 99 Introducción En la actualidad se utilizan también tecnologías que presentan una mayor sensibilidad y que no se basan en la separación previa de las proteínas mediante electroforesis en gel. Este es el caso de la tecnología SELDI, metodología en la que se emplean microarrays de diferentes tipos (intercambio iónico, afinidad, etc.) para llevar a cabo la separación selectiva de proteínas y su posterior análisis directo mediante MS (Espejel y Roa, 2008; Spisak et al., 2007). Otro nuevo avance tecnológico ha sido la cromatografía líquida multidimensional, a la que le sigue un análisis de péptidos mediante MS, técnica conocida como MudPIT (Delahunty y Yates, 2007), o el empleo de chips en donde se realizarán los inmunoensayos de tipo sandwich sin necesidad de realizar ningún tipo de mezcla a priori (en el mismo chip, con varias matrices de 10 diferentes anticuerpos de unión, se incuba una muestra, a continuación todos los anticuerpos son transferidos al mismo tiempo en función del ajuste, cada uno a su lugar de afinidad) (Li et al., 2012). Otro de los avances es el iTRAQ (de sus siglas en inglés Isobaric tag for relative and absolute quantitation), que permite el análisis cuantitativo de 4 muestras de modo simultáneo con una alta sensibilidad y reproducibilidad (Pottiez et al., 2012; Wu et al., 2006). Todas estas metodologías están dirigidas a la identificación y al análisis cuantitativo de las proteínas que son expresadas de modo diferencial en individuos sanos y enfermos. Además, la proteómica es una herramienta poderosa con la que se puede llegar a obtener un mayor conocimiento de la biología de los procesos patológicos, pudiéndose llegar a identificar desde proteínas cuya alteración implique la modificación de las rutas metabólicas clásicas (Bi et al., 2006), hasta proteínas implicadas en las vías de señalización celular (Madoz-Gúrpide et al., 2007). 100 Introducción 1.6. Marcadores propuestos en este estudio 1.6.1. PEDF El factor derivado del epitelio pigmentado (PEDF - por su nombre en inglés Pigment epithelium-derived factor) es una glicoproteína miembro de la familia de las serpinas, con un peso molecular de 50 kDa, que fue identificada y aislada a principios de la década de 1980 como un factor neurotrófico purificado de cultivos de células fetales humanas del epitelio pigmentario retiniano (Kostakis et al., 2010). Diez años más tarde, el PEDF surgió como uno de los inhibidores naturales más potentes de la vascularización ocular fisiológica y patológica (Tombran-Tink y Johnson, 1989). Inicialmente, se pensaba que el PEDF era un factor neurotrófico que podía diferenciar células Y79, pertenecientes al retinoblastoma y que no estaban proliferando en las neuronas (Dawson et al., 1999; Jin et al., 2002). Sin embargo, más tarde se descubrió que esta proteína presentaba una potente actividad anti-angiogénica, mucho mayor que cualquier otro factor conocido de producción endógena (Tombran-Tink y Johnson, 1989). De hecho, se ha demostrado que el PEDF es el inhibidor endógeno más potente de la angiogénesis, siendo más del doble de potente que la angiostatina, y siete veces más potente que la endostatina (Dawson et al., 1999). En la figura 12 se muestra la localización de los dominios funcionales de la proteína. 101 Introducción Figura 12. Diagrama esquemático que muestra el dominio funcional del PEDF Algunos estudios han demostrado que una disminución de los niveles de PEDF en el ojo se asocian con una serie de enfermedades neurovasculares oculares y neurodegenerativas (Jin et al., 2002). Además, la baja expresión de PEDF se ha correlacionado con un aumento de la incidencia de metástasis y con un peor pronóstico en el cáncer de próstata (Ek et al., 2006), el cáncer de páncreas (Halin et al., 2004), neuroblastomas (Uehara et al., 2004), y gliomas (Crawford et al., 2001). Por lo tanto, se puede proponer al PEDF, en la progresión del cáncer, como un factor antiangiogénico y/o como un supresor tumoral directo. Las implicaciones que esta molécula presenta han sido poco a poco descubiertas, y varios grupos han estado investigando el papel del PEDF en diversas condiciones patológicas como la enfermedad inflamatoria crónica (Guan et al., 2003), la aterosclerosis (Zhang et al., 2006), las complicaciones diabéticas (Yamagishi et al., 2005) y el cáncer (Funatsu et al., 2006). El gran atractivo que presenta esta molécula puede ser debido también al potencial terapéutico que demuestra tener su actividad: en las células madre neurales de mantenimiento (Filleur et al., 2005; Hase et al., 2005), en anti-inflamación en la patología retinopatía diabética (Ramírez-Castillejo et al., 2006), como un factor de supervivencia contra 102 Introducción el estrés oxidativo (Zhang et al., 2006), como inductor de la migración de células inmunitarias (Tsao et al., 2006), etc. Se han identificado dos péptidos funcionales en el PEDF, un péptido de 44 aminoácidos (localizado en las posiciones 78-121 de los 418 aminoácidos totales del PEDF humano) y otro péptido de 43 aminoácidos. La capacidad de la proteína para bloquear la pérdida vascular es producida por el péptido de 43 aminoácidos que interactúa con un receptor de 80 kDa, PEDF-RN, que ha sido identificado en células Y-79 (Takanohashi et al., 2005) del cerebelo, en las neuronas motoras (Alberdi et al., 1999), y en la retina neural. El péptido de 44 aminoácidos, a través de un receptor distinto identificado en las células endoteliales, induce la apoptosis, el bloqueo de la migración de células endoteliales, y la angiogénesis en la córnea (Bilak et al., 2002) (figura 13). Figura 13. Vista estéreo del diagrama de la forma nativa de la proteína glicosilada en la orientación de la serpina típica. Las cadenas-β están en cian y las hélices-α en magenta, las espirales y los giros están en color oro, y el residuo de hidratos de carbono se presenta como bolas y palos. El centro reactivo de la proteína se etiqueta como RCL, y la N-acetilglucosamina se etiqueta como NAG. Obtenida de Simovic, 2001. 1.6.2. Calprotectina La calprotectina es una proteína de unión al calcio y al zinc que pertenece a la familia de las calgranulinas/S100 (Yui et al., 2003), y que 103 Introducción presenta un papel importante en la modulación de la inmunidad innata (Chiavaccini et al., 2011). En cuanto a su estructura, la calprotectina tiene un peso molecular de 24 kDa, sus genes están localizados en el cromosoma 1q21 humano, y se presenta como un heterodímero compuesto por dos cadenas que unen calcio (con dos sitios de unión en cada cadena): la cadena pesada (de 14 kDa, denominada MRP14/S100A9/L1H (L1 cadena pesada ) / p14) y la cadena ligera (8 kDa, MRP8/S100A8/L1L (L1 cadena ligera) / p8/CP-10), que no están unidas covalentemente (Yui et al., 2003) (figura 14). Además, la calprotectina puede encontrarse como un complejo formado por hetero- u homo-dímeros (de modo mono-, di-, tri- o tetramérico) con cada cadena por separado (Terasaki et al., 2007; Stríz y Trebichavský, 2004). Figura 14. (a) Primer plano del motivo zinc His-3-Asp de la calprotectina. (b) Superposición de la S100A8 (verde) y S100A9 (rosa) del heterodímero. (c) Superposición de S100A8 (azul) y S100A9 (rojo) de las estructuras cristalinas de los dos dímeros correspondientes. Hay tres residuos de la S100A8 que contribuyen a la estabilización estructural del C-terminal de la hélice y que no tienen una contrapartida homóloga en S100A9. Obtenido de Korndörfer et al., 2007. La calprotectina también se clasifica como una proteína que ocasiona daños asociados al patrón molecular de la molécula, un término que describe cómo las moléculas liberadas de las células huésped que están dañadas son capaces de inducir una señalización inflamatoria (Chiavaccini et al., 2011). La proteína calprotectina se 104 Introducción encuentra principalmente en los neutrófilos (representando un 5 % del contenido proteico total y un 30 - 60 % del contenido proteico del citosol), y en menor medida en monocitos y macrófagos, principalmente en la membrana (alrededor del 1 % de toda la proteína citosólica de los monocitos) (Rodrigo, 2007; Stroncek et al., 2005). Además, la proteína es producida por las células de la médula ósea, el epitelio escamoso (queratinizante y no queratinizante), la mucosa de las células epiteliales, las células endoteliales, los túbulos del riñón, las células de la microglía, etc. (Rodrigo, 2007; Yui et al., 2003). Puesto que los principales productores de calprotectina son los neutrófilos, se sabe también que la concentración de calprotectina aumenta en el líquido extracelular de estas células bajo diversas condiciones inflamatorias, lo que sugiere que esta proteína tiene funciones importantes que influyen en los procesos inflamatorios. De hecho hay evidencias de que la calprotectina presenta actividad antimicrobiana (Stríz y Trebichavský, 2004), y además tiene actividad reguladora mediada por las células que participan en reacciones inflamatorias o inmunológicas (Cross et al., 2005; Petersson et al., 2007). Se sabe también que sus niveles plasmáticos aumentan en enfermedades infecciosas e inflamatorias (Viemann et al., 2007). La calprotectina no solo tiene propiedades antimicrobianas, sino que también presenta propiedades citostáticas (Arai et al., 2008), antiproliferativas (Stroncek et al., 2005), inductoras de la apoptosis (Stroncek et al., 2005; Tibble y Bjarnason, 2001), quimiotácticas (Stroncek et al., 2005; Viemann et al., 2007; Yui et al., 2003), y participa en las interacciones de los leucocitos con el endotelio (Ahma et al., 2003; Passey et al., 1999). La calprotectina también es capaz de inhibir el crecimiento de muchas células tumorales con amplia especificidad. De hecho, Chiavaccini, Viemann y sus respectivos colaboradores (Chiavaccini et al., 105 Introducción 2011; Viemann et al., 2007) comprobaron cómo se inhibía la actividad de los siguientes tipos celulares: MM46 carcinoma de mama en ratón, MH134 hepatoma de ratón, EL-4 timoma de ratón, L-929 fibrosarcoma de ratón, B16 melanoma de ratón, Ros17/2.8 osteosarcoma de rata, MCF-7 adenocarcinoma de mama humano, y MOLT-4 células de leucemia humana. Pese a que la calprotectina se asocia con muchos trastornos, los más frecuentes son los relacionados con las especialidades de obstetricia y ginecología (como el cáncer de mama, cáncer de ovario, cáncer de endometrio, cáncer de cuello uterino, la fisiología del cuello uterino y la vagina, el ciclo menstrual, el embarazo, etc.) (Nacken et al., 2003), o los relacionados con las especialidades digestiva y urinaria. 106 1.7. Objetivos Objetivos Objetivos La aparición de un derrame pleural de origen maligno es siempre la expresión de una enfermedad avanzada, y el augurio de un mal pronóstico. De ahí que el retraso en el diagnóstico suponga un importante perjuicio para estos pacientes, puesto que normalmente su esperanza de vida es muy baja. Hoy en día, la forma más rápida y eficaz de establecer un diagnóstico de malignidad del derrame consiste en el examen citológico del líquido pleural. Sin embargo, este método presenta una baja sensibilidad por lo que muchos pacientes deben someterse a otras pruebas invasivas para completar el diagnóstico. La Tesis Doctoral que se presenta se refiere a la búsqueda y validación de marcadores útiles para el diagnóstico del derrame pleural maligno que permitan distinguir, de modo no invasivo, a aquellos pacientes con derrame de origen oncológico de aquellos que sufren derrame pleural cuyo origen no es maligno. Por ello, los objetivos planteados para la realización de esta Tesis fueron los siguientes: Detectar e identificar proteínas cuya expresión se encuentre alterada en fluido pleural de pacientes con cáncer de pulmón no microcítico, en relación al fluido pleural de pacientes con enfermedad benigna del pulmón. Seleccionar y caracterizar, mediante criterios bioquímicos, posibles proteínas candidatas a marcadores de diagnóstico del derrame pleural maligno. Validar la utilidad clínica de los marcadores candidatos determinando sus parámetros diagnósticos. 109 2. Materiales y métodos Materiales y Métodos Materiales y Métodos 2.1. Muestras biológicas 2.1.1. Obtención de las muestras La muestra biológica escogida para realizar el presente estudio ha sido el fluido constituidos por pleural. Se pacientes estudiaron con DPB dos que grupos poblacionales, presentaban patologías diagnósticas diversas y pacientes con DPM derivado de neoplasias. A través de los Servicios de Neumología del Complejo Hospitalario Universitario de Vigo (CHUVI), y del Hospital Policlínico de Vigo, se obtuvieron muestras de fluido pleural de 89 pacientes diagnosticados de DPB y 67 con DPM, que presentaban edades comprendidas entre 20 y 96 años. Una parte del fluido pleural extraído fue analizado por el centro donador para poder establecer el diagnóstico. Para garantizar el anonimato de los donantes, cada una de las muestras suministradas se definió mediante un código y los parámetros género y edad del individuo, siguiendo el protocolo aprobado por el Comité Gallego para la investigación clínica (2007/179), la Ley de protección de datos 15/1999, y el Real Decreto 1720/2007. Cabe destacar que los pacientes a los que se les extrajo el fluido pleural, no tomaban medicación alguna en el momento de la extracción, de tal modo que la muestra obtenida no presentaba ningún tipo de alteración farmacológica. El fluido pleural obtenido se sometió a una centrifugación a 800 g durante 15 min, se congeló a -20 ºC, y se mantuvo a esta temperatura hasta que se efectuaron los análisis correspondientes. 113 Materiales y Métodos 2.1.2. Diagnóstico de los pacientes El diagnóstico de los pacientes estudiados se realizó siguiendo el protocolo establecido por el Servicio de Neumología del CHUVI. Tras la realización de la anamnesis (entrevista clínica al paciente) y de una exploración física completa según la sospecha diagnóstica, se realizaron una serie de determinaciones analíticas y pruebas de imagen. En ningún caso estos pacientes fueron sometidos a pruebas complementarias que no estuviesen indicadas de no haber sido incluidos en el estudio. Para el análisis del DP se siguieron las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (Villena-Garrido et al., 2006) por lo que en la mayoría de los casos fue necesaria la realización de una toracocentesis (extracción de una cantidad variable de líquido pleural), para poder realizar el análisis bioquímico, citológico y microbiológico del líquido pleural. Cuando el empleo de esta técnica no hizo posible el establecimiento de un diagnóstico, en los pacientes con exudado pleural se tuvo que realizar una segunda toracocentesis y una posterior biopsia pleural (con aguja Abrams). En función de la sospecha diagnóstica se indicó la realización de otros estudios complementarios (broncoscopia, tomografía computarizada del tórax y/o abdomen, etc.) para aquellos pacientes que así lo requiriesen. Además, en los pacientes con DP también se realizó una extracción de suero para determinaciones analíticas generales y específicas (marcadores tumorales, test de autoinmunidad, etc.). Para distinguir entre trasudados y exudados se siguieron los criterios de Light (Light et al., 1972). El fluido pleural se consideró de tipo exudado, cuando el contenido proteico fue superior a 3 g/dL, la relación de proteínas en líquido/suero fue mayor de 0,5 y la relación LDH pleural/sérica mayor de 0,6. 114 Materiales y Métodos Los pacientes con patologías malignas fueron caracterizados a través de secuencias de pruebas diagnósticas entre las cuales se incluyen el análisis citológico, que permite demostrar la presencia de células malignas en el líquido o tejido pleural, y el subsiguiente estudio anatomopatológico. Otras pruebas diagnósticas son la radiografía y la tomografía axial computarizada (TAC) torácicas, así como la broncoscopia y la punción-aspiración de aguja fina (PAAF) en las lesiones inaccesibles a la broncoscopia. Además, se tuvo que demostrar la presencia de células malignas en el líquido o tejido pleural, mediante citología pleural, para la realización del subsiguiente estudio anatomopatológico. El estudio anatomopatológico de los casos de DPM permite la determinación de la naturaleza, la localización, y la extensión del tumor, y su clasificación para poder emitir un juicio sobre el pronóstico del enfermo, determinándose así las opciones terapéuticas adecuadas, para lo que se suelen clasificar los tumores en función de la clasificación TNM. Las siglas TNM hacen referencia a tres aspectos del cáncer: la T indica el tamaño y el lugar de asentamiento del tumor primario, la N se refiere a la afectación de los ganglios linfáticos de acuerdo con su localización, y la M a la presencia o ausencia de metástasis a distancia, es decir, a la afectación de otros órganos. Se sabe que cuando un paciente presenta DPM el estadío que presenta de la clasificación TNM es siempre un T3 muy avanzado, o un T4. En lo referente a las patologías benignas de tipo exudado fueron clasificadas en cinco subgrupos: tuberculosos, paraneumónicos, miscelánea, paramalignos y no neoplásicos de origen desconocido. El diagnóstico del DPB de tipo tuberculoso se basó en la presencia del marcaje positivo o cultivo del bacilo Mycobacterium tuberculosis en el líquido pleural, esputo, o biopsia pleural, o bien en la presencia de 115 Materiales y Métodos granulomas caseosos típicos localizados en la biopsia pleural. Cualquier DPB que esté asociado con neumonía y que presente respuesta a tratamiento de tipo neumónico fue clasificado como DPB paraneumónico. El grupo DPB miscelánea incluye DP que cumplían con los criterios específicos para el diagnóstico del DP que presentasen diversos orígenes no incluidos en los otros subtipos (post-quirúrgicos, quilotórax, secundario a enfermedad vascular de tipo colagenosis, secundaria a toxicidad por fármacos, síndrome de Dressler, pleuritis urémica, posttraumáticos, y síndrome de hiperestimulación ovárica). Los DPB de tipo paramaligno reciben este nombre porque son DP causados por los efectos indirectos de neoplasias en la cavidad pleural, y también por los efectos indirectos del cáncer o de la terapia farmacológica en la cavidad pleural (Heffner, 2008). El DPB no neoplásico de origen desconocido se define con cualquiera de los siguientes criterios: DP que comprende de modo no específico una pleuritis observada mediante toracoscopia, toracotomía, biopsia o autopsia; ausencia de síntomas, o recurrencia del DP tras el seguimiento clínico y radiológico de un año de duración (Villena et al, 2003). Una vez concluido el diagnóstico, los pacientes incluidos en este estudio se clasificaron en los grupos que aparecen en la tabla 3. Todos los datos de la historia clínica, así como los resultados de las pruebas realizadas, fueron registrados en una base de datos, realizándose periódicamente seguimientos clínicos de los pacientes con DPM, y evaluando la respuesta a los tratamientos hasta el fallecimiento del paciente. 116 Materiales y Métodos Tabla 3. Características clínicas de los pacientes incluidos en este estudio. No. de No. de Edad, Años pacientes Hombres/Mujeres Media (Rango) 67 42/25 67 (20-91) 58 32/26 68 (34-91) 42 31/11 68 (37-91) Cáncer de mama 6 0/6 63 (34-75) CPM 3 2/1 75 (66-76) Cáncer de ovario 2 0/2 82 (79-85) Neoplasia de origen tímico 2 0/2 69 (65-73) Cáncer gástrico 2 0/2 73 (60-83) Colangiocarcinoma 1 1/0 61 Mesotelioma 6 5/1 67 (57-87) Linfoma 3 3/0 55 (20-79) 89 61/28 53 (20-96) Tuberculosis 30 20/10 44 (20 -96) Paraneumónico 29 22/7 55 (26 – 89) Miscelánea 12 8/4 57 (24 – 83) Postquirúrgicos 3 2/1 64 (53-74) Quilotórax 2 2/0 62 (54-70) Secundario a 2 2/0 48 (37-59) Secundario a fármacos 1 1/0 24 Síndrome de Dressler 1 1/0 80 Pleuritis urémica 1 0/1 45 Tras traumatismos 1 0/1 83 Síndrome de 1 0/1 34 3 1/2 65 (40 – 81) 15 10/5 62 (37 -85) Origen del DP DPM Neoplasia de origen epitelial CPNM DPB enfermedades colagenosis hiperestimulación ovárica Paramaligno No neoplásico de origen desconocido DP: Derrame pleural; DPM: Derrame pleural maligno; DPB: Derrame pleural benigno; CPNM: Cáncer de pulmón no microcítico; CPM: Cáncer de pulmón microcítico. 117 Materiales y Métodos 2.2. Preparación de las muestras para electroforesis Para la realización de las técnicas proteómicas se hizo necesario un prefraccionamiento previo de las muestras. En primer lugar se enriquecieron en proteínas minoritarias mediante cromatografía de afinidad y, posteriormente, fueron dializadas y liofilizadas. En la tabla 4 se muestran los datos clínicos de los pacientes tanto con patologías malignas como benignas, cuyas muestras sufrieron estos tratamientos previos y que fueron utilizadas en la primera parte del estudio basada en la búsqueda de marcadores mediante técnicas proteómicas. Tabla 4. Características clínicas de los pacientes incluidos en el estudio proteómico Paciente Edad (años) Género Diagnóstico DPM 1 54 Hombre CPNM DPM 2 60 Mujer CPNM DPM 3 60 Mujer CPNM DPM 4 57 Hombre CPNM DPB 1 38 Hombre Tuberculoso DPB 2 25 Mujer Tuberculoso DPB 3 29 Hombre Tuberculoso DPB 4 27 Hombre Tuberculoso DPM: derrame pleural maligno; CPNM: cáncer de pulmón no microcítico; DPB: derrame pleural benigno. 118 Materiales y Métodos 2.2.1. Cromatografía de afinidad a través de una columna de inmunoafinidad múltiple El principio del enriquecimiento mediante cromatografía de afinidad se basa en una separación de mezclas proteicas por su afinidad o capacidad de unión a un determinado ligando. En este caso, las proteínas que se retuvieron en la columna fueron aquellas que se unían de modo específico a un ligando que previamente se había unido de manera covalente a la matriz de la columna (fase estacionaria, también denominada gel o resina “de afinidad”). Después de que las proteínas que no se unen al ligando sean lavadas o eluidas a través de la columna, la proteína o proteínas de interés que han quedado retenidas en la columna se eluyen mediante el empleo de una solución que contiene un ligando libre u otro compuesto que es capaz de romper la interacción entre el ligando y la proteína. En nuestro caso se empleó una columna cromatográfica de afinidad múltiple Hu-6 (Multiple Affinity Removal Spin Cartridges Hu-6, Agilent Technologies) que contiene diferentes ligandos de afinidad unidos a una resina de soporte. Los ligandos son capaces de retener, de manera selectiva, la albúmina, la Ig G, la antitripsina, la Ig A, la transferrina y la haptoglobina, presentes en las muestras de fluidos pleurales. Figura 15. Esquema del método empleado para la separación de las proteínas por cromatografía de inmunoafinidad múltiple. 119 Materiales y Métodos Para la preparación de la muestra se tuvo en cuenta, en cada uno de los pases realizados, que la columna presenta una capacidad de carga de muestra sin diluir de 7 a 10 μL. La muestra se diluyó con una solución tamponadora comercial (Agilent Technologies) hasta un volumen final de 200 μL. Esta dilución se introdujo en la columna y se centrifugó a 100 g durante 90 segundos en una microcentrífuga Microfuge® 18 Centrifuge (Beckman CoulterTM). Es en este paso donde se retuvieron las proteínas abundantes (albúmina, IgG, antitripsina, etc.) siendo el eluido la fracción de interés (fracción eluida). Para una recuperación mayor de la fracción eluida, y teniendo en cuenta el protocolo, se añadieron 400 μL de solución tamponadora a la columna y se centrifugó de nuevo a 100 g durante 150 segundos. Este proceso se realizó dos veces. A continuación, para eluir las proteínas retenidas específicamente por la resina (fracción retenida), se introdujo en la columna la solución tamponadora competidora comercial (Agilent Technologies), a un volumen de 2 mL. Para la recuperación de las condiciones iniciales de la cromatografía, se aplicó un volumen de 4 mL de solución tamponadora inicial a la columna, eliminando así cualquier resto de proteína que pudiera quedar adherida a la matriz. El fluido pleural que se emplea en este método se debe descongelar y filtrar en el momento de su utilización. En cuanto al proceso cromatográfico, este debe ser realizado a temperatura ambiente y los tubos de eluido deben conservarse a +4 ºC desde su recogida hasta el final de la cromatografía. 2.2.2. Diálisis Debido a que concentraciones salinas superiores a 10 mM interfieren con procesos electroforéticos como el isoelectroenfoque (IEF) (Liumbruno, 2008), los eluidos cromatográficos obtenidos mediante la cromatografía de afinidad fueron dializados. Para la realización de esta 120 Materiales y Métodos técnica se emplearon membranas de diálisis con un punto de corte de masa molecular de 12.000-14.000 Da (Medicell International Ltd.) que son apropiadas para la mayoría de las diálisis de proteínas. Las moléculas con un tamaño inferior al punto de corte (sales) son eliminadas, ya que atraviesan la membrana para igualar la presión osmótica a ambos lados, mientras que las moléculas de mayor tamaño (en este caso proteínas) son retenidas en el interior de la misma. Una vez lavada la membrana con agua milli-Q (ultrapura), se depositó el eluido en su interior, y se introdujo en un matraz con 1 L de agua milli-Q. Se dejó dializar, en agitación y con cambios frecuentes del líquido exterior (cada 2-4 horas, durante el día, y cada 8 horas durante la noche), a +4 ºC a lo largo de 24 horas. Una vez finalizada la diálisis, la muestra se extrajo de la membrana, para posteriormente conservarse a -80 ºC, hasta su liofilización. 2.2.3. Liofilización Las muestras recuperadas de la diálisis fueron liofilizadas en un liofilizador Christ Alpha 2-4 (B. Braun Biotech) y conservadas a -80 ºC durante todo el proceso. En el momento de su utilización, las muestras fueron resuspendidas en una solución adecuada para los posteriores procesos analíticos: dodecilsulfato sódico (SDS), para muestras a las que les aplicaríamos electroforesis monodimensional, y Buffer lysis para muestras sometidas a electroforesis bidimensional. Debemos tener en cuenta que debido al elevado contenido en urea del Buffer lysis, una vez descongelada la muestra preparada en este tampón, no se puede volver a congelar. 121 Materiales y Métodos 2.3. Determinación de la concentración de proteínas Para la valoración de la concentración de proteínas se emplearon diferentes métodos, en función de la cantidad de proteína esperada y de su composición, evitándose valoraciones fuera del rango lineal de cada uno de los métodos (rango de cumplimiento de la ley de Lambert-Beer, una relación empírica que relaciona la absorción de luz con las propiedades del material atravesado). En todos los casos, los métodos producen una coloración medible en el rango de luz visible mediante un espectrofotómetro, luz que es proporcional a la cantidad de proteína existente en la muestra valorada. La concentración proteica se ha utilizado para calcular la cantidad de muestra necesaria para cada método analítico y, en el caso concreto de la concentración de muestra, para valorar la pérdida de proteína que había ocurrido tras los métodos de cromatografía de afinidad y de diálisis. 2.3.1. Método de Biuret En las muestras de fluido pleural crudo la concentración de proteínas se determinó mediante el método de Biuret (Gornall, Bardawill & David 1949). Este método está basado en la formación de complejos de color entre los iones de cobre (Cu2+) y los enlaces peptídicos de las proteínas, bajo condiciones alcalinas. Puesto que estos complejos, con coloración violeta, absorben luz a 545 nm y son medibles mediante espectrofotometría. Debido a que la reacción que ocurre es específica para enlaces de tipo amida (enlace entre un ácido y un grupo amino), que se dan en una 122 Materiales y Métodos proporción casi constante en las proteínas (uno por cada 110 unidades de masa), se supone que hay muy poca variación relativa en la respuesta de diferentes proteínas. Por tanto, se considera que es un método de valoración rápido, sencillo y preciso para determinar la concentración de proteínas en una muestra, empleándose para disoluciones en las que está presente una cantidad relativamente alta de proteínas (500 - 5000 µg). El patrón proteico empleado fue una disolución de seroalbúmina bovina a una concentración inicial de 70 mg/mL. 2.3.2. Método de Bradford modificado Una vez realizada la purificación de la muestra se hizo necesaria una segunda cuantificación, puesto que una de las desventajas de las purificaciones de muestras es la pérdida de proteínas que se suele dar en ellas. Debido a que las electroforesis 1D y 2D requieren que las muestras (previamente liofilizadas) estén resuspendidas en una solución tamponadora altamente desnaturalizante, y con una gran concentración de detergentes (urea, tiourea, etc.), se decidió emplear una modificación del método de Bradford (Bradford, 1976), desarrollada por Ramagli y Rodríguez (Ramagli y Rodríguez, 1985). El método de Bradford se basa en la utilización de una disolución de azul brillante de Coomassie G-250, cuya máxima absorbancia es medible a 595 nm cuando se une a la proteína (5 - 50 µg). Puesto que existen interferencias en el método cuando la muestra contiene detergentes en una concentración superior al 0,1 % del volumen total, o cuando están presentes reactivos tamponantes fuertemente alcalinos, es necesario emplear una modificación del método original de Bradford. La modificación del método escogida consistió en una acidificación del medio debida a la adición de 10 μL de HCl 0,1 N en cada tubo de reacción. En este caso el patrón empleado consistió en seroalbúmina bovina a una concentración de 5 mg/mL. 123 Materiales y Métodos 2.4. Electroforesis monodimensional Para la separación de las proteínas del fluido pleural inicial y de las fracciones eluida y retenida de la cromatografía, así como para la realización del paso previo de la transferencia de las proteínas a la membrana, se empleó la electroforesis monodimensional (1-DE). En concreto se utilizó la electroforesis desnaturalizante en geles de poliacrilamida en presencia de SDS o SDS-PAGE, siguiendo el método discontinuo descrito por Laemmli (Laemmli, 1970). 2.4.1. Desnaturalización de la muestra La solución tamponadora de carga de Laemmli, en la cual se prepararon las muestras obtenidas tras la cromatografía descrita en el apartado 2.2.1. del presente capítulo, estaba compuesta por Tris-HCl 50 mM (p/v) pH 6,8; SDS 2 % (p/v); azul de bromofenol 0,1 % (p/v); glicerol 10 % (v/v); y β-mercaptoetanol 5 % (v/v). La proporción de la mezcla varió en función de la concentración del tampón de carga empleado en cada caso, pero siempre se preparó hasta un volumen final de 16 μL, ya que 20 μL suponía la máxima carga del pocillo. Una vez preparadas las muestras con la disolución de carga, se mezclaron por agitación en vortex, se hirvieron durante 5 minutos (paso que favorece la desnaturalización proteica), y finalmente se centrifugaron a 3.220 g durante 30 segundos en una microcentrífuga Microfuge® 18 Centrifuge (Beckman CoulterTM). En cada carril se cargaron entre 2 y 50 μg de proteína total. 124 Materiales y Métodos 2.4.2. Electroforesis desnaturalizante en geles de poliacrilamida (SDS-PAGE) La SDS-PAGE se realizó en geles verticales con un tamaño de 82 mm x 68 mm x 0,75 mm, empleando un equipo Mini-Protean Tetra Cell (Bio-Rad), como el que aparece en la figura 16. Figura 16. Imagen del equipo Mini-Protean Tetra Cell (Bio-Rad) y sus accesorios (derecha). A la derecha de la imagen se muestra la fuente de alimentación empleada (modelo PowerPac 165-5050 de Bio-Rad). Tabla 5. Composición del gel concentrador y de los geles separadores al 8% y 12% de poliacrilamida. Componente Concentrador 4% Separador 8% Separador 12% H2O milli-Q 6,10 mL 4,64 mL 3,35 mL Tris-Cl 2,5 mL (0,5 M pH 6,8) SDS Acrilamida/bis 2,5 mL (1,5 M pH 8,8) 100 µL 1,3 mL 2,67 mL APS 10% 80 µL TEMED 7,5 µL 4 mL SDS: dodecilsulfato sódico; mQ: ultrapura; APS: persulfato amónico; TEMED: N´N´N´N´tetrametiletilendiamina. 125 Materiales y Métodos La matriz de poliacrilamida empleada tenía una relación 30 % T y 2,6 % C (T: poliacrilamida total empleada; C: crosslinker o agente entrecruzador N´N´-bis-metilen-acrilamida). Para la polimerización de los geles fue necesario la adición de agentes aceleradores de la polimerización, que en este caso fueron el persulfato amónico (APS) 10 % (p/v) y N´N´N´N´-tetrametil-etilendiamina (TEMED) 0,05 % (v/v). El gel separador se utilizaría a una concentración del 12 % en poliacrilamida (p/v), en la mayoría de los casos, mientras que para el gel concentrador la concentración usada fue del 4 % (p/v). Los geles se colocaron en la cubeta del equipo donde se realizó la electroforesis, y se le añadió la solución tamponadora de electrodo (solución que consiste en un sistema tampón Tris-glicina a pH 8,3). La corriente constante desarrollada fue de 90 V en el trayecto del gel concentrador y de 150 V en el separador, siendo el límite de intensidad de 1,8 A. La fuente encargada de generar el voltaje fue una fuente de alimentación modelo PowerPac 165-5050 (Bio-Rad) (figura 16). Cuando el frente de proteínas con el azul de bromofenol salió de la matriz del gel, la electroforesis se dio por terminada. En condiciones apropiadas, los polipéptidos reducidos debido a la acción del β-mercaptoetanol se unen al SDS en base a su masa en una relación 1 g polipéptido: 1,4 g SDS. Por lo tanto, migran en el gel como partículas cargadas negativamente que se diferencian en su peso molecular (Mr). La utilización de marcadores adecuados al rango de separación usado nos permitió extrapolar los valores de la Mr de las proteínas resueltas en otros carriles al utilizar el análisis de imagen, de tal manera que pudimos extrapolar los valores correspondientes a las proteínas resueltas en otros carriles del mismo gel, ya que la distancia recorrida por una banda en un gel de composición homogénea tiene una relación lineal con el logaritmo de la masa de esa banda. 126 Materiales y Métodos Se emplearon 2 tipos de marcadores: uno de bajo peso molecular (LMW Marker, Bio-Rad), que contiene proteínas en un rango de 15 a 98 kDa, y otro con proteínas de peso molecular de amplio rango, desde 6 hasta 200 kDa (BMW Marker, Bio-Rad). En muchos de los experimentos en los que se han empleado geles 1D su objetivo final era la realización de la transferencia de proteínas a membranas de fluoruro de polivinilideno (PVDF), y su consiguiente inmunodetección específica de las proteínas de interés. Por ello, en estos geles fue necesario el empleo de marcadores preteñidos de baja masa molecular (Prestained SDS-PAGE Standards-Low o Broad Range, BioRad), visibles durante todo el proceso sin necesidad de la realización de una tinción posterior. El rango de masa molecular relativa de las proteínas de este marcador comprendía de 6 a 200 kDa aproximadamente, dependiendo del lote de producto empleado. 2.5. Electroforesis bidimensional Para realizar la electroforesis bidimensional (2-DE) tanto el fluido pleural como liofilizadas y las fracciones congeladas, cromatográficas fueron obtenidas, resuspendidas en la una vez solución desnaturalizante (de lisis) durante 1 horas, a 30 ºC, y con agitación suave a 35 rpm. Para ello se empleó un baño termostático con agitación Unitronic 320 OR (P. Selecta). La solución desnaturalizante elegida contenía urea 7 M, tiourea 2 M, y 3-[(3-colamidopropil) dimetilamonio]-1propanolsulfonato (CHAPS) 4 % (p/v). Para valorar la concentración de proteínas de las muestras así resuspendidas se utilizó el método de Bradford modificado, detallado en el apartado 2.3.2. de este capítulo. 127 Materiales y Métodos En algunos casos, para establecer el patrón de Mr y punto isoeléctrico (pI) se añadió una mezcla de proteínas conocidas (SDS-PAGE Standards, Bio-Rad), detectables tras la tinción del gel. Los marcadores se aplicaron en un pocillo realizado en un lateral del gel, o por inmersión en la agarosa de sellado de un pequeño fragmento de papel de filtro que contenía de 2,5 a 5 μL de marcador. 2.5.1. Primera dimensión: Enfoque isoeléctrico Para la primera dimensión, o separación de las muestras en función de su pI, se utilizó la técnica de enfoque isoeléctrico o isoelectroenfoque (IEF). Se emplearon tiras ReadyStripTM IPG Strips (BioRad), que están formadas por un gel de acrilamida/bis-acrilamida (4 % T y 3 % C), copolimerizado con inmovilinas, y que presentan un gradiente de pH continuo unido a la matriz del gel. Las tiras empleadas tenían un tamaño de 7 y 17 cm x 3,3 mm x 0,5 mm, y presentaban rangos de pH de 4 a 7 (rango medio), y de 3 a 10 (rango amplio). Como paso inicial del proceso, las tiras fueron rehidratadas con una mezcla que presentaba entre 100 - 150 μg de muestra preparada en una solución desnaturalizante que contenía ditiotreitol (DTT) 20 mM, anfolitos transportadores de rango de pH amplio (Bio-Lyte 3/10 Ampholyte, Bio-Rad) 0,5 % (p/v) y trazas de azul de bromofenol. El volumen final de mezcla empleado fue de 350 μL en las tiras de 17 cm y 150 μL en las tiras de 7 cm, correspondientes a la máxima capacidad de absorción de las tiras IPG empleadas. La etapa inicial, o IEF, se realizó en el aparato Protean IEF Cell (Bio-Rad) (figura 17). La mezcla de rehidratación se depositaría en un carril de la bandeja de IEF, y encima sería colocada la tira de tal manera que el gel quedase en contacto con la muestra y con los polos positivos (pH más ácido) y negativo (pH más básico), en la posición adecuada 128 Materiales y Métodos según la polaridad de la corriente. Una vez impregnada de muestra, la tira sería cubierta con aceite mineral para evitar la evaporación durante toda la primera dimensión. Figura 17. Imagen del equipo Protean IEF Cell (Bio-Rad) y sus accesorios. Para la rehidratación de los geles se mantuvo un pequeño voltaje basal de 50 V durante 12 horas de forma activa y a 20 ºC. Sin embargo, para evitar el daño de los electrodos por depósitos de sales, en la mitad de la rehidratación se cubrieron los mismos con pequeños papeles de filtro humedecidos en agua ultrapura. Una vez acabada la rehidratación se procedió al IEF propiamente dicho, que fue realizado en todos los pasos con un límite de corriente de 50 µA por gel y manteniéndose una temperatura constante de 20 ºC (Parlar, Weiss 2002). El programa empleado presentaba las siguientes etapas: Etapa inicial: de bajo voltaje para la eliminación del exceso de sales (250 V durante 15 minutos y a +20 ºC) Rampa de voltaje lineal: comienza con el voltaje inicial de 150 V hasta llegar a un voltaje de 4.000 V para tiras IPG de 7 cm y 10.000 V para tiras IPG de 17 cm (tabla 6), durante aproximadamente 3 horas. 129 Materiales y Métodos Tabla 6. Parámetros seleccionados para conseguir una rampa de voltaje lineal. Longitud Voltaje Voltaje Tiempo Temperatura IPG inicial final 7 cm 250 V 4.000 V 2h 20 ºC 17 cm 250 V 10.000 V 3h 20 ºC Vh: voltios-hora. Enfoque final: Etapa que va del voltaje anterior de 4.000 V o 10.000 V hasta un total de 20.000 Vh (voltios-hora) para tiras IPG de 7 cm y hasta 60.000 Vh para tiras IPG de 17 cm (tabla 7), durante un período de 6 horas aproximadamente. Tabla 7. Parámetros seleccionados para conseguir un enfoque final Longitud Voltaje Voltaje Tiempo Temperatura IPG inicial final 7 cm 4.000 V 20.000 Vh 5h 20 ºC 17 cm 10.000 V 60.000 Vh 6h 20 ºC Vh: voltios-hora. Etapa de mantenimiento o holding: programado como una etapa constante de 500 V para que, una vez finalizado el IEF, las proteínas sigan sometidas a una intensidad de corriente suficiente para evitar movimientos aleatorios de los polipéptidos enfocados, en el tiempo transcurrido entre el final del IEF y el comienzo del equilibrado. 2.5.2. Equilibrado de las tiras IPG Antes de proceder a la realización de la segunda dimensión fue necesaria una preparación previa de las tiras IPG, equilibrándolas con 130 Materiales y Métodos un tampón específico, de modo que la muestra quedase preparada para la electroforesis desnaturalizante (Klein et al., 2004). Las tiras debían situarse en la bandeja de equilibrado con el gel de IEF hacia arriba, de modo que el aceite mineral de la primera etapa del método flotase en la solución y no interfiriese en la incubación. La primera de las soluciones empleadas en el equilibrado fue una solución tamponadora específica que contenía urea 6 M, Tris 50 mM pH 8,8, SDS 2 % (p/v), glicerol 30 % (v/v) y DTT 1 % (p/v). Esta incubación se realizaría dos veces a lo largo de 20 minutos (10 minutos cada vez) y posteriormente se repetiría durante otros 20 minutos (dos veces de 10 minutos cada vez) con una solución tamponadora similar a la anterior cuyo contenido en DTT sería substituido por iodoacetamida (IAA) 2,5 % (p/v) y trazas de azul de bromofenol. El DTT se empleó como agente reductor puesto que es capaz de romper los puentes disulfuro existentes en la muestra, facilitando la solubilización de mezclas complejas de proteínas. Al equilibrar posteriormente con IAA se consigue estabilizar los grupos -SH obtenidos en el paso anterior, impidiendo que vuelvan a reaccionar formando los puentes, y facilitando así una buena desnaturalización en la segunda fase (o SDS-PAGE) en conjunto con la acción del SDS y la urea (Shaw y Riederer, 2003). El glicerol se añadió a este tampón para minimizar los fenómenos de electroendósmosis, que ocasionan interferencias en el patrón bidimensional final. 2.5.3. Segunda dimensión: Electroforesis desnaturalizante en geles de poliacrilamida La segunda dimensión se produce de forma análoga al proceso descrito para la SDS-PAGE monodimensional (1-DE) (apartado 2.4.). El hecho de que la segunda dimensión se base en la separación por el tamaño de la cadena proteica se debe al empleo de SDS en la etapa de equilibrado (Laemmli, 1970). 131 Materiales y Métodos Para la separación electroforética se emplearon también geles de poliacrilamida (30 % T y 2,6 % C) que presentaban un tamaño de 19,5 cm x 18,4 cm x 1,5 mm, y minigeles (82 mm x 68 mm x 0,75 mm), con una concentración del 12 % de poliacrilamida en ambos casos. En este caso no existe gel concentrador debido a que la tira IPG cumple ya esta función. Los minigeles en los que se realizaría esta técnica serían empleados para experimentos iniciales y para la transferencia de proteínas a membranas de PVDF. La matriz del gel se preparó al 30 % de poliacrilamida, empleando como crosslinker o agente entrecruzador la N´N´-bis-metilen-acrilamida (30 % T; 2,6 % C). Como agentes aceleradores de la polimerización se empleó APS al 10 % (p/v) y TEMED al 0,05 % (v/v). En el caso de los minigeles, haciendo uso de peines específicos para la formación de pocillos, se originó un pequeño pocillo en una de las esquinas (superior izquierda) del gel para cargar la mezcla de marcadores preteñidos (Prestained SDS-PAGE Standards-Low o Broad Range, Bio-Rad), que estuvieron visibles durante todo el proceso sin necesidad de realizar una tinción posterior. El rango de masa molecular relativa de las proteínas comprendía de 20 a 110 kDa en el caso de Low Range y de 6 a 200 kDa, aproximadamente, en el caso de Broad Range como ya se había comentado en apartados anteriores. Una vez realizado el equilibrado de las tiras, se procedió a la colocación sobre la parte superior de los geles verticales de la tira IPG, sellando la unión entre ambos con agarosa de bajo punto de fusión al 0,5 % (p/v). La etapa de electroforesis se realizó en una unidad Protean II xi Cell (Bio-Rad) y el voltaje fue generado con las fuentes Power PAC 1000 y/ó 3000 (Bio-Rad). Para impedir el calentamiento del gel se mantuvo la temperatura constante a 15 ºC gracias a un baño termostático (Frigiterm- 132 Materiales y Métodos 10, P. Selecta), que mantuvo un flujo continuo de agua a través del interior de la cubeta de electroforesis (figura 18). Figura 18. De izquierda a derecha: Protean II xi Cell; Power PAC; y baño termostático (Frigiterm-10, P. Selecta). Los parámetros utilizados para la migración de las proteínas en el gel durante la electroforesis fueron: Entrada de la muestra en el gel: manteniéndose un amperaje constante de 20 mA, 100 V y 2 W durante 15 minutos. Separación: se emplearon 40 mA (constantes), 400 V y 16 W durante 4-6 horas, hasta que el frente azul de bromofenol alcanzó la parte inferior del gel. En el caso de los minigeles, la electroforesis se realizó de forma análoga al proceso descrito para la SDS-PAGE monodimensional (apartado 2.4.), empleando el equipo Mini-Protean Tetra Cell (Bio-Rad) y la fuente de alimentación PowerPac 165-5050 (Bio-Rad). La única diferencia que existe en la 2D-PAGE, con relación a la SDS-PAGE, es que no existe un gel concentrador ni pocillos de carga, de forma que la tira con el gel procedente del IEF debe colocarse sobre la parte superior del gel separador, sellándose la unión con agarosa al 0,5 % (p/v), al igual que en el caso de los geles grandes. El voltaje empleado en este caso fue de 90 V para la entrada de la muestra en el gel y 150 V para la separación de las proteínas, con un límite de intensidad máximo de 1,8 A. 133 Materiales y Métodos Una vez finalizada la electroforesis, los geles se introdujeron en la solución fijadora correspondiente para llevar a cabo la tinción, o bien las proteínas se transfirieron a membranas de PVDF para proceder a la inmunodetección específica de proteínas. 2.5.4. Electroforesis PAGE en condiciones nativas Cuando se desea estudiar la actividad biológica tras la separación de proteínas y de complejos proteicos intactos sin que sufran desnaturalización, la electroforesis nativa es una de las técnicas más empleadas. Con este método las proteínas, y complejos proteicos, se separan en función de su masa, como en el caso de la SDS-PAGE, pero también en función de su carga, pudiéndose distinguir proteínas con cargas similares pero pI relativamente diferentes. Pese a que hay diversas variantes del método en función del sistema empleado, en nuestro caso se decidió emplear una técnica similar a la SDS-PAGE descrita en el apartado 2.4., en el que se sigue el sistema de Laemmli (Laemli, 1970), pero en este caso se omite completamente el uso de SDS y el βmercaptoetanol en las soluciones de la electroforesis. El tampón de carga empleado en este método consistió en una mezcla compuesta por TrisHCl 75mM pH 6,8, azul de bromofenol 0,1 % (p/v), y glicerol 10 % (v/v). Las características de este método se definen como de alto pH, debido al uso del sistema Tris-glicina como tamponante (rango de pH 8,3-9,5), y es el indicado para resolver adecuadamente aquellas proteínas cuyo pI es inferior y no muy cercano a 8,3 (pH del tampón de electrodo), ya que podría producirse precipitación. Por lo tanto, todas las proteínas con pI inferior a 8,3 migran al ánodo (Shi y Jackowski, 1998; Schägger, 1999). Una de las características metodológicas que debemos tener en cuenta a la hora de realizar esta técnica es la susceptibilidad que tienen 134 Materiales y Métodos las proteínas al ataque de proteasas. Debido a ello se mantuvieron a una temperatura de 4 ºC desde su preparación hasta su análisis. Además, durante la electroforesis se intentó evitar el sobrecalentamiento del gel, puesto que podría producirse desnaturalización térmica de las proteínas, realizando el experimento a 100 V en la fase separadora y sin límite prefijado de amperaje. En este caso, y al igual que la SDS-PAGE, se resolvieron de 50 µg a 1 µg de proteína en cada una de las muestras estudiadas. El gel concentrador se mantuvo al 4 % (p/v) de poliacrilamida, mientras que el separador se preparó al 10 % (p/v). 2.6. 2.6.1. Tinción de geles de poliacrilamida Tinción con azul brillante de Coomassie Una vez obtenido el gel, se procedió a la tinción del mismo mediante una disolución del colorante azul brillante de Coomassie R-250 al 0,1 % (p/v), que fue preparado en etanol al 40 % (v/v) y ácido acético glacial al 10 % (v/v), donde se incubó el gel durante 2 horas. Para desteñir se utilizó una solución al 40 % (v/v) en etanol y al 10 % (v/v) en ácido acético glacial, incubando el gel 20 minutos y repitiendo el proceso 2 o 3 veces. Para la eliminación de los restos de colorante que no se uniese específicamente a las proteínas se dejaron los geles en agua milliQ durante toda la noche. Tras la tinción, se obtuvieron las imágenes de cada gel mediante el densitómetro GS-800 (Bio-Rad), para muestras visibles. Puesto que este densitómetro está configurado para su calibración automática cada vez que se enciende, todas las imágenes fueron obtenidas en idénticas 135 Materiales y Métodos condiciones, por lo que se pudieron emplear los valores de densidad óptica (intensidad) para estudios comparativos. 2.6.2. Tinción con nitrato de plata compatible con espectrometría de masas Para realizar esta tinción, una vez realizada la electroforesis, los geles se introdujeron en una solución fijadora durante toda la noche para poder llevar a cabo el proceso de tinción con nitrato de plata al día siguiente. Puesto que las proteínas serían identificadas mediante MS se tuvo que llevar a cabo una tinción compatible. Para la tinción con nitrato de plata específica para MS se realizaron los siguientes pasos: Fijación: etanol 40 % (v/v), ácido acético 10 % (v/v) (toda la noche). Lavado: agua ultrapura (5 min). Sensibilización: acetato de sodio 6,8 % (p/v), tiosulfato sódico 0,3 % (p/v), etanol 30 % (v/v) (60 min). Lavados: agua ultrapura (6 x 10 min). Reacción de plata: nitrato de plata 0,1 % (p/v) (30 min). Lavados: agua ultrapura (3 x 20 s). Revelado: carbonato sódico 3 % (p/v), formaldehído (37 %) 0,025 % (v/v) (15-20 min). Lavado: agua ultrapura (20 s). 136 Materiales y Métodos Parada: ácido etilendiaminotetracético (EDTA) 1,46 % (p/v) (10 min). Lavados: agua ultrapura (3 x 5 min). De los geles resultantes también se obtuvieron las imágenes digitalizadas empleando el densitómetro GS-800 (Bio-Rad) para muestras visibles, tal y como se ha especificado en el apartado anterior. 2.7. Transferencia de proteínas a membranas mediante Western Blot En el caso de querer llevar a cabo una tinción con anticuerpos específicos, los geles en una dimensión (1D) y/o minigeles en dos dimensiones (2D) fueron sometidos a la transferencia de proteínas empleando el método Western Blot. Este método es un tipo de sistema de blotting, también conocido como “en tanque” o “húmedo”. Las proteínas que estaban inmersas en el gel fueron transferidas a membranas de PVDF de 0,45 µm para la detección de proteínas de > 10 kDa (Immobilon-P, Millipore), siguiendo para ello el método descrito por Towbin y colaboradores (Towbin et al., 1979). Para llevar a cabo la transferencia, una vez finalizada la electroforesis, los geles se incubaron en una disolución amortiguadora de Tris/glicina (Tris 25 mM y glicina 192 mM, pH 8,3), con un 10 % (v/v) de metanol, para su equilibrado. La pieza de membrana, de tamaño similar al gel, se activó en metanol 100 % (v/v) durante 30 segundos, lo que le permitió pasar del estado hidrofóbico a polar. Posteriormente se incubó durante 2 minutos en agua ultrapura, y finalmente se equilibró en la misma disolución amortiguadora que el gel durante 30 segundos. Esta disolución amortiguadora se emplearía también para la transferencia, que se realizaría a 100 V (límite de 1,6 A) durante 1 hora en el Mini Trans-Blot 137 Materiales y Métodos (Bio-Rad), conectado a la fuente de alimentación Model 200/2,0 (Bio-Rad) (figura 19). Puesto que la transferencia requiere del mantenimiento de una conductividad y temperatura uniformes a lo largo de toda la cubeta, fue necesario el uso de agitación en el interior del tanque. Figura 19. Imagen de la fuente de alimentación Model 200/2,0 (Bio-Rad) y el equipo Mini Trans-Blot (derecha) empleado para la transferencia a membrana de las proteínas. Una vez finalizada la transferencia, la membrana se lavó con agua milli-Q y se inició la inmunodetección. El gel se recuperó para realizar una tinción con azul brillante de Coomassie, como control de la eficiencia del proceso de transferencia. 2.7.1. Tinción con rojo Ponceau S Como precaución, para poder comprobar que realmente había ocurrido la transferencia antes de la inmunodetección, las membranas de PVDF fueron teñidas con un colorante que, aunque presenta baja sensibilidad, se une de modo reversible a las proteínas. La membrana se incubó durante 5 min en una disolución de Ponceau S disuelto al 0,2 % (p/v) en ácido tricloroacético (TCA) 3 % (v/v). El desteñido del mismo se realizó con agua ultrapura hasta que las bandas y/o spots mayoritarios fueron visibles. 138 Materiales y Métodos Antes de proceder a la inmunodetección, se destiñó lo máximo posible la membrana, desapareciendo los restos de colorante que pudiesen haber quedado, con la solución de bloqueo. 2.7.2. Inmunodetección de proteínas Una vez finalizada la transferencia de proteínas, en el caso de membranas procedentes de Western Blot se procedió a la inmunodetección de la proteína de interés. La membrana se bloqueó en una disolución de leche desnatada al 5 % (p/v) en disolución amortiguadora salina de fosfato pH 7,4 (Phosphate-Buffered Saline, (PBS)) durante 2 horas a temperatura ambiente y en agitación. A continuación se incubó con el anticuerpo primario a 4 ºC, en agitación leve y durante toda la noche. Una vez lavada la membrana con PBS (3 veces por 5 minuos), se incubó con el anticuerpo secundario durante 90 minutos a temperatura ambiente y en agitación. El anticuerpo secundario empleado (anti-ratón, específico para Ig G (H+L) de Sigma) estaba conjugado con la enzima fosfatasa alcalina, y se empleó diluido en la disolución de bloqueo. El siguiente paso llevado a cabo consistió en varios lavados con PBS (2 lavados de 5 minutos), seguidos de un lavado con Tween-20 al 0,05 % (v/v) en PBS (1 lavado x 4 minutos), y por último lavados rápidos con PBS (2 lavados de 30 segundos). El revelado de la membrana se realizó mediante la adición del sustrato de la fosfatasa alcalina, el 5-bromo-4-cloro-3-indolilfosfato (BCIP: 0,19 mg/mL), unido al cromógeno azul de nitrotetrazolio (NBT: 0,4 mg/mL) en Tris 100 mM pH 9,5 y sulfato de magnesio 50 mM, sin agitación y en oscuridad. La hidrólisis de este sustrato por acción de la enzima genera un precipitado de color azulado visible a simple vista. 139 Materiales y Métodos El tiempo que se necesitó para la observación de las bandas proteicas osciló entre los 5 y los 60 minutos, en función del tipo de proteína inmunodetectada. Para parar la reacción, se sumergió la membrana en agua destilada durante 10 minutos. El análisis posterior de las imágenes se realizó como se describe en el apartado 2.8. 2.7.2.1. Inmunodetección de la proteína PEDF Como anticuerpo primario se empleó 1 μg/mL de un anticuerpo monoclonal de ratón anti-PEDF humano (MAB1059, clone 10F12.2, Millipore), en disolución de bloqueo. El anticuerpo secundario empleado fue Ig G (H+L) de cabra anti-ratón conjugada con la enzima fosfatasa alcalina (Sigma), diluida 1/3.000 en disolución de bloqueo. 2.7.2.2. Inmunodetección de la proteína S100-A9 Como anticuerpo primario se empleó 1 μg/mL de un anticuerpo monoclonal de ratón anti-S100-A9 humano (ab24111, abcam), en disolución de bloqueo. El anticuerpo secundario empleado fue Ig G (H+L) de cabra anti-ratón conjugada con la enzima fosfatasa alcalina (Sigma), diluida 1/3.000 y 1/15.000 en disolución de bloqueo. 2.8. 2.8.1. Análisis de imagen Adquisición de la imagen De cada uno de los geles y de cada una de las membranas de PVDF obtuvimos una imagen digitalizada empleando el densitómetro GS800 (Bio-Rad), que es un tipo de escáner más potente, capaz de calibrarse de modo automático cada vez que se enciende. La adquisición 140 Materiales y Métodos de las imágenes se realizó desde los programas específicos de análisis de imágenes 1D (Quantity One 4.4.1. de Bio-Rad) y 2D (PDQuest 7.3.0 de Bio-Rad), que permiten almacenar los datos asociados a la imagen (distribución de la intensidad, tamaño real del gel o de la membrana, etc.), haciéndolos disponibles de modo directo para el análisis (figura 20). Figura 20. Imagen del densitómetro CS 800 (Bio-Rad) empleado para el escaneado de geles y membranas. Las imágenes obtenidas fueron adquiridas con una resolución media (63,5 µm x 63,5 µm), empleándose el modo de transmisión de luz para los geles, y el modo refractivo para las membranas. En el caso de los geles, fue necesario el empleo de un filtro de luz complementario al color de tinción del gel, que para los geles teñidos con nitrato de plata se corresponde con el filtro de luz verde, y para los teñidos con azul brillante de Coomassie con el filtro para luz roja, mientras que las membranas de PVDF se escanearon con un filtro de luz verde. Las imágenes obtenidas en ambos casos se denominan mapas proteicos o mapas 1D o 2D. 2.8.2. Análisis de patrones monodimensionales Las imágenes de los geles teñidos mediante azul brillante de Coomassie, nitrato de plata, y/o las membranas procedentes de la 141 Materiales y Métodos transferencia y de la posterior inmunotinción de geles 1D, fueron analizadas con el programa Quantity One 4.4.1. (Bio-Rad). Este programa trabaja con archivos de tipo lsc, por lo que todas las imágenes 1D fueron adquiridas de modo específico. El análisis estándar comienza con la delimitación del número de carriles que presenta el gel/membrana, carriles que debemos ajustar para corregir posibles desviaciones (efectos de borde, o curvaturas de carriles laterales). A continuación, el programa nos permite determinar y eliminar el posible ruido de fondo que existe, pudiendo posteriormente detectar con mayor precisión cada una de las bandas. Esta detección se puede realizar de manera manual, señalándose aquellas bandas que el programa no ha considerado como tales, o bien eliminando aquellos artefactos considerados como bandas. Esta intervención manual se hace necesaria para ajustar el ancho de las bandas, y para la delimitación de las mismas. Completada la detección, se establecen los valores de Mr correspondientes a los marcadores de peso molecular empleados y se calcula, mediante regresión logarítmica, el coeficiente de correlación entre la distancia recorrida por los marcadores y el logaritmo de Mr, extrapolando los valores de masa correspondientes a las bandas de las muestras, y eliminando el valor de aquel marcador que no se ajustó a dicha correlación. El programa nos permite obtener un archivo de texto con todos los datos, en los que cada banda proteica aparece identificada con un número de carril y banda, y tiene asociada información sobre la masa y la cantidad de señal (denominada en el programa trace quantity), representativa de la cantidad de proteína. Dicha cantidad viene dada por el área bajo la curva de intensidad de la banda, por lo que la unidad de medida será intensidad multiplicada por la longitud de la banda (mm), aunque para su simplificación se emplea el término intensidad para 142 Materiales y Métodos referirnos a la cantidad de señal detectada. Además, es posible calcular la cantidad relativa de proteína en cada una de las bandas, en relación con el resto de bandas pertenecientes a la misma muestra, y en el caso de tener un patrón de cantidad de proteína (un duplicado de la membrana en otro gel), es posible hacer una determinación de la misma. Además de todas las aplicaciones ya mencionadas, el programa ofrece diferentes opciones de visualización, representaciones gráficas e informes. 2.8.3. Análisis de patrones bidimensionales Dada la complejidad que presentan los patrones 2D, su análisis tuvo que ser realizado a través de un programa específico. En este estudio se han comparado los geles y membranas 2D de proteínas empleando el software PDQuest 7.3.0. (Bio-Rad), que es considerado uno de los programas informáticos más robustos del mercado, ante el solapamiento o superposición de las manchas proteicas o spots (Dowsey et al., 2003; Marengo et al., 2005; Rogers et al., 2003). En este caso, el funcionamiento se basa en la asignación para cada uno de los puntos detectados en un gel/membrana de unas coordenadas X e Y (pixels), que se corresponden con su posición horizontal y vertical en la imagen (lo que nos proporciona el área de cada uno de los spots) y un valor Z que determina la intensidad de la señal (Marengo et al., 2005). En cada spot, el volumen del mismo se calculará como la intensidad multiplicada por el área (intensidad x mm2), lo que nos proporciona una medida cuantitativa de cada proteína. Para poder dar comienzo al análisis, las imágenes de los geles y de las membranas fueron modificadas con este software, de modo que se recortaron automáticamente siguiéndose un mismo criterio, en el que sólo se excluyesen los bordes de los geles y membranas donde no 143 Materiales y Métodos hubiese spots. Tras este paso se procedió al ajuste de los parámetros de identificación para la detección automática de spots, señalando el spot que hemos considerado más pequeño (lo que sirvió para determinar el tamaño máximo de impurezas), el más grande (que permite detectar arrastre o spots solapados) y el menos intenso (estableciendo así el nivel de ruido de fondo). Cuando las manchas proteicas son detectadas mediante el programa PDQuest, la imagen original es filtrada y suavizada para una mejor visualización de los puntos detectados. A partir de la imagen filtrada, se construyen a continuación los spots tridimensionales ajustados a un modelo gaussiano. El resultado final son tres imágenes separadas: la original digitalizada, la filtrada y procesada, y la gaussiana. Procesadas las imágenes, y de modo individual para cada una de ellas, se procedió a eliminar de forma manual las marcas detectadas que no se correspondían con spots. Estas marcas, visibles en la imagen digitalizada y en la filtrada, no se observan en la imagen sintética gaussiana. Por este motivo, sobre la imagen gaussiana es sobre la que se realizará el análisis de los datos (ya que en un experimento ideal la distribución de las proteínas debería ajustarse a una curva de Gauss). Una de las ventajas que podemos obtener con este sistema es que, al modelizar las manchas solapantes, con arrastre o cluster, podemos obtener datos de intensidad y posición (y por tanto de cantidad, Mr y pI) muy próximos a los reales (Garrels, 1989). Detectadas y revisadas las marcas, se procedió al reconocimiento y alineamiento de las imágenes, mediante un proceso denominado matching. Sobre las imágenes de los geles o membranas a analizar se van marcando aquellos spots presentes en todas las imágenes (de modo automático o manual), y gracias al empleo de coordenadas X e Y, se pueden ir reconociendo los puntos que representan los mismos spots en las diferentes imágenes. 144 Materiales y Métodos Una de las cosas importantes es que, mediante una de las opciones del programa, es posible intercambiar la imagen escaneada de los mapas de la comparación o matchset por sus correspondientes imágenes filtradas o gaussianas, tantas veces como lo deseemos, facilitándonos la visualización de los spots. Sin embargo, la imagen de referencia o master es una imagen gaussiana no modificable en este sentido. Finalizado el alineamiento, el programa nos permite la normalización de los datos en partes por millón (ppm), o porcentaje (%), calculando un valor de la cantidad normalizada que denomina “volumen relativo”; valor que se corresponde con el área del spot multiplicada por el valor de intensidad relativa a la intensidad total detectada en el gel o en la membrana. El empleo de parámetros relativos nos permite la eliminación de las diferencias debidas a la tinción con nitrato de plata (puesto que el fondo de tinción también determina la intensidad de los spots), al fondo de la inmunodetección en el caso de las membranas, y a otros factores como son los errores de manipulación. Se puede considerar, por tanto, que el “volumen relativo” de un spot es un dato que representa a la cantidad de proteína (Byrjalsen et al., 1999; López et al., 2001; Tsuji et al., 1999; Yan et al., 1999). Los datos obtenidos para cada imagen se pueden exportar y utilizar para hacer una serie de análisis cualitativos o cuantitativos. Además, el programa permite obtener histogramas de intensidad en uno o varios spots, así como datos de regresión, superposición de imágenes, etc. 2.9. Electroforesis diferencial en gel La metodología empleada para determinar la expresión diferencial de proteínas entre muestras de DPM y DPB se llevó a cabo utilizando 145 Materiales y Métodos una variante de la electroforesis bidimensional denominada Electroforesis Diferencial en Gel (DIGE). 2.9.1. Preparación y marcaje de las muestras Las muestras de 4 pacientes con DPB y 4 pacientes con DPM fueron centrifugadas, y los precipitados resultantes se resuspendieron en 50 μL de urea 8 M, tiourea 2 M, CHAPS 4 % y Tris 30 mM, determinándose la concentración de proteínas mediante el método de Bradford modificado (ver apartado 2.3.2. del presente capítulo). Los fluoróforos CyDye (Cy2, Cy3, Cy5) se reconstituyeron en dimetilformamida anhidra. Una vez reconstituidos, el Cy2 mostró coloración amarilla, el Cy3 roja, y el Cy5 azul. Para la manipulación de los fluoróforos se mantuvo la muestra en una cámara oscura y en hielo. Para el marcaje se empleó el Cy5 para 2 muestras de DPB y 2 de DPM, el Cy3 para los otras 2 muestras de DPB y 2 de DPM, y el Cy2 para los estándares internos, con la intención de reducir el error experimental debido al marcaje diferencial. Cada estándar interno se componía de 6,25 μg de proteína de cada una de las muestras, y para todas las muestras se prepararon 50 μg de proteína total. En cada vial de muestra se añadieron 400 pmoles del fluoróforo correspondiente por cada 50 μg de proteína. Una vez preparada la muestra se dejó reaccionar en hielo durante 30 minutos en oscuridad. El marcaje se terminó mediante la adición de lisina (1 μl de Lisina 10 mM/50 μg proteína), dejándola reaccionar durante 10 minutos en hielo. Las muestras, combinadas tras el marcaje, se disolvieron en un tampón de rehidratación compuesto por urea 7 M, tiourea 2 M, CHAPS 4 % (p/v), DTT 0,2 % (p/v) y 0,5 % (v/v) anfolitos 3-10. 146 Materiales y Métodos 2.9.2. Electroforesis bidimensional Para la primera dimensión, la separación se realizó en geles de poliacrilamida de 24 cm de longitud, con rango no lineal de pH de 3 - 11 (Immobilon Dry Strip, Amersham Biosciences). El IEF se realizó en el IPGphor™ Manifold (GE Healthcare Life Sciences). En primer lugar se llevó a cabo la rehidratación activa, aplicando 10 V durante 12 horas. A continuación se aplicaron 500 V de manera constante durante 1 hora; posteriormente, y en gradiente, se aplicarían 1.000 V durante 1 hora; después se mantuvo en gradiente hasta 5.000 V durante 2 horas; 5.000 V constantes durante 7 horas; y finalmente habría un paso final de mantenimiento con un voltaje constante a 500 V. La fase de equilibrado de las muestras se realizó conforme a lo que se describió en el apartado 2.5.2. del presente capítulo. La segunda dimensión se llevó a cabo en un sistema DALTsix (Amersham Biosciences). Tras el ensamblaje de los cristales, se prepararon los geles de poliacrilamida (12 % T y 2,6 % C), que presentaron unas dimensiones de 25,5 cm x 20,5 cm x 1 mm. La SDSPAGE se realizó a una intensidad constante de 2 W/gel, con temperatura estable de + 20 ºC durante 17 horas. 2.9.3. Adquisición de las imágenes Una vez realizada la 2-DE, las imágenes de los geles fueron adquiridas en el densitómetro Typhoon 9400 (Amersham Biosciences) con filtros específicos para las señales de fluorescencia que se iban a medir, donde se aplicaron las longitudes de onda de excitación y emisión correspondientes a cada fluoróforo (tabla 8). Los geles se escanearon 147 Materiales y Métodos entre los cristales, con iluminación basal, y aplicando las longitudes de onda de excitación y emisión correspondientes. Tabla 8. Longitudes de onda de excitación y emisión de los tres fluoróforos CyDye empleados. Cy2 Cy3 Cy5 λ excitación 488 512/52 625/50 λ emisión 515 565/615 670 λ: longitud de onda en nm. 2.9.4. Los Análisis diferencial de intensidad estudios comparativos de cada una de las imágenes adquiridas en un único gel fueron realizados mediante el programa DeCyder, versión 6.5 (Amersham Biosciences), con su módulo Differential In-Gel Analysis, que fue capaz de detectar automáticamente cada una de las manchas correspondientes a las proteínas resueltas, y realizar los análisis comparativos ofreciendo una medida ajustada de los cambios de abundancia de las proteínas diferenciales. Además de la detección de manchas proteicas, permitió la sustracción del fondo de la imagen, la normalización de los valores de intensidad y la eliminación de artefactos. Para comparar muestras de DPB frente a DPM se empleó en el módulo Biological Variation Analysis. Este módulo permite el emparejamiento de las manchas proteicas detectadas en todos los geles, gracias a la existencia del estándar interno constituido por todas las muestras analizadas, y es capaz de calcular los cambios en la abundancia relativa de cada uno de los spots analizados. Además, detecta spots cuya diferencia entre los dos grupos estudiados es significativa mediante la prueba t de Student (p < 0,05). Puesto que la 148 Materiales y Métodos prueba paramétrica contemplada en el programa no era la adecuada para el pequeño tamaño muestral, se realizaron estudios de comparación de muestras empleando la correspondiente prueba no paramétrica (U de Mann-Whitney). 2.10. Espectrometría de masas 2.10.1. Digestión de las proteínas y obtención de péptidos trípticos Para la identificación mediante MS de las proteínas de interés, éstas fueron extraídas de geles 2D preparativos revelados con la tinción de nitrato de plata específica para masas, que es mucho más sensible y permite la visualización de un mayor número de proteínas usando una menor cantidad de muestra para ello. Sin embargo, para la identificación de las proteínas alteradas encontradas en los geles obtenidos tras el análisis DIGE, se realizaron geles 2D preparativos que fueron revelados con azul brillante de Coomassie, el empleo de esta tinción permitía cargar una mayor cantidad de muestra por gel, y por tanto podríamos detectar mucho mejor las proteínas alteradas. La digestión fue realizada de manera similar para ambos tipos de tinciones, aunque con ligeras diferencias entre ellas que serán detalladas a continuación. Las piezas de gel obtenidas mediante el digestor automático Proteineer dp (Bruker) se introdujeron en una placa de 96 pocillos. Para eliminar la tinción, los geles teñidos con nitrato de plata fueron tratados con una disolución de 30 mM de Potasio hexacianoferrato II (K2 [Fe (CN)6]) y 100 mM tiosulfato de sodio pentahidratado (Na2S2O3·5H2O). En el resto de los geles teñidos con Coomassie se realizaron 2 lavados con agua milli-Q durante 10 min y se eliminó el colorante del gel mediante la 149 Materiales y Métodos incubación con 20 μL de acetonitrilo (AcN) 100 % (v/v) durante 15 minutos, y el posterior congelado durante 30 minutos. Una vez retirado el líquido del último lavado, las piezas de gel se secaron al vacío durante aproximadamente 30 minutos en una centrífuga Speed-Vac (Savant) para deshidratar la muestra. La muestra se incubó con 10 mM DTT en bicarbonato de amonio (NH4HCO3) 25 mM (50 mM en el caso de geles teñidos con nitrato de plata) durante 30 minutos a 56 ºC para que se produjese la reducción. Una vez transcurrido este tiempo el DTT se retiró rápidamente y se añadió a continuación IAA 55 mM en 25 mM NH4HCO3 (50 mM para geles teñidos con nitrato de plata) durante 15 minutos en oscuridad. La digestión fue acompañada de 12,5 ng/µL de tripsina (Roche Molecular Biochemicals) en 25 mM de NH4HCO3, pH 8,5, a 37 ºC durante toda la noche. Tras la digestión, el sobrenadante fue recolectado y 1 µL del mismo fue añadido a la placa de MALDI, donde se dejó secar a temperatura ambiente. Después se añadieron 0,5 µL de una concentración de 3 mg/mL de matriz de ácido α-ciano-4-hidroxicinámico (Sigma) en 50 % (v/v) de ACN que fueron añadidos sobre el péptido digerido y seco, y se dejó para que se secase a temperatura ambiente. 2.10.2. Análisis por MALDI-TOF y MS/MS Para el análisis de la huella peptídica se empleó un MALDI-TOF, modelo Voyager DE-STR Biospectrometry Workstation con cámara de colisión (Applied Biosystems). Como soporte se utilizó una placa de MALDI en la cual se depositaron, en cada una de las celdas que presenta, una mezcla de cada una de las muestras digeridas y de la matriz de ácido α-ciano-4hidroxicinámico. De esta manera, cuando la muestra fue golpeada por el láser, los analitos se ionizaron entrando en una cámara de vacío que los 150 Materiales y Métodos condujo hacia el analizador del espectrómetro. El espectrómetro opera en un modo de reflector positivo que es capaz de alcanzar un voltaje de aceleración de 20.000 V. Además, para poder calibrar el espectro se emplearon péptidos internos de la digestión con tripsina. Se adquirieron los espectros de masas y los péptidos identificados de modo ambiguo mediante PMF (por sus siglas en inglés: peptide mass fingerprinting) fueron enviados a un segundo analizador, fragmentándose por colisión (MS/MS). En este caso se obtuvieron espectros de masas correspondientes a oligopéptidos o aminoácidos (figura 21). Figura 21. Imagen representativa de cómo ocurre la activación de los iones de la muestra, cómo estos viajan a través del tubo de MALDI, y el patrón de masas obtenido al final del proceso de identificación peptídica. 2.10.3. Búsqueda en bases de datos e identificación de proteínas Una vez generados los espectros de masas, se calcularon los valores de m/z experimentales y se realizaron búsquedas en bases de 151 Materiales y Métodos datos, como NCBInr (por sus siglas en inglés: National Center for Biotechnology Information), con el motor de búsqueda Mascot Daemon search engine 2.1 (Matrix Science, http://www.matrixscience.com; (Cottrell, London 1999)), en las cuales se compararon los valores teóricos de m/z de las secuencias aminoacídicas contenidas en estas bases. Los parámetros de búsqueda empleados fueron: reglas de corte para la enzima tripsina, posibilidad de un único error de corte de la enzima, cabamidometil como modificación fija, y oxidación como modificación variable. Además, para los valores de masa monoisotópica seleccionados para PMF, la masa de proteína fue ilimitada, y se designó ± 50 ppm de tolerancia para la masa del péptido. Para cuestiones de secuencias y búsquedas de iones en MS/MS, la tolerancia de la masa de los péptidos fue de ± 100 ppm y la tolerancia de los fragmentos de ± 0.3 Da. La mayor parte de los resultados se aceptaron (p < 0,05 siendo p la probabilidad de que lo observado se parezca a un evento aleatorio). Cuando el resultado de la búsqueda fue significativo (> 95 % confianza), la proteína se consideró identificada. 2.11. Determinación de la concentración de los marcadores en el fluido pleural Estos ensayos fueron realizados tanto en las muestras de fluido pleural de pacientes con patología maligna como en pacientes con derrame pleural benigno. 152 Materiales y Métodos 2.11.1. Determinación de los niveles de la proteína PEDF Se determinó la concentración de la proteína PEDF en el fluido pleural empleándose para ello el inmunoensayo específico Pigment Epithelium-Derived Factor (PEDF) Sandwich ELISA Kit (Chemicon International, USA & Canada). El ELISA fue desarrollado según las instrucciones del fabricante, estimando las concentraciones de PEDF en función de la recta patrón obtenida a partir del análisis de las diluciones de las series de los estándares. Dicho análisis fue realizado en un lector de microplacas de 96 pocillos (EnVision Multilabel Plate Reader, Perkin Elmer) a una longitud de onda de 450 nm. 2.11.2. Valoración de los niveles de la proteína Calprotectina Se determinó la concentración de la calprotectina en el fluido pleural mediante el empleo del inmunoensayo específico Human Calprotectin ELISA Kit (Hycult biotech, Paises Bajos). El ELISA fue desarrollado siguiendo las instrucciones del fabricante, y las concentraciones de Calprotectina se estimaron en función de la recta patrón obtenida a partir del análisis de las diluciones en serie de los estándares. Dicho análisis fue realizado en un lector de microplacas de 96 pocillos (EnVision Multilabel Plate Reader, Perkin Elmer) a una longitud de onda de 450 nm. 2.12. Tratamiento estadístico de los datos Las pruebas se realizaron con el programa estadístico SPSS en su versión 15.0 para WINDOWS (Copyright© SPSS Inc. 1989-2002). 153 Materiales y Métodos 2.12.1. Análisis estadísticos En todos los casos, tanto en la parte de la búsqueda de marcadores como en la validación de los mismos, antes de realizar los análisis estadísticos de cada uno de los parámetros bioquímicos a estudio fue necesario comprobar si los valores de las variables se ajustaban a una distribución normal; para ello se aplicó el test de Kolmogorov-Smirnov a cada muestra poblacional. Una vez comprobada la normalidad de cada variable se realizó el test de Levene, con el cual se verificó la existencia de homogeneidad de varianzas de la variable a estudio para cada uno de los factores considerados. Realizados ambos test pudimos encontrarnos ante dos situaciones diferentes: - Distribución normal de la variable de estudio y existencia de homogeneidad de varianzas para dicha variable. En este caso fue necesario el empleo de un test de tipo paramétrico para la igualdad de medias. - Si la distribución de la variable de estudio no era normal o no existía homogeneidad de varianzas para dicha variable. En este caso fue necesario el empleo de estadística de tipo no paramétrica. 2.12.1.1. Análisis estadístico univariantes Para la comparación del volumen relativo de los spots de pacientes con DPB y DPM se empleó la prueba no paramétrica de la U de Mann Whitney para dos muestras independientes. Considerándose un límite de significación asintótica (bilateral) del 95 %, admitiéndose diferencias significativas si p ≤ 0,05. Para realizar un análisis estadístico de la comparación de los niveles de marcadores debemos tener en cuenta que al emplear la 154 Materiales y Métodos estadística paramétrica, el test de contraste de hipótesis para dos muestras independientes empleado fue la t de Student, mientras que para realizar los análisis de varianza, el test por defecto en este caso fue el ANOVA de 1 factor. En la estadística no paramétrica, el test de contraste de hipótesis para dos muestras independientes empleando sería la U de MannWhitney, y para realizar el análisis equivalente al análisis de varianza paramétrico se empleó el test de Kruskal-Wallis. 2.12.1.2. Análisis estadísticos multivariantes Los datos de volumen relativo de los spots cuya variación cuantitativa había resultado estadísticamente significativa fueron estudiados mediante el análisis de componentes principales (ACP). Además, para el análisis de las diferentes variables clinicopatológicas, con los candidatos a marcadores fue empleada la regresión logística. La base metodológica de estas pruebas estadísticas se detalla a continuación. a) Análisis de componentes principales Las relaciones que se presentan entre x variables correlacionadas pueden transformarse en otro conjunto de nuevas variables no correlacionadas entre sí llamado conjunto de componentes principales (CPs). En este estudio los CPs extraídos del análisis fueron contrastados estadísticamente con la prueba U de Mann-Whitney, considerándose significativos si p ≤ 0,05. La matriz de correlaciones contiene las correlaciones entre las variables originales y cada uno de los CPs extraídos del análisis. 155 Materiales y Métodos b) Regresión Existen varias opciones para estimar un modelo de regresión, de entre los que destacan, por su facilidad de aplicación e interpretación, el modelo de regresión lineal y el modelo de regresión logística. Cuando la variable dependiente es una variable continua, el modelo de regresión más utilizado fue la regresión lineal, mientras que cuando la variable de interés fue dicotómica (es decir, toma dos valores como sí/no, hombre/mujer) se utilizó la regresión logística. c) Correlación La correlación es una medida sobre el grado de relación entre 2 variables sin importar cuál es la causa y cuál es el efecto. La dependencia de la que se habla en este sentido es la dependencia de la varianza de las variables. Existen diferentes tipos de correlación: - Correlación de Pearson: es un índice que mide la relación lineal entre dos variables aleatorias cuantitativas y, que a diferencia de la covarianza, es independiente de la escala de medida de las variables. - Correlación de Spearman: es una correlación lineal entre dos variables pero que, a diferencia de la de Pearson, esta emplea valores medidos a nivel de una escala ordinal (si las variables están medidas a nivel de intervalo/razón deben convertirse a ordinales antes de emplearla). - Tau de Kendall: Es un estadístico usado para medir la asociación entre dos cantidades medibles. Es una medida de la correlación del rango, de la similitud de los órdenes de datos cuando se clasifican cantidades. 156 Materiales y Métodos 2.12.1.3. Curvas ROC Para la elaboración de una curva de características operativas relativas (curva ROC), se siguió el procedimiento descrito por Beck y Shultz (Beck, Shultz 1986). En esta curva están representados, para cada uno de los posibles puntos de corte que son tomados en función de los niveles de marcador de la muestra poblacional de pacientes con DPM, el porcentaje de verdaderos positivos (sensibilidad) en el eje de ordenadas, frente al porcentaje de falsos positivos (100-especificidad) en el eje de abscisas. El porcentaje de verdaderos positivos se calcula en función del número de individuos correctamente clasificados como enfermos por la prueba, con respecto al total de individuos de la muestra poblacional. El porcentaje de falsos positivos se calcula en función del número de individuos que, estando sanos, son erróneamente clasificados como enfermos por la prueba, con respecto al total de individuos de la muestra poblacional. Con ayuda del perfil de la curva ROC se determinó un punto de corte final para establecer los parámetros diagnósticos para el DPM de los niveles de los marcadores medidos mediante el ELISA. Estos parámetros se definen y calculan como se detalla a continuación (Bailar y Mosteller, 1992): - Sensibilidad diagnóstica: probabilidad de que el resultado de la prueba sea positivo (presencia de la enfermedad) cuando está presente la enfermedad. - Especificidad diagnóstica: probabilidad de que el resultado de la prueba sea negativo (ausencia de la enfermedad) cuando no está presente la enfermedad. - Eficiencia diagnóstica: parámetro que relaciona el número total de resultados correctos con el total de la muestra poblacional a estudio. 157 Materiales y Métodos - Likehood ratio: Indica cuánto más probable es un resultado determinado de una prueba diagnóstica en un paciente con una enfermedad dada, comparado con un paciente que no presenta la patología (pudiendo ser positivo o negativo). Se calcula dividiendo la probabilidad de un resultado de una prueba diagnóstica en personas con la enfermedad de interés, entre la probabilidad de dicho resultado en personas sin la enfermedad. - Valor predictivo positivo: Probabilidad de que una persona tenga la enfermedad cuando la prueba diagnóstica da un resultado positivo. - Valor predictivo negativo: Probabilidad de que una persona no tenga la enfermedad cuando la prueba diagnóstica da un resultado negativo. - Odds Ratio: Indica la magnitud de asociación entre exposición y el resultado (es el riesgo de haber estado expuesto, dada la enfermedad). 2.12.1.4. Análisis de validación cruzada La validación cruzada o cross-validation, es una técnica empleada para evaluar los resultados de un análisis estadístico y garantizar que son independientes de la partición entre datos de entrenamiento y datos prueba. Consiste en repetir y calcular la media aritmética obtenida de las medidas de evaluación sobre diferentes particiones. Este tipo de análisis se utilizan en entornos donde el objetivo principal es la predicción y en los que se quiere estimar cómo de preciso es un modelo que se llevará a cabo, puesto que esta validación cruzada es una manera de predecir el ajuste de un modelo a un hipotético conjunto de datos de prueba cuando no disponemos del conjunto explícito de datos de prueba. 158 Materiales y Métodos La validación cruzada dejando uno fuera o Leave-one-out crossvalidation implica separar los datos de forma que para cada repetición (interacción) tengamos una sola muestra para los datos de prueba, y todo el resto se quedaría conformando los datos de entrenamiento. Figura 22. Validación cruzada dejando uno fuera. Imagen tomada http://es.wikipedia.org 159 de 3. Resultados Resultados Resultados 3.1. Búsqueda de marcadores en el fluido pleural 3.1.1. Depleción de las proteínas abundantes del fluido pleural Para conseguir la depleción de las seis proteínas mayoritarias del fluido se procesaron los fluidos pleurales de 4 pacientes con DPB tuberculoso y de 4 pacientes con DPM derivado de adenocarcinoma pulmonar, empleando una columna de afinidad múltiple (Hu-6) específica para la eliminación de las proteínas mayoritarias del suero humano: albúmina, haptoglobina, Ig G e Ig A, antitripsina y transferrina. Posteriormente se determinó la concentración de proteínas en todas las muestras antes de su procesamiento. Esto se hizo para realizar un correcto ajuste del límite real de saturación de la columna, puesto que en todos los casos se comprobó que, al emplearse una concentración de proteínas elevada, aún en el rango de separación establecido por la casa comercial la retención de las proteínas mayoritarias no era 100 % eficaz. Como se muestra en la tabla 9, este método es capaz de eliminar más del 90 % del contenido proteico del fluido, con una media de recuperación de proteínas minoritarias del 8,4 %. En la tabla se observa además que la concentración media de proteínas en las muestras de fluido pleural crudo es ligeramente superior en las muestras derivadas de tumor que en las benignas. Sin embargo, el análisis en conjunto de la concentración de las muestras no ha revelado la existencia de diferencias 163 Resultados significativas en la concentración entre cada una de ellas (p = 0,386 para el contraste de medias con la prueba U de Mann-Whitney). La comparación de datos de la concentración de proteínas de la fracción retenida de todas las muestras entre ambos tipos patológicos, tampoco demostró la existencia de diferencias significativas (p = 0,564), ni entre las muestras de la fracción eluida (p = 0,127). Tabla 9. Cantidad de proteína (mg) en DPM y DPB. DPM Inicial Fracción eluida Fracción retenida (Media ± DS) (Media ± DS) (Media ± DS) 4,45 ± 0.48 0,44 ± 0,03 (9,8 %) 3,12 ± 0,81 (70,0 %) 4,13 ± 0.38 0,63 ± 0,32 (15,3 %) 2,94 ± 0,65 (71,2 %) (n=4) DPB (n=4) DPM: derrame pleural maligno, DPB: derrame pleural benigno, de pacientes con CPNM y tuberculosis, respectivamente. Antes y después de la depleción mediante la columna Hu6. El porcentaje del total de proteínas se muestra entre paréntesis. DS: desviación estándar. 3.1.2. Eficacia del prefraccionamiento del fluido pleural Para poder evaluar la eficacia del funcionamiento de la depleción de las 6 proteínas más abundantes, las muestras de fluido pleural, tanto antes como después de la depleción, se separaron mediante métodos electroforéticos. En primer lugar se resolvieron 10 µg de proteína de muestras de la fracción cruda del líquido pleural, de la fracción retenida en la columna, y de la fracción eluida (donde se localizan las proteínas minoritarias). En la figura 23 se muestra un gel SDS-PAGE teñido con azul brillante de Coomassie. 164 Resultados Como podemos observar, en los dos carriles cargados con fluido pleural crudo (carriles 1 y 4) aparece una banda más intensa entre las masas moleculares de 60 y 65 kDa, que se corresponde con la proteína albúmina. Esta proteína aparece también en los dos carriles de la fracción retenida (carriles 2 y 5) pero, sin embargo, apenas se observa en la fracción eluida (carriles 3 y 6), lo que confirma una buena separación cromatográfica. Figura 23. Separación mediante SDS-PAGE de 10 μg de fluido pleural crudo (carriles 1 y 4), de la fracción retenida en la columna Hu-6 (carriles 2 y 5), y de la fracción eluida (carriles 3 y 6). LMW: proteínas marcadoras de masa molecular; DPM: derrame pleural maligno; DPB: derrame pleural benigno. El mismo patrón se observa en las masas de aproximadamente 22 - 30 kDa y sobre 50 kDa, que se aprecian claramente en las fracciones cruda y retenida, y en menor medida en la fracción eluida. Estos valores de masa se corresponden con el Mr aproximado de las cadenas ligeras y pesadas de las Ig A e Ig G, que constituyen el segundo elemento más abundante (20 - 25 %) del fluido pleural, tras la albúmina. Estos patrones fueron observados en todas las muestras procedentes de pacientes con patología benigna y pacientes con patología maligna. 165 Resultados 3.1.3. Obtención de mapas proteicos bidimensionales del fluido pleural 3.1.3.1. Optimización del método Para la comprobación de la distribución proteica en mapas bidimensionales, se resolvieron 150 µg de proteína en tiras de IPG de 17 cm con un gradiente de pH de 3 a 10 y de 4 a 7, utilizando geles de poliacrilamida al 12 % en la segunda dimensión, que fueron posteriormente teñidos con nitrato de plata. Como se observa en la figura 24, la mayoría de las proteínas estaban localizadas en torno a un rango de pH de 4-7, puesto que los rangos 3-4 y 7-10 no presentaban un número elevado de spots susceptibles de análisis. Por ello, para ampliar la resolución de la muestra en el eje del pI, se escogió el rango de pH 4-7 para los análisis posteriores. Figura 24. Mapas 2D obtenidos a partir de la fracción eluida en la cromatografía HU-6 de muestras de DPM, resueltas en rangos de pH de 4-7 (izquierda) y de 3-10 (derecha). Mr: masa molecular relativa; pI: punto isoeléctrico. 166 Resultados 3.1.3.2. Efecto del prefraccionamiento mediante Hu-6 sobre el patrón bidimensional de proteínas de fluido pleural humano La optimización de la 2-DE nos permitió evaluar el efecto del prefraccionamiento de la columna Hu-6 sobre los geles bidimensionales de las proteínas del líquido pleural. En la figura 25 podemos observar los tres geles 2D correspondientes a un paciente con DPB, en los que se separaron 100 µg de proteína usando tiras IPG de pH 4-7. La disminución en la carga de proteínas junto con el empleo de un rango de pH adecuado, mejoró la resolución total, tanto del fluido pleural crudo como de las dos fracciones cromatográficas. Figura 25. Mapas representativos de la separación de una muestra de fluido pleural total, y de las fracciones obtenidas mediante cromatografía de afinidad de un paciente con DPM. En los mapas se han señalado las proteínas que son retenidas por la columna. Los recuadros correspondientes a cada proteína se han ampliado en la figura 26. pI: punto isoeléctrico. Como podemos observar en la figura 25, la fracción de muestra total presenta una gran cantidad de proteínas abundantes que impiden la visualización de las proteínas minoritarias existentes en la misma. Al 167 Resultados igual que ocurría con la separación mediante SDS-PAGE, se observó la presencia de albúmina, Ig G, Ig A, haptoglobina, antitripsina y transferrina en la fracción cruda y en la retenida, y su ausencia o disminución en la fracción eluida. En este caso la mejoría es más evidente debido al empleo de una tinción con nitrato de plata, 100 veces más sensible que el azul brillante de Coomassie empleado en los geles 1D (Görg et al., 2004; Vercauteren et al., 2007). Como era de esperar, tras el prefraccionamiento se comprobó que la fracción eluida presentaba una mejor resolución en los geles 2D que las fracciones cruda y retenida. Para facilitar la visualización de la mejora producida tras la cromatografía, en la figura 26 se muestran ampliadas las áreas de los mapas donde se localizan las proteínas abundantes. Figura 26. Ampliación de las zonas de la figura 25 correspondientes a cada una de las proteínas retenidas por la columna, donde se pueden observar manchas proteicas no visibles en el fluido pleural crudo o en la fracción retenida, pero sí en la fracción eluida. 168 Resultados 3.1.4. Comparación del proteoma del derrame pleural de pacientes con patologías malignas y benignas Las muestras de DP eluido de 4 pacientes con DPB tipo tuberculoso y 4 pacientes con DPM derivado de carcinoma de tipo epitelial fueron comparadas mediante la metodología DIGE. Todas las muestras fueron procesadas y resueltas como se detalla en el apartado 2.9. del capítulo anterior, obteniéndose mapas proteicos de la fracción eluida de DPB y de DPM, todos ellos marcados con los fluoróforos Cy3 y Cy5, y mapas proteicos del estándar interno empleado que fue marcado con el fluoróforo Cy2. En la figuras 27 y 28 se muestran mapas representativos de los resultados obtenidos tras el marcaje, y de los diferentes tipos de escaneados realizados a los geles. Figura 27. De izquierda a derecha, mapas representativos para una muestra del estándar interno, una muestra de un paciente con DPM y una muestra de un paciente con DPB. Las tres muestras fueron resueltas en el mismo gel. En función de la longitud de onda de excitación y emisión empleada, solamente se aprecian las proteínas marcadas con el fluoróforo correspondiente. 169 Resultados Figura 28. Imágenes de los cuatro geles DIGE donde se puede observar la emisión de fluorescencia de cada una de las muestras. En todos los geles, el estándar interno está marcado con Cy2, que emite en la longitud de onda del verde. En los geles 1 y 2 las muestras de DPB emiten en la longitud de onda del naranja mientras que las de DPM emiten en la del rojo. En los geles 3 y 4 las muestras DPM emiten en la longitud de onda de naranja, y las muestras DPB en la longitud de onda del rojo. Un primer paso en este método consistió en la comparación de cada una de las muestras con el estándar interno resuelto en el mismo gel pero marcado con fluoróforos diferentes. Así se detectaron las manchas proteicas (a partir de ahora denominadas spot), se eliminó el fondo de la imagen, y se normalizaron los valores de intensidad de cada spot. Estos datos fueron expresados en volumen relativo (intensidad por el área del spot) y relativizados al volumen del spot correspondiente en el estándar interno del mismo gel. El número promedio de spots detectado inicialmente en el conjunto total de mapas fue de 1681. En uno de los grupos de geles (compuesto por dos muestras y el estándar) aparecían 2.108 especies proteicas, en el segundo grupo 1.619, en el tercer grupo 1.413, y en el cuarto 1.587. De todos los spots detectados, solo 974 aparecían en todos los geles, y esta cantidad sería la empleada para realizar los análisis estadísticos. El análisis de la suma total de los volúmenes normalizados de todas las especies proteicas detectadas en los mapas pertenecientes a pacientes con patologías malignas presenta un valor mayor que el detectado en pacientes con patologías benignas (14.872 frente a 13.436). 170 Resultados Sin embargo, el análisis estadístico de este resultado no reveló la existencia de diferencias significativas (p = 0,114) entre los volúmenes normalizados de ambas patologías. En lo referente al volumen normalizado de cada especie proteica, el test U de Mann-Whitney mostró que únicamente 41 de los 974 spots mostraban diferencias significativas (p = 0,021) en su expresión entre las muestras eluidas de pacientes con DPM y DPB (tabla 10): 25 de ellos presentaban un incremento en su expresión en los pacientes con DPM, mientras que 16 mostraban un descenso. Tabla 10. Spots que presentaron variaciones significativas al comparar la expresión proteica entre fluido pleural de pacientes con tuberculosis y fluido pleural de pacientes con CPNM. Spot Volumen normalizado DPM Media ± DS Volumen normalizado DPB Media ± DS Cociente DPM/DPB 695 0,62 ± 0,26 1,24 ± 0,14 0,50 708 1,19 ± 0,21 0,79 ± 0,09 1,49 727 0,61 ± 0,24 1,21 ± 0,16 0,50 872 0,79 ± 0,11 0,54 ± 0,07 1,46 877 1,17 ± 0,44 0,67 ± 0,10 1,74 896 1,14 ± 0,49 0,62 ± 0,09 1,84 905 1,10 ± 0,31 0,65 ± 0,12 1,69 921 1,03 ± 0,20 0,70 ± 0,15 1,47 967 1,20 ± 0,50 0,41 ± 0,15 2,91 1126 1,39 ± 0,32 0,71 ± 0,13 1,96 1167 0,44 ± 0,28 1,61 ± 0,23 0,27 1184 0,49 ± 0,28 1,50 ± 0,24 0,33 1193 0,38 ± 0,27 1,60 ± 0,23 0,24 1247 1,76 ± 1,04 0,64 ± 0,19 2,74 1277 1,40 ± 0,50 0,50 ± 0,11 2,83 1280 1,07 ± 0,10 0,66 ± 0,14 1,61 1348 1,41 ± 0,45 0,42 ± 0,10 3,36 1354 1,26 ± 0,23 0,51 ± 0,09 2,46 1365 1,17 ± 0,34 0,63 ± 0,16 1,86 171 Resultados Spot Volumen normalizado DPM Media ± SD Volumen normalizado DPB Media ± SD Cociente DPM/DPB 1377 1,13 ± 0,27 0,75 ± 0,07 1,51 1619 0,59 ± 0,22 1,31 ± 0,38 0,45 1626 0,35 ± 0,09 1,57 ± 0,34 0,22 1707 1,27 ± 0,23 0,89 ± 0,21 1,42 1756 1,31 ± 0,33 0,51 ± 0,10 2,57 1921 1,82 ± 1,03 0,37 ± 0,03 4,92 1945 1,33 ± 0,17 0,68 ± 0,20 1,96 1987 1,87 ± 0,71 0,61 ± 0,12 3,08 2084 1,52 ± 0,63 0,55 ± 0,13 2,76 2154 1,24 ± 0,30 0,53 ± 0,18 2,34 2209 1,25 ± 0,24 0,56 ± 0,09 2,24 2211 0,49 ± 0,19 1,35 ± 0,19 0,36 2214 0,43 ± 0,13 1,52 ± 0,44 0,27 2231 0,27 ± 0,23 1,96 ± 0,66 0,19 2234 0,48 ± 0,25 1,45 ± 0,47 0,33 2239 0,34 ± 0,14 1,50 ± 0,50 0,36 2240 0,39 ± 0,26 1,37 ± 0,52 0,29 2331 0,27 ± 0,23 1,96 ± 0,61 0,14 2332 1,32 ± 0,37 0,45 ± 0,02 2,97 2414 0,28 ± 0,12 1,88 ± 0,88 0,15 2416 0,21 ± 0,05 1,98 ± 0,86 0,11 2511 1,54 ± 0,33 0,38 ± 0,11 4,05 Media: media del volumen relativo normalizado respecto al estándar interno correspondiente; DS: Desviación estándar; DPB: derrame pleural benigno; DPM: derrame pleural maligno. A partir de dos geles promedio se realizaron representaciones 3D donde se pueden apreciar los cambios en el volumen para cada uno de los spots con diferencias significativas (figura 29). 172 Resultados Figura 29. Representación 3D de los spots que presentaron variaciones significativas al comparar la expresión proteica entre el fluido pleural de pacientes con DPB y el fluido pleural de pacientes con DPM. En cada cuadro se muestra una vista en 3D de un spot de un paciente con patología maligna (izquierda), el número de spot, y la vista 3D de un spot correspondiente a un paciente con patología benigna (derecha). 173 Resultados 3.1.4.1. Análisis de Componentes principales Cuando recogemos la información de una muestra de datos, lo más frecuente es tomar el mayor número posible de variables (en nuestro caso spots). Sin embargo, si tomamos demasiadas variables tendremos que tener en cuenta múltiples coeficientes de correlación, siendo difícil poder visualizar relaciones entre las variables. Además, si se toman muchas variables, lo normal es que estas estén relacionadas o que midan lo mismo bajo distintos puntos de vista. Por eso es necesario intentar reducir el número de variables a analizar siempre que sea posible. Las relaciones que se presentan entre x variables correlacionadas (que miden información común) pueden transformarse en otro conjunto de nuevas variables, no correlacionadas entre sí, llamado conjunto de CPs de tal manera que la varianza biológica de los datos se reduzca a unos pocos CPs que sean capaces de explicar la mayor parte de la varianza observada. Las nuevas variables son combinaciones lineales de las anteriores y se van construyendo según el orden de importancia en cuanto a la variabilidad total que se recoge de la muestra. Cuando la correlación de algunas variables con la CP1 es > 0,8 se dice que estas variables “saturan” en el CP1, porque constituyen un grupo diferenciado de variables dentro de la matriz de correlaciones. El CP1 tiene, por lo tanto, la varianza máxima y los componentes sucesivos explican progresivamente proporciones menores de la varianza. En nuestro estudio, se realizó el ACP, en primer lugar con los datos del volumen relativo normalizado de todos los spots presentes en los cuatro geles (974 spots). En este análisis se consiguió reducir la varianza biológica de los datos originales a 7 CPs, que explicaron el 100 % de la variabilidad entre DPM y DPB (tabla 11). 174 Resultados Aplicando la prueba no paramétrica de comparación de medias U de Mann-Whitney a los CPs originados en el análisis, entre los tres primeros CPs que explicaban el 69 % de las diferencias entre los grupos se comprobó que solo el CP2 era estadísticamente significativo (p = 0,021) y era el responsable de un 24,3 % de la varianza. Tabla 11. Componentes obtenidos en el ACP utilizando los datos de los 974 spots presentes en los cuatro geles analizados por el método DIGE. Componente principal 1 Total 278,99 Autovalores iniciales % de la varianza 28,64 % acumulado 28,64 2 236,67 24,30 52,94 3 155,12 15,93 68,87 4 96,79 9,94 78,81 5 91,64 9,41 88,22 6 63,53 6,52 94,74 7 51,16 5,26 100,00 Total: valor absoluto o autovalor de cada componente principal. Figura 30. Representaciones gráficas en 2D (izquierda) y 3D (derecha) de los CPs más significativos obtenidos tras el ACP de los 974 spots. En el gráfico en 2D se representan los dos primeros CPs. En el gráfico en 3D se presentan los tres primeros CPs, de los cuales sólo el CP2 presentó diferencias significativas al analizarlo mediante la prueba de la U de Mann-Whitney. CP: componente principal; DPB: derrame pleural benigno; DPM: derrame pleural maligno. 175 Resultados En la figura 30 se muestran representaciones 2D y 3D de los resultados obtenidos en el ACP, donde pueden observarse las diferencias existentes entre el grupo de pacientes con enfermedad maligna y el de pacientes con enfermedad benigna. En el gráfico 2D se observa más claramente cómo las muestras de DPB presentaron valores positivos para el CP2, mientras que los DPM presentaron valores negativos. Este CP2, como se puede apreciar en la figura 30, es el factor que permite una separación efectiva de las muestras en función del grupo al que pertenecen. Este mismo análisis multivariante se llevó a cabo con los volúmenes relativos estandarizados de los 41 spots que presentaron diferencias significativas al estudiarlos estadísticamente con la prueba U de Mann-Whitney. En este caso, se encontró también una reducción de la variabilidad biológica a 7 CPs, capaces de explicar el 100 % de la varianza entre grupos (tabla 12). Tabla 12. Componentes obtenidos en el ACP utilizando los datos de los 41 spots que presentaban variaciones significativas al comparar su expresión entre el fluido pleural benigno y el fluido pleural maligno. Autovalores iniciales Componente principal 1 2 3 4 5 6 7 Total % de la varianza % acumulado 32,73 6,16 2,35 1,81 0,91 0,61 0,43 72,73 13,70 5,22 4,01 2,03 1,36 0,96 72,73 86,43 91,65 95,66 97,69 99,04 100,00 Total: valor absoluto o autovalor de cada componente principal. Tras la aplicación de la prueba U de Mann-Whitney a los CPs extraídos de este nuevo análisis, se comprobó que el CP1 era significativo (p = 0,021) y explicaba aproximadamente el 73 % de la varianza entre los 176 Resultados grupos. Una vez representados gráficamente los tres primeros CPs (figura 31), se observa que las muestras de DPB presentaron valores negativos para el CP1, mientras que las muestras de DPM presentaron valores positivos, de modo que el CP1 era capaz de separar de una manera efectiva los dos grupos estudiados en este análisis, al igual que ocurría en el caso anterior. Figura 31. Representaciones gráficas en 2D (izquierda) y 3D (derecha) del CP1 junto con los otros CPs capaces de explicar la mayor variabilidad (CP2 y CP3), obtenidos tras analizar los 41 spots que presentaron variaciones significativas. CP: componente principal; DPB: derrame pleural benigno; DPM: derrame pleural maligno. 3.1.5. Identificación de proteínas con expresión diferencial en el DP de pacientes con patologías malignas y benignas Los 41 spots que mostraban niveles significativamente diferentes entre las muestras eluidas de pacientes con patología maligna y pacientes con patología benigna fueron sometidos a identificación mediante MS (Figura 32). 177 Resultados Figura 32. Mapa representativo de un gel resultante de la metodología DIGE donde se resaltan las manchas proteicas que fueron analizadas mediante MS. Con este fin se realizaron geles 2D preparativos (con mayor cantidad de proteína) de una muestra estándar que contenía las 8 muestras empleadas para el DIGE. En la figura 12 se muestra un mapa 2D analítico y el mapa preparativo equivalente, donde la cantidad de proteína empleada fue cuatro veces mayor (Figura 33). Figura 33. Geles representativos de fluido pleural obtenidos con fin analítico (izquierda) y preparativo (derecha). Los spots seleccionados fueron extraídos del gel preparativo y digeridos con tripsina. Los péptidos trípticos se analizaron a través de 178 Resultados MALDI-TOF, y en los casos en los que existía una cantidad de proteína suficiente (obteniéndose señal de iones peptídicos) pero no una identificación, las muestras se analizaron mediante MS/MS, y los espectros resultantes fueron contrastados con la base de datos SwissProt. En algunos casos, los spots no pudieron ser identificados debido a la poca cantidad de proteína presente en el gel. En la tabla 13 se muestran las identidades de las proteínas resueltas. Tabla 13. Identidad de las proteínas analizadas mediante MS. Spot DPM DPB DPM Volumen Volumen / normalizado normalizado DPB Media ± SD Media ± SD Identidad Nº acceso SwissProt Función Respuesta inmunitaria Movimiento celular Coagulación 695 0,62 ± 0,26 1,24±0,14 0,50 Complemento C3 P01024 708 1,19 ± 0,21 0,79±0,09 1,49 Gelsolina P06396 727 0,61 ± 0,24 1,21±0,16 0,50 Cadena β del fibrinógeno P02679 872 0,79 ± 0,11 0,54±0,07 1,46 Complemento C3 P01024 Respuesta inmunitaria 877 1,17 ± 0,44 0,67±0,10 1,74 α 1-B-glicoproteína P04217 Respuesta inmunitaria 896 1,14 ± 0,49 0,62±0,09 1,84 Hemopexina P02790 Homeostasis 905 1,10 ± 0,31 0,65±0,12 1,69 Hemopexina P02790 Homeostasis 921 1,03 ± 0,20 0,70±0,15 1,47 Hemopexina P02790 Homeostasis 967 1,20 ± 0,50 0,41±0,15 2,91 Albumina P02768 Homeostasis 1126 1,39 ± 0,32 0,71±0,13 1,96 Factor derivado del epitelio pigmentado P36955 Antiangiogénico 1167 0,44 ± 0,28 1,61±0,23 0,27 Cadena β del fibrinógeno P02675 Coagulación 1184 0,49 ± 0,28 1,50±0,24 0,33 Región C de la cadena 1 de la Ig-γ P01857 Respuesta inmunitaria 1193 0,38 ± 0,27 1,60±0,23 0,24 Cadena β del fibrinógeno P02675 Coagulación 1277 1,40 ± 0,50 0,50±0,11 2,83 Hemopexina P02790 Homeostasis 1280 1,07 ± 0,10 0,66±0,14 1,61 Hemopexina P02790 Homeostasis 179 Resultados Tabla 13. Identidad de las proteínas analizadas mediante MS (Continuación). Spot DPB DPM DPM Volumen Volumen normalizado normalizado / Media ± SD Media ± SD DPB Identidad Nº acceso Función SwissProt 1348 1,41 ± 0,45 0,42±0,10 3,36 Hemopexina P02790 Homeostasis 1354 1,26 ± 0,23 0,51±0,09 2,46 Hemopexina P02790 Homeostasis 1365 1,17 ± 0,34 0,63±0,16 1,86 Ceruloplasmina P00450 Metabolismo iónico 1377 1,13 ± 0,27 0,75 ± 0,07 1,51 Factor derivado del epitelio pigmentado P36955 Antiangiogénico 1619 0,59 ± 0,22 1,31 ± 0,38 0,45 Actina citoplásmica 1 P60709 Movimiento celular 1626 0,35 ± 0,09 1,57 ± 0,34 0,22 Actina citoplásmica 1 P60709 Movimiento celular 1707 1,27±0,23 0,89 ± 0,21 1,42 Complemento C3 P01024 Respuesta inmunitaria 1756 1,31 ± 0,33 0,51 ± 0,10 2,57 Hemopexina P02790 Homeostasis 1945 1,33 ± 0,17 0,68 ± 0,20 1,96 Complemento C3 P01024 Respuesta inmunitaria 1987 1,87 ± 0,71 0,61 ± 0,12 3,08 Inhibidor de metaloproteinasas 2 P16035 Inhibidor de metaloproteína 2084 1,52 ± 0,63 0,55 ± 0,13 2,76 Apolipoproteina A-1 P02647 Metabolismo lipídico 2154 1,24 ± 0,30 0,53 ± 0,18 2,34 Hemopexina P02790 Homeostasis 2209 1,25 ± 0,24 0,56 ± 0,09 2,24 Hemopexina P02790 Homeostasis 2211 0,49 ± 0,19 1,35 ± 0,19 0,36 Proteína sérica A4 amiloide P35542 Respuesta inmunitaria 2231 0,27 ± 0,23 1,96 ± 0,66 0,14 S 100 A9 P06702 Unión al calcio 2234 0,48 ± 0,25 1,45 ± 0,47 0,33 α-2-macroglobulina P01023 Proteasa 2239 0,34 ± 0,14 1,50 ± 0,50 0,22 Proteína sérica A4 amiloide P35542 Respuesta inmunitaria 2414 0,28 ± 0,12 1,88 ± 0,88 0,15 S100 A8 P05109 Unión al calcio 2416 0,21 ± 0,05 1,98 ± 0,86 0,11 β -2-microglobulina P61769 Respuesta inmunitaria 2511 1,54 ± 0,33 0,38 ± 0,11 4,05 Hemopexina P02790 Homeostasis DPM: Derrame pleural maligno; DPB: Derrame pleural benigno; DPM/DPB: variación encontrada entre derrames malignos y benignos; SD: desviación estándar. Fueron identificadas 35 proteínas de las 41 significativas, es decir, un 86 %. Entre las proteínas identificadas detectamos proteínas 180 Resultados relacionadas con la homeostasis (40 %), con la respuesta inmunitaria (20 %), con el movimiento celular y la coagulación (13,3 %), la unión de calcio y la angiogénesis (13,3 %) y, finalmente, con la inhibición de metaloproteinasas, el metabolismo lipídico y la actividad proteinasa (13,3 %). 3.2. Selección y caracterización bioquímica de proteínas con expresión diferencial en derrame pleural maligno y benigno De todas las proteínas identificadas que presentaban diferencias significativas en su expresión entre los pacientes con patología maligna y benigna, seleccionamos para su estudio las que por su función y por sus características parecían más interesantes como posibles candidatos a marcadores del DPM. Éstas han sido las proteínas: PEDF, y las proteínas S 100 A8 y S 100 A9. 3.2.3. Caracterización de la proteína PEDF La proteína PEDF se identificó a partir de dos spots con una Mr teórica de 51 kDa y un pI aproximado de 6 (figura 34), que presentaba una ratio de aumento de expresión de 1,51 y 1,96 veces en los mapas 2D de pacientes con patología maligna (tabla 13, Spots 1126 y 1377; apartado 3.1.5. del presente capítulo). En la figura 34 se representan las isoformas que presentaban diferencias significativas en los niveles de PEDF mediante la tecnología DIGE. Como podemos apreciar en la figura, en el caso del derrame existían dos isoformas de esta proteína cuya expresión variaba entre los pacientes con patología maligna y los pacientes con patología benigna. 181 Resultados Figura 34 Volumen relativo de los spots correspondientes a la proteína PEDF obtenidos en cada gel DIGE en relación con su volumen en el gel estándar. DPM: derrame pleural maligno; DPB: derrame pleural benigno. 3.2.1.1. Inmunodetección de la proteína PEDF mediante immunobloting Como primer paso en la detección mediante inmunoblot de la proteína PEDF, se realizó una electroforesis monodimensional, seguida de Western Blot e inmunodetección con el anticuerpo monoclonal. En esta electroforesis se cargaron muestras eluidas mediante cromatografía de afinidad múltiple (apartado 2.2.1. del capítulo anterior) y crudas (sin tratamiento previo) de una de las parejas empleadas para la tecnología DIGE, empleando dos concentraciones diferentes de proteína. El inmunoblot reveló la existencia de dos bandas de aproximadamente 50 kDa, que podían ser fácilmente detectadas cuando se separaban las muestras eluidas en geles de poliacrilamida al 12 %, no 182 Resultados siendo tan aparentes cuando la separación se realizaba con muestras crudas (figura 35). Además, el análisis de las bandas no reveló la existencia de diferencias significativas entre ambas muestras de DPB y DPM. Figura 35. Imagen representativa del inmunoblot de la proteína PEDF. Muestra eluida: fracciones eluidas de la cromatografía de afinidad múltiple HU-6. DPM: derrame pleural maligno de orígen epitelial, DPB: Derrame pleural benigno de tipo tuberculoso. Una vez obtenido este resultado el siguiente paso fue la realización de un análisis de todas las parejas de muestras empleadas para el estudio DIGE, utilizando tanto muestras crudas como muestras eluidas, de manera que se pudiese observar si en otras parejas se cumplía la misma condición que en la anterior. En el caso de las muestras crudas se observó una banda muy fuerte en torno a 48 kDa, que se correspondía con el peso molecular de la proteína PEDF (figura 36). Al realizar el mismo análisis con muestras eluidas pudimos observar una banda en torno a 50 kDa, que se correspondía con la proteína PEDF y que estaba presente en todas las muestras, que aparecía con menor intensidad de lo que ocurría con las muestras eluidas (figura 37). Figura 36. Imagen representativa del inmunoblot de la proteína PEDF en diferentes muestras con DPM y DPB, empleando muestras crudas. 183 Resultados Figura 37 Imagen representativa del inmunoblot de la proteína PEDF en diferentes muestras con DPM y DPB, empleando muestras eluidas. El estudio cuantitativo de las bandas realizado mediante el Quantity One demostró que, en general, no existían diferencias en los niveles de la proteína PEDF entre las diferentes muestras, independientemente del grupo patológico estudiado. De hecho, en el caso del inmunoblot realizado en muestras crudas, salvo en la última pareja analizada en la cual sí que existían diferencias significativas entre los resultados obtenidos, el resto de las bandas no presentaban diferencias entre las parejas estudiadas (figura 38). El análisis de la última pareja mostró un aumento significativo de la intensidad de la proteína en el paciente con patología maligna. Sin embargo, el análisis de muestras eluidas de esta misma pareja mostró niveles más bajos de intensidad para el paciente con DPM (figura 39). En el inmunoblot realizado en muestras eluidas, la pareja con mayor diferencia entre los valores de la proteína fue la pareja 3, lo que no concuerda con lo obtenido en muestras crudas; de hecho parecía haber una inversión de los resultados entre ambas. 0.12 Muestras crudas Trace RD X mm 0.1 0.08 0.06 0.04 0.02 0 DPM DPB DPM DPB DPM DPB DPM DPB Figura 38 Gráfico representativo de los valores obtenidos del análisis mediante el Quantity One del inmunoblot de la proteína PEDF en muestras crudas. 184 Resultados Muestras eluidas 0.5 Trace RD x mm 0.4 0.3 0.2 0.1 0 DPM DPB DPM DPB DPM DPB DPM DPB Figura 39. Gráfico representativo de los valores obtenidos del análisis mediante el Quantity One del inmunoblot de la proteína PEDF en muestras eluidas. 3.2.1.2. Análisis de las isoformas de la proteína PEDF El estudio de las isoformas en el fluido pleural de la proteína PEDF se llevó a cabo siguiendo el procedimiento que se describe a continuación. En primer lugar se realizó una electroforesis bidimensional en minigeles, seguida de Western Blot e inmunodetección. Figura 40. Inmunodetección de la proteína PEDF en mapas 2D. Las imágenes superiores corresponden a muestras de pacientes con DPM, mientras que las imágenes inferiores se corresponden con muestras de pacientes con DPB. Sobre cada una de las imágenes se muestra una visión 3D de las isoformas que aparecen en cada uno de los inmunoblots. 185 Resultados En la figura 40 se muestra la detección con el anticuerpo monoclonal de ratón anti PEDF humano, donde se aprecian los spots de la proteína PEDF en las muestras eluidas de pacientes con DPM y DPB sometidos a 2D-PAGE y Western Blot. El análisis de esta proteína nos permitió la detección de más de 12 isoformas en cada uno de los casos, y en la mayoría de las membranas analizadas aparecieron duplicados o triplicados de los spots entre los que no había ni una unidad de pH de diferencia entre ambos (figura 41). Esto nos serviría para explicar por qué mediante la tecnología DIGE aparecían dos spots con puntos isoeléctricos diferentes, en los cuales aparecía identificada la misma proteína, el PEDF. Figura 41. Inmunodetección de la proteína PEDF en mapas 2D mediante el anticuerpo monoclonal human anti-mouse PEDF protein en el que se muestran los diferentes spots que aparecen en cada uno de los inmunoblots. Cada spot de PEDF resuelto en los inmunoblots 2D mostró diferente variación en los pares maligno-benigno (figura 42). Se puede observar que la mayor parte de las isoformas aparecen incrementadas en pacientes con patología maligna, y que la variación media global en todo el conjunto de spots fue de un aumento de 1,3 en el caso de los pacientes con DPM. Sin embargo se encontraron isoformas con un aumento de expresión que mostraban una variación de 2,8 veces, mientras que otros de los spots mostraban un cambio de 1,8 veces. 186 Resultados Cantidad normalizada 2500 2000 1500 1000 500 0 E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 Spot Figura 42. Inmunodetección de la proteína PEDF en mapas 2D en el que se muestran los diferentes spots que aparecen en cada uno de los inmunoblots y gráfico representativo de la cantidad normalizada de proteína existente en cada spot. 3.2.2. Validación de la proteína PEDF como marcador de DPM A pesar de que la proteína PEDF presentaba múltiples isoformas, se realizó el estudio de la valoración de esta proteína mediante un ELISA comercial capaz de detectar todas las isoformas posibles de esta proteína. 3.2.2.1. Valoración de los niveles de la proteína PEDF en el derrame pleural En este estudio se incluyeron un total de 52 pacientes diagnosticados de DP. De acuerdo con los criterios de diagnóstico que se describen en el apartado 2.7.2. del capítulo anterior, los pacientes se agruparon para el análisis estadístico como se resume en la tabla 14. En esta cohorte, el grupo formado por pacientes con DPM se correspondió con 22 pacientes que presentaban CPNM, mientras que el grupo formado por pacientes con patologías benignas estaba compuesto por 30 pacientes, en el que la mayoría de ellos padecían tuberculosis (27 pacientes), aunque también había 2 pacientes que presentan DP paraneumónico y 1 paciente con DP de tipo idiopático. 187 Resultados Tabla 14. Comparación de los niveles de PEDF en DPM y DPB. Origen del derrame Nº de pacientes PEDF, µg/mL Media ± DS (Rango) Valor de p DPM CPNM 22 DPB Tuberculoso 4,59 ± 1,69 (1,95 – 7,37) a 27 4,15 ± 1,41 (1,18 – 6,43) Paraneumónico 2 2,34 ± 0,25 (2,16 – 2,52) Idiopático 1 2,62 0,166 DPM: derrame pleural maligno; CPNM: cáncer de pulmón no microcítico; DPB: derrame pleural benigno; DS: desviación estándar aP < ,166 entre DPM y DPB. Usando la metodología específica de ELISA, se determinó la concentración de la proteína PEDF (µg/mL) en los diferentes grupos estudiados, mostrándose los resultados en la tabla 14, donde el nivel medio de PEDF en el grupo de pacientes con patología maligna fue de 4,59 µg/mL, ligeramente superior al de los pacientes con patologías benignas, 3,97 µg/mL, lo que confirma los resultados proteómicos obtenidos en los estudios anteriores, en los que encontrábamos un ligero incremento de los valores de este marcador en los pacientes con patología maligna. Sin embargo, esta diferencia no alcanza una significación estadística (p < 0,166). Puesto que no hay diferencias entre la patología benigna y maligna, no se realizaron pruebas adicionales para ver si existían diferencias en la concentración de esta proteína entre las diferentes patologías estudiadas. 188 Resultados 3.2.2.2. Parámetros diagnósticos del PEDF como marcador del derrame pleural maligno Como era de esperar a partir de los resultados descritos, el rendimiento diagnóstico de los niveles de PEDF en los pacientes no demostró ser de utilidad en la discriminación del orígen del DPM. El área bajo la curva ROC fue de 0,68 (IC del 95 %) (figura 43). Para un punto de corte establecido de 4,25 µg/mL, puesto que era el que proporcionaba la más alta precisión, se obtuvieron los parámetros de sensibilidad y especificidad, de 59,09 % y 63,33 %, respectivamente. Los valores predictivos positivos y negativos, LR positivos y negativos, y eficiencia diagnóstica, se muestran en la tabla 15, aunque como se puede apreciar no son unos datos aceptables en un buen candidato a marcador del DPM. Figura 43. A la izquierda diagrama de cajas de todos los valores de PEDF obtenidos en los ELISAs realizados a pacientes con patologías malignas y benignas. A la derecha curva ROC resultante del análisis de estos valores mediante el estudio estadístico pertinente. 189 Resultados Tabla 15. Sensibilidad, especificidad, valores predictivos positivo y negativo, likehood ratio positivo y negativo, y eficiencia del PEDF para clasificar entre DPM y DPB. Sensibilidad Especificidad % % Grupo y punto de corte DPM vs. DPB (95 % IC) (95 % IC) 59,09 63.33 (36,4 – 79,3) (43,9 – 80,1) VPP % 54,17 VPN % LR Positivo LR Negativo (95 % IC) (95 % IC) 67,86 1,61 Eficiencia 0,65 61,54 (1,0 – 2,5) (0,3 – 1,3) ≤ 4,25 µg/mL DPM: Derrame pleural maligno; DPB: Derrame pleural benigno; IC = intervalo de confianza; VPP: valor predictivo positivo; VPN: valor predictivo negativo; LR: likehood ratio. 3.2.2.3. Relación de los niveles de PEDF con las caracteríticas clínicas y bioquímicas de los pacientes Otro de los análisis que se realizó fue la investigación de la posible relación de los niveles de PEDF en el líquido pleural con las características clínico-patológicas de los pacientes (tabla 16). Para ello se evaluó la cantidad media y el rango de PEDF que existía en relación con cada una de las características clínicas y, mediante un test estadístico paramétrico, se evaluó si existían diferencias significativas entre dichas medidas. Los resultados mostraron que no existían diferencias entre los niveles de PEDF en relación con el género, la edad, el hábito tabáquico, o el tamaño del DP. 190 Resultados Tabla 16. Valores de la proteína PEDF en el fluido pleural en relación con las características clínico patológicas de los pacientes estudiados. Características Nº de Pacientes PEDF Media ± DS (rango) (µg/mL) Valor de p 33 19 4,15 ± 1,47 (1,18 – 7,04) 4,38 ± 1,74 (1,61 – 7,36) 0,602 25 27 3,92 ± 1,27 (1,61 – 6,43) 4,53 ± 1,76 (1,18 – 7,36) 0,164 Hábito tabáquico No-fumador Fumador y ex-fumador 21 29 4,36 ± 1,51 (1,61 – 7,01) 4,02 ± 1,54 (1,18 – 7,04) 0,435 Tamaño del DP < 1/3 > 1/3 13 39 4,07 ± 1,45 (1,95 – 6,43) 4,29 ± 1,61 (1,18 – 7,36) 0,661 Género Hombre Mujer Edad ≤ 50 > 50 DP: Derrame pleural; Nº: número; DS: Desviación estándar. 3.2.2.4. Correlación de los niveles de PEDF con otras variables clínicas para la clasificación del derrame pleural maligno Por último se analizó la existencia de relaciones entre los niveles de PEDF de muestras tanto benignas como malignas y los niveles de leucocitos, polimorfonucleados (PMN), monocitos, ADA, LDH, contenido de proteínas, glucosa y valores de pH del DP. Como se puede apreciar en la tabla 17, las correlaciones significativas se encontraron entre el PEDF y los monocitos (p = ,010), y el PEDF y los polimorfonucleares (p = ,023), ambos en el caso de los pacientes con DPM, y tanto con la metodología de correlación de la Tau de Kendall como mediante la Rho de Spearman. Estos resultados demuestran la existencia de relaciones entre los niveles de estos tipos celulares y la patología DPM, en los que la proteína PEDF también está influyendo. 191 Resultados Tabla 17. Corelación entre los niveles de PEDF con variables diagnósticas del DP. Valor de p para el PEDF (ng/ml) Tau de Kendall Rho de Spearman Todos DPM DPB Todos DPM DPB Leucocitos 0,655 0,481 0,329 0,649 0,490 0,306 PMN 0,210 0,023 0,815 0,251 0,043 0,828 Monocitos 0,151 0,010 0,815 0,178 0,021 0,828 ADA 0,859 0,575 0,536 0,858 0,518 0,522 LDH 0,692 0,809 0,502 0,758 1,000 0,666 Proteínas 0,111 0,511 0,230 0,118 0,488 0,289 Glucosa 0,517 0,910 0,401 0,479 0,916 0,381 pH 0.737 0,239 0,537 0,650 0,154 0,706 pleural maligno; DPM: Derrame DPB: Derrame pleural benigno; PMN: polimorfonucleados; ADA: Adenosina desaminasa; LDH: Lactato deshidrogenasa. 3.2.3. Caracterización de la proteína S 100 A9 La proteína S 100 A9 se identificó a partir de un spot con una Mr aproximada de 14 kDa y un pI de 9,5 (figura 44), que presentaba una ratio de descenso de expresión de 0,14 veces en los mapas 2D de pacientes con patología maligna, o lo que es lo mismo, esta proteína aparecía un 86 % más elevada en pacientes con patologías benignas (tabla 13, Spot 2231; apartado 3.1.5. del presente capítulo). 192 Resultados Figura 44. Mapa preparativo en el que aparecen marcados todos los spots que presentaban variaciones significativas entre las patologías malignas y benignas, y en el que aparece señalado el spot que se identificó como proteína S 100 A9. 3.2.3.1. Inmunodetección de la proteína S 100 A9 mediante immunobloting Con el fin de detectar la proteína S 100 A9 tanto en muestras crudas (sin haberles realizado ningún tipo de tratamiento previo) como en muestras eluidas de la cromatografía de inmunoafinidad múltiple HU6 (apartado 2.1. del capítulo anterior), se separaron diferentes cantidades de proteínas mediante SDS-PAGE y se transfirieron a membranas de PVDF mediante Western Blot. Para la inmunodetección de la proteína S 100 A9 se empleó el anticuerpo de ratón anti-S 100 A9 humano. En la figura 45 observamos que, en el caso de la muestra cruda, aparecen una serie de bandas que no se corresponden con el tamaño esperado para la proteína S 100 A9 y que podrían corresponderse con uniones inespecíficas del anticuerpo a inmunoglobulinas. 193 Resultados Figura 45. Membranas representativas de los inmunoblots obtenidos tras el análisis de diferentes diluciones de una muestra cruda (izquierda) y eluida (derecha) de un paciente con patología maligna. LMW: Marcador de peso molecular. Cuando se analizó la muestra eluida (figura 45) se observó una banda de aproximadamente 32 kDa que podría corresponderse con agregados de proteínas S 100 A9, o bien con la unión de la proteína S 100 A9 a otras proteínas de su misma familia. Para comprobar si los resultados obtenidos en lo referente al patrón de bandas se debían a la formación de complejos de unión heteromérica de esta proteína con otras de la familia de las S 100, o bien a la formación de complejos homoméricos, se realizó una separación de proteínas mediante electroforesis en condiciones no desnaturalizantes, o PAGE nativa. Tras haberse realizado la transferencia de las proteínas a una membrana de PVDF mediante Western Blot, pudimos comprobar los resultados de esta metodología mediante la inmunodetección de la proteína S 100 A9, en la que observamos que realmente se formaban varios complejos, de alto peso molecular, pero no había ninguna banda bien definida que nos caracterizase a la proteína (figura 46). Figura 46. Membrana obtenida tras el inmunoblot de diferentes diluciones de una muestra cruda. 194 Resultados En el estudio de las proteínas que presentan una gran capacidad de formar complejos homo y heteroméricos, se debe tener en cuenta que las condiciones que se tienen que emplear para separar las proteínas y poder visualizarlas deben ser más desnaturalizantes para lograrlo. Por eso decidimos probar la adición de urea a las muestras y la incubación a 100 ºC de las mismas, previa electroforesis, durante un periodo mayor de tiempo. En un primer análisis se probó la adición de urea a las muestras. La urea y la tiourea rompen los enlaces de hidrógeno y se utilizan cuando la unión de los hidrógenos ocasiona la agregación no deseada, o la formación de estructuras secundarias que afectan a la movilidad proteica. La concentración de urea típicamente más usada es 8 M. Como se puede apreciar en la figura 47, no se detectaron diferencias entre el empleo de dicho compuesto en el patrón observable de las muestras. Al igual que en la SDS-PAGE, en la 2D-PAGE también se emplea urea para la desnaturalización de las proteínas, por tanto se comprobó cuál era el resultado que se obtendría si se transferían las proteínas de una 2DPAGE a una membrana PVDF y se realizaba el inmunoblot. En este caso el resultado tampoco fue concluyente (datos no mostrados). Figura 47. Membrana obtenida tras el estudio de la adición de urea a las muestras tras la SDS-PAGE y el inmunoblot. LMW: Marcador de peso molecular. 195 Resultados Teniendo en cuenta que la urea no tenía efecto en las muestras, se decidió aplicar durante mayor tiempo una temperatura de 100 ºC a las mismas para forzar la desnaturalización de las proteínas. Utilizando estas condiciones pudimos ser capaces de detectar una banda de alrededor de 28 kDa, que se corresponde con el tamaño descrito del homodímero de la proteína S 100 A9 (figura 48). Figura 48. Membrana obtenida tras la aplicación de 100 ºC durante 30 min previa SDSPAGE. Ab: anticuerpo; LMW: Marcador de peso molecular. Una vez puesto a punto el método de detección se comprobó el resultado obtenido tras el análisis de esta proteína en las 8 muestras (4 pacientes con patologías benignas y 4 con patologías malignas) que se habían empleado para la detección de las proteínas candidatas mediante la técnica DIGE. Como se puede observar en la figura 49, los pacientes con patología benigna presentaban una banda en torno a 28 kDa que no estaba presente, a simple vista, en los carriles correspondientes a los pacientes con patologías malignas. Figura 49. Membrana obtenida tras el inmunoblot de diferentes muestras de pacientes con patología maligna y benigna. DPM: Derrame pleural maligno; DPB: Derrame pleural benigno; LMW: Marcador de peso molecular. 196 Resultados Las bandas obtenidas fueron analizadas mediante el programa Quantity One 4.4.1 (Bio-Rad), que permite la representación gráfica de su intensidad, así como el cálculo de su masa molecular (figura 50). Figura 50. Niveles de S 100 A9 en DPB y DPM. El histograma representa la intensidad de señal detectada en cada una de las bandas del inmunoblot. El gráfico de puntos muestra la separación que hay entre los pacientes con patologías benignas y malignas en cuanto a la intensidad de señal. Las diferencias de intensidad detectadas entre las muestras con patologías benignas y malignas fueron significativas (p = 0,021) al realizarle el análisis no paramétrico de igualdad de medias o test U de Mann-Whitney. Y pese a que la ratio entre la intensidad de los pacientes con patologías maligna y benigna no era exactamente igual que la obtenida mediante la metodología DIGE (tabla 18), los resultados nos permitieron concluir que la proteína sí que se expresaba de manera diferencial entre ambos tipos de muestras. 197 Resultados Tabla 18. Valores normalizados de la intensidad y volumen obtenidos mediante el inmunoblot y la metodología DIGE. Y ratio obtenida de la división de los resultados de las muestras de DPM entre DPB. Patología Inmunoblot DPM Intensidad Normalizada 1,14 DPB 5,48 DIGE Ratio DPM/DPB Volumen Normalizado 0,27 Ratio DPM/DPB 0,14 0,21 1,96 DIGE: del inglés diferencial in gel electrophoresis; DPM: derrame pleural maligno; DPB: derrame pleural benigno. 3.2.4. Validación de la proteína calprotectina como marcador de derrame pleural maligno En múltiples artículos describen la gran capacidad que tiene la proteína S 100 A9 de formar heterodímeros con la proteína S 100 A8, originando un dímero que se conoce con el nombre de Calprotectina. Debido a que en nuestro estudio ambas proteínas se expresaban con una disminución estadísticamente significativa entre las dos patologías estudiadas, nos pareció interesante validar la concentración de este heterodímero en lugar de realizar un estudio por separado de ambas proteínas. 3.2.4.1. Valoración de los niveles de la proteína calprotectina en el derrame pleural Se valoraron 67 muestras de DPM y 89 de DPB con diferentes patologías, que fueron clasificadas en diferentes grupos en función de la etiología del derrame que presentaban. En la tabla 19 se representa el número de pacientes de cada uno de los grupos patológicos empleados, así como cada una de las etiologías del derrame a las que se correspondía cada uno de los pacientes. También aparece el género, y la media y rango de edades de estos pacientes. 198 Resultados Tabla 19. Pacientes incluidos en el estudio de valoración de los niveles de calprotectina en derrame pleural Origen del DP DPM Neoplasias de origen epitelial CPNM Cáncer de mama CPM Cáncer ovárico Neoplasia epitelial tímica Cáncer gástrico Colangiocarcinoma Mesotelioma Linfoma DPB Tuberculosis Paraneumónico Miscelánea Post-quirúrgicos Quilotórax Secundario a enfermedades vasculares tipo colagenosis Secundario a fármacos Síndrome de Dressler Pleuritis urémica Post-traumáticos Síndrome de hiperestimulación ovárica Paramalignos No neoplásicos de origen desconocido No. de Pacientes No. Hombres/Mujeres Edad, años Media (Rango) 67 42/25 67 (20-91) 58 42 6 3 2 2 2 1 6 32/26 31/11 0/6 2/1 0/2 0/2 0/2 1/0 5/1 68 68 63 75 82 69 73 (34-91) (37-91) (34-75) (66-76) (79-85) (65-73) (60-83) 61 67 (57-87) 3 3/0 55 (20-79) 89 61/28 53 (20-96) 30 29 12 3 2 2 20/10 22/7 8/4 2/1 2/0 2/0 44 (20 -96) 55 (26 – 89) 57 (24 – 83) 64 (53-74) 62 (54-70) 48 (37-59) 1 1 1 1 1 1/0 1/0 0/1 0/1 0/1 24 80 45 83 34 3 15 2/1 10/5 65 (40 – 81) 62 (37 - 85) DPM: derrame pleural maligno; DPB: derrame pleural benigno; No: Número; CPNM: Cáncer de pulmón no microcítico; CPM: Cáncer de pulmón microcítico. El análisis de los resultados del ELISA demostró la existencia de diferencias significativas (p < ,001) en la concentración ente patologías malignas y benignas (tabla 20). De hecho, los pacientes con patologías malignas presentaban una media en la concentración de la proteína 199 Resultados calprotectina de 257,2 ng/mL, mientras que en los pacientes con patologías benignas la media era diez veces mayor: 2.627,1 ng/mL. Sin embargo, estos valores fluctuaban en función del tipo de patología del que se estuviese hablando, existiendo diferencias significativas entre los distintos grupos estudiados. Por ejemplo en el caso de los DPM de tipo epitelial y los DPM de tipo mesotelioma (238.7 ng/mL vs 435.8 ng/mL, p < ,03), cuyas diferencias entre grupos eran significativas. En la tabla 20 se muestran estos resultados de las diferencias existentes entre grupos. En el caso de los pacientes con patologías benignas también existían diferencias significativas al considerar los distintos subgrupos (p < ,01). Las comparaciones entre grupos muestran que los niveles de la proteína calprotectina en pacientes con DPB tipo tuberculoso (2.982,3 ng/mL) fueron significativamente mayores (p < ,01) que en los pacientes que se clasificaron como miscelánea (1.654,8 ng/mL), paramalignos (1.316,9 ng/mL; p < ,054), o no neoplásicos de origen desconocido (1.234,1 ng/mL; p < ,01). Además, aquellos pacientes aquejados de DPB tipo paraneumónico también expresaron elevados niveles de calprotectina (3.517,9 ng/mL). Sin embargo, estos niveles no fueron estadísticamente significativos al compararlos con el grupo de pacientes que presentaban DPB de tipo tuberculoso. A pesar de ello, si se comparaban los niveles de los pacientes con DPB paraneumónico con pacientes que presentaban patologías que estaban dentro del grupo miscelánea o no neoplásicos de origen desconocido, sí se encontraban diferencias estadísticamente significativas entre ambos grupos patológicos (p < ,02 y p < ,01, respectivamente). 200 Resultados Tabla 20. Concentración de calprotectina en muestras de derrame pleural de pacientes con patologías malignas y patologías benignas. Origen del DP DPM Neoplasias de origen epitelial CPNM Cáncer de mama CPM Cáncer ovárico Neoplasia epitelial tímica Cáncer gástrico Colangiocarcinoma Mesotelioma Linfoma DPB Tuberculosis Paraneumónicos Miscelánea Post-cirugía Quilotórax Secundario a enfermedades vasculares tipo colagenosis Secundario a fármacos Síndrome de Dressler Pleuritis Urémica Post-traumáticos Síndrome de hiperestimulación ovárica Paramalignos No neoplásicos de origen desconocido No. de pacientes Calprotectina, ng/mL Media (Rango) Valor p 67 58 42 6 3 2 2 2 1 6 3 257,2 (90,7 – 736,42)1 238,7(90,7 – 545) 2 255,4 (118 - 545) 163,6 (90,7 - 315,9) 239,5 (97,7 - 381,3) 183,8 (93,3 – 274,3) 242,9 (196,3 - 289,4) 154,1 (136,4 - 171,8) 238,6 435,8 (116,2 – 736,4) 258,8 (196,6 – 338,7) 89 30 29 12 3 2 2 2.627,1 (21 – 9.530,1) 3 2.982,3 (414,5 – 6.965,3) 4, 5, 6 3.517,9 (21 – 9.530,1) 7, 8 1.654,8 (353,2 – 5.709) 763,6 (353,2 – 1.008,1) 679,1 (522,6 – 835,5) 4.562,5 (3.415,9 – 5.709) 1 1 1 1 1 1.169,2 1.415,6 572,58 2.265,5 1.660,9 3 15 1.316,9 (241,6 – 2.236,8) 1.234,1 (172,6 – 4.494,8) .001 DPM: derrame pleural maligno; ; DPB, derrame pleural benigno. 1p < ,01 entre los grupos de DPM. 2p < ,03 frente a mesoteliomas. 3p < ,01 entre los grupos de DPB. 4p < ,01 frente a miscelánea. 5p < ,054 frente a paramalignos. 6p < ,01 frente a no neoplásicos de origen desconocido. 7p < ,02 frente a miscelánea. 8p < ,01 frente a no neoplásicos de origen desconocido. 201 Resultados 3.2.4.2. Parámetros diagnósticos de la calprotectina como marcador del derrame pleural maligno Otro de los análisis realizados ha sido la evaluación del rendimiento diagnóstico de la calprotectina en el líquido pleural de los pacientes con DPM y DPB para la determinación de la utilidad de la proteína en la diferenciación del origen del DP. Se determinó la curva ROC representando, para cada posible punto de corte, el porcentaje de verdaderos positivos (sensibilidad) frente al porcentaje de falsos positivos (100-especificidad). En la figura 51A aparece la curva ROC obtenida de los 67 pacientes con patologías malignas y los 89 con patologías benignas. El AUC de la calprotectina resultó ser de 0,963 (con un intervalo de confianza del 95 %, 0,932 - 0,994). La figura 51B representa las concentraciones individuales de calprotectina en los diferentes grupos diagnósticos estudiados. Figuras 51. Curva ROC con los valores de la calprotectina y niveles del DPM y DPB de cada patología. AUC, área bajo la curva ROC; DPM: derrame pleural maligno; DPB: derrame pleural benigno. 202 Resultados Con ayuda del perfil de la curva ROC se determinaron los dos puntos de corte más adecuados para establecer los parámetros diagnósticos del DPM de los niveles de calprotectina valorados mediante ELISA. La tabla 21 muestra la especificidad, sensibilidad, VPP, VPN, LR positivos y negativos, y los datos de eficiencia. Los resultados positivos de la proteína calprotectina se definieron como los valores por debajo o iguales a los del punto de corte, y los negativos como los resultados obtenidos por encima de ese punto de corte. Tabla 21. Puntos de corte, sensibilidad, especificidad, valores predictivos, LR positivo y negativo y eficiencia de la calprotectina para clasificar entre DPM y DPB. Grupo y punto Sensibilidad Especificidad de corte % % (95 % IC) (95 % IC) DPM vs DPB 97,01 88,76 ≤545 ng/mL (89,6-99,6) (80,3-94,5) DPM vs DPB 100 83,15 (94,6-100) (73,7-90,2) 92,54 83,33 (83,4-97,5) (65,3-94,4) DPM vs. TB 98,51 96,67 ≤612 ng/mL (92-100) (82,8-99,9) 95,52 96,55 (87,5-99,1) (82,2-99,9) TB vs subgrupoI 86,67 80 ≤1660.9 ng/mL (69,3-96,2) (61,4-92,3) ≤736.4 ng/mL DPM vs. DPB subgrupo I ≤455.4 ng/mL DPM vs Paraneumónico ≤532.5 ng/mL VPP VPN % % 86,7 97,5 81,7 100 92,5 83,3 98,5 96,7 98,5 90,3 85,7 81,2 LR LR Positivo Negativo (95 % IC) (95 % IC) 8,63 0,034 (7,9-9,4) (0,008-0,1) 5,93 (5,4-6,5) 0 5,55 0,09 (4,7-6,6) (0.03-0.3) 29,55 0,01 (27,5-31,8) (0,001-0,2) 27,7 0,05 (25,4-30,2) (0,005-0,4) 4,33 0,17 (3,5-5,4) (0,05-0,5) Eficiencia 92,3 90,4 89,7 97,9 95,8 83,3 DPM: Derrame pleural maligno; DPB: Derrame pleural benigno; DPB subgrupo I: DP miscelánea, paramalignos y no neoplásicos de origen desconocido; TB: tuberculosos; IC: intervalo de confianza; VPP: valor predictivo positivo; VPN: valor predictivo negativo; LR: likehood ratio. 203 Resultados El primer punto de corte, ≤ 545 ng/mL, fue seleccionado debido a que presentó la mayor eficiencia (92,31 %), con una sensibilidad del 97,01 % y una especificidad del 88,76 %. También se estableció un punto de corte de ≤ 736,4 ng/mL para una sensibilidad del 100 %, con una alta especificidad (83,15 %) y una eficiencia ligeramente inferior (90,38 %) a la del punto de corte anterior. Además, se analizó la capacidad de distinción de los diferentes grupos mediante el empleo de esta proteína. Se vio que este marcador mostraba la máxima eficiencia en la discriminación entre DPM y DPB de origen tuberculoso (tabla 21, figura 52 A) con una sensibilidad de 98,51 %, una especificidad de 96,67 % y una LR de positivo de 29,55 y negativo de 0,01. También discrimina con buena precisión el DPM del DPB paraneumónico, con una sensibilidad de 95,52 %, una especificidad de y 96,55 %, y con un valor de LR positivo de 27,7 y negativo de 0,05 (tabla 21, figura 52 B). Los niveles de calprotectina también eran capaces de discriminar entre los pacientes con DPM y los pacientes que presentan DPB del subgrupo I (miscelánea, paramalignos y no neoplásicos de origen desconocido), con una eficiencia del 89,69 % para el punto de corte de ≤ 455,4 ng/mL (tabla 21, figura 52C). Otra de las cuestiones importantes que planteaba esta proteína es que, empleando un punto de corte de 1.660,9 ng/mL, podíamos diferenciar entre pacientes que presentaban DPB de tipo tuberculoso y pacientes incluidos en lo que denominamos subgrupo I, con una eficiencia del 83,33 % (tabla 21, figura 52D). 204 Resultados Figura 52. Curvas ROC correspondientes a la capacidad de la calprotectina para distinguir entre diferentes subtipos de derrames. 3.2.4.3. Parámetros diagnósticos de otras variables para la clasificación del DPM En las muestras de DP en las que se determinó el valor diagnóstico de la calprotectina, se analizaron los parámetros diagnósticos de otras variables que de forma rutinaria se determinan en la práctica clínica, utilizando para ello los puntos de corte establecidos. Como podemos ver en la tabla 22, solamente la enzima ADA es capaz de 205 Resultados detectar la patología con una sensibilidad superior al 90 %. No obstante, su baja especificidad indica un elevado número de falsos positivos, lo que hace que la eficiencia de este marcador sea baja. En cuanto al resto de los marcadores, todos ellos presentan alguno de estos valores tan bajo que empeora el resultado final de eficiencia, y hace que se clasifique mal a pacientes que presentan enfermedad maligna o a pacientes que no la presentan, por lo que no se podrían considerar buenos marcadores. Tabla 22 Puntos de corte, sensibilidad, especificidad, LR positivo y negativo, y eficiencia de los leucocitos, PMN, monocitos, ADA y concentración de proteína para clasificar entre DPM y DPB. Marcador Leucocitos (L/mm3) PMN (%) (%) ADA (U/L) (g/L) de corte ≤ 1,150 ≤ 24 Monocitos Proteína Punto > 75 ≤ 37.9 ≤5 Sensibilidad Especificidad LR LR % % Positivo Negativo Eficiencia (95 % IC) (95 % IC) (95 % IC) (95 % IC) 53,13 79,07 2,54 0,59 (40,2-65,7) (69,0-87,1) (2-3,3) (0,4-1) 80,95 49,43 1.6 0,39 (69,1-89,8) (38,5-60,4) (1,3-2) (0,2-0,7) 76,56 50,57 1,55 0,46 (64,3-86,2) (39,6-61,5) (1,2-2) (0,3-0,8) 94,74 49,35 1,87 0,11 (85,4-98,9) (37,8-61) (1,5-2,4) (0,03-0,3) 58,21 65,17 1,67 0,64 (45,5-70,2) (54,3-75) (1,3-2,2) (0,4-1) 68 62,67 61,59 68,66 62,18 PMN: polimorfonucleados; ADA: Adenosina desaminasa; IC: Intervalo de confianza; LR: Likehood ratio. 3.2.4.4. Influencia de los niveles de calprotectina sobre la predicción del derrame pleural maligno Para ver si existía alguna influencia de las características clínicas, bioquímicas y de los niveles de calprotectina sobre la predicción del DPM, se necesitó acudir a métodos estadísticos de regresión logística 206 Resultados univariante (tabla 23). Los modelos de regresión nos permiten evaluar la relación entre una variable (dependiente) respecto a otras variables en conjunto (independientes). Debemos tener en cuenta que cuando la variable que hemos tenido que introducir en el modelo fue una variable categórica (de más de dos categorías), fue necesario recurrir a una serie de transformaciones para que los resultados obtenidos sobre la variable en cuestión fuesen correctos e interpretables. Usando el punto de corte más exacto (545 ng/mL), que era el que tenía una sensibilidad menor pero era capaz de diagnosticar de un modo acertado un mayor número de pacientes, se ha visto que existe una fuerte asociación de los bajos niveles de calprotectina con la probabilidad de padecer o no la patología. De hecho, los valores obtenidos en el análisis univariante demuestran que es el marcador que presenta la mayor magnitud de asociación [u Odds Ratio (OR)] de todos los estudiados (256,75, p < ,001). Este mismo análisis univariante reveló la existencia de asociaciones significativas para la edad del paciente, el consumo de tabaco, el tamaño del DP, el estado del recuento celular, la concentración de ADA, y la concentración total de proteína, lo que indica que en función de las características de los pacientes hay individuos más o menos propensos a desarrollar MPE. Cada uno de estos valores predictivos significativos fueron introducidos en un modelo multivariante de regresión logística para así poder evaluar la asociación entre los niveles bajos de calprotectina y el DPM con el ajuste de otras variables explicativas. El modelo final obtenido indica que la asociación no dependía de ninguna de las otras variables, y que los niveles de calprotectina, empleando para ello el punto de corte ≤ 545 ng/mL, se mantuvieron como un único predictor significativo del error máximo permitido, con una OR ajustada de 553,28 (p < ,001), frente a la más elevada del resto de valores predictivos, de 3.05 (p = ,62), correspondiente a la concentración de proteínas del líquido pleural (tabla 23). 207 Resultados Tabla 23. Resultados de los análisis de regresión logística univariante y multivariante de las caraceterísticas demográficas y de los marcadores seleccionados. Análisis univariante Valor Análisis multivariante Valor OR (95 % IC) de p OR (95 % IC) de p Género = Hombre 1,30 (0,66 – 2,53) ,44 ― ― Edad ≥60 4,13 (2,07 – 8,27) < ,001 1,13 (0,19 – 6,53) ,90 Tabaco 1,82 (0,93 – 3,57) ,08 1,07 (0,18 – 6,34) ,94 Neoplasia previa 1,43 (0,66 – 3,12) ,37 ― ― 2,36 (1,10 – 5,06) ,03 0,57 (0,05 – 6,04) ,64 4,28 (2,09 – 8,75) < ,001 1,51 (0,27 – 8,49) ,64 Linfocitos 75 (%) 3,34 (1,63 – 6,83) ,001 0,53 (0,06 – 5,08) ,58 Proteínas ≤5 (g/L) 2,61 (1,36-5,00) ,004 1,67 (0,31 – 8,94) ,55 ADA ≤38 (U/L) 17,54 (5,05 – 60,94) < ,001 3,18 (0,30 – 33,17) ,33 256,75 (54,32– 1213,61) < ,001 663,14 (35,37– 12433,89) < ,001 Características Tamaño del DP 1/3 Leucocitos ≤1150 (L/mm3) Calprotectina ≤545 (ng/mL) OR: odds ratio; IC: Intervalo de confianza 3.2.4.5. Comparación de la sensibilidad de la citología y la calprotectina en la detección del derrame pleural maligno De los 67 pacientes que presentaban patología maligna 34 de ellos tuvieron una citología pleural positiva en la primera toracocentesis, mientras que 33 presentaron citología negativa, y por tanto la sensibilidad resultante fue del 50,75 %. Al determinar los niveles de calprotectina en los pacientes mal clasificados por la citología la sensibilidad de la prueba fue muy alta para cualquiera de los dos puntos de corte mencionados anteriormente. Empleando el punto de corte de mayor precisión (≤ 545 ng / ml) fueron bien clasificados 31 de los 33 pacientes de cáncer con citología negativa, mejorando la sensibilidad de la citología hasta el 97 %. Y empleando el segundo punto de corte 208 Resultados propuesto, ≤ 736,42 ng/mL, se pudieron clasificar correctamente a todos los pacientes con citología negativa (100 % de sensibilidad). 3.2.4.6. Validación de los datos obtenidos. Para la validación de los resultados obtenidos en el grupo de estudio, con respecto a la capacidad diagnóstica de la calprotectina, se ha realizado un procedimiento estadístico de remuestreo denominado Análisis de validación cruzada por el método “dejando uno fuera”, en el cual se han obtenido los resultados que se observan en la figura 53 en lo referente a la curva ROC de cada uno de los análisis estadísticos realizados. Como podemos observar, los resultados obtenidos son muy similares a los conseguidos con los datos originales. Figura 53. Análisis de validación cruzada por el método “dejando uno fuera”. 209 4. Discusión Discusión Discusión Para poder realizar un correcto diagnóstico, pronóstico y monitorización de las enfermedades, uno de los métodos más usados a hoy en día es la búsqueda e identificación de tantos marcadores como sea posible. Éste es precisamente el objetivo de esta Tesis, en la que se han empleado técnicas de una de las áreas más prometedoras de la bioquímica, la proteómica, para la identificación de aquellas proteínas que presentaban expresión alterada en el DPM. En este trabajo se han utilizado metodologías como el DIGE, basado en una búsqueda sin ideas preconcebidas sobre la existencia o la identidad de los biomarcadores, que incrementa la cantidad de potenciales marcadores descubiertos en un único procedimiento experimental (Byrne et al., 2008), y técnicas como el ELISA, que permiten la detección de pequeñas diferencias en los niveles de las proteínas, no apreciables mediante otras metodologías. 4.1. Búsqueda de marcadores en el fluido pleural El DPM representa una importante fuente de morbilidad para los pacientes con cáncer. De hecho, en estudios postmorten de pacientes con enfermedades neoplásicas se ha observado que el 15 % de estos pacientes presentaban DP (Antony et al., 2000). Los DPM pueden ser originados a partir de tumores malignos primarios de la pleura, o de enfermedades malignas intratorácicas o extratorácicas subyacentes, que llegan a la cavidad pleural por vía linfática, o por diseminación contigua (Heffner, 2008). Aunque no existen estudios epidemiológicos, se ha estimado que en Estados Unidos, por 213 Discusión ejemplo, la incidencia anual de los DPM es de más de 150.000 casos, siendo el cáncer de pulmón la causa principal que ocasiona DPM, seguido del cáncer de mama (Cohen y Hossain, 1966; Jemal et al., 2006; Jemal et al., 2009; Stenbygaard et al., 1999). La enfermedad oncológica es también una de las principales causas de DP de tipo exudado; de hecho, diferentes estudios han demostrado que entre el 42 y el 77 % de los derrames exudativos son secundarios a malignidad (Valdés et al., 1996; Heffner, 2008). El espacio en el que se localiza el fluido pleural está conectado con el parénquima pulmonar, existiendo un equilibrio a nivel celular y humoral entre ambos (Jantz y Antony, 2008). En condiciones fisiológicas el líquido pleural es un ultrafiltrado del plasma, y su cuantía se estima en 0,15 mL/kg de peso para cada hemitórax (Porcel-Pérez, 2010). Por eso, cuando este balance se rompe ante la presencia de un tumor, aparece una concentración de moléculas alterada en el fluido pleural (Jantz y Antony 2008). Este fluido, además, se caracteriza por ser una muestra biológica de fácil acceso para el estudio de marcadores tumorales (Heffner, 2008; Hung et al., 2003; Ishikawa et al., 1997; Kataria y Khurshid 2001). El análisis de diferentes tipos de muestras biológicas (células tumorales, tejidos y fluidos) para la identificación de proteínas con expresión diferencial, ha sido una alternativa empleada para el descubrimiento de nuevos biomarcadores (Hanash et al., 2008). En estudios basados en técnicas proteómicas no es frecuente la utilización de fluido pleural, siendo los fluidos biológicos más usados para la búsqueda de nuevos biomarcadores el suero, el plasma, el fluido cerebroespinal y la orina (Good et al., 2007). Sin embargo, existen multitud de fluidos biológicos todavía no estudiados, como son el fluido de lavado del colon, la saliva, el fluido pleural y el lavado bronco-alveolar, el fluido sinovial, el aspirado de fluido del pezón, las lágrimas, el semen, el fluido del tracto genital femenino y el fluido amniótico, para los cuales 214 Discusión existen trabajos de caracterización puntuales, aunque todavía no existe información a gran escala como ocurre con el suero (Giusti et al., 2012; Hu et al., 2006). En la introducción de este trabajo hemos explicado los distintos tipos de marcadores tumorales existentes, aunque poco efectivos, para la detección de la patología maligna en pacientes con DP. Pese a que se sabe que los marcadores tumorales juegan un papel muy importante a la hora de dirigir al clínico hacia un diagnóstico, pronóstico o monitorización, en función de la patología que estemos estudiando, y del marcador, se obtendrán diferentes resultados. Por todo ello, uno de los retos principales a día de hoy en la investigación de cualquier patología es el hallazgo de parámetros bioquímicos que puedan llegar a convertirse en marcadores efectivos para el diagnóstico de una enfermedad. El objetivo principal de esta Tesis Doctoral es coincidente con el objetivo marcado por la comunidad científica que acabamos de mencionar, la búsqueda de nuevos marcadores tumorales en el fluido pleural que sirvan para establecer un diagnóstico certero de la existencia de la patología maligna en el DP. El hecho de que se escojan pacientes con derrame de tipo exudado es debido al hecho de que son fácilmente diferenciables de los trasudados. Sin embargo, el poder clasificar los exudados entre sí es muy difícil. Sería bueno poder clasificar a los pacientes que presentasen DPM de un modo rápido, y así se podrían empezar a aplicar las terapias correspondientes sin necesidad de que se prolongase más en el tiempo, mejorando la supervivencia de los pacientes. También es deseable buscar marcadores medibles en fluidos para evitar la aplicación de métodos diagnósticos invasivos. 215 Discusión Con este objetivo en este trabajo se han empleado metodologías proteómicas de expresión como la 2-DE y su variante DIGE, y la MS, con el fin de comparar los geles proteicos en líquido pleural de individuos con una patología benigna, como es la tuberculosis, y de pacientes con patologías malignas, y poder identificar las proteínas alteradas. Así, hemos podido detectar, e identificar, las proteínas con alteraciones en sus niveles de expresión en relación al DPM. En función de la estrategia empleada diremos que los estudios proteómicos existentes hoy en día están catalogados como top-down (de arriba a abajo) y bottom-up (de abajo a arriba). Los denominados topdown son aquellos en los que se intenta la separación del mayor número posible de proteínas intactas mediante técnicas como la 2-DE o sistemas multidimensionales y, una vez separadas las proteínas, se digieren con tripsina y se analizan los péptidos resultantes mediante técnicas como la MS para tratar de identificar las proteínas por comparación con la información existente en bases de datos (Kelleher, 2004; Wehr, 2006). La principal ventaja de este tipo de metodologías es que nos proporcionan información sobre la cantidad de proteínas y sobre su estructura (González-Buitrago et al., 2008). Esta ha sido la aproximación escogida para nuestro estudio proteómico. Sin embargo en los métodos denominados bottom-up (Wehr, 2006) las proteínas introducidas en el espectrómetro de masas generan péptidos por escisión enzimática. Aunque en este caso las proteínas se pueden separar primero por electroforesis o cromatografía no es muy normal hacerlo, puesto que únicamente contendría una muestra específica de un tipo proteico. En este tipo de experimentos una mezcla compleja de proteínas puede ser digerida inicialmente formando iones (ESI-MS). Esta metodología de ionización por electrospray puede estar acoplada a una cromatografía líquida (en línea). En este último caso, se pueden llegar a separar de miles a cientos de miles de péptidos, y por lo tanto se requiere la separación en dos o más dimensiones antes del 216 Discusión análisis cromatográfico. La identidad de la proteína original se determina por comparación de los espectros de masas con masas de péptidos teóricos calculados a partir de una base de datos proteómicos, o genómicos (Wehr, 2006). Debido a que el estudio a nivel proteómico de los fluidos biológicos es relativamente reciente, todavía existen pocos artículos donde se analice el líquido pleural con esta finalidad. Por el contrario, el proteoma mejor caracterizado es el del plasma y suero humano que contiene miles de proteínas diferentes, entre las que se encuentran aquellas que ejercen funciones específicas en la sangre y otras muchas secretadas o perdidas por las células y tejidos de todo el cuerpo. Aunque esto hace que sea una muestra ideal para la búsqueda de biomarcadores, la gran abundancia de unas pocas proteínas como la albúmina y las inmunoglobulinas hace que las proteínas de interés normalmente queden enmascaradas (González-Buitrago et al., 2008). Puesto que el fluido pleural es una muestra biológica cuyas concentraciones proteicas dependen fundamentalmente de las del suero, la gran abundancia de proteínas mayoritarias también impide la visualización de las proteínas de interés secretadas por las células tumorales, por lo que se hace necesaria una preparación previa antes de aplicar técnicas proteómicas. 4.1.1. Depleción de las proteínas más abundantes del líquido pleural De un modo similar a lo que ocurre con el suero, la investigación del contenido del DP requiere de metodologías de prefraccionamiento previo con el fin de eliminar las proteínas que presentan una alta abundancia y así evitar la interferencia que estas proteínas suelen tener con las de mayor interés biológico (Faca et al., 2007). 217 Discusión En proteómica, una de las estrategias habituales que se suele llevar a cabo para eliminar proteínas muy abundantes consiste en la realización del prefraccionamiento de la muestra, previo a la separación electroforética, con el objetivo de enriquecer las muestras en proteínas poco abundantes, difíciles de visualizar en un mapa 2D obtenido a partir de una muestra no fraccionada. De hecho, numerosos autores han desarrollado diversas técnicas de fraccionamiento, entre las que se incluyen distintos tipos de cromatografía, extracción secuencial con diversos disolventes, y precipitación selectiva, entre otras (Blonder et al., 2002; Görg et al., 2004; Molloy, 2000; Prinz et al., 2004). Otros autores como Soltermann et al. (Soltermann et al., 2008) demostraron la gran utilidad del acoplamiento de una cromatografía de manera directa a la caracterización de proteínas por MS (LC-MS/MS), y Hsieh et al. (Hsieh et al., 2006), emplearon un kit de limpieza previo de la muestra, que permitía una mejor resolución final de las proteínas. En suero se ha demostrado que la cromatografía de afinidad resulta de gran utilidad a la hora de eliminar proteínas tan abundantes como la albúmina (que constituye un 51-71 % del total de proteínas) o las inmunoglobulinas (8-26 %) (Cho et al., 2005) y, puesto que el líquido pleural presenta una composición bastante similar a la del suero, la depleción mediante cromatografía de afinidad también es un método factible en estas muestras. En nuestro cromatografía de estudio, afinidad en concreto, múltiple para se ha empleado una las seis proteínas más abundantes en suero, denominada Hu-6, que presenta anticuerpos específicos que retienen las proteínas albúmina, transferrina, Ig G, Ig A, antitripsina y haptoglobina (Pernemalm et al., 2008). Esta misma cromatografía ya se había empleado anteriormente para muestras de suero de pacientes con cáncer de próstata, donde sus autores lograron incrementar el número de spots detectados en mapas proteicos de suero 218 Discusión obtenidos mediante el empleo de la técnica 2D-DIGE, en aproximadamente un 76 % (Byrne et al., 2008). El procesamiento del fluido pleural a través de la columna Hu-6 permitió separar la muestra en dos fracciones cromatográficas. La fracción eluida, no retenida por los anticuerpos de la columna, contenía las proteínas minoritarias del DP. La fracción retenida, estaba enriquecida en las proteínas mayoritarias que se habían unido a los anticuerpos específicos. Los perfiles cromatográficos obtenidos fueron muy similares cuando se procesaron las muestras de fluido pleural de ambos tipos de pacientes (con enfermedad benigna o maligna). Debido a que el proceso cromatográfico requería el uso de disoluciones tamponadoras ricas en sales, se hizo necesaria la realización de un paso previo a la electroforesis para la eliminación de estas sales, puesto que son una de las principales interferencias en la 2DE (Herbert, 1999). Las sales afectan al comportamiento de la corriente eléctrica; de hecho, un voltaje superior a 100 V durante la rehidratación de la muestra es indicativo de que la concentración de sales es demasiado elevada (Ahmed, 2009). Los métodos de desalado, en concreto el empleado en este experimento (diálisis frente a agua ultrapura), presentan una serie de inconvenientes: al tratarse de membranas con un tamaño de poro determinado, las proteínas de baja masa molecular pueden pasar por difusión a su través; además se pueden perder proteínas por adsorción a la membrana de filtración o de diálisis (Greenlee et al., et al., 2009; Kim, 2010). Para este trabajo, se escogieron membranas con un corte de 12,000-14,000 Da, de modo que la mayoría de las proteínas que se pueden separar en la electroforesis no se perdiesen durante la diálisis. Por otro lado, cualquier manipulación de las muestras conlleva una posible desnaturalización de las proteínas. Si bien la pérdida de la conformación 3D nativa no afecta a este estudio, puesto que la 219 Discusión electroforesis se realiza en condiciones desnaturalizantes, para reducir este riesgo las muestras deben mantenerse a 4ºC durante todo el prefraccionamiento, Para comprobar la integridad de las proteínas y la eficacia del proceso cromatográfico, se realizó la separación en geles de poliacrilamida en una dimensión. En la fracción eluida observamos que no se detectan, o se detectan de forma más tenue, las bandas de albúmina y del resto de proteínas abundantes. Además, se puede observar cómo el total de bandas que se visualizan en la fracción eluida es mucho mayor que en la fracción cruda, y sobre todo que en la retenida. Por tanto, la cromatografía permitió separar las seis proteínas más abundantes del resto de la muestra, de tal manera que la fracción eluida quedó enriquecida en proteínas poco abundantes. Cuando se realizó la separación en dos dimensiones, en la cual los geles fueron teñidos con nitrato de plata, 100 veces más sensible que la tinción con Coomassie empleada en los geles 1D (Görg et al., 2004; Vercauteren et al., 2007), se pudo comprobar nuevamente la eficacia de esta cromatografía. abundantes En (albúmina, la Igs fracción A y G, retenida, las antitripsina, seis proteínas haptoglobina y transferrinas) quedaron retenidas por los anticuerpos de la columna, haciendo que las proteínas minoritarias eluyesen. Por este motivo, la fracción eluida presenta una mayor concentración de proteínas minoritarias, que es el objetivo de la cromatografía empleada. La separación cromatográfica permitía detectar más especies proteicas, al considerar la suma de spots detectados en fracción eluida y fracción retenida, con respecto a los spots detectados en el fluido pleural crudo. Esto se debe en parte a que las técnicas de prefraccionamiento permiten aumentar la muestra que se resuelve en un gel, reduciendo además en este caso el rango dinámico, ya que se elimina la albúmina (aproximadamente el 50 % de la muestra total), varias proteínas y una 220 Discusión gran cantidad de Igs. Estos hechos, además de permitir la resolución de un mayor número de proteínas, permiten visualizar proteínas de abundancia media o baja. Numerosos autores han destacado la importancia que tiene el uso de este tipo de metodología para la detección de proteínas alteradas en el plasma (Hanash et al., 2008; Lee et al., 2003; Mathivanan et al., 2010; Simpson et al., 2008). De hecho, Byrne et al. (Byrne et al., 2008) han demostrado la utilidad y eficacia de este tipo de fraccionamiento previo al análisis del total de proteínas eluidas, para la posterior identificación de marcadores tumorales del cáncer de próstata mediante 2D-DIGE y MS. Esta es una tendencia que ha sido reconocida en los estudios proteómicos, especialmente de suero, en los últimos años, ya que es esperable que las proteínas biomarcadoras sean del tipo de receptores secretados, factores de transcripción, etc., que se encuentran en baja cantidad en el suero (Pelech et al., 2003). De ahí la utilidad de la técnica descrita en los estudios proteómicos, especialmente de los realizados en suero. 4.1.2. Detección e identificación de proteínas con expresión alterada En la búsqueda e identificación de marcadores tumorales mediante herramientas proteómicas, y en concreto mediante el empleo de la 2-DE, existen varias aproximaciones técnicas posibles. Pese a las ventajas que aporta la 2-DE a la proteómica, la gran cantidad de pasos que requiere y que no son todavía susceptibles de automatización, la corriente eléctrica (cuyo comportamiento depende de la temperatura), la resistencia que genera la muestra, la cantidad de agua que pudiese haber penetrado en las tiras IPG, las características de la fuente de alimentación, etc., hacen que existan numerosos factores que afectan a 221 Discusión la reproducibilidad de la técnica. El uso de la muestra a temperaturas inadecuadas, y la adición de sustancias tamponadoras no aconsejables, hace que se produzcan modificaciones proteicas que se pueden llegar a ver reflejadas en el gel 2D (Ly y Wasinger, 2008). En nuestro estudio, y como variante a la 2-DE, se empleó la técnica DIGE con el fin de identificar marcadores tumorales por su diferente expresión en los dos grupos de muestras. Esta metodología, pese a presentar las mismas desventajas que la 2-DE, el hecho de poder resolver las muestras en un mismo gel hace que la reproducibilidad de la técnica sea mayor y por tanto reduce al mínimo los factores modificables de la técnica. Un inconveniente de este método es que no permite obtener información de las especies proteicas que están presentes sólo en una de las muestras de un grupo de pacientes, ya que el programa empleado no analiza los spots si no están presentes todas las muestras del grupo (Hegmans et al., 2007; Pernemalm et al., 2009). Se resolvieron muestras de la fracción eluida de pacientes con patologías benignas y malignas, que fueron marcadas con los fluoróforos Cy3 y Cy5, y se obtuvo un estándar interno constituido por una parte proporcional de cada una de las muestras incluidas en el mismo experimento, marcado con Cy2. El uso del marcaje con fluoróforos permitió una mayor sensibilidad en la detección de las proteínas, puesto que presenta un rango dinámico lineal de tres órdenes de magnitud, y por tanto una sensibilidad de detección mucho mayor. De hecho el rango lineal de los fluoróforos es de 105 mientras que el del nitrato de plata es de 102 (Liumbruno, 2008). El marcaje fluorescente, sin embargo, depende de la abundancia de Lysina en las proteínas, de modo que la resolución final del DIGE suele ser peor, y la automatización suele obligar a eliminar spots debido a la incertidumbre de su detección. Esto ocurre en particular con proteínas que presentan un alto contenido en carbohidratos (altamente 222 Discusión glicosiladas) si presentan un porcentaje bajo en lisinas que suelen resolverse mal en la zona de enfoque de los mapas fluorescentes (de ahí los problemas con este tipo de marcaje). En nuestro estudio, una vez adquiridas las imágenes se detectaron aproximadamente 1.600 especies proteicas presentes en cada uno de los geles. Tras el procesamiento y la normalización de los volúmenes relativos (representativos de la cantidad de proteína), se compararon los datos de cada uno de los geles con el fin de encontrar manchas proteicas similares. En el conjunto de mapas se detectaron 974 manchas proteicas comunes a todos ellos. Una vez realizada la prueba no paramétrica de comparación de medias U de Mann-Whitney, adecuada para dos muestras independientes con un tamaño muestral pequeño, se detectaron 41 manchas proteicas que presentaban una variación estadísticamente significativa con un nivel de confianza del 95 %. Desde el punto de vista estadístico debemos considerar que el análisis de un limitado número de muestras conlleva un riesgo de omisión de proteínas que podrían expresarse de manera diferencial. De todos modos, este riesgo no significa que aquellas proteínas que fueran clasificadas como significativas sean clasificadas de modo opuesto mediante la inclusión de más muestras en el estudio (Byrjalsen et al., 1999). Por otra parte, se emplearon herramientas estadísticas multivariantes para determinar la expresión diferencial de proteínas. El análisis de CP de las 974 manchas proteicas permitió reducir su variabilidad a tan solo 7 CPs, cada uno de los cuales es una función lineal de los volúmenes relativos que presentan las manchas proteicas empleadas como variables originales, que puede representar un factor que explica la variabilidad biológica. En este caso, el conjunto de los 7 CPs permite explicar el 100% de la diferencia entre los grupos de pacientes con enfermedad benigna y maligna. Para comprobar si alguno 223 Discusión de estos CPs permitía por sí solo diferenciar ambos grupos, se realizó un análisis de comparación de medias mediante la prueba U de MannWhitney, donde se detectaron diferencias significativas en el CP2, de modo que mediante la representación gráfica de los CPs se pudo establecer una asíntota que dividía los dos grupos. Sin embargo, la varianza explicada por este CP no fue muy alta (24,29 %). Debido a esto, se repitió el análisis de componentes principales, aplicándolo en este caso a los 41 spots con diferencias significativas entre los dos grupos de pacientes. Se hallaron 7 CPs, al igual que en el caso anterior, que eran capaces de explicar el 100 % de la variabilidad biológica contenida, siendo el CP1 significativo tras realizarse la prueba U de Mann-Whitney, y permitiendo separar los grupos frente a cualquiera de los CPs restantes. En este caso, la varianza explicada por este CP1 fue alta (72,73 %). La resolución y alineamiento de estos 41 spots fue comprobada de manera manual, detectándose una variación (aumento o disminución) de sus volúmenes relativos (equivalentes a sus niveles en fluido pleural) entre 1,4 y 9,5 veces en muestras de pacientes con DPM derivado de adenocarcinoma pulmonar, con respecto a enfermos con DPB tuberculoso. Las proteínas cuyos niveles presentaban diferencias significativas entre DPB y DPM fueron sometidas a un proceso de identificación por MS. Aquellas manchas proteicas cuya intensidad de tinción fue baja en los geles analíticos, reflejando por tanto una baja cantidad de proteína, no pudieron ser detectadas, por lo que se tuvo que realizar un gel preparativo con una mayor cantidad de proteína para poder extraerlas e identificarlas. A pesar de ello, algunas proteínas procesadas mediante MS no dieron lugar a suficiente cantidad de información como para permitir una correcta identificación. 224 Discusión De manera global se pudieron identificar más del 85% de las proteínas con diferencias significativas entre individuos con patología benigna y maligna. La mayoría fueron identificadas en función de su huella peptídica por MALDI-TOF, que es una de las herramientas más empleadas para la identificación de proteínas (Cañas et al., 2007; Niwa, 2008), a pesar de que existen múltiples técnicas con el mismo fin (LuqueGarcía y Neubert, 2007). Por lo tanto, la comparación mediante la metodología DIGE de muestras de DPB asociado a tuberculosis y DPM derivado de CPNM nos ha permitido encontrar 17 proteínas alteradas. De todas las proteínas identificadas posteriormente mediante MS, se consideraron como candidatas a marcadores para el diagnóstico del fluido pleural el PEDF, las proteínas S 100 A8 y S 100 A9, la gelsolina y el inhibidor de metaloproteinasas tipo 2, ya que su función está relacionada con el cáncer. El resto de las proteínas detectadas están relacionadas con la homeostasis sanguínea, con la coagulación y/o con la respuesta inmunitaria y, puesto que muchas de estas proteínas pueden llegar a estar influenciadas por otras enfermedades, o por el estado anémico del paciente, se consideró que tenían menor potencial como marcadores. El PEDF, también denominado serpina F1 o EPC-1, es una glicoproteína de 50 kDa de la familia de las serpinas (inhibidoras de serín proteasas). El análisis mediante la tecnología DIGE de esta proteína demostró la existencia de un incremento significativo del volumen relativo, de entre 1,5 y 2 en las muestras de DPM con respecto a las de DPB, en los dos spots detectados. El papel que esta proteína tiene en el cuerpo humano todavía no está claro y, en algunos casos, presenta controversias (Ek et al., 2006). El PEDF parece expresarse en tejidos fetales y adultos, incluyendo cerebro y columna vertebral, ojo, hígado, plasma, hueso, riñón, corazón y pulmón. Dentro de las funciones que realiza, una de las primeras que se han descrito ha sido su actividad neurotrópica en células cerebelares, que inhibían el crecimiento de la 225 Discusión microglía ocular (Dawson, 1999). Además, parece ser un potente inhibidor de la angiogénesis sensible a hipoxia (Abramson et al., 2003), de tal manera que es capaz de regular la neovascularización de la retina (Zhang et al., 2006). También se ha visto que presenta función antiapoptótica. Estas funciones están presentes en dos epítopos diferentes de la proteína, donde se ha elucidado que el péptido de 43 aminoácidos confiere actividad antiangiogénica y anti-apoptótica, mientras que el péptido de 44 aminoácidos presenta actividad neurotrópica (Ek et al., 2006). A pesar de que en nuestro caso la proteína aumentaba en los pacientes con DPM, algunos autores destacan una bajada en los niveles de PEDF relacionada con el aumento de la densidad vascular intratumoral, y con la presencia de metástasis tumoral (Cosgrove et al., 2004; Ek et al., 2006; Simpson et al., 2008). Sin embargo, otros autores destacan la existencia de un aumento de PEDF en pacientes que presentan adenocarcinoma con estadios III o IV de la enfermedad (Ueara et al., 2004), o bien la expresión aumentada en pacientes con CPNM, aunque únicamente en pacientes con adenocarcinoma, apareciendo una menor expresión en pacientes con otros tipos de CPNM (Zhang et al., 2006). El análisis mediante la tecnología DIGE de la proteína S 100 A9 demostró la existencia de un ratio de descenso de expresión de 0,14 veces en los mapas 2D de pacientes con patología maligna frente a los pacientes con patología benigna, que en ese caso se trataba de pacientes con DPB de tipo tuberculoso. Se sabe que tanto la proteína S 100 A8 como la S 100 A9 son moléculas proinflamatorias expresadas y secretadas por fagocitos reclutados, y parecen tener un papel crucial en la respuesta inmunitaria innata. Además, en presencia de inflamación son parámetros sensibles que pueden emplearse para la monitorización de la enfermedad y la respuesta a tratamientos (Foell et al., 2007). Se han observado también estas dos proteínas como marcadores para las 226 Discusión infecciones causadas por micobacterias, como en el caso del DPB tipo tuberculoso. Por tanto, una mayor expresión en pacientes con patologías benignas detectado mediante la metodología DIGE, en el que solamente estamos analizando muestras con DPB tuberculoso y DPM con cáncer de pulmón, sería coincidente con lo obtenido en estudios previos. En relación con la proteína gelsolina, los análisis realizados mostraron un aumento de la gelsolina en los pacientes con cáncer de pulmón. La gelsolina es una proteína de 20 kDa (Shieh et al., 1999), dependiente de calcio y regulada por PIP2 (fosfatidil-inositol 4,5bifosfato), que está implicada en el crecimiento celular y en la actividad de las células apoptóticas (Okano et al., 2006; Sun et al., 1999). Además, es esencial para el mantenimiento de la morfología celular y la motilidad (Dosaka-Akita et al., 1998). La sobreexpresión de gelsolina en pacientes con cáncer de pulmón puede relacionarse con un mal pronóstico de la enfermedad, debido a que un incremento de la expresión de esta proteína en células cancerosas se correlaciona con una invasión linfática, y como consecuencia en un aumento de la motilidad de estas células, existiendo por tanto probabilidad de metástasis (Shieh et al., 1999). Curiosamente, en pacientes con cáncer de pulmón que han sido consumidores de gran cantidad de tabaco se observa una expresión significativamente negativa de esta proteína en comparación con pacientes no fumadores o fumadores de menos de 20 paquetes al año (Dosaka-Akita et al., 1998). Esto es debido a que las sustancias carcinógenas del tabaco afectan a la metilación del ADN de los neumocitos tipo II que revisten el pulmón, impidiendo la expresión de la proteína (Dosaka-Akita et al., 1998). El inhibidor de metaloproteinasas tipo 2 es una proteína de 21 kDa que forma un complejo de manera selectiva con las metaloproteinasas tipo 2 (Kallakury et al., 2001; Stetler-Stevenson et al., 227 Discusión 1990), y se une mediante interacciones adicionales a dominios de hemopexina (Tuuttila et al., 1998). En este trabajo se ha detectado un aumento significativo en pacientes con patología maligna. Una sobreproducción de la actividad de estas enzimas está asociada a una variedad de condiciones patológicas, como ocurre con la conversión de las células tumorales a patologías malignas (Stetler-Stevenson et al., 1990), además de estar relacionado con una desorganización del parénquima pulmonar (Garbacki et al., 2009). El aumento del tejido conectivo es un rasgo característico de muchas condiciones fisiológicas y patológicas. Entre éstas se incluyen la remodelación extensiva del tejido durante procesos de desarrollo, destrucción del tejido relacionado con la inflamación y las enfermedades autoinmunes, y metástasis en cáncer. Las metaloproteinasas presentan un gran potencial de degradación de todos los componentes de la matriz extracelular (Tuuttila et al., 1998). Para el control de la proteólisis se requiere un balance delicado entre la activación y la inhibición de estas metaloproteinasas. La mayoría de ellas se secretan como preproenzimas, que requieren la activación y conversión a propéptidos; por ello una de las vías de control de estas proteínas son los inhibidores de metaloproteinasas (Tuuttila et al., 1998). Hay estudios que demuestran que no sólo los inhibidores de metaloproteinasas actúan como tal, sino que la α-2-macroglobulina también es un inhibidor severo de éstas (Visse y Nagase, 2003). El citoesqueleto es una estructura muy dinámica que se remodela como respuesta a una gran variedad de señales. El estímulo generado por los factores de crecimiento promueve el ensamblaje de la actina a la membrana plasmática generándose movimiento, mientras que las señales apoptóticas causan la destrucción del citoesqueleto mediante cambios morfológicos. En nuestro trabajo se han identificado dos spots pertenecientes a la actina, con un descenso de los valores en el DPM con relación al DPB. La actina del citoesqueleto celular es una parte esencial 228 Discusión de las interacciones entre membranas y de las funciones intracelulares, y está relacionada con el control de la locomoción, secreción y endocitosis del citoplasma de los macrófagos (Stüven et al., 2003). Durante estas actividades el citoplasma, que contiene numerosos filamentos de actina, presentará estructura de gel o sol, en función de su concentración. Cambios en esta concentración serán los que regularán la movilidad de los macrófagos (Yin y Stossel, 1979), junto con los cambios en la concentración de calcio. La proteína α-2-macroglobulina es una proteína inhibidora de varias enzimas relacionadas con los leucocitos durante la fagocitosis, siendo una proteína importante durante la inflamación y la inducción de daño en los tejidos. Además, actúa como proteína transportadora de varias hormonas (Alexandrakis et al., 2000). En nuestro estudio la proteína α-2-macroglobulina fue detectada con niveles disminuidos en pacientes con cáncer de pulmón, lo cual se relaciona con otros estudios donde esta proteína está disminuida en DPM (Alexandrakis et al., 2000; Kunter et al., 2002). Para el mantenimiento de la homeostasis sanguínea existen múltiples proteínas que son capaces de transportar iones por la sangre. Además de la albúmina, que en este estudio había sido eluida en el prefraccionamiento, existen otras proteínas como la hemopexina y la ceruloplasmina que se encargan del transporte de iones por la sangre. En nuestro estudio se observa un incremento significativo en los pacientes con patología maligna en un spot de ceruloplasmina, y en 11 spots de hemopexina. La ceruloplasmina es una proteína de 132 kDa (Bento et al., 2007), que presenta actividad ferroxidasa y es capaz de movilizar metales en el hígado para oxidarlos posteriormente, incorporando el grupo férrico a su molécula. Se ha visto que el incremento en suero está relacionado con algunas patologías malignas. La expresión del gen de esta proteína 229 Discusión se ha detectado en algunos tejidos como el bazo, pulmón, testículo y cerebro. Además, se ha visto que existen incrementos rápidos durante infecciones, traumas y embarazos (Hellman y Gitlin, 2002), por lo que se puede relacionar con la presencia de la inflamación pleural rápida y el incremento del contenido de esta proteína en el fluido pleural, debido al adenocarcinoma tumoral en los pacientes con DPM. En estos pacientes se ha detectado un incremento de 1,9 veces en relación a pacientes con DPB, en los que puede que la inflamación surja en un tiempo no tan rápido como en el caso de los DPM (más progresivamente). La hemopexina es una glicoproteína sérica de 63 kDa, que se une al grupo hemo de la hemoglobina con gran afinidad para transportarlo a un receptor específico de la superficie celular de los hepatocitos (Altruda et al., 1985; Tolosano y Altruda, 2002). Se ha visto que se encuentra aumentada en otros tipos de cáncer, y en otros fluidos biológicos (Dowling et al., 2007). En nuestro análisis presenta niveles entre 1,5 y 4,1 mayores en DPM, lo que se correlaciona con los resultados obtenidos por estos autores. A pesar de que los lípidos tienen un papel importante en el metabolismo celular, todavía no está establecida la importancia que estos tienen en la fisiología y en las enfermedades de la pleura (Pachón y Escuín, 2005). La apolipoproteína A-I (Apo-AI) es una proteína relacionada con el metabolismo lipídico. Forma parte de las lipoproteínas HDL, y se encarga del transporte de colesterol desde los tejidos hasta el hígado. Los niveles de apolipoproteínas en líquido pleural son inferiores a sus niveles en suero; sin embargo los niveles relativos de HDL líquido pleural/suero son similares a los niveles relativos de Apo-AI líquido pleural/suero (Vaz et al., 2001). Esta proteína, sintetizada en el hígado y en el intestino, aparece incrementada en pacientes con patología maligna de nuestro estudio con un aumento de 2,8 veces. 230 Discusión El resto de las proteínas identificadas, todas ellas relacionadas con la respuesta inmunitaria o con la agregación plaquetaria, representan un 24% del total de proteínas identificadas. En este grupo están presentes el factor C3 del complemento, la glicoproteína α-1-B, la β-2-microglobulina, la cadena γ- y la cadena β del fibrinógeno, la región C de la Ig-γ y la proteína sérica amiloide A-4. La detección de los complejos formados por los factores del complemento en los fluidos biológicos indica directamente activación del complemento (Salomaa et al., 1998). Para la predicción del tipo patológico de DP se ha sugerido el análisis de la vía del complemento que está activada. Niveles elevados de los factores del complemento C3, y de su producto C5b-9, suelen aparecer en pacientes con DPB tuberculoso, mientras que niveles disminuidos de estos factores normalmente se asocian con DPM o con reumatitis (Shitrit et al., 2008). En nuestras muestras se han detectado 4 spots identificados como el factor C3 del complemento, tres de ellos presentaron valores elevados en las muestras de DPM, mientras que sólo en una de ellas disminuía. La glicoproteína α-1-B fue identificada a partir de un único spot que presentaba un aumento de 1,7 veces en los pacientes con DPM. Esta proteína se considera un marcador de la respuesta inflamatoria, puesto que presenta dominios similares a las Igs, a los antígenos de histocompatibilidad o al antígeno receptor de células T. La proteína β-2-microglobulina ha sido caracterizada en el fluido pleural en numerosos estudios (García et al., 2004; Kamble et al., 2005; Suzuki et al., 2005). En ellos encontraron un incremento significativo de sus niveles en el DPM de pacientes con mieloma múltiple. Estos datos no concuerdan con el descenso encontrado por nosotros en pacientes con DPM, en el único spot identificado como beta-2-microglobulina. 231 Discusión 4.2. Selección y caracterización bioquímica de proteínas con expresión diferencial en derrame pleural maligno y benigno Basándonos en los estudios realizados por Ueara, Zhang y sus respectivos colaboradores (Ueara et al., 2004; Zhang et al., 2006) sobre la proteína PEDF en los que destacaban la existencia de un aumento de PEDF en pacientes que presentaban CPNM, en estadios III y IV de la enfermedad, decidimos que esta proteína podía ser un buen candidato a marcador debido a la similitud con las muestras que estábamos empleando nosotros para nuestra validación, en la que todas ellas presentaban estadios III y IV, y la mayoría de los pacientes estaban diagnosticados como CPNM. Además, numerosos autores relacionaban esta proteína con la presencia de metástasis tumoral y un aumento de densidad vascular (Cosgrove et al., 2004; Ek et al., 2006; Simpson et al., 2008), por lo que decidimos validarla y así poder confirmar si nuestros resultados se asemejaban a los observados por los diferentes autores. En lo referente a las proteínas S 100 A8 y S 100 A9, sabemos que las proteínas de la familia de las S 100 han sido objeto de revisión, debido al potencial que presentan como marcadores tumorales y dianas terapéuticas del cáncer, cada vez más evidente (Foell et al., 2007; Gebhardt et al., 2006; Raquil et al., 2008; Salama et al., 2008). Existen estudios que las relacionan con procesos metastáticos del pulmón (Salama et al., 2008) o con condiciones inflamatorias en el cáncer (Gebhardt et al., 2006; Kim et al., 2009), siendo por ello comunes en cánceres gástricos, en cáncer de mama y en adenocarcinoma de pulmón (Cross et al., 2005). Sin embargo, de lo que no se duda es de su relación con procesos inflamatorios. De hecho se ha observado un aumento de la producción de ambas proteínas en diferentes muestras de pacientes con enfermedades inflamatorias (Lügering et al., 1995). Además, 232 la Discusión concentración sérica de la proteína calprotectina se ha relacionado con la AR, o variables clínicas como el número de articulaciones inflamadas (Brun et al., 1994; Hammer et al., 2007; Hammer 2010). Por todo esto consideramos que estas proteínas eran los candidatos más prometedores a marcadores de diagnóstico del DPM, y por ello decidimos realizar un estudio de validación en profundidad. 4.2.1. Caracterización de la proteína PEDF La proteína PEDF se identificó a partir de dos spots cuya masa molecular aproximada era de 51 kDa. Debido a la existencia de estas dos isoformas, como primera aproximación se decidió realizar una puesta a punto del método de inmunoblot, para poder ver si en las muestras sin ningún tipo de tratamiento previo éramos capaces de visualizar esta proteína. Aunque, según un estudio previo realizado en derrame, sería necesario un pretratamiento de las muestras para la visualización de la banda correspondiente a esta proteína (Hsieh et al., 2006), como la proteína había sido detectada en muestras crudas de otros tejidos como la córnea y conjuntiva (Shao et al., 2004), homogeneizados de tejido pulmonar (Cosgrove et al., 2004), suero (Petersen et al., 2003), etc. nos pareció buena idea la detección de esta proteína en muestras sin pretratamiento. Una vez puesto a punto el método, las 8 muestras de fluido pleural empleadas para la metodología DIGE fueron resueltas mediante 1-DE, transferidas a membranas e inmunodetectadas con anticuerpos anti-PEDF. El análisis mediante inmunoblot de la proteína PEDF nos permitió visualizar las bandas correspondientes a la proteína que presentaban un peso molecular en torno a 50 kDa, que era el esperado. De forma similar a lo aquí descrito, Shao, Cosgrove, Chen, Petersen y sus correspondientes colaboradores (Chen et al., 2009; Cosgrove et al., 2004; 233 Discusión Petersen et al., 2003; Shao et al., 2004) encontraron esta gran banda de aproximadamente 50 kDa. La existencia de isoformas con masas moleculares similares o diferentes puntos isoeléctricos, como se apreciaba al utilizar la metodología DIGE, podría explicar el espesor de la banda observada. La cuantificación de la mencionada banda correspondiente a la proteína PEDF reveló que no existían diferencias significativas en la expresión de esta proteína entre ambas patologías. Este resultado es congruente con la existencia de diferentes isoformas, de modo que, aunque alguna de las isoformas de esta proteína sí que presenta una sobreexpresión en DPM, en conjunto esta sobreexpresión quedaría enmascarada por la existencia de otras con menor expresión. Para comprobar este hecho, decidimos realizar la electroforesis bidimensional de muestras con patologías malignas y benignas, y la posterior transferencia a membrana e inmunoblot de la proteína PEDF, para detectar la existencia de isoformas. Del mismo modo que lo obtenido en suero por Petersen y colaboradores (Petersen et al., 2003), en DP se obtuvieron 12 isoformas de la proteína PEDF en cada inmunoblot, apareciendo incluso duplicados o triplicados entre los que no existía ni una sola unidad de pH de diferencia. Sin embargo el análisis de las isoformas mediante el programa PDQuest no reveló la existencia de diferencias estadísticamente significativas entre las isoformas de ambas patologías. Estos resultados restaban interés sobre el PEDF y su posible valor como marcador de diagnóstico del DP ya que eran contradictorios o, al menos no confirmatorios de los resultados que se habían obtenido en la comparación de proteomas mediante DIGE. Sin embargo, el PEDF ha sido descrito en numerosos trabajos como factor relacionado con el cáncer y nos pareció muy interesante la estrecha relación demostrada entre el PEDF y la angiogénesis. Por ejemplo, está descrito que los niveles 234 Discusión de PEDF son un factor importante a la hora de predecir el pronóstico de varios tipos de cáncer, como ocurre con el adenocarcinoma pancreático (Good et al., 1990), carcinoma hepatocelular (Matsumoto et al., 2004) y cáncer prostático (Halin et al., 2004). Por todo ello, en nuestro caso decidimos seguir adelante con su validación y ver qué ocurría cuando se determinaba la concentración de la proteína mediante metodologías más sensibles, como la técnica ELISA, aún siendo conscientes de que dicha metodología no nos permitiría la diferenciación entre isoformas, sino simplemente la cuantificación de la cantidad total de proteína detectada en cada una de las muestras. 4.2.2. Validación de la proteína PEDF como marcador de derrame pleural maligno La validación de la proteína PEDF mediante la metodología ELISA fue realizada en fluido pleural crudo, sin prefraccionamiento previo como ocurría en algunas de las muestras empleadas en el inmunoblot. Esto se debe a que queríamos reproducir al máximo las condiciones que los clínicos se encontrarían si esta técnica se llegase a implantar en un futuro en los hospitales. Al comparar los niveles medios de PEDF que se detectaron mediante la metodología ELISA, entre el grupo de pacientes con patologías benignas y los pacientes con patologías malignas, observamos que el nivel medio de concentración de la proteína en el grupo de pacientes con DPM fue de 4,59 mg/mL, nivel ligeramente superior al detectado en pacientes con DPB, que fue de 3,97 mg/mL. Esto confirmaría los resultados obtenidos tras el análisis realizado mediante la metodología proteómica de inmunoblot; sin embargo, las diferencias detectadas no alcanzaron la significación estadística (p < 0,166). Buscando en la bibliografía estudios que midiesen niveles de PEDF en líquido pleural observamos que son muy escasos, de hecho sólo 235 Discusión en el realizado por Hsieh et al. (Hsieh et al., 2006) se determina la cantidad de PEDF que hay en líquido pleural y, aunque en otros también parecen hablar de estas patologías, en ninguno de ellos miden directamente la cantidad de esta proteína en el fluido pleural. Hsieh et al. (Hsieh et al., 2006) comparan la expresión de PEDF en pacientes que presentan patologías de exudados malignos y de trasudados, detectando unos niveles de expresión del PEDF incrementados en el caso de muestras de pacientes aquejados de trasudado pleural. Pese a que en nuestro estudio son las muestras malignas las que aparecen con una concentración incrementada de la proteína, los resultados obtenidos por Hsieh et al. (Hsieh et al., 2006) no son comparables a los nuestros, por la diferente naturaleza de las muestras empleadas. Sin embargo, sí que podemos decir que el rango de concentración de PEDF encontrado en nuestro estudio en líquido pleural coincide con el rango de los niveles descritos en suero por varios autores, de 5 mg/mL como promedio (Ogata et al., 2007; Petersen et al., 2003). Como era de esperar tras los resultados obtenidos, el rendimiento diagnóstico de los niveles de PEDF no demostró ser útil para la discriminación de la patología maligna. El área bajo la curva ROC detectada fue de 0,6 (IC del 95 %). Aunque hay estudios que muestran a esta proteína como candidata a marcador de patologías malignas, como cáncer de próstata, (Byrne et al., 2008) el valor detectado del AUC tampoco fue demasiado buena (0.788), y la sensibilidad diagnóstica del estudio no les servía para clasificar al marcador como tal. Una corriente en la investigación del cáncer es la identificación y la modulación de los eventos que ocurren en la génesis tumoral. La angiogénesis es uno de estos eventos conocido por ser fundamental en el desarrollo, crecimiento y metástasis de las neoplasias, y es una de las características que diferencia a un tumor del tejido que lo hospeda (Folkman, 1990). Esta evidencia sugiere que la angiogénesis está regulada por un balance neto entre factores positivos (angiogénicos) y 236 Discusión negativos (angiostáticos) producidos por el tumor y otras células (Boehm et al., 1997; Crowther et al., 2001; Lewis y Pollard, 2006). Se sabe que los tumores producen inhibidores angiogénicos como la angiostatina, la trombospondina y la endostatina (Cao, 1999; Folkman, 2006; Lawler y Detmar, 2004). Además, podemos decir que los niveles de PEDF son un factor importante a la hora de predecir el pronóstico de varios tipos de cáncer, como ocurre con el adenocarcinoma pancreático (Good et al., 1990), carcinoma hepatocelular (Matsumoto et al., 2004) y cáncer prostático (Halin et al., 2004). Una de las funciones propuestas para el PEDF es como potente inhibidor de la angiogénesis y, por tanto, un descenso en los niveles de esta proteína estaría asociado con una mayor progresión de la neoplasia y con metástasis (Byrne et al., 2008; Cai et al., 2006; Halin et al., 2004). Sin embargo, a pesar de que las diferencias no son estadísticamente significativas, en nuestras muestras aparece incrementado en pacientes con patologías malignas. La participación del PEDF en la supervivencia y muerte celular (funciones contrapuestas), podría deberse a que el PEDF es un factor de crecimiento que es a la vez neuroprotector, y un potente modulador endógeno de la angiogénesis. El PEDF comparte algunos rasgos con el VEGF; ambas proteínas son neuroprotectores, haciéndolas objetivos interesantes para el tratamiento de diversas enfermedades, como ocurre con la enfermedad de Parkinson (Falk et al., 2010), pero tienen diversas funciones que las hacen diferentes, sobre todo en lo referido a los sistemas vasculares. Mientras que el VEGF tiene como función la permeabilidad vascular de las células endoteliales, el PEDF presenta actividad anti-angiogénica, y capacidad para inhibir la migración de células endoteliales (Falk et al., 2010). Estas acciones opuestas son particularmente apreciables en el ojo, donde muchos estudios han demostrado cómo la homeostasis angiogénica es mantenida por un delicado equilibrio entre estimuladores angiogénicos, como VEGF-A e 237 Discusión inhibidores angiogénicos como PEDF. El hecho de que no existan diferencias notables entre los pacientes con DPM y DPB analizados en este trabajo puede radicar en el origen de las muestras empleadas. Por un lado, los niveles más altos de PEDF en DPM podrían deberse a un intento de limitar el daño tumoral, como se ve en la esclerosis lateral amiotrófica (Falk et al., 2010), donde parece existir una regulación positiva en la cantidad de PEDF del liquido cefalorraquídeo de los pacientes aquejados de esta enfermedad. Sin embargo, por otro lado las muestras con patologías benignas presentan condiciones inflamatorias y, como se ha observado, el PEDF también tiene propiedades anti-inflamatorias relacionadas con la aterosclerosis (Yamagishi et al., 2006; Nakamura et al., 2009). Debemos tener en cuenta que el PEDF es un potente inhibidor de la angiogénesis y, por tanto, un descenso en los niveles de esta proteína estará asociado con una mayor progresión de la neoplasia y con metástasis (Byrne et al., 2008; Cai et al., 2006; Halin et al., 2004). Esto podría explicar el porqué en nuestras muestras aparece incrementado en pacientes con patologías malignas, como una manera que el cuerpo presenta de controlar que no siga desarrollándose esa situación de metástasis y progresión tumoral. Los niveles de PEDF medidos en DP no mostraban relación con las características clínico-patológicas de los pacientes, siendo estos resultados similares a los obtenidos en estudios previos por Feng et al. (Feng et al., 2011) y Uehara et al. (Uehara et al., 2004), en lo que a edad y género se refiere. Por el contrario, se comprobó estadísticamente que existía una correlación entre los niveles de PEDF detectados en muestras de pacientes con patologías benignas y malignas, y la cantidad de monocitos, leucocitos y PMN. El que exista esta correlación positiva del PEDF con los PMN y monocitos en las muestras de pacientes con DPM se 238 Discusión relaciona con lo obtenido por Bard et al. (Bard et al., 2004), que detectaron la presencia de esta proteína en exosomas derivados de células tumorales y linfocitos en liquido pleural de pacientes con neoplasias. Se sabe que los exosomas son vesículas de origen endosomal obtenidas a través de la membrana, y secretadas por diferentes tipos celulares, entre los que se incluyen las células epiteliales, los linfocitos y las células tumorales; siendo los dos últimos tipos celulares la tipología más abundante de células detectadas en el fluido pleural de los pacientes que analizaron (Bard et al., 2004). En resumen, hemos sido capaces de ver los niveles de expresión del PEDF en pacientes con DPM y DPB, demostrando que la concentración de la proteína es similar en ambas muestras, y los niveles coinciden con los detectados en muestras de suero. Lamentablemente, los niveles de esta proteína no permiten un diagnóstico preciso del DPM. Sin embargo, el que la proteína PEDF presenta varias funciones, entre las que se incluyen la anti-tumorigénesis y la inflamación, podría anular la utilidad de esta proteína en muestras con patologías malignas o benignas, sobre todo de tipo inflamatorio, ya que podrían obtenerse diferentes resultados en función de la patología que se esté estudiando. 4.2.3. Caracterización de la proteína Calprotectina En este estudio, en la fracción eluida del fluido pleural se encontraron dos especies proteicas pertenecientes a la familia de las proteínas S 100, correspondientes a las proteínas S 100 A8 y S 100 A9. Los valores de volumen estandarizado encontrado en los pacientes con DPM fueron entre 4 y 5 veces menores que en pacientes con DPB. Las proteínas de esta familia son pequeñas moléculas acídicas de 10-20 kDa, encontradas exclusivamente en vertebrados. Se localizan en casi todos los fluidos corporales debido a que son secretadas por 239 Discusión neutrófilos. Se caracterizan por ser proteínas que se unen al calcio mediante el motivo hélice-vuelta-hélice y tienen habilidad para formar homodímeros, heterodímeros u oligómeros entre los diferentes componentes de su familia (Salama et al., 2008). En el caso concreto de las proteínas S 100 A8 y S 100 A9 se sabe que son capaces de formar heterodímeros siendo el ratio de formación de dímeros-monómeros de 10:1 respectivamente (De Seny et al., 2008). En condiciones inflamatorias ambas se producen de forma independiente. La proteína S 100 A9 se encontrará ante condiciones inflamatorias agudas como la gingivitis, mientras que la producción de S 100 A8 se limita a inflamaciones de tipo crónico (Zwadlo et al., 1988). En ausencia de calcio, la forma heterodimérica es la preferente. Estos complejos formados por la proteína S 100 A8 y la S 100 A9, se denominan comúnmente como calprotectina (Foell et al., 2007). La calprotectina se puede encontrar en la bibliografía bajo varios sinónimos (complejo de las proteínas S100A8 y S100A9, antígenos 27E10, factor relacionado con la inhibición de macrófagos, proteínas MRP8/14, L1L L1H y proteínas calgranulina A/B). La calprotectina es un heterodímero de 24 kDa compuesto por cadenas ligeras (MRP8) y pesadas (MRP14) (8 y 14 kDa). Es un miembro de la familia de las proteínas S 100, que son proteínas de unión al calcio. En presencia de calcio, los complejos heterodiméricos suelen tetramerizarse en dímeros, trímeros y tetrámeros (Stríz et al., 2004). La calprotectina también contiene zinc, de hecho presenta una capacidad de unión al zinc más elevada que otras proteínas S 100. Estos dominios no se verán afectados por la unión del calcio. Además, tanto S 100 A8 como S 100 A9 contienen histidina con secuencias de unión al zinc, que se supone que están involucrados en la actividad antibacteriana de esta proteína (Terasaky et al., 2007). 240 Discusión Antes de proceder a su validación mediante la técnica ELISA se realizó un estudio de caracterización electroforética las proteínas para obtener una visión un poco más general de lo que está sucediendo con las proteínas en cada una de las patologías estudiadas. El análisis mediante inmunoblot de la proteína S 100 A9 resultó ser más difícil de lo esperado a priori. Por un lado, la gran capacidad que esta proteína presenta de formar complejos entre ella misma, o entre componentes de su familia y, por otro, la alta resistencia del dímero a la desnaturalización (McCormick et al., 2005) hizo necesario el empleo de condiciones más desnaturalizantes a la hora de realizar las diferentes pruebas en los geles 1D. Los agentes desnaturalizantes empleados fueron la urea y la temperatura, que modifican la estructura tridimensional de las proteínas. El hecho de que mediante la técnica DIGE permitiera la separación de los monómeros se debe a que en la electroforesis bidimensional se utilizan agentes desnaturalizantes como la urea y el DTT, y a que se permite una mejor resolución de las proteínas al separarlas no solo por su masa molecular, como ocurre con la electroforesis monodimensional, sino también por su pI. Una vez puesto a punto el método, las 8 muestras de fluido pleural empleadas en la metodología DIGE fueron resueltas mediante 1DE, transferidas a membranas e inmunodetectadas con anticuerpos anti-S 100 A9. En condiciones desnaturalizantes, calentando la muestra a 100 ºC durante 1h, se pudo observar una banda en torno a 29 kDa que se correspondería con el dímero S 100 A9 (cuyo monómero tiene un tamaño de 14 kDa). De forma similar a lo aquí descrito Kumar, Qin y sus respectivos colaboradores (Kumar et al., 2001; Qin et al., 2010) encontraron esta banda de aproximadamente 29 kDa en condiciones desnaturalizantes, aunque en su caso sí fueron capaces de detectar además una forma monomérica de 14 kDa. Una posible explicación es que en derrame puede que la proteína S100 presente un ratio dímero/monómero mayor de lo que ocurre en otros fluidos corporales, 241 Discusión siendo mucho más difícil la detección de la forma monomérica (De Seny et al., 2008). A pesar de no poder separar el monómero de la proteína S100 A9, realizamos un estudio cuantitativo de las bandas del dímero separadas mediante electroforesis monodimensional. Como era esperable, este análisis reveló la existencia de diferencias significativas en la expresión de esta proteína entre ambas patologías estudiadas, corroborándose los datos obtenidos para el monómero mediante DIGE. 4.2.4. Validación de la proteína Calprotectina como marcador de derrame pleural maligno Debido a la gran complejidad a la hora de separar los dímeros formados por la proteína S 100 A9 cuando se realizan las tecnologías 1DE y 2-DE, a la hora de utilizar la metodología ELISA decidimos hacerla con el complejo dimérico formado por las proteínas S 100 A8 y S 100 A9, denominado calprotectina. La validación de esta proteína se realizó en un grupo de pacientes que presentaban DP derivado de patologías malignas (de origen epitelial, mesoteliomas y linfomas) y en pacientes cuyo derrame se derivaba de de patologías benignas (en su mayoría pacientes con tuberculosis o neumonía, así como pacientes con derrames de otro tipo denominados paramalignos, no neoplásicos de origen desconocido y miscelánea). Debido a que los pacientes son tratados por el Servicio de Neumología del CHUVI pudimos tener acceso a información de las características clínico-patológicas de los mismos, y por tanto pudimos analizar otros marcadores como el ADA, LDH, glucosa, etc., que podrían ofrecer información adicional a nuestro estudio. La determinación de los niveles de calprotectina mediante ELISA fue realizada en muestras de fluido pleural crudo, sin prefraccionamiento 242 Discusión previo, debido a que queríamos reproducir al máximo las condiciones que se encontrarían los clínicos en caso de que la técnica se implantase en un futuro en los hospitales, como práctica diagnóstica habitual. Al comparar los niveles medios de calprotectina detectados mediante la metodología ELISA observamos cómo estos niveles eran diez veces menores en derrames malignos que los detectados en derrames benignos (p < ,001). Si nos fijamos en los valores medios de concentración de calprotectina vemos cómo son similares entre los distintos tipos de neoplasias evaluadas, a excepción del DPM de tipo mesotelioma, que presenta niveles más elevados que difieren significativamente de los DPM de origen epitelial. En lo referente a los pacientes que presentan patologías benignas, observamos cómo también existen diferencias en las concentraciones de la proteína entre ambos grupos, siendo los pacientes tuberculosos y paraneumónicos los que presentan valores más elevados. Además, la comparación de los pacientes tuberculosos y paraneumónicos con el resto de grupos de pacientes con patologías benignas mostró la existencia de diferencias significativas, lo que sugiere que la calprotectina también podría ser empleada para la discriminación entre las diferentes etiologías benignas del derrame. Las proteínas pertenecientes a la familia de las S 100 han sido objeto de revisión debido al potencial que presentan, cada vez más evidente, como marcadores tumorales y dianas terapéuticas del cáncer (Foell et al., 2007; Gebhardt et al., 2006; Raquil et al., 2008; Salama et al., 2008). Existen estudios que demuestran la existencia de concentraciones elevadas de S 100 A8 y S 100 A9 implicadas en procesos metastásicos. Esto se demostró porque los tumores primarios secretan factores solubles como VEGF, TGF-β y TNF-α que inducen la expresión de S 100 A8 y S 100 A9 en las células mieloides y endoteliales dentro del pulmón antes de que exista metástasis (Salama et al., 2008). Otros 243 Discusión autores sugieren una relación directa de la expresión de ambas proteínas con condiciones inflamatorias en el cáncer (Gebhardt et al., 2006; Kim et al., 2009), siendo por ello comunes en cánceres gástricos, en el cáncer de mama y en el adenocarcinoma de pulmón (Cross et al., 2005). Sin embargo, a pesar de su clara relación con el cáncer, no hay duda de que estas proteínas están directamente implicadas en procesos de inflamación. Así, se ha observado un aumento de la producción de ambas proteínas en diferentes muestras de pacientes con enfermedades inflamatorias (Lügering et al., 1995). Además, la concentración sérica de la proteína calprotectina se ha relacionado con varias variables asociadas a la actividad de la AR y psoriásica, o variables clínicas como el número de articulaciones inflamadas (Brun et al., 1994; Hammer et al., 2007; Hammer 2010), y variables biológicas como la proteína C reactiva y la concentración y velocidad de sedimentación globular (Kane et al., 2003). Desde hace años se sabe que estas proteínas S 100 desarrollan funciones intracelulares y extracelulares. Dentro de las funciones intracelulares se incluyen algunas como: regulación de la fosforilación de las proteínas y de la actividad enzimática, la homeostasis de calcio, la regulación de los componentes del citoesqueleto y la regulación de los factores de transcripción. En relación a las actividades extracelulares, algunos miembros de la familia actúan como quimioatrayentes, activadores de macrófagos y moduladores de la proliferación celular (Salama et al., 2008). Actualmente existen escasos estudios sobre la presencia de calprotectina en DPM. De hecho, en el análisis realizado por Davidson et al. (Davidson et al., 2010) aparecían niveles de calprotectina en derrames procedentes de 36 mujeres con cáncer de mama, que van desde 301 hasta 9.431 ng/mL. En nuestro caso podemos decir que nuestros resultados no son comparables, debido a que Davidson et al. (Davidson et al., 2010) realizaban un análisis de diferentes fluidos en conjunto 244 Discusión mientras que nosotros solamente analizamos fluido pleural. En otro estudio, realizado en DPM originado por carcinomas de ovario en estadios avanzados, Odegaard et al. (Ødegaarg et al., 2008) describen una serie de niveles valorados en diferentes fluidos que van desde 2.008 hasta 3.335 ng/mL, valores que difieren de nuestros resultados, aunque hay que señalar que en nuestro caso sólo tenemos dos muestras con este tipo de DPM. Además, es importante señalar que en ambos estudios mencionados se emplea un ensayo de ELISA diferente (Kristinsson et al., 1998; Tibble et al., 2001) para medir la proteína calprotectina, pudiendo existir discrepancias al tratarse del empleo de diferentes anticuerpos. Para poder evaluar el valor diagnóstico de la proteína se hizo necesario la realización de un análisis estadístico del rendimiento diagnóstico mediante las curvas ROC (Beck y Shultz, 1986), que permitieron una determinación de la sensibilidad, especificidad y eficiencia diagnóstica del estudio. Este análisis mostró una buena capacidad de distinción entre DPM y DPB, con un AUC de 0,963, sustancialmente mayor que los valores de AUC obtenidos para los marcadores bioquímicos utilizados por rutina en los mismos pacientes, como son el ADA, la LDH, etc. En el estudio se encontraron dos posibles puntos de corte para la clasificación de la muestra como benigna o maligna. Estos puntos de corte se establecieron en base a diversos criterios: un primer punto de corte de ≤ 545 ng/mL que logra la máxima precisión con una sensibilidad y especificidad de 97,01 y 88,76 %, respectivamente. Y un segundo punto de corte de ≤ 736,4 ng/mL que logra una sensibilidad del 100 %, pero cuya especificidad disminuye en este caso hasta 83,15 %. Además, la calprotectina mejora en gran medida la sensibilidad y la especificidad de los marcadores clásicos empleados para el diagnóstico del DPM, como son el CEA, CA-125, CYFRA 21-1 y CA 15-3 (Liang et al., 2008), e incluso mejora el uso de varios paneles que combinan varios 245 Discusión marcadores (Villena et al., 2003). Sin embargo, no podemos obviar un estudio en el que encontraron que la metaloproteinasa de la matriz 9 (MMP-9) jugaba un papel muy importante a la hora de distinguir los derrames pleurales malignos originados por el cáncer de pulmón (no estudiaron otros orígenes malignos) de los pacientes con patologías benignas de tipo inflamatorio, con una sensibilidad y especificidad del 80 y 100 %, respectivamente (Kremer et al., 2010). Además de los buenos parámetros diagnósticos de la calprotectina, el análisis mediante regresión logística de la concentración de esta proteína corroboró la gran importancia que tiene para la determinación del riesgo de presentar un derrame de origen maligno. En nuestro caso, otros de los parámetros que también influyen en la probabilidad de que el derrame se deba a una enfermedad neoplásica son: presentar una edad superior a 60 años, presentar un gran tamaño del derrame (> 1/3), tener valores bajos de ADA (≤ 38 U/L) y leucocitos (≤ 1.150 L/mm3), tener un contenido en linfocitos > 75 %, una concentración de proteínas ≤ 5g/L y, en menor medida, el hábito tabáquico. Sin embargo, la contribución de estos factores fue mínima al compararla con la contribución que tiene la calprotectina, lo que hace que estos factores no sean significativos en el análisis multivariante. Como ya se ha citado anteriormente, la calprotectina pertenece a la familia de las proteínas de unión al Ca+2 citoplasmático, denominadas familia S 100. Y se ha demostrado que estas proteínas están implicadas tanto en la respuesta inflamatoria como en trastornos neoplásicos (Cross et al., 2005; Foell et al., 2007; Gebhardt et al., 2006; Kristinsson et al., 1998; Raquil et al., 2008; Salama et al., 2008). Curiosamente, la función relacionada con el cáncer es de alguna manera contradictoria. Por un lado, es un poderoso agente apoptótico producido por las células inmunitarias y, por otro lado, la expresión en células tumorales de la proteína calprotectina también se ha asociado con el desarrollo del tumor, la invasión del cáncer, o la metástasis (Gebhardt et al., 2006; Kim 246 Discusión et al., 2009; Kristinsson et al., 1998; Salama et al., 2008). Además, la calprotectina tiene también una doble función como proteína intracelular y extracelular, dificultando aún más su importancia biológica en los fluidos pleurales. En cuanto a la relación que esta proteína presenta con la inflamación, podemos decir que es indudable que es una proteína proinflamatoria, y que juega un papel importante en varias enfermedades inflamatorias (Cross et al., 2005; Foell et al., 2007; Gebhart et al., 2006; Roth et al., 2003), por lo que altos niveles de esta proteína se esperarían en pacientes con enfermedades de tipo inflamatorio, como la mayoría de las patologías benignas consideradas en este estudio (Vermeire et al., 2006; Kallel et al., 2011). En lo referente a los niveles detectados en DPM, podríamos habernos encontrado niveles elevados de esta proteína, puesto que está involucrada en la inflamación asociada a la carcinogénesis (Gebhardt et al., 2006; Ghavami et al., 2009; Salama et al., 2008). Sin embargo, en nuestro caso hemos encontrado niveles de calprotectina que van desde 90,7 hasta 736,42 ng/ mL en DPM. Estos niveles son claramente inferiores a los detectados en DPB, pero eso no quiere decir que en los pacientes oncológicos la calprotectina tenga una expresión inhibida. El hecho de que el DP sea un síntoma de enfermedad, obviamente implica que no existen para este estudio controles sanos con los que comparar. Únicamente se puede asegurar que la expresión de calprotectina en DPM es inferior a la expresión en DP de origen benigno. Los niveles de calprotectina más altos encontrados en DPB, en comparación con los detectados en DPM, podrían ser debidos a la función antimicrobiana de la calprotectina. Se ha propuesto que esta proteína se libera masivamente cuando los neutrófilos mueren, para inhibir el crecimiento de una variedad de patógenos fúngicos y bacterianos (Corbin et al., 2008; Nisapakultorn et al., 247 2001; Discusión Santhanagopalan et al., 1995). De acuerdo con esto, hemos encontrado los mayores niveles de calprotectina en pacientes con neumonía y DP tuberculoso, mientras que los niveles más bajos se detectaron en otras patologías benignas no infecciosas. En un estudio reciente, realizado por Kremer et al. (Kremer et al., 2010), se analizaron varios marcadores en el líquido pleural de varios pacientes que presentaban cáncer de pulmón y enfermedad inflamatoria benigna. Curiosamente se encontró que las concentraciones de DP de los siete marcadores biológicos analizados fueron menores en los pacientes que presentaban cáncer. De una manera similar a lo que ocurre con la calprotectina, dos de estos marcadores (MMP-2 y MMP-9) se expresan en diversos procesos patológicos, tales como la inflamación y el cáncer, y también en respuesta a infecciones (Kremer et al., 2010). Se sabe que la concentración de cualquier molécula en los fluidos corporales se ve influenciada por muchos factores; entre ellos se podrían incluir la proximidad de la secreción al fluido, o la dilución del líquido, por lo que los niveles de calprotectina no tienen por qué ser necesariamente los mismos cuando se miden en el plasma/suero o en líquido pleural. En este sentido, no consideramos una contradicción el hallazgo de altos niveles plasmáticos de calprotectina en cáncer de ovario, en comparación con los tumores benignos (Ødegaard et al., 2008), o en el suero de pacientes con cáncer de próstata (Hermani et al., 2005), y también en muestras de suero y heces de pacientes con carcinoma colorrectal (Kallel et al., 2011; Kristinsson et al., 1998; Vermeire et al., 2006). De acuerdo con esto, la MMP-2 y MMP-9 detectados en los niveles inferiores de DP de los pacientes con cáncer de pulmón (Kremer et al., 2010) también se han asociado con un aumento de la extensión del tumor, y con un mal pronóstico en el cáncer de pulmón (Kodate et al., 1997), y se ha detectado sobreexpresión en los ovarios y en pacientes con cáncer de mama (Somiari et al., 2006; Zhang et al., 2011; Zhang et al., 2012). Estamos de acuerdo con Kremer et al. cuando afirman que, 248 Discusión independientemente de los mecanismos implicados, la existencia de alteración en los niveles de una molécula en el DP, que en nuestro sería la calprotectina, es de importancia clínica considerable. 4.2.4.1. Procedimiento a seguir para la utilización de la calprotectina para la detección del derrame pleural maligno en la práctica clínica diaria Una de las aplicaciones clínicas más interesantes de los resultados de este trabajo es la utilización de la proteína calprotectina para mejorar la sensibilidad de la citología. Como ya hemos mencionado, la citología pleural es un examen de laboratorio para detectar la presencia de células cancerosas en el espacio pleural o en el área que rodea los pulmones. Sin embargo, el porcentaje de DPM diagnosticado mediante esta técnica se sitúa entre un 40-87% dependiendo del origen de la patología (Maskell y Butland 2003; Alemán et al., 2007; Heffner 2008). (Froudarakis, 2008). Por lo tanto, aunque su especificidad es muy buena, la citología es una técnica que presenta baja sensibilidad, por lo que se requiere la utilización de otros métodos (muchos de ellos invasivos para asegurar un correcto diagnóstico del DPM. En este trabajo, hemos visto cómo la adición del análisis de la calprotectina, empleando cualquiera de los dos puntos de corte mejora los resultados de la citología en cuanto a la correcta detección de pacientes con DPM. El punto de corte de mayor precisión (≤ 545 ng/mL) nos permitió la detección de 31 de los 33 pacientes oncológicos con citología negativa, mejorando la sensibilidad de la citología hasta el 97 %. Empleando el segundo punto de corte propuesto, ≤ 736,42 ng/mL, se logra clasificar correctamente a todos los pacientes con citología negativa (100 % de sensibilidad). 249 Discusión Una de las cuestiones que nos planteamos a la hora de validar los resultados de nuestro estudio es determinar en qué paso del protocolo de diagnóstico de la etiología del DP debería efectuarse la valoración de la proteína calprotectina. A la vista de nuestros resultados, sería muy útil determinar los niveles de calprotectina en aquellos pacientes en los que tras la toracocentesis, presentan citología negativa para células malignas. Podría utilizarse el punto de corte ≤ 736,42 ng/mL, que presentaba un 100 % de sensibilidad. Además, el método de medición puede ser fácilmente incorporado en la práctica clínica diaria sin ningún riesgo o incomodidad para el paciente. El algoritmo propuesto sería el mostrado en la figura 54. Si la citología es positiva, se confirma la malignidad de la enfermedad del paciente. En los casos dudosos o de citología negativa, podrían determinarse los niveles de calprotectina. En aquellos pacientes con niveles mayores a 736 ng/mL podría descartarse malignidad y se consideraría que el derrame es de origen benigno. Por tanto, la determinación de calprotectina evitaría a estos pacientes pruebas invasivas posteriores, y las pruebas a las que se someterían serían las específicas para enfermedades benignas. Sin embargo, si los niveles de calprotectina son inferiores a 736 ng/mL no podría excluirse determinantemente la malignidad, por lo que estos pacientes tendrían que ser sometidos a pruebas diagnósticas adicionales como la toracoscopia o biopsia pleural, pruebas invasivas necesarias para confirmar la presencia de enfermedad maligna. 250 Discusión Figura 54. Algoritmo de diagnóstico de derrame pleural incluyendo la determinación de calprotectina. A pesar de su potencial utilidad clínica, estos resultados deben validarse antes de aplicarlos en la rutina hospitalaria. En este sentido, al realizar la validación habría que incrementar el número de pacientes, en particular en el caso de algunas patologías, que deberían ser reclutados en diferentes hospitales. También sería necesario realizar la cuantificación de los niveles de calprotectina en distintos laboratorios, para confirmar la robustez del método. 251 5. Conclusiones Conclusiones Conclusiones 1. Para el estudio del proteoma del fluido pleural humano la cromatografía de afinidad múltiple es adecuada como método de fraccionamiento previo a la electroforesis bidimensional. Este prefraccionamiento permite el enriquecimiento en proteínas minoritarias, el incremento de la resolución de los mapas proteicos y la detección de proteínas poco abundantes en el fluido pleural. 2. La comparación de los mapas bidimensionales de fluido pleural de individuos con enfermedad tuberculosa y de pacientes con cáncer de pulmón no microcítico ha permitido la detección de diferencias estadísticamente significativas en la expresión de 17 proteínas, pudiendo considerarse candidatos a marcadores del derrame pleural maligno. De ellas, en especial las proteínas PEDF, gelsolina, TIMP-2, S 100 A8 y S 100 A9 son las de mayor interés, por su estrecha relación con el proceso tumoral. 3. La determinación de los parámetros diagnósticos del PEDF, medido en el fluido pleural, reveló su escasa utilidad para discriminar pacientes según la etilogía maligna o benigna del derrame. Este resultado es concordante con la existencia de múltiples isoformas de ésta proteína en el fluido pleural. 4. El heterodímero calprotectina, formado por la unión de las proteínas S 100 A8 y S 100 A9 se ha revelado en este estudio como un excelente marcador no invasivo para determinar el origen maligno o benigno del derrame pleural. 255 Conclusiones 5. En clínica la calprotectina sería de gran utilidad como método complementario a la citología, puesto que permitiría la clasificación correcta de pacientes con derrame pleural maligno cuya citología fuese negativa, y evitaría la realización de pruebas invasivas innecesarias en pacientes con derrame pleural benigno. 256 Bibliografía Bibliografía Bibliografía Abrams LD. A pleural-biopsy punch. Lancet 1958;1(7010):30-31. Abramson LP, Stellmach V, Doll JA, Cornwell M, Arensman RM, Crawford SE. Wilms´ tumor growth is suppressed by antiangiogenic pigment epithelium-derived factor in a xenograft model. J Pediatr Surg. 2003;38(3):336-342. Adams RF, Gleeson FV. Percutaneous Image-guided Cutting-Needle Biopsy of the Pleura in the Presence of a Suspected Malignant Effusion. Radiology. 2001;219(2):510-514. Adams RF, Gray W, Davies RJO, Gleeson FV. Percutaneous ImageGuided Cutting Needle Biopsy of the Pleura in the Diagnosis of Malignant Mesothelioma. Chest. 2001;120(6):1798-1802. Aggarwal AN, Gupta D, Jindal SK. Diagnosis of tuberculous pleural effusion. Indian J Chest Dis Allied Sci. 1999;41(2):89-100. Ahmad A, Bayley DL, He S, Stockley RA. Myeloid related protein-8/14 stimulates interleukin-8 production in airway epithelial cells. American journal of respiratory cell and molecular biology. 2003;29(4):523. Ahmed FE. Sample preparation and fractionation for proteome analysis and cancer biomarker discovery by mass spectrometry. Journal of separation science. 2009;32(5‐6):771-798. Alaiya AA, Franzén B, Moberger B, Silfverswärd C, Linder S, Auer G. Two‐dimensional gel analysis of protein expression in ovarian tumors shows a low degree of intratumoral heterogeneity. From Genome to Proteome. 1999:459-466. Alataş F, Alataş Ö, Metintaş M, Çolak Ö, Harmanci E, Demir S. Diagnostic value of CEA, CA 15-3, CA 19-9, CYFRA 21-1, NSE and TSA assay in pleural effusions. Lung Cancer. 2001;31(1):9-16. Alberdi E, Aymerich MS, Becerra SP. Binding of pigment epitheliumderived factor (PEDF) to retinoblastoma cells and cerebellar granule neurons. J Biol Chem. 1999;274(44):31605. 259 Bibliografía Alemán C, Sanchez L, Alegre J, Ruiz E, Vázquez A, Soriano T, Teixidor J, Andreu J, Felip E, Armadans L, Fernández De Sevilla L. Differentiating between malignant and idiopathicpleural effusions: the value of diagnosticprocedures. QJM. 2007;100(6):351-359. Alexandrakis MG, Coulocheri SA, Bouros D, Vlachonikolis IG, Eliopoulos GD. Significance of alpha-2-macroglobulin, alpha-1-acid glycoprotein, and C-reactive protein in pleural effusion differentiation. Respiration. 2000;67(1):30-35. Altruda F, Poli V, Restagno G, Argos P, Cortese R, Silengo L. The primary structure of human hemopexin deduced from cDNA sequence: evidence for internal, repeating homology. Nucleic Acids Res. 1985;13(11):3841-3859. Antony VB. Immunological mechanisms in pleural disease. European Respiratory Journal. 2003;21(3):539-544. Antony VB, Loddenkemper R, Astoul P, Boutin C, Goldstraw P, Hott J P, et al. Management of malignant pleural effusions. American journal of respiratory and critical care medicine. 2000;162(5):1987. Antony VB, Loddenkemper R, Astoul P, Boutin C, Goldstraw P, Hott J P, et al. Management of malignant pleural effusions. European Respiratory Journal. 2001;18(2):402-419. Antunes G, Neville E. Management of malignant pleural effusions. Thorax. 2000;55(12):981-983. Arai K, Takano S, Teratani T, Ito Y, Yamada T, Nozawa R. S100A8 and S100A9 overexpression is associated with poor pathological parameters in invasive ductal carcinoma of the breast. Curr Cancer Drug Targets. 2008 2008 Jun;8(4):243-252. Atalay F, Ernam D, Hasanoglu HC, Karalezli A, Kaplan Ö. Pleural adenosine deaminase in the separation of transudative and exudative pleural effusions. Clin Biochem. 2005;38(12):1066-1070. Bailar III JC, Mosteller F. Medical technology assessment. Medical uses of statistics 1992:393-412. Bass Jr JB, Farer LS, Hopewell PC, O'Brien R, Jacobs RF, Ruben F, et al. Treatment of tuberculosis and tuberculosis infection in adults and children. American Thoracic Society and The Centers for Disease Control 260 Bibliografía and Prevention. American journal of respiratory and critical care medicine. 1994;149(5):1359. Bast Jr RC, Ravdin P, Hayes DF, Bates S, Fritsche Jr H, Jessup JM, et al. 2000 update of recommendations for the use of tumor markers in breast and colorectal cancer: clinical practice guidelines of the American Society of Clinical Oncology. Journal of Clinical Oncology. 2001;19(6):1865-1878. Beck JR, Shultz EK. The use of relative operating characteristic (ROC) curves in test performance evaluation. Arch Pathol Lab Med. 1986;110(1):13. Bence Jones H. Papers on chemical pathology. The Lancet. 1847;2:269270. Bento I, Peixoto C, Zaitsev VN, Lindley PF. Ceruloplasmin revised: structural and functional roles of various metal cation-binding sites. Acta Crystallogr D Biol Crystallogr. 2007;63(Pt 2):240-248. Berger HW, Mejia E. Tuberculous pleurisy. Chest 1973;63(1):88. Bi X, Lin Q, Foo TW, Joshi S, You T, Shen HM, Ong CN, et al. Proteomic analysis of colorectal cancer reveals alterations in metabolic pathways: mechanism of tumorigenesis. Molecular and Cell Proteomics. 2006 Jun;5(6):1119-1130. Bielsa S, Esquerda A, Salud A, Montes A, Arellano E, RodríguezPanadero F, et al. High levels of tumor markers in pleural fluid correlate with poor survival in patients with adenocarcinomatous or squamous malignant effusions. Eur J Intern Med. 2009;20(4):383-386. Bielsa S, Martín-Juan J, Porcel JM, Rodríguez-Panadero F. Diagnostic and prognostic implications of pleural adhesions in malignant effusions. Journal of Thoracic Oncology 2008;3(11):1251. Bilak MM, Becerra SP, Vincent AM, Moss BH, Aymerich MS, Kuncl RW. Identification of the neuroprotective molecular region of pigment epithelium-derived factor and its binding sites on motor neurons. The Journal of neuroscience. 2002;22(21):9378-9386. Blonder J, Goshe MB, Moore RJ, Pasa-Tolic L, Masselon CD, Lipton MS, Smith RD. Enrichment of integral membrane proteins for proteomic 261 Bibliografía analysis using liquid chromatography-tandem Journal of proteome research. 2002;1(4):351-360. mass spectrometry. Boehm T, Folkman J, Browder T, O'Reilly MS. Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance. Nature. 1997;390(6658):404-406. Botana-Rial M, Casado-Rey P, Leiro-Fernández V, Andrade-Olivié M, Represas-Represas C, Fernández-Villar A. Validity of procalcitonin and C-reactive protein measurement when differentiating between benign and malignant pleural effusion. Clin Lab. 2011;57(5-6):373. Bouros D, Froudarakis 2000;118(3):577-579. M, Siafakas NM. Pleurodesis. Chest. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976;72(1):248-254. Branca P, Rodriguez RM, Rogers JT, Ayo DS, Moyers JP, Light RW. Routine measurement of pleural fluid amylase is not indicated. Arch Intern Med. 2001;161(2):228. Broaddus VC, Light RW. What is the origin of pleural transudates and exudates? Chest. 1992;102:658. Broaddus VC. Diuresis and transudative effusions—changing the rules of the game. Am J Med. 2001 6/15;110(9):732-735. Brun JG, Jonsson R, Haga HJ. Measurement of plasma calprotectin as an indicator of arthritis and disease activity in patients with inflammatory rheumatic diseases. J Rheumatol. 1994;21(4):733. Buccheri G, Ferrigno D. Lung tumor markers of cytokeratin origin: an overview. Lung Cancer. 2001;34:S65-S69. Bueno CE, Clemente MG, Castro BC, Martin LM, Ramos SR, Panizo AG, et al. Cytologic and bacteriologic analysis of fluid and pleural biopsy specimens with Cope's needle: study of 414 patients. Arch Intern Med. 1990;150(6):1190. Burgess LJ. Biochemical analysis of pleural, peritoneal and pericardial effusions. Clinica chimica acta. 2004;343(1-2):61-84. 262 Bibliografía Burgess LJ, Maritz FJ, Taljaard JJ. Comparative analysis of the biochemical parameters used to distinguish between pleural transudates and exudates. Chest. 1995;107(6):1604-1609. Byrjalsen I, Mose Larsen P, Fey SJ, Nilas L, Larsen MR, Christiansen C. Two-dimensional gel analysis of human endometrial proteins: characterization of proteins with increased expression in hyperplasia and adenocarcinoma. Mol Hum Reprod. 1999;5(8):748. Byrne JC, Downes MR, O’Donoghue N, O’Keane C, O’Neill A, Fan Y, et al. 2D-DIGE as a strategy to identify serum markers for the progression of prostate cancer. Journal of proteome research. 2008;8(2):942-957. Cai J, Parr C, Watkins G, Jiang WG, Boulton M. Decreased pigment epithelium–derived factor expression in human breast cancer progression. Clinical cancer research. 2006;12(11):3510-3517. Cañas B, Piñeiro C, Calvo E, López-Ferrer D, Gallardo JM. Trends in sample preparation for classical and second generation proteomics. Journal of Chromatography A. 2007;1153(1-2):235-258. Canney PA, Moore M, Wilkinson PM, James RD. Ovarian cancer antigen CA125: a prospective clinical assessment of its role as a tumour marker. Br J Cancer. 1984;50(6):765. Cao Y. Therapeutic potentials of angiostatin in the treatment of cancer. Haematologica. 1999;84(7):643-650. Carter A, Martin NH. Serum sialic acid levels in health and disease. J Clin Pathol. 1962;15(1):69-72. Chang DB, Yang PC, Luh KT, Kuo SH, Yu CJ. Ultrasound-guided pleural biopsy with Tru-Cut needle. Chest. 1991;100(5):1328-1333. Chen J, Ye L, Zhang L, Jiang WG. The molecular impact of pigment epithelium-derived factor, PEDF, on lung cancer cells and the clinical significance. Int J Oncol. 2009;35(1):159-166. Chiavaccini L, Hassel DM, Shoemaker ML, Charles JB, Belknap JK, Ehrhart EJ. Detection of calprotectin and apoptotic activity within the equine colon from horses with black walnut extract-induced laminitis. Vet Immunol Immunopathol. 2011 12/15;144(3–4):366-373. 263 Bibliografía Cho SY, Lee EY, Lee JS, Kim HY, Park JM, Kwon MS, et al. Efficient prefractionation of low‐abundance proteins in human plasma and construction of a two‐dimensional map. Proteomics. 2005;5(13):33863396. Christ-Crain M, Müller B. Biomarkers in respiratory tract infections: diagnostic guides to antibiotic prescription, prognostic markers and mediators. European Respiratory Journal. 2007;30(3):556. Cohen S, Hossain SA. Primary carcinoma of the lung. A review of 417 histologically proved cases. Dis Chest. 1966 Jan;49(1):67-74. Cope C. New pleural biopsy needle. J Am Med Assoc. 1958;167(9):1107. Corbin BD, Seeley EH, Raab A, Feldmann J, Miller MR, Torres VJ, et al. Metal chelation and inhibition of bacterial growth in tissue abscesses. Science's STKE. 2008;319(5865):962. Cortés-Télles A, Rojas-Serrano J, Torre-Bouscoulet L. Quilotórax: frecuencia, causas y desenlaces. Neumol Cir Torax. 2010;69(3):157-162. Cosgrove GP, Brown KK, Schiemann WP, Serls AE, Parr JE, Geraci MW, et al. Pigment Epithelium–derived Factor in Idiopathic Pulmonary Fibrosis. American journal of respiratory and critical care medicine. 2004;170(3):242-251. Costa M, Quiroga T, Cruz E. Measurement of pleural fluid cholesterol and lactate dehydrogenase. Chest. 1995;108(5):1260-1263. Cottrell J, London U. Probability-based protein identification by searching sequence databases using mass spectrometry data. Electrophoresis. 1999;20(18):3551-3567. Crawford SE, Stellmach V, Ranalli M, Huang X, Huang L, Volpert O, et al. Pigment epithelium-derived factor (PEDF) in neuroblastoma: a multifunctional mediator of Schwann cell antitumor activity. J Cell Sci. 2001;114(24):4421. Cross SS, Hamdy FC, Deloulme JC, Rehman I. Expression of S100 proteins in normal human tissues and common cancers using tissue microarrays: S100A6, S100A8, S100A9 and S100A11 are all overexpressed in common cancers. Histopathology. 2005 Mar;46(3):256269. 264 Bibliografía Crowther M, Brown NJ, Bishop ET, Lewis CE. Microenvironmental influence on macrophage regulation of angiogenesis in wounds and malignant tumors. J Leukoc Biol. 2001;70(4):478-490. Davidson B, Stavnes HT, Førsund M, Berner A, Staff AC. CD105 (Endoglin) expression in breast carcinoma effusions is a marker of poor survival. The Breast. 2010;19(6):493-498. Dawson DW, Volpert OV, Gillis P, Crawford SE, Xu HJ, Benedict W, et al. Pigment epithelium-derived factor: a potent inhibitor of angiogenesis. Science. 1999;285(5425):245. De Larrea CF, Duplat A, Giampietro F, de Waard J, Luna J, Singh M, et al. Diagnostic accuracy of immunological methods in patients with tuberculous pleural effusion from Venezuela. Investigación Clínica. 2011;52(1). De Seny D, Fillet M, Ribbens C, Marée R, Meuwis MA, Lutteri L, et al. Monomeric calgranulins measured by SELDI-TOF mass spectrometry and calprotectin measured by ELISA as biomarkers in arthritis. Clin Chem. 2008;54(6):1066-1075. DeFrancis N, Kloske E, Albano E. Needle biopsy of the parietal pleurapreliminary report. N Engl J Med. 1955;252(22):948-951. Dejsomritrutai W, Senawong S, Promkiamon B. Diagnostic utility of CYFRA 21‐1 in malignant pleural effusion. Respirology. 2001;6(3):213216. Delahunty CM, Yates JR3. MudPIT: multidimensional protein identification technology. Biotechniques. 2007 2007 Nov;43(5):563-565, 567. Desiderio DM, Nibbering NM editors. Cancer Biomarkers. Analytical techniques for discovery. ; 2007. Dosaka-Akita H, Hommura F, Fujita H, Kinoshita I, Nishi M, Morikawa T, et al. Frequent loss of gelsolin expression in non-small cell lung cancers of heavy smokers. Cancer Res. 1998;58(2):322. Dowling P, O'Driscoll L, Meleady P, Henry M, Roy S, Ballot J, et al. 2‐D difference gel electrophoresis of the lung squamous cell carcinoma 265 Bibliografía versus normal sera demonstrates consistent alterations in the levels of ten specific proteins. Electrophoresis. 2007;28(23):4302-4310. Dowsey AW, Dunn MJ, Yang GZ. The role of bioinformatics in two‐dimensional gel electrophoresis. Proteomics. 2003;3(8):1567-1596. Economidou F, Tzortzaki EG, Schiza S, Antoniou KM, Neofytou E, Zervou M, et al. Microsatellite DNA analysis does not distinguish malignant from benign pleural effusions. Oncol Rep. 2007;18(6):15071512. Edelman GM, Poulik MD. Studies on structural units of the γ-globulins. J Exp Med. 1961;113(5):861. Ek ETH, Dass CR, Choong PFM. Pigment epithelium-derived factor: a multimodal tumor inhibitor. Molecular cancer therapeutics. 2006;5(7):1641. Ek ETH, Dass CR, Choong PFM. PEDF: a potential molecular therapeutic target with multiple anti-cancer activities. Trends Mol Med. 2006;12(10):497-502. Emad A, Rezaian GR. Diagnostic value of closed percutaneous pleural biopsy vs pleuroscopy in suspected malignant pleural effusion or tuberculous pleurisy in a region with a high incidence of tuberculosis: a comparative, age-dependent study. Respir Med. 1998 3;92(3):488-492. Espejel F, Roa JC. Surface enhanced laser desorption/ionization (SELDI): tecnología proteómica y su aplicación en oncología. Medicina clínica. 2008;131(8):312-317. Evans DJ. The use of adjunctive corticosteroids in the treatment of pericardial, pleural and meningeal tuberculosis: Do they improve outcome? Respir Med. 2008;102(6):793-800. Faca V, Pitteri S, Newcomb L, Glukhova V, Phanstiel D, Krasnoselsky A, et al. Contribution of protein fractionation to depth of analysis of the serum and plasma proteomes. J Proteome Res. 2007 Sep;6(9):3558-3565. Falk T, Gonzalez RT, Sherman SJ. The yin and yang of VEGF and PEDF: multifaceted neurotrophic factors and their potential in the treatment of Parkinson’s disease. International journal of molecular sciences. 2010;11(8):2875-2900. 266 Bibliografía Feng C, Ding Q, Zhang Y, Jiang H, Wen H, Wang P, et al. Pigment epithelium-derived factor expression is down-regulated in bladder tumors and correlates with vascular endothelial growth factor and matrix metalloproteinase-9. Int Urol Nephrol. 2011;43(2):383-390. Ferreiro L, Álvarez-Dobaño JM, Valdés L. Systemic Diseases and the Pleura. Archivos de Bronconeumología. 2011 7;47(7):361-370. Ferrer J. Pleural 1997;10(4):942-947. tuberculosis. European Respiratory Journal. Ferrer J, Roldán J. Clinical management of the patient with pleural effusion. Eur J Radiol. 2000 5/1;34(2):76-86. Ferrer J, Roldán J, Teixidor J, Pallisa E, Gich I, Morell F. Predictors of Pleural Malignancy in Patients With Pleural Effusion Undergoing Thoracoscopy*. Chest. 2005;127(3):1017-1022. Ferrer J, Villarino MA, Encabo G, Felip E, Bermejo B, Vilà S, et al. Diagnostic utility of CYFRA 21-1, carcinoembryonic antigen, CA 125, neuron specific enolase, and squamous cell antigen level determinations in the serum and pleural fluid of patients with pleural effusions. Cancer. 1999 15;86(8):1488-1495. Ferrer JS, Muñoz XG, Orriols RM, Morell FB, Light RW. Evolution of idiopathic pleural effusion. Chest. 1996;109(6):1508-1513. Filleur S, Volz K, Nelius T, Mirochnik Y, Huang H, Zaichuk TA, et al. Two functional epitopes of pigment epithelial–derived factor block angiogenesis and induce differentiation in prostate cancer. Cancer Res. 2005;65(12):5144. Foell D, Wittkowski H, Vogl T, Roth J. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules. J Leukoc Biol. 2007;81(1):28-37. Folkman J. Antiangiogenesis in cancer therapy--endostatin and its mechanisms of action. Exp Cell Res. 2006;312(5):594-607. Folkman J. What is the evidence that tumors are angiogenesis dependent? J Natl Cancer Inst. 1990;82(1):4-6. 267 Bibliografía Freixinet Gilart J, Ramírez Gil ME, Gallardo Valera G, Moreno Casado P. Traumatismos torácicos. Archivos de Bronconeumología. 2011;47, Supplement 3(0):9-14. Froudarakis ME. Diagnostic work-up of pleural effusions. Respiration. 2008;75(1):4-13. Funatsu H, Yamashita H, Nakamura S, Mimura T, Eguchi S, Noma H, et al. Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology. 2006;113(2):294-301. Gaïni S, Koldkjær OG. Procalcitonin, lipopolysaccharide-binding protein, interleukin-6 and C-reactive protein in community-acquired infections and sepsis: a prospective study. Critical Care. 2006;10(2):R53. Garbacki N, Di Valentin E, Piette J, Cataldo D, Crahay C, Colige A. Matrix metalloproteinase 12 silencing: A therapeutic approach to treat pathological lung tissue remodeling? Pulm Pharmacol Ther. 2009;22(4):267-278. García RR, de Prado Urquía MMM, de Larrea LB. Separación de trasudados y exudados pleurales mediante la cuantificación de parámetros bioquímicos. Rev Clin Esp. 2004;204(10):511-520. Garrels JI. The QUEST system for quantitative analysis of twodimensional gels. J Biol Chem. 1989;264(9):5269. Gaspar MJ, De Miguel J, Díaz JDG, Díez M. Clinical utility of a combination of tumour markers in the diagnosis of malignant pleural effusions. Anticancer Res. 2008;28(5B):2947-2952. Gebhardt C, Németh J, Angel P, Hess J. S100A8 and S100A9 in inflammation and cancer. Biochem Pharmacol. 2006;72(11):1622-1631. Ghavami S, Chitayat S, Hashemi M, Eshraghi M, Chazin WJ, Halayko AJ, et al. S100A8/A9: a Janus-faced molecule in cancer therapy and tumorgenesis. Eur J Pharmacol. 2009;625(1-3):73-83. Giusti LGDL, Iacconi P, Da Valle Y, Ciregia F, Ventroni T, Donadio E, et al. A proteomic profile of washing fluid from the colorectal tract to search for potential biomarkers of colon cancer. Molecular BioSystems. 2012. 268 Bibliografía Gold P, Freedman SO. Demonstration of tumor-specific antigens in human colonic carcinomata by immunological tolerance and absorption techniques. J Exp Med. 1965;121(3):439-462. González Buitrago JM, Ferreira L, Muniz MC. Proteómica clínica y nuevos biomarcadores en los líquidos biológicos. Med Clin. 2008;131(11):426-434. Good DJ, Polverini PJ, Rastinejad F, Le Beau MM, Lemons RS, Frazier WA, et al. A tumor suppressor-dependent inhibitor of angiogenesis is immunologically and functionally indistinguishable from a fragment of thrombospondin. Proceedings of the National Academy of Sciences. 1990;87(17):6624. Good DM, Thongboonkerd V, Novak J, Bascands JL, Schanstra JP, Coon JJ, et al. Body fluid proteomics for biomarker discovery: lessons from the past hold the key to success in the future. Journal of proteome research. 2007;6(12):4549-4555. Görg A, Weiss W, Dunn MJ. Current two‐dimensional electrophoresis technology for proteomics. Proteomics. 2004;4(12):3665-3685. Gornall AG, Bardawill CJ, David MM. Determination of serum proteins by means of the biuret reaction. J Biol Chem. 1949;177(2):751-766. Greenlee LF, Lawler DF, Freeman BD, Marrot B, Moulin P. Reverse osmosis desalination: Water sources, technology, and today's challenges. Water Res. 2009;43(9):2317-2348. Grijalva CG, Zhu Y, Nuorti JP, Griffin MR. Emergence parapneumonic empyema in the USA. Thorax. 2011;66(8):663-668. of Gu P, Huang G, Chen Y, Zhu C, Yuan J, Sheng S. Diagnostic utility of pleural fluid carcinoembryonic antigen and CYFRA 21-1 in patients with pleural effusion: a systematic review and meta-analysis. J Clin Lab Anal. 2007;21(6):398-405. Guan M, Yam HF, Su B, Chan KP, Pang CP, Liu WW, et al. Loss of pigment epithelium derived factor expression in glioma progression. J Clin Pathol. 2003;56(4):277. Haddad FJ, Younes RN, Gross JL, Deheinzelin D. Pleurodesis in patients with malignant pleural effusions: talc slurry or bleomycin? 269 Bibliografía Results of a prospective randomized trial. World J Surg. 2004;28(8):749752. Halin S, Wikström P, Rudolfsson SH, Stattin P, Doll JA, Crawford SE, et al. Decreased pigment epithelium-derived factor is associated with metastatic phenotype in human and rat prostate tumors. Cancer Res. 2004;64(16):5664. Halla JT, Schrohenloher RE, Volanakis JE. Immune complexes and other laboratory features of pleural effusions. Ann Intern Med. 1980;92(6):748. Hammer HB, Ødeg̊ard S, Fagerhol MK, Landewé R, Van Der Heijde D, Uhlig T, et al. Calprotectin (a major leucocyte protein) is strongly and independently correlated with joint inflammation and damage in rheumatoid arthritis. Ann Rheum Dis. 2007;66(8):1093-1097. Hammer HB, Ødegård S, Syversen SW, Landewé R, van der Heijde D, Uhlig T, et al. Calprotectin (a major S100 leucocyte protein) predicts 10year radiographic progression in patients with rheumatoid arthritis. Ann Rheum Dis. 2010;69(01):150-154. Hanash SM, Pitteri SJ, Faca VM. Mining the plasma proteome for cancer biomarkers. Nature. 2008;452(7187):571-579. Haro-Estarriol M, Casamitjá-Sot MT, Alvarez-Castillo LA, CalderónLópez JC, Martínez-Somolinos S, Sebastián-Quetglas F. Utility of amylase levels in malignant pleural effusion. Med Clin. 2007 Sep 22;129(10):372-374. Hase R, Miyamoto M, Uehara H, Kadoya M, Ebihara Y, Murakami Y, et al. Pigment Epithelium–Derived Factor Gene Therapy Inhibits Human Pancreatic Cancer in Mice. Clinical cancer research. 2005;11(24):87378744. Heffner JE. Diagnosis and management of malignant pleural effusions. Respirology. 2008;13(1):5-20. Heffner JE, Klein JS. Recent advances in the diagnosis and management of malignant pleural effusions. Mayo Clinic Proceedings: Mayo Clinic. 2008;83(2):235-50. 270 Bibliografía Heffner JE, Nietert PJ, Barbieri C. Pleural Fluid pH as a Predictor of Survival for Patients With Malignant Pleural Effusions*. Chest. 2000;117(1):79-86. Hegmans J, Hemmes A, Lambrecht B. Proteomics of Pleural Effusion. Proteomics of Human Body Fluids. 2007:285-307. Hellman NE, Gitlin JD. Ceruloplasmin metabolism and function. Annu Rev Nutr. 2002;22(1):439-458. Herbert B. Advances in protein solubilisation for two‐dimensional electrophoresis. From Genome to Proteome. 1999:80-83. Hermani A, Hess J, De Servi B, Medunjanin S, Grobholz R, Trojan L, et al. Calcium-binding proteins S100A8 and S100A9 as novel diagnostic markers in human prostate cancer. Clinical cancer research. 2005;11(14):5146-5152. Hooper C, Lee YC, Maskell N. Investigation of a unilateral pleural effusion in adults: British Thoracic Society pleural disease guideline 2010. Thorax. 2010;65(Suppl 2):ii4-ii17. Hsieh WY, Chen MW, Ho HT, You TM, Lu YT. Identification of differentially expressed proteins in human malignant pleural effusions. European Respiratory Journal. 2006;28(6):1178-1185. Hu S, Loo JA, Wong DT. Human body fluid proteome analysis. Proteomics. 2006;6(23):6326-6353. Huggins JT. Chylothorax and cholesterol pleural effusion. Semin Respir Crit Care. 2010 Dec;31(6):743-750. Hung TL, Chen FF, Liu JM, Lai WW, Hsiao AL, Huang WT, et al. Clinical evaluation of HER-2/neu protein in malignant pleural effusionassociated lung adenocarcinoma and as a tumor marker in pleural effusion diagnosis. Clinical cancer research. 2003;9(7):2605-2612. Hurwitz S, Leiman G, Shapiro C. Mesothelial cells in pleural fluid: TB or not TB. S Afr Med J. 1980;57:937-939. Imecik O, Ozer F. Diagnostic value of sialic acid in malignant pleural effusions. Chest. 1992;102(6):1819-1822. 271 Bibliografía Iqbal J, Liu T, Mapow B, Swami VK, Hou JS. Importance of flow cytometric analysis of serous effusions in the diagnosis of hematopoietic neoplasms in patients with prior hematopoietic malignancies. Anal Quant Cytol Histol. 2010 Jun;32(3):161-165. Ishikawa H, Satoh H, Kamma H, Naito T, Yamashita YT, Ohtsuka M, et al. Elevated sialyl Lewis Xi antigen levels in pleural effusions in patients with carcinomatous pleuritis. Internal medicine. 1997;36(10):685-689. Jantz MA, Antony VB. Pathophysiology of the pleura. Respiration. 2008;75(2):121-133. Järvisalo J, Hakama M, Knekt P, Stenman UH, Leino A, Teppo L, et al. Serum tumor markers CEA, CA 50, TATI, and NSE in lung cancer screening. Cancer. 1993;71(6):1982-1988. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA: a cancer journal for clinicians. 2009;59(4):225-249. Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, et al. Cancer statistics, 2006. CA: a cancer journal for clinicians. 2006;56(2):106-130. Jin J, Guan M, Hin FY. Pigment epithelium derived factor: a potent inhibitor of angiogenesis. Recent Advances In Ophthalmology. 2002. Johnston WW. The malignant pleural effusion. A review of cytopathologic diagnoses of 584 specimens from 472 consecutive patients. Cancer. 1985;56(4):905-909. Jones PW, Moyers JP, Rogers JT, Rodriguez RM, Lee YC, Light RW. Ultrasound-Guided Thoracentesis*. Chest. 2003;123(2):418-423. Jones T, Price P. Development and experimental medicine applications of PET in oncology: a historical perspective. Lancet Oncol. 2012;13(3):e116-25. Jones T, Price P. Development and experimental medicine applications of PET in oncology: a historical perspective. The Lancet Oncology. 2012;13(3):e116-e125. Kakari S, Stringou E, Toumbis M, Ferderigos AS, Poulaki E, Chondros K, et al. Five tumor markers in lung cancer: significance of 272 Bibliografía total and "lipid"-bound sialic acid. Anticancer Res. 1991;11(6):21072110. Kallakury BVS, Karikehalli S, Haholu A, Sheehan CE, Azumi N, Ross JS. Increased expression of matrix metalloproteinases 2 and 9 and tissue inhibitors of metalloproteinases 1 and 2 correlate with poor prognostic variables in renal cell carcinoma. Clinical cancer research. 2001;7(10):3113-3119. Kallel L, Fekih M, Boubaker J, Filali A. Faecal calprotectin in inflammatory bowel diseases: review. Tunis Med. 2011;89(5):425-429. Kamble R, Wilson CS, Fassas A, Desikan R, Siegel DS, Tricot G, et al. Malignant pleural effusion of multiple myeloma: prognostic factors and outcome. Leuk Lymphoma. 2005;46(8):1137-1142. Kane D, Roth J, Frosch M, Vogl T, Bresnihan B, FitzGerald O. Increased perivascular synovial membrane expression of myeloid‐related proteins in psoriatic arthritis. Arthritis & Rheumatism. 2003;48(6):16761685. Kataria YP, Khurshid I. Adenosine deaminase in the diagnosis of tuberculous pleural effusion. Chest. 2001;120(2):334-336. Kelleher NL. Peer Reviewed: 2004;76(11):196-203. Top-Down Proteomics. Anal Chem. Khaleeq G, Musani AI. Emerging paradigms in the management of malignant pleural effusions. Respir Med. 2008;102(7):939-948. Kim HJ, Kang HJ, Lee H, Lee ST, Yu MH, Kim H, et al. Identification of S100A8 and S100A9 as serological markers for colorectal cancer. Journal of proteome research. 2009;8(3):1368-1379. Kim S, Sahn SA. Postcardiac Injury Syndrome. Chest. 1996;109(2):570572. Kim SJ, Ko SH, Kang KH, Han J. Direct seawater desalination by ion concentration polarization. Nature Nanotechnology. 2010;5(4):297-301. Kinasewitz G. Transudative effusions. European Respiratory Journal. 1997;10(3):714-718. 273 Bibliografía Klein E, Klein JB, Thongboonkerd V. Two-dimensional gel electrophoresis: a fundamental tool for expression proteomics studies. Contrib Nephro. 2004;141:25-39. Klimiuk J, Krenke R. Role of biomarkers in making the diagnosis of tuberculous pleurisy. Pneumonol Alergol Pol. 2011;79(4):288-297. Kodate M, Kasai T, Hashirnoto H, Yasumoto K, Iwata Y, Manabe H. Expression of matrix metalloproteinase (gelatinase) in T1 adenocarcinoma of the lung. Pathol Int. 1997;47(7):461-469. Kolditz M, Halank M, Schiemanck CS, Schmeisser A, Höffken G. High diagnostic accuracy of NT-proBNP for cardiac origin of pleural effusions. European Respiratory Journal. 2006;28(1):144-150. Korndorfer IP, Brueckner F, Skerra A. The Crystal Structure of the Human (S100A8/S100A9) 2 Heterotetramer, Calprotectin, Illustrates how Conformational Changes of Interacting [alpha]-Helices Can Determine Specific Association of Two EF-hand Proteins. J Mol Biol. 2007;370(5):887-898. Kostakis ID, Cholidou KG, Kallianidis K, Perrea D, Antsaklis A. The role of calprotectin in obstetrics and gynecology. European Journal of Obstetrics & Gynecology and Reproductive Biology 2010;151(1):3-9. Koster FT, McGregor DD, Mackaness GB. The mediator of cellular immunity: II. Migration of immunologically committed lymphocytes into inflammatory exudates. J Exp Med 1971 1971 Feb 1;133(2):400-409. Kremer R, Best LA, Savulescu D, Gavish M, Nagler RM. Pleural fluid analysis of lung cancer vs benign inflammatory disease patients. Br J Cancer 2010;102(7):1180-1184. Kristinsson J, Røseth A, Fagerhol MK, Aadland E, Schjønsby H, Børmer OP, et al. Fecal calprotectin concentration in patients with colorectal carcinoma. Diseases of the colon & rectum 1998;41(3):316-321. Kumar RK, Yang Z, Bilson S, Thliveris S, Cooke BE, Geczy CL. Dimeric S100A8 in human neutrophils is diminished after phagocytosis. J Leukoc Biol 2001;70(1):59-64. Kunter E, Ilvan A, Kilic E, Cerrahoglu K, Isitmangil T, Capraz F, et al. The effect of pleural fluid content on the development of pleural 274 Bibliografía thickness. The International Journal of Tuberculosis and Lung Disease 2002;6(6):516-522. Kuralay F, Tokgöz Z, Cömlekci A. Diagnostic usefulness of tumour marker levels in pleural effusions of malignant and benign origin. Clinica chimica acta 2000;300(1-2):43-55. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970 Aug 15;227(5259):680-685. Lai RS, Chen CC, Lee PC, Lu JY. Evaluation of cytokeratin 19 fragment (CYFRA 21-1) as a tumor marker in malignant pleural effusion. Jpn J Clin Oncol 1999;29(9):421. Lawler J, Detmar M. Tumor progression: the effects of thrombospondin1 and-2. Int J Biochem Cell Biol 2004;36(6):1038-1045. Lee JH, Chang JH. Diagnostic Utility of Serum and Pleural Fluid Carcinoembryonic Antigen, Neuron-Specific Enolase, and Cytokeratin 19 Fragments in Patients With Effusions From Primary Lung Cancer*. Chest 2005;128(4):2298-2303. Lee JR, Baxter TM, Yamaguchi H, Wang TC, Goldenring JR, Anderson MG. Differential protein analysis of spasomolytic polypeptide expressing metaplasia using laser capture microdissection and two-dimensional difference gel electrophoresis. Applied Immunohistochemistry & Molecular Morphology 2003;11(2):188. Lewis CE, Pollard JW. Distinct role of macrophages in different tumor microenvironments. Cancer Res 2006;66(2):605. Li H, Bergeron S, Juncker D. Microarray-to-microarray transfer of reagents by snapping of two chips for cross-reactivity-free multiplex immunoassays. Anal Chem 2012. Liang QL, Shi HZ, Qin XJ, Liang XD, Jiang J, Yang HB. Diagnostic accuracy of tumour markers for malignant pleural effusion: a metaanalysis. Thorax 2008;63(1):35. Light RW. Pleural diseases. Curr Opin Pulm Med 2003;9(4):251. Light RW. Pleural effusion. N Engl J Med 2002;346(25):1971-1977. 275 Bibliografía Light RW. Diagnostic principles in pleural disease. European Respiratory Journal 1997;10(2):476-481. Light RW editor. Pleural Diseases 3rd Edn ed. Baltimore: Williams and Wilkins; 1995. Light RW, Erozan YS, Ball WCJ. Cells in pleural fluid. Their value in differential diagnosis. Archives of Internal Medicine 1973;132(6):854-860. Light RW, Lee YCG. Textbook of pleural diseases. : Hodder Arnold; 2008. Light RW, Macgregor MI, Luchsinger PC, Ball WCJ. Pleural effusions: the diagnostic separation of transudates and exudates. Annual of Internional Medicine. 1972;77(4):507-513. Light RW, Porcel JM. Derrame pleural paraneumónico y empiema. Med Clin 2000;115:384-391. Light RW, Rogers JT, Moyers JP, Lee Y, Rodriguez RM, Alford Jr WC, et al. Prevalence and clinical course of pleural effusions at 30 days after coronary artery and cardiac surgery. American journal of respiratory and critical care medicine 2002;166(12):1567. Lindgren J, Kuusela P, Hellström PE, Pettersson T, Klockars M. The ovarian cancer associated antigen CA 125 in patients with pleural effusions. European Journal of Cancer and Clinical Oncology 1988;24(4):737-739. Liumbruno GM. Proteomics: applications in transfusion medicine. Blood Transfusion 2008;6(2):70. Livingston RB, McCracken JD, Trauth CJ, Chen T. Isolated pleural effusion in small cell lung carcinoma: favorable prognosis. A review of the Southwest Oncology Group experience. Chest 1982;81(2):208-211. Llorente Fernández JL, Zalacaín Jorge R, Galdiz Iturri JB, Amilibia Alonso J, Capelastegui Saiz A, Crespo Notario JA, et al. Utilidad de la biopsia pleural con aguja de Cope: a propósito de 106 biopsias consecutivas. Med Clin (Barc) 1984 1984 Feb 18;82(6):242-244. Lombardi C, Tassi G, Pizzocolo G, Donato F. Clinical significance of a multiple biomarker assay in patients with lung cancer. A study with logistic regression analysis. Chest 1990;97(3):639-644. 276 Bibliografía López JL, Mosquera E, Fuentes J, Marina A, Vázquez J, Alvarez G. Two-dimensional gel electrophoresis of Mytilus galloprovincialis: differences in protein expression between intertidal and cultured mussels. Marine ecology.Progress series 2001;224:149-156. López-Abente G, Hernández-Barrera V, Pollán M, Aragones N, PerezGomez B. Municipal pleural cancer mortality in Spain. Occup Environ Med 2005;62(3):195. Lügering N, Stoll R, Kucharzik T, Schmid KW, Rohlmann G, Burmeister G, et al. Immunohistochemical distribution and serum levels of the Ca 2-binding proteins MRP8, MRP14 and their heterodimeric form MRP8/14 in Crohn’s disease. Digestion. 1995;56(5):406-415. Luque-Garcia JL, Neubert TA. Sample preparation for serum/plasma profiling and biomarker identification by mass spectrometry. Journal of Chromatography A 2007;1153(1-2):259-276. Ly L, Wasinger VC. Peptide enrichment and protein fractionation using selective electrophoresis. Proteomics 2008;8(20):4197-4208. Lyons-Boudreaux V, Mody DR, Zhai J, Coffey D. Cytologic Malignancy Versus Benignancy: How Useful Are the “Newer” Markers in Body Fluid Cytology? Arch Pathol Lab Med 2008;132(1):23-28. Macori F, Iacari V, Falchetto Osti M, Potente G, Anaveri G. Assessment of complications in patients with lung transplantation with high resolution computerized tomography. Radiol Med 1998 JulAug;96(1-2):42-47. Madoz-Gúrpide J, Cañamero M, Sanchez L, Solano J, Alfonso P, Casal JI. A proteomics analysis of cell signaling alterations in colorectal cancer. Molecular and cell proteomics 2007 2007 Dec;6(12):2150-2164. Marel M. Epidemiology of pleural effusion. European Respiratory Monograph 2002;7:146-156. Marel M, Štastny B, Melínová LŠ, Svandová E, Light RW. Diagnosis of pleural effusions. Chest 1995;107(6):1598. Marengo E, Robotti E, Antonucci F, Cecconi D, Campostrini N, Righetti PG. Numerical approaches for quantitative analysis of 277 Bibliografía two‐dimensional maps: A review of commercial software and home‐made systems. Proteomics 2005;5(3):654-666. Maskell NA, Butland RJA. BTS guidelines for the investigation of a unilateral pleural effusion in adults. Thorax 2003;58(suppl 2):ii8. Mathivanan S, Ji H, Simpson RJ. Exosomes: extracellular organelles important in intercellular communication. Journal of proteomics 2010;73(10):1907-1920. Matsumoto K, Ishikawa H, Nishimura D, Hamasaki K, Nakao K, Eguchi K. Antiangiogenic property of pigment epithelium‐derived factor in hepatocellular carcinoma. Hepatology 2004;40(1):252-259. McCormick MM, Rahimi F, Bobryshev YV, Gaus K, Zreiqat H, Cai H, et al. S100A8 and S100A9 in human arterial wall. J Biol Chem 2005;280(50):41521. McLoud TC, Flower CD. Imaging the pleura: sonography, CT, and MR imaging. Am J Roentgenol 1991;156(6):1145-1153. Medford AR, Maskell 2005;961(81):702-710. N. Pleural Effusion. Postgrad Med J Meisel S, Shamiss A, Thaler M, Nussinovitch N, Rosenthal T. Pleural fluid to serum bilirubin concentration ratio for the separation of transudates from exudates. Chest 1990;98(1):141-144. Meyer PC. Metastatic carcinoma of the pleura. Thorax 1966;21(5):437. Mezger J, Permanetter W, Gerbes AL, Wilmanns W, Lamerz R. Tumour associated antigens in diagnosis of serous effusions. J Clin Pathol 1988;41(6):633. Miedouge M, Rouzaud P, Salama G, Pujazon MC, Vincent C, Mauduyt MA, et al. Evaluation of seven tumour markers in pleural fluid for the diagnosis of malignant effusions. Br J Cancer 1999;81(6):1059. Mishra EK, Davies RJO. Advances in the investigation and treatment of pleural effusions. Expert Review of Respiratory Medicine 2010;4(1):123133. Molina A, Ramirez M, García Casas O, Puig Li, Cáceres-Palou Z, Gea J, Bago J. Nuevas Perspectivas en el tratamiento quirúrgico de las 278 Bibliografía enfermedades graves de la caja torácica que cursan con afectación respiratoria. Arch. Bronconeumol. 2003; 39: 507-513. Molloy MP. Two-dimensional electrophoresis of membrane proteins using immobilized pH gradients. Anal Biochem 2000;280(1):1-10. Morelock SY, Sahn SA. Drugs and the Pleura*. Chest 1999;116(1):212221. Nakamura K, Yamagishi S, Adachi H, Kurita Nakamura Y, Matsui T, Inoue H. Serum levels of pigment epithelium‐derived factor (PEDF) are positively associated with visceral adiposity in Japanese patients with type 2 diabetes. Diabetes Metab Res 2009;25(1):52-56. Nance KV, Shermer RW, Askin FB. Diagnostic efficacy of pleural biopsy as compared with that of pleural fluid examination. Mod Pathol 1991 1991 May;4(3):320-324. Nisapakultorn K, Ross KF, Herzberg MC. Calprotectin expression inhibits bacterial binding to mucosal epithelial cells. Infect Immun 2001;69(6):3692-3696. Niwa T. Biomarker discovery for kidney diseases by mass spectrometry. Journal of Chromatography B 2008;870(2):148-153. Ødegaard E, Davidson B, Engh V, Onsrud M, Staff AC. Assessment of endoglin and calprotectin as potential biomarkers in ovarian carcinoma and borderline tumors of the ovary. Obstet Gynecol 2008;199(5):533. e1533. e8. Ogata N, Matsuoka M, Matsuyama K, Shima C, Tajika A, Nishiyama T, et al. Plasma concentration of pigment epithelium-derived factor in patients with diabetic retinopathy. Journal of Clinical Endocrinology & Metabolism 2007;92(3):1176-1179. Ogirala RG, Agarwal V, Vizioli LD, Pinsker KL, Aldrich TK. Comparison of the Raja and the Abrams pleural biopsy needles in patients with pleural effusion. American Journal of Respiratory and Critical Care Medicine 1993;147(5):1291. Okano T, Kondo T, Kakisaka T, Fujii K, Yamada M, Kato H, et al. Plasma proteomics of lung cancer by a linkage of multi‐dimensional 279 Bibliografía liquid chromatography and two‐dimensional electrophoresis. Proteomics 2006;6(13):3938-3948. difference gel Onda M, Nagata S, Ho M, Bera TK, Hassan R, Alexander RH, et al. Megakaryocyte potentiation factor cleaved from mesothelin precursor is a useful tumor marker in the serum of patients with mesothelioma. Clinical cancer research 2006;12(14):4225-4231. Orriols R, Muñoz X, Drobnic Z, Ferrer J, Morell F. High adenosine deaminase activity in pleural effusion due to psittacosis. Chest 1992;101(3):881b. Pachón EG, Escuin ILL. Apolipoproteína A1 y apolipoproteína B en los derrames pleurales. Rev Clin Esp 2005;205(8):363-366. Paganuzzi M, Onetto M, Marroni P, Filiberti R, Tassara E, Parodi S, et al. Diagnostic Value of CYFRA 21–1 Tumor Marker and CEA in Pleural Effusion Due to Mesothelioma*. Chest 2001;119(4):1138-1142. Parlar H, Weiss W. Sample prefractionation with Sephadex isoelectric focusing prior to narrow pH range two-dimensional gels. Proteomics 2002;2:1652-1657. Pass HI, Lott D, Lonardo F, Harbut M, Liu Z, Tang N, et al. Asbestos exposure, pleural mesothelioma, and serum osteopontin levels. N Engl J Med 2005;353(15):1564-1573. Passey RJ, Xu K, Hume DA, Geczy CL. S100A8: emerging functions and regulation. J Leukoc Biol 1999;66(4):549-556. Patel PS, Baxi BR, Balar DB. Significance of serum sialoglycoproteins in patients with lung cancer. Neoplasma 1989;36(1):53-59. Pelech S, Sutter C, Zhang H. Kinetworks™ protein kinase multiblot analysis. Methods in molecular biology-Clifton then totowa 2003;218:99112. Pérez Rodríguez E, Villena Garrido MV editors. Enfermedades de la pleura. Ergón ed. C/ Arboleda, 1. 28220 Majadahonda (Madrid): Monografías Neumomadrid; 2003. Pernemalm M, De Petris L, Eriksson H, Branden E, Koyi H, Kanter L, et al. Use of narrow‐range peptide IEF to improve detection of lung 280 Bibliografía adenocarcinoma markers in plasma and pleural effusion. Proteomics 2009;9(13):3414-3424. Pernemalm M, Orre LM, Lengqvist J, Wikstrom P, Lewensohn R, Lehtio J. Evaluation of three principally different intact protein prefractionation methods for plasma biomarker discovery. Journal of proteome research 2008;7(7):2712-2722. Petersen SV, Valnickova Z, Enghild JJ. Pigment-epithelium-derived factor (PEDF) occurs at a physiologically relevant concentration in human blood: purification and characterization. Biochem J 2003;374(Pt 1):199. Petersson S, Bylander A, Yhr M, Enerbäck C. S100A7 (Psoriasin), highly expressed in ductal carcinoma in situ (DCIS), is regulated by IFNgamma in mammary epithelial cells. BMC Cancer 2007 Nov;6(7):205. Piqueras Olmeda RM, Garcia Vila JH, Gonzalez Anon M, Bordon Ferre F, Jornet Fayos J, Ambit Capdevila S. Echography-guided percutaneous biopsy of pleural lesions and effusions. Rev Clin Esp 1999 Sep;199(9):560-563. Poe RH, Israel RH, Utell MJ, Hall WJ, Greenblatt DW, Kallay MC. Sensitivity, specificity, and predictive values of closed pleural biopsy. Arch Intern Med 1984;144(2):325. Poe RH, Levy PC, Israel RH, Ortiz CR, Kallay MC. Use of fiberoptic bronchoscopy in the diagnosis of bronchogenic carcinoma. A study in patients with idiopathic pleural effusions. Chest 1994;105(6):1663-1667. Porcel Pérez JM. ABC del líquido pleural. Seminarios de la Fundación Española de Reumatología 2010;11(2):77-82. Porcel J, Vives M, Esquerda A. Use of panel of markers in pleural fluid for differential diagnosis of benign and malignant effusions. Chest 2004;126:1757-1763. Porcel JM. Pearls and myths in pleural fluid analysis. Respirology 2011;16(1):44-52. Porcel JM, Light RW. Diagnostic approach to pleural effusion in adults. Am Fam Physician 2006;73(7):1211-1220. 281 Bibliografía Porcel JM, Salud A, Vives M, Esquerda A, Rodríguez-Panadero F. Soluble oncoprotein 185HER-2 in pleural fluid has limited usefulness for the diagnostic evaluation of malignant effusions. Clin Biochem 2005;38(11):1031-1033. Porcel JM, Vives M, Cao G, Bielsa S, Ruiz-González A, MartínezIribarren A, et al. Biomarkers of infection for the differential diagnosis of pleural effusions. European Respiratory Journal 2009;34(6):1383-1389. Porcel-Pérez JM. Practical management of pleural effusion. An Me .Interna (Madrid) 2002:58-64. Pottiez G, Wiederin JL, Fox H, Ciborowski P. Comparison of 4-plex to 8-plex iTRAQ® quantitative measurements of proteins in human plasma samples. J Proteome Res. 2012 May 17. Price B, Ware A. Mesothelioma trends in the United States: an update based on Surveillance, Epidemiology, and End Results Program data for 1973 through 2003. Am J Epidemiol 2004;159(2):107. Prinz T, Müller J, Kuhn K, Schäfer J, Thompson A, Schwarz J, et al. Characterization of low abundant membrane proteins using the protein sequence tag technology. Journal of Proteome Research 2004;3(5):10731081. Pugatch RD, Faling LJ, Robbins AH, Snider GL. Differentiation of pleural and pulmonary lesions using computed tomography. J Comput Assist Tomogr 1978;2(5):601. Qin F, Song Y, Li Z, Zhao L, Zhang Y, Geng L. S100A8/A9 induces apoptosis and inhibits metastasis of CasKi human cervical cancer cells. Pathology & Oncology Research 2010;16(3):353-360. Qureshi NR, Rahman NM, Gleeson FV. Thoracic ultrasound in the diagnosis of malignant pleural effusion. Thorax 2009;64(2):139-143. Ramagli LS, Rodriguez LV. Quantitation of microgram amounts of protein in two‐dimensional polyacrylamide gel electrophoresis sample buffer. Electrophoresis 1985;6(11):559-563. Ramírez-Castillejo C, Sánchez-Sánchez F, Andreu-Agulló C, Ferrón SR, Aroca-Aguilar JD, Sánchez P, et al. Pigment epithelium–derived 282 Bibliografía factor is a niche signal for neural stem cell renewal. Nat Neurosci 2006;9(3):331-339. Raquil MA, Anceriz N, Rouleau P, Tessier PA. Blockade of antimicrobial proteins S100A8 and S100A9 inhibits phagocyte migration to the alveoli in streptococcal pneumonia. The Journal of Immunology 2008;180(5):3366-3374. Ray M, Kindler HL. 2009;136(3):888-896. Malignant pleural mesothelioma. Chest Reynolds JH, McDonald G, Alton H, Gordon SB. Pneumonia in the immunocompetent patient. Br J Radiol 2010 Dec;83(996):998-1009. Rodrigo L. Fecal calprotectin. Revista Española de Enfermedades Digestivas 2007;99:683-688. Rodríguez-Panadero F, Borderas Naranjo F, López Mejías J. Pleural metastatic tumours and effusions. Frequency and pathogenic mechanisms in a post-mortem series. Eur Respir J 1989 1989 Apr;2(4):366-369. Rodriguez-Panadero F, Perez MA, Moya MA, Cruz MI. Management of pleural disease. Arch Bronconeumol 2009;45 Suppl 3:22-27. Rogers M, Graham J, Tonge RP. Using statistical image models for objective evaluation of spot detection in two‐dimensional gels. Proteomics 2003;3(6):879-886. Romero S. Nontraumatic 2000;6(4):287. chylothorax. Curr Opin Pulm Med Romero S, Candela A, Martin C, Hernandez L, Trigo C, Gil J. Evaluation of different criteria for the separation of pleural transudates from exudates. Chest 1993;104(2):399-404. Romero S, Fernandez C, Arriero JM, Espasa A, Candela A, Martin C, et al. CEA, CA 15-3 and CYFRA 21-1 in serum and pleural fluid of patients with pleural effusions. European Respiratory Journal 1996;9(1):17-23. Roth J, Vogl T, Sorg C, Sunderkötter C. Phagocyte-specific S100 proteins: a novel group of proinflammatory molecules. Trends Immunol 2003;24(4):155-158. 283 Bibliografía Sack U, Hoffmann M, Zhao XJ, Chan KS, Hui DSC, Gosse H, et al. Vascular endothelial growth factor in pleural effusions of different origin. European Respiratory Journal 2005;25(4):600-604. Sahn SA. The pathophysiology of pleural effusions. Annu Rev Med 1990;41:7-13. Sahn SA, Good JT. Pleural fluid pH in malignant effusions. Ann Intern Med 1988;108(3):345. Sakuraba M, Masuda K, Hebisawa A, Sagara Y, Komatsu H. Pleural effusion adenosine deaminase (ADA) level and occult tuberculous pleurisy. Annals of thoracic and cardiovascular surgery: official journal of the Association of Thoracic and Cardiovascular Surgeons of Asia 2009;15(5):294. Salama I, Malone PS, Mihaimeed F, Jones JL. A review of the S100 proteins in cancer. European Journal of Surgical Oncology (EJSO) 2008;34(4):357-364. Salomaa ER, Viander M, Saaresranta T, Terho EO. Complement components and their activation products in pleural fluid. Chest 1998;114(3):723-730. Sancho JF. Marcadores tumorales en líquido pleural. Arch Bronconeumol 2000;36:295-297. Santhanagopalan V, Hahn BL, Dunn BE, Weissner JH, Sohnle PG. Antimicrobial activity of calprotectin isolated from human empyema fluid supernatants. Clin Immunol Immunopathol 1995;76(3):285-290. Schägger H. Microseparation Techniques III: Gel Electrophoresis for Sample Preparation in Protein Chemistry. Microcharacterization of Proteins 1999:63-74. Scherpereel A, Lee Y. Biomarkers for mesothelioma. Curr Opin Pulm Med 2007;13(4):339. Schnyder JM, Tschopp JM. Medical thoracoscopy. Rev Med Suisse 2011 2011 Apr 13;7(290):796-797. Schrohl AS, Holten-Andersen M, Sweep F, Schmitt M, Harbeck N, Foekens J, et al. Tumor markers: from laboratory to clinical utility. Mol Cell Proteomics 2003 Jun;2(6):378-387. 284 Bibliografía Screaton NJ, Flower CDR. Percutaneous needle biopsy of the pleura. Radiol Clin North Am 2000;38(2):293-301. Segura RM. Useful clinical biological markers in diagnosis of pleural effusions in children. Paediatric Respiratory Reviews 2004;5:S205-S212. Sekine I, Sumi M, Saijo N. Local control of regional and metastatic lesions and indication for systemic chemotherapy in patients with nonsmall cell lung cancer. Oncologist 2008;13(Supplement 1):21-27. Shao C, Sima J, Zhang SX, Jin J, Reinach P, Wang Z, et al. Suppression of corneal neovascularization by PEDF release from human amniotic membranes. Invest Ophthalmol Vis Sci 2004;45(6):1758-1762. Shao C, Qu J, He L. A comparative study of clinical manifestations caused by tuberculosis in immunocompromised and nonimmunocompromised patients. Chin Med J (Engl) 2003 Nov;116(11):1717-1722. Shaw MM, Riederer BM. Sample preparation for two‐dimensional gel electrophoresis. Proteomics 2003;3(8):1408-1417. Shi Q, Jackowski G. One-dimensional polyacrylamide gel electrophoresis. Gel electrophoresis of proteins: A practical approach, 3rd ed.Oxford University Press, Oxford 1998:1-52. Shieh DB, Godleski J, Herndon JE, Azuma T, Mercer H, Sugarbaker DJ, et al. Cell motility as a prognostic factor in stage I nonsmall cell lung carcinoma. Cancer 1999;85(1):47-57. Shimokata K, Niwa Y, Yamamoto M, Sasou H, Morishita M. Pleural fluid neuron-specific enolase. A useful diagnostic marker for small cell lung cancer pleurisy. Chest 1989;95(3):602-603. Shimokata K, Totani Y, Nakanishi K, Yamamoto M, Hasegawa Y, Kawatsu H, et al. Diagnostic value of cancer antigen 15.3 (CA 15-3) detected by monoclonal antibodies (115D8 and DF3) in exudative pleural effusions. Eur Respir J 1988 Apr;1(4):341-344. Shinto RA, Light RW. Effects of diuresis on the characteristics of pleural fluid in patients with congestive heart failure. Am J Med 1990;88(3):230234. 285 Bibliografía Shitrit D, Ollech JE, Ollech A, Peled N, Amital A, Fox B, et al. Diagnostic value of complement components in pleural fluid: Report of 135 cases. Respir Med 2008;102(11):1631-1635. Simonovic M, Gettins PGW, Volz K. Crystal structure of human PEDF, a potent anti-angiogenic and neurite growth-promoting factor. Proceedings of the National Academy of Sciences 2001;98(20):11131. Simpson RJ, Jensen SS, Lim JWE. Proteomic profiling of exosomes: current perspectives. Proteomics 2008;8(19):4083-4099. Smith RA, Cokkinides V, von Eschenbach AC, Levin B, Cohen C, Runowicz CD, et al. American Cancer Society guidelines for the early detection of cancer. CA: a cancer journal for clinicians 2002;52(1):8-22. Soltermann A, Ossola R, Kilgus Hawelski S, von Eckardstein A, Suter T, Aebersold R, et al. N‐glycoprotein profiling of lung adenocarcinoma pleural effusions by shotgun proteomics. Cancer Cytopathology 2008;114(2):124-133. Somiari SB, Somiari RI, Heckman CM, Olsen CH, Jordan RM, Russell SJ, et al. Circulating MMP2 and MMP9 in breast cancer—potential role in classification of patients into low risk, high risk, benign disease and breast cancer categories. International journal of cancer 2006;119(6):1403-1411. Soriano E, Mallolas J, Gatell JM, Latorre X, Miró JM, Pecchiar M, et al. Characteristics of tuberculosis in HIV-infected patients: a casecontrol study. AIDS 1988;2(6):429. Spisak S, Tulassay Z, Molnar B, Guttman A. Protein microchips in biomedicine and biomarker discovery. Electrophoresis 2007 2007 Dec;28(23):4261-4273. Stenbygaard LE, Sørensen JB, Larsen H, Dombernowsky P. Metastatic pattern in non-resectable non-small cell lung cancer. Acta Oncol 1999;38(8):993-998. Stetler-Stevenson WG, Brown PD, Onisto M, Levy AT, Liotta LA. Tissue inhibitor of metalloproteinases-2 (TIMP-2) mRNA expression in tumor cell lines and human tumor tissues. J Biol Chem 1990;265(23):13933-13938. 286 Bibliografía Stríz I, Trebichavský I. Calprotectin – a pleiotropic molecule in acute and chronic inflammation. Physiol Res 2004;53(3):245-253. Stroncek DF, Shankar RA, Skubitz KM. The subcellular distribution of myeloid-related protein 8 (MRP8) and MRP14 in human neutrophils. J Transl Med 2005 Sep;28(3):36. Stüven T, Hartmann E, Görlich D. Exportin 6: a novel nuclear export receptor that is specific for profiling-actin complexes. EMBO J 2003;22(21):5928-5940. Sulu E, Damadoğlu E, Berk Takır H, Kuzu Okur H, Köroğlu E, Yılmaz A. A case of endobronchial inflammatory pseudotumor invading the mediastinum. Tuberk Toraks 2011 2011;59(1):77-80. Sumi M, Kagohashi K, Satoh H, Ishikawa H, Funayama Y, Sekizawa K. Endostatin levels in exudative pleural effusions. Lung 2003;181(6):329-334. Sun CY, Xia GW, Xu K, Ding Q. Application of iTRAQ in proteomic study of prostate cancer. Zhonghua Nan Ke Xue 2010 Aug;16(8):741-744. Sun HQ, Yamamoto M, Mejillano M, Yin multifunctional actin regulatory protein. 1999;274(47):33179-33182. HL. Gelsolin, a J Biol Chem Suzuki M, Betsuyaku T, Kojima T, Saito H, Nishiura Y, Fukasawa Y, et al. Pleural involvement of dialysis-related amyloidosis. Intern Med 2005;44(6):628. Takanohashi A, Yabe T, Schwartz JP. Pigment epithelium‐derived factor induces the production of chemokines by rat microglia. Glia 2005;51(4):266-278. Taryle DA, Potts DE, Sahn SA. The incidence and clinical correlates of parapneumonic effusions in pneumococcal pneumonia. Chest 1978;74(2):170. Terasaki F, Fujita M, Shimomura H, Tsukada B, Otsuka K, Otsuka K, et al. Enhanced expression of myeloid-related protein complex (MRP8/14) in macrophages and multinucleated giant cells in granulomas of patients with active cardiac sarcoidosis. Circulation journal: official journal of the Japanese Circulation Society 2007;71(10):1545-1550. 287 Bibliografía Tibble J, Sigthorsson G, Foster R, Sherwood R, Fagerhol M, Bjarnason I. Faecal calprotectin and faecal occult blood tests in the diagnosis of colorectal carcinoma and adenoma. Gut 2001;49(3):402-408. Tibble JA, Bjarnason I. Non-invasive investigation of inflammatory bowel disease. World Journal of Gastroenterology 2001;7(4):460-465. Timms JF, Cramer R. Difference gel electrophoresis. Proteomics 2008;8(23‐24):4886-4897. Tolosano E, Altruda F. Hemopexin: structure, function, and regulation. DNA Cell Biol 2002;21(4):297-306. Tomaselli G, Gamsu G, Stulbarg MS. Constrictive pericarditis presenting as pleural effusion of unknown origin. Arch Intern Med 1989;149(1):201. Tombran-Tink J, Johnson LV. Neuronal differentiation of retinoblastoma cells induced by medium conditioned by human RPE cells. Invest Ophthalmol Vis Sci 1989;30(8):1700-1707. Toumbis M, Chondros K, Ferderigos AS, Daganou M, Dema A, Dalamaga A, et al. Clinical evaluation of tumor markers in malignant and benign pleural effusion. Anticancer Res 1992 Jul-Aug;12(4):12671270. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences 1979;76(9):4350. Tsao YP, Ho TC, Chen SL, Cheng HC. Pigment epithelium-derived factor inhibits oxidative stress-induced cell death by activation of extracellular signal-regulated kinases in cultured retinal pigment epithelial cells. Life Sci 2006;79(6):545-550. Tsuji T, Shimohama S, Kamiya S, Sazuka T, Ohara O. Analysis of brain proteins in Alzheimer's disease using high-resolution twodimensional gel electrophoresis. J Neurol Sci 1999;166(2):100-106. Tuuttila A, Morgunova E, Bergmann U, Lindqvist Y, Maskos K, Fernandez-Catalan C, et al. Three-dimensional structure of human 288 Bibliografía tissue inhibitor of metalloproteinases-2 at 2.1 Å resolution1. J Mol Biol 1998;284(4):1133-1140. Tyers M, Mann 2003;422(6928). M. From genomics to proteomics. Nature Uehara H, Miyamoto M, Kato K, Ebihara Y, Kaneko H, Hashimoto H, et al. Expression of pigment epithelium-derived factor decreases liver metastasis and correlates with favorable prognosis for patients with ductal pancreatic adenocarcinoma. Cancer Res 2004;64(10):3533. Ungerer JPJ, Oosthuizen HM, Retief JH, Bissbort SH. Significance of adenosine deaminase activity and its isoenzymes in tuberculous effusions. Chest 1994;106(1):33-37. Utine G, Ozcelik U, Yalcin E, Dogru D, Kiper N, Aslan A, et al. Childhood Parapneumonic Effusions*. Chest 2005;128(3):1436-1441. Valdés L, Alvarez D, Valle JM, Pose A, San José E. The etiology of pleural effusions in an area with high incidence of tuberculosis. Chest 1996;109(1):158-162. Vatansever S, Gelisgen R, Uzun H, Yurt S, Kosar F. Potential role of matrix metalloproteinase-2,-9 and tissue inhibitors of metalloproteinase1,-2 in exudative pleural effusions. Clinical & Investigative Medicine 2009;32(4):E293-E300. Vavetsi R, Bonovas S, Polizou P, Papanastasopoulou C, Dougekou G, Sitaras N. The diagnostic role of glycosaminoglycans in pleural effusions: A pilot study. BMC Pulmonary Medicine 2009;9(1):9. Vaz MAC, Teixeira LR, Vargas FS, Carmo AO, Antonangelo L, Onishi R, et al. Relationship Between Pleural Fluid and Serum Cholesterol Levels*. Chest 2001;119(1):204-210. Vercauteren FGG, Arckens L, Quirion R. Applications and current challenges of proteomic approaches, focusing on two-dimensional electrophoresis. Amino Acids 2007;33(3):405-414. Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006;55(3):426-431. Viemann D, Barczyk K, Vogl T, Fischer U, Sunderkötter C, SchulzeOsthoff K, et al. MRP8/MRP14 impairs endothelial integrity and 289 Bibliografía induces a caspase-dependent and -independent cell death program. Blood 2007 2007 Mar 15;109(6):2453-2460. Villena Garrido V, Ferrer Sancho J, Blasco H, de Pablo Gafas A, Pérez Rodríguez E, Rodríguez Panadero F, et al. Diagnosis and Treatment of Pleural Effusion. Archivos de Bronconeumología ((English Edition)) 2006 7;42(7):349-372. Villena V, López-Encuentra A, Echave-Sustaeta J, Martín-Escribano P, Ortuño-de-Solo B, Estenoz-Alfaro J. Diagnostic value of CA 549 in pleural fluid. Comparison with CEA, CA 15.3 and CA 72.4. Lung Cancer 2003;40(3):289-294. Villena V, López-Encuentra A, Echave-Sustaeta J, Martín-Escribano P, Ortuño-de-Solo B, Estenoz-Alfaro J. Diagnostic value of CA 72-4, CA 15-3, and CA19-9 assay in pleural fluid. A study of 207 patients. Cancer 1996 1996 Aug 15;78(4):736-740. Villena V, Pérez V, Pozo F, López-Encuentra A, Echave-Sustaeta J, Arenas J, et al. Amylase Levels in Pleural Effusions*. Chest 2002;121(2):470-474. Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases. Circ Res 2003;92(8):827-839. Volpino P, Cangemi V, Caputo V, Mazzarino E, Galati G. Clinical usefulness of serum ferritin measurements in lung cancer patients. J Nucl Med Allied Sci 1984 Jan-Mar;28(1):27-30. Wagner IC, Guimarães MJ, da Silva LK, de Melo FM, Muniz MT. Evaluation of serum and pleural levels of the tumor markers CEA, CYFRA 21-1 and CA 15-3 in patients with pleural effusion. J Bras Pneumol 2007 2007 Apr;33(2):185-191. Walker WC, Wright 1967;26(6):467. V. Rheumatoid pleuritis. Ann Rheum Dis Wehr T. Top-down versus bottom-up approaches in proteomics.LGCG 2006; 24(9). Wilkins MR, Pasquali C, Appel RD, Ou K, Golaz O, Sanchez JC, et al. From proteins to proteomes: Large scale protein identification by two- 290 Bibliografía dimensional electrophoresis and arnino acid analysis. Nat Biotechnol 1996;14(1):61-65. Williams MR, Turkes A, Pearson D, Griffiths K, Blamey RW. Serum ferritin as a marker of therapeutic response in stage III and IV breast cancer. Eur J Surg Oncol 1990 Feb;16(1):22-27. Wiwanitkit V. Sputum AFB in tuberculous pleural effusion. Lung India 2011;28(2):154. Wong PC. Management of tuberculous pleuritis: can we do better? Respirology 2005;10(2):144-148. Wu WW, Wang G, Baek SJ, Shen RF. Comparative study of three proteomic quantitative methods, DIGE, cICAT, and iTRAQ, using 2D gelor LC-MALDI TOF/TOF. J Proteome Res. 2006 Mar;5(3):651-8. Yamagishi S, Adachi H, Abe A, Yashiro T, Enomoto M, Furuki K, et al. Elevated serum levels of pigment epithelium-derived factor in the metabolic syndrome. Journal of Clinical Endocrinology & Metabolism 2006;91(6):2447-2450. Yamagishi S, Nakamura K, Ueda S, Kato S, Imaizumi T. Pigment epithelium-derived factor (PEDF) blocks angiotensin II signaling in endothelial cells via suppression of NADPH oxidase: a novel antioxidative mechanism of PEDF. Cell Tissue Res 2005;320(3):437-445. Yan JX, Sanchez JC, Rouge V, Williams KL, Hochstrasser DF. Modified immobilized pH gradient gel strip equilibration procedure in SWISS‐2DPAGE protocols. From Genome to Proteome 1999:143-146. Yin HL, Stossel TP. Control of cytoplasmic actin gel–sol transformation by gelsolin, a calcium-dependent regulatory protein. Nature. 1979;18;281(5732):583-6. Yui S, Nakatani Y, Mikami M. Calprotectin (S100A8/S100A9), an inflammatory protein complex from neutrophils with a broad apoptosisinducing activity. Biol Pharm Bull 2003;26(6):753-760. Zhang SX, Wang JJ, Gao G, Shao C, Mott R, Ma J. Pigment epithelium-derived factor (PEDF) is an endogenous antiinflammatory factor. The FASEB journal 2006;20(2):323-325. 291 Bibliografía Zhang W, Hu X, Yang X, Wang Q, Cheng H, Wang S, et al. Combined detection of serum matrix metalloproteinase 9, acetyl heparinase and Cathepsin L in diagnosis of ovarian cancer. Chin J Cancer Res 2012;24(1):67-71. Zhang W, Yang HC, Wang QI, Yang Zhijun, Chen H, Wang Sumei, et al. Clinical Value of Combined Detection of Serum Matrix Metalloproteinase-9, Heparanase, and Cathepsin for Determining Ovarian Cancer Invasion and Metastasis. Anticancer Res 2011;31(10):3423-3428. Zwadlo G, Brüggen J, Gerhards G, Schlegel R, Sorg C. Two calciumbinding proteins associated with specific stages of myeloid cell differentiation are expressed by subsets of macrophages in inflammatory tissues. Clin Exp Immunol 1988;72(3):510. Recursos Web: - Pulmonary – Critical Care Associates of East Texas http://www.pcca.net/PleuralEffusion.html - Citología para niños http://www.anamerino.com/educacional.html - Departamento de Fisiología. Universidad de Costa Rica http://163.178.103.176/Fisiologia/respiratorio/ejercicios/eje rc_6/respi_ejercicio_6.html - Departamento de Fisiología. Universidad de Costa Rica http://163.178.103.176/Fisiologia/respiratorio/pracb_7/resp i_pracb_1.html - Enciclopedia de la salud http://www.beltina.org - Investigación en mesotelioma maligno http://www.researchmalignantmesothelioma.com 292 Bibliografía - Laboratorio Zambon http://www.zambon.es/servicios/atlas/fichas/3106.htm - Masscot search buscador de MS http://www.matrixscience.com - Pagina web del Dr. Viyabo http://viryabo.hubpages.com/hub/mesotheliomavictims_and-the-dreaded_asbestos-illnesses - Portal médico http://www.portalesmedicos.com/publicaciones/articles/209 2/1/Cuidados-de-Enfermeria-en-paciente-con-drenaje-pleuralpor-neumotorax-espontaneo-PLEUREVAC.html# - Salud, enfermedad, medicina y remedios http://www.tubesalud.com/pruebas-de-tuberculosis - Wikipedia http://es.wikipedia.org/ 293