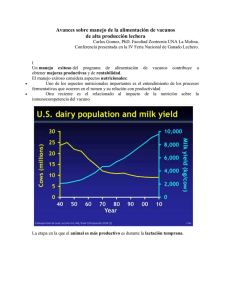
tratamiento de acidos del rumen con inhibidores de alfa
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS A61K 31/702 (2006.01) A61K 31/715 (2006.01) A61P 1/04 (2006.01) ESPAÑA 12 11 Número de publicación: 2 272 418 51 Int. Cl.: TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01304379 .9 86 Fecha de presentación : 17.05.2001 87 Número de publicación de la solicitud: 1157696 87 Fecha de publicación de la solicitud: 28.11.2001 54 Título: Tratamiento de acidosis del rumen con inhibidores de alfa-amilasa. 30 Prioridad: 24.05.2000 GB 0012793 24.05.2000 GB 0012760 17.07.2000 GB 0017495 45 Fecha de publicación de la mención BOPI: 01.05.2007 73 Titular/es: PFIZER Inc. 235 East 42nd Street New York, New York 10017, US 72 Inventor/es: Banks, Bernard Joseph; Haxell, Mark Andrew; Lunn, Graham; Pacey, Michael Stephen y Roberts, Lee Richard 45 Fecha de la publicación del folleto de la patente: 74 Agente: Carpintero López, Francisco ES 2 272 418 T3 01.05.2007 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, 75 – 28071 Madrid ES 2 272 418 T3 DESCRIPCIÓN Tratamiento de acidosis del rumen con inhibidores de alfa-amilasa. 5 10 15 20 25 30 La invención descrita en este documento se refiere al tratamiento de acidosis del rumen, especialmente acidosis crónica en rumiantes, y afecciones relacionadas. La acidosis del rumen es una enfermedad metabólica bien documentada de los rumiantes causada por el exceso de consumo de carbohidratos fácilmente fermentables, y problemas asociados con la afección que se conocen desde hace muchos años: véase Nordlund y col., 1995, Nagaraja y col., 1998, Owens y col., 1998 y Dirksen 1969. La acidosis puede dividirse en dos formas: aguda y crónica. Se define la acidosis aguda como un pH en el rumen entre pH 4,0 y 5,0 con lactato ruminal elevado, y acidosis crónica como pH en el rumen entre 5,0 y 5,5 con niveles normales de lactato de hasta 5 mM. La bibliografía también hace referencia a acidosis subaguda, que tiene valores de pH en el rumen por debajo de 5,0 pero en algunos casos está asociado con altos niveles de lactato y en otras no. Se clasifica el primer caso como acidosis aguda leve, y el último como acidosis crónica. La causa principal de la acidosis es el consumo de una dieta con un alto contenido de carbohidratos fácilmente fermentables y/o que es baja en forraje. La acidosis crónica puede suceder cuando los animales comen grandes cantidades de dietas fácilmente fermentables y puede suceder en cualquier fase de la producción, o de hecho, durante todo el tiempo que estén con dietas altamente concentradas. La acidosis aguda puede suceder cuando tiene lugar un gran aumento en la cantidad de concentrado en la dieta, por ejemplo, después del parto o una transferencia a los pastos. Sin embargo, también puede suceder después de una alteración en los patrones de ingesta de alimentos normal tal como la presentación accidental de alimento en exceso o un periodo de ayuno seguido por una ingesta excesiva. El pH reducido del rumen también puede estar causado por una disminución en la proporción de fibra bruta en la dieta. La etiología de la acidosis está, por lo tanto, basada en la ingestión absoluta de cantidades excesivas de carbohidratos y/o una proporción desfavorable de productos alimenticios básicos en la proporción. El tipo de grano (maíz con alta humedad es más inductor de la acidosis que el maíz o forraje secado con rodillo) y el tipo de procesamiento (grano escamado a chorro es particularmente digestible) junto con el tipo y la cantidad de forraje es importante. Los granos tales como la cebada, el trigo y maíz de alta humedad que tienen rápidas velocidades de digestión ruminal de almidón generalmente causan los mayores problemas. Por ejemplo la cebada, la harina de trigo, la avena y el maíz escamado a chorro tienen todos una disponibilidad de almidón ruminal mayor del 85%. Las directrices para dietas del ganado para la producción láctea que producen más de 35-40 kg de leche sugieren fibra neutro detergente del 25-30% en la dieta, siendo el 75% de ésta de forraje, niveles de carbohidratos no estructurales del 35-40% y almidón del 30-40% (Nocek 1997). 35 40 La acidosis aguda está caracterizada por una disminución brusca en el pH ruminal con una alta concentración de ácido láctico ruminal (50-100 mM). La población microbiana ruminal experimenta un cambio significativo, con un aumento en bacterias productoras de ácido láctico gram-positivas, específicamente Streptococcus bovis y especies de Lactobacillus. La caída del pH conduce a la muerte de las bacterias gram-negativas y a la reducción o desaparición completa de los protozoos ciliados. El cambio en el patrón de fermentación para la producción de lactato está asociado con una producción disminuida de ácido graso volátil (AGV). Los cambios sistémicos incluyen pH y bicarbonato en la sangre disminuidos y D y L-lactato en sangre aumentados. La acidosis aguda puede causar una alteración significativa de las funciones fisiológicas tales como estasis ruminal y deshidratación, que conduce finalmente a coma y muerte. Incluso si el animal sobrevive, nunca se recuperará completamente. 45 50 55 La acidosis crónica tiene signos clínicos mucho más tenues. Los animales permanecen alerta y consumen alimento, pero pueden parecer “indispuestos”. La caída del pH del rumen por debajo de 5,5 se debe a un aumento general en la fermentación en el rumen que conduce a una producción mayor de AGV. El aumento de AGV en el rumen está altamente correlacionado con los aumentos en la sangre, pero el pH de la sangre no cambia significativamente. Los protozoos ciliados totales del rumen disminuyen debido a la caída del pH, cambiando la proporción de algunas especies, pero sin desaparecer completamente. Los recuentos de bacterias viables totales aumentan con el tiempo, incluyendo las bacterias amilolíticas aumentadas. Sin embargo, no sucede el crecimiento incontenible de las especies S. bovis y Lactobacillus observado en acidosis aguda. Aunque la velocidad de producción de lactato se eleva transitoriamente después de la alimentación, el lactato se utiliza inmediatamente en la producción de AGV, y no se acumula en el rumen. Específicamente, los síntomas de la acidosis crónica son una caída en el pH ruminal hasta 5,0-5,5 sin acumulación significativa de ácido láctico. 60 65 2 ES 2 272 418 T3 Sumario de síntomas de acidosis aguda y crónica 5 10 15 20 25 30 35 40 45 50 La acidosis del rumen está asociada con muchas afecciones secundarias que pueden tener un impacto significativo sobre el rendimiento del animal de ganado, es decir, reducción en la conversión del alimento en carne y/o leche. La calidad de la leche también puede sufrir asociada con la acidosis. El daño irreversible al epitelio ruminal sucede a un pH del rumen por debajo de 5,5, causando hiperqueratosis, agregación papilar y ruminitis del epitelio ruminal. Los animales tienen un apetito y un rendimiento reducidos debido a la absorción alterada de nutrientes, produciendo una ganancia de peso reducida en el ganado macho y una producción y calidad de la leche disminuidas en el ganado lechero. Otros efectos son laminitis, diarrea intermitente, apetito reducido e ingesta cíclica de alimentos, una alta proporción de sacrificio del rebaño por problemas de salud mal definidos, mal estado corporal y abscesos sin causas obvias. La laminitis crónica es uno de los signos clínicos más uniformes, con crestas en la pared dorsal de la pezuña, ulceración de las plantas, lesiones por la enfermedad de la línea blanca, hemorragias en las plantas y pezuñas deformes. Como media, los granjeros informan de que el 25% de los animales en los rebaños lecheros en el Reino Unido están cojos, y la incidencia real de laministis crónica probablemente es mayor ya que no siempre se produce una cojera detectable. Se sabe que los abscesos hepáticos están unidos a la acidosis, y en la mayoría de los pastos la incidencia de abscesos hepáticos está en una media del 12% al 32% del ganado sacrificado, y es una causa principal del decomiso del hígado. Los abscesos hepáticos no se diagnostican necesariamente mientras el animal esté vivo, pero tienen un efecto nocivo sobre su rendimiento y salud general. Los animales también pueden tener una función inmune deprimida, y una alta incidencia de enfermedades respiratorias e índices de fertilidad reducidos. La mayoría de los rebaños lecheros con un problema de acidosis crónica tienen un índice anual de reposición del rebaño de más del 45%, o un índice de sacrificio anual superior al 31%. Las razones para el sacrificio están habitualmente mal definidas. (Nocek 1997, Nordlund 1995, Nagaraja 1998, Stock y Britten 1998, AnimalPharm 1999, Kay 1969, McManus 1977). Otro problema que puede observarse con el alimento de vacas lecheras de alto rendimiento con una dieta alta en carbohidratos y/o baja en forraje es el “síndrome de leche de bajo contenido en grasas” relacionado con acidosis. Según cae el pH en el rumen, el patrón de fermentación cambia hacia una producción mayor de propionato y menor de acetato y butirato. Cuando se produce aproximadamente la mitad de la grasa de la leche a partir de acetato y butirato, esto produce una disminución en el contenido en grasas de la leche. (AT Chamberlain & JM Wilkinson, Feeding the Dairy Cow, Chalcombe Publications, UK, 1996). Se estima que la acidosis del rumen y los problemas relacionados tienen un coste en la industria de ganado de más de un billón de dólares por año debido a la pérdida de producción. 55 60 65 Los tratamientos recomendados para la acidosis aguda incluyen la administración de una mezcla de bicarbonato sódico, formaldehído, óxido de magnesio y carbono vegetal para eliminar rápidamente las bacterias en división. (NebGuide G91-1047-A). Se usan ampliamente tampones (Horn 1979, Kennelly 1999), pero no parecen ser suficientemente eficaces para satisfacer la industria del ganado. La apetibilidad de la mayoría de los tampones es baja, y requiere un tratamiento cuidadoso para evitar la ingesta reducida de alimento. Los antibióticos ionóforos tales como monensina, lasalocid y salinomicina son generalmente eficaces contra bacterias gram-positivas, incluyendo las principales bacterias ruminales productoras de lactato, S. bovis y especies de Lactobacillus (Burrin y Britton 1986, Coe 1999, Nagaraja 1985). Por lo tanto, son eficaces para prevenir la acidosis aguda cuando se cambia a dietas de alto contenido en concentrados cuando el ganado alcanza por primera vez el pasto o después del parto. También funciona reduciendo la producción total de AGV en el ganado con acidosis crónica, y por lo tanto estabiliza el pH del rumen. Sin embargo, los ionóforos también disminuyen la ingesta de comida. Otras clases de antibióticos también han demostrado prevenir o mejorar la acidosis crónica, incluyendo la virginiamicina en ovejas (Thorniley y col 1998), y el antibiótico peptídico que contiene azufre tiopeptina, que es particularmente eficaz contra S. bovis (Armstrong 1984). 3 ES 2 272 418 T3 5 10 Sin embargo, el uso sostenido de aditivos alimenticios antibióticos ya no se ve como una herramienta de tratamiento apropiada (para una revisión véase: The use of drugs in food animals: benefits and risks, 1999). El control probiótico se ha demostrado con varias especies, incluyendo Selenomonas ruminantium subsp. lactolytica cepa JDB201 (Wiryawan y col., 1995), Megasphaera elsedenii que utiliza lactato (Das, Kung y Hession 1995), y en términos más generales la patente WO 96/17525. Ésta última también reivindica enzimas que aumentan la degradación de almidón o fibra. Otros tratamiento propuestos, pero no comercializados, incluyen el uso de bacteriocinas (Teather y Forster 1998), y la manipulación económica inviable de fermentación ruminal con ácidos orgánicos (Martin, 1988, Martin y col., 1999). • Armstrong, D.G. Antibiotics as feed additives for ruminant livestock in “Antimicrobials and Agriculture The proceedings of the 4th Intemational symposium on antibiotics in agriculture: benefits and malefits”, 1984 ed. Woodbine M. Butterworths ISBN 0 408 11155 0 15 • Das, N.K. Ruminant feed additive Patent application US 76-748210 761207 20 • Kennelly, J.J., Robinson, B. y Khorasani, G. R. Influence of carbohydrate source and buffer on rumen fermentation characteristics, milk yield, and milk composition in early-lactation Holstein cows Journal of Dairy Science 1999 82: 2486-2496 • Kung, L. y Hession, A.O. Preventing in vitro lactate accumulation in ruminal fermentations by inoculation with Megasphaera elsdenii Journal of Animal Science 1995 73: 250-256 25 • Martin, S.A. Manipulation of ruminal fermentation with organic acids: a review Journal of Animal Science 1998 76: 3123-3132 • Martin, S.A., Streeter, M.N., Nisbet, D.J., Hill, G.M. y Williams, S.E. Effects of DL-Malate on ruminal metabolism and performance of cattle fed a high-concentrate diet Journal of Animal Science 1999 77: 1008-1015 30 • Teather, R.M. y Forster, R.J. Manipulating the rumen microflora with bacteriocins to improve ruminant production Canadian Journal of Animal Science 1998 78 (Supplement): 57-69. • The use of drugs in food animals: benefits and risks CABI publishing 1999 ISBN 0 85199 371 0 35 • Thomiley, G.R., Rowe, J.B., Cowcher, P.C., Boyce, M.D. A single drench of virginiamycin to increase safety of feeding grain to sheep Australian Journal of Agricultural Research 1998 49 (5): 899-906 40 • Wiryawan, K.G. y Brooker, J.D. Probiotic control of lactate accumulation in acutely grain-fed sheep Australian Journal of Agricultural Research 1995 46 (8):1555-68 • Kay, M., Fell, B.F. y Boyne, R. The relationship between the acidity of the rumen contents and rumenitis in calves fed on barley Research in Veterinary Science 1969 10 181-187 45 • McManus, W.R., Lee, G.J. y Robinson, V.N.E. Microlesions on rumen papillae of sheep fed diets of wheat grain Research in Veterinary Science 1977 22: 135-137 Referencias adicionales 50 1. Lameness costs UK dairy herds, says RMN AnimalPharm 417 March 26th 1999 p6 2. Burring, D.G. y Britton, R.A. Response to monensin in cattle during subacute acidosis Journal of Animal Science 1986 63:888-893 55 3. Coe, M.L., Nagaraja, T.G., Sun, Y.D., Wallace, N. Towne, E.G., Kemp, K.E. y Hutcheson, J.P. Effect of Virginiamycin on ruminal fermentation in cattle during adaptation to a high concentrate diet and during an induced acidosis Journal of Animal Science 1999 77:2259-2268 60 4. Dirksen, G. Acidosis in Physiology of Digestion and Metabolism in the Ruminant: Proceedings of the Third Intemational Symposium, Cambridge, Inglaterra: agosto 1969 Ed. A.T. Phillipson, Oriel Press IBSN O 85362 053 9 5. Nagaraja, T.G. Galyean, M.L. y Cole, N.A. Nutrition and Disease Veterinary Clinics of North America: Food Animal Practice 1998 14 (2) 257-277 65 6. Nagaraja, T.G., Avery, T.B., Galitzer, S.J. y Harmon, D.L. Effect of ionophore antibiotics on experimentially induced lactic acidosis in cattle American Journal of Veterinary Research 1985 46 (12) 2444-2452 4 ES 2 272 418 T3 7. Nocek, J.E. Bovine acidosis: Implications on laminitis Journal of Dairy Science 1997 80:1005-1028 5 8. Nordlund, K. V. Garrett, E. F. Oetzel, G. R Herd-based rumenocentesis: a clinical approach to the diagnosis of subacute fumen acidosis. Compendium on Continuing Education for the Practicing Veterinarian. 1995. 17: 8, Supplement, S48-S56 9. Owens, F.N. Secrist, D.S. Hill, W.J. y Gill D.R. Acidosis in cattle: a review Journal of Animal Science 1998 76: 275-286 10 10. University of Nebraska, Lincoln NebGuide G91-1047-A http:/www.inar.unl.edu/pubs/AnimalDisease/g 1047.htm El documento DE 2658562 describe derivados de aminoazúcares que contienen de 2 a 18 unidades de azúcar y el documento US 4273765 describe derivados de aminoazúcares que contienen trehalosa, agentes inhibidores de amilasa. 15 20 25 30 35 40 Hay una necesidad general de un tratamiento seguro y eficaz para la acidosis del rumen; especialmente acidosis del rumen crónica y/o aguda; especialmente en rumiantes tales como vacas y ovejas; especialmente en rumiantes en lactación tales como vacas y ovejas; que preferiblemente puede administrarse fácilmente, tal como con comida o bebida; que preferiblemente es no antimicrobiano; que es preferiblemente apetitoso para el animal; que preferiblemente es activo sólo en el rumen y no tiene efectos sistémicos; que preferiblemente no presenta ningún residuo en la carne y/o leche, y que preferiblemente no requiere un periodo de reposo; que es preferiblemente no tóxico para el animal y los que manipulan los alimentos (fabricante y granjero); y/o que preferiblemente puede estabilizar la fermentación del rumen, evitando de este modo la reducciones excesivas en el pH y manteniendo las proporciones de AGV de modo que la producción de grasa en la leche no se vea afectada de forma adversa. Los autores han descubierto que ciertos inhibidores de la α-amilasa y/o α-glucosidasa bacteriana pueden usarse para reducir el pH ruminal de un modo eficaz que debe ser útil en el tratamiento de acidosis tanto crónica como aguda y afecciones relacionadas. Por “inhibidor” en este documento se entiende agentes individuales y mezclas de agentes que tienen actividad inhibidora, incluyendo la fermentación de los productos mencionados a continuación. Un aspecto de la invención es el uso de un inhibidor eficaz de la α-amilasa y/o α-glucosidasa bacteriana concretamente acarbosa o trestatina A, B o C, en la fabricación de una composición para el tratamiento de acidosis del rumen. Son de particular de interés los inhibidores de amilasas/glucosidasas presentes en las bacterias ruminales, tales como las mencionadas a continuación en este documento. Un aspecto adicional de la invención es una formulación adecuada para el tratamiento de acidosis en un animal que comprende un inhibidor de la α-amilasa y/o α-glucosidasa bacteriana del rumen concretamente acarbosa o trestatina A, B o C. Otro aspecto de la presente invención se refiere un procedimiento para mejorar la calidad y/o cantidad de la leche de los rumiantes que componen la paliación curativa y el tratamiento profiláctico de un rumiante con una cantidad eficaz de un inhibidor de la alfa-amilasa y/o alfa-glucosidasa bacteriana del rumen. 45 Otros aspectos de la invención son los definidos en las reivindicaciones. 50 Preferiblemente el inhibidor de la α-amilasa y/o la α-glucosidasa bacteriana tiene una CI50 de 10−3 M o menor, más preferiblemente 10−4 M o menor, más preferiblemente 10−5 M o menor, en las exploraciones de amilasa y glucosidasa descritas en este documento. Preferiblemente, el inhibidor de amilasa y/o α-glucosidasa tiene una baja actividad antimicrobiana, más preferiblemente con un valor de CIM de más de 50 µg/ml en los ensayos descritos en este documento, más preferiblemente de más de 100 µg/ml. 55 Los inhibidores de α-amilasa y/o α-glucosidasa son las sustancias descritas a continuación y análogos simples de los mismos, incluyendo los Ejemplos siguientes, que se consideran eficaces en las exploraciones mencionadas a continuación: 60 65 5 ES 2 272 418 T3 5 10 15 20 25 30 35 Todas las sustancias mencionadas en este documento se pueden marcar por ejemplo con isótopos de algunos átomos, como se conoce bien en la técnica. Tales sustancias marcadas isotópicamente están disponibles por procedimientos bien conocidos en la técnica. Los inhibidores preferidos incluyen acarbosa y análogos superiores de la misma, Trestatina A, Trestatina C. 40 Un grupo preferido de inhibidores es un compuesto sustancialmente puro, o un producto de fermentación o biotransformación parcialmente purificado, inhibidores que incluyen acarbosa y análogos superiores de la misma, Trestatina A, Trestatina C. 45 Se prefieren especialmente la acarbosa y la Trestatina C. Algunos de los inhibidores se pueden preparar por biotransformación/fermentación, tal como los procedimientos descritos en este documento a continuación. 50 55 60 65 Productos de biotransformación/fermentación Se obtuvieron los cultivos de Streptomyces conglobatus ATCC31005, Streptomyces coelicolor subespecie flavus ATCC19894, Streptomyces kursannovii ATCC11912 y Streptomyces lienomycini ATCC43687 de la American Type Culture Collection (ATCC ubicada en 10801 University Boulevard, Manassas, Virginia 20110-2209, Estados Unidos.). Los cultivos de Streptomyces sp. KC672 aislados de un sedimento marino de la Bahía de Suruga, Japón, y Streptomyces sp CL45763 se han depositado de acuerdo con el Tratado de Budapest en el National Collections of Industrial and Marine Bacteria Ltd. y se les han asignado los números de acceso NCIMB41058 y NCIMB41057 respectivamente. (El NCIBM está ubicado en 23 St. Machar Drive, Aberdeen, U.K. AB24 3RY.). El depositante fue Pfizer Central Research, Pfizer Limited, Ramsgate Road, Sandwich, Kent, CT13 9NJ, Gran Bretaña. Pfizer Ltd. es una subsidiaria de propiedad total de Pfizer Inc. 235 East 42nd Street, Nueva York, Nueva York, Estados Unidos. Además, se pueden usar las cepas mutantes de Streptomyces conglobatus ATCC31005, Streptomyces coelicolor subespecie flavus ATCC19894, Streptomyces kursannovii ATCC11912, Streptomyces lienomycini ATCC43687, Streptomyces sp. KC672 y Streptomyces sp. CL4576. Tales cepas mutantes se pueden obtener de forma espontánea o por la aplicación de técnicas conocidas, tales como la exposición a radiación ionizante, luz ultravioleta, y/o mutágenos químicos tales como N-metil-N-nitrosouretano, N-metil-N’-nitro-N-nitrosoguanadina, etilmetilsulfato etc. Las formas transformadas genéticamente y recombinantes incluyen mutantes y variantes genéticas producidos por técnicas 6 ES 2 272 418 T3 de ingeniería genética, incluyendo por ejemplo recombinación, transformación, transducción, fusión de protoplastos etc. 5 10 La fermentación de los cultivos de Streptomyces conglobatus ATCC31005, Streptomyces coelicolor subespecie flavus ATCC19894, Streptomyces kursannovii ATCC11912, Streptomyces lienomycini ATCC43687, Streptomyces sp. KC672 y Streptomyces sp. CL4576 se puede realizar usando procedimientos convencionales bien conocidos en la técnica para bacterias filamentosas del género Streptomyces. Por ejemplo, el crecimiento del organismo puede tener lugar en un medio sólido o en un medio líquido acuoso adecuado en condiciones aeróbicas en el intervalo de 24 a 35ºC usando fuentes adecuadas de carbono, nitrógeno y elementos traza tales como hierro, cinc, manganeso durante 2 a 30 días. Se hace uso de los siguientes medios de fermentación. 15 20 25 Medio de Producción de AP5-H Almidón de maíz (Hidex) Extracto de levadura (Oxoid) K2 HPO4 MgSO4 ·7H2 O Ácido glutámico FeSO4 ·7H2 O ZnSO4 ·2H2 O MnSO4 ·2H2 O CaCO3 Agua corriente NaOH 80 g 5g 1g 1g 1g 0,01 g 0,001 g 0,001 g 7g 1l a pH 7,0 30 Medio MECO de 1 /2 potencia 35 40 Glucosa Almidón Hidrolizado con Ácido (HidexTM , Japón) CasitoneTM (fuente de Difco-nitrógeno) Extracto de levadura (OxoidTM ) Germen de trigo (Sigma) Carbonato cálcico Agua desmineralizada NaOH 5g 10 g 2,5 g 2,5 g 2,5 g 2,0 g 1l a pH 7,0 45 Medio ANG-3 Modificado 50 55 60 65 Almidón soluble Glucosa Harina de Soja (TrusoyTM ) NaNO3 K2 HPO4 MgSO4 ·7H2 O KCl FeSO4 ·7H2 O Tampón MOPS (Sigma) Agua desmineralizada NaOH 20 g 100 g 10 g 2g 1g 0,5 g 0,5 g 0,01 g 20 g 1l a pH 7 Todos los medios descritos se pueden suplementar con otros almidones, almidones parcialmente hidrolizados o almidones solubles y/o azúcares tales como D-xilosa, D-ribosa, D-maltosa, D-maltotriosa, D-sedoheptulosa, D-trehalosa, D-glucosa y/o fuentes de nitrógeno tales como asparagina, aspartato y glutamina. 7 ES 2 272 418 T3 Ejemplo 1 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces conglobatus ATCC31005 5 10 15 Se inoculó Streptomyces conglobatus ATCC31005 mantenido en medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en dos matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio Meco de 1 /2 potencia. Después se dejaron incubar durante 7 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se centrifugó el caldo a 3500 rpm y se retiró el sobrenadante del micelio. Se determinó la actividad inhibidora de α-amilasa para el sobrenadante que se resume a continuación en la tabla. Dilución del sobrenadante en el ensayo 1:1000 1:10000 1:100000 % inhibición matraz 1 91 89 65 % inhibición matraz 2 86 90 58 20 Ejemplo 2 25 30 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces spp CL 45763 Se inoculó Streptomyces sp. CL45763 mantenido en medio agar de Bacto ISP-3 como una carga completa de esporas en cuatro matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5-H. Después se dejaron incubar durante 9 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se combinaron los caldos, se centrifugaron a 3500 rpm y se retiró el sobrenadante del micelio. Después se determinó la actividad inhibidora de α-amilasa para el sobrenadante que se resume a continuación en la tabla. 35 Dilución del sobrenadante en el ensayo 40 45 % inhibición 1:1000 1:10000 1:100000 79 77 53 Ejemplo 3 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces coelicolor subespecie flavus ATCC19894 50 55 Se inoculó Streptomyces coelicolor subespecie flavus ATCC19894 mantenido en un medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en diez matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5-H. Después se dejaron incubar durante 4 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se centrifugaron los caldos a 3500 rpm, y después se retiró el sobrenadante del micelio. Se determinó la actividad inhibidora de α-amilasa para los sobrenadantes combinados que se resume a continuación en la tabla. Dilución del sobrenadante en el ensayo 60 % inhibición matraz 1 65 8 1:1000 1:10000 66 35 ES 2 272 418 T3 Ejemplo 4 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces kursannovii ATCC11912 5 10 15 Se inoculó Streptomyces kursannovii ATCC11912 mantenido en un medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en dos matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5-H. Después se dejaron incubar durante 5 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se centrifugaron los caldos a 3500 rpm, y se retiró el sobrenadante del micelio. Se determinó la actividad inhibidora de α-amilasa para cada sobrenadante que se resume a continuación en la tabla. Dilución del sobrenadante en el ensayo % inhibición matraz 1 % inhibición matraz 2 1:1000 1:10000 1:100000 85 85 73 70 27 30 20 Ejemplo 5 25 30 35 40 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces lienomycini ATCC43687 Se inoculó Streptomyces lienomycini ATCC43687 mantenido en un medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en tres matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio ANG-3 modificado. Después se dejaron incubar durante 5 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se centrifugaron los caldos a 3500 rpm, y se retiró el sobrenadante del micelio. Se determinó la actividad inhibidora de α-amilasa para cada sobrenadante individual que se resume a continuación en la tabla. Dilución del sobrenadante en el ensayo 1:1000 1:10000 1:100000 % inhibición matraz 1 87 70 41 % inhibición matraz 2 85 75 41 % inhibición matraz 3 85 76 47 45 Ejemplo 6 Preparación de un caldo de fermentación que demuestra actividad inhibidora de α-amilasa de fluido ruminal de Streptomyces sp. KC672 50 55 Se inoculó Streptomyces sp. KC672 mantenido en un medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en dos matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5-H. Después se dejaron incubar durante 7 días a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto se centrifugaron los caldos a 3500 rpm, y se retiró el sobrenadante del micelio. Se determinó la actividad inhibidora de α-amilasa para los sobrenadantes que se resume a continuación en la tabla. Dilución del sobrenadante en el ensayo 60 1:1000 1:10000 % inhibición matraz 1 54 21 % inhibición matraz 1 49 22 65 9 ES 2 272 418 T3 Ejemplo 7 Aislamiento de un inhibidor de α-amilasa de fluido ruminal de Streptomyces conglobatus ATCC31005 - ejemplo comparativo 5 10 15 20 25 30 Se inoculó una carga completa de esporas de Streptomyces conglobatus ATCC31005 mantenido en un medio agar ATCC172 de 1 /4 potencia en dos matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5-H. Después de 24 horas de incubación a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm), se usaron estos matraces para inocular minitarros de 5 l (ElectrolabTM , Gloucester, U.K.) que contenían cada uno 3,5 litros de medio AP5-H. Se incubaron estos caldos a 28ºC con una aireación de 3 l/min y agitación a 300 rpm durante 6 días. Al recoger los caldos, se centrifugaron a 2500 rpm y se decantaron los sobrenadantes. Se agitaron ambos dos veces durante 45 minutos con 86 g de carbón vegetal y después se filtraron a través de un lecho de ArbocelTM . El pH en esta etapa era de pH 7. Se extrajo cada torta de carbono dos veces con 860 ml de acetona acuosa (1:1) manteniendo el pH entre 2 y 3 por la adición de ácido clorhídrico concentrado. Los cuatro extractos de acetona acuosa se evaporaron parcialmente, se combinaron y se liofilizaron para obtener 40 g de un sólido marrón. Este sólido se disolvió después en 500 ml de agua desionizada y se aplicó a una columna de 750 ml de Amberlite IR120 (forma H+ ) a un caudal de 2 ml/min. Después se lavó la columna con 1 l de agua y se eluyó con solución de amoniaco 5 N recogiendo fracciones de 50 ml. Las fracciones 13 a 28 se liofilizaron para dar 1,4 g de un polvo marrón oscuro. Éste se disolvió después en 15 ml de agua, se filtró y el filtrado resultante se diluyó con 5 ml de acetonitrilo. Esto se inyectó en volúmenes de 2 ml en una columna de Cosmosil NH2 -MS (20 x 250 mm) y se eluyó a 20 ml/min con acetonitrilo y agua (60:40). Se recogieron fracciones cada 30 segundos y se analizaron por CL-EM usando un instrumento Finnegan AQATM . Las fracciones que contenían M+H+ 970 se combinaron y se secaron para dar una goma sólida, 70 mg. El sólido se disolvió después en dos ml de agua, se filtró y se inyectó en dos mitades en una columna Waters AquaTM 5 micron 125A (21 x 150 mm), usando un sistema Waters Delta PrepTM 4000 con detección de serie de diodos. Se recogieron las fracciones y dos, ambas fracción 21, se combinaron conteniendo el pico de M+H+ 970 que produce un sólido blanco, 6,5 mg. Los datos de masa exactos se recogieron en un instrumento Bruker Apex II FT-ICR-MS 4.7T en el que la muestra, disuelta en metanol/agua/ácido acético (50:50:1) a aproximadamente 0,5 mg/ml, se introdujo en una fuente de electronebulización analítica mediante infusión directa a 4 µl/min. m/z (IEN, FTEM) [M+H]+ = 970,3601, C37 H64 NO28 requiere 970,3609 m/z (IEN, FTEM) [M+Na]+ =992,3452, C37 H63 NO28 requiere 992,3429 35 La RMN (protones, carbono-13, TOCSY, HSQC y HMBC) y el espectro de masas de este compuesto de fracción 21, también conocido como “6942/99/1” son coherentes con la estructura mostrada a continuación 40 45 50 55 60 El compuesto mostrado anteriormente se ha descrito en la Patente de GB 1 482 543 y (Ag.Biol.Chem. 46(7) (1982) 1941). 65 10 ES 2 272 418 T3 TABLA 1 13 Desplazamientos químicos de H y C RMN de 6942/99/1 (δ en ppm con relación a dioxano interno) 5 10 15 20 25 30 35 40 45 50 55 60 65 11 ES 2 272 418 T3 Se descubrió que el “compuesto de la Fracción 21” tiene un efecto inhibidor en la exploración de amilasa mencionada en este documento. 5 Ejemplo 8 Aislamiento de un inhibidor de α-amilasa de fluido ruminal de Streptomyces conglobatus ATCC31005 - ejemplo comparativo 10 15 Se usó el Medio de Producción AP5-H mencionado anteriormente como medio de fermentación. Se inoculó Streptomyces conglobatus ATCC31005 mantenido en un medio agar ATCC172 de 1 /4 potencia como una carga completa de esporas en dos matraces Erlenmeyer de 300 ml que contenían cada uno 50 ml de medio AP5H. Después se dejaron incubar durante 24 horas de incubación a 28ºC, 200 rpm en un Agitador Infors Multitron con desplazamiento de 1” (2,5 cm). En este punto el inóculo se transfirió a un matraz Fernbach de 3 litros que contenía 1 litro de medio AP5-H y se incubó durante otras 24 horas en las mismas condiciones que las descritas para los matraces Erlenmeyer. Después se transfirió este inóculo a 20 litros de medio AP5-H que se había esterilizado previamente en un fermentador de acero inoxidable de 30 litros New Brunswick MicrosTM . Después se agitaron los caldos a 300 rpm a 28ºC con 20 l/min de aire durante 112 horas y después se recogieron. 20 25 30 35 40 Los caldos recogidos se centrifugaron usando una Carr PowerfugeTM a 20 000G. Al sobrenadante, a un pH natural de 7,8 se añadieron 500 g de carbón vegetal activado decolorante. (Aldrich 16155-1) y la mezcla se agitó durante 16 horas. Después del filtrado a través de un coadyuvante de filtración, tal como ArbocelTM , se trató el sobrenadante con otros 500 g de carbón vegetal, durante 1 hora de la misma manera. Las tortas combinadas de carbón vegetal se lavaron con metanol acuoso (10 l 1:1) y después se extrajeron dos veces con acetona acuosa (10 l 1:1) por agitación durante 1 hora seguida de filtración a través de coadyuvante de filtración. Después de evaporación rotatoria parcial y secado por congelación se obtuvieron 98,7 g de material biológicamente activo. Este material se disolvió en 1800 ml de agua desmineralizada y se cargó en una columna de 3,5 l Amberlite IR 120(H)TM a un caudal de 5 ml/minuto. Después de un lavado con agua (2 l), se eluyó el producto con alícuotas de 1 l de solución de amoniaco 5 N. Después de secado por congelación, las fracciones más potentes (5 a 8) se combinaron para dar 10,8 g de sólido marrón. Se purificaron 1,1 g de este material por cromatografía, en cinco inyecciones iguales, usando un sistema de cromatografía Waters Delta Prep 4000TM , un CromasilNH2 250 x 21,2 mm (de Phenomenex) y un gradiente de acetonitrilo al 67% y agua al 33% a 50/50 cada 20 minutos con un caudal de 24 ml/minuto. Se recogieron fracciones de 12 ml. Las fracciones que contenían el pico de interés (31 a 35 de cada realización) se combinaron para dar 138 mg de sólido blanco. Este material se cromatografió de nuevo, esta vez usando una columna Aqua 150 x 21,2 mm (de Phenomenex) y un gradiente de agua al 100% a agua al 90% y acetonitrilo al 10% durante 15 minutos con un caudal de 21,2 ml/minuto. Se recogieron fracciones a intervalos de medio minuto. Se obtuvo un total de 43 mg del producto deseado de las fracciones 22 y 23. Los datos observados son coherentes con la siguiente estructura, mencionada en este documento como el “compuesto del Ejemplo 8”: 45 50 55 60 M/z (IEN, FT-MS) [M+H]+ = 1435,546 que corresponde a una fórmula molecular de C56 H95 N2 O40 (+/- 3,028 ppm). M/z (IEN, FT-MS) [M+H]+ = 1457,528 que corresponde a una fórmula molecular de C56 H94 N2 O40 (+/- 1,914 ppm). Todos los datos de RMN dados a continuación se registraron en una máquina Varian Innova 600 MHz a 10ºC en D2 O usando una sonda de 3 mm. 65 12 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 13 ES 2 272 418 T3 5 10 15 20 25 30 35 40 Modificaciones a acarbosa y otros inhibidores relacionados de α-amilasa y/o α-glucosidasa Biotransformaciones 45 Biotransformación microbiana 50 55 60 Se podrían usar organismos completos microbianos capaces de glicosidación de acarbosa y otros inhibidores relacionados de α-amilasa y/o α-glucosidasa para obtener una actividad inhibidora de α-amilasa y/o α-glucosidasa aumentada, que incluye Bacillus subtilis ATC550601 , Saccharopolyspora erythrae ATCC116352 y un mutante bloqueado de S. avermitilis ATCC535673 . Otros organismos que pueden glucosidar incluyen Cunninghamella sp. NRRL569514 y Beauvaria bassiana DSM 875 y DSM 134415 . Además también se podría usar la biosíntesis microbiana dirigida de acarbosa por un Actinoplanes sp CBS 793,964 suministrado con rutina con otros organismos productores de inhibidor de α-amilasa y/o α-glucosidasa relacionados. Estos pueden dar análogos de acarbosa u homólogos similares a la acarbosa relacionados que también podrían demostrar actividad inhibidora de α-amilasa y/o α-glucosidasa aumentada. Además también se podrían usar microorganismos capaces de O-acetilación16 , oxidación (incluida epoxidación17 y formación de cetonas18 ), hidroximetilación19 O-metilación20 , etc. para crear nuevos análogos de acarbosa y análogos relacionados que también podrían demostrar actividad inhibidora de α-amilasa y/o α-glucosidasa aumentada. Biotransformaciones enzimáticas brutas, parcialmente purificadas y purificadas Se pueden usar procedimientos enzimáticos de glicosilación para sintetizar o modificar oligosacáridos. No se requiere protección y desprotección específica de grupos hidroxilo y las enzimas sólo se transfieren a uno o dos grupos hidroxilo. Esto conduce a menudo a menos etapas de reacción y procedimientos de purificación más simples. 65 Se ha usado la transglicosilación de amilasa maltogénica de Bacillus stearothermophilus (BSMA) con acarbosa y diversos aceptores, en la que la enzima era un transformante de Escherichia coli que portaba el gen BSMA. 5 Se 14 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 observó que BSMA escindía el primer enlace glicosídico de la acarbosa para dar el pseudotrisacárido (PST) y después lo añadía a una unidad de glucosa en la posición α(1→6) para dar isoacarbosa, en la que la misma acarbosa tenía una unión α(1→4) en la glucosa terminal. La adición de varios carbohidratos diferentes al producto de digestión dio productos de transferencia en los que el PTS se unió principalmente α(1→6) a D-glucosa, D-manosa y D-galactosa y α-D-glucopiranósido de metilo. Con D-fructopiranosa y D-xilopiranosa, el PTS se unía en α(1→5) y α(1→4) respectivamente. La α-α trehalosa y maltitol dieron ambos dos productos principales con el PTS unido α(1→6) y α(1→4) al resto de glucopiranosa. El PTS se transfirió principalmente a C-6 del resto no reductor de maltosa, celobiosa, lactosa y gentiobiosa. La sacarosa dio PTS unido α(1→4) al resto de glucosa. La rafinosa dio dos productos principales con el PTS unido en α(1→6) y α(1→4) al resto de D-galactopiranosa. La maltotriosa dio dos productos principales con PTS unido α(1→6) y α(1→4) al resto de glucopiranosa del extremo no reductor. El xilitol dio PTS unido α(1→5) como producto principal y el D-glucitol dio PTS unido α(1→6) como el único producto. Todos estos ejemplos pueden mostrar actividad inhibidora de α-amilasa mejorada. Se pueden usar otros grupos de enzimas para producir análogos glicosidados de la acarbosa u otros inhibidores de α-amilasa y/o α-glucosidasa que tienen grupos de azúcar o hidroxilo accesibles. Las preparaciones enzimáticas que se pueden usar incluyen α y β-galactosidasa, α y β-manosidasa, β-N-acetilglucosaminidasa, β-N-acetilgalactoaminidasa, y α-L-fucosidasa. 6 La glicosidación puede tener lugar en cada extremo de la unidad valienamina o ciclitol de la acarbosa y la experiencia muestra que se prefiere que la transferencia de glicosilo tenga lugar en la unidad de monosacárido terminal no reductor de los sustratos. 7 Los estudios que usan endoglicosidasas pueden conducir a estructuras ramificadas. Las preparaciones enzimáticas descritas pueden ser derivados microbiológicos, por ejemplo Aspergillus niger, A. terreus, A. oryzae, Bacillus circulans, B. stearothermophilus, Coccobacillus, o jugos de insectos, por ejemplo caracol, o derivados de plantas, por ejemplo manzanas, setas, semillas de alfalfa, harina de almendra desgrasada, etc.6 También se pueden usar glicosiltransferasas para glicosilar la acarbosa y los análogos relacionados que demuestran actividad inhibidora de α-amilasa pero son enzimas mucho menos frecuentes. 8 Muchas de estas glicosiltransferasas se han clonado. A menudo se hace referencia a ellas como que son bastante estrictas a uno o dos restos de sacárido distales y también son muy específicas del donante de glicosilo. También se les puede forzar para trabajar con donantes y/o aceptores no naturales manteniendo sus ventajas de estricta selectividad de región y estereoselectividad y elevados rendimientos. Solamente están disponibles fácilmente unas pocas glicosiltransferasas y la mayoría de los experimentos se ha realizado con galactosiltransferasa Gal T.9 Un grupo especial de glicosil transferasas son las ciclodextrina glucanotransferasas (CGTasa). Estas enzimas se producen por microorganismos y muchas están disponibles en el mercado. Catalizan la ciclodextrinación del almidón pero también transfieren una o más unidades de α-glicosilo a diversos aceptores. Se pueden usar para prolongar glicósidos o para la α-glicosilación de muchos compuestos. Se usó la CGTasa de B. stearothermophilus para la transglicosilación de rutina en la que la unidad de glicosilo se prolongó en una o más unidades de glucosa. 10 Un enfoque similar se podría usar para la acarbosa y los inhibidores de α-amilasa y/o α-glucosidasa relacionados que contienen unidades de glucosa. Otro enfoque es usar glucógeno fosforilasa que es la enzima bien conocida responsable de la formación o degradación de glucanos α(1→4). La fosforilasa requiere un sustrato activado tal cono el éster de glucosilfosfato. Con este sustrato se puede alargar una cadena de glucano, la unidad básica, en unidades de glucosa con la liberación de fosfato.11 También se puede hacer la modificación de acarbosa y de los inhibidores de α-amilasa y/o α-glucosidasa relacionados que contienen unidades de glucosa usando hidrólisis selectivas con la misma α-amilasa que pueden escindir unidades de azúcar o transglicosilar 12,13 . Para otras modificaciones de los grupos hidroxilo de unidades de azúcar se pueden usar acilasas, esterasas, lipasas, hidrolasas y deshidratasas. 50 Referencias para esta sección 1. Petuch B.R y col., Microbial transformation of immunosuppressive compounds 111. Glucosylation of immunomycin and FK506 by Bacillus subtilis ATCC55060. J. Ind. Microbiol. 13, 131-135, (1994) 55 2. Arison, B.H y col. Microbial glycosidation of avermectins. Eur. Pat. Appl. (1992) EP 520557 A 1. 3. Pacey M.S. y col. Preparation of 13-epi-selamectin by biotransformation using a blocked mutant of Streptomyces avermitilis. J. Antibiotics, 53 (3), 301-305, (2000) 60 4. Cruegar, A y col. Novel acarviosin glycoside: synthesis of a new saccharase inhibitor via biotransformation. Ger. Offen. (1999) DE 19821038 A1 5. Park, H.P y col. Transglycosylation reactions of Bacillus stearothermophilus maltogenic amylase with acarbose and various acceptors. Carbohydrate Res. 313, (1998), 235-246 65 6. M. Scigelova y col. Glycosidases -a great synthetic tool. J. of Molecular Catalysis B: Enzymatic 6, (1999), 483494. 15 ES 2 272 418 T3 7. Crout DHG, y col. Glycosidases and glycosyltransferases in glycoside and oligosaccharide synthesis. Curr. Opin. Chem. Biol 2(1), (1998), 98-111, 5 8. Kren, V. y col. Glycosylation employing bio-systems: from enzymes to whole cells. Chem. Soc. Rev. 26, (1997), 463 9. C. H. Wong. y col. Enzymes in Synthetic Organic Chemistry. Tetrahedron Org. Chem. Ser. Eds. Baldwin J.E & Magnus P.D., Pergamon (1994), Vol 12. 10 10. Suzuki y col. Agric. Biol. chem. Enzymatic formation of 4-α-D-glucopyranosyl-rutin 55, (1991),181 11. Evers B y col. Further syntheses employing phosphorylase. Bioorganic & Medicinal Chemistry 5(5), (1997), 857-863 15 12. Takada, M y col. Chemo-enzymic synthesis of galactosylmaltooligosaccharidonolactone as a substrate analogue inhibitor for mammalian α-amylase. Japón. J. Biochem. (Tokio) 123(3), (1998), 508-515 13. Kim, T.K y col. Synthesis of glucosyl-sugar alcohols using glycosyltransferases and structural identification of glucosyl-maltitol. J. Microbiol. Biotechnol. 7(5), (1997), 310-317. 20 14. Chatterj, P y col. Glucosidation of betulinic acid by Cunninghamella sp. J. Nat. Prod. 62(5), (1999), 761-763. 15. Kittleman, M y col. Microbial hydroxylation and simultaneous formation of the 4”-O-methylglucoside of the tyrosine-kinase inhibitor CGP 62706. Chimia 53(12), (1999), 594-596. 25 16. Oda S y col. Double coupling of acetyl coenzyme A production and microbial esterification with alcohol acetyl-transferase in an interface bioreactor. J. Ferment. Bioeng. 83, (1997), 423-428 30 17. Garcia-Granados y col. Biotransformation of ent-6α-acetoxy- and ent-6-ketomanoyloxides with Rhizopus nigricans ATCC10404 and Curvularia lunata ATCC12017. Phytochemistry 45,(1997), 283-291. 18. Fantin,G y col. Regioselective microbial oxidation of bile acids. Tetrahedron, 54, (1998), 1937-1942. 35 19. Azerad, R. Solicitud de Patente WO 99/47963 con fecha de 23.09.99. Novel method for the production of fexofenadine using Absidia corymbifera LCP 63-1800 or Streptomyces platensis NRRL 2364. 20. Sariaslani, F y col. Novel biotransformations of 7-ethoxycoumarin by Streptomyces griseus. NRRL8090. Appl. Environ. Microbiol. 46(2), (1983), 468-474. 40 Ciertas sustancias mencionadas en este documento pueden existir en una o más formas geométricas y/o estereoisoméricas. La presente descripción incluye todos estos isómeros y sales de los compuestos reivindicados. Ciertos compuestos mencionados en este documento pueden existir en más de una forma tautomérica. De forma similar ciertos compuestos mencionados en este documento pueden tener formas zwitteriónicas. También se debe entender que la descripción abarca todas estos tautómeros, zwitteriones. 45 50 55 60 La descripción incluye sales veterinariamente aceptables de los compuestos mencionados en este documento, incluyendo las sales de adición de ácidos y básicas de los mismos cuando sea apropiado. Las sales de adición de ácidos adecuadas se forman a partir de ácidos que forman sales no tóxicas y son ejemplos las sales de clorhidrato, bromhidrato, yodhidrato, sulfato, hidrogenosulfato, nitrato, fosfato, hidrogenofosfato, acetato, maleato, fumarato, lactato, tartrato, citrato, gluconato, succinato, benzoato, metanosulfonato, bencenosulfonato, y p-toluenosulfonato. Las sales básicas adecuadas se forman a partir de bases que forman sales no tóxicas y son ejemplos las sales de aluminio, calcio, litio, magnesio, potasio, sodio, cinc y dietanolamina. Para una revisión de las sales adecuadas véase Berge y col, J. Pharm. Sci., 66, 1-19 (1977). Los especialistas en la técnica apreciarán que ciertos derivados protegidos de los compuestos mencionados en este documento, que se pueden preparar antes de una etapa de desprotección final, pueden no tener la actividad biológica deseada como tal, pero pueden, en algunos casos, transformarse después de la administración en el cuerpo, por ejemplo por el metabolismo, para formar los compuestos mencionados en este documento que son biológicamente activos. Tales derivados se incluyen en el término “profármaco”. Además los especialistas en la técnica apreciarán que ciertos restos conocidos por los especialistas en la técnica como “pro-restos”, por ejemplo como se describe en “Design of Prodrugs” de H Bundgaard (Elsevier) 1985, se pueden colocar en funcionalidades apropiadas cuando tales funcionalidades están presentes en los compuestos mencionados en este documento, también para formar un “profármaco”. Además, ciertos compuestos mencionados en este documento pueden actuar como profármacos de otros compuestos mencionados en este documento. 65 Los especialistas en la técnica apreciarán que se pueden preparar ciertas sustancias mencionadas en este documento por procedimientos diferentes a los que se han descrito anteriormente en este documento, por adaptación de los procedimientos descritos en este documento y/o adaptación de procedimientos conocidos en la técnica, por ejemplo 16 ES 2 272 418 T3 la técnica descrita en este documento, o usando libros de texto convencionales tales como “Comprehensive Organic Transformations -A Guide to Functional Group Transformations”, RC Larock, VCH (1989 o ediciones posteriores), 5 “Advanced Organic Chemistry - Reactions, Mechanisms and Structure”, J. March, Wiley-Interscience (3a edición o posteriores), “Organic Synthesis -The Disconnection Approach”, S Warren (Wiley), (1982 o ediciones posteriores), 10 “Designing Organic Syntheses” S Warren (Wiley) (1983 o ediciones posteriores), “Guidebook To Organic Synthesis” RK Mackie and DM Smith (Longman) (1982 o ediciones posteriores), “Methoden der Organischen Chemie”, Houben Weyl, Georg Thieme Verlag, Stuttgart, “The Chemistry of the Hydroxyl Group” Parts 1 & 2, Saul Patai, (1971), Interscience Publishers, 15 “The Chemistry of the Amino Group”, Saul Patai, (1968), Interscience Publishers, “Trends in Synthetic Carbohydrate Chemistry”, ACS Symposium Series 386, (1989), American Chemical Society, Washington, DC, 20 “Advances in Carbohydrate Chemistry and Biochemistry”, Volumes 1-39, Academic Press, Nueva York “Carbohydrate Chemistry”, Volumes 1-11, The Chemical Society, Londres, “Methods in Carbohydrate Chemistry”, Volumes 1-8, Academic Press, Nueva York, 25 “Carbohydrates Synthetic Methods and Applications in Medicinal Chemistry”, Ogura, H. y col., (1992), Kodansha, Tokio. y las referencias en los mismos como guía. 30 35 40 45 50 55 60 65 Se debe entender que los procedimientos de transformación sintética mencionados en este documento son solamente ejemplares y se pueden realizar en diversas secuencias diferentes para que los compuestos deseados se puedan ensamblar eficazmente. El químico especialista ejercitará su criterio y su experiencia para la secuencia de reacciones más eficaz para la síntesis de un compuesto diana dado. Por ejemplo, se pueden añadir sustituyentes y/o se pueden realizar transformaciones químicas sobre intermedios diferentes a los mencionados en este documento junto con una reacción particular. Esto dependerá inter alia de factores tales como la naturaleza de otros grupos funcionales presentes en un sustrato particular, la disponibilidad de intermedios clave y la estrategia de grupos protectores (si los hay) que se deben adoptar. Claramente, el tipo de química implicada influirá en la elección del reactivo que se usa en dichas etapas de síntesis, la necesidad, y tipo, de grupos protectores que se emplean, y la secuencia para lograr la síntesis. Los procedimientos se pueden adaptar según sea apropiados a los reactantes, reactivos y otros parámetros de reacción de manera que será evidente para los especialistas en la técnica por referencia a libros de texto convencionales y a los ejemplos proporcionados a continuación en este documento. Será evidente para los especialistas en la técnica que se puede necesitar que los grupos funcionales sensibles se protejan y desprotejan durante la síntesis de un compuesto de la invención. Esto se puede lograr por procedimientos convencionales, por ejemplo como se describe en “Protective Groups in Organic Synthesis” por TW Greene y PGM Wuts, John Wiley & Sons INC (1999), y las referencias en el mismo. Los grupos funcionales que pueden ser deseables para proteger incluyen oxo, hidroxi, amino y ácido carboxílico. Los grupos protectores adecuados para oxo incluyen acetales, cetales (por ejemplo etilencetales) y ditianos. Los grupos protectores adecuados para hidroxi incluyen grupos trialquilsililo y diarilalquilsililo (por ejemplo terc-butildimetilsililo, terc-butildifenilsililo o trimetilsililo) y tetrahidropiranilo. Los grupos protectores adecuados para amino incluyen terc-butiloxicarbonilo, 9-fluorenilmetoxicarbonilo o benciloxicarbonilo. Los grupos protectores adecuados para ácido carboxílico incluyen alquilo C1−6 o ésteres de bencilo. Los inhibidores de amilasa y/o α-glucosidasa se pueden administrar solos o en combinación con uno o más agentes usados en el tratamiento (incluyendo profilaxis) de la enfermedad o en la reducción o supresión de los síntomas según sea apropiado para el tratamiento de acidosis y afecciones relacionadas. Los ejemplos de tales agentes (que se proporcionan a modo de ilustración y no se deben interpretar como limitantes) incluyen tampones, antibióticos que incluyen ionóforos, probióticos, ácidos orgánicos y bacteriocinas, antiparasitarios, por ejemplo, fipronil, lufenurón, imidacloprid, avermectinas (por ejemplo abamectina, ivermectina, doramectina), milbenicinas, organofosfatos, piretroides; antihistaminas, por ejemplo clorfeniramina, trimeprazina, difenildramina, doxilamina; antifúngicos, por ejemplo fluconazol, ketoconazol, itraconazol, griseofulvina, anfotericina B; antibacterianos, por ejemplo enrofloxacina, marbofloxacina, ampicilina, amoxicilina; anti-inflamatorios, por ejemplo prednisolona, betametasona, dexametasona, carpofeno, ketoprofeno; suplementos dietéticos, por ejemplo ácido gamma linoleico, y emolientes. Los inhibidores de amilasa y/o α-glucosidasa se pueden administrar solos, pero generalmente se administrarán en mezcla con un excipiente, diluyente o vehículo adecuado, seleccionado respecto a la vía pretendida de administración y la práctica farmacéutica/veterinaria/ganadera convencional. 17 ES 2 272 418 T3 5 10 15 De forma ventajosa para el tratamiento de animales de ganadería tales como ovejas y ganado vacuno, el agente activo se puede administrar por vía oral usando procedimientos convencionales adecuados tales como mezclarlos con el pienso de los animales, el agua de bebida o mediante un bolo suministrado directamente al rumen. Para la administración en el pienso de un aditivo alimenticio concentrado o premezcla se puede proporcionar mezcla con el alimento normal del animal. Se pueden incluir agentes estabilizantes físicos y químicos adicionales para mantener o mejorar la estabilidad de los agentes activos en dicha formulación. Los procedimientos mediante los que el agente activo se puede administrar incluyen la administración oral por cápsula, bolo, comprimido, o poción o, como alternativa, se pueden administrar por inyección o como un implante en el rumen. Tales formulaciones se pueden preparar de una manera convencional de acuerdo con la práctica veterinaria convencional. Por ejemplo, el agente activo se puede administrar por vía oral en forma de soluciones, polvos o suspensiones, que pueden contener agentes aromatizantes o colorantes, para aplicaciones de liberación inmediata, retardada, modificada, sostenida, en pulsos o controlada. Además de la administración en el alimento o en la bebida como parte de la dieta normal del ganado, se prevé que el agente activo se puede administrar de forma separada entre la alimentación y la bebida normal, por ejemplo en forma de un “manjar” apetitoso tal como en una formulación basada en melazas. 20 25 30 35 Para suspensiones acuosas y/o elixires, el agente activo se puede combinar con diversos agentes edulcorantes o aromatizantes, sustancias colorantes o tintes, con agentes emulsionantes y/o de suspensión y con diluyentes tales como agua, etanol, propilenglicol y glicerina, y combinaciones de los mismos. Se pueden también incluir agentes estabilizantes físicos y químicos adicionales para mantener o potenciar la estabilidad de los agentes activos en dicha formulación. El agente activo también se puede administrar mediante una formulación de bolo de acción prolongada directamente al rumen, en el que el dispositivo de formulación se retiene en el saco ruminorreticular durante periodos prolongados de tiempo para facilitar la liberación sostenida. La retención ruminal del dispositivo de formulación como se describe en este caso se puede lograr usando matrices o depósitos densos basados en cilindros de aluminio o acero o gránulos de una mezcla de arcilla, fármaco y otros ingredientes. El agente activo se puede administrar, en ciertos casos de forma parenteral, por ejemplo, de forma intravenosa, intraarterial, intraperitoneal, intramuscular o subcutánea, o administrarse por técnicas de infusión. Para tal administración parenteral el agente activo se usa de la mejor manera en forma de una solución acuosa estéril que puede contener otras sustancias, por ejemplo, suficientes sales o glucosa para hacer que la solución sea isotónica con la sangre. La solución acuosa se debe tamponar adecuadamente (preferiblemente a un pH de 3 a 9), si es necesario. La preparación de formulaciones parenterales estériles adecuadas se logra fácilmente por metodología de esterilización terminal o por fabricación aséptica usando técnicas farmacéuticas bien conocidas por los especialistas en la técnica. 40 45 Por tanto, las dosis unitarias del agente activo pueden contener de 0,001 mg a 20 mg del agente activo para la administración de forma única o dos o más al mismo tiempo, según sea apropiado. Por ejemplo, la acarbosa se ha administrado a 15 g por animal por día en 2 comidas separadas. Un intervalo diana para un compuesto activo es hasta aprox. 3 g/animal/día. El veterinario/ganadero determinará en cualquier suceso la dosis real que será la más adecuada para cada animal individual o para cada grupo de animales y ésta puede variar con la edad, el peso, la dieta, y la respuesta del animal particular. Las dosificaciones anteriores son ejemplares del caso promedio. Pueden, por supuesto, ser casos individuales en los que hagan falta intervalos de dosificación mayores o menores y tales están dentro del alcance de esta invención. Los especialistas en la técnica apreciarán que, en el tratamiento de ciertas afecciones tales como acidosis aguda el agente activo se puede dar como una única dosis según se necesite o se desee. 50 El agente activo normalmente se administrará por vía oral o por cualquier otra vía adecuada (que puede finalmente alcanzar el rumen), en forma de preparaciones que comprenden el ingrediente activo, opcionalmente en forma de una sal orgánica o inorgánica no tóxica, de adición de ácidos o bases, en una forma de dosificación veterinaria/farmacéutica aceptable. 55 Dependiendo de la dolencia y el animal a tratar, así como de la vía de administración. Las composiciones se pueden administrar a dosis variables (véase a continuación). 60 Aunque es posible administrar el agente activo directamente sin ninguna formulación, los agentes activos preferiblemente se emplean en forma de una formulación farmacéutica o veterinaria que comprende un vehículo, diluyente o excipiente farmacéutica o veterinariamente aceptable y agente activo. El vehículo, diluyente o excipiente se puede seleccionar respecto a la vía de administración pretendida y la práctica farmacéutica y/o veterinaria convencional. Las composiciones que comprenden el agente activo pueden contener del 0,1 por ciento en peso al 90,0 por ciento en peso del ingrediente activo. 65 Las formulaciones variarán respecto al peso del compuesto activo en las mismas, dependiendo de la especie de animal a tratar, la gravedad y el tipo de afección y el peso corporal del animal. Para la administración parenteral y oral, los intervalos de dosis típicos del ingrediente activo son de 0,0001 a 1000 mg por kg de peso corporal del animal. 18 ES 2 272 418 T3 Preferiblemente, el intervalo es de 0,001 a 20 mg por kg. Por ejemplo, la acarbosa se administró a 16 mg/kg. Más preferiblemente el intervalo es 0,001 a 5 mg/kg, y mucho más preferiblemente 0,001 a 0,5 mg/kg. 5 También debe apreciarse que todas las referencias de este documento al tratamiento incluyen tratamiento curativo, paliativo y profiláctico. La eficacia de los agentes se puede demostrar usando los siguientes Procedimientos de Ensayo, en los que la acarbosa se usa como un ejemplo de un inhibidor de amilasa y/o α-glucosidasa adecuado. 10 Procedimiento de Ensayo Ensayo de amilasa bacteriana del rumen - protocolo 1 15 El ensayo utiliza un kit de amilasa Sigma (577) para determinar si los compuestos inhiben la acción de las amilasas sobrenadantes del fluido ruminal. Las reacciones enzimáticas implicadas en el ensayo son las siguientes: 5 ET-G7 PNP → (α-amilasa) → 2 ET- G5 + 2 G2 PNP + 2 ET-G4 + 2 G3 PNP + ET-G3 + G4 -PNP 2 G2 PNP + 2 G3 PNP → (α-glucosidasa) → 4 PNP + 10 glucosa 20 25 30 35 40 La α-amilasa hidroliza el 4,6-etildieno-G7-PNP (ET-G7 PNP) en los fragmentos PNP G2, G3 y G4 . La α-glucosidasa (α-1,4-glucano glucohidrolasa EC 3.2.1.3) hidroliza G2 PNP y G3 PNP para producir p-nitrofenol y glucosa. Se hidrolizan cinco moles de sustrato (ET-G7 PNP) para producir 4 moles de p-nitrofenol. El p-nitrofenol absorbe luz a 405 nm, y después de un periodo de dos minutos de demora el índice del aumento de la absorbancia a 405 nm es directamente proporcional a la actividad de α-amilasa en el pocillo. Se recogió fluido ruminal de terneros de 4 meses Hereford x Friesian (125-135 kg, suministrados por Cwmnant Calves Ltd. Cwmnant. Tregaron. Ceredigion) alimentados con la dieta GH313. El fluido ruminal se recogió de terneros sacrificados en matraces al vacío precalentados, tan pronto como fue posible después de la eutanasia. Entonces se filtró a través de una capa doble de gasa absorbente (Gasa absorbente BP, GAUZ 4 de Robert Bailey plc, Stockport) para retirar partículas de heno y alimento. El líquido se centrifugó a una fuerza centrífuga relativa de 23.300 durante 60 minutos, y el sobrenadante se decantó, evitando la contaminación de la fase superior suelta del sedimento mediante el vertido cuidadoso. El sobrenadante después se alicuotó en tubos de plástico de 50 ml y se congeló a -20ºC. Cuando se requirió para su uso en un ensayo, el fluido ruminal sobrenadante se descongeló dejando los tubos en agua fría. Los compuestos de ensayo o los controles se repartieron en una placa de ensayo de 96 pocillos a 4 µl/pocillo. Después se añadieron 100 µl por pocillo de reactivo amilasa Sigma 577 (compuesto a la mitad del volumen descrito en las instrucciones (es decir 10 ml para un vial 577-20)) a cada pocillo, seguido por µl por pocillo de fluido ruminal sobrenadante. En T=0 se tomó la lectura a 405 nm en esta etapa usando un lector de placas Anthos. Después se incubó la placa a temperatura ambiente o 37ºC hasta que se vio una ventana de densidad óptica de aproximadamente 1,000 U (típicamente una hora a 37ºC o tres horas a temperatura ambiente). Se tomó una segunda lectura a 405 nm, y la primera lectura se restó de ella. Los compuestos activos provocan una reducción en las lecturas de densidad óptica en comparación con el control sin que se ensayara el agente. Resultados- CI50 en la exploración de amilasa de fluido ruminal (usando kit Sigma 577) 45 Compuesto 50 55 60 CI50 Media (µM) Número de ensayos Acarbosa 2,03 n= 34 Trestatina A 0,17 n= 8 Trestatina B 2,89 n= 6 Trestatina C 0,09 n= 6 V-1532 (ej. comparativo) 0,57 n= 2 Ejemplo 7 (ej. comparativo) 2,06 n= 8 Ejemplo 8 (ej. comparativo) 0,44 n= 10 65 19 ES 2 272 418 T3 Respuesta de dosis de acarbosa en el ensayo de amilasa bacteriana del rumen [concentración de acarbosa en unidades Molares] 5 10 15 20 25 Protocolo de ensayo de glucosidasa de fluido ruminal 30 Este ensayo se usa para determinar valores de CI50 para inhibidores de actividad glucosidasa bacteriana de suspensión de células de fluido ruminal bovino (RFCS) usando un ensayo colorimétrico. 35 El ensayo mide la conversión de maltosa en glucosa. Las células de fluido ruminal se incuban con maltosa en presencia de inhibidores, y la cantidad de glucosa producida se evalúa usando un punto final colorimétrico rojo. Cuánto más alto es el nivel de inhibición, menor es la glucosa producida y menor el color rojo producido. Las placas se leen a 450 nm. Reacción principal: • Maltosa + glucosidasa → glucosa 40 Ensayo de glucosa • Glucosa + ATP → G-6-P y ADP (Hexoquinasa y Mg2+ ) 45 • G-6-P y NADP → 6-fosfogluconato (6-PG) y NADPH • NADPH + metosulfato de fenacina (PMS)→ NADP + PMSH • PMSH + INT (cloruro de yodonitrotetrazolio) → PMSH + INTH 50 55 60 65 El INTH está coloreado rojo oscuro. Se recogió fluido ruminal de una vaca seca donante Guernsey de cinco años fistulizada alimentada dos veces al día con 1,4 kg de GH313 y 2,3 kg de heno. El fluido ruminal se recogió en matraces al vacío precalentados. Después se filtró a través de una capa doble de gasa absorbente (Gasa absorbente BP, GAUZ 4 de Robert Bailey plc, Stockport) para retirar partículas de heno y alimento. El líquido se centrifugó a una fuerza centrífuga relativa 650 durante 15 minutos para retirar partículas de alimento y protozoos. El sobrenadante se decantó en tubos recientes y se centrifugó a una fuerza centrífuga relativa de 23.300 durante 60 minutos. Se desecharon el sobrenadante y la fase superior suelta de sedimento. El sedimento se resuspendió en PBS a 1:8 del volumen original, es decir, 50 ml de PBS para el sedimento de 400 ml de fluido ruminal, y se congeló a -20ºC. Cuando se requirió para su uso las células descongelaron dejando el tubo en agua fría, y después se diluyeron a 4,5 µl de células/pocillo (45 µl/ml). Los compuestos de ensayo o los controles se repartieron en la placa de ensayo de 96 pocillos a 2 µl/pocillo, seguidos de 50 µl por pocillo de maltosa 10 mM y 50 µl/pocillo de suspensión de células de fluido ruminal. La placa se incubó a 37ºC durante 1 hora. Se reconstituyó el kit de detección de glucosa Sigma 115A por adición de 17 ml de agua Millipore y 4 ml de reactivo de color a cada vial. Se añadieron 100 µl de esta solución por pocillo y se devolvió la palca al incubador a 37ºC durante 45 minutos. Después se leyó la placa a 450 nm. Los compuestos activos provocan una reducción en las lecturas de densidad óptica en comparación con los pocillos de control sin inhibidor. 20 ES 2 272 418 T3 Resultados - CI50 en exploración de glucosidasa de fluido ruminal Compuesto 5 CI50 Media (µM) Número de ensayos Acarbosa 1,08 n=7 Trestatina A 33,6 n=3 Trestatina B 4,10 n=2 Trestatina C 148,5 n=2 V-1532 (comparativo) 65,5 n=2 Ejemplo 7 (comparativo) 6,38 n=1 Ejemplo 8 (comparativo) 13,1 n=2 10 15 20 Ensayo de amilasa bacteriana del rumen - protocolo 2 25 El ensayo utiliza la digestión de amilosa unida covalentemente a Azul Brillante de Remazol R para determinar si los compuestos inhiben la acción de las amilasas sobrenadantes de fluido ruminal. Cuando el sustrato insoluble se incuba con amilasa, se libera tinción azul al pocillo. Esto se puede medir espectrofotométricamente para determinar cuanta actividad amilasa está presente, y si los compuestos de ensayo son inhibidores de amilasa. 30 35 40 Se recogió fluido ruminal de una vaca seca donante Guernsey de cinco años fistulizada alimentada dos veces al día con 1,4 kg de GH313 y 2,3 kg de heno. El fluido ruminal se recogió en matraces al vacío precalentados. Después se filtró a través de una capa doble de gasa absorbente (Gasa absorbente BP, GAUZ 4 de Robert Bailey plc, Stockport) para retirar partículas de heno y alimento. El líquido se centrifugó a una fuerza centrífuga relativa de 23.300 durante 60 minutos, y el sobrenadante se decantó, evitando la contaminación de la fase superior suelta del sedimento mediante el vertido cuidadoso. El sobrenadante después se alicuotó en tubos de plástico de 50 ml y se congeló a -20ºC. Cuando se requirió para su uso en un ensayo, el fluido ruminal sobrenadante se descongeló dejando los tubos en agua fría. Se añadieron a cada pocillo 100 µl por pocillo de una suspensión al 2% de azul celeste de amilosa (Sigma A3508) desde un vaso de precipitación que se agitó minuciosamente para asegurar una distribución uniforme del sustrato. Los compuestos de ensayo o controles se repartieron a la placa de ensayo de 96 pocillos a 4 µl/pocillo, seguidos por 100 µl por pocillo de sobrenadante de fluido ruminal. Después se incubó la placa a 37ºC durante 2,25 horas. Se retiró suavemente µl de líquido de cada pocillo usando una pipeta de 12 canales, se transfirió a una placa nueva de 96 pocillos y se leyó a 620 nm. Los compuestos activos provocan una reducción de las lecturas de densidad óptica en comparación con los pocillos de control sin inhibidor. Resultados - CI50 en exploración de amilasa de fluido ruminal (azul celeste de amilosa) 45 50 Compuesto CI50 Media (µM) Número de ensayos Acarbosa 2,39 n=4 Trestatina A 0,79 n=2 V-1532 (comparativo) 2,07 n=2 Ejemplo 7 (comparativo) 0,56 n=2 Ejemplo 8 (comparativo) 9,45 n=2 55 Protocolo para la determinación de concentraciones inhibidoras mínimas (CIM) en Aerobios 60 Se determinaron las CIM por una técnica de dilución en agar convencional de acuerdo con el National Committee for Clinical Laboratory Standards (NCCLS, M7 Edición A2). A continuación se detalla un resumen del procedimiento empleado. Se determinaron las CIM usando el medio de ensayo convencional, agar Mueller Hinton (MH) (Unipath). 65 Preparación de las placas de agar: se añadieron 19 ml de medio de ensayo a diluciones de duplicación apropiadas del compuesto de ensayo (1 ml) y se mezclaron minuciosamente. La mezcla se vertió en una placa petri (90 mm) y se dejó que el agar solidificara. 21 ES 2 272 418 T3 Preparación del inóculo: Se inocularon de cuatro a cinco colonias del organismo de ensayo desde un cultivo en placa de agar MH a 10 ml de caldo MH (Unipath). Se incubó el caldo a 37ºC hasta que estuvo visiblemente turbio. Se ajusto la densidad del cultivo a una turbidez equivalente a la de un patrón 0,5 McFarland mediante la adición de solución salina (0,85% v/v). 5 Inoculación de las placas de agar: Las placas se secaron durante aproximadamente 1 hora en un incubador a 37ºC. Las placas se inocularon con un inoculador Multipoint (Denley). Los alfileres de este dispositivo suministran 0,001 ml de inóculo a la placa (equivalente a 104 - 105 organismos). 10 Incubación de las placas: se invirtieron las placas y se incubaron a 37ºC durante 18 horas. Determinación de puntos finales: se registraron las CIM como la concentración más baja de compuesto de ensayo que inhibe completamente el crecimiento, independientemente de si el inóculo causo una colonia única o una ligera niebla. 15 Referencias para esta sección National Committee for Clinical Laboratory Standards 20 Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically-second edition. Approved standard reference methods for the determination of MIC of aerobic bacteria by broth macrodilution, broth microdilution and agar dilution. Chair holder J. Allan Witz, PhD DNAX Research Institute, NCCLS Document M7-A2 Villanova, Pa: NCCLS, 1990 25 Resultados usando acarbosa en este ensayo 30 35 40 45 50 55 60 65 22 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 50 55 Dietas usadas en los siguientes ensayos 60 [Todas las dietas se proporcionaron por Grain Harvesters Ltd, The Old Colliery, Wingham, Canterbury, Kent CT3 1LS, Inglaterra.] 65 23 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 24 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 25 ES 2 272 418 T3 5 10 15 20 25 30 35 40 45 50 Evaluación de agentes usando la técnica de simulación de rumen (RUSITEC) para crear un modelo de acidosis crónica 55 60 65 La técnica de simulación de rumen in vitro (RUSITEC), descrita por primera vez por Czerkawski y Breckenridge (1977) se usó para evaluar el efecto de la acarbosa inhibidora de α-amilasa y/o α-glucosidasa bacteriana sobre los perfiles de pH y producción de AGV diarios usando una ración de concentrado de ganado comercial (GH313 - véase más adelante). La alimentación con 30 g/día de esta ración con 2,5 g/día de paja de cebada troceada se ha visto previamente que produce concentraciones de ácidos grasos volátiles (AGV) de más de 150 mM, es decir concentraciones asociadas con acidosis crónicas in vivo (Nagaraja, Galyean & Cole, 1998, supra). Equipo: El aparato consta de dos unidades RUSITEC que contienen cada una cuatro recipientes de fermentación. Cada recipiente tiene un volumen de 1 litro, y se calentó en un baño de agua hasta 39ºC. El alimento se colocó en una bolsa de nylon (14 x 9 cm, 50 µm) y se agitó suavemente usando un mecanismo de pistón (8 golpes/min). Se infundió tampón (McDougall, 1948) continuamente a una velocidad de aproximadamente 750 ml/día por una bomba peristáltica de ocho canales (Watson Marlow). Se recogió el efluente en frascos de cristal de 1 litro que contenían 20 ml de solución de ácido oxálico (12 g/100 ml en agua desionizada). Esto se añadió para inhibir la actividad microbiana adicional. 26 ES 2 272 418 T3 Alimento: Cada recipiente se suministró diariamente con una bolsa que contenía 30 g de la ración comercial de gránulos GH313 (89% materia seca) y 2,5 g de paja de cebada (90% materia seca) troceada en tramos de 1-2 cm. 5 Se añadieron 7 g de almidón de trigo (Sigma Nº Ct. S4126) a la fase líquida de todos los recipientes de fermentación en la alimentación de los últimos cuatro días del experimento para simular acidosis aguda. Donante de fluido ruminal: El fluido ruminal se recogió de una vaca seca Guernesey de cinco años. El animal se alimentó dos veces al día con 1,4 kg de GH313 y 2,3 kg de heno. Los contenidos del rumen se recogieron a través de una fístula ruminal (Bar Diamond Inc. P.O.Box.60 Bar Diamond Lane. Parma. Idaho. 83660-0060. Estados Unidos). 10 15 20 Inoculación de los recipientes: Se tomaron los contenidos del rumen del animal donante fistulizado a las 08:00 h (antes de la alimentación de la mañana). El material se llevó al laboratorio en matraces aislados precalentados y después se filtró a través de cuatro capas de gasa de algodón en otro matraz aislado precalentado. Se pesaron 70 g del residuo sólido en cada una de las ocho bolsas de nylon. Una bolsa que contenía sólidos del rumen y una bolsa que contenía alimento freso se colocaron en la cámara de alimentación para cada recipiente. El contenido líquido de cada recipiente era 100 ml de agua desionizada, 200 ml de tampón artificial y 500 ml de fluido ruminal. Después de ensamblar y sellar los recipientes, se colocaron en los baños de agua y la biela del pistón se unió a la barra de transmisión. Los tubos de efluente se colocaron en los matraces de recogida. El espacio de cabeza de cada recipiente se lavó con CO2 durante 2 minutos, después se pusieron en marcha el motor de funcionamiento del pistón y la bomba de infusión de tampón. Mantenimiento diario y procedimiento de muestreo: Estos procedimientos se realizaron cada día a la misma hora. Se prepararon ocho bolsas de alimento y se calentó un frasco de dosificación de 1 l que contenía tampón de infusión a 39ºC. 25 1. Se apagaron los motores de funcionamiento y se paró la bomba de infusión. Los cables de infusión se pinzaron y se desconectaron de la bomba. 2. Se retiraron los recipientes de fermentación del baño de agua y a su vez se sirvieron. 30 3. Se extrajo la cámara de alimento de cada recipiente y se cambiaron las bolsas de alimento. En el día 2 la bolsa nueva reemplazó a la que contenía sólidos del rumen, mientras que en días posteriores la bolsa nueva reemplazó la que se había incubado durante 48 horas. Después se reemplazó la cámara en el recipiente de fermentación. 35 40 45 50 4. Se colocó la bolsa retirada en una pequeña bolsa de plástico y se añadieron 25 ml de tampón del dosificador. Se lavó la bolsa apretándola en el tampón durante 20 segundos, después se vertió el líquido en el recipiente. Se repitió este procedimiento de lavado dos veces con tampón reciente. 5. Después de reensamblar el recipiente, se repuso en el baño de agua y se unió a la barra de transmisión. Se reconectó el cable de infusión y se recolocó el electrodo de pH. Se cambió el frasco de recogida de efluente y se purgó el espacio de cabeza del recipiente con CO2 hasta que se sirvió el siguiente recipiente. 6. Este procedimiento se repitió para todos los recipientes, después se pusieron de nuevo en marcha los motores de funcionamiento y la bomba de infusión cuando finalizó el gaseado. El gaseado del último recipiente fue de una duración similar como para los otros recipientes. Tratamiento con acarbosa: La acarbosa se obtuvo en forma de comprimidos GlucobayTM (Bayer, AAH Pharmaceuticals). Cada comprimido contiene 100 mg de acarbosa. Los recipientes duplicados se trataron con 0,1, 10 y 100 mg/día de acarbosa añadiendo 1 comprimido a cada una de las bolsas de alimento para obtener 100 mg/recipiente/día. Las dosis inferiores se prepararon disolviendo/suspendiendo un comprimido en 10 ml de tampón (dando una solución de acarbosa de 10 mg/ml). Un ml de esta solución se añadió después a 9 ml de tampón, dando una solución de 1 mg/ml. Se añadió después un ml de cada solución a los contenidos de las dos bolsas de alimento, para dar 10 y 1 mg/recipiente/día. Finalmente se secó la acarbosa sobre el alimento dejando las bolsas a temperatura ambiente durante una noche. 55 60 65 Análisis: Se midieron las pérdidas de materia seca de las bolsas de nylon después de 48 horas de incubación secando los contenidos lavados de la bolsa en un horno durante 23 h a 65ºC. Se tomaron diariamente muestras de efluente (10 ml) y se almacenaron a -20ºC para el posterior análisis de AGV y lactato. El pH se registró automáticamente a intervalos de 17 minutos usando el equipo suministrado por Philip Harris Education. Se acopló un electrodo de combinación en cada recipiente a través de un puerto apretado por gas en la tapa. Se conectó cada electrodo a un SensorMeter, y se conectaron cuatro SensorMeter a un datalogger DL plus 128. Los valores de pH registrados se descargaron a un software Datadisk 32 en funcionamiento en PC (Philip Harris Education) y después se transfirieron a una hoja de cálculo para su análisis posterior. Los electrodos se retiraron de los recipientes (cuando las bolsas de alimento se cambiaron), se aclararon y se colocaron en un tampón convencional pH 7. Las lecturas fueron de 7,0 +/0,1 unidades durante el experimento. Se reequilibraron los electrodos a pH 7,0 antes de recolocarlos en los recipientes. Se midieron los AGV añadiendo 0,1 ml de una solución que contenía una mezcla de 25 g/100 ml de ácido metafosfórico y 1,2 g/100 ml de ácido crotónico a 1 ml del efluente. Se centrifugó esta mezcla durante 10 minutos a 12000 g y se transfirió una alícuota del sobrenadante a un vial de tomamuestras automático. Los AGV se resolvieron y se 27 ES 2 272 418 T3 5 10 cuantificaron en un cromatógrafo de gases Hewlett Packard 6890 series equipado con un tomamuestras automático y un detector de ionización de llama. Los ácidos se resolvieron en una columna SGE Ltd 25metre BP21 (0,33 mm D.E., 0,22 mm D.I. espesor de película 0,25 µm). Se usó nitrógeno como gas de vehículo con un caudal de 1,9 ml/min. La temperatura del horno era de 165ºC, y los puertos de inyección y los detectores se mantuvieron a 250ºC. Se calcularon las concentraciones usando ácido crotónico como patrón interno, y se equilibró el sistema usando una solución patrón que contenía ácido acético, propiónico, butírico, isovalérico y n-valérico. El ácido L-láctico se midió usando el kit Sigma 826, y se midió D-lactato usando el mismo procedimiento, excepto en que se reemplazó L-LDH con DLDH (Sigma Nº Catálogo L2011) y se reemplazó L-lactato por D-lactato (Sigma Nº Catálogo L0625). Los ensayos se realizaron en una placa de microtitulación de 96 pocillos y se midieron las absorbancias usando un lector de placas de microtitulación Anthos equipado con un filtro de 340 nm. Se equilibró el sistema preparando soluciones de D y Llactato de 0 a 100 mM. Programa 15 20 25 Día 0 3 5 10 18 22 Inocular Comenzar a recoger efluente Comenzar la medición diaria de pH Comenzar la dosificación con acarbosa (0,1, 10 ó 100 mg/ml/recipiente/día) a pares de recipientes. Continuar hasta el final del experimento. Añadir almidón adicional a todos los recipientes. Finalizar el experimento. Referencias para esta sección 30 Czerkawski, J.W. and Breckenridge, G. 1977. Design and development of a long-term rumen simulation technique (RUSITEC). British Journal of Nutrition, 38, 371-384. McDougall, E.I. 1948. Studies on ruminant saliva. 1. The composition and output of sheep’s saliva. Biochemical Journal, 43, 99-199. Resultados Rusitec: acarbosa 35 40 45 50 55 60 La comparación del periodo de tratamiento con el periodo de control precedente indica un cambio relacionado con la dosis en la producción de AGV de -16%, -10%, +3% y -3% en respuesta a las adiciones de 100, 10, 1 y 0 mg/recipiente/día de acarbosa. Hubo un cambio general de los productos de fermentación de acetato y propionato a butirato en todos los tratamientos entre los periodos de control y de tratamiento, provocando aumentos en la producción de butirato del 134%, 76%, 27% y 24% respectivamente para las dosis anteriores. No hubo acumulación de L-lactato en este estudio, confirmando que el modelo representaba acidosis crónica en vez de aguda. 65 28 ES 2 272 418 T3 Resultado RUSITEC usando Acarbosa Resumen experimental 5 Procedimiento de mantenimiento diario como se ha descrito previamente para Acarbosa. Vaca donante de fluido ruminal - alimentada con gránulos GH313 y paja de cebada. Alimento diario - 30 g de gránulos GH313 y 2,5 g de paja de cebada troceada. 10 Preparación del Tratamiento Acarbosa: 1 comprimido añadido a cada bolsa para obtener 100 mg/recipiente/día 15 20 Ejemplo 8: Ocho muestras x 57 mg previamente pesadas almacenadas en el frigorífico en 380 2.1. El día antes de que las bolsas de alimento se tuvieran que colocar en RUSITEC, se disolvió una muestra de 57 g en 2,28 ml de tampón (25 mg/ml). Se añadieron 0,21 ml de esta solución a 1,9 ml de tampón para obtener una solución de 2,5 mg/ml. Se añadió 1 ml de cada solución a una bolsa de alimento preparada para obtener 25 y 2,5 mg/recipiente/día y se secaron durante una noche a temperatura ambiente. El ejemplo 8 se usa como ejemplo comparativo. Programa Día 25 30 0 4 5 9 10 18 Inocular Comenzar a recoger efluente Comenzar la medición diaria de pH Revisar los datos, asignar los recipientes a los tratamientos Comenzar los tratamientos. Finalizar el experimento. 35 40 45 50 55 60 65 Resultados y Conclusiones: En este experimento el Ejemplo 8 0,02 mM dio un aumento de la media diaria de pH de 0,3 unidades en comparación con las 0,7 unidades para acarbosa 0,2 mM. Los tratamientos de 100 mg de acarbosa, 25 o 2,5 mg de Ejemplo 8 por recipiente por día, o ninguno (control), produjeron cambios en la producción total de AGV de -15%, -8%, -1% y -11% en comparación con el periodo de control precedente. Hubo una tendencia a la redistribución de los productos de fermentación, con una producción de butirato que aumenta en el periodo de tratamiento en comparación con el control. Los aumentos proporcionales fueron del 113%, 20%, 18% y 1% respectivamente. No hubo acumulación de L-lactato en este estudio, confirmando que el modelo representaba acidosis crónica en vez de aguda. 29 ES 2 272 418 T3 Exploración in vitro de ácido propiónico en el rumen Reactivos 5 10 Fluido Ruminal: Se alimentó una vaca seca de ocho años Guernsey, con una fístula ruminal (Bar Diamond Inc. P.O.Box.60. Bar Diamond Lane. Parma. Idaho. 83660-0060. Estados Unidos) dos veces al día con 1,4 kg de GH633 y 2,3 kg de heno. Se usó este animal como fuente de contenido ruminal, que se tomó a las 08:00 h (antes de la comida de la mañana). Se llevó el material al laboratorio en un matraz aislado precalentado, y después se filtró a través de cuatro capas de gasa de algodón en otro frasco precalentado, que se almacenó en un incubador a 40ºC hasta que se dosificó el fluido a los tubos de ensayo. Tampón: Disolver lo siguiente en agua desionizada. 15 Na2 HPO4 ·2H2 O KH2 PO4 NaH2 PO4 ·2H2 O g/l g/500 ml 9,88 3,40 1,11 4,94 1,70 0,55 20 Ajustar a pH 7,0 con NaOH 1 M. 25 Desoxigenar burbujeando con una mezcla libre de oxígeno (CO2 al 10%, H2 al 5% en nitrógeno) durante al menos 5 minutos. Mezcla de sustrato 68 g de almidón de trigo. Ex Sigma Cat. S-4126 30 17 g de α-celulosa. Ex Sigma Cat. C-6429. 15 g de harina de soja Tipo 1. Ex Sigma Cat. S-9633. 35 Mezclar bien. Inmediatamente antes de su uso, suspender en tampón a 200 mg/ml. 40 Solución de ácido metafosfórico/crotónico Se disolvió lo siguiente en agua desionizada. ácido metafosfórico al 25% (p/v). Ex. BDH Cat. 291904A más 45 ácido crotónico al 1,2% (p/v). Ex Sigma Cat. C-4630 Mezcla de AGV convencional 50 Se disolvió lo siguiente en 100 ml de agua desionizada. pm concentración nominal peso (mg) mM 55 60 65 Acetato sódico. Ex Sigma Cat. S-7670 Propionato sódico. Ex Sigma Cat. P-1880 Butirato sódico. Ex Sigma Cat. B-5887 ácido n-valérico. Ex Aldrich Cat. 24.037-0 ácido isovalérico. Ex Sigma Cat. I-7128 136,1 96,1 110,0 102,1 102,1 680 192 110 102 102 50 20 10 10 10 Se añadió 1 ml de solución de ácido metafosfórico/crotónico a 10 ml de mezcla de AGV y después se alicuotó en viales de tomamuestras automático de líquidos. 30 ES 2 272 418 T3 Procedimiento El ensayo se realizó en tubos de centrífuga Sorvall de 16 ml. 5 10 15 Se colocó un comprimido que contenía 100 mg de acarbosa en 10 ml de tampón y se agitó hasta que el comprimido se disolvió completamente, dando una solución de 10 mg/ml de acarbosa. Esta solución se diluyó con tampón en serie a 2, 0,4, 1,08, y 0,016 mg/ml. Se añadió un ml de estas soluciones para triplicar los tubos de ensayo (dando concentraciones de mezcla de ensayo finales de 1000, 200, 40, 8 y 1,6 µg/ml). Se prepararon los tubos de control remplazando la solución de acarbosa con tampón. Se añadió un ml de suspensión de sustrato a todos los tubos del ensayo, seguido por 3 ml de tampón calentado desgasificado y después por 5 ml de agua madre ruminal filtrada. Se acoplaron tapones Suba-Seal (Nº 29), y se redujo la presión de cabeza en los tubos pasando una aguja hipodérmica unida a una línea de vacío a través del tapón hasta que el contenido del tubo produjo espuma. Después se colocaron los tubos en un incubador durante 6 horas y se agitaron cada hora. La concentración de AGV previa a la incubación se determinó preparando tres tubos como para una incubación pero se añadió 1 ml de solución de ácido metafosfórico/crotónico inmediatamente después del agua madre ruminal. Estos tubos se almacenaron a 4ºC y se procesaron con los tubos después de la incubación. 20 La incubación se concluyó después de 6 horas retirando los tapones y añadiendo 1 ml de solución de ácido metafosfórico/crotónico. Después se centrifugaron los tubos durante 8 minutos a 18.000 g a 4ºC, y se almacenó una alícuota del sobrenadante en un vial de tomamuestras automático de líquidos hasta que se necesitó para el análisis de AGV por cromatografía de gases (como se describe en el protocolo de RUSITEC). 25 Cálculo de resultados 30 La producción de AGV total y propionato durante la incubación se determinó del siguiente modo. Primero, se calcularon las concentraciones de AGV total y ácido propiónico antes de la incubación como la media de los análisis de las muestras previamente a la incubación. Después, para cada muestra incubada, la concentración previa a la incubación restada a la concentración después de la incubación dio la producción durante la incubación. También se calculó la proporción molar de ácido propiónico en los AGV totales producidos durante la incubación. 35 Los valores de AGV total y % de ácido propiónico se promediaron para los tubos replicados, y las valores de AGV total y % de ácido propiónico medios de control se normalizaron como el 100%, después se expresó el cambio producido por los tratamientos del ensayo con relación a este valor. acarbosa 40 *Dosis AGV Total % Propionato 1000 50 88 200 58 81 40 63 74 8 72 74 1,6 92 94 0,32 96 97 0 100 100 µg/ml 45 50 55 Ensayo in vivo en ganado vacuno fistulizado 60 65 Objetivo: Determinar el efecto del agente que se tiene que ensayar, en este caso acarbosa, sobre la acidosis del rumen crónica inducida en ganado vacuno fistulizado. Se indujo un perfil de pH de rumen representativo de acidosis crónica aumentando por etapas el nivel de alimento concentrado de una dieta especificada y por una reducción del forraje ofrecido. Esto estuvo seguido por un tratamiento de cada animal con acarbosa, administrado a través de una fístula ruminal permanente para establecer su capacidad de normalizar el pH ruminal. Animales de experimentación: Seis novillos fistulizados Hereford x Friesian, que pesaban 170-230 kg (suministrados por Cwmnant Calves Ltd. Cwmanat. Tregaron, Ceredigion). 31 ES 2 272 418 T3 Tratamiento: Glucobay® 100. Acarbosa, 100 mg por comprimido. 5 Manejo: El ganado se alimentó con gránulos de GH651 para ganado vacuno con alto en contenido de cereales (cantidad variable) con paja de cebada (cantidad variable) dividido en dos comidas iguales, administradas a aproximadamente las 08:00 h y 14:30 h cada día. Se registraron los tiempos exactos de alimentación. Había agua disponible ad libitum. El ganado se alojó individualmente en cubículos (9 metros cuadrados por cubículo) en un pabellón con ambiente controlado a 16ºC. Diseño 10 15 20 25 30 Grupo Tratamiento Forma Vía Acarbosa (g/m) Volumen (ml) Nº de Animales 1 Acarbosa Sol. Ac. A través de fístula 4,0 100 6 Mientras se inducía la acidosis crónica, se tomaron mediciones manuales de pH aproximadamente 5 y 8 horas después de la alimentación de la mañana. Las muestras de fluido ruminal se tomaron para el análisis de AGV y lactato. Una vez que se generó un perfil de pH adecuado (véase la sección de procedimiento), a cada novillo se le equipó con un arnés para transportar un dispositivo automatizado de muestreo y registro de pH (Philip Harris Plus 128 Data logger. +p.H. First Sense Recorder). Se registraron los valores de pH ruminales de forma automática cada 17 minutos durante un máximo de 21 días. Se tomaron muestras de fluido ruminal (10 ml) dos veces al día para la medición de los niveles de AGV, proporciones molares y niveles de lactato. Éstas se recogieron (por retirada manual de una muestra de contenido ruminal con un cazo pequeño de acero inoxidable, filtración y transferencia a un vial de polipropileno de 10 ml) justo antes de que se añadiera la acarbosa al rumen en ambos momentos de dosificación. Las sondas de pH se retiraron para su limpieza y reequilibrado inmediatamente antes de la alimentación de la mañana. Resultados: Se usaron las curvas de pH medio diario para calcular el periodo durante el que el pH ruminal estaba por debajo de 5,5, y era por lo tanto indicativo de acidosis crónica. 35 40 45 50 55 Se tomaron muestras de fluido ruminal a las 13:00 y 16:00, es decir, antes y después de la alimentación de la tarde. Hubo una pequeña diferencia en las concentraciones de AGV totales en las muestras de las 13:00, pero las concentraciones de AGV en las muestras de las 14:00 disminuyeron durante el periodo de tratamiento. Esto fue coherente con los perfiles de pH. En todos los momentos de muestreo el porcentaje de propionato fue menor durante el periodo de tratamiento. No hubo acumulación de ácido láctico en las muestras de fluido ruminal, indicando que los animales no experimentaron acidosis aguda durante el experimento. Eficacia de la acarbosa en ganado lechero en lactación 60 El estudio midió el efecto de la acarbosa en el pH ruminal, producción de leche y composición de la leche en vacas en lactación en las que se había inducido acidosis crónica ofreciendo una dieta altamente fermentable. El estudio incluyó la medición de la velocidad de adaptación a la introducción y retirada de acarbosa. 65 Los animales experimentales eran seis vacas multíparas en lactación Holstein/Friesian con entre 5 y 11 años de edad y 500-700 kg, con cánulas ruminales permanentes. Los animales comenzaron el experimento al principio de la lactación, pero no antes del pico de la lactación, para permitir una sensibilidad experimental mayor. Las principales mediciones en este estudio fueron el pH en el saco ventral del rumen, la producción de leche y la composición de la leche. 32 ES 2 272 418 T3 Las prácticas de manejo cumplían el UK Home Office Code of practice for the Housing and Care of Animals used in Scientific Procedures (1989). 5 Diseño: Los animales inscritos en el estudio recibieron el objeto de ensayo durante 21 días consecutivos desde los momentos puntuales de inicio descritos a continuación. 10 15 20 Procedimiento 25 30 35 40 Procedimientos de Reducción del Enmascaramiento/Sesgo: Se inscribieron seis vacas multíparas en lactación Holstein/Friesian en el estudio en el Día -1. Los animales se emparejaron basándose en el momento del parto (se juntaron las vacas con fechas similares). Dentro de cada pareja, un animal recibió T01 y el otro T02. El tratamiento se asignó aleatoriamente. Cuando fue posible, la aleatorización se hizo de forma que las ingestas de alimento medias por grupo de tratamiento fueran similares. Procedimientos: A aproximadamente dos semanas antes del Día 0, ocho animales comenzaron un periodo de alimentación preliminar diseñado para identificar un régimen de alimentación que indujera niveles de pH acidóticos en el rumen. Cada vaca se mantuvo en un box de establo a partir de este punto hasta la finalización del estudio. Se alimentó con ración de control totalmente mezclada (TMR) y cuando fue necesario se ajustaron la cantidad y la composición para establecer un pH ruminal mínimo de 5,0-5,5. Se calculó la ingesta media durante los 5 últimos días del periodo preliminar y se ofreció esta cantidad media a cada animal durante la exposición. Se retiró el alimento no consumido y se pesó en una base diaria y antes de la alimentación de la mañana. Se suplementó la TMR con 0,5 kg/día de trigo molido sin aditivo (Control) o conteniendo el objeto de ensayo (acarbosa a 15 g por día), y se ofreció de forma separada en dos mitades durante la alimentación de la mañana y de la tarde. También se usó un sistema de distribución de agua automático para ofrecer agua ad libitum. Composición de TMR 45 50 55 Ingrediente % en la ración de MS total Ensilado de pasto Ensilado de maíz Trigo triturado Harina de cebada Harina de colza Harina de soja Pulpa de remolacha azucarera con melazas Alimento de trigo Regumaize Harina de pescado Minerales 10,0 30,0 16,7 9,2 4,1 6,1 9,2 8,2 4,0 1,0 1,5 Total 100,0 60 65 Desde el comienzo del estudio se ordeñaron los animales dos veces al día mediante un sistema de tuberías a aproximadamente las 06:30 h y 16:00 h. Se registro de forma manual el peso de la producción de leche y después se transcribió a un archivo de leche diaria electrónico. En el Día -1 se examinó cada animal físicamente por un veterinario cirujano para asegurar la normalidad física y clínica. Los animales satisficieron todos los criterios de inclusión y ninguno de los criterios de exclusión. 33 ES 2 272 418 T3 5 10 En el Día 0, comenzó el régimen de alimentación con el objeto del ensayo descrito en DISEÑO. Tres animales siguieron el diseño Control/Tratamiento/Control (A/B/A) en tres periodos experimentales consecutivos mientras que un segundo grupo de tres animales siguió la secuencia de tratamiento opuesta (B/A/B). Los periodos de alimentación experimental duraron 3 semanas, que constaban de 2 semanas de adaptación y una semana final para mediciones detalladas. Los animales se alimentaron dos veces al día a intervalos irregulares a aproximadamente las 08:00 h y 15:00 h (es decir, intervalos de 7 y 17 horas) para permitir que el muestreo del rumen para la medición de pH se concentrara durante el periodo de pH mínimo (estimado en 2-4 h después de la segunda alimentación). Se le ofreció a cada animal 0,5 kg/día de suplemento de harina de trigo a la TMR dividido de forma igual en las dos alimentaciones y sin contener ningún aditivo (Suplemento A) o conteniendo el objeto de ensayo (Suplemento B). Cada animal completó el estudio después de la medición final de pH del tercer periodo experimental en el Día 62. 15 20 25 30 35 Mediciones: Se usó un equipo de medición de pH automático (Philip Harris Plus 128 Data logger + pH First Sense Recorder) para registrar los valores de pH ruminal cada 17 minutos. Se congelaron una muestra de 10-15 ml de fluido ruminal tomada a las 07:30 h y dos muestras tomadas a pH aproximadamente mínimo (aproximadamente a las 18:00 h y 20:00 h) inmediatamente a -20ºC para análisis posteriores. El peso fresco de TMR ofrecida y rehusada se registró diariamente para cada animal. Durante las semanas sin mediciones (es decir, periodo preliminar y semanas 1 y 2 de adaptación en cada periodo experimental), se determinaron la materia seca (MS) de los principales componentes del forraje (ensilados de pasto y maíz) aproximadamente cada semana (o más frecuentemente si parecía necesario por la evaluación visual del ensilado). Durante las semanas de medición (es decir, la semana 3 en cada periodo experimental) se midió la MS de la TMR diariamente durante los últimos 5 días mientras se preparó una masa de cada uno de los componentes individuales de la TMR (ensilado de pasto, ensilado de maíz, mezcla de concentrado, harina de trigo) de los mismos 5 días para análisis de dieta posterior (es decir, una muestra de cada alimentación principal por periodo). Solamente se tomó una muestra de Regumaize durante el estudio ya que es la única masa de líquido. Los alimentos rehusados se muestrearon para la determinación de MS durante los últimos 5 días de cada periodo experimental. Se tomaron muestras únicas de 20 ml de leche para la grasa, proteínas y lactosa en los ordeños am y pm en 3 días alternos en cada semana de adaptación. Durante la semana de medición se tomaron muestras de leche en los últimos 5 días consecutivos. Cada muestra de leche se analizó por separado. Además se tomó otra muestra de 20 ml de leche en cada ocasión que se muestreó leche durante las semanas de medición y se congeló inmediatamente a -20ºC para posibles análisis posteriores. Los datos de producción de leche diaria se generaron totalizando los ordeños de la mañana y de la tarde en una fecha determinada. Se midió el peso vivo de cada animal en cada periodo experimental. Resultados: Se calculó el pH ruminal como el tiempo que estaba por debajo de pH 5,5 (es decir en un estado de acidosis crónica) para los periodos de tratamiento y de control. El tiempo medio por debajo de 5,5 fue de 4,3 horas para los periodos de control y 3,4 horas para los periodos de tratamiento. La grasa en leche aumentó drásticamente en animales tratados, de una media de 1033 gramos por día a 1281 gramos por día. La proporción de grasa en la leche también aumentó, de 32,8 g/l a 46,1 g/l. 40 Modelo de acidosis aguda: evaluación de acarbosa Diseño experimental 45 50 55 60 65 34 ES 2 272 418 T3 5 10 15 20 25 30 35 Procedimientos: Se alojaron en grupo diez vacas secas y novillas Holstein (peso inicial 740 ± 27 (SE) kg, intervalo 606-807 kg) durante el periodo previo al tratamiento y se alojaron individualmente durante el periodo experimental. Los animales se trasladaron a una manga de contención durante la recogida de muestras, tratamiento y primera exposición. Posteriormente se muestrearon y dosificaron en sus cubículos individuales. Se les ofreció a los animales aproximadamente 5 kg de heno de alfalfa, 16 kg de ensilado, 6 kg de concentrado y 5 kg de paja diariamente en una ración mezclada total ofrecida en dos tomas (60:40 concentrado:dieta de forraje). Se mantuvieron en cama de paja solamente durante el periodo previo al tratamiento. Se proporcionó agua ad libitum. Los animales se adaptaron a la ración de lactación durante al menos 10 días antes de que se administraran los tratamientos. De un grupo de 6 vacas secas y 5 novillas que no estaban en lactación, se seleccionaron diez basándose en exposición previa a la exposición y salud general. Los animales se emparejaron por peso corporal y se asignaron aleatoriamente a grupos de control y de tratamiento con acarbosa dentro de cada pareja, asegurando la distribución similar de las novillas y las vacas. En los días 0-6 del tratamiento, los animales recibieron 1,07 mg acarbosa/kg disueltos en 200 ml de agua a través de la cánula ruminal justo antes de las alimentaciones AM (07:30) y PM (16:00). Los animales del tratamiento 1 recibieron solamente una cantidad equivalente de agua. En los días 7 y 8, se le administró a cada animal un compuesto de exposición a través de la cánula. Cuando el pH alcanzó ∼4,5 y hubo evidencias de producción de L-lactato, se consideró que se había inducido la acidosis aguda. Cuando un animal experimentó acidosis aguda por estos criterios, se retiraron los contenidos ruminales y se inoculó el rumen con contenido ruminal de un animal donante. Los animales se pesaron en los días -1 y 5 para calcular la dosificación de la acarbosa y las cantidades del compuesto de exposición. Para medir el pH de fluido ruminal se equipó con un arnés a los animales para sostener un sistema de registro de datos de pH automático. El pH del rumen se registró cada 10 minutos durante los días de la exposición hasta que una animal experimentó acidosis aguda. Se tomaron muestras de fluido ruminal (∼50 ml) desde la cánula ruminal a través de un tubo de muestras filtrado). Las horas de muestreo eran justo antes de cada exposición y 3, 6, 8, 10 y 12 horas después de cada exposición. Se midió el pH inmediatamente. Se prepararon muestras para el análisis de AGV y lactato añadiendo 10 ml de fluido ruminal a 1 ml de una solución que contenía una mezcla de 25 g/100 ml de ácido metafosfórico y 1,2 g/100 ml de ácido crotónico justo después de cada recogida. En algunos casos se filtró la muestra a través de gasa antes de la medición del pH y el tratamiento ácido. Esta mezcla se centrifugó durante 10 min a 12000 g. Se retiró una alícuota del sobrenadante para el análisis inmediato de lactato, una se congeló para un posterior análisis de lactato usando el kit Sigma 826. Una tercera alícuota se transfirió a un vial de tomamuestras automático para el análisis de AGV posterior. Se realizó una determinación inicial de L-lactato durante el estudio para establecer el estado acidótico usando el kit Sigma 735. Posteriormente se volvieron a medir el D y L-lactato para el análisis estadístico como se describe a continuación. Los AGV se midieron en un cromatógrafo de gases Hewlett Packard 6890 series equipado con un tomamuestras automático y un detector de ionización de llama. Los ácidos se resolvieron en una columna SGE Ltd. 25metre BP21 (0,33 mm D.E., 0,22 mm D.I., espesor de película 0,25 µm). Se usó nitrógeno como gas de vehículo con un caudal de 1,9 ml/min. La temperatura del horno era de 165ºC, y los puertos de inyección y los detectores se mantuvieron a 250ºC. Se calcularon las concentraciones usando ácido crotónico como patrón interno, y se equilibró el sistema usando una solución patrón que contenía ácido acético, propiónico, butírico, isovalérico y n-valérico. 40 Resultados 45 pH: Para la exposición se presentan los datos de pH como un cálculo del tiempo durante el que el pH ruminal estaba por debajo de un intervalo de límites. La primera exposición no indujo acidosis aguda, pero después de la segunda exposición, cuatro de las vacas de control tenían valores de pH ruminal por debajo de 4,5. El corto periodo por debajo de pH 4,5 fue debido a su retirada del estudio en ese punto. El pH ruminal permaneció por encima de 5,0 en todo el ganado tratado, indicando que la acarbosa evitaba la acidosis aguda que sigue a la exposición a carbohidratos. El efecto del tratamiento de reducir el número de vacas que llegaron a ser acidóticas se muestra como significativo (P 0,5) por un simple análisis de tabla de contingencia. 50 55 Lactatos: No se detectó lactato después de la primera exposición, pero los niveles aumentaron a > 50 mM para cuatro o cinco controles a las 10 horas de la exposición en la segunda y se quedaron a cero en todos los animales tratados con acarbosa. El quinto control, que tenía un pH de -5,0, tenía un nivel máximo de lactato de 6 mM. Se resumen en la tabla los D-lactatos, L-lactatos y lactatos totales medios de la segunda exposición. Todos los lactatos fueron mayores en el grupo control que en el grupo de tratamiento y hubo una tendencia del tratamiento de interacción con el tiempo (las diferencias aumentaron en el tiempo). 60 65 35 ES 2 272 418 T3 Media de Grupo de D-Lactato, L-lactato y Lactatos Totales en Muestras de las Exposiciones (mM) del Día 2 5 10 15 20 25 30 Respuestas de pH de Animales Individuales a una Segunda Exposición de Carbohidratos 35 40 45 50 55 60 Análisis/conclusiones: Un tratamiento con acarbosa dos veces al día redujo las respuestas de pH a una alta carga de carbohidratos y bloqueó la producción de L-lactato en respuesta a la carga. Las respuestas de pH de la primera exposición fueron similares para los dos grupos; fue la segunda exposición la que permitió la distinción. Esto es similar a las observaciones de Cowe y col. (J. Anim. Sci. 77:2259, 1999) en las que la acidosis aguda se induce después de múltiples exposiciones. 65 36 ES 2 272 418 T3 REIVINDICACIONES 5 1. El uso de un inhibidor eficaz de la alfa-amilasa y/o alfa-glucosidasa bacteriana del rumen en la preparación de un medicamento para el tratamiento curativo, paliativo y profiláctico de la acidosis del rumen y las afecciones secundarias de la acidosis del rumen, en el que el inhibidor se selecciona entre: 10 15 y Trestatinas de fórmula 20 25 30 en la que N es 1, 2 ó 3 y cuando N = 2 representa Trestatina A, N = 1 representa Trestatina B, y N = 3 representa Trestatina C, 35 40 y en el que la acidosis del rumen o la afección secundaria de la acidosis ruminal se selecciona entre: acidosis del rumen crónica, acidosis del rumen aguda, laminitis, laminitis crónica, diarrea intermitente, apetito reducido e ingesta de alimento cíclica, una elevada tasa de sacrificio del rebaño por problemas de salud mal definidos, mal estado corporal, abscesos sin causas obvias, ulceración plantar, lesiones por enfermedad de la línea blanca, hemorragias plantares, pezuñas malogradas, cojera, abscesos hepáticos, enfermedades respiratorias, índices de fertilidad reducidos, ganancia de peso reducida en ganado de producción de carne, conversión de alimento reducida en ganado de producción de carne y producción y calidad de la leche disminuidas en ganado lechero. 2. El uso de acuerdo con la reivindicación 1, en el que el inhibidor se selecciona entre acarbosa, Trestatina A, y Trestatina C. 45 3. El uso de acuerdo con la reivindicación 2, en el que el inhibidor se selecciona entre acarbosa y Trestatina C. 4. El uso de acuerdo con la reivindicación 3, en el que el inhibidor es acarbosa. 50 5. El uso de acuerdo con cualquiera de las reivindicaciones 1 a 4 en el que el medicamento es para el tratamiento de acidosis del rumen crónica. 6. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4 en el que el medicamento es para el tratamiento de acidosis del rumen aguda. 55 60 65 7. El uso de acuerdo con cualquiera de las reivindicaciones 1 a 4 en el que, cuando la afección a tratar es calidad reducida de la leche, la mejora de la calidad de la leche se manifiesta como un aumento en el contenido de grasas de la leche. 8. El uso de acuerdo con cualquiera de las reivindicaciones 1 a 4, en el que el inhibidor de la alfa-amilasa y/o alfaglucosidasa bacteriana del rumen se usa en combinación con uno o más agentes usados en el tratamiento (incluyendo la profilaxis) de la enfermedad. 9. El uso de acuerdo con la reivindicación 8, en el que el inhibidor de la alfa-amilasa y/o alfa-glucosidasa bacteriana del rumen se usa en combinación con uno o más agentes seleccionados entre: tampones, antibióticos, antiparasitarios, antihistaminas, antifúngicos, antibacterianos, anti-inflamatorios, suplementos dietéticos y emolientes. 37 ES 2 272 418 T3 10. El uso de un ensayo como procedimiento de exploración en la identificación de un inhibidor de una alfaglucosidasa bacteriana del rumen adecuada para el tratamiento de acidosis en un rumiante, en el que el ensayo se caracteriza porque se incuba un compuesto con fluido ruminal y maltosa y se mide la conversión de la maltosa en glucosa por un medio colorimétrico. 5 10 15 20 25 30 35 40 45 50 55 60 65 38