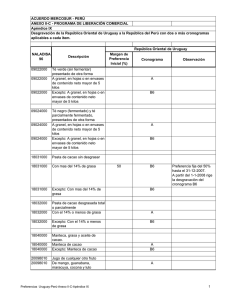
descargar
Anuncio

INSTITUTO POLITECNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS DEPARTAMENTO DE GRADUADOS E INVESTIGACIÓN EN ALIMENTOS “CARACTERIZACIÓN DE GRASAS ALTERNATIVAS DE LA MANTECA DE CACAO” T E S I S QUE PARA OBTENER EL GRADO DE MAESTRO EN CIENCIAS CON ESPECIALIDAD EN A L I M E N T O S P R E S E N T A: I.B.Q. RAQUEL CUAMBA GAONA DIRECTORES DE TESIS: M. en C. YOJA GALLARDO NAVARRO M. en C. HAYDEÉ HERNÁNDEZ UNZÓN MEXICO D.F. 2008 El presente trabajo se realizó en el laboratorio de tecnología de alimentos de la sección de graduados e investigación en alimentos, en las centrales de espectroscopia y de microscopía pertenecientes a la Escuela Nacional de Ciencias Biológicas del IPN. Así como en el laboratorio de rayos X de la Escuela Superior de Físico Matemáticas del IPN. También se realizó parte de este trabajo en el Instituto de Investigaciones para la Industria Alimenticia de la Habana Cuba. La presente tesis estuvo bajo la dirección de la M.en C. Yoja Gallardo Navarro y de la M. en C. Haydeé Hernández Unzón, con financiamiento de los proyectos “Caracterización bioquímica y fisicoquímica de grasas y aceites benéficos a la salud y su aplicación en alimentos”, con número de registro 20070255 y “Utilización de Okara deshidratada en el desarrollo de alimentos enriquecidos con proteína, bajos en grasa y con aporte de fibra”, con número de registro 20080494, así como con el apoyo de CONACYT y PIFI. DEDICATORIA A Dios que me concede día a día bendiciones y pruebas que me permiten reconocer su grandeza, paciencia y amor. A la familia que Dios me dio. AGRADECIMIENTOS A la M en C Yoja Gallardo Navarro y a la M en C Haydée Hernández Unzón directoras de este proyecto, así como a la M. en C. Teresa Cruz y Victoria, Dra. Irasema Anaya Sosa, Dra. Yadira Espinosa Rivera y a la M. en C. Laura Almazán, sinodales en este trabajo, por sus consejos y sugerencias, los cuales contribuyeron a mejorar y enriquecer esta tesis. A los profesores e investigadores que apoyaron en los diversos análisis realizados en el presente trabajo: Dra. Gabriela Gómez Gasca y Dr. Jesús Palacios Gómez (Laboratorio de difracción de rayos X de la ESFM-IPN) Dr. Ramón Arana Errasquín (ENCB-IPN) Al personal que labora en las centrales de microscopía y espectroscopia de la ENCB-IPN. Al Instituto de Investigaciones para la Industria Alimenticia de la Habana Cuba, de manera especial a la Dra. Ma. Cristina Jorge, a Celeste e Ivannia, por compartir sus conocimientos sobre la elaboración de chocolate así como por su apoyo en la parte de evaluación sensoria. A la Ing. Pilar Paredes de la empresa DCMX Cocoa, por obsequiar la manteca de cacao mexicana. Así como a la empresa AarhusKarlshamn México S.A. de C.V. por facilitar las muestras de grasa, de manera especial a la Ing. Rosa Ledesma por su apoyo en la realización de algunos análisis y al Ing. Joaquín Barragán por la asesoría técnica en grasas y aceites. A los compañeros y amigos que compartieron conmigo su tiempo y me apoyaron de diversas maneras (Ana, Raque, Lupita, Mary, Liz, Lalo, y Marta) Mi más sincero agradecimiento a mi familia y a mis tías Josefina y Sofía, por todo el apoyó que me dieron y me siguen dando. Puchi porque a todos nos animas, gracias. CONTENIDO Página ÍNDICE DE CUADROS v ÍNDICE DE FIGURAS vii RESUMEN x SUMMARY xi ÍNDICE INTRODUCCION 1 I ANTECEDENTES 3 1.1 3 Lípidos 1.1.1 Definiciones 3 1.1.2 Clasificaciones 4 1.1.3 Grasas y Aceites 5 1.1.4 Composición de Grasas y Aceites 6 1.1.4.1 Acilgliceroles 6 1.1.4.2 Ácidos Grasos 7 1.1.5 Cristalización y Polimorfismo en Grasas y Aceites 10 1.1.6 Métodos Empleados en el Estudio de la Cristalización de Grasas y 15 Aceites 1.1.6.1 Resonancia Magnética Nuclear 15 1.1.6.2 Microscopía con Luz Polarizada 17 1.1.6.3 Calorimetría Diferencial de Barrido 17 1.1.6.4 Difracción de Rayos X 18 1.1.7 Proceso Industrial para la Fabricación de Grasas y Aceites 20 1.1.8 Ácidos Grasos Trans 21 1.1.8.1 Efectos de los Ácidos Grasos Trans en la Salud 23 1.1.8.2 Legislación y Regulación de los Ácidos Grasos Trans 24 i 1.2 Historia del Chocolate 1.2.1 Características de la Manteca de Cacao 1.3 Grasas Alternativas de la Manteca de Cacao 1.3.1 Producción y Consumo de las Grasas Alternativas 26 28 29 33 de la Manteca de Cacao en México. 1.3.2 Regulación del Uso de Grasas Alternativas de la Manteca de Cacao 1.4 Producción de Chocolate y Chocolate Análogo 1.4.1Proceso de Elaboración de Chocolate 1.4.2 Tecnología para la Utilización de las Grasas Alternativas de la 35 37 38 41 Manteca de Cacao en la Elaboración de Chocolate Análogo 1.5 Evaluación Sensorial 42 1.6 JUSTIFICACIÓN 46 II OBJETIVOS 47 2.1 Objetivo General 47 2.2 Objetivos Específicos 47 III MATERIALES Y MÉTODOS 48 3.1 Materias Primas 48 3.2 Reactivos 49 3.3 Materiales de Laboratorio 50 3.4 Equipos 50 3.5 Métodos Analíticos 51 3.5.1 Ácidos Grasos Libres 51 3.5.2 Valor de Peróxido 53 3.5.3 Color 55 3.5.4 Humedad y Materia Volátil 56 3.5.5 Impurezas Indeseables, Olor 57 ii 3.5.6 Índice de Yodo 59 3.5.7 Punto de Fusión 60 3.5.8 Índice de Saponificación 61 3.5.9 Determinación del Perfil de Ácidos Grasos y del Contenido de 61 Ácidos Grasos Trans 3.5.10 Contenido de Sólidos Grasos 63 3.5.11 Estudio de Cristalización, Fusión y Polimorfismo 65 3.5.12 Elaboración de Chocolate 67 3.5.13 Atemperado de Chocolate 68 3.5.14 Determinación de Color en los Productos 68 3.5.15 Determinación de aw 68 3.5.16 Análisis Sensorial 68 3.6 Desarrollo Experimental 3.6.1 Caracterización Fisicoquímica de las Grasas Alternativas de la 70 71 Manteca de Cacao 3.6.2 Caracterización del Perfil de Ácidos Grasos de las Grasas 71 Alternativas de la Manteca de Cacao y Cuantificación de Ácidos Grasos Trans 3.6.3 Caracterización de las Propiedades Térmicas y de Cristalización de 72 las Mantecas Alternativas de la Manteca de Cacao 3.6.4 Elaboración de Chocolate Análogo, Determinación de Condiciones 73 de Atemperado y Elaboración de Tabletas 3.6.5 Evaluación de Propiedades Funcionales en las Tabletas 74 3.6.6 Determinación aw en Tabletas de Chocolate Análogo. 75 3.6.7 Evaluación Sensorial de las Tabletas 75 IV RESULTADOS 4.1 Caracterización Fisicoquímica de las Grasas Alternativas de la 77 77 Manteca de Cacao 4.1.1 Ácidos Grasos Libres y Valor de Peróxido 77 4.1.2 Color, Humedad - Materia Volátil, Olor 78 4.1.3 Índice de Yodo, Punto de Fusión e Índice de Saponificación 81 iii 4.2 Caracterización del Perfil de Ácidos Grasos y Cuantificación de Ácidos 84 Grasos Trans 4.3 Caracterización de las Propiedades Térmicas y de Cristalización 4.3.1 Contenido de Sólidos Grasos por Resonancia Magnética 94 94 Nuclear 4.3.2 Cristalización, Estudio con Microscopio - Luz Polarizada 97 4.3.3 Cristalización y Fusión, por Calorimetría Diferencial de Barrido 102 4.3.4 Polimorfismo por Difracción de Rayos X 109 4.4 Elaboración y Evaluación de Masas de Chocolate Análogo 114 4.4.1 Masas para la Elaboración de Chocolate Análogo 114 4.4.2 Curvas de Atemperado 114 4.5 Producción de Tabletas de Chocolate Análogo 117 4.5.1 Evaluación Tecnológica de las Tabletas de Chocolate Análogo 120 4.5.2 Color y aw en las Tabletas de Chocolate Análogo 121 4.6 Evaluación Sensorial de Tabletas de Chocolate Análogo 123 V CONCLUSIONES 130 VI BIBLIOGRAFÍA 132 iv INDICE DE CUADROS Cuadro Titulo Página 1 Clasificación de los lípidos con base en su estructura 4 2 Principales aceites vegetales y cultivan 5 3 Ácidos grasos de mayor importancia en grasas y aceites 7 4 Punto de fusión (°C) de algunos ácidos grasos 9 5 Tendencia de cristalización en algunas grasas y aceites 14 6 Recomendaciones de la ingesta de grasa diaria (Organismo de Nutrición Nórdico 1996) 25 7 Polimorfismo y puntos de fusión en la manteca de cacao 28 8 Polimorfismo de la manteca de cacao de acuerdo a los espacios cortos determinados por DRX. 29 9 Contenido de triacilgliceroles palmítico-oleico-palmítico, palmítico-oleico-esteárico y esteárico-oleico-esteárico en algunas grasas vegetales 31 10 Precios indicativos de la manteca de cacao y grasas alternativas de la manteca de cacao 35 11 Reactivos empleados en el análisis fisicoquímico de grasas y aceites. 49 12 Peso de muestra en relación al índice de yodo en aceites ó grasas 59 13 Relación de peso de muestra, solución de hidróxido de sodio y trifloruro de boro en metanol para la metilación de ácidos grasos. 62 14 Condiciones de operación para análisis cromatográfico en función de la fase estacionaria de la columna. 63 15 Formulaciones para elaborar chocolate análogo. 73 16 Codificación de las tabletas de chocolate análogo para su evaluación sensorial 75 17 Cantidad de ácidos grasos libres y de peróxidos en manteca de cacao y grasas alternativas de la manteca de cacao 78 áreas geográficas donde se v 18 Determinación de color y humedad en manteca de cacao y grasas alternativas de la manteca de cacao 79 19 Evaluación del olor en la manteca de cacao y en las grasas alternativas de la manteca de cacao. Resultados de las determinaciones de índice de yodo, punto de fusión e índice de saponificación en manteca de cacao y grasas alternativas de la manteca de cacao. 80 21 Perfil de ácidos grasos y contenido de ácidos grasos trans obtenido en manteca de cacao mexicana, cubana y grasas alternativas de la manteca de cacao. 83 22 Perfil de ácidos grasos en manteca de cacao y en algunas grasas o aceites empleados como alternativas de la manteca de cacao. 84 23 Compatibilidad entre las grasas alternativas de la manteca y la manteca de cacao 87 24 Tiempos de retención de los ácidos grasos detectados mediante cromatografía de gases en las manteca de cacao y grasas alternativas de la manteca de cacao 88 25 Contenido de sólidos grasos de las mantecas de cacao y grasas alternativas de la manteca de cacao. 95 26 Cristalización de la manteca de cacao y grasas alternativas de la manteca de cacao a diferentes tiempos. 98 27 Temperaturas de fusión y la correspondiente forma cristalina determinada por calorimetría diferencial de barrido 102 28 Análisis comparativo del punto de fusión en mantecas de cacao y en grasas alternativas de la manteca de cacao, obtenidos por calorimetría diferencial de barrido y método capilar AOCS 109 29 Resultados del análisis por difracción de rayos X. Espacios cortos y la correspondiente forma del cristal 113 Condiciones de preparación y moldeo de masas de chocolate análogo 114 31 Condiciones de enfriamiento para la solidificación de las tabletas de chocolate análogo 118 32 Evaluación de aplicación y funcionalidad de las tabletas elaboradas con manteca de cacao y tabletas con grasas alternativas de la manteca de cacao. Valores de color y aw en tabletas de chocolate análogo 121 20 30 33 81 122 vi ÍNDICE DE FIGURAS Figura Titulo Página 1 Molécula de triestearina 6 2 Ácidos grasos con diferente grado de saturación 8 3 Configuración cis y trans en isómeros geométricos. 9 4 Bosquejo de la jerarquía en la estructura que se presenta en la grasa cristalizada 10 5 Principales formas polimórficas en grasas 12 6 Arreglo de los triacilgliceroles que se presenta en cada una de las sub células de las formas cristalinas más comunes 13 7 Vías de cristalización de acuerdo al polimorfismo en grasas 14 8 Relación entre el contenido de sólidos grasos y los atributos sensoriales 16 9 Geometría de la refracción de rayos X, de los diferentes planos un cristal de acuerdo a la ley de Bragg 19 10 Cambio que ocurre en el ácido graso durante la hidrogenación 22 11 Ácido graso trans y ácido graso saturado 23 12 Consumo de chocolate por persona en Europa, Asia, Sudamérica y Estados Unidos de Norteamérica (kilogramos por año) 27 13 Grasas alternativas de la manteca de cacao 32 14 Diagrama del proceso de atemperado del chocolate 40 15 Desarrollo experimental para el análisis fisicoquímico de las grasas alterativas de la manteca de cacao, así como la elaboración de chocolate análogo y la evaluación tecnológica y sensorial del mismo. 70 16 Diagrama general para la elaboración de chocolate 74 17 Hoja de evaluación de atributos en tabletas de chocolate análogo. 76 vii 18 Principales ácidos grasos en manteca de cacao de origen mexicano, origen cubano y grasas alternativas de la manteca de cacao. 86 19 Perfil cromatográfico de la manteca de cacao de origen mexicano 89 20 Perfil cromatográfico de la manteca de cacao de origen cubano 90 21 Perfil cromatográfico de la grasa equivalente de la manteca de cacao 91 22 Perfil cromatográfico de la grasa reemplazante de la manteca de cacao 92 23 Perfil cromatográfico de la grasa sustituta de la manteca de cacao 93 24 Contenido de sólidos grasos de la manteca de cacao y grasas alternativas. 96 25 Imagen comparativa de la cristalización de la manteca de cacao usando Microscopio óptico con LP 40x: Tiempo 0 (imagen izquierda), tiempo 7 h. (imagen central) y tiempo 24 h (imagen derecha) a temperatura de 24 °C. 98 26 Imagen comparativa de la cristalización en grasas alternativas de la manteca de cacao usando MLP 40x a diferentes tiempos (de arriba hacia abajo: 0,1,2,3 y 4 minutos) a temperatura de 24 °C. 100 27 Imagen comparativa de la cristalización en grasas alternativas de la manteca de cacao usando MLP 40x, a diferentes tiempos (de arriba hacia abajo: 0,5,10,15 y 20 minutos) a temperatura de 24 °C. 101 28 Termograma de la manteca de cacao de origen mexicano. Análisis dinámico. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C 103 29 Termograma de la manteca de cacao de origen cubano. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C 104 30 Termograma de la grasa equivalente de la manteca de cacao. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C 105 31 Termograma de la grasa reemplazante de la manteca de cacao. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C 106 32 Termograma de la grasa sustituta de la manteca de cacao. 107 viii Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C 33 Espectro de espacios cortos de la manteca de cacao mexicana obtenido por difracción de rayos X 110 34 Espectro de espacios cortos de la manteca de cacao cubana obtenido por difracción de rayos X 110 35 Espectro de espacios cortos de la grasa equivalente de la manteca de cacao obtenido por difracción de rayos X 111 36 Espectro de espacios cortos de la grasa reemplazante de la manteca cacao obtenido por difracción de rayos X 112 37 Espectro de espacios cortos de la grasa sustituta de la manteca de cacao obtenido por difracción de rayos X 112 38 Curva de atemperado para la formulación TMC. 115 39 Curva de atemperado para la formulación TMC-GEMC . Tableta de chocolate análogo con problemas de brillo y color elaborada con manteca equivalente de la manteca de cacao 115 41 Curva de atemperado para la formulación TGEMC. 117 42 Proceso de elaboración de tabletas de chocolate análogo. 119 43 Tabletas elaboradas con manteca de cacao y con grasas alternativas de la manteca de cacao 120 44 Gráfico radial de los atributos evaluados sensorialmente en tabletas sabor chocolate 123 45 Resultados de la evaluación en las tabletas de chocolate análogo en sus atributos: uniformidad de color y brillo (Diagrama de Barras). 124 46 Resultados de la evaluación de las tabletas de chocolate análogo en sus atributos: intensidad del olor, olor extraño, intensidad del sabor, y sabor extraño. (Diagrama de Barras). 125 47 Resultados de la evaluación de las tabletas de chocolate análogo en sus atributos: dureza, derretimiento, cremosidad, cerosidad (Diagrama de Barras). 127 40 116 ix RESUMEN Actualmente la industria chocolatera produce un dulce sabor chocolate o chocolate análogo, utilizando grasas alternativas de la manteca de cacao (GAMC), que comparten propiedades y características con la manteca de cacao. Esta investigación tuvo como objetivo analizar manteca de cacao como referencia y 3 tipos de GAMC: grasa equivalente de la manteca de cacao (GEMC), grasa reemplazante de la manteca de cacao (GRMC) y grasa sustituta de la manteca de cacao (GSMC). La información que se obtuvo fue en relación a su composición fisicoquímica, de manera particular, el contenido de ácidos grasos trans, además de sus propiedades y/o características de cristalización y polimorfismo, También se evaluó la funcionalidad mediante la elaboración de chocolate análogo, así como los atributos sensoriales en tabletas hechas con el mismo. Se determinó en base a los resultados del análisis fisicoquímico que los tres tipos de GAMC cumplen con lo establecido en las normas mexicanas para este tipo de grasas. Únicamente se detectaron ácidos grasos trans, en la muestra GRMC (43.8%), y en la muestra GEMC (0.5%). La cristalización y polimorfismo se estudió mediante difracción de rayos X, calorimetría diferencial de barrido y microscopía con luz polarizada. Se observó que las muestras de manteca de cacao presentaron la forma V o β y que su cristalización al igual que la muestra GEMC es lenta, las muestras GRMC y GSMC mostraron la forma β’, y cristalizan rápidamente. El chocolate elaborado con MEMC y/o con manteca de cacao requirió ser atemperado. Se observó una reducción en el tiempo de cristalización de las tabletas de chocolate análogo usando las muestras GSMC y GRMC. La evaluación sensorial de las tabletas, de manera general indicó que las GAMC contribuyen a mejorar algunos atributos, como brillo y suavidad, sin embargo, en relación a los atributos: cerosidad, rapidez de fusión, intensidad del sabor y olor, se percibieron como deficientes. En general los resultados llevan a la conclusión de que el uso de GSMC constituye una buena opción para la producción de chocolate análogo debido a que tiene una cristalización rápida y estable, no requiere atemperado ayudando a optimizar el proceso de elaboración y también ayuda a reducir la ingesta de ácidos grasos trans, ya que no los contiene. x SUMMARY At present the chocolate industry produces a sweet taste chocolate or analogous chocolate, utilizing the cocoa butter's alternative fats (CBA ), they share properties and characteristics with the cocoa butter. This investigation aimed at analyzing cocoa butter like reference and CBA fellows: the cocoa butter's equivalent ( CBE ), the cocoa butter's replace ( CBR ) and cocoa butter substitute ( CBS ). The information obtained of these fats was in relation to his physicochemical composition, trans fatty acids content, in addition to their properties and characteristics of crystallization and polymorphism, also the sensorial attributes detected in tablets produced with this fats and finally the evaluation of their technological functionality. On the basis of the aftermath of physicochemical analysis, CBA three fellows obey with the established in the Mexican standards for this fats. Only were detected trans fatty acids in CBR ( 43,8 % ), and CBE ( 0,5 % ). The crystallization and polymorphism were studied by means of X-ray diffraction, differential calorimetry of sweeping and microscopy with light polarized, it was observed than, the signs of cocoa butter showed the form V or beta and than his crystallization just like the sign CBE is slow, the signs the CBR and CBS showed the form beta prime, and crystallize rapidly. The chocolate elaborated with CBE and or with cocoa butter, required to be tempered. A reduction in the time of crystallization of the analogous bars of chocolate was observed using CBS and CBR itself. The sensorial evaluation of the tablets, in general, suggested that the CBA contribute to improving some attributes like gloss and softness, however in relation to the attributes: waxy, rapidity of fusion, intensity of taste and smell, they were perceived like deficient. To conclude, all of the present results proved that CBS is the better material because not to contain trans fatty acids and at the same time provide a fast and stable crystallization, CBS can help to optimize the process of elaboration of analogous chocolate because does not need tempering process and can help to decrease the intake of trans fatty acids. xi INTRODUCCIÓN El Chocolate es un producto que de acuerdo a la Norma Oficial Mexicana NOM186-SSA1/SCFI-2002, se elabora a partir de la mezcla de dos o más de los siguientes ingredientes: pasta de cacao, manteca de cacao, cocoa, adicionado de azúcares u otros edulcorantes, así como de otros ingredientes opcionales, tales como productos lácteos y aditivos para alimentos, encontrándose dentro de éste diferentes variedades. En el 2007 en México el consumo per cápita de chocolate osciló alrededor de 500 gramos por año, cifra baja en comparación con Estados Unidos y Europa que tienen un consumo que supera los 15 kg ( www.radiotrece.com.mx ). La producción de chocolate, el acuerdo de la Directiva 2000/36/EC del Parlamento y Consejo Europeo indica que solo esta permitido un máximo de 5% de grasa diferente a la manteca de cacao del peso total del producto, para ser llamado “chocolate”, y la grasa debe cumplir con algunas características específicas. Actualmente a nivel industrial la reducción de tiempos de elaboración del chocolate, aunado a la reducción de costos, han ocasionado que se usen las grasas diferentes a la manteca de cacao, resultando en una práctica desleal según la opinión de algunas personas. En muchos países, especialmente de América latina, se ha vuelto una práctica común la inclusión de más de 5% de grasa diferente a la manteca cacao para elaborar un producto similar al chocolate. En el caso particular de México la importación libre de aranceles de chocolate extranjero, la protección que han gozado por años los productores de cocoa nacionales, y el consumo de cacao que rebasa la producción nacional, han ocasionado que muchas empresas ahora produzcan y/o trabajen no con chocolate, sino con dulce sabor chocolate ó chocolate análogo, es decir sin manteca de cacao. Actualmente el número de empresas que dejan de hacer chocolate para producir “dulces con sabor a chocolate” (nombre que se le debe dar al producto que no cumpla con lo indicado para la elaboración de chocolates de acuerdo a la NOM-186-SSA1/SCFI-2002) ó chocolate análogo crece aún más, iniciando una nueva era para México como productor de este tipo de producto. 1 A través de los años se ha reunido información de las características que hacen tan particular a la manteca de cacao, como lo es su composición de ácidos grasos, la cual es responsable del polimorfismo y cristalización tan característica que presenta 6 formas de cristales, así como de los atributos sensoriales (Stauffer, 1999). Basándose en estos conocimientos, a través de los años se han desarrollado grasas alternativas de la manteca de cacao, grasas vegetales que provienen de diferentes fuentes y que tienen ciertas características similares a la manteca de cacao (Jewell, 1998; Beckett, 2000). Una de las características de la manteca de cacao, es que es sólida a temperatura ambiente, pero funde a temperatura cercana a la temperatura corporal, por lo cual las grasas que se usen como alternativas de la manteca de cacao deben tener esta característica también (Stauffer, 1999). Por otra parte en la actualidad se sabe de la gran importancia del efecto que tienen las grasas que forman parte de la dieta en la salud de los consumidores. La Consulta de Expertos de la OMS/FAO de 2002 sobre el Régimen Alimentario, la Nutrición y la Prevención de las Enfermedades Crónicas (OMS, Serie de Informes Técnicos, TRS, 916) concluyó de manera especial que había pruebas convincentes de que el consumo de grasas que contengan ácidos grasos trans (AGT) aumenta el riesgo de sufrir enfermedades cardiovasculares, por lo que recomendó que el consumo de AGT no supere el 1% del aporte energético alimentario diario (www.pediatraldia.cl). Los ácidos grasos trans en grasas y aceites se forman principalmente al realizarse la hidrogenación parcial, aunque también pueden formarse durante la deodorización, estos ácidos grasos trans afectan la salud incrementando el nivel de lipoproteínas de baja densidad (LBD), relacionadas en gran manera con padecimientos cardiovasculares, como la aterosclerosis e inclusive diabetes (Wood, 1992; Bathena, 1992; Mensink y Plat, 2002). Muchos países tiene ya regulaciones en relación a la declaración del contenido de ácidos grasos trans en los alimentos (Spiller, 2004; Guerrero, 2006), desafortunadamente entre los países que aun faltan por establecer dichas regulaciones esta México. 2 I ANTECEDENTES 1.1 Lípidos Los lípidos son compuestos orgánicos, componentes del tejido adiposo, componentes estructurales de las células vivas, suministran energía (9 kcal) y son vehículo de compuestos liposolubles. La importancia de los lípidos es amplia, juegan un papel relevante en la nutrición, en la industria constituyen un ingrediente base para elaborar cosméticos, productos farmacéuticos, productos químicos y productos alimenticios. De manera específica los lípidos de los alimentos por sus propiedades físicas y químicas como lo es su composición, estructura cristalina y propiedades de fusión, influyen mucho en las propiedades funcionales de numerosos alimentos. Sin embargo los lípidos de los alimentos ya sea en forma de aceite o grasa, han sido asociados con enfermedades, de manera especial las grasas saturadas de origen animal o vegetal y las grasas parcialmente hidrogenadas, que se cree aumentan el riesgo de sufrir enfermedades relacionadas con el sistema cardiovascular (Nawar, 1998). 1.1.1 Definiciones Existen varias definiciones de lípidos, que hacen referencia a sus componentes, al grupo químico al que pertenecen, a su carácter natural, al valor nutrimental, a su origen, y a su solubilidad o insolubilidad en disolventes polares y no polares. Sin embargo, en la actualidad la definición de lípidos ya no es tan exacta, debido a que hay ciertos cambios o nuevas características, por ejemplo, en el sentido estricto de solubilidad los ácidos grasos de cadena corta C1-C4 son completamente miscibles en agua e insolubles en disolventes no polares, por otra parte, si bien los ácidos grasos trans se consideran derivados de un proceso natural de hidrogenación de las bacterias, al formarse durante la hidrogenación industrial ya no pueden considerarse productos naturales. Adicionalmente ya existen compuestos de carácter lipídico de un valor calórico inferior al establecido para los lípidos. Por lo que para fines prácticos se adoptará la definición más común: Lípido (del griego lípos, “grasa”) sustancia apolar que es en parte o del 3 todo insoluble en agua, pero soluble en disolventes apolares como cloroformo, disulfuro de carbono, éter o etanol caliente (Bohinski, 1991; O’Keefe, 2002). 1.1.2 Clasificaciones Los lípidos pueden clasificarse de diferentes maneras, por ejemplo, con base en sus propiedades físicas a temperatura ambiente (aceites son líquidos y grasas son sólidas), su polaridad (polares y lípidos neutros), su función en el cuerpo humano (ácidos grasos esenciales y no esenciales) ó en su estructura (simples y complejos). En el Cuadro 1 se muestra una clasificación con base en su estructura (Nawar, 1998; O’Keefe, 2002). Cuadro 1. Clasificación de los lípidos con base en su estructura. Clase Subclase Descripción Lípidos simples Acilgliceroles Glicerol+ácidos grasos Ceras Alcohol de cadena larga+ácido graso de cadena larga Lípidos compuestos Fosfoacilgliceroles Glicerol+ ácidos grasos +fosfato+otro grupo que contenga nitrógeno Esfingomielinas Esfingosina+ácido graso + fosfato + colina Cerebrósidos Esfingosina + ácido graso + azúcar simple Gangliósidos Esfingosina+ ácido graso + carbohidrato complejo que contiene ácido siálico Lípidos derivados Materiales que satisfacen la Ejemplos: carotenoides, definición de lípidos pero no la esteroides, vitaminas de los lípidos simples o liposolubles. complejos Fuente: Nawar, 1998. En los productos vegetales como nueces, semillas, legumbres y cereales la fracción lipídica se compone principalmente de acilgliceroles neutros, que se consideran lípidos simples (Nawar, 1998). 4 1.1.3 Grasas y Aceites El 80 % de la producción mundial de grasas y aceites se usa para la alimentación humana, 14 % para la industria oleoquímica (se incrementa notablemente en la actualidad el porcentaje destinado de los aceites vegetales a la industria de bio combustibles por la gran demanda), y 6% para la alimentación animal (Gunstone, 2000). Los lípidos presentes en los alimentos que consumimos, son grasas y aceites que pueden ser de origen animal y/o vegetal. En el periodo 2006-2007 se registro un total de 152.73 TM de grasas y aceites de mayor importancia comercial, donde 128.25 TM corresponden a la producción de los 13 principales tipos de aceites vegetales y 24.48 TM a la producción de las cuatro principales grasas de origen animal, estos resultados muestran la importancia que tiene los lípidos de origen vegetal (Oil World Annual, 2007). La naturaleza debido a los diferentes climas, tipos de suelos, y características de los cultivos permite que exista una amplia gama de aceites y grasas de origen vegetal, en el Cuadro 2 se presentan algunos aceites indicando las zonas o países donde principalmente se cultivan. Cuadro 2. Principales aceites vegetales y áreas geográficas donde se cultivan. Cultivo 1 Aceites líquidos Principal área de cultivo Semilla de colza Frijol de soya Semilla de girasol Cacahuate Maíz Algodón Oliva Europa, Canadá, Australia, China, India EUA, Brasil, Argentina, China Europa (Centro y Sur), EUA, Argentina India, China, EUA, África (Norte) EUA, Brasil, Argentina, Europa (Sur), China EUA, China, India, Pakistán Área del mediterráneo 2 Palma Aceite de palma Malasia, Indonesia, Africa (Este), Brasil (Oeste) 3 Aceites láuricos Coco Almendra de palma Islas Filipinas, Indonesia Malasia, Indonesia 4 Cacao y grasas exóticas Cacao Semilla de Shea Semilla de Sal Hueso de mango Semilla de Illipe Kokum Costa de Marfil, Brasil, Ghana Costa de Marfil, Ghana India India Borneo India Fuente: Nilsson y col., 2002 5 En la mayoría de las plantas, los lípidos se almacenan de alguna forma especial, por ejemplo, en muchas semillas como en el caso del girasol y canola es en los cotiledones en donde se almacenan, en algunas frutos como el aguacate y el fruto de la palma africana se almacenan en el mesocarpio, en otros frutos como el coco es en el endospermo donde se almacenan (Nilsson y col., 2002). 1.1.4 Composición de Grasas y Aceites Un aceite ó grasa cruda se compone mayormente de triacilgliceroles (más de 95%). Se denominan grasas neutras (sólidas) ó aceites neutros (líquidos) a los triacilgliceroles según su estado físico a temperatura ambiente. Además de los triacilgliceroles, también hay pequeñas cantidades de diacilgliceroles, monoacilgliceroles y ácidos grasos libres (Gunstone, 2000). 1.1.4.1 Acilgliceroles Un acilglicerol es un éster que se forma por una molécula de glicerol (trihidroxialcohol) y uno o varios ácidos grasos. El glicerol tiene tres grupos alcohol donde los ácidos grasos pueden unirse, según el número de ácidos orgánicos se pueden tener monoacilgliceroles, diacilglicéroles ó triacilgliceroles. En la Figura 1 se presenta un triacilglicerol, esta molécula corresponde a la triestearina o triestearato de glicerol, que se compone de tres moléculas de ácido graso esteárico unidos al glicerol (Nawar, 1998). Figura 1. Molécula de triestearina Fuente: Nawar, 1998. Se asigna una numeración que describe el orden de los grupos hidroxilo en la molécula de glicerol, sn1, sn2 y sn3, el carbono C1 en la parte superior 6 denominado también α, el carbono C2 en la posición intermedia denominado β y el carbono C3 en la parte inferior llamado α’ (O’Keefe, 2002). 1.1.4.2 Ácidos Grasos Los ácidos grasos, son ácidos monocarboxílicos alifáticos con longitudes de cadena de 4 a 24 átomos de carbono. Se han usado a través de los años nombres comunes para ciertos ácidos grasos, muchos de estos nombres se asignaron en base a su origen botánico o zoológico. (O’Keefe, 2002). Actualmente se han identificado más de 1000 ácidos grasos naturales, el número es tan grande debido a las variaciones en grado de insaturación, longitud de cadena y presencia o ausencia de otros grupos funcionales. Sin embargo, de acuerdo a los científicos y tecnólogos se considera que solo entre 25 y 50 ácidos grasos son los más importantes (Gunstone, 2000). El Cuadro 3, muestra un listado de los ácidos grasos que son más comunes y se encuentran en mayor abundancia en los aceites y grasas. Cuadro 3. Ácidos grasos de mayor importancia en grasas y aceites. Nombre común Ácidos saturados Láurico Mirístico Palmitito Esteárico Ácidos monoinsaturados Oleico Erúcico Ácidos Poliinsaturados (n-6) Linoleico γ-Linolénico (GLA) Araquidonico Ácidos Poliinsaturados (n-3) Linolénico EPA DHA Nombre sistemático Número de carbonos Dodecanoico Tetradecanoico Hexadecanoico Octadecanoico 12:0 14:0 16:0 18:0 9-octadecenóico 13-dococenoico 9-18:1 13-22:1 9,12-octadecadienoico n-6 18:2 6,9,12-octadecatrienoico 5,8,11,14-eicosatetranoico n-6 18:3 n-6 20:4 9,12,15-octadecatrienoico n-3 18:3 5,8,11,14,17-eicosapentaenoico 4,7,10,13,16,19-docosahexaenoico n-3 20:5 n-3 22:6 *Basado en la producción anual de aceites vegetales considerando 8 ácidos que constituyen el 97% del total de la producción: laúrico (4%), mirístico (2%), Palmítico (11%), esteárico (4%), oleico (34%), linoleico (34%), linolenico (5%) y erúcico (3%) Fuente: Gunstone, 2000. 7 Algunas características de los ácidos grasos que influyen en las propiedades físicas y químicas de grasas y aceites son: número de dobles enlaces ó instauraciones en la cadena de carbonos, la longitud y la posición del ácido graso insaturado dentro de la cadena, y la posición cis ó trans del doble enlace (Charley, 2005). Los ácidos grasos saturados se caracterizan porque cada átomo de carbono está unido a otros dos átomos de carbono y a 2 átomos de hidrógeno. Los ácidos grasos insaturados tienen uno o más átomos de carbono enlazados a un segundo átomo de carbono mediante un doble enlace, que ocasiona que la molécula no sea lineal (Charley, 2005). En la Figura 2 se muestra al ácido graso linolénico (las flechas indican la posición de las instauraciones), y al ácido graso esteárico. Ác. Linolénico C-18:3 (poliinsaturado) Ác. Esteárico C-18:0 (saturado) Figura 2. Ácido grasos con diferente grado de saturación Fuente: AarhusKarlshamn, 2006 Si la cadena de carbonos es larga y saturada, el punto de fusión del compuesto se incrementará, y de manera inversa entre más dobles enlaces o instauraciones ocasiona tenga la cadena de carbonos el punto de fusión disminuirá (Charley, 2005), en el Cuadro 4 se muestran algunos ejemplos. 8 Cuadro 4. Punto de fusión (°C) de algunos ácidos grasos No. de Carbonos Ácido graso Punto de Fusión °C 12 Láurico 45 14 Mirístico 54 16 Palmítico 63 18 Esteárico 70 18:1 trans Elaídico* 44 18:1 Oleico* 14 18:2 Linoleico* -5 18:3 Linolénico* -11 Fuente: Kellens, 2000; *Nilsson y col., 2002. En los ácidos grasos insaturados existen isómeros posicionales e isómeros geométricos. Los posicionales son aquellos en los que los dobles enlaces se encuentran en otras posiciones dentro de la cadena lineal del ácido graso. Los isómeros geométricos son aquellos en donde los radicales y los dos átomos de hidrógeno que convergen en un doble enlace se encuentran en posiciones diferentes (Charley. 2005). La Figura 3 ilustra las configuraciones cis y trans que se pueden presentar en los ácidos grasos. Figura 3. Configuración cis y trans en isómeros geométricos. En los aceites y grasas naturales se encuentran normalmente isómeros cis, con algunas excepciones en que se presentan cantidades muy pequeñas de isómeros trans, por ejemplo en el sebo de res y en la mantequilla, esto es debido al proceso digestivo en el animal, que incluye la bio-hidrogenación por parte de las bacterias (Becerra, 2005). Las formas trans tienen propiedades físicas intermedias entre los ácidos grasas cis y ácidos grasos saturados. Su conversión a energía se da en la misma proporción de la de los grasos saturados (Lehninger, 2004). 9 1.1.5 Cristalización y Polimorfismo en Grasas y Aceites Las propiedades físicas de las grasas y productos que contienen grasa, se deben en gran manera a su cristalización, es decir, la estructura de la red cristalina presente. El estudio de esa estructura y sus propiedades se ha enfocado principalmente en la composición lipídica, en el polimorfismo y la proporción sólido/líquido que se presenta a diferentes temperaturas. En la Figura 4 se muestra un bosquejo de los niveles que de estructura que presenta la grasa cristalizada (Tang y Marangoni, 2006). Reología propiedades mecánicas propiedades sensoriales Grasa Nivel macroscópico >0.2 mm Redes de cristales Contenido de grasa Polimorfismo Estructura Molecular Núcleos de cristales Microestructura 0.25-200μm Cristales Moléculas de triacilgliceroles Nanoestructura 0.4-250nm Figura 4. Bosquejo de la jerarquía en la estructura que se presenta en la grasa cristalizada. Fuente:Tang y Marangoni, 2006. Para el estudio de la solidificación de grasas, se ha usado ampliamente la cristalografía. Un cristal esta constituido por átomos arreglados en un patrón tridimensional que se repite periódicamente. Las características más importantes de un cristal son la periodicidad y regularidad del arreglo de los patrones tridimensionales, que pueden constituirse de un átomo, grupos de átomos, una molécula o grupos de moléculas. Cuando la energía cinética de las moléculas no es suficiente para evitar que estas se asocien entre sí gracias a las atracciones moleculares, se asumirán orientaciones y posiciones fijas unas respecto a otras, y 10 así ocurrirá la solidificación, cada molécula que entra a formar parte del sólido se verá influenciada casi de la misma manera que las moléculas precedentes, y así la molécula será un arreglo tridimensional ordenado, un cristal (Moreno, 2000). La cristalización de una grasa comienza con un sobre enfriamiento de la grasa fundida (equivalente a la sobre saturación de una solución), a temperatura inferior a la de fusión se inicia la formación de núcleos, estos se deshacen y se vuelven a formar, esto se repite hasta que alcancen un tamaño crítico. La energía libre de Gibbs de estos núcleos alcanzará un valor máximo al llegar ese tamaño crítico, para mantener al mínimo la energía libre el proceso de formación y fusión continuará, a su vez los núcleos al crecer forman una superficie, debido a la agregación de aglomerados y puentes entre los núcleos se formará finalmente la red de cristales (Campos, 2005). El proceso de cristalización se ha dividido en tres segmentos o tres eventos: La nucleación, el crecimiento y la transformación. En la etapa de nucleación los triacilgliceroles forman agregados para constituir cristales primarios. La ruta normal de nucleación en las grasas se conoce como nucleación heterogénea. Este proceso inicia en las superficies y es favorecida con agitación. La lecitina y otros lípidos polares, monoglicéridos, diglicéridos y pequeñas cantidades de triacilgliceroles de alto punto de fusión se usan para controlar la nucleación (Nilsson y col., 2002) En la etapa de crecimiento se determina la forma cristalina (polimorfismo), que tiene gran impacto en la aplicación que tenga la grasa. La nucleación y crecimiento son rápidos. La etapa de transformación, que consiste en llegar a la forma cristalina termodinámicamente más estable, es la última etapa de la cristalización, es además la más lenta, y tanto el polimorfismo como la composición tienen gran influencia (Nilsson y col., 2002). Los triacilgliceroles y las grasas normalmente cristalizan en tres o más formas cristalinas. El polimorfismo se define como la existencia de varias formas cristalinas, con la misma composición química pero de diferente estructura, que al fundirlas dan fases líquidas idénticas. El polimorfismo permite la existencia de 11 múltiples puntos de fusión. Dos formas cristalinas son enantiotrópicas cuando cada una tiene un intervalo definido de estabilidad. Dos formas cristalinas son monotrópicas si una es estable y la otra es meta estable bajo todo tipo de condiciones; en estas formas cristalinas la transición irá en la dirección a la forma más estable. Las grasas naturales son invariablemente monotrópicas. En los compuestos de cadena larga, el polimorfismo está asociado con diferentes tipos de empaquetamiento de las cadenas de carbonos de los ácidos grasos ó con diferentes ángulos de inclinación, el modo de empaquetamiento puede llamarse subceldillas. Dentro de una celdilla unidad se encuentran las subcélulas, una subcélula es la parte más pequeña de la unidad espacial de repetición a lo largo de los ejes de la cadena. Se conocen siete tipos de empaquetamientos de las subcélulas de hidrocarburos (Nawar, 1998). En la Figura 5, se muestran las proyecciones por cadenas terminales de los principales empaquetamientos de las subcélulas ó formas cristalinas en las grasas, que son alfa (α), beta prima (β’) y beta (β). ALFA BETA PRIMA BETA Figura 5. Principales formas polimórficas en grasas. Fuente: Nilsson y col., 2002. La forma alfa tiene una simetría hexagonal y se forma a baja temperatura y altas velocidades de enfriamiento, las cadenas de ácidos grasos son perpendiculares a el plano del grupo metilo final y oscilan, por el alto grado de libertad molecular. La forma alfa tiene una corta duración (10 s a 2 h), pero en grasas completamente hidrogenadas puede mantenerse por años a temperatura ambiente, por ejemplo, el aceite de palma hidrogenado (Marangoni, 2005). 12 La forma intermedia es conocida como beta prima, tiene una forma ortorrómbica, las cadenas están inclinadas respecto al plano del grupo metilo final (Figura 6) y donde las cadenas de ácidos grasos adyacentes están en diferentes planos. Por ejemplo, la grasa butírica (Foubert y col., 2007). La forma beta es la más estable, tiene punto de fusión más alto que las otras formas, y una simetría triclínica (Figura 5), donde a diferencia del arreglo ortorrómbico todas las cadenas de ácidos grasos están en el mismo plano (Figura 6). Por ejemplo la manteca de cacao (Foubert y col., 2007). Figura 6. Arreglo de los triacilgliceroles que se presenta en cada una de las sub células de las formas cristalinas más comunes. (Foubert y col., 2007) Se sabe que a temperaturas arriba de la temperatura de fusión de la grasa, no hay un orden en sus moléculas y es líquida, al enfriarla, se crea la forma alfa (Figura 7), que es normalmente inestable a temperatura ambiente, esta se funde o transforma a la forma beta prima (Figura 7). Si la grasa es tratada a bajas velocidades ó el enfriamiento es detenido cuando aun la temperatura es alta, se forma también el cristal beta prima, esta forma cristalina puede fundirse y transformarse a la forma beta. Es difícil obtener la forma beta a partir de la grasa fundida de manera directa, una manera de obtenerla es mediante un enfriamiento muy lento y con ciclos de temperatura (Nilsson y col., 2002). 13 Grasa fundida Beta Beta’ ’ Alpha Cristalización Fusión Conversión Figura 7. Vías de cristalización según el polimorfismo en grasas. Fuente: Nilsson y col., 2002 Actualmente se usa el polimorfismo deliberadamente en la manufactura de grasas, como una manera de controlar la forma, tamaño, e interacción de los cristales (Birker y Padley, 1987). La tendencia natural a formar cristales α, β’ y β en algunas grasas ya se conoce, en el Cuadro 5 se muestran algunos ejemplos (Podmore, 2000). Cuadro 5. Tendencia de cristalización en algunas grasas y aceites. Forma α Forma β’ Forma β Aceite de palma completamente hidrogenado Aceite de algodón Aceite de palma Sebo Aceite de arenque Aceite de pescado Aceite de ballena Aceite de nabo Grasa butírica Manteca de cerdo modificada Aceite de soya Aceite de cártamo Aceite de girasol Aceite de ajonjolí Aceite de cacahuate Aceite de Maíz Aceite de canola Aceite de oliva Aceite de coco Manteca de cacao Estearina de palma Manteca de puerco Aceite de algodón completamente hidrogenado Fuente: Podmore, 2000. D’Souza y col (1990), publicaron una revisión de las formas polimórficas y espacios cortos de diferentes grasas naturales y grasas comerciales, reportadas hasta ese año por varios investigadores. La estabilidad polimórfica de las grasas o mezclas de grasas reportada en D’Souza y col. (1990), fue determinada usando 14 difracción de rayos X, ya que los patrones de difracción dan información inequívoca de la forma polimórfica de la grasa. 1.1.6 Métodos Empleados para el Estudio de la Cristalización de Grasas y Aceites El estudio del proceso o desarrollo de la cristalización se realiza utilizando varias técnicas, entre las que se encuentran: Resonancia magnética nuclear (pNMR) para determinar el contenido de sólidos grasos indicando diferentes grados de cristalización, la microscopía que es una herramienta para visualizar el proceso de cristalización bajo parámetros como el tiempo, velocidad de agitación y/o temperatura, la calorimetría diferencial de barrido es empleada para detectar cambios endotérmicos o exotérmicos que ocurren durante un análisis dinámico de aceites y grasas en función de la temperatura (formas cristalinas según puntos de fusión o temperaturas de cristalización). El análisis con difracción de rayos X. a grasas, permite determinar las formas cristalinas de acuerdo a espacios cortos o largos dentro de la estructura del cristal (Roos, 1995). 1.1.6.1 Resonancia Magnética Nuclear En una grasa se puede determinar la porción de material sólido y líquido, estas dos fracciones constituyen un sistema. La fracción sólida se reporta como el contenido de sólidos grasos, y se puede obtener por diferentes técnicas, una de ellas es la resonancia magnética nuclear (RMN) que es un método directo. Esta técnica mide la respuesta de los núcleos de los hidrógenos (protones) a un pulso de energía de intensidad y frecuencia corta en un campo magnético. Cuando un pulso de frecuencia de radio se aplica a la grasa se induce una señal de magnetización. La amplitud inicial de la señal es proporcional al número de protones presentes en la muestra. Cuando hay más de un componente que contenga protones (grasa líquida y grasa sólida), la señal cae de acuerdo a cada componente. Los protones en la fase sólida presentan una caída más rápida de la 15 señal que los protones en la fase líquida. La diferencia entre la señal inicial (que corresponde a las dos fases: líquida y sólida) y la señal final (que corresponde a la pura fracción líquida) es proporcional a la cantidad de protones presentes en la fase sólida, de lo cual se calcula la fracción sólida (Campos, 2005). La relación entre el contenido de sólidos grasos, el grado de cristalización y las propiedades sensoriales es muy importante, el contenido de sólidos grasos presentes a la temperatura entre 20-25 °C indica la dureza (Figura 8), entre los 25 y 30 °C se relaciona con la resistencia al calor, entre 30 y 35 °C indica la rapidez de fusión y finalmente la presencia de sólidos grasos a 35 °C ó más temperatura en el caso de grasas para confitería se relaciona con la cerosidad, o sensación de grasa que no funde en la boca (Nilsson y col., 2002). 1 Dureza 2 Resistencia térmica Contenido de sólidos grasos % 1 3 Rapidez de fusión 4 Cerosidad 3 2 4 Temperatura °C Figura 8. Relación entre el contenido de sólidos grasos y los atributos sensoriales. Fuente: Nilsson y col., 2002 El contenido de sólidos grasos de 30-35 °C, da información de lo que ocurre cuando se funde en la boca la grasa, punto muy importante al hablar de chocolate. La pendiente de la curva entre los 30 y 35 °C esta relacionada con lo rápido que funde la grasa, por ejemplo, cuando el chocolate se funde en la boca , es necesaria una gran cantidad de energía, ya que el cambio de estado sólido a 16 líquido requiere de energía, que es denominada calor latente (en la manteca de cacao es de alrededor de 157 J/g), por otra parte para aumentar la temperatura de la grasa en 1 °C se requieren 2.0 J/g, por lo que la energía requerida para fundir el chocolate es proporcionada por transferencia de calor, (36 °C temperatura corporal) del interior de la boca al chocolate ( la temperatura sube aproximadamente 20 °C, la suma del calor específico y latente es: 20*2+157=197 J/g). Si la pendiente es pronunciada, la fusión es muy rápida y se produce una sensación refrescante en la boca (Beckett, 2000). 1.1.6.2 Microscopía con Luz Polarizada La microestructura de la grasa comprende partículas de tamaño de 0.25-200 μm (Figura 4), la cual ha sido visualizada gracias a varios métodos microscópicos. La microscopía de luz polarizada (MLP), es el método más popular en el estudio de las grasas, principalmente por requerir de una preparación relativamente simple de la muestra a observar. Las imágenes obtenidas mediante esta técnica proveen la distribución espacial dentro de la red de grasa cristalizada (Tang y Marangoni, 2006; Liang y col., 2006). Siguiendo el método de microscopia de luz polarizada, las observaciones de las muestras, se hacen usando objetivos de 4x, 10x y 40x. Lo que se puede observar corresponde a la región intranuclear de las redes de cristales. Se puede apreciar el crecimiento de los cristales, pero solo en dos dimensiones. Los elementos sólidos se observan directamente como formas brillantes en un fondo oscuro (Awad y Marangoni, 2005). 1.1.6.3 Calorimetría Diferencial de Barrido La calorimetría diferencial de barrido (CDB), es un método conveniente para determinar la cristalización y el comportamiento de fusión de una grasa, permite obtener el comportamiento térmico global del producto. 17 Aunque se recomienda usar la CDB para el estudio de grasas y aceites, es importante tener presente que al ser las grasas mezclas de tracilgliceroles, y que a su vez estas moléculas se componen de diferentes ácidos grasos, puede dificultarse el análisis calorimétrico, por lo cual, muchos de los estudios se hacen usando triacilgliceroles que contengan un solo tipo de ácido graso, como la triestearina, tripalmitina, etc (Singh y col., 1999; Mac y col., 2006), o bien mezclas de triacilgliceroles conocidos, de los que previamente se ha realizado un análisis de triacilgliceroles puros (Gartí y col., 1989); También se han estudiado diferentes grasas, que por diversos motivos son de gran interés, por ejemplo, la manteca de cacao, que es una de las grasas de las que más reportes se encuentran en la literatura (Dimick y Manning, 1987; Davis y Dimick, 1989; Chaiseri y Dimick, 1989; Oh y Swanson, 2006), por otra parte se han estudiado mezclas de manteca de cacao y aceites para entender el efecto “eutéctico” o incompatibilidad entre grasas (Pérez y col. 2005) ó aceites exóticos (Sessa, 1996) . El chocolate como tal ha sido estudiado por medio de CDB con el fin de entender el problema de cristalización conocido como “fat bloom”, así como el efecto de promotores de cristalización (Hachiya y col., 1989a; Hachiya y col., 1989b; Reddy y col., 1996). Las grasas o mantecas industriales debido a que conforman un universo bastante complejo por ser mezclas de diferentes aceites y grasas sometidos a diversos procesos de modificación no se han estudiado muy ampliamente (Lovegren y col., 1976; Foubert y col., 2006; Foubert y col., 2007). El resultado de un análisis de calorimetría diferencial de barrido es un termograma, que muestra las transiciones que ocurren al material de estudio. Existen dos tipos de transiciones, las de primer orden y las de segundo orden. Las de primer orden producen picos, que indican la transición y la temperatura a la que ocurre. La mayoría de las transiciones de fase de los lípidos son de primer orden (Martínez y col., 1999). 1.1.6.4 Difracción de Rayos X El proceso de difracción consiste en la dispersión de rayos X por las nubes electrónicas de los átomos, el patrón observado es el resultado de la interferencia 18 constructiva y destructiva de la radiación dispersada por todos los átomos, la analogía a la reflexión ordinaria surge del arreglo regular de los átomos en el cristal. En la Figura 9 se muestra la geometría de la refracción de rayos X de los diferentes planos del cristal, donde se aprecia un ángulo de incidencia y de refracción, representado por θ. Figura 9. Geometría de la refracción de rayos X, de los diferentes planos del cristal de acuerdo a la ley de Bragg. Fuente: Marangoni, 2005. Donde un haz de rayos X hace un ángulo θ con un conjunto de planos cuyo espacio interplanar es “d” , dado que hay un gran número de planos paralelos , las reflexiones de los planos sucesivos interferirán unos con otros y habrá interferencia constructiva, únicamente cuando la diferencia entre el recorrido de los planos sucesivos sea igual a un número entero de longitudes de onda, será constructiva, entonces los rayos incidentes estarán en fase, esto se presenta cuando nλ= 2dsenθ, esta relación es conocida como la Ley de Bragg, desde el punto de vista físico, la ecuación establece que se observará un pico en la intensidad difractada cuando λ, d y θ tomen valores tales que el correspondiente valor de n sea un número entero. El ángulo de incidencia θ se reporta en grados, λ es la longitud de onda del rayo X (varía según el elemento químico empleado), d es la distancia repetida entre dos planos reticulares en Å y n como ya se mencionó es un número entero (Moreno, 2000; Marangoni, 2005). Los estudios de la cristalización en grasas se han realizado usando DRX desde hace varios años, y gracias a esto, se ha entendido mejor el polimorfismo que presentan (Hoerr y Paulicka, 1968; Yap y col., 1989; van Malssen y col.,1996 a; van Malssen y col.,1996 b; van Malssen y col.,1996 c) Los patrones típicos de difracción de rayos X que exhiben las grasas, son dos grupos de líneas de 19 difracción que corresponden a espacios cortos y espacios largos. Los espacios largos corresponden a los planos formados por los grupos metil finales, son dependientes de la longitud de la cadena y el ángulo de inclinación los ácidos grasos componentes de las moléculas glicéricas. Los espacios cortos se refieren a la sección transversal del arreglo de la cadena de carbonos y son independientes de la longitud de la cadena. Los espacios largos son observados alrededor de 1-15° 2θ, los espacios cortos son observados alrededor de la región 2θ de 16-25° . Los espacios cortos son ampliamente usados para caracterizar las diversas formas polimórficas (D’Souza y col., 1990). La forma β’ es usualmente asociada con triglicéridos asimétricos (Foubert y col., 2006). La forma β se observa en grasas con triacilglicéroles simétricos, la manteca de cacao presenta este tipo de triacilgliceroles. D’Souza y col. en 1990 presentaron una revisión muy amplia de las formas polimórficas en base a los espacios cortos determinados en grasas naturales y grasas industrializadas o comerciales. Para grasas comerciales las forma reportada de acuerdo a los espacios cortos en Å fueron: α (4.15), β’ (4.35, 4.2, 4.03, 3.8) y β (4.57, 4.22, 4.00, 3.85, 3.65, 3.50). 1.1.7 Proceso Industrial para la Fabricación de Grasas y Aceites Para obtener mantecas ó grasas y aceites de grado alimenticio es necesario realizar un proceso que comprende varias operaciones con el objetivo de ir transformando a las grasas o aceites crudos hasta tener la calidad y atributos deseables que los hacen aptos para su uso. De acuerdo a la norma NMX-F-009SCFI-2005 estas operaciones son: 1. Neutralización ó refinación química. 2. Blanqueo. 3. Pre-tratamiento para refinación física. 4. Hidrogenación y filtración para eliminar el catalizador de níquel. 5. Deodorización. 6. Interesterificación ó redistribución de radicales de ácidos grasos. 7. Cristalización y envasado. 20 De acuerdo a la norma NMX-F-009-SCFI-2005 los procesos de deodorización ó refinación física en su caso, deben de ser los procesos finales antes del proceso de cristalización y envasado. Así mismo indica que la combinación de las operaciones que se utilicen dependerá del tipo y calidad de materias primas usadas y de las especificaciones de cada tipo de producto fabricado por la industria (www.economia.gob). En la actualidad la industria de grasas y aceites utiliza el proceso de fraccionamiento que consiste en enfriar y agitar de manera controlada, para producir fracciones sólidas y líquidas de características especiales y contenido de sólidos grasos diferentes, que se pueden utilizar para balancear el contenido de ácidos grasos y así obtener mantecas con características específicas (Becerra, 2005). 1.1.8 Ácidos Grasos Trans Los ácidos grasos trans (AGT) se forman de manera natural en pequeñas cantidades por la acción de microorganismos presentes en el estómago de los rumiantes (Lee y col., 2006); por lo que se pueden encontrar AGT en la mantequilla, la leche (el ácido vaccenico, representa el 45-50% del total de isómeros trans presentes) , grasas de origen animal, etc., sin embargo, esta forma de AGT supone una pequeña proporción (<0,5% del aporte energético total) de la cantidad total de grasas trans consumidas (Destaillats y col. 2006). Los ácidos grasos trans de producción industrial, conocidos generalmente como “grasas trans”, han sido definidos por la Comisión Mixta FAO/OMS del Codex Alimentario como: “ácidos grasos insaturados que contienen uno o varios enlaces dobles aislados (no conjugados) en una configuración trans” (www.pediatraldia. cl/GRASAS %202006/eliminar_grasas_trans.htm). En el proceso de deodorización se pueden formar ácidos grasos trans, por lo cual es difícil obtener aceites o grasas con 0% AGT. En este proceso se producen de 1 a 4% de ácidos grasos trans, dependiendo de las condiciones de operación. La 21 temperatura de desodorización es el factor más importante, ya que el aumento de temperatura cataliza la isomerización, por lo que, dentro de los posible, es conveniente deodorizar a baja temperatura. Sin embargo, esto tiene un límite en la eficiencia de deodorización (Becerra, 2005). La hidrogenación se emplea para la producción de “shortenings” o mantecas, la materia prima es una aceite o grasa que tenga ácidos grasos insaturados, el objetivo de hidrogenar es incrementar la calidad o estabilidad ante la oxidación, además de conseguir una consistencia o estado físico que permiten cierta plasticidad y algunas otras ventajas tecnológicas (Lawson, 1995). Durante la hidrogenación el aceite o grasa se expone al gas hidrógeno en presencia de un catalizador, los dobles enlaces en el radical el ácido graso se abren y un átomo de hidrógeno se une a cada uno de los dos átomos de carbono que antes estaban unidos mediante el doble enlace como se muestra en la Figura 10. Los dobles enlaces no solo disminuyen sino que también migran durante la hidrogenación. En el caso de los ácidos grasos poliinsaturados, sólo se saturan algunos dobles enlaces. Como resultado se forman isómeros de ácidos grasos insaturados que no ocurren en forma natural (Becerra, 2005). - CH2- CH = CH- CH2HIDRÓGENO - CH2- CH2 - CH2 - CH2- Figura 10. Cambio que ocurre en el ácido graso durante la hidrogenación. Un ejemplo muy claro de qué sucede al hidrogenar se observa en el índice de yodo, por ejemplo, el valor del índice de yodo del aceite de soya disminuye de 129 a 76 al hidrogenarlo, la proporción total de ácidos insaturados en la grasa desciende en solo un 3%, pero más de la mitad de ácidos totales presentes adquieren la forma del ácido monoinsaturado en posición trans, conocido como ácido elaídico C 18:1 trans-9 (FAO, 1991). 22 Los ácidos grasos trans generalmente son de punto de fusión más alto que los correspondientes isómeros cis. El ácido graso cis 9 octadecenóico o ácido cis 9 oleico tiene un punto de fusión de 14°C sí sufre una isomerización durante la hidrogenación se convierte en el ácido trans 9 oleico (ácido elaídico), el cual tendrá un punto de fusión de 44°C, en caso de que sí se efectúe la hidrogenación del ácido oleico, el ácido graso formado será el ácido graso esteárico con punto de fusión de 70°C. En la Figura 11 se observa que tanto el ácido graso elaídico como el esteárico presentan una forma lineal aun cuando uno es monoinsaturado y el otro es saturado (Becerra, 2005). Enlace en posición trans Ácido graso elaídico Ácido graso esteárico Figura 11. Ácido graso trans y ácido graso saturado. Fuente: AarhusKarlshamn, 2006 1.1.8.1 Efectos de los Ácidos Grasos Trans en la Salud En la década de los 90’s, se aceptó que los ácidos grasos trans incrementaban la presencia de la lipoproteína de baja densidad (LBD) y disminuían la presencia de la lipoproteína de alta densidad (LAD), situación más perjudicial que la ocasionada por las grasas saturadas (Spiller, 2004). Se sabe que la lipoproteína de baja densidad transporta colesterol en la sangre, causa depósitos en las arterias, por lo que es importante no se incremente el nivel de esta lipoproteína. La lipoproteína de alta densidad también transporta colesterol en la sangre, pero el colesterol en esta forma se considera protector, por lo que es llamado colesterol bueno, de manera que no debe disminuir el nivel de esta lipoproteína. El incremento de la lipoproteína de baja densidad esta directamente relacionada con 23 la cantidad de ácidos grasos trans consumidos, este incremento ocasiona la pérdida del balance que debe existir en el perfil lipoproteico (Katan y col., 1995). En el 2002 el Dr. Katz encontró que un alto contenido de grasas trans en la membrana de los glóbulos rojos influía en arritmias y posiblemente la muerte por ataque cardiaco (Spiller 2004). También los ácidos grasos trans pueden incorporarse a los fosfolípidos de las membranas, lo que puede ocasionar alteraciones en el empaquetamiento y fluidez de las membranas celulares, ya que las propiedades físicas (Figura 11) de estos ácidos grasos son parecidas a las de los ácidos grasos saturados. La sustitución de ácidos grasos cis por ácidos grasos trans, puede afectar la actividad biológica de algunas moléculas, favoreciendo la aparición de estados patológicos (Chardigny y col., 2007). 1.1.8.2 Legislación y Regulación de los Ácidos Grasos Trans La Consulta de Expertos de la OMS/FAO de 2002 sobre el Régimen Alimentario, la Nutrición y la Prevención de las Enfermedades Crónicas (OMS, Serie de Informes Técnicos, TRS, 916) concluyó que había pruebas convincentes de que el consumo de AGT aumenta el riesgo de sufrir enfermedades cardiovasculares. Además, recomendó que el consumo de AGT no supere el 1% del aporte energético alimentario diario y propuso que se realizaran esfuerzos para aumentar la cantidad de grasas monoinsaturadas y polinsaturadas en el suministro alimentario y los regímenes alimentarios humanos. Por lo que en el 2004 la Asamblea Mundial de la Salud adoptó una resolución que respaldaba la Estrategia Mundial sobre Régimen Alimentario, Actividad Física y Salud, que hizo de la eliminación de los AGT un punto clave para las acciones de los gobiernos en respaldo de dicha estrategia (www.pediatraldia.cl/GRASAS%202006/ eliminar _gra sas_trans.htm). 24 Los datos del consumo de AGT de las calorías totales consumidas diariamente en los países siguen siendo incompletos, sin embargo en algunos países se cuenta ya con una cifra estimada, por ejemplo, se calcula un consumo aproximado de 2 a 3 % (4,5-7,2 g/día) en los Estados Unidos, 3% (7,2 g/día) en Argentina, 2% (4,5 g/día) en Chile y de 1,1% (2,6 g/día) en Costa Rica. (www.pediatraldia.cl/GRASAS%202006/eliminar_grasas_trans.htm) Desde hace algunos años hay recomendaciones al respecto, por ejemplo, en el Cuadro 6, se muestra una recomendación para la ingesta de grasa que contempla los niveles de consumo de los diferentes ácidos grasos incluyendo AGT (Nilsson y col., 2002). Cuadro 6. Recomendación de la ingesta de grasa diaria (Organismo de Nutrición Nórdico 1996) % del total de calorías ingeridas Grasa total 25-30 Suma de grasa saturada y grasa trans <10 Grasa mono insaturada cis (ácido oleico) 10-15 Poli insaturadas 5-10 (no menor de 3) De la familia omega 3 1 (no menor 0.5) Fuente: Nilsson y col., 2002 Algunos países regularon y legislaron el contenido de AGT en los alimentos hace algunos años. El caso particular de Chile sirvió para que los países integrantes del MERCOSUR siguieran su ejemplo, de manera que Argentina, Uruguay, Paraguay y Brasil han establecido que un producto podrá declararse como libre de AGT si tiene 0.2 g ó menos de AGT/ porción. En Europa también tienen legislaciones al respecto, por ejemplo Dinamarca, cuya legislación indica que un producto podrá declararse libre de AGT si tiene menos de 1 g de AGT por cada 100 g de lípido. Estados Unidos a través de la FDA desde enero del 2006 estableció que debe contener 0.5 g ó menos de AGT por porción un producto para declararlo libre de AGT, este último caso es de gran importancia para México ya que Estados Unidos es su mayor importador y socio comercial (Guerrero, 2006). Para el caso particular de México solo se cuenta con la NOM-043-SSA2-2005 que establece lo 25 siguiente: “Se deberá informar acerca de la importancia de limitar al mínimo posible la ingestión de alimentos con alto contenido de azúcares refinados, colesterol, ácidos grasos saturados, ácidos grasos trans, sal y recomendar la utilización preferente de aceites vegetales”. 1. 2 Historia del Chocolate Cuando los aztecas en el siglo XII conquistaron la región donde se sitúa el México actual adoptaron de los Toltecas el arte de cultivar el cacao, utilizando las semillas de las habas, al igual que los Toltecas, como moneda de curso corriente, y ración cotidiana para los soldados, por su alto valor nutritivo y por sus propiedades de bebida refrescante (Kaarst, 1984). En el año de 1502, en el curso de su cuarto viaje hacia las “Indias Occidentales” topó Colón por primera vez con las habas de cacao durante su travesía por el Golfo de Honduras, al observar la carga de una embarcación indígena. Tiempo después Hernán Cortés pudo constatar el efecto tonificante de la bebida muy sazonada, el “cacau-atl” . Cuando la corte española probó previa adición de jarabe de azúcar de caña, dicha bebida, fue bien recibida, dando lugar al nacimiento de la materia prima que fue y es base aun de nuevos productos alimenticios. Si bien en España ya llegaba el cacao proveniente de América, fue hasta el siglo XVII que el cacao llegó a otros países europeos (Francia, Italia, Inglaterra, Holanda, Alemania y Suiza). A finales del siglo XVII las habas de cacao y sus derivados se vendían en las boticas, pero únicamente la gente que podía pagar su alto precio los adquiría. Fue hasta fines del siglo XVIII y principios del XIX que mediante la industrialización de la fabricación de cacao y chocolate se logró popularizar el consumo de dichos productos más ampliamente (Kaarst, 1984). El chocolate es un producto homogéneo elaborado a partir de la mezcla de dos o más de los siguientes ingredientes: pasta de cacao, manteca de cacao, cocoa, adicionado de azúcares u otros edulcorantes, así como de otros ingredientes opcionales, tales como productos lácteos y aditivos para alimentos, 26 encontrándose dentro de éste diferentes variedades (NOM-186-SSA1/SCFI2002). Actualmente solo en algunos países el consumo de chocolate es muy alto, como se muestra en la Figura 12, los países llamados del primer mundo, son los que principalmente consumen este producto, en tanto que muchos otros países no 0.8 1.5 1.8 1.8 2.1 3.4 3.9 4.4 4.4 4.5 5.2 5.4 5.7 7 7 7.7 8.2 8.6 8.7 8.8 9.4 9.6 12 10 8 6 4 2 0 Su iza Au str a lia Irla n No d a rue Re ga ino Un Ale ido m Din ania am arc a Be lgic a Su ec To ia tal EU 15 US A Fin lan d ia Fra nci a Ho lan da Au str a lia Ca na da Ita lia Gr ec ia Ja p Po on rtu g Es a l pa ña Bra z il Kg de chocolate per capita figuran en las estadísticas debido a su bajo consumo. País Figura 12. Consumo de chocolate por persona en Europa, Asia, Sudamérica y Estados Unidos de Norteamérica (kg/año). Fuente: Association of the Chocolate, Biscuit and Confectionery Industries of the EU/International Confectionery; Association Statistical Bulletin 2003. En México el consumo per capita de chocolate por año fue de 250 g en el 2005 (www.alimentariaonline.com), en el 2006 fue de tan solo 400 g (www. revistaejecutivos.org) y en el 2007 se registro un consumo per capita de 500 g, aun cuando la industria chocolatera ha realizado varias campañas publicitarias promoviendo el consumo de este producto (www.radiotrece.com). La industria chocolatera se divide en dos grupos importantes en cuanto a su producción: la industria que hace chocolate como tal y la industria que hace dulces que consisten en productos de cualquier tipo recubiertos de chocolate, es importante aclarar que “los productos elaborados o recubiertos con una mezcla de cacao en polvo, azúcar y manteca vegetal, no son considerados como productos de chocolate en el contexto de la confitería” (Edwards, 2000; Cakebread, 1981). 27 1.2.1 Características de la Manteca de Cacao La manteca de cacao, se obtiene de las semillas del cacaotero (Theobroma cacao). Las propiedades de la manteca de cacao incluyen un sabor y olor agradable, su comportamiento de fusión y textura a diferentes temperaturas le proporcionan un valor adicional. Por lo anterior, es la manteca de cacao el ingrediente que más influye en las características de textura, sabor y brillo de un chocolate (Chaiseri y Dimick, 1989). La manteca de cacao se caracteriza por tener triacilgliceroles simétricos, es una de las grasas vegetales que más se ha estudiado, principalmente por presentar un polimorfismo especial. En el Cuadro 7 (D’Souza y col., 1990) se resumen las fases y formas de los cristales de la manteca de cacao así como sus respectivos puntos de fusión. Cuadro 7. Polimorfismo y puntos de fusión en la manteca de cacao. Lovegren y col., 1976 Forma PF °C VI 13.0 Hicklin y col., 1985 Forma PF °C I 17.9 Davis y Dimick 1986 Forma PF °C I 17.6 Stauffer 1999 Forma PF °C I 17.3 V 20.0 II 24.4 II 19.9 II 23.3 IV 23.0 III 27.7 III 24.5 III 25.5 III 25.0 IV 28.4 IV 27.9 IV 27.3 II 30.0 V 33 V 34.4 V 33.8 I 33.5 VI 34.6 VI 34.1 VI 36.3 Fuente: D’Souza y col., 1990. El polimorfismo en las grasas esta relacionado con la apariencia visual dada por el tipo de cristal en el sistema. Una grasa bien cristalizada tiene una superficie lisa y con brillo, ya que los cristales están alineados y reflejan la luz. Para el caso de la manteca de cacao y en particular de los chocolates, si se presentan grandes agregados de cristales en la superficie, el producto adquiere 28 una apariencia mohosa indeseable, conocida como florecimiento de grasa o “fat bloom” , este problema puede deberse a: Polimorfismo, transformación de la forma V a la forma VI Presencia de material líquido en el sistema, de manera que las formas polimórficas inestables se funden en el material líquido y recristalizan en una forma más estable sobre la superficie de otros cristales. Variaciones en la temperatura de almacenamiento cercana a la temperatura de fusión provocando una recristalización (Beckett, 2000). El polimorfismo de la manteca de cacao indicado en el Cuadro 7, se confirma mediante los estudios por difracción de rayos X , En el Cuadro 8 se indican los datos de los espacios cortos correspondientes a cada una de las formas cristalinas de la manteca de cacao (D’Souza y col., 1990) . Cuadro 8. Polimorfismo de la manteca de cacao de acuerdo a los espacios cortos determinados por DRX. Espacio corto (Å) Forma polimórfica 4.29 MF 3.70 F 4.25 F 4.63 R, 4.25 F, 3.87 R 4.35 MF, 4.17 D 5.43 R, 4.60 MF, 3.99 R, 3.88 D, 3.76 R, 3.68 D 5.47 R, 5.16 D, 4.60 M, 4.28 D, 4.04 R, 3.88 F, 3.71 F Intensidad de señal: MF, muy fuerte; F, fuerte; R, regular; D, débil Fuente: D’Souza, 1990. I II III IV V VI En la manteca de cacao la forma V mediante DRX revela una línea muy fuerte a 4.6 Å, característica de la estructura β, la forma VI presenta espacios cortos similares solo que las líneas son de menor intensidad (D’Souza y col., 1990). 1.3 Grasas Alternativas de la Manteca de Cacao Un verdadero chocolate es aquel que tiene manteca de cacao. A nivel mundial existen algunas compañías cuya producción de chocolates es muy significativa, 29 dichas compañías utilizan mayormente manteca de cacao. Sin embargo, en México y muchos otros países las industrias han dado el cambio de usar chocolate hacia el compound, es decir, productos que saben y parecen chocolate pero no lo son. Las grasas que se utilizan en lugar de la manteca de cacao son grasas vegetales, conocidas como grasas alternativas de la manteca de cacao (www.revistaejecutivos.org). El origen de las grasas alternativas de la manteca de cacao se remonta a 1897, cuando la empresa danesa Aarhus Oliefabrik introdujo al mercado de la industria chocolatera una grasa de origen láurico (estearina). Durante el mismo periodo la empresa británica Loders and Nucoline producía ya las mantecas “sustitutas” elaboradas de estearinas láuricas (Jewell, 1988). Las mantecas vegetales inicialmente se usaron en la elaboración de chocolate y en coberturas de chocolate debido a que era imposible adquirir manteca de cacao fácilmente, tal fue el caso de la empresa Rowntree que durante la primera guerra mundial tuvo que recurrir al uso de las mantecas vegetales (Beckett ,2000). Los avances en hidrogenación de grasas después de la primera guerra mundial permitieron obtener nuevas grasas a partir del aceite de coco y aceite de palmiste. Para los años 50 ocurrieron dos descubrimientos en relación a las mantecas alternativas de la manteca de cacao, primero se determinó las características de los triglicéridos de la manteca de cacao, logrando entender el comportamiento físico de esta grasa y se encontró que ciertas grasas vegetales tenían los mismos triacilgliceroles que la manteca de cacao y el segundo suceso fue el escalamiento de técnicas de fraccionamiento de las grasas (Jewell 1988). En 1956 Unilever obtuvo una patente referente a un método para producir manteca que era casi idéntica a la manteca de cacao, se comercializó con éxito hasta 1960, se adicionaba al chocolate en cantidades variables, hasta que en 1977 se aprobó una ley en el Reino Unido en la que se restringía la adición de esta manteca a un 5%, para poderle seguir llamando chocolate al producto (Beckett 2000). Por otra parte en 1957 Loders y Nucoline desarrollaron un producto elaborado con la fracción media del aceite de palma y alguna otra grasa de las que se conocía tenían triacilgliceroles similares a la manteca de cacao (Cuadro 9), el 30 comportamiento fisicoquímico del producto fue parecido al de la manteca de cacao (Jewell, 1988). Las grasas alternativas de la manteca de cacao incluyen dos tipos de grasas, las que por su naturaleza tienen las características similares a la manteca de cacao y las que han sido alteradas por medio de procesos físicos, incluyendo la cristalización para incrementar el nivel de triacilgliceroles 2 oleoil disaturados (Jandacek, 1992). Cuadro 9. Contenido de triacilgliceroles palmítico-oleico-palmítico, palmíticooleico-esteárico y esteárico-oleico-esteárico en algunas grasas vegetales. Nombre genérico de la planta Burseraceae Dacryodes rostrata Dipterocarpaceae Shorea especies Vaterica indica Guttiferae Allan backia sp Garcinia indica Pentadesma butyracea Palmae Elaeis especies Sapotaceae Butyrospermum parkii Mimusops njace Palaquium oleosum Nombre común Composición de ácidos grasos (% en peso) Palmítico Esteárico Oleico (C16:0) (C18:0) (C18:1) Composición de triacilgliceroles. POP POE EOE Almendra de Java 11 40 44 X X XX Illipe manteca Dhupa manteca 21 39 38 X XX XX 10 39 48 X X XX Kagne manteca Kokum manteca Kenya manteca 3 53 44 X XX 3 56 39 X XX 5 46 48 X XX Aceite de palma 42 6 40 Shea manteca Njave manteca Siak manteca 7 39 49 X XX 4 36 58 X XX 6 54 40 X XX XX X Fuente: Jewell, 1998. A nivel comercial las grasas alternativas de la manteca de cacao se dividen en tres grupos, en la Figura 13 se muestra esta clasificación (Gunstone 2004). 31 ALTERNATIVAS (AMC) EQUIVALENTES Y MEJORADORAS (GEMC) REEMPLAZANTES (GRMC) SUSTITUTAS (GSMC) Figura 13. Grasas alternativas de la manteca de cacao. Fuente: Gunstone, 2004. I. Las grasas llamadas equivalentes (también se conocen como extensoresmejoradoras) se consideran compatibles con la manteca de cacao, la cantidad que puede ser adicionada a la manteca de cacao es limitada solo en bases legales y no funcionales de acuerdo a la Directiva 2000/36/EC. II. Las grasas reemplazantes se consideran parcialmente compatibles con la manteca de cacao (Gunstone, 2004). Tienen un bajo costo (Jandacek, 1992). Los principales aceites que se utilizan son aceites de palma y de soya, se fraccionan y/o hidrogenan con el fin de obtener básicamente los ácidos grasos esteárico, palmítico y oleico tan característicos de la manteca de cacao. En el caso particular del ácido graso de 18 átomos de carbono y una instauración, puede encontrarse en su forma trans (ácido graso elaídico), resultando una configuración muy diferente a la del ácido graso oleico presente en la manteca de cacao. Aun así la compatibilidad puede llegar a ser alta, y posiblemente se puede obtener un producto con buenas características de cristalización (Beckett, 2000). III. Las grasas sustitutas pueden tener las mismas propiedades físicas que la manteca de cacao pero tienen una marcada diferencia en la composición de ácidos grasos, su incompatibilidad puede comprometer la calidad del producto (Gunstone, 2004). Las grasas sustitutas son grasas que se hacen a partir de aceite de coco o aceite de palmiste, por lo que se les denomina grasas láuricas, se puede considerar que fundan en el mismo rango de temperaturas que la manteca de cacao. Estas grasas tienen un gran contenido de trilaurina. Una limitante de estas mantecas, es que en ambientes húmedos o presencia de lipasas se efectúa la liberación de ácidos grasos, por hidrólisis, presentándose un desagradable sabor (comúnmente se le identifica con sabor a jabón) que corresponde al ácido graso láurico libre (Beckett, 2000). 32 1.3.1 Producción y Consumo de las Grasas Alternativas de la Manteca de Cacao Los altos costos de la manteca de cacao así como el abastecimiento inconstante y calidad variable, dieron lugar a que tuvieran gran aceptación estas grasas vegetales alternativas de la manteca de cacao, ya que la posibilidad de sustituir o extender la manteca de cacao con una manteca vegetal más económica ofrece una gran ayuda en cuestión de costos. Las grasas alternativas de la manteca de cacao se producen a partir de ciertos aceites, grasas y/o fracciones de los mismos. A continuación se mencionan los principales aceites y grasas que se utilizan para la elaboración grasas alternativas de la manteca de cacao. Aceite de palma y aceite de almendra de palma El aceite de almendra de palma se obtiene de la almendra del fruto de la palma de aceite (Elaeis guineensis), es rico en ácido graso láurico y mirístico. El aceite de palma se obtiene del mesocarpio carnoso del fruto de la palma de aceite (Elaeis guineensis). La oleína de palma es la fracción líquida, obtenida del fraccionamiento del aceite de palma, como su nombre lo indica contiene principalmente ácido oleico. La estearina de palma es la fracción con punto de fusión elevado obtenida del fraccionamiento del aceite de palma (White, 1992). Aceite de soya La soya (Glycine max (L.) Merr.) es una planta leguminosa de cultivo anual. El frijol de soya tiene gran demanda por ser considerada una fuente de proteína, de lecitina y de aceite. El aceite de soya que se obtiene del frijol es de 18 a 22 %, es rico en ácidos grasos poli insaturados, este aceite es ampliamente utilizado en la industria alimentaria (Nilsson y col., 2002). Manteca de Shea Proviene del árbol con el mismo nombre (Vitellaria paradoxa), el fruto de este árbol tiene una almendra de la que es extraída la manteca de Shea. La manteca 33 de Shea es rica en ácidos grasos esteárico y oleico. Es conocida también como manteca de Karite. (http://www.libertynatural.com/info/shea.htm) Manteca de IIlipe Se obtiene del fruto del árbol con el mismo nombre (Shorea stenoptra) en los bosques de Borneo en el Pacífico Sur; tiene características químicas similares a la manteca de cacao, aunque su punto de fusión es más alto (Kamel y Kakuda, 1992). Manteca de semilla de mango El mango (Mangifera indica) cuya semilla es rica en aceite, es de donde se obtiene el aceite que es semisólido a temperatura ambiente, pero al igual que la manteca de cacao funde a temperatura corporal, es similar su color al de la manteca de cacao. (http://www.oilsbynature.com). Manteca de sal Se extrae del fruto del árbol de Sal (Shorea robusta) crece en Indonesia y Malasia, Norte, Este y área central de la India. La almendra del fruto, es rica en manteca compuesta de ácidos grasos esteárico y oleico, en menor proporción ácidos grasos poliinsaturados. (http://www.oilsbynature.com) Aceite de coco El fruto de la palmera de coco (Cocos nucifera L.) es ampliamente utilizado para suplir las necesidades alimenticias de varias poblaciones. El aceite de coco se obtiene por extracción de la copra del coco, este aceite es altamente saturado y sólido a temperatura ambiente (White, 1992). En el Cuadro 10 (AarhusKarlshamn, 2008), se muestran los precios indicativos para el mes de Septiembre del 2008 de las grasas alternativas, estas grasas se cotizan en dólares debido a que pueden ser productos importados: 34 Cuadro 10. Precios indicativos para grasas alternativas de la manteca de cacao. Producto Costo Manteca de cacao 5.9 USD/Kg Grasa equivalente de la manteca de cacao 5.0 USD/kg Grasa reemplazante de la manteca de cacao 2.0 USD/kg Grasa sustituta de la manteca de cacao 1.8 USD/kg Fuente: AarhusKarlshamn, 2008 El consumo en México de las grasas alternativas de la manteca de cacao, es principalmente para elaborar coberturas y productos moldeados (“coatings”, “compounds” términos en inglés) un dato aproximado de consumo anual es (AarhusKarlshamn, 2008): GEMC 1000 toneladas métricas GRMC 2000 toneladas métricas GSMC 23000 toneladas métricas Como se mencionó algunos aceites y grasas que se usan para elaborar las grasas alternativas de la manteca de cacao provienen de frutos exóticos, las grasas hechas con ese tipo de materias primas se importan, por lo que su consumo es limitado por los costos (AarhusKarlshman, 2008). 1.3.2 Regulación del Uso de Grasas Alternativas de la Manteca de Cacao Por otra parte, en relación particular a la producción de chocolates la Directiva del parlamento Europeo (Directive 2000/36/EC) y la FAO establece que el chocolate, el chocolate con leche -incluido el familiar-, el chocolate blanco, así como el chocolate a la taza, pueden contener hasta un 5 % de materias grasas vegetales distintas de la manteca de cacao. Estas mantecas vegetales, grasa de Illipe´ (Shorea spp.), aceite de palma (Elaeis guineensis y Elaeis olifera), sal (Shorea robusta), shea (Butyrospermum parkii), kokum gurgi (Garcinia indica) y almendra o hueso de mango (Mangifera indica), solas o mezcladas, son equivalentes de la manteca de cacao y constituyen, pues, grasas vegetales no laúricas, miscibles en cualquier proporción con la manteca de cacao y compatibles con sus propiedades 35 físicas y deben obtenerse mediante tratamientos de refinado o de fraccionamiento (Directive 2000/36/EC). Para el etiquetado la Directiva Europea indica para los productos de chocolate en uno de sus apartados que: La etiqueta de los productos de chocolate que contengan materias mantecas vegetales (permitidas) distintas de la manteca de cacao deberá contener la mención, bien visible y legible, «contiene grasas vegetales además de manteca de cacao», en el mismo campo visual que la lista de ingredientes, claramente diferenciada de dicha lista, en caracteres de al menos igual tamaño, en negrita y situada cerca de la denominación de venta. La adición de mantecas vegetales distintas de la manteca de cacao además de estar restringida a un 5% conlleva ciertas recomendaciones: la restricción de dicho nivel para grasas vegetales de origen tropical, expresadas en equivalente de manteca de cacao; exclusión de las grasas obtenidas por procesos químicos/enzimáticos; la existencia previa de un método confiable de detección y control de contenido de grasas; dos tipos de etiquetado para las distintas descripciones, la lista de ingredientes y la nota “contiene mantecas vegetales distintas de la manteca de cacao” en letras claramente impresas en la cara principal del producto empaquetado final, para asegurarse que los consumidores estarán adecuadamente informados. Muchos productores y consumidores consideran un engaño el uso de las grasas alternativas, y les llaman chocolates falsos a los productos elaborados con estas grasas. Considerando la adición de grasas equivalentes, que si están permitidas en 5% máximo, la detección de estas grasas es difícil, ya que presentan ácidos grasos que tiene la manteca de cacao, en un chocolate se complica aun más el determinar si es que tiene alguna manteca equivalente y en que proporción, ya que solo lo sabe el productor, y en muchos casos no lo declara. Se han realizado 36 diversos trabajos de investigación, en los que se han desarrollado procedimientos de detección y cuantificación de mantecas equivalentes en chocolates, basándose en los patrones de triacilgliceroles, en modelos matemáticos, etc. Los resultados son prometedores, inclusive algunos de estos trabajos están ya validados (Buchgraber y col., 2004; Dionisi y col., 2004; Guyon y col., 2004; Buchgraber y col., 2007). Es importante aclarar, que en Europa, las grasas alternativas que se usan son las equivalentes, y no se acoge la idea de usar grasas reemplazantes y sustitutas como sucede en América Latina, en donde la situación pareciera ser inversa, ya que los productos de chocolate análogo con grasas reemplazantes y sustitutas son los que más abundan. En México, se reguló de manera diferente a Europa el uso de grasas alternativas, en primer lugar, no se limita el empleo de grasas alternativas por su origen, en segundo lugar, se establece un máximo de 5% de grasa como máximo a adicionar, del total de las grasas del producto terminado, sin reducir el contenido mínimo de las materias de cacao, mientras que en la legislación europea el 5% aplica al porcentaje total de la fórmula. La información comercial de los chocolates o productos con chocolate deben cumplir con lo indicado en la NOM186-SSA1/SCFI-2002. En el apartado 12.2.1.8.1.1 (NOM-186-SSA1/SCFI-2002) indica: Aquellos productos que no cumplan con las especificaciones señaladas, deben utilizar el término chocolate anteponiendo el texto “Sabor a”, usando la misma tipografía que la de la denominación. (www.economia.gob.mx). En el aparatado 12.2.1.8.1.2 (NOM-186-SSA1/SCFI-2002) señala, “Cuando en la elaboración de los productos objeto de esta norma se utilice una grasa diferente a la manteca de cacao se deberá hacer mención del origen de la misma” (www.economia.gob.mx) 1.4 Producción de Chocolate y Chocolate Análogo El número de adeptos al chocolate ha ido en aumento a los largo de los años, este producto de confitería tiene gran aceptación por personas de todas las 37 edades. En la actualidad hay gran cantidad de productos de chocolate o que llevan chocolate, una clasificación de estos productos es (Jorge, 2007): Productos sólidos o macizos Productos recubiertos o bañados Productos rellenos Productos huecos Los productos sólidos están constituidos por una masa compacta de chocolate y se elaboran a partir de materias primas tradicionales. Existen otros productos que por su composición e ingredientes, son muy cercanos a un chocolate ya que aun llevan licor de cacao y manteca de cacao. Sin embargo existen también productos de chocolate sin chocolate, es decir que solo se asemejan al chocolate, ya que estos son productos en los que la cocoa es acompañada de alguna manteca vegetal y de azúcar, el licor de cacao y manteca de cacao como tal ya no están presentes en las formulaciones, estos productos abundan en el mercado de confitería en varios países, por ejemplo México (www.radiotrece.com.mx). 1.4.1 Proceso de Elaboración de Chocolate La elaboración de chocolates o chocolate análogo se realiza en varias etapas (Jorge, 2007): Mezclado Refinación Concheo Atemperado (nucleación, cristalización, solidificación aparente) Moldeo Mezclado. Tiene la función de lograr una unión, lo más uniforme posible, de todas las materias primas y lograr una masa compacta donde no se distingan componentes sin mezclar. En esta operación el parámetro fundamental es el tiempo de mezclado. Normalmente una mezcla rica en grasa requiere menos 38 tiempo que una magra. En igualdad de grasa, un mezcla sin leche lleva menos tiempo que una que si la tiene. Sin embargo otros factores también influyen en el tiempo de mezclado, como las características físicas de las materias primas, la temperatura de la grasa, la humedad de los ingredientes (presencia de agua dificulta todas la operaciones), el tipo de leche. La forma en que se adicionan los ingredientes es muy importante, si es gradual será mejor y más rápido se mezclarán (Jorge, 2007). Refinación. Aumenta progresivamente la finura de la pasta o masa de chocolate, humectándola y homogeneizándola. Si bien el objetivo es lograr finura, debe cuidarse no se llegue a un tamaño de partícula exageradamente pequeño, ya que aumenta el área superficial, implicando mayor cantidad de grasa para recubrir dichas superficies. Se reporta que además de la disminución de tamaño de partícula, ocurren cambios de sabor. La refinación define la granulometría lo que influye en aspectos de calidad como fusión al paladar, arenosidad, aspereza y fluctuaciones en sabor y color. (Jorge, 2007) Concheo. Proceso en el que se desarrolla el sabor o “flavor” y se convierte el chocolate en un líquido que fluya libremente, esto implica que se recubran las superficies de las partículas sólidas con grasa, de modo que estas puedan deslizarse unas junto a otras (Beckett, 2000). En este proceso se reduce la humedad, se eliminan los ácidos volátiles, y en el caso de los granos de azúcar son redondeados (se eliminan las formas puntiagudas) mejorando las características de textura (Jorge, 2007). Atemperado. Es conocido también como la formación controlada de “semillas” de cristales estables, en un número apropiado y consta de: Nucleación, crecimiento e incremento en tamaño de los núcleos primarios y la solidificación aparente (Beckett, 2000). La manteca de cacao tiene una composición de ácidos grasos y a su vez una composición de triacilgliceroles que ocasionan polimorfismo (6 estados cristalinos diferentes) en su cristalización. El atemperado asegura que solo se formen cristales V o β. El apropiado atemperado da al chocolate la solidez y 39 características de fundido deseadas (Stauffer, 1999). El atemperado puede realizarse en equipos especiales o de manera artesanal, manual (tableo). Existen varias formas de asegurar la cristalización deseada, una de ellas es mediante el atemperado, actualmente se emplea una forma muy novedosa, que consiste en sembrar cristales (forma V), ó trabajar la masa de chocolate a temperaturas específicas para crear los cristales deseados (Jorge, 2007). En la Figura 14, se indican las etapas para atemperar masa de chocolate, es importante tener estricto control de la temperatura, ya que la cristalización puede efectuarse sin percatarse, en tal caso deberá fundirse nuevamente toda la masa de chocolate. Masa de chocolate caliente Temperatura: Superior al punto de fusión de β (33.8°C) Enfriamiento rápido Masa todavía sin grasa cristalizada Temperatura: Algo superior al punto de fusión de β Enfriamiento lento Cristalización en la masa aumenta la viscosidad Temperatura: Entre los puntos de fusión de β’ y β 30.7-33.8°C’ Calentamiento Masa bien atemperada suficientes cristales de la forma β Temperatura: Superior al punto de fusión de β’ pero inferior al de β Enfriamiento rápido Producto final proporción de grasa de forma β estable Figura 14. Diagrama del proceso de atemperado del chocolate Fuente: Jorge, 2007. Moldeo. Es la etapa en la que se dará forma a la masa de chocolate. Previamente se indicó la amplia gama de chocolates que se pueden elaborar dependiendo de la forma que se le de a la masa de chocolate. Es muy importante la contracción de la fase grasa para la apariencia y brillo, si hubiera mala contracción se dificultará la salida del producto del molde, ocasionando ralladuras o fracturas que 40 afectan su apariencia. También el brillo y apariencia se ve afectado por la temperatura y humedad al llenarse los moldes, así como a la velocidad de enfriamiento del producto ya colocado en el molde (Jorge, 2007) Es importante que se formen tanto el tipo como la cantidad adecuada de cristal deseado, de ser así, al momento de desmoldar el producto saldrá fácilmente de los moldes, ya que hubo buena contracción, evitándose pérdidas por partiduras o daños en el producto. Algunas de las etapas claves en el moldeo son (Jorge y col, 2001): Atemperado adecuado del chocolate Moldes limpios a temperatura correcta (24-26°C chocolate) (4°C debajo de la temperatura de trabajo para grasas no atemperables) Deposito de chocolate en los moldes Uniformidad Vibración de moldes, para expulsar aire en la masa de chocolate Enfriamiento inicial de 10-12 °C, enfriamiento de 6-8 °C, calentamiento de 12-14 °C. Desmolde 1.4.2 Tecnología para la Utilización de las Grasas Alternativas de la Manteca de Cacao en la Elaboración de Chocolate Análogo Se puede usar una línea tecnológica que es destinada para elaboración de chocolate con manteca de cacao para elaborar productos hechos con mantecas alternativas de la manteca de cacao, sin embargo existen otras tecnologías que son muy utilizadas actualmente, estas tecnologías tienen ventajas, como la disminución de espacio utilizado (los equipos no son grandes), disminución de mano de obra, disminución de gastos de energía, etc. Los métodos se conocen como sistemas completos. Sistemas completos o “All in”. Los sistemas totales pueden dividirse en líneas generales en sistemas de Molinos de bolas y tipo Mcintyre o Universal. 41 Sistema Mcintyre Sistema Martín LLoveras. Universal Molinos de bolas Weiner Sistema Mazzetti. WaFa (molino de bolas) En el caso particular del molino de bolas, es un equipo que no realiza un concheo como lo define la tecnología tradicional, pero homogeniza logrando una textura final adecuada. En el molino de bolas, el refinado y la homogenización de la masa se realiza de forma muy eficiente y uniforme. El refinado de la masa se obtiene con la combinación del giro de dos ejes y las micro esferas contenidas en el tanque de molienda, logrando una gran homogeneidad en la finura del producto (Jorge, 2007). 1.5 Evaluación Sensorial Desde la antigüedad el hombre de manera conciente o inconciente, ha rechazado o aceptado los alimentos según sea la sensación que le producen al observarlos e ingerirlos. El chocolate es un caso especial al realizar una evaluación sensorial, ya que este producto más que pretender satisfacer las necesidades nutricionales, esta enfocado a brindar una sensación de placer, por lo que sus atributos sensoriales son los que determinan la calidad del mismo (Rodríguez, 2002). En la evaluación sensorial los instrumentos de medición son los sentidos humanos: vista, oído, gusto, olfato y tacto. Las señales visuales son importantes en el control de la calidad de las materias primas o del proceso y las impresiones visuales influyen decisivamente en la actitud del consumidor hacia el producto. Por ejemplo, es difícil que el consumidor acepte con agrado un chocolate que presenta una superficie blanquizca “fat bloom”. Es muy importante diferenciar entre el olor y aroma. El primero es la percepción de sustancias volátiles por medio de la nariz. En cambio el aroma es la detección después de haberse puesto el alimento en la boca; o sea que el aire, en el caso del aroma, no es el medio de transmisión de la sustancia, sin la 42 membrana mucosa del paladar. Los sabores se perciben cuando se ponen en contacto los alimentos con la superficie de la lengua. La unión del gusto y del olfato se denomina “analizador químico”, por ser la energía química la que estimula a ambos. En la bibliografía inglesa esta relación se conoce como por “flavour”. Cuando se habla de sabor, se incluyen las sensaciones olorosas retronasales (Rodríguez, 2002) El sentido del oído es muy importante en la percepción de la textura de los alimentos, por ejemplo, un atributo importante en la evaluación de la textura de tabletas de chocolate es el sonido al partir “snap” que está muy relacionado con la fragilidad del producto. En la evaluación sensorial de los alimentos, las percepciones táctiles por medio de los dedos, la palma de la mano, la lengua, las encías, la parte interior de las mejillas, la garganta y el paladar, son muy importantes, ya que es donde se detectan los atributos de textura de los alimentos. De manera general se definen cuatro características básicas en todos los alimentos: apariencia, olor, sabor y textura (Jorge y col., 2001). Apariencia La apariencia agrupa el conjunto de propiedades del producto que se detectan mediante los receptores visuales, como son, entre otras: color, tamaño, forma, brillo, aspecto de la superficie. Por ejemplo para evaluar la apariencia de los chocolates las muestras se deben colocar en un “área visible”, donde se colocarán piezas completas y partidas, de manera que los catadores evalúen la apariencia de las muestras (Capdevila y Jorge, 2005). Los atributos a evaluar en la apariencia externa pueden ser: forma, superficie, color y brillo, los catadores deberán prestar atención a la presencia de defectos tales como deformaciones, piso hundido, ralladuras, superficie con apariencia blanquizca “fat bloom”, migración de grasa o humedad, orificios, falta de brillo, color atípico, etc. En la apariencia interna se pueden evaluar espacios ocasionados por burbujas o partículas sólidas. La apariencia es muy importante en la evaluación de la calidad de los productos de chocolate, los atributos que la componen pueden reflejar deficiencias en el 43 proceso productivo, por ejemplo la estabilidad y conservación del brillo está influenciada por el atemperado, las condiciones de almacenamiento y la manipulación del producto (Beckett, 2000). Olor. Percepción de sustancias volátiles liberadas en los objetos por medio de la nariz. Hay diferentes componentes aromáticos, por lo que es necesario al evaluar el olor medir la intensidad. Atributos típicos de olor y sabor para la evaluación de los productos de chocolate son: Intensidad del olor/sabor, definición del olor/ sabor del relleno (en caso de tenerlo), balance o armonía del olor/ sabor, pudiendo presentarse defectos reconocidos a través de los términos: olor/sabor extraño, rancio, envejecido, jabonoso, fermentado, etc. (Capdevila y Jorge, 2005). Textura. Es la característica que presenta mayor complejidad, es el conjunto de propiedades mecánicas, geométricas y de superficie (Rodríguez, 2002). Las propiedades mecánicas se relacionan con la reacción del producto a una fuerza. Hay cinco características elementales: dureza, cohesividad, viscosidad, elasticidad y adhesividad. Para evaluar chocolates se consideran las siguientes propiedades mecánicas: Dureza. Se refiere a la fuerza requerida para lograr la deformación o penetración en un alimento. En la boca la dureza se percibe comprimiendo el producto entre los dientes o entre la lengua y el paladar. Según sea la fuerza empleada aplicada, los términos descriptivos son: blando, firme, duro. Suavidad. La suavidad o granulosidad es un atributo geométrico relacionado con la percepción del tamaño y forma de las partículas en el producto. Se usan términos descriptivos como: suave, arenoso, grueso. Derretimiento. Es un atributo que mide la velocidad de derretimiento del chocolate o relleno si es que lo tuviera. 44 Cremosidad. Atributo que está relacionado con el sistema graso empleado. Mide la sensación de llenura de la boca. Cerosidad. Define la sensación textural grasosa que persiste en el interior de la boca, es un defecto grave que se presenta fundamentalmente con el uso de mantecas vegetales. Los atributos geométricos están relacionados con el tamaño, forma y distribución de las partículas en el producto. Los atributos de superficie están relacionados con el contenido de humedad y/o grasa. En la boca están también relacionados con el modo en que estos constituyentes son liberados (Rodríguez, 2002). Para realizar una evaluación sensorial hay que tener en cuenta el área donde se realizará, la presentación de las muestras, el tipo de información en la hoja de evaluación. Las condiciones ambientales son muy importantes en una evaluación sensorial, por ejemplo: área silenciosa, libre de distracciones, adecuada, ventilación adecuada, superficies libres de olores. iluminación Las muestras deben ser codificadas preferiblemente usando un número aleatorio de tres cifras. El código deberá ser diferente para cada prueba. Las escalas son medios usados en el análisis sensorial por los jueces, y estas permiten hacer explícitas las percepciones de los jueces en relación a un estímulo dado. Las escalas se usan para medir o comparar productos de acuerdo a atributos sensoriales, o pueden cuantificar el nivel de agrado o desagrado de una muestra. La escala de intervalo implica iguales distancias entre objetos para medir el tamaño de las diferencias, tienen una unidad de medida, por lo que las diferencias entre las asignaciones numéricas son importantes. Hay una gama amplia de escalas de intervalos, existen las escalas lineales que pueden ser estructuradas, semi estructuradas o no estructuradas (Rodríguez, 2002). 45 1.6 JUSTIFICACIÓN Actualmente las industrias productoras de chocolates en México utilizan las grasas alternativas de la manteca de cacao por ser más económicas. Dado que no se han realizado estudios en México sobre estas grasas, es necesario tener mayor información de las mismas, por lo que se analizarán aspectos fisicoquímicos, térmicos (mediante calorimetría diferencial de barrido y resonancia magnética nuclear), de cristalización y polimorfismo (mediante difracción de rayos X, microscopia y resonancia magnética nuclear) para profundizar en las similitudes o diferencias en relación a la manteca de cacao. La manteca de cacao aporta en gran parte las características sensoriales y funcionales en el chocolate, y dado que en la actualidad muchos productores están fabricando sus productos con grasas alternativas de la manteca de cacao, es importante y necesario evaluar la funcionalidad y los atributos sensoriales, y en base a los resultados ampliar la información de las ventajas o desventajas que aportan estas grasas a los chocolate análogos. Además en la actualidad es de gran interés para los productores de alimentos, la adopción de prácticas de comercialización responsable que apoyen a la promoción y comercialización de alimentos con bajo contenido de grasas saturadas y ácidos grasos trans. Debido a que muchas de las grasas y aceites son parcialmente hidrogenadas, representan una fuente de ácidos grasos trans, el consumo de este tipo de ácidos grasos perjudica a la salud del consumidor, por este motivo se determinará en las grasas alternativas de la manteca de cacao el perfil de ácidos grasos por cromatografía de gases y se cuantificará el contenido de ácidos grasos trans y de esta manera brindar a toda persona interesada en el tema, información que sea de ayuda para la elección de que grasa constituye una mejor opción. 46 II. OBJETIVOS 2.1 OBJETIVO GENERAL Analizar física y químicamente grasas de origen vegetal utilizadas como alternativas de la manteca de cacao, así como evaluar tecnológica y sensorialmente chocolate análogo elaborado con dichas grasas. 2.2 OBJETIVOS ESPECÍFICOS: I. Analizar parámetros fisicoquímicos en las grasas alternativas de la manteca de cacao. II. Determinar el perfil de ácidos grasos y cuantificación del contenido de ácidos grasos trans en las grasas alternativas de la manteca de cacao. III. Caracterizar las propiedades térmicas, de cristalización y polimorfismo de las grasas alterativas a la manteca de cacao IV. Utilizar grasas alternativas de la manteca de cacao en la elaboración de chocolate análogo. V. Determinar las condiciones tecnológicas para una correcta cristalización en productos de chocolate análogo. VI. Evaluar la funcionalidad de las masas de chocolate análogo en la elaboración de tabletas, y los atributos físicos de las mismas. VII. Evaluar sensorialmente las tabletas de chocolate análogo. 47 III. MATERIALES Y MÉTODOS 3.1 Materias primas En el presente trabajo se usó manteca de cacao como referencia para el análisis de las grasas alternativas de la manteca de cacao. La manteca de cacao fue proporcionada por la empresa mexicana DCMX Cocoa, S.A. de C.V. y el Instituto de Investigaciones para la Industria Alimenticia (Habana, Cuba). Las grasas alternativas de la manteca de cacao que se utilizaron en este trabajo de acuerdo a la NMX-F-009-SCFI-2005 son materias grasas del tipo “mantecas vegetales” indicados sub-tipo 5, en la que de acuerdo al proveedor recibieron los procesos norma anteriormente citada. Las grasas que fueron proporcionadas por la empresa AarhusKarlshman S.A. de C.V. (México), son: Grasa equivalente de la manteca de cacao (GEMC) Grasa reemplazante de la manteca de cacao (GRMC) Grasa sustituta de la manteca de cacao (GSMC) En el presente trabajo el producto elaborado con grasas vegetales es nombrado “Chocolate Análogo”. Las materias primas que se utilizaron para elaborar los chocolates análogos se listan a continuación y fueron proporcionados por el Instituto de Investigaciones para la Industria Alimenticia (Habana, Cuba): Leche descremada en polvo (Sancor Coop Unidos Sanchales, Argentina) Cocoa alcalinizada (Infelersa SA Guayaquil, Ecuador) Lecitina de soya (Cuba Oficina Gral. Procesadora) Vainillina (Rhovanil Roída, Francia) Azúcar refino (Caeté Grupo Lyra, Cuba) 48 3.2 Reactivos En el Cuadro 11 se listan los reactivos que se utilizaron en cada uno de los análisis fisicoquímicos Cuadro 11. Reactivos empleados en el análisis fisicoquímico de grasas y aceites. Reactivo Análisis Cloroformo grado reactivo Índice de yodo / valor de peróxido Solución de Wijs Índice de yodo Yoduro de potasio Índice de yodo / valor de peróxido Almidón de papa Índice de yodo / valor de peróxido Tiosulfato de sodio Índice de yodo / valor de peróxido Ácido clorhídrico Índice de yodo Dicromato de potasio Índice de yodo / valor de peróxido Ácido acético Valor de peróxido Ácido salicílico Valor de yodo / valor de peróxido Fenoftaleína Ácidos grasos libres Alcohol etílco Ácidos grasos libres Hidróxido de sodio Ácidos grasos libres Nitrógeno Cromatografía Hidróxido de sodio Metilación de ácidos grasos Metanol grado cromatográfico Metilación de ácidos grasos Helio Cromatografía Aire comprimido Cromatografía Oxígeno Cromatografía Estándar de 36 ácidos grasos Cromatografía Trifloruro de boro Metilación de ácidos grasos Hexano grado cromatográfico Cromatografía Pentano grado cromatográfico Cromatografía 49 3.3 Material de Laboratorio Material de laboratorio de uso común (vasos de precipitado, matraces Erlenmeyer con y sin tapón, matraces de bola de fondo plano, refrigerantes, buretas micropipetas y pipetas de diferentes capacidades) Termómetros de intervalo de -2°C a 68°C. Tubos capilares de 1mm de diámetro interno y 2 mm de diámetro externo, de 50 mm de longitud. Portaobjetos (71mm x 26 mm x 1 mm), cubreobjetos (24 mm x 24 mm), tubos capilares sin heparina 75 mm con diámetro interno 1.5 mm. Moldes para chocolate de policarbonato Tubos de vidrio de 10 mm de diámetro y 189 mm de longitud con tapones de plástico para equipo de resonancia magnética nuclear (RMN). 3.4 Equipos Parrilla eléctrica con regulador de agitación y calentamiento. Balanza analítica Digital A&D Company Limited Max 120 gr d=0.1 mg. Colorímetro Lovibond White Light Gabinet Salisbury England. Cromatógrafo de Gases. Marca: Agilent Technologies 6890N Network System. Injector: 7683B Series (On Colon). Detector: FID (Detector de Flama). Columna: Capillary 100.0m x 250µm x 0.2µm, Modelo No. J / W 112-88A7, 250°C máximo (HP-88) (AarhusKarlshman, México). Equipo de resonancia magnética nuclear. Minispec Modelo: Mq20, Brucker Serie MOVAC 000232/NA 870. Baño seco con 4 compartimentos con porta tubos integrados, para colocar en ellos los tubos de vidrio, con programa de temperatura deseada, con una variación de ± 0.1 °C. (AarhusKarlshman, México). Microscopio Axiophot 1 Zeiss, México con un procesador de imágenes KS400 Zeiss, se usó el filtro polarized Light. Se trabajó con el objetivo 40x. Intensidad de luz 1/1000 (Central de microscopia, ENCB-IPN). 50 Calorímetro diferencial de barrido. Equipo marca Perkin Elmer modelo Diamond DSC, con sistema de enfriamiento, intervalo de temperaturas de trabajo de -50°C a 200°C. Celdas de acero inoxidable (Central de espectroscopia, ENCB-IPN). Equipo de difracción de rayos X. Marca Bruker modelo D8 Discover Generación de radiaciones a partir de tubo de Cobre. Software Difract Plus operando en el modo 2θ. Celda de policarbonato para muestras. (Laboratorio de difracción de rayos X, ESFM-IPN). Molino de bolas. WA-FA. Modelo WA-FA 20 de Esferas. Potencia 1.5kW. Dimensiones: Altura 1.05 m Largo 0.73 m y Ancho 0.55 m. Para mezclado de materias primas, refinado, conchado .Tanque cilindro con doble pared aislante, dotado en su interior de agitador y esferas. Bomba para reciclado y descarga de producto. Sistema de termostato autónomo. (IIIA, Cuba). Mesa con cubierta de mármol. Túnel de enfriamiento 6 m de largo las dimensiones del túnel 0.35 m de ancho por 0.12 m de altura. Mesa con banda vibradora de 2 m de longitud. (IIIA, Cuba). 3.5 Métodos Analíticos 3.5.1 Ácidos Grasos Libres AOCS; Ca 5a-40 (1994) Los ácidos grasos libres son parte de la molécula del triacilglicerol, separados del glicerol generalmente por medio de hidrólisis que puede ser ocasionada por la acción de lipasas. La descomposición de las grasas y los aceites comestibles por hidrólisis tiene implicaciones en el sabor y olor. La determinación de los ácidos grasos libres existentes en una muestra de aceite o grasa se puede realizar mediante la titulación con álcali. Aplicable a todos los aceites y grasas vegetales y animales, crudos o refinados. 51 Preparación de soluciones: Alcohol etílico del 95 %, el alcohol debe de dar un punto final definido y distintivo con la fenolftaleína, debiendo de ser neutralizado con álcali hasta dar un vire rosa permanente, justo antes de ser usado. Solución indicadora de fenolftaleína, al 1 % en alcohol del 95 %. Se prepara una solución de hidróxido de sodio, recientemente estandarizada, que deberá ser apropiada, dependiendo del intervalo de concentración de ácidos grasos libres esperados en la muestra. Procedimiento La muestra en caso de ser sólida, se funde y se mezcla. No se debe calentar más de 10 º C arriba del punto de fusión. Se pesa la cantidad dentro de un matraz Erlenmeyer de 250 ml. Se adiciona la cantidad especificada de alcohol neutralizado y unas gotas del indicador. Se titula con una solución estándar de hidróxido de sodio 0.1 N, se agita vigorosamente hasta la aparición del primer color rosa permanente, de la misma intensidad del alcohol neutralizado anteriormente, el color se debe mantener por 30 segundos. Cálculos El porcentaje de ácidos grasos libres, en la mayoría de las grasas y aceites, se calcula como oleico, otros casos como el aceite de coco ó el de almendra de palma (PKO) se expresa como ácido láurico y el aceite de palma se expresa en términos de ácido palmítico. A).- % ácidos grasos libres como oleico = mL de álcali x N x 28.2 /Peso de muestra B).-% de ácidos grasos libres como láurico = mL de álcali x N x 20.0/ Peso de muestra C).- % de ácidos grasos libres como palmítico= mL de álcali x N x 25.6/ Peso de muestra 52 3.5.2 Valor de Peróxido A.O.C.S; Cd 8-53, (1994) Durante el proceso de oxidación algunos de los compuestos que se forman son peróxidos. La determinación de miliequivalentes de peróxido por kilogramo de muestra, que oxidan el yoduro de potasio, permiten tener una noción del avance de la reacción de oxidación, siendo importante considerar que los peróxidos se convierten en cetonas y aldehídos, por lo que valores de peróxidos en etapas avanzadas de la oxidación pueden llegar a ser bajos. El presente método es aplicable a todas las grasas y aceites normales, incluyendo margarinas. Las siguientes soluciones se preparan: acético-cloroformo, 3-2, v/v, se mezclan 3 volúmenes de ácido acético glacial con 2 volúmenes de cloroformo. Para la solución saturada de yoduro de potasio (KI), se disuelve un exceso de KI en agua destilada (aproximadamente 10 g de yoduro de potasio en 6 mL de agua). Se almacena en la oscuridad cuando no se utilice. Cuando se este utilizando se verifica que la solución presente cristales de KI sin disolver, como indicador de que realmente esta saturada. Se prueba la solución saturada de KI por adición de 2 gotas de solución de almidón a 0.5 ml de la solución de KI en 30 mL de solución de ácido acéticocloroformo. Si un color azul se forma y este requiere más de 1 gota de solución de tiosulfato de sodio para desaparecer, se descarta la solución de KI y se prepara solución fresca. La solución de tiosulfato de sodio 0.1 N, exactamente estandarizada con dicromato de potasio como estándar, se prepara como se describe a continuación: Se disuelven 24.9 gr de tiosulfato de sodio en agua destilada y se diluye a 1 litro. Se utiliza como estándar primario dicromato de potasio que debe ser de partícula fina, el cual se seca a 105 ºC por 2 horas y se enfría en un desecador. Se pesan de 0.16 a 0.22 gr de dicromato de potasio dentro de un matraz de 500 ml. Se disuelve en 25 ml de agua y se agregan 5 ml de ácido clorhídrico concentrado, 20 ml de solución de yoduro de potasio y se agita. Se deja reposar 5 minutos en la oscuridad y después se adicionan 100 ml de agua destilada. Se titula con solución de tiosulfato de sodio, se agita constantemente hasta que una coloración amarilla casi desaparezca. Se agrega de 1 a 2 ml de indicador de almidón y se 53 continúa la titulación, se adiciona la solución de tiosulfato de sodio lentamente hasta el momento preciso en que la coloración azul desaparezca. El gasto de la solución de tiosulfato de sodio se expresa en términos de la normalidad: Normalidad de la solución del bisulfato de sodio = 20.394 X masa de K 2Cr2O7 /mL de solución de tiosulfato de sodio Se prepara la solución de tiosulfato de sodio, 0.01 N, exactamente estandarizada, adicionando exactamente 100 ml de solución de tiosulfato de sodio 0.1 N a un matraz volumétrico de 1 litro y se diluye al volumen con agua destilada. La solución indicadora de almidón al 1% se prepara agregando 1 gramo de almidón a una pequeña cantidad de agua destilada fría. Se agregan con agitación, 100 ml de agua hirviendo y se hierve por algunos minutos. Para probar la sensibilidad se colocan 5 ml de solución de almidón en 100 mL de agua y se agrega 0.05 ml de solución de yoduro de potasio 0.1 N. El color azul producido deberá desaparecer con 0.05 ml de tiosulfato de sodio 0.1 N. Para grasas y aceites, se pesan 5.0 gr + 0.05 gr de muestra dentro de un matraz Erlemeyer de 250 ml con tapón y se agregan 30 ml de solución acético-cloroformo 3: 2, se agita para disolver la mezcla. Se agregan 0.5 mL de solución saturada de KI usando una pipeta volumétrica. Se deja reposar la solución agitando ocasionalmente por exactamente 1 minuto y se agrega inmediatamente 30 mL de agua destilada. Se titula con solución 0.1 N de tiosulfato de sodio, se adiciona con agitación constante, hasta que el color amarillo del yodo casi desaparezca. Se agregan aproximadamente 2 mL de solución indicadora de almidón, se continua la titulación, con agitación constante, especialmente cuando se este cerca del punto final para liberar todo el yodo de la fase del solvente. Se agrega la solución de tiosulfato de sodio gota a gota hasta que el color azul desaparezca. Se realiza una determinación en blanco de los reactivos siguiendo el mismo procedimiento solamente que sin muestra. La titulación en blanco no debe exceder 0.1 mL de la solución de tiosulfato de sodio 0.1 N. Cálculos Valor de peróxido (miliequivalente de peróxido / 1 Kg de muestra) = (S - B) * N * 1000 /Peso de la muestra 54 Donde: B : ml titulación del blanco. S : ml de la titulación de la muestra. N : Normalidad de la solución del tiosulfato de sodio. 3.5.3 Color A.O.C.S Cc 13b-45 (1994) El color de los aceites y grasas es causado por una mezcla de pigmentos entre los cuales se encuentran algunos carotenos, clorofilas, luteína, licopeno, gosipol y otros. El color es uno de los atributos que caracterizan a los aceites y grasas ya sea en su estado natural o cuando han sido sometidos a procesos de refinación. Es aplicable este método a grasas y aceites en su estado líquido, asegurando que la muestra no presente turbidez al momento de la medición de color, se basa en la igualación de color de la muestra con la escala Lovibond. Se requieren tubos de vidrio claro con paredes pulidas y dimensiones de 19 mm. de diámetro interno, 22 mm. de diámetro externo y 154 mm. de longitud, ajustable al tintometro Lovibon. El tubo de color debe de tener 2 marcas. Una para indicar la columna de aceite de 133.35 mm (5 ¼”) y otro para indicar una columna de aceite de 25.4 mm. (1”). Comparador Lovibond construido de madera y de acuerdo a especificación AOCS. Papel filtro Whatman número 13 o equivalente. Estándares de color permanente: Rojo 0,1-0,9; 1-5,0; 6-10; arriba de 10. Amarillo 1-10, 10-20, y 20- 79 Los aceites o grasas refinados, blanqueados y deodorizados, generalmente no requieren de filtrarse, sin embargo se recomienda filtrar para retirar cualquier impureza. Se pone la muestra fundida y filtrada dentro del tubo de vidrio a la marca correspondiente y se inserta el tubo dentro del comparador. Se sostiene el tubo en posición vertical dentro del comparador y ver el color de la muestra con ayuda de la luz, tratar de ver el color del estándar comparable al de la muestra y realizar el registro correspondiente. Para aceites blanqueados, refinados y aceites deodorizados se usan las siguientes relaciones de amarillos y rojos: 55 10 amarillo hasta 1,5 rojo 15 amarillo hasta 2,0 rojo 20 amarillo hasta 2,5 rojo 25 amarillo hasta 3,0 rojo 35 amarillo hasta 3,5 rojo Se reporta el color de la muestra en unidades Lovibond indicando la suma de números de vidrios de color amarillo y de ser necesario también la altura de la columna usada, si no se usó la altura estándar establecida. 3.5.4 Humedad y Materia volátil NMX-F-211-SCFI-2006 Este método determina la humedad y cualquier otro material volátil bajo las condiciones del método. Ya que el agua tiende a asentarse en muestras que se han reblandecido o fundido, se debe tener cuidado para mezclar muy bien las muestras. Se debe ablandar la muestra con un calentamiento suave y se mezcla vigorosamente con un mezclador eficiente. Se pesan de 5g a 20g de la muestra bien mezclada en un vaso tarado que haya sido secado y enfriado previamente en el desecador. Se calienta la muestra sobre la placa eléctrica, se gira el vaso lentamente con la mano, para evitar que se salpique la muestra si hay ebullición muy rápida de la humedad. La aproximación del punto final se juzga por el cese de burbujas de vapor y también por la ausencia de espuma. Se juzga el punto final colocando un vidrio de reloj limpio y seco sobre el vaso. La presencia de vapor se indica por la condensación sobre el vidrio de reloj. No se debe calentar la muestra por arriba de 130°C, excepto al final de la prueba. Se calienta momentáneamente al punto de humeo incipiente cuando el punto final aparente ha sido alcanzado, se debe tener precaución de no sobrecalentar. Se enfría la muestra a temperatura ambiente en el desecador y se pesa. 56 Se expresa el resultado como: % Humedad y materia volátil=[ (M1- M2) / M1]x100 Donde: M1 = peso de la muestra inicial en gramos M2 = peso de la muestra final en gramos 3.5.5 Impurezas indeseables, Olor NMX-F-473-SCFI-2006 La concentración de substancias odoríferas en un aceite es generalmente muy baja; sin embargo, el número de constituyentes puede llegar a ser muy alto. Estos pueden ser eficientemente eliminados a través de cada uno de los pasos de la refinación y principalmente en la deodorización. Una eventual desviación durante el proceso de refinación o un inadecuado almacenamiento de los aceites refinados puede dar origen a la aparición de olores indeseables, por lo que se hace necesaria la evaluación. Este método se basa en el calentamiento del aceite o grasa y en el desprendimiento de sustancias volátiles que son evaluadas organolépticamente, a la temperatura establecida en la norma, y que son diferentes a los olores peculiares característicos de las semillas de donde procede el aceite o grasa. En el caso de que la muestra sea sólida a temperatura ambiente, esta se calienta en un baño maría, a temperatura controlada por encima de su punto de fusión, con el propósito de lograr una completa homogeneidad. Debe estar seca y libre de humedad y limpia, asegurando por filtración de la muestra caliente a través de un papel filtro de poro fino y de ser necesario agregando ayuda filtro a la muestra antes de filtrarla. Procedimiento Se pesan 50 g de muestra en un vaso de precipitado de 250 ml; se calienta en baño maría y cuando se obtenga una temperatura máxima de 60°C, se procederá a efectuar la prueba organoléptica, no se deben percibir olores extraños o rancios. Esta prueba se realiza por duplicado. Al realizarse la prueba, si se percibe un olor característico ligero, no desagradable y peculiar a las semillas u origen del cual procede, bajo la temperatura de experimentación determinada, se considerara el producto como aceptable. 57 3.5.6 Índice de Yodo A.O.C.S. Cd 1-25 (1994) El valor de Yodo es una medida de instauración de grasas y aceites y es expresado en términos de centigramos de yodo absorbido por gramo de muestra (% de yodo absorbido). Este método se basa en la reacción del monocloruro de yodo en medio acético con los ácidos grasos, y en medir la cantidad de yodo que está presente en forma libre. En función de este se determina el grado de insaturación del aceite. Es aplicable a las grasas y aceites normales. Se preparan las siguientes soluciones: Solución de yoduro de potasio al 15%. Solución indicadora de almidón al 1%, se debe realizar prueba de sensibilidad en la forma indicada en la técnica de valor de peróxido. La solución de tiosulfato de sodio 0.1 N deberá estar recién preparada y estandarizada con una solución estándar de dicromato de potasio, como se indicó en la técnica de valor de peróxido. Procedimiento Se funde la muestra, si no esta liquida (la temperatura durante el fundido y filtrado no debe exceder 10 ºC arriba del punto de fusión de la muestra) y se filtra a través de un papel filtro, para remover impurezas sólidas y algunas trazas de humedad (La filtración puede hacerse dentro de un horno de 80-85 ºC, pero debe completarse en 5 min ± 30 seg). La muestra debe de estar absolutamente seca. Después de filtrar, se deja la muestra filtrada a una temperatura de 68-71± 1 ºC, antes de pesar la muestra. Una vez que la muestra está a 68-71 ºC se pesa la muestra, dentro de un matraz de 500 ml, el peso de la muestra desde ser tal que deberá haber un exceso de solución Wijs de 100 a 150 % sobre la cantidad absorbida. El Cuadro 12 es una guía de la cantidad de muestra a pesar. Se adicionan 20 mL de tetracloruro de carbono o cloroformo sobre la muestra y se agita, asegurándose de que la muestra quede completamente disuelta. Se adicionan 25 mL de solución Wijs dentro del matraz conteniendo la muestra, se tapa el matraz, se agita la muestra para asegurar la mezcla y se pone el cronómetro a 30 minutos. Se guarda la muestra inmediatamente en un lugar oscuro durante el tiempo que dura la reacción a una temperatura de 25 ± 5 º C. 58 Cuadro 12. Peso de muestra en relación del índice de yodo del aceite o grasa. Valoy de Yodo esperado Menos de 3 3 5 10 20 40 60 80 100 120 140 160 180 200 Peso de gramos 150% de exceso 10.0000 8.4613 5.0770 2.5384 0.8461 0.6346 0.4321 0.3966 0.3173 0.2644 0.2266 0.1983 0.1762 0.1586 muestra en 100% de exceso 10.0000 10.5760 6.3460 3.1730 1.5885 0.7935 0.5822 0.3173 0.2538 0.2115 0.1813 0.1587 0.1410 0.1269 Exactitud de peso 0.0010 0.0050 0.0005 0.0002 0.0002 0.0002 0.0002 0.0001 0.0001 0.0001 0.0001 0.0001 0.0001 0.0001 Fuente: AOCS Cd 1-25 Se saca el matraz del almacenamiento y se adicionan 20 mL de solución de yoduro de potasio, se adicionan 100 mL de agua destilada. Posteriormente se titula con solución de tiosulfato de sodio 0.1 N, se debe adicionar gradualmente, con agitación constante y vigorosa, se continua la titulación hasta que el color amarillo casi desaparezca, se adicionan de 1 a 2 mL de solución indicadora de almidón y se continua la titilación justo a la desaparición del color azul. Se realiza al menos una determinación de blanco con cada grupo de muestras, simultáneamente. Cálculos: Valor de Yodo = (B - S) X N X 12.69 / Peso de muestra en g Donde: B = Titulación del blanco. S = Titulación de la muestra N = Normalidad de la solución del tiosulfato. 59 3.5.7 Punto de Fusión A.O.C.S. Cc 1-25 y Cc 3-25 (1994) Las grasas y aceites sean de origen natural o vegetal, son mezclas de glicéridos y otros componentes menores (pigmentos, esteroles, ceras y tocoferoles). El término punto de fusión no implica las mismas características que si estuvieran las sustancias con una naturaleza pura definida. Las grasas pasan a través de un estado de suavidad antes de convertirse totalmente en líquidas. El punto de fusión es entonces definido por las condiciones específicas del método que se utilice y ocurre a la temperatura en que la muestra viene a ser completamente limpia y líquida. En el caso del método de capilar abierto, el resultado es un índice de la temperatura a la cual viene a ser más suave o lo suficientemente fluida para deslizarse o correr dentro del capilar. Este método es aplicable a grasas como el aceite de coco, estearinas, grasas hidrogenadas y grasas duras. Se funde la muestra y se filtra a través de un papel filtro para remover las trazas de humedad e impurezas. Es esencial que la muestra esté completamente seca. Se sumergen al menos 4 tubos capilares limpios en la muestra líquida de tal forma que la muestra alcance aproximadamente 10 mm. de altura en cada tubo. Se enfría la muestra de tal forma que no se salga del tubo. Se identifican y se colocan los tubos a temperatura de 4-10 º C por 16 horas (puede ser por toda la noche) o una hora indicando el tiempo de prueba. Se sacan los capilares de dispositivo de enfriamiento y se sujetan con una banda de cinta teflón u otro medio al termómetro, de tal forma que el extremo bajo del tubo capilar este a la par con el fondo del bulbo de mercurio del termómetro. Se sujeta el termómetro dentro de un vaso de 600 mL lleno de agua destilada limpia a una temperatura de 8 a 10 ºC abajo de la temperatura de fusión esperada, se coloca el termómetro de tal forma que este sumergido en el agua hasta la marca de inmersión. Se agita el agua del baño con una barra magnética, se aplica calor de tal manera que la temperatura del baño se incremente a una velocidad de 1 ºC por minuto. Cuando se este cerca del punto final de la prueba (3 a 4 grados previos de la 60 temperatura de fusión esperada), se agita el agua del baño con una corriente suave de aire o con otro medio sustituible y se aplica calor de tal forma que el incremento de temperatura sea de 0.5 ºC por minuto. La grasa usualmente pasa de un estado de opalescencia a cristalino antes de fundir completamente. Se continúa calentando hasta que la columna de grasa comienza a ser clara y se deslice en cada uno de los tubos. Se registra la temperatura a la que la columna de grasa resbala o se desliza en cada tubo y se calcula el promedio de todos los tubos, se reporta el promedio como punto de fusión capilar o punto de deslizamiento. 3.5.8 Índice de Saponificación (AOCS; Ca 2d-25, 1994) El índice de saponificación es la cantidad de álcali necesaria para saponificar una cantidad definida de muestra. Se expresa como el número de miligramos de hidróxido de potasio (KOH) requerido para saponificar 1 g de muestra. Se disuelven de 35 a 45 g de hidróxido de potasio en 20 mL de agua y se diluye a 1 L con alcohol (95%). Se deja en reposo durante toda la noche y se decanta el líquido claro. Se pesan 2 g de aceite o grasa en un matraz cónico y se agregan exactamente 25 mL de la solución alcohólica de hidróxido de potasio. Se adapta un condensador de reflujo y se calienta el matraz en agua hirviendo durante 1 h. Se agita fuertemente. Se adiciona 1 mL de fenoftaleína (1%) y se titula en caliente el exceso de álcali con ácido clorhídrico 0.5 M (titulación “a” mL). Se realiza una prueba en blanco al mismo tiempo (titulación “b” mL). El índice de saponificación es entonces: IS = (b-a) 28,05 / Peso de muestra en g 3.5.9 Determinación de Perfil de Ácidos Grasos y Cuantificación de Ácidos Grasos Trans AOCS Ce 1f-96 (1994) Los ácidos grasos trans, son isómeros formados durante el proceso de refinación, deodorización ó durante el proceso de hidrogenación (la isomerización es 61 ocasionado por la alta temperatura), son compuestos con el mismo peso molecular, que los cis, pero geométricamente y/o en posición diferente. Mediante la introducción al puerto de inyección en un cromatógrafo de gases, de los ésteres metílicos de los ácidos grasos presentes en los aceites y grasas, se vaporizan y se transportan por un gas inerte a través de una columna empacada o capilar. Los componentes que eluyen de la columna pasan uno a uno por el detector, el cual genera una señal eléctrica proporcional, que es transformada por el integrador del equipo en una gráfica de la señal obtenida contra tiempo llamada cromatograma. Preparación de ésteres metílicos. Se pesa la muestra de grasa o aceite en un matraz de reacción de 50 o 125 mL de acuerdo al Cuadro 13, se adicionan los mL de NaOH 0.5 N en metanol correspondientes y se pone un dispositivo de ebullición. Se conecta al condensador y se calienta sobre un baño de vapor de 5 a 10 minutos. Se adiciona la cantidad especificada de reactivo BF 3 en metanol, y se coloca nuevamente el condensador. Después de 10 minutos se retira, y se deja enfriar, se adicionan 10 mL agua destilada. Se realiza la separación de los ésteres metílicos en un embudo de separación, adicionando 10 mL de N-pentano. Se evapora ligeramente el exceso de N-pentano para concentrar la muestra, se coloca la muestra en un vial para ser inyectada posteriormente al cromatógrafo. Cuadro 13. Relación de peso de muestra, solución de hidróxido de sodio y trifloruro de boro en metanol para la metilación de ácidos grasos. Muestra mg Matraz mL NaOH 0.5 N mL BF3-Metanol mL 100-250 50 4 5 250-500 50 6 7 500-750 125 8 9 750-1000 125 10 12 Fuente: ISC LAB 037. 2006 Se establecen las condiciones de operación del cromatógrafo de gases de acuerdo al Cuadro 14, midiendo la velocidad linear promedio del gas de arrastre. 62 Cuadro 14.Condiciones de operación para análisis fase estacionaria columna. Fase estacionaria SP2340 SP 2560 Condiciones de 192°C 170°C temperatura Isotérmica isotérmica Presión de columna 125 125 Velocidad He 15 cm/s 16 cm/s Fuente: ISC LAB 037. 2006 cromatográfico en función de CP TM Sil88 175°C isotérmica 130 19cm/s BPX-70 198° isotérmica 155 17cm/s Una vez que se establecen las condiciones de operación, rampas de temperatura y tiempos de permanencia a cada temperatura, se inyectan de 0.5 a 1 μL de ésteres metílicos. Al terminar el programa se compara el resultado obtenido con el cromatograma del estándar (previamente analizado), si la separación obtenida no es idéntica a la del estándar, se deberán realizar los cambios en la temperatura del horno en pasos, desde un grado, para obtener una buena separación, registrar las condiciones finales. La identificación de picos, para aceites y grasas parcialmente hidrogenadas con trans isómeros conteniendo dobles ligaduras se identificaran usando el concepto de equivalente de cadena larga. Para aceites y grasas parcialmente hidrogenadas, la separación del trans isómero C 18-1 y el isómero C18-1 9 cis deberá ser claramente detectado. El análisis cuantitativo salvo en casos excepcionales se puede realizar suponiendo que el total de componentes de la muestra están representados en el cromatograma, de tal manera que el total de las áreas bajo las curvas representan el 100% de los componentes (elusión total). Si el equipo incluye un integrador, se podrán utilizar los datos que este proporciona. En caso contrario se deberá determinar el área de cada pico multiplicando la altura por el ancho a la mitad de la altura del pico y, cuando sea necesario, tomando en cuenta las diferentes atenuaciones usadas durante el registro. 3.5.10 Contenido de Sólidos Grasos (IUPAC 2.150) Este método determina la cantidad de glicéridos sólidos en un aceite o grasa. Solo el pulso o longitud de la señal RMN (resonancia magnética nuclear) de la grasa líquida es medida. El total de contenido líquido se obtiene de la fusión y 63 medida de la muestra a 60 °C. Es aplicable a grasa plastificadas, y grasas para confitería con un contenido de sólidos de 95% a 10 °C. Se utilizan tubos de vidrio para medición, con tapón de plástico, para equipo Broker, medidas de de 10 mm de diámetro y 189 mm de longitud (proveedor Bruker Mexicana, S.A. de C.V.). Para el acondicionamiento térmico de las muestras, se requieren blocks de aluminio con agujeros perforados, o baños secos con compartimentos con diámetro de los espacios no mayor de 0.4 mm. que el diámetro externo de los tubos de medición. La profundidad de los orificios debe ser tal que el nivel de la grasa este 10 mm abajo de la superficie superior externa del block. La distancia entre los ejes de 2 orificios vecinos debe de ser de 7 mm., más grande que el diámetro de los mismos orificios. Se funde la muestra, teniendo cuidado de no sobrepasar los 10 ºC arriba del punto de fusión de la muestra, si es necesario se deberá filtrar. Se homogeniza perfectamente la muestra. Se coloca la muestra en los tubos de medición perfectamente limpios y secos, a una altura de 2 cm y se tapan. (Se pone muestra en tantos tubos, como temperaturas de medición se requieren). Procedimiento para el método de rutina sin usar pretratamiento especial. Se colocan los tubos en el baño de 60 ºC y se dejan por 15 minutos para muestras de grasas no láuricas y 30 minutos para muestras de grasas láuricas. Se transfieren los tubos al baño de 0 ºC. Se dejan en este baño por exactamente 60 2 minutos. Se retiran uno después de otro y se colocan en los porta tubos de los baños regulados, a las temperaturas de 10, 20, 30, 35 y 40 ºC, (uno por temperatura de medición). Después de 30 minutos de haber puesto cada tubo de muestra, se transfiere cada uno sucesivamente y tan rápido como sea posible, secándolo e introduciéndolo dentro del orificio del campo magnético del equipo de RMN, previamente se activó a la posición READY para hacer la medición. Tratamiento especial para grasas como la manteca de cacao. Se coloca la muestra en los tubos, se introducen al baño de 60 ºC y se mantienen por 30 minutos. Se pasan posteriormente al baño regulado a 0 °C y se mantienen por 90 minutos 5 minutos. Se sacan y se colocan en el baño regulado a 26 °C por 40 64 horas 0.5 horas. Después se colocan nuevamente en el baño regulado a 0 °C y se mantienen por 90 minutos 5 minutos y finalmente se colocan por 30 minutos en cada uno de los baños a temperatura de medición (10, 20, 30, 35 y 40 °C). Se realiza la lectura en el equipo Brucker como se describió en el procedimiento de rutina. 3.5.11 Estudio de Cristalización y Polimorfismo Método utilizando microscopio óptico con luz polarizada para la observación de cristales (Campos, 2005). Preparación de la muestra: Se calienta la grasa para borrar toda memoria de cristales a 80 °C y se homogeniza. Se tomar un poco de muestra con un tubo capilar precalentado, se coloca una gota (cerca de 10μL) en el portaobjeto (precalentado a 80 °C), inmediatamente se coloca un cubreobjetos (precalentado a 80°C) sobre la muestra, cuidando se forme una película de grosor uniforme. Se lleva inmediatamente al microscopio a la temperatura de estudio. Se observa la muestra utilizando los objetivos 10x o 40x usando luz polarizada, se determina bajo que objetivo se observa mejor la muestra y se capturan las imágenes de acuerdo al tiempo deseado o evento registrado (cristales). Método para análisis calorimétrico dinámico usando calorimetría diferencial de barrido (Pérez y col.,2005; Foubert y col., 2007). Se deberá calibrar previamente el equipo antes del análisis. Se pesan de 5-15 mg de muestra previamente fundida en una celda, se cierra herméticamente, se verifica que la celda de referencia este limpia. Se colocan las celdas dentro la cámara y se sella. Se aplica el programa de temperatura, de acuerdo a Foubert y col,. este consiste en: 10 minutos a 70 °C para asegurar que la muestra este completamente fundida, enfriar a una velocidad de 5 °C/min hasta llegar a 0 °C, se mantiene por 2 minutos a 0 °C, posteriormente se calienta a una velocidad de 65 5 °C/min hasta llegar a 70 °C. Se obtendrá el termograma correspondiente a la etapa de cristalización (exotérmica), así como a la etapa de fusión (endotérmica). Método empleando difracción de rayos X para la identificación de formas cristalinas (D´Souza y col., 1990) Las formas polimórficas son también distinguibles por las diferencias en el ángulo de inclinación de la unidad celular en el cristal. El análisis por difracción de rayos X mide los espacios cortos y espacios largos de una célula unitaria (de Man 1992). De manera particular los espacio cortos se usan para caracterizar las formas polimórficas. Empleando la difracción de rayos X, la muestra se expone al haz de rayos X para obtener todas las orientaciones posibles del cristal. Los valores de λ, d y θ correspondientes a la difracción se logran de acuerdo a: 1. Se mantiene λ constante usando radiación X filtrada, que es aproximadamente monocromática. 2. El parámetro d puede tener cualquier valor consistente con la estructura cristalina. 3. El parámetro variable es θ, en función del cual se miden los picos de difracción. Debido a la interferencia negativa o destructiva no pueden aparecer picos de intensidad en ángulos que no satisfacen la Ley de Bragg. (Cullity, 1990). El equipo de difracción de rayos X debe tener una fuente de radiaciones a partir de elemento, de acuerdo a la longitud de onda de la radiación deberá elegirse el elemento. La longitud de onda del Cu es de 1.54 x10 -8 (1.54 Å), adecuado para el análisis de grasas. La preparación previa de la muestra, se propone para el caso de las grasas un tamaño de muestra de 1x10x15 mm con una superficie lisa, procurando manipularla sin tocar la superficie, se coloca la grasa en un porta muestra de las dimensiones convenientes según sea el tamaño de la muestra. Se coloca en el equipo de difracción de rayos X para su análisis, operando en método 2θ, realizando barridos que abarquen zonas especificas de interés, para el caso de las grasas los espacios largos se detectan alrededor de 1-15° 2θ y en el caso de los espacios cortos alrededor de 16-25°. Las señales registradas por 66 el equipo se procesan mediante el software del mismo, las intensidades de señal se observan como picos, estos aparecen a un ángulo determinado, el valor de ángulo (también lo da el equipo) se emplea para determinar los espacios cortos, mediante la Ley de Bragg, los valores se reportan Å . 3.5.12 Elaboración de Chocolate (Jorge y col., 2001) El proceso para elaborar chocolate consta de varios pasos: Se funde la grasa, teniendo cuidado de no calentar más de 10 °C arriba de su punto de fusión, se pesa los ingredientes de acuerdo a la fórmula establecida, teniendo especial cuidado de que los ingredientes que sean polvos, se mantenga en recipientes cerrados para evitar que se hidraten, también se recomienda cernir los polvos, para evitar la presencia de grumos o partículas extrañas. Se prende el equipo (molino de bolas) y se espera a que llegue a la temperatura de trabajo (46°C), se enciende el sistema de agitación. Se debe verificar que se encuentre limpio el tanque de mezclado y conductos de recirculación, o bien anteriormente se haya empleado una grasa compatible, en caso contrario, se debe limpiar el equipo usando grasa del mismo tipo de la que se usará en la fórmula. Se comienza adicionando 2/3 partes del total de la grasa, se adiciona por partes la leche en polvo descremada, posteriormente se agrega el azúcar y finalmente la cocoa, se deja el tiempo necesario, verificando que la agitación tenga la velocidad adecuada, se verifica el tamaño de partícula, que no se observen aglomerados, se adiciona el resto de la grasa y la lecitina, y se continua mezclando, finalmente se adiciona la vainillina, y se continua la agitación para permitir la completa integración de los ingredientes, se revisa la homogeneidad en color, presencia de partículas al tacto y de manera visual. Cuando ya se observa una pasta homogénea y sin partículas perceptibles, se detiene la agitación, y se saca el producto del equipo. El tiempo de residencia en el equipo dependerá también de la cantidad de producto preparado, así como de la agitación y temperatura a la que se trabaje. Una vez que la masa de chocolate está lista, se debe mantener a 45°C, a esta temperatura se puede atemperar para su inmediato moldeo. 67 3.5.13 Atemperado del Chocolate (Jorge y col., 2001) Se vierten dos tercios del chocolate fundido (45 °C) sobre una superficie fría (mesa de mármol, acero, etc.). Se remueve el chocolate constantemente con una espátula o paleta. Se trabajar la masa hasta que empiece a espesarse. Se integra la masa atemperada al resto de la masa caliente, se remueve hasta obtener una masa homogénea. Se verifica la temperatura con el termómetro, si se tiene la temperatura deseada se puede comenzar a trabajar o moldear. Si no es así se deberá corregir, volviendo a enfriar, o bien si es demasiado fría, se percibe espesa, se calentará suavemente removiendo hasta que este a la temperatura correcta de trabajo. En base a las características de la masa de chocolate que se observan durante el atemperado, se determinan las temperaturas adecuadas para establecer la curva de atemperado. 3.5.14 Determinación de color en las tabletas de chocolate Se realiza la determinación en el equipo Color Mate spectrophotometer, y se interpretará según el plano de cromaticidad del sistema Hunter. 3.5.15 Determinación de aw Se realiza la molienda o rallado de los alimentos sólidos según aplique, se llenan las celdas. Finalmente coloca en el equipo Aqua Lab para la determinación de aw 3.5.16 Análisis Sensorial (Rodríguez, 2002) El análisis sensorial es una herramienta que permite evaluar, medir, analizar e interpretar la percepción de los atributos en un producto. El Instituto de Investigación para la Industria Alimenticia (La Habana Cuba) cuenta con un panel de jueces entrenados en el análisis sensorial de chocolate. En una sesión de evaluación sensorial las muestras a evaluar se codifican, se explica a los jueces los atributos a evaluar, se utiliza una hoja de evaluación de atributos, se entregan las muestras a los jueces en un orden conveniente para la evaluación. 68 Los jueces, evalúan los siguientes atributos: Uniformidad de color, brillo, intensidad del olor, olor extraño, intensidad del sabor, sabor extraño, dureza, derretimiento, cremosidad, suavidad, cerosidad. Para evaluar los anteriores atributos, se toma la muestra y se observa detalladamente su apariencia externa (uniformidad de color y brillo). Posteriormente se parte la tableta usando las manos, se evalúa la dureza. Enseguida se deberá acercar el producto a la nariz para evaluar la intensidad del olor o presencia de olor extraño. Se coloca un trozo del producto en la boca, mantenerlo en la boca para evaluar los atributos intensidad del sabor, sabor extraño en caso de que lo haya, derretimiento, cremosidad, suavidad y cerosidad. Se repite el procedimiento para cada muestra. 69 3. 6 Desarrollo Experimental En la Figura 15, se muestra el diagrama que indica el desarrollo experimental para el análisis fisicoquímico de las grasas alterativas de la manteca de cacao, así como la elaboración de chocolate análogo y la evaluación tecnológica y sensorial del mismo. Selección de materias Primas (grasas alternativas de la manteca de cacao y manteca de cacao) Elaboración de productos aplicando grasas alternativas de manteca de cacao Caracterización de materias primas Fisicoquímica. Evaluación tecnológica de las masas de chocolate análogo Perfil de ácidos grasos y contenido de ácidos grasos trans. Propiedades térmicas. Cristalización Polimorfismo. Elaboración de tabletas de chocolate análogo. Evaluación tecnológica de las tabletas Evaluación Sensorial Ácidos grasos libres •Valor de peróxido •Color •Humedad y materia volátil •Olor •Índice de yodo •Punto de fusión •Índice de saponificación Figura 15. Desarrollo experimental para el análisis fisicoquímico de las grasas alterativas de la manteca de cacao, así como la elaboración de chocolate análogo y la evaluación tecnológica y sensorial del mismo. . 70 3.6.1 Caracterización Fisicoquímica de las Grasas Alternativas de la Manteca de Cacao La caracterización fisicoquímica de la manteca de cacao y de las grasas alternativas de la manteca de cacao, consistió en la determinación de ácidos grasos libres, valor de peróxido, punto de fusión, índice de yodo, índice de saponificación, color, humedad y materia volátil, determinación sensorial de impurezas indeseables olor, utilizando métodos de la AOCS y métodos de prueba en concordancia con las normas mexicanas aplicadas a grasas y aceites, que se indicaron anteriormente en la parte de métodos analíticos. 3.6.2 Caracterización del Perfil de Ácidos Grasos de las Grasas Alternativas de la Manteca de Cacao y Cuantificación de Ácidos Grasos Trans Para la caracterización del contenido de ácidos grasos y cuantificación de ácidos grasos trans en las diferentes grasas por cromatografía de gases, se contó con el apoyo de la empresa AarhusKarlshman México S.A. de C.V. Se realizó la metilación de las grasas para obtener los correspondientes ésteres metílicos, el peso de muestra fue de 0.2 g, se adicionaron 10 ml de NaOH al 2% en metanol, se colocó a reflujo 120 -130 °, dejándose por 20 minutos, y se adicionaron 5 ml de trifluoruro de boro, y se dejo reaccionar por otros 20 minutos. Se inyectaron 0.2 microlitros de esteres métilicos. El programa empleado en el análisis cromatográfico fue: Temperatura inicial de 45°C , se mantuvo por 5 minutos. Se continuó calentando a 15°C por minuto hasta llegar a 165°C, se mantuvo por 1 minuto. Posteriormente, se continuó el calentamiento aumentando 1°C por minuto, hasta llegar a 225°C esta temperatura se mantuvo por 20 minutos. El método usado fue AOCS Ce 1f-96, (2006). El software del equipo calculó el área bajo la curva de cada pico y se presentó como porcentaje del ácido graso identificado respecto al tiempo de aparición según el estándar empleado. 71 3.6.3 Caracterización de las Propiedades Térmicas y de Cristalización de las Grasas Alternativas de la Manteca de Cacao Los estudios de resonancia magnética nuclear para determinar el contenido de sólidos grasos a diferentes temperaturas, se realizaron usando un equipo de resonancia magnética nuclear Brucker Minispec Modelo: Mq20, se empleó un baño seco para el tratamiento térmico, las temperaturas programadas fueron: 10, 20, 30 35 y 40°C, con una variación de ± 0.1 °C. Se empleo el método IUPAC 2.150. Ex 2.323, en el caso de la manteca de cacao y la grasa equivalente de la manteca de cacao se usó el método de tratamiento especial que indica la técnica. Los estudios de microscopía con luz polarizada, se realizaron en la central de microscopía ENCB, IPN. Se siguió el método descrito por Campos 2005, la prueba se realizó a una temperatura de trabajo de 24 °C (temperatura ambiente). Se tomaron fotografías a diferentes tiempos según se registró la cristalización. Los estudios de calorimetría diferencial de barrido, se realizaron en la central de espectroscopia ENCB, IPN. Se siguió el método para obtener el análisis calorimétrico dinámico (Perez y col.,2005; Foubert y col., 2007). Las condiciones de cada etapa de acuerdo al método mencionado fueron: 10 minutos a 70°C. Enfriamiento de 70 a 0°C a una velocidad de 5°C/min. Se mantuvo 2 minutos a 0°C. Finalmente se calentó de 0 a 70°C a una velocidad de 5°C. El estudio de las grasas empleando difracción de rayos X, se realizó en la Escuela Superior de Físico Matemáticas, del IPN. Para la preparación de la muestra, se fundió la grasa a 80 °C, se dejo solidificar a temperatura ambiente (24°C) en recipientes metálicos (para obtener una superficie lisa), se siguió la metodología descrita en métodos y materiales. La duración de cada prueba fue de 45 minutos aproximadamente, tiempo en el que se pudieron detectar las señales. 72 3.6.4 Elaboración de Chocolate Análogo, Determinación de Condiciones de Atemperado y Elaboración de Tabletas. El chocolate análogo se elaboró en la planta piloto de la Escuela Latinoamericana y del Caribe de Chocolatería del Instituto de Investigaciones para la Industria Alimenticia, en la Ciudad (IIIA). de la Habana Cuba . Se consultó con los proveedores de grasa y personal del IIIA las fórmulas que se usan a nivel comercial. Con base a la información obtenida, se prepararon 4 fórmulas una con cada tipo de grasa (Cuadro 15), y una formulación más en la que se adicionó 5% de la grasa diferente a la manteca de cacao, cabe mencionar que de acuerdo a la información proporcionada en los antecedentes, el parlamento Europeo indica debe ser una grasa compatible con la manteca de cacao y no debe ser grasa láurica ni grasa hidrogenada, por lo que se usó la grasa equivalente. Se prepararon 5 kg de cada fórmula. Cuadro 15. Formulaciones para elaborar chocolate análogo. INGREDIENTE %T %TMC-GEMC % % % MC (5) TGEMC TGRMC TGSMC Cocoa 15 15 15 15 15 Manteca 35 35* 35 32 30 LDP 5 5 5 6 6 Azúcar 45 45 45 47 49 *Se usó del total de la manteca, 30% manteca de cacao y 5% de grasa equivalente de la manteca de cacao. LDP-leche descremada en polvo. Donde TMC, tableta con manteca de cacao; TMC-GEMC tableta con grasa equivalente de la manteca de cacao 5%, TGEMC, tableta con grasa equivalente de la manteca de cacao; TGRMC, tableta con grasa reemplazante de la manteca de cacao; TGSMC, tableta con grasa sustituta de la manteca de cacao. Se adicionó 0.05% de vainillina y 0.4% de lecitina del peso total preparado. Se siguió el proceso indicado en la Figura 16 para la elaboración de las tabletas de chocolate análogo. Las condiciones de operación del molino de bolas fueron: temperatura del agua de 47 °C, velocidad de agitación de 28 rpm. El tiempo de mezclado dependió de la completa integración de los ingredientes, cuando no se percibieron grumos y se observó fluida y homogénea la masa de chocolate análogo se dio por terminado el proceso. 73 Las diferentes formulaciones de chocolate análogo se enfriaron para favorecer la cristalización, las formulaciones que incluían manteca de cacao se atemperaron, previamente para poder moldearse, ya que la manteca de cacao se sabe debe atemperarse para su adecuada cristalización (Beckett, 2000). MATERIAS PRIMAS MEZCLADO REFINADO Y CONCHADO ATEMPERADO MOLDEADO ENFRIAMIENTO DESMOLDE Figura 16. Diagrama general para la elaboración de chocolate. Para la producción de las tabletas de chocolate análogo, se utilizaron moldes rectangulares de policarbonato. Los moldes llenos se colocaron sobre la banda de una mesa vibradora, para facilitar la expulsión de burbujas y homogeneización del contenido en cada molde. 3.6.5 Evaluación de Propiedades Funcionales en las Tabletas Una vez sólidas las tabletas, se desmoldaron y se realizó una sencilla evaluación funcional, los atributos evaluados fueron: Cristalización (rapidez) Contracción, Fácil desmolde 74 Fisuras o grietas Brillo Color, Betas, o apariencia blanquizca. 3.6.6 Determinación aw en las Tabletas de Chocolate Análogo Se determinó el valor de aw de cada una de las tabletas elaboradas con las diferentes mantecas alternativas de la manteca de cacao. Se cortaron en pequeños trozos las tabletas y se realizó la determinación con el equipo Aqualab. 3.6.7 Evaluación Sensorial de las Tabletas Las tabletas de chocolate análogo elaboradas en la planta piloto de la Escuela de chocolatería de Centroamérica y del caribe, se evaluaron sensorialmente en la sala de cata del Instituto de Investigaciones para la Industria Alimenticia. Ciudad de la Habana, Cuba. La evaluación la realizaron 7 jueces entrenados. Las muestras se codificaron como se indica en el Cuadro 16: Cuadro 16. Codificación de las tabletas de chocolate análogo para su evaluación sensorial Fórmula Codificación TMC 043 TMC-GEMC 804 TGEMC 949 TGRMC 615 TGSMC 125 Donde TMC, tableta con manteca de cacao; TMC-GEMC tableta con grasa equivalente de la manteca de cacao 5%, GEMC. TGEMC, tableta con grasa equivalente de la manteca de cacao; TGRMC, tableta con grasa reemplazante de la manteca de cacao; TGSMC, tableta con grasa sustituta de la manteca de cacao. Las muestras se mantuvieron desde su producción hasta el momento de su traslado a la sala de cata en una cámara climatizada de 19-21°C de temperatura, 75 ya en la sala de cata se mantuvieron en un recipiente térmico antes de ser entregadas a cada juez. Se usaron escalas de intervalo (10 cm) para evaluar los siguientes atributos en cada una de las tabletas: Uniformidad de color, brillo, intensidad del olor, olor extraño, intensidad del sabor, sabor extraño, dureza, derretimiento, cremosidad, suavidad, serosidad. En la Figura 17 se muestra el formato para la evaluación sensorial. Uniformidad del color Ausencia Uniforme Brillo Ausencia Brilloso Intensidad del olor Ausencia Muy marcado Ausencia Muy marcado Ausencia Muy marcado Ausencia Muy marcado Ausencia Muy marcada Muy lento Muy rápido Ausencia Muy marcada Ausencia Muy marcada Ausencia Muy marcada Olor extraño Intensidad del sabor Sabor extraño Dureza Derretimiento Cremosidad Suavidad Cerosidad Figura 17. Hoja de evaluación de atributos en tabletas de chocolate análogo. Fuente: Rodríguez, 2002. 76 IV. RESULTADOS 4.1 Caracterización Fisicoquímica de las Grasas Alternativas de la Manteca de Cacao En el presente trabajo se determinó la calidad de la maneca de cacao y las grasas alternativas de la manteca de cacao con base en los valores que marcan las normas correspondientes, Norma Mexicana NMX-F-343-SCFI-2008 “Especificaciones para la manteca de cacao” y las Normas Oficiales Mexicanas NMX-F-009-SCFI-2005 Alimentos-Uso Industrial- Mantecas Vegetales y Grasas o Mantecas Mixtas o Compuestas, y a la NMX-F-037-SCFI-2005 Alimentos-Aceite de Almendra de Palma- Especificaciones, esta última norma se consideró debido a que el proveedor indicó que el origen de la grasa sustituta es el aceite de almendra de palma. 4.1.1 Ácidos Grasos Libres y Valor de Peróxido Los triacilgliceroles al hidrolizarse forman ácidos grasos libres y glicerol. La oxidación de los triacilgliceroles normalmente toma lugar en los carbonos adyacentes a los dobles enlaces, procediendo con la formación de hidroperóxidos, estos compuestos se puede detectar midiendo el valor de peróxido. La determinación de ácidos grasos libres y de peróxidos son considerados indicadores para establecer la calidad de grasas y aceites (Nilsson y col., 2002). En el Cuadro 17 se muestra la cantidad de ácidos grasos libres y el valor de peróxidos detectado en las grasas analizadas. Los valores obtenidos en la muestra de manteca de cacao mexicana y manteca de cacao cubana están por debajo de los valores máximos especificados por la norma así como por lo indicado en el CODEX STAN 86-1981 (1,75 % como olieco), por lo que son aptas para su uso. 77 Cuadro 17. Cantidad de ácidos grasos libres y de peróxidos en manteca de cacao y grasas alternativas de la manteca de cacao. Ácidos grasos libres AGL, % Valor de peróxido VP, meq/kg Muestra Determinación Norma Determinación Norma MCM 0.96* 1,75a 0.6 5,0a MCC 1.51* 1,75a 0.6 5,0a GEMC 0.043* 0,05b 0.3 1,5b GRMC 0.060* 0,05b NP 1,5b GSMC 0.014** 0,05c NP 1,0c * Expresado en Oleico; ** Expresado en láurico. NP, no presenta. MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. Donde “a” corresponde a la norma Norma Oficial Mexicana NMX-F343-SCFI-2008 para la manteca de cacao, “b” corresponde a la Norma Oficial Mexicana NMX-F-009-SCFI-2005 y “c” corresponde a la Norma Oficial Mexicana NMX-F-037-SCFI2006 (para grasa láurica). La muestra GEMC tiene valores dentro de especificaciones (Cuadro 17), la muestra GRMC tuvo un valor superior al máximo indicado para ácidos grasos, posiblemente esta grasa al momento de empacarla estaba en el valor máximo de 0,05, por lo cual cumplía con la especificación y durante el almacenamiento se inicio un proceso de deterioro que fue el causante del incremento de ácidos grasos libres, sin embargo el valor de peróxido si estuvo dentro del intervalo marcado en la norma, por lo que se consideró apta para su uso. Los valores de la muestra GSMC respecto a la norma correspondiente, están dentro de los especificado por lo que se acepta que es apta para su uso. Los valores obtenidos de ácidos grasos libres y valor de peróxido indican que el proceso de producción empleado en estas grasas comerciales fueron los adecuados, principalmente la operación de deodorización, que es la etapa en la que se debe disminuir el valor de ácidos grasos libres presentes. 4.1.2 Color, Humedad - Materia Volátil, Olor El color, presencia de humedad y olor, son comúnmente parámetros de control para evaluar procesos de blanqueo y desodorización en grasas y aceites, ya que 78 después de estos procesos las grasas deben ser cristalinas, sin turbidez, sin humedad y sin olor (AarhusKarlshamn, 2006). El CODEX STAN 86-1981, no indica alguna especificación para el color de la manteca de cacao, sin embargo, la norma mexicana si indica un valor máximo, en el Cuadro 18 se observa que el color de las mantecas de cacao presentan un valor superior al especificado, al respecto es importante mencionar que es una práctica común a nivel industrial que la manteca de cacao, únicamente se someta a deodorización, si bien este proceso puede retirar de la grasa compuestos que dan color no es su función blanquear a totalidad, por lo que en base a los parámetros de ácidos grasos libres y peróxidos que se encuentran dentro de especificación, se sugiere, que tienen buena calidad y que el color no afecta. Los valores de color obtenidos en las grasas alternativas de la manteca de cacao cumplen con la especificación correspondiente, lo que indica que el proceso de blanqueo y deodorización si se realizaron y fueron adecuados, es importante mencionar que muchas de las grasas y aceites tienen colores muy bajos por su origen (AarhusKarlshamn, 2006). Cuadro 18. Determinación de color y humedad en manteca de cacao y grasas alternativas de la manteca de cacao Color* Humedad % Muestra Determinación Norma Determinación Norma MCM 16R40A 5,0Ra 0.038 0,5a MCC 19 R,40 A 5,0Ra 0.065 0,5a GEMC 0.5R,10 A 3,5Rb 0.004 0,05b GRMC 1R,8 A 3,5Rb 0.009 0,05b GSMC 1R,10 A 1,5Rc 0.007 0,05c MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. * Escala lovibond, R, rojo y A, amarillo. Donde “a” corresponde a la norma Norma Oficial Mexicana NMX-F-343-SCFI-2008 para la manteca de cacao, “b” corresponde a la Norma Oficial Mexicana NMX-F-009-SCFI2005 y “c” corresponde a la Norma Oficial Mexicana NMX-F-037-SCFI-2006 (para grasa láurica) 79 También se realizó la comparación del color de las grasas en estado sólido con el “Atlas de colores”, para obtener la combinación de matices, para la muestra MCM tuvo valores de N(00), M(10) y Y(30), para la muestra MCC se encontró una valor de N(00), M (00) y Y (20), para las grasas alternativas de la manteca de cacao los valores fueron N(00), M(00) y Y(00), donde N, corresponde a negro, M a magenta y Y al amarillo (Küppers, 2002). La presencia de humedad en las grasas o un ambiente húmedo, puede ocasionar hidrólisis en los aceites y grasas por lo que es importante conservar estos productos en ambientes secos (Gunstone, 2000). De acuerdo a los resultados obtenidos (Cuadro 18) todas las muestras cumplen con las normas correspondientes en cuanto al valor de humedad. En el Cuadro 19, se reportan los resultados de la evaluación del olor percibido en las muestras, en el caso de la manteca de cacao, se percibió el olor a cacao, y se indicó como “característico” en tanto que en las demás grasas no se percibió olor. Es importante que no se perciban olor a rancio o algún olor extraño, ya que esto puede implicar que: el proceso de deodorización en fábrica no se realizó de manera adecuada, que hay una contaminación o deterioro en el material. Muchos compuestos liposolubles pueden afectar a las grasas y aceites al disolverse en ellos, es por este motivo que se recomienda que las grasas, mantecas y aceites se mantengan en empaques adecuados y lejos de compuestos aromáticos (Charley, 2005). Cuadro 19 . Evaluación del olor en la manteca de cacao y en las grasas alternativas de la manteca de cacao. Muestra Olor MCM Característico del producto, ligeramente a chocolate MCC Característico del producto, ligeramente a chocolate GEMC Exento de olor extraño ó rancio GRMC Exento de olor extraño ó rancio GSMC Exento de olor extraño ó rancio MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. 80 4.1.3 Índice de Yodo, Punto de Fusión e Índice de Saponificación El grado de insaturación en un ácido graso se mide de manera indirecta por la adición de yodo a los dobles enlaces que contenga, por lo tanto a mayor índice de yodo mayor es el grado de insaturación o dobles enlaces. El proceso de hidrogenación reduce el grado de insaturación, y por lo tanto se reduce el valor de yodo, las grasas saturadas en su totalidad por lo tanto presentan valores de yodo cercanos a cero. Entre el índice de yodo y el punto de fusión existe una relación inversa, a mayor índice de yodo menor punto fusión, y a menor valor de yodo el punto de fusión será alto (Baur, 1995). La manteca de cacao de acuerdo a la NMX-F-343-SCFI-2008, debe tener un índice de yodo de 32 a 42, un punto de fusión de 31 a 35°C y un índice de saponificación de 188 a 200, en el Cuadro 20 se muestran los valores obtenidos de estos parámetros para la manteca de cacao, los cuales se encuentran dentro de lo especificado. Cuadro 20.Resultados de las determinaciones de índice de yodo, punto de fusión e índice de saponificación en manteca de cacao y grasas alternativas de la manteca de cacao. MCM 37.12±0.1 Punto de Fusión °C 31.5 MCC 35.55±0.08 32 200.06±0.43 GEMC 34.25±0.14 33 187.3±0.75 GRMC 63.24±0.16 35 188.96±0.35 GSMC 0.45±0.06 34 246.01±0.42 Muestra Índice de Yodo Índice de saponificación 196.15±0.7 MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. El índice de yodo es útil para determinar en cierta forma el graso de dureza, índices de yodo altos indican un alto contenido de componentes insaturados, que contribuyen a la suavidad en la manteca de cacao, Chaiseri y Dimick (1989) reportaron un índice de yodo de 36.54±0.62 de varias muestras de manteca de cacao de lugares ubicados en América del norte y centro América, del análisis 81 que realizaron a mantecas de cacao de diferentes regiones del mundo indicaron que la zona geográfica y el clima tiene un efecto notable en la presencia de determinados ácidos grasos, que se refleja en el índice de yodo. Para el caso de las mantecas de cacao de diferente origen que se analizaron, se cumple que a menor índice de yodo mayor punto de fusión (MCC) y que mayor índice de yodo menor punto de fusión (MCM). Para el caso de las grasas vegetales no existe una especificación de valor de yodo, debido a que son mezclas de varios aceites ó grasas, y además han pasado por algún tipo de proceso que modifica sus propiedades. De acuerdo a la NMX-F-009-SCFI-2005, el punto de fusión debe tener un valor máximo de 50°C y el índice de saponificación debe ser mínimo de 175. En el Cuadro 20, se muestran los resultados de la grasa sustituta de la manteca de cacao, se observa que tiene un índice de yodo muy bajo, indicando que es muy saturada, el valor obtenido concuerda con lo reportado por Dijkstra, en el 2007, para la fracción esteárica del aceite de almendra de palma que tuvo un índice de yodo de 0.4. El valor obtenido en la manteca reemplazante fue el más alto de todas las muestras, lo que sugiere que es la más insaturada. La grasa equivalente de la manteca de cacao tiene un valor de yodo y de punto de fusión cercanos al que presentaron las mantecas de cacao, por lo que se puede suponer que tanto en dureza como en grado de insaturación son similares. El límite que indica la NMX-F-009-SCFI-2005 para punto de fusión, no es funcional aplicarlo a grasas alternativas de la manteca de cacao, ya que deben tener un comportamiento de fusión cercano al de la manteca de cacao. El índice de saponificación es un indicador del peso molecular o tamaño, como una función de las longitudes de la cadena de los ácidos grasos constituyentes. Altos valores indican bajo peso molecular, es decir ácidos grasos de cadena corta o intermedia, valores bajos indican pesos moleculares altos (Baur, 1995). De los valores obtenidos de las grasas alternativas de la manteca de cacao se puede asumir que la grasa sustituta por su alto índice de saponificación contiene ácidos grasos de cadena corta y con un peso molecular bajo, mientras que el resto de las 82 grasas contiene ácidos grasos de cadena larga que resultan en los valores obtenidos de índice de saponificación, que son ciertamente cercanos entre si. 4.2 Caracterización del Perfil de Ácidos Grasos y Contenido de Ácidos Grasos Trans por cromatografía de gases. Los ácidos grasos detectados por cromatografía de gases en cada muestra se indican en el Cuadro 21, en el Cuadro 22 se muestran los perfiles de ácidos grasos de algunas grasas y aceites puros, como se observa solo hay semejanza entre los perfiles de las mantecas de cacao, las grasas alternativas analizadas, de acuerdo a los valores obtenidos se sugiere son mezclas de grasas y/o grasas que han sufrido varias operaciones de transformación, como la hidrogenación, fraccionamiento o interesterificación, ya que estas operaciones dan como resultado perfiles diferentes a los que tiene los aceites y grasas puros o sin procesar. Cuadro 21. Perfil de ácidos grasos y contenido de ácidos grasos trans en manteca de cacao mexicana, cubana y grasas alternativas de la manteca de cacao. Número de carbonos /Ácido graso MCM MCC GEMC GRMC GSMC C 6:0 Caproico ND ND ND ND 0.1 C 8:0 Caprilico ND ND ND ND 1.5 C 10:0 Cáprico ND ND 0.1 ND 2.5 C 12:0 Láurico ND ND 0.1 1.3 51.8 C 14:0 Mirístico 0.1 ND 0.7 0.8 22.3 C 16:0Palmítico 26.3 25.8 41.8 21.8 10.3 C 16:1Palmitoleico 0.2 0.2 ND 0.1 ND C 18:0 Esteárico 33 35 20.8 7.2 11.1 ND ND 0.5 43.8 ND 35.4 34 31.7 23.6 0.1 C 18:2 cis Linoleico 3.3 3.0 3.2 0.2 0.1 C 18:3 Linolénico 0.2 0.2 0.1 0.4 0.2 C 18:1 trans Elaídico C 18:1 cis Oleico MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. T trazas. ND, no detectado. 83 Cuadro 22. Perfil de ácidos grasos en manteca de cacao y en algunas grasas o aceites empleados como alternativas de la manteca de cacao. Ácido graso Caprilico Caprico Láurico Mirístico Palmitico Esteárico Oleico Linoleico Linolenico Araquidico Número de carbonos C8:00 C10:0 C12:0 C14:0 C16:0 C18:0 C18:1 C18:2 C18:3 C20:0 MC 0.1 26.3 33.8 34.4 3.1 1.3 a AP 0.3 1.1 43 4.6 39.3 10.7 0.4 0.3 a AS 0.1 10.5 4 23 54 7.5 0.3 PKO a Karite o a Shea 3.3 3.4 48.2 16.2 8.4 2.5 15.3 2.3 4 44 44 <6 0.1 <2 Illipe b 15-19 42-48 32-38 <1.5 <1 <1 Manteca de mango Manteca b de sal <1.5 <1.5 11 – 17 30 – 45 38 – 50 3–7 <0.8 <2 4-7 41-47 37-43 0-4 3-9 Donde MC, manteca de cacao; AP, aceite de palma; AS, aceite de soya; PKO, aceite de palmiste. Fuente: a AarhusKarlshamn y b www.oilsbynature.com En el Cuadro 21 se observa que la manteca de cacao de origen mexicano y cubana, tienen principalmente ácido oleico, ácido esteárico y ácido palmítico, se observa el perfil característico para manteca de cacao de acuerdo al Cuadro 22, no se aprecian diferencias considerables entre la manteca de origen mexicano y la manteca de origen cubano. En la Figura 19 y Figura 20 se presenta el perfil cromatográfico de ambas mantecas de cacao, La grasa equivalente de la manteca de cacao presentó en mayor proporción al ácido palmítico, ácido oleico y ácido esteárico, de las tres grasas alternativas que se analizaron, es la grasa equivalente la que más se acerca en composición de ácidos grasos a la manteca de cacao, como se observa en la Figura 18. Esta semejanza permite suponer que el comportamiento en la cristalización y polimorfismo puede ser muy parecido. La semejanza entre esta grasa y la manteca de cacao se había observado también en los resultados de índice de yodo y punto de fusión. Comparando el perfil obtenido con los valores del Cuadro 22, se sugiere que es una mezcla de varias grasas y aceites, se cree uno de los componentes es el aceite de palma por el contenido de ácido palmítico detectado en la grasa equivalente. En la Figura 21 se muestra el perfil cromatográfico de esta grasa equivalente de la manteca de cacao. Se observa en el Cuadro 21, que los principales ácidos grasos detectados en la grasa reemplazante de la manteca de cacao fueron el ácido elaídico, ácido 84 oleico, y ácido palmítico, no se parece al perfil de la manteca de cacao, esto permite suponer una incompatibilidad en ácidos grasos; por otra parte se considera que es una grasa parcialmente hidrogenada, ya que 43.8% de ácidos grasos trans es una cantidad que solo puede presentarse debido al proceso de hidrogenación, el perfil obtenido se comparó con el reporte de una grasa parcialmente hidrogenada de palma que tuvo 36.1% de ácidos grasos trans (Foubert y col., 2007) y hidrogenado, con los datos del aceite de soya parcialmente que puede llegar a tener un 65 % de isomeros trans (Kellens, 2000), sin embargo no se puede establecer a partir de que esta elaborada esta grasa, únicamente se puede asegurar que es una grasa hidrogenada. En la Figura 22 se presenta el perfil cromatográfico de la grasa reemplazante de la manteca de cacao. En el Cuadro 21, se observa el perfil de la ácidos grasos de la grasa sustituta, el ácido graso láurico fue el más abundante (51.8%), el cual da esa naturaleza de grasa láurica, en la Figura 18 se aprecia mejor la marcada diferencia entre la composición de ácidos grasos de esta grasa en relación a las demás grasas, por lo que se supone la incompatibilidad que existiría en caso de mezclarse con las otras grasas. El perfil obtenido de comparó con el perfil de ácidos grasos de una grasa láurica (elaborada con aceite de almendra de palma) reportado por Foubert y col., (2007), se encontró que los valores son muy cercanos, C12:0 54.1%, C14:0 19.5% C16:0 8.6% C18:0 11.5%, sin embargo Foubert y col., si detectaron 0.5% de ácidos grasos trans, mientras que en la grasa sustituta de la manteca de cacao analizada en este trabajo no se detectaron ácidos grasos trans. En la Figura 23 se muestra el perfil cromatográfico de la grasa sustituta de la manteca de cacao. 85 GSMC Mantecas GRMC GEMC MCC MCM 0% 20% 40% 60% 80% 100% % Ácidos Grasos Palmítico Esteárico Oleico Elaídico Láurico Mirístico Otros Figura 18. Principales ácidos grasos en manteca de cacao de origen mexicano cubano, y grasas alternativas de la manteca de cacao. De acuerdo al Cuadro 6 (Nilsson y col., 2002), del total de grasas consumidas diariamente menos del 30% deben ser grasas saturadas (incluyendo grasas trans), aproximadamente 50 % deben ser grasas mono insaturadas y un 20% deben ser grasas polinsaturadas. En la Figura 18, se observa que cualquiera de las grasas analizadas tiene más del 50% de grasas saturadas, sin embargo la manteca de cacao y grasa equivalente presentan un balance más adecuado entre saturados e insaturados. La grasa reemplazante es una fuente importante de ácidos grasos trans, lo que la hace poco recomendable, y la grasa sustituta es la más saturada. Los ácidos grasos saturados contribuyen al incremento del colesterol total en sangre, efecto que se considera perjudicial a la salud, pero se sabe, es aun más dañino el efecto que tienen los ácidos grasos trans, ya que no solo incrementan el colesterol total, también aumentan los niveles de lipoproteína de baja densidad que está asociada con padecimientos cardiovasculares (Spiller, 2000). Por lo que un reto para la industria de grasas y aceites deberá ser el desarrollar una grasa que tenga menor porcentaje de ácidos grasos saturados, que no contenga ácidos grasos trans y al mismo tiempo ser una alternativa de la manteca de cacao que tenga un buen desempeño en todo los demás atributos. 86 Con base en los resultados del análisis cromatográfico se elaboró el Cuadro 23, en él se indica la compatibilidad de las grasas alternativas de la manteca de cacao considerando su composición de ácidos grasos, la compatibilidad indica que mezclas pueden realizarse para evitar problemas de cristalización, separación de fases etc. (AarhusKarlshamn, 2006). Una aplicación interesante es conocer que grasas son compatibles para el desarrollo de fórmulas para chocolates análogos. Cuadro 23. Compatibilidad entre las grasas alternativas de la manteca de cacao y la manteca de cacao. Manteca Compatible MC GEMC GRMC GSMC GEMC MC Parcialmente compatible GRMC GRMC MC , GEMC Incompatible GSMC GSMC GSMC MC, GEMC, GRMC MC, manteca de cacao; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. Cuando se mezclan sistemas grasos diferentes, se presenta una incompatibilidad, el sistema en conjunto formado por grasas diferentes lleva a tener cristales, pero el estado físico es blando, le llevara mayor tiempo solidificar y es probable aparezcan nuevos cristales en la superficie, y den una apariencia no deseable, mezclar grasas que tienen perfiles de ácidos grasos diferentes es como apilar sillas diferentes, tarde o temprano el arreglo se derrumbará (Beckett, 2000). En los cromatogramas (Figuras 19-23) se indica la señal detectada en pico amperes (pA) en el eje vertical, y en el eje horizontal se indica el tiempo de retención en minutos al que se registró la señal. Los tiempos de retención se indican en el Cuadro 24. 87 Cuadro 24. Tiempos de retención de los ácidos grasos detectados mediante cromatografía de gases en las mantecas de cacao y grasas alternativas de la manteca de cacao. Tiempo de retención (minutos) Ácido graso MCM MCC GEMC GRMC GSMC Caproico 16.375 Caprílico 19.134 Cáprico 21.398 21.400 Undecanoico 22.593 Láurico 23.953 23.838 Tridecanoico 23.959 25.491 Mirístico 27.282 Palmítico 32.147 32.324 Palmitoleico 33.974 34.161 Margárico 35.119 35.316 35.162 Esteárico 38.722 38.902 38.696 38.627 40.043 40.150 Elaídico 27.365 27.247 27.354 32.277 32.107 32.132 33.304 38.554 Oleico 40.749 40.966 40.838 41.876 40.629 Linoleico 43.958 44.191 44.066 43.357 43.993 &-Linolénico 46.477 46.690 46.447 46.419 46.408 Linolénico 48.100 48.331 48.032 88 Tiempo (minutos) Figuras 19. Perfil cromatográfico de la manteca de cacao de origen mexicano. (Columna Capillary CG 100.0m x 250µm x 0.2µm, Inicial 45°C , Temperatura Inicial 45°C , tiempo de espera 5 minutos. Rampa 1: 15°C/min, temperatura final: 165°C, tiempo de espera 1 min. Rampa 2: 1°C/min, temperatura final 225°C, tiempo final de espera 20 min). 89 Tiempo de retención (minutos) Figura 20. Perfil cromatográfico de la de manteca de cacao de origen cubano. (Columna Capillary CG 100.0m x 250µm x 0.2µm, Inicial 45°C , Temperatura Inicial 45°C , tiempo de espera 5 minutos. Rampa 1: 15°C/min, temperatura final: 165°C, tiempo de espera 1 min. Rampa 2: 1°C/min, temperatura final 225°C, tiempo final de espera 20 min). 90 Tiempo de retención (minutos) Figura 21. Perfil cromatográfico de la grasa equivalente de la manteca de cacao. (Columna Capillary CG 100.0m x 250µm x 0.2µm, Inicial 45°C , Temperatura Inicial 45°C , tiempo de espera 5 minutos. Rampa 1: 15°C/min, temperatura final: 165°C, tiempo de espera 1 min. Rampa 2: 1°C/min, temperatura final 225°C, tiempo final de espera 20 min). 91 Tiempo de retención (minutos) Figura 22. Cromatografía de la grasa reemplazante de la manteca de cacao. (Columna Capillary CG 100.0m x 250µm x 0.2µm, Inicial 45°C , Temperatura Inicial 45°C , tiempo de espera 5 minutos. Rampa 1: 15°C/min, temperatura final: 165°C, tiempo de espera 1 min. Rampa 2: 1°C/min, temperatura final 225°C, tiempo final de espera 20 min). 92 Tiempo (minutos) Figura 23. Perfil cromatográfico de la grasa sustituta de la manteca de cacao. (Columna Capillary CG 100.0m x 250µm x 0.2µm, Inicial 45°C , Temperatura Inicial 45°C , tiempo de espera 5 minutos. Rampa 1: 15°C/min, temperatura final: 165°C, tiempo de espera 1 min. Rampa 2: 1°C/min, temperatura final 225°C, tiempo final de espera 20 min). 93 4.3 Caracterización de las Propiedades Térmicas y de Cristalización de las Grasas Alternativas de la Manteca de Cacao 4.3.1 Contenido de Sólidos Grasos por Resonancia Magnética Nuclear En el Cuadro 25 se muestra el contenido de sólidos grasos (CSG) a las temperaturas de estudio, 10 20, 30, 35 y 40 °C. No existen especificaciones en las normas mexicanas para el contenido de sólidos grasos en manteca de cacao ni en las grasas alternativas de la manteca de cacao. Sin embargo para la manteca de cacao existe un perfil de sólidos grasos de referencia (Aarhus Karlshamn, 2006; Gunstone y Harwood, 2007), en base a estos datos se compararon los resultados obtenidos en este trabajo. El perfil mencionado indica que a la temperatura de 20 °C debe haber un contenido de sólidos grasos de 72 a 89 %, a 30 °C un contenido de sólidos de 40 a 65% y finalmente a 35 °C un contenido de sólidos de 0 a 3 %. Los resultados obtenidos de la manteca de cacao de origen mexicano están por debajo del límite inferior del perfil esperado, indicando que es una manteca suave. Chaiseri y Dimick (1989), reportaron las diferencias entre mantecas de cacao de varios orígenes, indicaron que las mantecas de cacao de origen Africano y de Norte y centro América tiene características de dureza intermedias, sin embargo, factores como el clima y zona geográfica pueden ocasionar diferencias en la formación de ácidos grasos que ocasionen mayor o menor dureza, las mantecas suaves o de bajo contenido de sólidos pueden utilizarse adicionando un porcentaje de manteca de cacao de contenido de sólidos altos para compensar la falta sólidos y aumentar la dureza. El emplear manteca de cacao de bajo contenido de sólidos en la elaboración de productos, puede afectar la funcionalidad y calidad de los mismos, por ejemplo, un chocolate hecho con manteca de cacao suave, necesitaría temperatura más baja de enfriamiento para lograr la solidificación o cristalización, y a temperatura ambiente seguramente estaría derretido o completamente reblandecido. El contenido de sólidos grasos de la manteca de cacao de origen mexicano, se comparó con el de la manteca de cacao de Brasil, el perfil es similar, cabe 94 mencionar que la manteca de cacao de Brasil dentro del mercado mundial se le reconoce como la manteca más suave (Gunstone y Harwood, 2007). La adición de manteca de cacao de sólidos altos puede mejorar la dureza de la manteca de cacao suave, de igual manera se puede emplear alguna de las grasas alternativas de la manteca de cacao, previo conocimiento de su compatibilidad, para mejorar el atributo dureza (Stauffer, 1996). Es necesario un estudio amplio, que incluya varias muestra de manteca de origen mexicano, para establecer sus características y así se determine el grado de dureza en relación al resto de las mantecas de cacao que se han estudiado a nivel mundial. Cuadro 25. Contenido de sólidos grasos alternativas de la manteca de cacao. Muestra MCM MCC GEMC GRMC GSMC 10°C 77.90 84.60 88.00 95.00 96.91 en manteca de cacao y grasas Sólidos grasos a diferentes temperaturas (%) 20°C 30°C 35°C 40°C 0.43 0.42 66.80 29.90 74.70 42.20 0.48 0.41 70.90 41.10 3.20 0.35 86.99 45.64 6.04 0.39 95.46 50.02 3.16 0.0 MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. La manteca de cacao de origen cubano y las grasas alternativas tienen a 10 °C un contenido superior al 84% no hay diferencia considerable entre ellas a esta temperatura. Se observa en el Cuadro 25, que el contenido de sólidos grasos a 20°C disminuye, de acuerdo a la Figura 24, el contenido de sólidos presente a temperatura de 20 a 25 °C esta relacionado con la dureza de la grasa, siendo la grasa sustituta de la manteca de cacao la de mayor dureza seguida de la grasa reemplazante, en tanto que la grasa equivalente se observa tiene menor porcentaje de sólidos grasos que la manteca de cacao. El contenido de sólidos grasos a temperatura de 25 a 30 °C, se relaciona con la resistencia térmica, por lo tanto suponiendo una temperatura ambiente que oscile en ese intervalo de temperatura, un chocolate o chocolate análogo será sólido si es que la materia grasa empleada que contiene presenta sólidos altos a dicha temperatura. Las 95 grasas sustituta y reemplazante de la manteca de cacao debido a su alto contenido de sólidos grasos pueden ser una buena opción para elaborar chocolates análogos que se comercialicen en lugares calidos, pues su resistencia al calor será mayor que si se emplea manteca de cacao y grasa equivalente de la manteca de cacao. 1 Sólidos grasos % 100 2 80 3 60 40 4 20 0 10 25 20 30 35 40 Temperatura °C MCM MCC GEMC GRMC GSMC Figura 24. Perfil del contenido de sólidos grasos. MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. Obtenido por pRMN en un equipo Minispec Brucker PC-20. Donde las zonas 1 y 2, indican la dureza y resistencia al calor; 3 indica la zona de fusión y 4 la zona en que se percibe cerosidad. A la temperatura de 30 °C se observa que las muestras han fundido aproximadamente en un 50% (Cuadro 25), es importante mencionar que este contenido de sólidos es el que permite que el chocolate se observe como un producto sólido aun cuando ya hay grasa fundida. La pendiente que se forma entre el contenido de sólidos grasos a 30 °C y 35°C, se relaciona con la rápida o lenta fusión de la grasa, esta pendiente si es muy pronunciada indica que gran cantidad de triacilgliceroles presentes tienen su punto de fusión en ese intervalo de temperatura, ya que a la temperatura de 35 °C el contenido de sólidos grasos es cercano a cero, es decir, la mayoría se ha fundido, si aun quedara gran cantidad de sólidos grasos a 35 °C, se percibiría una 96 sensación cerosa, de ahí la importancia de que las grasas o mantecas usadas en la elaboración de chocolates ó chocolates análogos tengan una pendiente muy pronunciada y además un punto de fusión cercano a la temperatura corporal (Beckett, 2000). Se calculó la pendiente de cada grasa entre 30 °C y 35 °C, los valores obtenidos fueron: 5.89 para MCM, 8.34 para MCC, 7.58 para GEMC, 7.92 para GRMC y de 9.37 en GSMC. De acuerdo a estos resultados la mayor pendiente se registra en la muestra GSMC, por lo que se espera tenga una rápida fusión, pero es necesario se realice una evaluación sensorial para definir como se percibe el atributo de fusión. En el Cuadro 20 se reportaron los puntos de fusión de cada muestra, esos resultados concuerdan con el contenido de sólidos a 35 °C, por ejemplo: la manteca reemplazante tuvo el punto de fusión más alto (Cuadro 20) y de acuerdo al análisis de contenido de sólidos también es la grasa que tiene el porcentaje de sólidos grasos más alto (Cuadro 23). Finalmente, en la Figura 25 a la temperatura de 40 °C las mantecas y grasas alternativas de la manteca de cacao presentan sólidos grasos inferiores a 0.5%, es decir se encuentran casi fundidas. Cristalización, Estudio con Microscopio - Luz Polarizada El proceso de cristalización se observó utilizando el microscopio óptico- luz polarizada (MLP), los resultados muestran la formación y desarrollo de cristales, así como la diferencia en tiempos requeridos para que se presente la cristalización. Las observaciones se realizaron a 24 °C (temperatura ambiente). Las fotografías se tomaron cada minuto, se consideró que una vez cristalizada la grasa no era necesario seguir tomando más imágenes, de igual manera en las mantecas que tardaron en cristalizar solo se tomaron fotos si se apreciaba un cambio. En el Cuadro 26 se indica a los diferentes tiempos la cristalización. 97 Cuadro 26. Cristalización de la manteca de cacao y grasas alternativas de la manteca de cacao a diferentes tiempos. Cristalización a 24 °C (minutos) Muestra 0 5 10 15 20 24 h MCC NP NP NP NP NP P GEMC NP P P P P P GRMC NP P P P P P GSMC NP P P P P P MCC, manteca de cacao cubana; GEMC, equivalente de manteca de cacao; GRMC, reemplazante de manteca de cacao; GSMC, sustituta de la manteca de cacao. NP, no presenta y P, presenta. En el caso de la manteca de cacao, la cristalización fue lenta, se estuvo observando la muestra en un periodo de 7 h continuas, sin presentarse una cristalización completa como se observa en la Figura 25, sin embargo, después de 24h cristalizó, es posible que al descender la temperatura durante la noche se haya favorecido la cristalización, Mazzanti y col., (2003) reportaron que se observó cristalización (con MLP) en la manteca de cacao a 20°C después de 1 día bajo condiciones estáticas, los cristales observados tenían un tamaño entre 40-50 μm. Figura 25. Imagen comparativa de la cristalización de la manteca de cacao usando Microscopio óptico con LP 40x: Tiempo 0 (imagen izquierda), tiempo 7 h. (imagen central) y tiempo 24 h (imagen derecha) a temperatura de 24 °C. La escala indica 50 micras. 98 De acuerdo a Tang y Marangoni (2006), en muestras que tienen un alto contenido de grasa sólida se dificulta la toma de imágenes con microscopio óptico de luz polarizada (MLP), sin embargo aunque las grasas estudiadas tienen alto contenido de sólidos grasos (Cuadro 25), fue posible observar que las grasas reemplazante y sustituta presentaron cristales más finos que la manteca equivalente como se observa en la Figura 26, estos resultados concuerdan con lo reportado por Awad y col., (2004), quienes indicaron que en muestras con alto contenido de sólidos grasos, solo se detectan finos cristales, en tanto que en muestras con bajo contenido de sólidos grasos se observaron aglomerados de cristales grandes. En cuanto al tiempo requerido para observar cristalización se encontró que, la grasa reemplazante es la que cristalizó totalmente en menor tiempo (10 minutos), como se observa en la Figura 27 (columna central), seguida de la grasa sustituta (15 minutos), y por último la grasa equivalente, este resultado se debe a los ácidos grasos presentes, los resultados concuerdan con lo reportado por Foubert y col., en el 2006, quienes indicaron que la grasas que contiene ácidos grasos trans y las grasas de origen láurico cristalizan más rápido que grasas de otra naturaleza. Cabe mencionar que en grasas de carácter láurico una vez que se forman los núcleos, la velocidad de crecimiento de los cristales es mayor comparada con la de los sistemas basados en sistemas de ácidos grasos de cadena larga como palmítico/esteárico/elaídico (Nilsson y col., 2002), por lo que desde el punto de vista tecnológico, la completa cristalización de un producto elaborado con manteca láurica cristaliza primero que el producto elaborado con manteca hidrogenada. 99 0 1 4 3 Tiempo (minutos) 2 Figura 26. Imagen comparativa de la cristalización en grasas alternativas de la manteca de cacao usando MLP 40x a diferentes tiempos (de arriba hacia abajo: 0,1,2,3 y 4 minutos) a temperatura de 24 °C. La escala indica 50 micras. GEMC (columna izquierda), GRMC (columna central) y GSMC (columna derecha). 100 0 5 20 15 Tiempo (minutos) 10 Figura 27. Imagen comparativa de la cristalización en grasas alternativas de la manteca de cacao usando MLP 40x, a diferentes tiempos (de arriba hacia abajo: 0,5,10,15 y 20 minutos) a temperatura de 24 °C. GEMC (columna izquierda), GRMC (columna central) y GSMC (columna derecha). 101 4.3.3 Cristalización y Fusión, por Calorimetría Diferencial de Barrido Se obtuvieron los termogramas de cristalización y de fusión, de acuerdo al método empleado por Foubert y col. (2007). Una de las grasas que se ha estudiado ampliamente es la manteca de cacao, la cual presenta 6 formas cristalinas, en el Cuadro 27, se indican las temperaturas registradas en cada termograma de cada una de las grasas analizadas, y se comparan con las formas que presenta la manteca de cacao, cabe mencionar que existen diferencias aun entre los puntos de fusión de las formas polimórficas reportadas para la manteca de cacao entre los investigadores, estas diferencias se deben principalmente a las condiciones bajo las que se forman los cristales y las condiciones de análisis. Cuadro 27. Temperaturas de fusión (°C) y la correspondiente forma cristalina determinada por calorimetría diferencial de barrido MUESTRA Valor obtenido Fusión °C Forma (Stauffer 1999) I II II IV V VI 17.3 23.3 25.5 27.3 33.8 36.3 MCM P1(20.15), P2 (18.24) P3(14.37) X MCC P1(20.99), P2 (18.4) X GEMC P1(26.19), P2 (17.34) X GRMC P1(34.89), P2 (24.17) X GSMC P1 (32.95) X MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de la manteca de cacao; GRMC, grasa reemplazante de la manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. P, pico y subíndices indican orden de aparición. Los puntos de fusión remarcados corresponden a los picos detectados claramente. 102 Figura 28. Termograma de la manteca de cacao de origen mexicano. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C (línea azul). Calentamiento a 5 °C/min de 0 °C a 70 °C (línea verde). En la Figura 28, se observa la cristalización de la manteca de cacao mexicano, la cual inicia en 16.04 °C, se registra la formación de un pico que se registró a 13.06 °C, con una valor de ΔH=-48.34 J/g. Al llegar a 0 °C aún no se completó la cristalización, por lo que se sugiere que el programa de temperatura debe llegar a temperaturas inferiores a 0 °C para permitir se complete la cristalización. En la etapa de calentamiento no se aprecia de manera clara el inició de la fusión. Se observa un pico muy amplio, posiblemente se conforme de 3 picos, se supone la existencia de tres eventos, por lo que se recomienda un calentamiento más lento. El punto máximo se registro a 20.15 °C con un valor de ΔH=47.25 J/g, la etapa de fusión termina aproximadamente en los 24.03 °C. 103 Figura 29 . Termograma de la manteca de cacao de origen cubano. Análisis dinámico, enfriamiento 5 °C/min de 70 °C hasta 0 °C (línea azul). Calentamiento a 5 °C/min de 0 °C hasta 70 °C (línea verde). En la Figura 29 se observa la cristalización de la manteca de cacao cubana, la cual inicia en 16.41 °C, se observa la formación de un pico que tiene al parecer dos puntos máximos, se determinó indicar como punto máximo el que se registró a 13.92 °C, con una valor de ΔH=-52.61 J/g, se observa que al llegar a 0 °C aún no se completaba la cristalización, pero de acuerdo al programa, se inició el calentamiento, por lo que se considera necesario que el programa de temperatura debe llegar a temperaturas inferiores a 0°C. En la etapa de calentamiento se inició la fusión a 7.85 °C aproximadamente. Se observa un pico muy amplio, que al igual que el registrado en la etapa de enfriamiento permite suponer la existencia de dos eventos. El punto máximo se registro a 20.99 °C con un valor de ΔH=59.24 J/g, la etapa de fusión termina aproximadamente en 28.57 °C. 104 Figura 30. Termograma de la grasa equivalente de la manteca de cacao. Análisis dinámico, enfriamiento 5 °C/min de 70 °C a 0 °C (línea azul). Calentamiento a 5 °C/min de 0 °C a 70 °C (línea verde). La Figura 30 corresponde a el análisis de la grasa equivalente de la manteca de cacao, se observan en la etapa de enfriamiento dos picos, la cristalización parece iniciar en 20.71 °C el primer pico tiene su punto máximo en 18.97°C con un valor ΔH=-11.61 J/g, posteriormente se registra un segundo pico, con área mayor que el primero, la temperatura del punto máximo en el pico es de 11.19°C con un valor de ΔH=-35.16 J/g. La cristalización se interrumpió, debido a que se comenzó el calentamiento, por lo que es conveniente para una grasa con la naturaleza de la grasa equivalente programar se llegue a una temperatura inferior a 0 °C. La etapa de calentamiento muestra que la fusión se inicia a 3.57 °C, se presentan dos picos, el primero con 105 un valor máximo en 17.34 °C , con una ΔH= 75.73 J/g, posteriormente cerca a la base se registro otra zona donde permanece constante antes de regresar a la línea base, posiblemente corresponda a la fusión de una forma cristalina, seguramente con un calentamiento más lento se podría definir mejor si es un pico de fusión o es parte del pico que si se observó de manera clara. La fusión parece terminar en 30.71 °C de temperatura. De acuerdo al Cuadro 27 la forma cristalina según los puntos de fusión registrados corresponde a la presencia de la forma I (17 °C). Figura 31. Termograma de la grasa reemplazante de la manteca de cacao. Análisis dinámico, enfriamiento 5°C/min de 70 °C hasta 0 °C (línea azul). Calentamiento a 5 °C/min de 0 °C hasta 70 °C (línea verde). De acuerdo a la Figura 31, el termograma de la grasa reemplazante de la manteca de cacao, indica el comienzo de la cristalización a 28 °C, tecnológicamente pudiera ser favorable, pues se ahorraría energía al no requerirse un equipo de enfriamiento. A 23 °C se forma una pequeña curva, la 106 temperatura de enfriamiento fue de 5 °C/min posiblemente se requiere de un enfriamiento más lento, para detectar si esta curva corresponde a un evento relevante. El siguiente pico que se observa tiene su máximo valor a 15.88 °C, con una ΔH de -75.81 J/g (el signo negativo es porque la cristalización es un evento en el que se libera calor), no se apreció de manera clara si termina el proceso de cristalización ya que a los 0 °C se comenzó el calentamiento. En la etapa de calentamiento, la fusión inicia aproximadamente en 16 °C, y en 34.89 °C se registra el punto máximo del único pico definido que se detectó, el valor ΔH registrado fue de 88.33 J/g. De acuerdo al punto donde se regresa a la línea base, la temperatura a la que termina la fusión es 38.57 °C. De acuerdo a lo encontrado por Foubert y col., (2006), las grasa láuricas y grasas parcialmente hidrogenadas llegan a la forma β’, que se visualiza en forma de un solo pico, del perfil cromatográfico de la grasa reemplazante mostró que es una grasa hidrogenada, por lo que se cree que el pico formado corresponde a la forma β’ . Figura 32. Termograma de la grasa sustituta de la manteca de cacao. Análisis dinámico, enfriamiento 5 °C/min de 70 °C hasta 0 °C (línea azul). Calentamiento a 5 °C/min de 0 °C hasta 70 °C (línea verde) 107 En la Figura 32 se observa que la grasa sustituta de la manteca de cacao inicia su etapa de cristalización en 24.3 °C. Se observa un pico que tiene su máximo valor a 12.67 °C con una ΔH de -99.43 J/g, en este termograma se aprecia el final de la cristalización a 3.2 °C, ya que si regresa a la línea base, se considera que para esta grasa el programa de temperatura y tiempo si es adecuado. En la etapa de calentamiento la fusión inicia en 21.07 °C, el único pico que se forma tiene un valor máximo a 32.95 °C y un valor ΔH de 110.13 J/g, la fusión parece terminar a 35.53°C. El pico observado coincide con lo reportado por Lovegren y col., (1976) para una grasa láurica, ellos indicaron que el pico encontrado por su temperatura de fusión correspondía a la formación de cristales β’, de manera que se asume que la cristalización en la grasa sustituta de la manteca de cacao corresponde a la forma β’. Lovegren y col. (1976) publicaron los termogramas correspondientes a cada una de las 6 formas polimórficas que puede presentar la manteca de cacao, tres termogramas que registraban cada uno un pico, los picos eran diferentes, pero tenían en común el punto máximo a una temperatura de 20°C, le denominaron forma V, los termogramas obtenidos de la manteca mexicana y cubana coinciden en la forma y temperatura de los picos reportados por Lovegren y col., por lo que se asume que la forma cristalina presente en las manteas de cacao es la forma V, es importante mencionar que Lovegren y col., asignaron de manera inversa la nomenclatura de los 6 tipos de cristales de la manteca de cacao, por lo que de acuerdo a la nomenclatura actual la forma polimórfica determinada corresponde a la forma II ó “α”. En el Cuadro 28 se muestran los valores de punto de fusión de cada muestra determinado por CDB y por el método de la A.O.C.S. Cc 1-25 y Cc 3-25 (1994). Los valores de punto de fusión obtenidos mediante calorimetría diferencial de barrido fueron inferiores a los obtenidos mediante la técnica de análisis de punto de fusión por capilar, únicamente el punto de fusión de la grasa reemplazante de la manteca de cacao fue similar. 108 Cuadro. 28. Análisis comparativo del punto de fusión (°C) en mantecas de cacao y en grasas alternativas de la manteca de cacao, obtenidos por calorimetría diferencial de barrido y método AOCS. MCM Punto de fusión por CDB °C 20.15 MCC 20.99 32 GEMC 17.34 33 GRMC 34.89 35 GSMC 32.95 34 Muestra Punto de fusión Capilar °C 31.5 MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de la manteca de cacao. Se concluye que las condiciones de temperatura y tiempo durante la cristalización influyen en la o las formas polimórficas que presentan las grasas, de manera que un estudio mediante calorimetría diferencial de barrido constituye una herramienta para detectar de manera mas detallada el polimorfismo, ya que se tiene mayor control de la temperatura y velocidad de enfriamiento. En la manteca de cacao que se esperaba presentara la forma V, debido al tratamiento térmico únicamente se detectó la forma II. 4.3.4 Polimorfismo Determinado por Difracción de Rayos X Se utilizó la Ley de Bragg (nλ=2dsenθ) para interpretar los difractogramas obtenidos de las mantecas en estado puro, y de los productos elaborados, recordando que el ángulo θ es el ángulo de incidencia del rayo X relativo al plano del cristal, λ es la longitud de onda del rayo X, d en Å es la distancia repetida entre dos planos reticulares , los valores “d” estos corresponden a los espacios cortos de la cadena de carbonos y en base a estos se establece el polimorfismo. En la Figura 33, se muestra el patrón obtenido por difracción de rayos X de la muestra de manteca de cacao de origen mexicano, y en la Figura 34 se muestra el patrón obtenido de la manteca de origen cubano. Como se observa las señales registradas se ubicaron entre los 10 y 27 grados. Hubo una mayor intensidad en los picos entre los 19-20 2θ (los espacios cortos son observados alrededor de la 109 región 2θ de 16-25 de acuerdo a D’Souza y col, 1990). Las imágenes que se observan, corresponden a la existencia de una estructura consistente de la forma V, que es la forma deseada en la manteca de cacao. 6000 Intensidad, cuentas 5000 4000 3000 2000 1000 0 8 10 12 14 16 18 20 22 24 26 28 30 32 34 32 34 2 Tetha, grados Figura 33. Patrón de DRX obtenidos entre 19-20 2θ de manteca de cacao de origen mexicano a temperatura ambiente, el patrón corresponde a la forma V ó B. 5000 Intensidad, cuentas 4500 4000 3500 3000 2500 2000 1500 1000 500 0 8 10 12 14 16 18 20 22 24 26 28 30 2 Theta, grados Figura 34. Patrón de DRX de la manteca de cacao de origen cubano a temperatura ambiente, el patrón corresponde a la forma V ó B. 110 En las Figuras 35, 36 y 37 se muestran los difractogramas de las muestras de las grasas equivalente, reemplazante y sustituta de la manteca de cacao respectivamente. Se observa que no hay parecido entre los patrones que se obtuvieron de las mantecas alternativas de la manteca de cacao respecto a la manteca de cacao. Intensidad, cuentas 2500 2000 1500 1000 500 0 8 10 12 14 16 18 20 22 24 26 28 30 2 Theta, grados Figura 35. Patrón de DRX obtenidos entre 19-20 2θ de en modo 2θ de la grasa equivalente de la manteca de cacao a temperatura ambiente. En la Figura 35, se observa que los picos registrados para la grasa equivalente de la manteca de cacao se ubicaron entre los 16-25 2θ, se aprecia que tres picos al parecer tuvieron una intensidad muy parecida entre los 20 y 23 2θ Las muestras de las grasas reemplazante y sustituta de la manteca de cacao (Figura 36 y 37), sí presentan cierta similitud entre ellas, estas dos muestras registraron mayor intensidad entre lo 19 y 24 2θ , como se aprecia por el tamaño de las señales (picos). 111 32 34 EMC Intensidad, cuentas 3000 2500 2000 1500 1000 500 0 8 10 12 14 16 18 20 22 24 26 28 30 32 34 32 34 2 Theta, grados Figura 36. Patrón de DRX obtenido en modo 2θ de la grasa reemplazante de la manteca de cacao a temperatura ambiente. 3500 intensidad, cuentas 3000 2500 2000 1500 1000 500 0 8 10 12 14 16 18 20 22 24 26 28 30 2 Theta, grados Figura 37. Patrón de DRX obtenido en modo 2θ de la grasa sustituta de la manteca de cacao a temperatura ambiente. En el Cuadro 29 se indican los valores en Å de los espacios cortos “d” en las cadenas de carbonos de los ácidos grasos, estos valores se obtuvieron utilizando el valor del ángulo 2θ de cada señal registrada (Figuras 33-37) y sustituyendo en 112 la ecuación de la Ley de Bragg. Las muestras de manteca de cacao (MCM y MCC), mostraron una señal muy fuerte a 4.57 Å, este resultado concuerda con lo reportado para la manteca de cacao en su forma polimórfica V (D’Souza y col., 1990), por lo que se comprueba la formación de cristales en su forma V bajo las condiciones de temperatura que se manejaron. Cuadro 29. Resultados del análisis por difracción de rayos X. Espacios cortos y la correspondiente forma del cristal. Muestra MCM MCC GEMC GRMC GSMC Valor “d” (Å) 4.57 MF, 3.98F, 3.86R, 3.74R, 3.67R, 5.39D 4.57 MF, 3.98F, 3.74R, 3.86R, 3.67R, 4.07D 4.20MF, 3.84F, 4.32D, 4.03D 4.22MF, 3.81MF, 4.03F, 4.39F 4.57MF, 4.24F, 4.3F, 3.96F, 3.73D Forma Β (V) Β (V) Β β’ β’ MCM, manteca de cacao mexicana; MCC, manteca de cacao cubana; GEMC, grasa equivalente de manteca de cacao; GRMC, grasa reemplazante de manteca de cacao; GSMC, grasa sustituta de manteca de cacao. Los resultados corresponden a los espacios cortos en Å. MF, muy fuerte; F, fuerte; R, regular; D, débil. Para las grasas alternativas de la manteca de cacao no se encontró algún dato como tal para comparar, sin embargo, asumiendo que la grasa sustituta de la manteca de cacao es de aceite de almendra de palma, se hizo la comparación con el reporte de D’Souza y col., (1990), para aceite de almendra de palma, dado que los valores son similares, por lo que se cree que la grasa sustituta de la manteca de cacao cristaliza en la forma β’. En la grasa reemplazante se consideró lo reportado por D’Souza y col. (1990) para mantecas vegetales, que aunque no especifican con que están elaboradas, los resultados coinciden, por lo que se cree que la forma cristalina encontrada en la grasa reemplazante corresponde a la forma β’ también. 113 4.4 Elaboración y Evaluación de Chocolate Análogo 4.4.1 Elaboración de Masas de Chocolate Análogo Se elaboraron masas de chocolate de acuerdo a las fórmulas descritas en el desarrollo experimental. En el Cuadro 30 se indica el tiempo de permanencia en el molino de bolas, como se observa, fue una hora el tiempo requerido para que estuvieran perfectamente integrados los ingredientes, con excepción de la fórmula que tuvo 100% manteca de cacao, que requirió 50 minutos. La variación en los porcentajes de una a otra formulación no afectó de manera importante en el tiempo de mezclado y refinado (permanencia en WA-FA). Para realizar la evaluación sensorial se decidió moldear las masas en forma de tabletas. Cuadro 30. Condiciones de preparación y moldeo de chocolate y productos sabor a chocolate FÓRMULA TMC TMC-GEMC TGEMC TGEMC Repetición TGRMC TGSMC Permanencia en WA-FA minutos 50 60 60 60 60 60 Atemperado °C 45-28-31 45-28-30.3 45-28-31.4 45-28-30.5 45-36 45-35 4.4.2 Curvas de Atemperado La manteca de cacao requiere de temperaturas especiales para su correcta cristalización, la cual se logra exitosamente por medio el atemperado. En el Cuadro 30 se indican las temperaturas a las que se atemperó la masa elaborada con manteca de cacao y en la Figura 38 se presenta la curva correspondiente. El perfil de ácidos grasos de la grasa equivalente fue muy parecido al de la manteca de cacao, en varios de los análisis se pudieron observar resultados parecidos entre estas dos grasas, y la necesidad de atemperar también es otra característica que comparten. 114 50 45.0 °C Temperatura °C 45 40 35 31.0°C 28.0°C 30 25 20 1 2 Etapas de atemperado 3 Figura 38. Curva de atemperado para la masa de chocolate TMC En el Cuadro 30 se indican las temperaturas a la que se atemperó la masa elaborada con manteca de cacao 5% de grasa equivalente (TMC-GEMC), así como la masa de chocolate análogo elaborada 100% de grasa equivalente (TGEMC). En la Figura 39 se presenta la curva correspondiente para TMCGEMC. 50 45.0 °C Temperatura °C 45 40 35 30.3°C 28.0°C 30 25 20 1 2 3 Estapas de atemperado Figura 39. Curva de atemperado para la masa de chocolate análogo TMC-GEMC 115 En el caso de la masa de chocolate análogo TGEMC se presentaron problemas de cristalización, las condiciones de atemperado que se usaron fueron, enfriar de 45 °C a 28 °C de acuerdo al método de atemperado manual o artesanal, y llegar a una temperatura final de 31.4 °C. Se moldeó la masa, pero se presentaron los siguientes problemas: requirió de más tiempo para solidificar y además no cristalizó de manera homogénea, al momento de desmoldar se quedo parte del producto en los moldes, presentó una apariencia manchada y sin brillo en algunas zonas, en la Figura 40 se muestra una imagen del aspecto que tuvieron las tabletas. Figura 40. Tableta de chocolate análogo elaborado con grasa equivalente de la manteca de cacao, que presentó problemas de brillo y color . Se concluyó que los defectos que se observan en la Figura 40 se debieron a que las temperaturas de atemperado no fueron adecuadas, es importante mencionar que para la elaboración de chocolates hay mucha información de las condiciones de atemperado, pero para atemperar las grasas alternativas de la manteca de cacao es necesario que el productor de chocolates o chocolates análogos establezca esas condiciones. La temperatura a la que se decidió moldear fue de 31.4 °C, asumiendo que se iba a presentar un comportamiento como la manteca de cacao, pero no fue así. Se elaboró nuevamente la masa de chocolate análogo TGEMC, modificando únicamente la temperatura final de atemperado. En el Cuadro 30 se presentó la modificación realizada. Los resultados obtenidos después de la modificación fueron buenos, ya que no se presentó ninguno de los defectos que se habían observado. 116 En la Figura 41, se muestran las curvas que se emplearon para atemperar las masas de chocolate análogo TGEMC. La curva en color negro es la que se recomienda para atemperar este tipo de grasa. 50 45.0°C Temperatura °C 45 40 45.0°C 35 31.4 °C 28.0°C 30 30.5°C 28.0°C 25 20 1 2 3 Etapas de atemperado TGEMC TGEMC Repetición Figura 41. Curva de atemperado para la formulación TGEMC. 4.5 Producción de Tabletas de Chocolate Análogo Con las masas chocolate análogo se elaboraron tabletas utilizando moldes de policarbonato, se eliminó el aire atrapado con ayuda de una mesa vibradora. Para que solidificaran las tabletas se empleo un túnel de enfriamiento y una vez sólidas, se desmoldaron y evaluaron. En el Cuadro 31 se indican los tiempos y temperaturas con que se trabajo cada producto. 117 Cuadro 31. Condiciones enfriamiento para la solidificación de las tabletas de chocolate análogo. Enfriamiento en túnel FÓRMULA TMC Tiempo minutos 30 Temperatura entrada °C 10 Temperatura salida °C NR* TMC-GEMC 30 11 15.6 TGEMC 30 10 15.4 TGRMC 15 10 15.4 TGSMC 15 10 15.4 *NR, no registrado. TMC, tabletas con manteca de cacao; TMC-GEMC 5% tabletas con manteca de cacao y 5% grasa equivalente; TGEMC, tabletas con grasa equivalente de la manteca de cacao; TGRMC, tabletas con grasa reemplazante de la manteca de cacao; TGSMC, tabletas con grasa sustituta de la manteca de cacao. Se observa en el Cuadro 31 que las tabletas TGRMC y TGSMC cristalizaron en la mitad del tiempo que requirieron las tabletas TMC, TMC-GEMC y TGEMC, estos resultados coinciden con los datos obtenidos mediante microscopia (Figura 26 y 27) y calorimetría diferencial de barrido (Figura 31 y 32) que indicaron una cristalización más rápida en comparación con la manteca de cacao. Desde el punto de vista tecnológico, es deseable una rápida cristalización pues se ahorra energía, y se disminuyen tiempos de proceso, por lo que se cree es una buena opción el usar este tipo de grasas. En la Figura 42 se muestra de manera resumida mediante imágenes el proceso de elaboración de las tabletas de chocolate análogo. 118 1 2 3 4 5 6 7 8 9 10 11 Figura 42. Proceso de elaboración de tabletas de chocolate análogo. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Pesado de ingredientes. Inspección de equipo y establecer condiciones. Mezclado de ingredientes (refinación, conchado). Producto terminado. Verificación de condiciones molde . Vaciado en moldes si el producto no requiere atemperado. Atemperado de producto. Moldeado de producto. Mesa vibratoria para sacar burbujas de aire. Túnel de enfriamiento Desmoldado. 119 4.5.1 Evaluación Tecnológica de las Tabletas de Chocolate Análogo Al estar sólidas las tabletas, se realizó una evaluación, para establecer como afecta cada una de las grasas en las características de producto terminado, se evaluó la cristalización, la contracción, la facilidad en el desmolde, así como la apariencia externa. En la Figura 43, se muestra una imagen con una tableta de cada formulación elaborada. Se observó que el color en las tabletas es igual a simple vista, aunque por el efecto de la luz al tomar la fotografía no se aprecia de manera homogénea el brillo. Al hacer la evaluación, las tabletas de la formulación TSMC, presentaron mayor brillo. TMC TMC-GEMC TGEMC TGRMC TSMC Figura 43. Tabletas elaboradas con manteca de cacao TMC, con manteca de cacao y 5% grasa equivalente TMC-GEMC 5%; con grasa equivalente de la manteca de cacao TGEMC; con grasa reemplazante de la manteca de cacao TGRMC y con grasa sustituta de la manteca de cacao TGSMC. Las tabletas presentaron un color homogéneo, sin manchas ni rayas o grietas. En el Cuadro 32 se indican los resultados de la evaluación de algunos atributos que son de importancia en el chocolate. 120 Cuadro 32. Evaluación de aplicación y funcionalidad de las tabletas de chocolate análogo. TMC Parámetro Cristalización (rapidez) B TMCGEMC B Contracción B Fácil desmolde Fisuras o grietas Brillo Betas, o color blanco TGEMC TGRMC TGSMC R MB MB B B B MB B B B B MB NP NP NP NP NP B MB B MB MB NP NP NP NP NP E; excelente; MB, muy bien; B, bien; R, regular; M, Malo;P, presentó; NP, no presentó. TMC, producto con manteca de cacao; TMC-GEMC 5% tableta con manteca de cacao y 5% manteca equivalente; TGEMC, tableta con grasa equivalente de la manteca de cacao; TRMC, tableta con grasa reemplazante de la manteca de cacao; TSMC, tableta con grasa sustituta de la manteca de cacao. 4.5.2 Color y aw en las Tabletas de Chocolate Análogo. La proliferación de levaduras y mohos se da a partir de valores de aw de 0,6 y a valores de 0,5 no hay proliferación microbiana (Fennema, 1998). Los valores obtenidos de aw en las tabletas se muestran en el Cuadro 33, se considera que en las tabletas difícilmente habrá proliferación microbiana, pero si pueden presentarse reacciones de oxidación no enzimática o enzimática, reacciones que se pueden presentar, debido a que las tabletas contiene alrededor de 35 % de grasa. Es muy importante tener en cuenta el buen manejo del producto, especialmente, el uso de barreras físicas como envolturas y empaques, que deben ser adecuados para proteger de humedad, luz y trazas de metales, que son iniciadores de la oxidación no enzimática. De manera especial es necesario impedir la hidrólisis, ya que como resultado de esta reacción los ácidos grasos quedan libres, dando lugar a sabores indeseables, por ejemplo, las tabletas hechas con la grasa laúrica, si se presenta hidrólisis, el sabor a ácido graso láurico o sabor a “jabón” se percibirá notablemente, afectando su calidad y aceptación (AarhusKarlshamn, 2006). 121 Cuadro 33. Valores de color y aw en tabletas de chocolate análogo Color (Atlas) Producto Aw N M Y Color (Hunter) L a B PMC 0.492 ±0.019 90 99 60 20.98 5.72 3.04 PMC-EMC5% 0.496 ±0.018 90 99 60 30.37 5.23 3.88 PEMC 0.498 ±0.018 90 99 80 28.77 5.87 4.08 PRMC 0.499 ±0.026 80 80 80 30.84 5.52 4.21 PSMC 0.477 ±0.005 80 50 50 31.05 6.45 4.98 Donde N, corresponde al negro; M, corresponde al magenta y Y corresponde al amarillo. En el Cuadro 33, se observa que las tabletas que se elaboraron con mantecas alternativas presentan mayor luminosidad “L” que las tabletas elaboradas únicamente con manteca de cacao. Las tabletas TGSMC son las que presentaron mayor luminosidad, este resultado concuerda con la evaluación del brillo (Cuadro 32) que se hizo posteriormente al desmolde. Es importante notar que en las tabletas TMC-GEMC es mayor la luminosidad que la detectada en las tabletas TMC y TGEMC, lo que permite suponer que una opción para mejorar el brillo de la manteca de cacao es mezclando con grasa equivalente, como se hizo en la formulación TMC-GEMC, este resultado de mayor luminosidad también coincide con la evaluación que se mostró en el Cuadro 32. Cabe mencionar que esta prueba de color usando el sistema Hunter no se realizó de manera inmediata a la elaboración de las tabletas, sin embargo, con base en los resultados obtenidos se cree que los productos mantuvieron su brillo. También se muestra en el Cuadro 33 los valores de color obtenidos mediante el Atlas de colores (Küppers, 2002), únicamente las tabletas TMC y TMC-GEMC presentan los mismos valores. 122 4.6 Evaluación Sensorial de las Tabletas de Chocolate Análogo La evaluación sensorial la realizaron 7 jueces entrenados del Instituto de Investigaciones para la Industria Alimenticia (Ciudad de la Habana, Cuba). Los datos obtenidos se procesaron mediante un análisis de varianza de clasificación simple (1-vía) para cada atributo sensorial. En los atributos que se encontró diferencia significativa (p<0.05) se realizó una prueba de comparación múltiple de Duncan para ver cuáles eran significativamente diferentes. De manera resumida se presentan en la Figura 44 todos los atributos evaluados por medio de un Diagrama Radial. Uniformidad del color 10 Cerosidad 8 Brillo 6 Suavidad Intensidad del olor 4 2 0 Cremosidad Olor extraño Derretimiento Intensidad del sabor Dureza TMC TMC-GEMC Sabor extraño TGEMC TGRMC TGSMC Figura 44. Atributos evaluados sensorialmente en tabletas sabor chocolate (Diagrama Radial) Los resultados del análisis sensorial del atributo uniformidad de color se muestran en la Figura 45. Los jueces indicaron que todas las tabletas presentaron uniformidad en el color. 123 El brillo es el resultado una correcta alineación de los cristales, de la creación de la forma cristalina correcta. La correcta cristalización se logra mediante un buen atemperado, así como condiciones de enfriamiento y almacenamiento adecuados Jorge, 2007. 10 9 8 7 6 5 4 3 2 1 0 Uniformidad del color TMC TMC-GEMC Brillo TGEMC TGRMC TGSMC Figura 45. Resultados de la evaluación a las tabletas sabor chocolate en sus atributos: Uniformidad de color y Brillo. Anteriormente en los Cuadros 32 y 33 se indicó que presentaron mayor brillo y luminosidad las tabletas TGSMC. La evaluación de los jueces indicó que todas las tabletas con excepción de las tabletas TMC tuvieron buen brillo, como se observa en la Figura 45, de acuerdo al análisis hay diferencias significativas entre las tabletas TMC y el resto de las tabletas de las otras formulaciones.. En la Figura 46, se muestran los resultados de la evaluación a los atributos Intensidad del olor y sabor, así como presencia de olor y sabor extraño. Los jueces indicaron que las tabletas TMC y TMC-GEMC presentaron mayor intensidad en el olor, no existen diferencia significativa entre ellas, la misma intensidad del olor se percibirá si se agrega o no grasa equivalente de la manteca 124 de cacao, este resultado es bueno desde el punto de vista económico, ya que la grasa equivalente es más económica que la manteca de cacao y con base al resultado obtenido se cree que la adición de la grasa equivalente no afectará en el olor del producto, pero si será más económico. 10 9 8 7 6 5 4 3 2 1 0 Intensidad del olor Olor extraño TMC TMC-GEMC Intensidad del sabor TGEMC TGRMC Sabor extraño TGSMC Figura 46. Resultados de la evaluación a las tabletas sabor chocolate en sus atributos: Intensidad del olor, olor extraño, intensidad del sabor, sabor extraño. La razón de que se perciba en estas tabletas mayor intensidad del olor a chocolate es la presencia de la manteca de cacao, ya que como se mencionó en el Cuadro 21 la manteca de cacao aun sin cocoa tiene el olor a chocolote. Los jueces indicaron que las tabletas TGSMC y TGEMC son las que menos intensidad en el olor presentaron, no hay diferencia significativa entre ellas en este atributo, es indistinto que se use cualquiera de las grasas GSMC y GEMC el olor a chocolate será poco intenso. En el Figura 46 se observa que en las tabletas TGEMC y TGSMC se percibió un olor extraño al chocolate, sin embargo, no es significativa. Por lo cual se asume que las grasas alternativas de la manteca de cacao no aportan olor. 125 De igual manera que en la evaluación del atributo intensidad en el olor, los jueces indicaron que las tabletas TMC y TMC-GEMC presentan mayor intensidad en el sabor a chocolate, no hay diferencia significativa entre los resultados de la evaluación, por lo que es indistinto se adicione o no grasa equivalente de la manteca de cacao en 5%. Nuevamente se asume este resultado como una ventaja para disminuir costos de producción. La presencia de la manteca de cacao aporta el sabor a chocolate de manera más intensa. De acuerdo a los jueces en las tabletas TGEMC y TGSMC se percibió muy poca intensidad en el sabor a chocolate, las diferencias entre estas tabletas no fueron significativas, por lo que es indistinto cual grasa se use, el resultado será el mismo, baja intensidad de sabor a chocolate. En cuanto al atributo olor extraño, como se observa en la Figura 46, nuevamente en las tabletas TGEMC y TGSMC de acuerdo a la evaluación de los jueces se percibió un olor extraño, sin embargo estos resultados no son significativos. En la Figura 47 se muestran los resultados de la evaluación de los atributos dureza, derretimiento, cremosidad, suavidad y cerosidad. La dureza de un producto se percibe en la boca comprimiendo el producto entre los dientes o entre la lengua y el paladar. Este atributo sensorial como ya se mencionó tiene mucha relación con el contenido de sólidos grasos (Figura 8) y el grado de cristalización. 126 10 9 8 7 6 5 4 3 2 1 0 Dureza Derretimiento TMC Cremosidad TMC-GEMC TGEMC Suavidad TGRMC Cerosidad TGSMC Figura 47. Evaluación de las tabletas sabor chocolate en sus atributos: Dureza, derretimiento, cremosidad, suavidad, cerosidad. De acuerdo a la evaluación de los jueces las tabletas TGSMC fueron las que se percibieron con mayor dureza, la razón de que se perciba como la más dura, es debido a su contenido de sólidos grasos, que de acuerdo a Cuadro 25 fueron los más altos a 20°C en comparación con las demás grasas. La diferencia en dureza entre las tabletas TGSMC y el resto de las tabletas es significativa, pero entre las tabletas TMC, TMC-TGEMC y TGEMC no existe diferencia significativa, de acuerdo al Cuadro 25, el perfil de sólidos grasos de la manteca de cacao y la grasa equivalente de la manteca de cacao tiene cierta semejanza, de manera que la percepción de que tiene la misma dureza las tabletas que se elaboraron con estas grasas es congruente. En la evaluación del atributo derretimiento los jueces indicaron que las tabletas TGEMC mostraron mayor derretimiento. Las tabletas TMC-TGEMC también mostraron un mayor derretimiento, sin embargo, las diferencias entre TMCTGEMC y TGEMC fueron significativas. Considerando que presentan mayor derretimiento las tabletas que tienen 5% de grasa equivalente de la manteca de 127 cacao, que las tabletas elaboradas con el 100% de manteca cacao, puede asumirse que el adicionar un 5% de grasa equivalente ayudará a mejorar este atributo en la manteca de cacao. Los jueces indicaron que las tabletas TGRMC y TGSMC presentaron un derretimiento lento, no existen diferencias significativas entre los resultados de estas tabletas, por lo que es indistinto se use la grasa reemplazante o la grasa sustituta de la manteca de cacao, el resultado será un pobre derretimiento al consumir estas tabletas. Los jueces indicaron que las tabletas TMC-GEMC se percibieron como las más cremosas, se encontraron diferencias significativas entre estas tabletas y el resto de la tabletas. Se asume que la adición de 5% de grasa equivalente de la manteca de cacao mejora el atributo cremosidad en la manteca de cacao es importante se mejore este atributo en cualquier producto pues se relaciona con la sensación de llenura en la boca. Como se observa en la Figura 49 las tabletas TMC y TGRMC también se percibieron como cremosas, no hay diferencias significativas en el nivel de cremosidad que percibieron los jueces en estas tabletas. Las tabletas TGEMC y TGSMC de acuerdo a la evaluación de los jueces fueron las menos cremosas, no existen diferencias significativas en el nivel de cremosidad detectado. En relación al atributo suavidad, como se observa en la Figura 47, los jueces indicaron que la suavidad se presentaba notablemente en todas la tabletas, aunque en las tabletas TMC-GEMC se percibía más este atributo las diferencias no fueron significativas. Recordando que este atributo se refiere a la geometría, tamaño y forma de las partículas que componen al chocolate en este caso al chocolate análogo, se asume que cualquiera de las grasas permite lograr un producto que se percibe como suave siempre y cuando el proceso no tenga deficiencias. En el atributo cerosidad, las tabletas TMC y TMC-GEMC se percibieron como menos cerosas, no se encontraron diferencias significativas entre ellas, sin embargo, respecto a las demás tabletas (TGEMC, TGRMC y TGSMS) sí se encontraron diferencias. Las tabletas TGEMC, TGRMC y TGSMC se percibieron como cerosas, no se encontraron diferencias significativas entre ellas en este 128 atributo. Se sugiere que sin importar que grasa alternativa de la manteca de cacao se utilice, se percibirá ceroso el producto en comparación con uno que lleve manteca de cacao. Es precisamente en este atributo en el que se percibe la diferencia que hay entre las grasas vegetales y la manteca de cacao, ya que muchas veces el consumidor percibe que no es chocolate lo que esta comiendo debido a la sensación cerosa que le causa en la boca el producto. 129 V. CONCLUSIONES 1. La manteca de cacao de origen mexicano, la manteca de cacao de origen cubano, y las grasas alternativas de la manteca de cacao tienen características fisicoquímicas que cumplen con las especificaciones de las normas mexicanas por lo que son aptas para su uso en la elaboración de productos. 2. El perfil de ácidos grasos es muy similar entre las mantecas de cacao de diferente origen. De las tres grasas alternativas de la manteca de cacao analizadas, únicamente la grasa equivalente de la manteca de cacao presenta semejanza al perfil de ácidos grasos de la manteca de cacao. 3. En las mantecas de cacao de diferente origen y en la grasa sustituta de la manteca de cacao no se detectaron ácidos grasos trans. En la grasa reemplazante de la manteca de cacao se detectaron ácidos grasos trans y en la grasa equivalente de la manteca de cacao se detectó 0,5% de ácidos grasos trans. 4. La grasa reemplazante de la manteca de cacao y la grasa sustituta de la manteca de cacao cristalizan en la mitad del tiempo requerido por la manteca de cacao y grasa equivalente. 5. Las grasas reemplazante y sustituta de la manteca de cacao forman de manera directa cristales de forma β’, las mantecas de cacao y manteca equivalente presentan polimorfismo, los resultados de los diferentes estudios permitieron identificar las formas γ, α, y β bajo diferentes condiciones de estudio. 6. En base a los ácidos grasos presentes en las grasas se presenta una compatibilidad en la manteca de cacao con la grasa equivalente de la manteca de cacao, la manteca de cacao es parcialmente compatible con la grasa reemplazante de la manteca de cacao y es incompatible con la grasa sustituta de la manteca de cacao. 130 7. Las formulaciones para elaborar chocolate análogo que incluyan manteca de cacao y/o grasa equivalente de la manteca de cacao deben atemperarse para lograr la correcta cristalización. Las formulaciones que incluyan grasa reemplazante o grasa sustituta de la manteca de cacao no se atemperan. 8. La intensidad del olor y sabor característico a chocolate será mayor siempre que se use manteca de cacao, aun cuando se mezcle con grasa equivalente de la manteca de cacao. El empleo de las grasas alternativas de la manteca de cacao causa una baja intensidad del olor y sabor a chocolate. 9. La manteca de cacao permite tener un derretimiento rápido, aporta cremosidad y suavidad, además de contribuir a una percepción mínima de cerosidad. 10. La manteca sustituta de la manteca de cacao es una alternativa que contribuye a lograr mayor brillo y luminosidad, incrementa la dureza “snap” al partir la tableta y al comer tabletas de chocolate análogo hecho con la grasa sustituta se percibe suavidad. Y es la grasa alternativa más económica 11. La grasa equivalente de la manteca de cacao, mejora los atributos de la manteca de cacao como el derretimiento, la cremosidad, y no afecta la intensidad del olor y sabor a chocolate cuando se mezcla con manteca de cacao. 12. La grasa reemplazante de la manteca de cacao es una grasa que en los atributos sensoriales se encuentra de manera general en un punto intermedio en relación a las grasas equivalente y sustituta. 131 VI. BIBLIOGRAFÍA AarhusKarlshamn México. 2006. Seminario de Grasas y Aceites comestibles. Morelia, Michoacán. AarhusKarlshamn México. 2008. Comunicación personal. American Oil Chemist Society (AOCS). 1994. Official Methods and Recommended Practices , Volume I and II American Oil Chemist Society (AOCS) 2006 Official Methods and Recommended Practices , Volume I Association of the Chocolate, Biscuit and Confectionery Industries of the EU/International Confectionery; Association Statistical Bulletin 2003. ACOBISCO. Awad S. T. and Marangoni A. G. 2005. Comparison Between Image Analyses Methods for the Determination of the Fractal Dimension of Fat Crystal Networks. Chapter 11. In Marangoni A. G. (Ed) Fat Crystal Networks. Marcel Decker 381-386 Awad S. T., Rogers M. A. and Marangoni A. G. 2004. Scaling Behavior of the Elastic Modulus in Colloidal Networks of Fat Crystals J. Phys. Chem. B 108:171179 Bathena J. S. 1992. Fatty Acids and Diabetes. Chapter 36. In Kuang Ch. (ed) Fatty Acids in Foods and their Health Implications. 10 a Edition Marcel Dekker Inc. pp 831-833 Baur J. F. 1995. Analytic Methods for Oils and Fats. Chapter 14. In Lawson H. (ed). Foods oils and fats. Technology, Utilization, and Nutrition. Chapman Hall. pp 283-287 Becerra R. J. 2005. Ácidos grasos trans: Problemas y Soluciones. México. Revista ANIAME: XVIII: 10:48. 132 Beckett S.T. 2000. La Ciencia del Chocolate. Ed. Acribia S.A. pp 55-73, 97-117. Birker P. J. and Padley F. B. 1987. Chapter 1. Physical Properties of Fats and Oils. In Hamilton R. and Bhati A., (Ed) Recent Advances in Chemistry and Technology of Fats and Oil Elservier Applied Science Publishers LTD. pp 2-11 Boamin L. Sebright J. Shi Y, Hartel R, and Perepezko J. 2006. Approaches to Quantification of Microstructure for Model Lipid Systems. J. Am. Oil Chem. Soc., 83(5):389-399 Bohinski R. 1991. Lípidos, Membranas y Receptores. Capítulo 11. Bioquímica 5ª Edición Ed. Addison-Wesley Iberoamericana pp 418-430 Buchgraber M, Ulberth F. and Anklam E. 2004. Cluster Analysis for the Systematic Grouping of Genuine Cocoa Butter and Cocoa Butter Equivalent Samples Based on Triglyceride Patterns. J. Agric. Food Chem., 52:3855-3860 Buchgraber M, Androni S. and Anklam E. 2007. Determination of Cocoa Butter Equivalents in Milk Chocolate by Triacylglycerol Profiling. J. Agric. Food Chem., 55:3284-3291 Cakebread S. H. 1981. Dulces elaborados con azúcar y chocolate. Edición en español . Acribia. pp 11-29, 49-65 Campos R. 2005. Experimental Methodology. Chapter 9 . In Marangoni A. (Ed) Fat crystal Networks. Marcel Decker. pp 267-348 Capdevila Q. y Jorge M.C. 2005. La bombonería aretesanal. Conceptos básicos fundamentales. IIIA. Pp 33-35 Chaiseri S. and Dimick P.S. 1989. Lipid and hardness characteristics of cocoa Butters from different Geographic Regions. J. Am. Oil Chem. Soc., 66(11):17711776 133 Chardigny J. M., Clouet P., Combe N., Quignard-Boulangé A., Schmitt B., Lagarde M. And Leger C.L. 2007. Metabolism of trans and conjugated fatty acids. European Journal of Lipid Science and Technology 109:930-934 Charley H. 2005. Tecnología de Alimentos. Procesos químicos y físicos en la preparación de alimentos. Editorial Limusa. pp 305-308, 310-320 CODEX STAN 86-1981, Rev. 1-2001 Norma para la Manteca de Cacao pp 1-2 Cullity B.D. 1990. Elements of X-ray Difracction. Second Edition. Editorial Wesley. pp 81-87 Davis T. and Dimick P. 1989. Lipid Composition of High-Melting Seed Crystals Formed During Cocoa Butter Solidification. J. Am. Oil Chem. Soc., 66(10):14941498 De Man. 1992. Chemical and Physical Properties of fatty acids in Fatty acids. Chapter 2. In Kuang Ch. (Ed) Foods and their health implications. Marcel Dekker Inc. 17-45 Destaillats F., Wispelaere M., Jofree F., Golay P.A., Hug B., Giuffrida F., Fauconnot L. and Dionisi F. 2006. Authenticity of milk fat analysis of triacylglycerols Application to the detection of partially hydrogenated vegetable oils. Journal of Chromatography. 1131: 227-234 Dijkstra A.J. 2007. Modification Processes and Food Uses. Chapter 4. In Gunstone F.D., Harwood J.L. and Dijkstra A.J. (ed) The Lipid Handbook. Third Edition CRC Press pp 323-326 Dimick P. and Manning D. M. 1987. Thermal and Compositional Properties of Cocoa Butter During Static Crystallization. J. Am. Oil Chem. Soc., 64(12):16631669 134 Dionisi F., Golay P., Hug B., Baumgartner M., Callier Ph. and Destaillats F. 2004. Triacylgrlycerol Analysis for the Quantification of Cocoa Butter Equivalents (CBE) I Chocolate: Feasibility Study and Validation. J. Agric. Food Chem., 52: 1835-1841 Directive 2000/36/EC of the European Parliament and of the Council relating to cocoa and chocolate products intended for human consumption . Off. J. Commission Eur. Commun. 2000, L197, 19-25. D´Souza V.D. deMan J.M. and deMan L. 1990. Short Spacings and Polymorphic Forms of Natural and Commercial Solid Fats: A Review. Journal American Oil Chemist Society., 67(11):835-844 Edwards W. P. 2002. The Science of Sugar Confectionary. Publishers by The Royal Society of Chemistry. pp 5-22 FAO.1991.Utilización de alimentos tropicales: Semillas oleaginosas tropicales. Organización de las Naciones Unidas para la Agricultura y la Alimentación Roma 47/5 ISBN 92-5-302800-9 FAO/WHO. 1994. Fats and oils in human nutrition. Rome, Food and Agriculture Organization. FDA Federal Register 2003. Rules and Regulations. 68(133):41434-41506 Fennema O. 1998 Agua y Hielo. Capitulo 2. En Química de los Alimentos 2a Edición. Ed Acribia pp 48-57. Foubert I., Dewettinck, K., Van de W, D,. Dijkstra A.J. and Quinn P.J. 2007. Physical Properties: Structural and Physical Characteristics. Chapter 7. In Gunstone F, Harwood J. and Dijkstra A (Ed) The Lipid Handbook. Third Edition CRC Press by Taylor & Francis Group 486-493 Foubert I, Vereecken R. Smith K. and Dewettinck K. 2006. Relationship between Crystallization Behavior, Microestructure, and Macroscopic Properties in Trans 135 Containing and Trans Free Coating Fats and Coatings. Journal Agricultural Food Chemistry, 54: 7256-7262 Foubert I, Vereecken J. Smith K. and Dewettinck K. 2007. Relationship between Crystallization Behavior, Microstructure, and Macroscopic Properties in transContaining and Trans Free Filling Fats and Fillings. J. Agric. Food Chem., 55:7793-7801 Garti, N.; Aronhime, J.S.; and Saring, S. 1989. The role of Chain and Emulsifier on the Polymorphism of mixtures of Triglycerides .J. Am. Oil Chem. Soc., 66(8):10851089 Guerrero, J.E. 2006. Elaboración de productos de panificación con bajo contenido de ácidos grasas trans. Tesis de Maestría en Ciencias de Alimentos. Escuela Nacional de Ciencias Biológicas del IPN. pp 52-60 Gunstone F. D. 2000. Composition and Properties of Edible Oils. Chapter 1. In Hamm W. and Hamilton R. (Ed). Edible oil Processing. Sheffield Academic Press. pp 2-29 Gunstone F. D. 2004. The Chemistry of oils and Fats Sources, Composition, Properties and Uses Blackwell Publishing LTD 1-35, 248-252 Gunstone F.D. and Harwood J.L. 2007. Occurrence and Characterization of Oils and Fats. Chapter 2. In Gunstone F.D., Harwood J.L. and Dijkstra A.J. (ed) The Lipid Handbook Third Edition CRC Press pp 55-59 Guyon F., Destousse S., Moustirats J., Esclapez M., Salagoity M. H. and Medina B. 2004. Alternative Method for the Quantification by Gas Chromatography Triacylglycerol Class Analysis of Cocoa Butter Equivalent Added to Chocolate Bars. J. Agric. Food Chem. 52:2770-2775 136 Hachiya I., Koyano T. and Sato K. 1989 a. Effects on Solidification Behavior of Cocoa Butter and Dark Chocolate. I. Kinetics of Solidification J. Am. Oil Chem. Soc., 66(12):1757-1762 Hachiya I., Koyano T. and Sato K. 1989 b. Effects on Solidification Behavior of Cocoa Butter and Dark Chocolate. II. Physical Properties of Dark Chocolate. J. Am. Oil Chem. Soc., 66(12):1763-1770 Hoerr C. W. and Paulicka F.R. 1968. The Role of X-Ray Diffraction in Studies of the Crystallography of Monoacid Saturated Triglycerides. J. Am. Oil Chem. Soc. Presented at the Joing Meeting, Washington D.C. April. ISC LAB 037. 2006. Cromatografía capilar de grasas y aceites. Manual de Técnicas de Análisis. AarhusKarlshamn México IUPAC 2.150 Ex 2.323 Solid content determination in fats by NMR Internacional Union of Rure and Applied Chemistry Standard Methods for the Análisis of Oils, Fats & Derivates, International Union of Pure and Applied chemistry. Oxford, UK: Blackwell Scientific Publications. Jandacek J. R. 1992. Commercial Applications of fatty Acid Derivates in Foods. Chapter 17. In Kuang Ch. (Ed). Fatty Acids in Foods and their Health Implications. 10 a Edition Marcel Dekker Inc. pp 411-414 Jewell G.G. 1988. Vegetable fats. Chapter 12. In Beckett S.T. (Ed) Industrial Chocolate manufacture and use. Glasgow and London Van Nostrand Reinhold. pp 227-236 Johansson D. and Björn B. 1995. Sintering of Fat Crystal Networks in Oil During Post-Crystallization Processes J. Am. Oil Chem. Soc. 72(8):911-919 Jorge Ma. C. 2007. Conceptos Básicos sobre los principios de sensorial. Conceptos Básicos de Tecnología de Transformación Evaluación del Cacao y 137 Elaboración de Chocolate. Instituto de Investigaciones para la Industria Alimenticia (Cuba). pp 66-86, 116-119. Jorge C. M. Bernal Z. y Perea J. 2001. Conceptos Básicos para la Elaboración de Productos de Chocolatería. ISBN 959-7003-09-0 (Cuba) pp 61-74 Kaarst J. R. 1984. Cacao y Chocolate. Capítulo 7. En Meiners K. y Kreiten H. (Ed) El Nuevo Manual para la Industria Confitera, Tomo II. Silesia-Essenzenfabrik. pp 669-673. Kamel S. B. and Kakuda Y. 1992. Fatty Acids in Fruits and Fruit Products. Chapter 10. In Kuang Ch. (ed) Fatty Acids in Foods and their Health Implications. 10 a Edition Marcel Dekker Inc. pp 280-282 Katan, M. B., Zock, P. L. Mensink, R. P. 1995. Trans fatty acids and their effects on lipoproteins in humans. Annual Review of Nutrition 15:473-493 Kellens M. 2000. Oil Modification Processes. Chapter 5. In Hamm W. and Hamilton R. (Ed) Edible oil Processing. Sheffield Academic Press. pp 129-137 Küpers H. 2002. Atlas de los colores. Ed. Blume, España. Lawson H. 1995. Foods oils and fats. Technology, Utilization, and Nutrition. Chapman Hall. pp 58-61, 212-214 Lee J. H., Govind K. and Brou K. 2006. Concentration and Distribution of Conjugated Linolénico Acids and Trans-fatty Acids in Small Ruminant Milk and Meat Lipids. Journal of Food Lipids 13:100–111 Lehninger A. 2004. Principles of Biochemistry. Fourth Edition. WH. Freeman and Company. pp 349-350 138 Liang B., Sebright J. L., Shi Y. Hartel R. W. and Perepezko J. H. 2006. Approaches to Quantification of Microstructure for Model Lipid Systems. Journal Am. Oil Chem. Soc. 83:5, 389-399 Lovegren, N. V.; Gray M. S. and Fuege R.O. 1976. Polymorphic Changes in Mixtures of Confectionary Fats J. Am. Oil Chem. Soc. 53(2):83-88 Mac N. W., Farhat I.A., Himawan C., Starov V.M., and Stapley A.G. F. 2006. A differential Scanning Calotimetry Study of the Crystallization Kinetics of Triestearin-tripalmitin mixtures. J. Am. Oil Chem. Soc. 83(1):1-9 Marangoni G.A. 2005. Crystallography. Chapter 1. In Marangoni G.A (Ed) Fat Crystal Networks. Marcel Decker pp 1-20 Martínez N. N. Andrés G. A. Chiralt B. A. y Fito M. P. 1999. Termodinámica y cinética de sistemas alimento entorno. IPN Dirección de Publicaciones y Materiales Educativos. Primera Edición. pp 233-235, 242-244 Mazzanti, G, Guthrie S. E, Sirota E. B. Marangoni A. G. and Idziak S. H. J. 2003. Orientation and Phase Transitions of Fat Crystals under Shear. Crystal Growth & Design 3(5):721-725 Mensink P. R. and Plat J. 2002. Dietary Fats and Coronary Heart Disease. Chapter 20. In Akoh C. and Min D.(ed) Food Lipids Chemistry, Nutrition, and Biotechnology. Second Edition. Editorial Marcel Dekker Inc. pp 608-615 Moreno E. R. 2000. Determinación de estructuras cristalinas, curso. Libro de resúmenes y apuntes del taller de cristalografía y Química Inorgánica. Sociedad Mexicana de Cristalografía A.C. Narine S. S. and Marangoni A. G. 2005. Microestructure. Chapter 7. Fat Cristal Networks. Marcel Decker pp 179-189 139 Nawar W. W. 1998. Lípidos. Capítulo 5. En Fennema O. (ed) Química de los Alimentos 2ª Ed. Editorial Acribia pp 270-287 Nilsson L., Alander J., Andersson A. Ch., Bagge C., Helmbring G., Hjorth M., Hägren J.,Komen G., Kristoffersson Ch., Modig M., Nilsson J., Norberg S., Pedersen M., Wennermak B., and Wennermark M. 2002. Handbook Vegetable Oils and Fats. Karlshamns AB Civilen Halmstad. First Edition pp 15, 23, 69-71, 112-130 NMX-F-009-SCFI-2005, Alimentos-Uso Industrial- Mantecas Vegetales y Grasas o Mantecas Mixtas o Compuestas- Especificaciones. Secretaría de Economía. NMX-F-037-SCFI-2006, Alimentos-Aceite de Almendra de Palma- Especificaciones. Secretaría de Comercio y Fomento Industrial. NMX-F-211-SCFI-2006 Alimentos-Aceites y Grasas vegetales o animalesDeterminación de humedad y materia volátil-Método de prueba. Secretaria de Comercio y Fomento Industrial. NMX-F-473-SCFI-2006 Alimentos-Aceites y Grasas vegetales o animalesDeterminación sensorial de impurezas indeseables-olor-Método de prueba. Secretaria de Comercio y Fomento Industrial. NMX-F-343-SCFI-2008, Alimentos-Manteca de Cacao-Especificaciones. Secretaría de Comercio y Fomento Industrial. NOM-186-SSA1/SCFI-2002, Productos y servicios. Cacao, productos y derivados .I Cacao. II Chocolate. III Derivados. Especificaciones sanitarias. Denominación comercial. Secretaría de Comercio y Fomento Industrial. NOM-043-SSA2-2005, Servicios básicos de salud. Promoción y educación para la salud en materia alimentaria. Criterios para brindar orientación. Secretaria de Economía. Oil World Annual. 2007. Publishers: ISTA Mielke GmbH, Hamburg, Germany. 140 Oh J.H. and Swanson B. G. 2006. Polymorphic Transitions of Cocoa Butter Affected by High Hydrostatic Pressure and Sucrose Polyesters. J. Am. Oil Chem. Soc. 83(12):1007-1014 O’Keefe S.F. 2002. Nomenclature and Classification of Lipids. Chapter 1. In Akoh C. and Min D. (ed) Food Lipids Chemistry, Nutrition, and Biotechnology. Second Edition. Editorial Marcel Dekker Inc. pp 1-5 OMS/FAO. 2002. Serie de Informes Técnicos, TRS, 916. en página web referencia pediatraldia. Pérez M. D., Álvarez S. C.; Morales R.J.A., Toro V.J.F. Charó A. M. y Dibildox A. E. 2005. The Effect of Supercooling on Crystallization of Cocoa Butter-Vegetable Oil-Blends. J. Am. Oil Chem. Soc., 82( 7):471-479. Podmore J. 2000. Applications of Edible Oils. Chapter 7. In Hamm W. and Hamilton R. (Ed) Edible oil Processing. Sheffield Academic Press. pp 191-194 Reddy S. Y., Full N., Dimick P.S. and Ziegler G.R. 1996. Tempering Method for Chocolate Containing Milk-Fat Fractions J. Am. Oil Chem. Soc. 73(6):723-727 Rodríguez Á. I. 2002. Introducción a la Evaluación Sensorial de Alimentos. Material Docente confeccionado para el Diplomado de Chocolatería. Impreso en IIIA Centro de documentación e información científico técnica. (Cuba) pp 2-17, 48-56 Roos Y. H. 1995. Phase transitions in foods. Academic Press Inc. pp 65-68, 142149. Sessa D.J. 1996. Derivation of a Cocoa Butter Equivalent from Jojoba Transesterified Ester via a Differential Scanning Calorimetry Index. J. Sci Food Agric. 72:295-298 141 Singh S. K., Jalali A. F. and Aldén M. 1999. Modulated Temperature Differential Scanning Calorimetry for Examination of Tristearin Polymorphism: 2 Isothermal Crystallization of Metastable Forms. J. Am. Oil Chem. Soc. 76(4):507-510 Spiller G. A. 2004. The trans fats dilemma and Natural palm oil. Pascoe Publishing Inc. pp 27-49. Stauffer C. 1999. Fats and Oils. Second reprint. Eagen Press Handbook Series by the American Association of Cereal Chemists Inc. 91-100. Tang D. and. Marangoni A. G. 2006. Microstructure and Fractal Analysis of Fat Crystal Networks J. Am. Oil Chem. Soc. 83(5):377-388 Tarek S A.; Rogers M. A. and Marangoni A. 2004. Scaling Behavior of the Elastic Modulos in Colloidal Networks of Fats Crystals. Journal Phys. Chem. B, 108(1):171-179 van Malssen K., Peschar R. and Schenk H. 1996 a. Real-Time X-Ray Powder Diffraction Investigations on Cocoa Butter. I Temperature-Dependent Crystallization Behavior. J. Am. Oil Chem. Soc 73(10):1209-1215 van Malssen K., Peschar R. and Schenk H. 1996 b. Real-Time X-Ray Powder Diffraction Investigations on Cocoa Butter. II.The relationship Between Melting Behavior and Composition of β-Cocoa Butter. J. Am. Oil Chem. Soc. 73(10):2171223 van Malssen K., Peschar R. and Schenk H. 1996 c. Real-Time X-Ray Powder Diffraction Investigations on Cocoa Butter III. Direct β-Crystallization of Cocoa Butter: Occurrence of a Memory Effect. J. Am. Oil Chem. Soc., 73(10):1225-1230 White J.P. 1992. Fatty Acids in Oilseeds (Vegetable Oils). Chapter 9. In Kuang Ch. (ed) Fatty Acids in Foods and their Health Implications. 10 a Edition Marcel Dekker Inc. pp 247-248, 253 142 Wood R. 1992. Biological Effects of Geometrical and Positional Isomers of Monounsaturated Fatty Acids in Humans. Chapter 29. In Kuang Ch. (ed) Fatty Acids in Foods and their Health Implications. 10 a Edition Marcel Dekker Inc. pp 665-667 Yap P.H., deMan J.M. and deMan L. 1989. Polymorphism of Palm Oil and Palm Oil Products J. Am. Oil Chem Soc. 66(5):693-698 Páginas de Internet consultadas: www.pediatraldia.cl/GRASAS%202006/eliminar_grasas_trans.htm (20/02/2007) www.britanniafood.com/english/tc07.htm (23 /03/2007) www.libertynatural.com/info/shea.htm(12/03/2007) www.oilsbynature.com/products/illipe-butter-refined.htm(12/03/2007) www.alimentariaonline.com (17/02/2007) www.revistaejecutivos.org (01/06/2007) www.paho.org/Spanish/DD/PIN/ps070425.htm (070907) www.radiotrece.com.mx (16/06/2008) www.economia.gob.mx (10/08/2008) 143