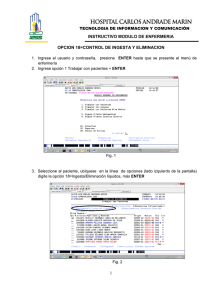
Ejercicio y terapia hormonal sustitutiva. Efectos sobre el equilibrio
Anuncio

Ejercicio y terapia hormonal sustitutiva. Efectos sobre el equilibrio hidromineral en un modelo de rata ovariectomizada Máster en Biología y Tecnología de la Reproducción Curso 2013/2014 Alumna: Marta A. Pérez Cabo Tutor: Dr. Juan Argüelles Luis Fecha de presentación: 12 de junio de 2014 AGRADECIMIENTOS Quiero dar las gracias en primer lugar a mi tutor, el Dr. Juan Argüelles, por su dedicación y entrega a la hora de guiarme en la realización de este trabajo, por estar siempre disponible a pesar de tener muchas otras responsabilidades, y por tener siempre una sonrisa y unas palabras amables que ofrecer. Sin su paciencia a la hora de enseñarme todas y cada una de las técnicas y la confianza que en mí depositó me habría sido imposible realizar este trabajo. Agradecer también la ayuda a los otros miembros del Área de Fisiología de la universidad. En especial a mi tutora académica, la Dra. Carmen Perillán, por el apoyo y acogida que me dio, por confiar en mí y hacerme un hueco en su laboratorio y por su gran amabilidad; y a la Dra. Paula Núñez por su ayuda y atención desinteresadas con mi trabajo y por esos invaluables buenos ratos cuando era necesaria una desconexión. Igualmente, agradecer al Dr. Celestino González González por su orientación y ayuda iniciales para enfocar mi trabajo, sin los cuales probablemente aún seguiría buscando un tema que me convenciese. Y por último, dar también un especial agradecimiento a Caja Burgos y a la Fundación Jiménez Manrique, por el generoso apoyo económico que me brindaron para la realización de este máster, a través de su programa “Jóvenes Excelentes”. En los tiempos que corren no es precisamente fácil encontrar quien crea en ti, se arriesgue, y te dé una oportunidad para seguir formándote. Por ello, no puedo sino agradecer la confianza que ambas entidades han depositado en mí, ya que gracias a ello he podido cursar este máster y realizar este trabajo. Gracias a ambas instituciones hoy puedo decir sin dudar que he aprovechado la oportunidad y que he aprendido mucho más de lo que allá por el inicio del máster hubiera podido imaginar. 3 ABREVIATURAS ADH Hormona antidiurética HT Hipertensión ALD Aldosterona LH Hormona luteinizante ANGI Angiotensina I MnPO Núcleo preóptico medio ANGII Angiotensina II MVL Médula ventral lateral AP Área postrema MWS Million Women Study AT-1 Receptor de angiotensina II de Na+ Sodio tipo I NPV Núcleo paraventricular ECA Enzima convertidora de NSO Núcleo supraóptico angiotensina NTS Núcleo del tracto solitario ECV Enfermedad cardiovascular OCV Órganos circunventriculares EEC Estrógenos equinos conjugados Eje H/h/g Eje Hipotálamo/hipófisis/gónada ERC Ensayo randomizado controlado EXE Ejercicio FDA Food and Drugs OSF Órgano subfornical OT Oxitocina OVLT Órgano vasculoso de la lámina terminal OVX Ovariectomía p.c. Peso corporal Administration PNA Péptido natriurético auricular Fig. Figura PSE Pseudoovariectomía FSH Hormona estimulante del RE Receptor estrogénico folículo Ref. Referencia GnRH Hormona liberadora de SNC Sistema nervioso central gonadotropinas SNS Sistema nervioso simpático HERS Heart and Estrogen/ Progestin Replacement Study 4 SRAA Sistema renina-angiotensina- UI Unidades internacionales aldosterona VEC Volumen extracelular TE Terapia con estrógenos solos VIC Volumen intracelular TEP Terapia combinada con VP Vasopresina estrógenos y progesterona THS Terapia hormonal sustitutiva WHI Women’s Health Initiative 17-B-EST 17-β-estradiol 5 ÍNDICE INTRODUCCIÓN ........................................................................................................ 10 1. FISIOLOGÍA DE LA REPRODUCCIÓN EN LA MUJER .................................. 10 1. 1. Fisiología del fin de la función reproductiva: ................................................. 12 3. HIPERTENSIÓN (HT), ENFERMEDAD CARDIOVASCULAR (ECV) Y MENOPAUSIA. ......................................................................................................... 14 4. EL BALANCE HIDROMINERAL ........................................................................ 16 4.1. Regulación osmótica: ....................................................................................... 17 4.2. Regulación volumétrica y de presión: .............................................................. 17 5. MECANISMOS IMPLICADOS EN LA REGULACIÓN DEL BALANCE HIDROMINERAL. ..................................................................................................... 18 5.1. Regulación central del balance hidromineral. .................................................. 18 5.2. Rutas hormonales implicadas en la regulación del balance hidromineral ....... 19 5.3. La sed ............................................................................................................... 22 5.4. Integración de los sistemas:.............................................................................. 22 6. LOS ESTRÓGENOS Y LA REGULACIÓN DEL BALANCE HIDROMINERAL .................................................................................................................................... 23 6.1. Estrógenos y SRAA ......................................................................................... 24 6.2. Estrógenos y vasopresina ................................................................................. 24 7. LA TERAPIA HORMONAL SUSTITUTIVA (THS) ........................................... 25 7.1. Efectividad y riesgos de la THS ....................................................................... 27 8. EL EJERCICIO FÍSICO Y LA TENSIÓN ARTERIAL ........................................ 30 HIPÓTESIS Y OBJETIVOS ....................................................................................... 32 1. HIPOTÉSIS ............................................................................................................ 32 2. OBJETIVOS ........................................................................................................... 32 6 3. JUSTIFICACIÓN DEL TRABAJO ....................................................................... 32 MATERIALES Y METODOLOGÍAS ....................................................................... 34 1. MATERIALES ....................................................................................................... 34 2. METODOLOGÍAS ................................................................................................. 36 RESULTADOS ............................................................................................................. 41 1. EVOLUCIÓN DEL PESO...................................................................................... 41 2. INGESTA DE COMIDA ........................................................................................ 43 3. INGESTA HÍDRICA .............................................................................................. 45 4. INGESTA SALINA ................................................................................................ 47 5. HEMATOCRITO ................................................................................................... 49 6. OSMOLALIDAD EN PLASMA............................................................................ 50 7. OSMOLALIDAD EN ORINA ............................................................................... 51 8. PROTEÍNA EN PLASMA ..................................................................................... 53 9. PROTEÍNA EN ORINA ......................................................................................... 54 DISCUSIÓN .................................................................................................................. 56 CONCLUSIONES ........................................................................................................ 62 BIBLIOGRAFÍA .......................................................................................................... 63 7 ÍNDICE DE FIGURAS Fig. 1............................................................................................................................... 11 Fig. 2............................................................................................................................... 12 Fig. 3............................................................................................................................... 13 Fig. 4............................................................................................................................... 16 Fig. 5............................................................................................................................... 18 Fig. 6............................................................................................................................... 20 Fig. 7............................................................................................................................... 21 Fig. 8............................................................................................................................... 23 Fig. 9............................................................................................................................... 29 Fig. 10............................................................................................................................. 34 Fig. 11............................................................................................................................. 37 Fig. 12............................................................................................................................. 38 Fig. 13............................................................................................................................. 40 Fig. 14............................................................................................................................. 41 Fig. 15............................................................................................................................. 43 Fig. 16............................................................................................................................. 45 Fig. 17............................................................................................................................. 49 Fig. 18............................................................................................................................. 50 Fig. 19............................................................................................................................. 51 Fig. 20............................................................................................................................. 51 Fig. 21............................................................................................................................. 53 Fig. 22............................................................................................................................. 54 8 ÍNDICE DE TABLAS Tabla 1 ........................................................................................................................... 14 Tabla 2. .......................................................................................................................... 26 Tabla 3. .......................................................................................................................... 26 Tabla 4 ........................................................................................................................... 28 Tabla 5 ........................................................................................................................... 35 Tabla 6 ........................................................................................................................... 41 Tabla 7 ........................................................................................................................... 43 Tabla 8 ........................................................................................................................... 45 Tabla 9 ........................................................................................................................... 47 Tabla 10 ......................................................................................................................... 49 Tabla 11 ......................................................................................................................... 50 Tabla 12 ......................................................................................................................... 51 Tabla 13 ......................................................................................................................... 53 Tabla 14 ......................................................................................................................... 54 9 INTRODUCCIÓN 1. FISIOLOGÍA DE LA REPRODUCCIÓN EN LA MUJER La reproducción es un proceso biológico fundamental para la vida, a través del cual, a partir de unos organismos progenitores, se generan nuevos individuos semejantes a ellos y, por ende, se preserva la especie. La fisiología de la reproducción es la rama de la Fisiología que se encarga de estudiar dicho proceso biológico, a fin de conocer el funcionamiento y control de la función reproductiva de los seres vivos1. En el ser humano, como en el resto de mamíferos, la reproducción es de tipo sexual, por lo que es necesario que se generen y unan dos gametos: uno masculino o espermatozoide, y otro femenino u ovocito1,2. El ciclo reproductivo de la mujer es el conjunto de sucesos fisiológicos que llevan a que el gameto femenino madure dentro del folículo, experimente la ovulación y se introduzca en la trompa uterina2. Su duración media es de 28 días, (oscilando típicamente entre los 24 y los 35 días) y tiene como característica principal la presencia de menstruación (sangrado uterino de entre 3 y 7 días de duración) al principio de cada ciclo, por lo que recibe el nombre de ciclo menstrual3. Como en el resto de mamíferos, el ciclo reproductivo de la mujer está controlado por el denominado eje hipotálamohipófisis-gonadal (eje H/h/g) y por las hormonas sexuales. Las fluctuaciones en los niveles de estas últimas producen cambios cíclicos en los folículos ováricos (ciclo ovárico) y en el endometrio (ciclo uterino)3,4. El hipotálamo secreta la hormona liberadora de gonadotropinas (GnRH) de forma continua y pulsátil, y la libera a la circulación portal, a través de la cual llega a adenohipófisis o hipófisis anterior5. En ella, la GnRH induce la producción de gonadotropinas, concretamente de la hormona estimulante del folículo (FSH) y de la hormona luteinizante (LH), que son liberadas a la circulación sistémica y llegan a los ovarios. Estos son a su vez glándulas endocrinas donde se producen estrógenos (principalmente, estradiol) y progesterona, los cuales mediante mecanismos de retroalimentación regularán también la producción de LH y FSH6. En función de los cambios observados en el ovario en respuesta a los niveles hormonales, el ciclo se divide en dos fases, una folicular o preovulatoria, y otra lútea o postovulatoria. 10 En la fase folicular la secreción de FSH recluta una cohorte de folículos en el ovario, que al ir desarrollándose secretan cantidades crecientes de estradiol e inhibina B. El estradiol induce cambios en el epitelio uterino, que prolifera llegando a duplicar o triplicar su grosor (fase proliferativa del ciclo uterino)2; y actúa sobre los folículos estimulando su propia síntesis. La inhibina B es secretada por los folículos preantrales y antrales pequeños7, y actúa junto con el estradiol para producir una retroalimentación negativa sobre la hipófisis que baja progresivamente los niveles de FSH. Una vez se selecciona el folículo dominante (el único capaz de responder a los ahora reducidos niveles de FSH) y el nivel de estradiol es lo suficientemente alto, este pasa a ejercer una retroalimentación positiva sobre la hipófisis. Esto provoca el pico de secreción de LH que inducirá la ovulación. Tras la extrusión del cúmulo oóforo, el resto de células que formaban parte del folículo pasarán a formar el cuerpo lúteo3,6. En la fase lútea, el cuerpo lúteo comienza a secretar progesterona e inhibina A8. La progesterona induce cambios a nivel uterino, haciendo que su epitelio comience a acumular agua y sustancias nutritivas (fase secretora del ciclo uterino). Además, la progesterona y la inhibina A producen una retroalimentación negativa en la adenohipófisis que evita la secreción de gonadotropinas3,8. En ausencia de gestación, el cuerpo lúteo degenera en cuerpo albicans. La caída de la progesterona produce la constricción de las arterias uterinas, y la isquemia del endometrio hace que se descame produciendo la menstruación2. A la vez, el descenso en los niveles de progesterona e inhibina A elimina la retroalimentación negativa sobre la adenohipófisis, que vuelve a liberar FSH, reiniciando de nuevo el ciclo3,9. (Ver fig. 1) Fig. 1: Esquema básico del control del ciclo menstrual de la mujer8. 11 1. 1. Fisiología del fin de la función reproductiva: Con el envejecimiento, las mujeres, como las hembras de todos los mamíferos, sufren un paulatino deterioro de su función reproductiva, hasta que llega un momento que se pierde totalmente. Este momento queda marcado en la especie humana por la menopausia, que es el cese definitivo de los ciclos menstruales10. La menopausia se diagnostica de forma retrospectiva cuando ha transcurrido un año de la última menstruación, y la edad media de su aparición es de entre 50 y 52 años en mujeres europeas 11, y de 51±8 años a nivel mundial 12. Fig. 2: Declinar del número de folículos con la edad de la mujer y evolución de otros sucesos reproductivos que lo acompañan. (redibujado por 13 según 12 y 15). Cada mujer recibe una dotación de ovogonias durante su desarrollo fetal. Éstas se dividen por mitosis, de forma que en el cuarto mes de vida fetal los ovarios poseen entre 6 y 7 millones de ovocitos contenidos en folículos primordiales. Sin embargo, en la segunda mitad de la gestación, gran parte de ellos se pierden por apoptosis, de modo que en el momento del nacimiento sólo quedan de 1 a 2 millones de folículos primordiales13. Tras el nacimiento, esta pérdida de folículos continúa, y al llegar a la menarquía quedan alrededor de 400000-500000 folículos. A medida que la mujer en edad fértil va teniendo ciclos, el número de folículos continúa descendiendo, y al llegar a la menopausia quedan menos de 100013–15. Este progresivo descenso de la reserva folicular se acompaña de otros sucesos reproductivos visibles, como son el descenso de 12 la calidad ovocitaria (desde los 20 años), la reducción de la fertilidad (a partir de los 31 años) seguida de un agotamiento de la misma (alrededor de los 40 años), la aparición de irregularidad en los ciclos y, finalmente, la menopausia14. (Ver fig. 2). A nivel hormonal, la menopausia desencadena un desequilibrio. Lo que ocurre es que al ir agotándose la reserva folicular, el escaso número de folículos remanentes ya no es capaz de producir la suficiente cantidad de inhibina B como para inhibir la producción de FSH por la hipófisis. Esto motiva que, ya desde 4 ó 5 años antes de la menopausia, se detecten niveles elevados de FSH basal (>40 UI/l14) por el inicio del declive de la función reproductiva (y lo mismo ocurre, aunque en menor medida, con la LH)16. El nivel de estradiol decae progresivamente, aunque su descenso se inicia más tarde (alrededor de un año antes de la menopausia), puesto que inicialmente los altos niveles de FSH mantienen bastante activa su producción folicular. Cabe decir que, aunque su descenso es muy acusado, su nivel nunca llega a ser cero, puesto que siempre hay una cierta producción de estradiol desde andrógenos en el tejido graso periférico10. (Ver fig.3). Fig. 3: Evolución de los niveles hormonales en relación con la menopausia de la mujer10. 2. SIGNOS Y SÍNTOMAS DEL FIN DE LA FUNCIÓN REPRODUCTIVA. El desequilibrio hormonal que se produce en la mujer con el envejecimiento reproductivo causa una serie de manifestaciones clínicas, todas ellas relacionadas con el déficit estrogénico que se produce en la peri y postmenopausia16. 13 En general, los síntomas pueden dividirse en función de su tiempo de aparición en a corto-medio plazo o a largo plazo (ver tabla 1). Alteraciones menstruales (irregularidad, ciclos más largos, metrorragia y finalmente amenorrea)10,16. Sofocos y sudoración, palpitaciones, insomnio, cefaleas17–19. SÍNTOMAS A CORTO-MEDIO PLAZO Ganancia de peso19. Pérdida de elasticidad de la piel y sequedad18. Atrofia urogenital (llevando a disuria, cistitis, incontinencia…)16,18. Pérdida de rugosidad y elasticidad y estrechamiento vaginal, causando dispareunia10,18,19. Depresión e irritabilidad19. Osteoporosis10,16,18,20. SÍNTOMAS A Enfermedad cardiovascular, con aumento de hipertensión, LARGO PLAZO riesgo de infarto y de accidente cerebrovascular10,16,18,20. Tabla 1: Signos y síntomas más frecuentes del síndrome climatérico de la mujer. 3. HIPERTENSIÓN (HT), ENFERMEDAD CARDIOVASCULAR (ECV) Y MENOPAUSIA. La presión sanguínea en las mujeres es generalmente menor que en los hombres de la misma edad durante casi toda la vida de la mujer21–27, exceptuando únicamente la prepubertad y la postmenopausia21,23. De igual forma, entre las mujeres en edad premenopáusica la prevalencia de la HT, definida por la European Society of Hypertension y la European Society of Cardiology como una presión sanguínea sistólica/diastólica de más de 140 mmHg/90 mmHg28, es menor que entre los hombres de la misma edad 21,22,24 . Así, estos últimos tienen un mayor riesgo cardiovascular y de enfermedades renales. 24 14 Sin embargo, durante la primera década tras la menopausia, la presión arterial sistólica de las mujeres se eleva progresivamente, situándose a niveles comparables a los de los varones de edad similar 23,27. Dicho incremento es mayor cuanto más tiempo ha transcurrido desde la menopausia.29 Esto lleva a que la incidencia de HT en las mujeres postmenopáusicas llegue a ser semejante23 o incluso superior21,27,30 que en los hombres del mismo grupo de edad. Hoy en día, más del 25 % de las mujeres postmenopáusicas a nivel mundial se consideran hipertensas27. La ECV es la principal causa de mortalidad en mujeres de más de 25 años a nivel mundial21,31, y la primera causa de mortalidad en mujeres en España32. La HT es uno de los principales factores de riesgo de ECV32–34, por lo que la morbilidad y la mortalidad de ECV aumenta entre las mujeres de más edad30,31,33. Se estima que, por cada incremento de 20 mmHg de la presión arterial sistólica, se duplica el riesgo de mortalidad por ECV en las mujeres entre 40 y 89 años21. De entre las ECV, las que más frecuentemente se observan en las mujeres postmenopáusicas son los accidentes cerebrovasculares y la enfermedad arterial coronaria33,35,36. Concretamente, el riesgo de padecer un accidente cerebrovascular se duplica para las mujeres cuando transcurren 10 años desde la menopausia31. Por otra parte, cabe destacar que el incremento en la prevalencia de la HT suele ir acompañado de la aparición de otros factores relacionados con la edad y los hábitos de vida que, en combinación con aquélla, incrementan más aún el riesgo cardiovascular. Entre ellos, pueden citarse la obesidad, la dislipemia, o la diabetes 21,27,36. Además, se ha descrito que la HT por sensibilidad a la sal es más frecuente en las mujeres postmenopáusicas que en las premenopáusicas25,37. Debido al actual aumento en la esperanza de vida, que sigue siendo superior en las mujeres, se estima que la población mundial alcanzará los 9400 millones de personas en 2050. De ellas, alrededor de 1000 millones serán mujeres postmenopáusicas27 (ver fig. 4). Por tanto, la prevención de la HT asociada a la menopausia y del riesgo cardiovascular que ésta genera se convierten hoy en día en un asunto de una vital importancia27,35. 15 Fig. 4: Desarrollo estimado de la población femenina mundial en las próximas 4 décadas27. Vistos los importantes cambios que se producen en la presión arterial de las mujeres tras la menopausia, muchos investigadores pensaron que las hormonas sexuales femeninas podían tener algún efecto protector frente a la HT y la ECV. 21–25,27 Este efecto se ha atribuido concretamente a los estrógenos en lugar de a la progesterona, por tres razones: por un lado, por su ya citado descenso tras la menopausia. Por otro, por el incremento del nivel de estrógenos de entre 50 y 180 veces durante el embarazo, asociado al descenso de la presión arterial durante los dos primeros trimestres21,38. Y por último, porque existen estudios en los que la progesterona parece ejercer un efecto vasoconstrictor cuando se administra en la terapia hormonal a mujeres postmenopáusicas23,39,40. 4. EL BALANCE HIDROMINERAL El agua es el componente mayoritario del organismo de los mamíferos41. Su volumen y presión deben mantenerse a los niveles adecuados para permitir los intercambios metabólicos y gaseosos necesarios para el mantenimiento de la homeostasis42–44. Esto implica un control del volumen y la presión del líquido corporal, así como una regulación osmótica. 16 El líquido corporal puede encontrarse en dos compartimentos separados por membranas celulares: la mayoría se encontrará dentro de las células, constituyendo el volumen intracelular (VIC), y el resto fuera de las mismas, constituyendo el volumen extracelular (VEC). Este VEC a su vez se divide en líquido intersticial (que rodea a las células) o en plasma sanguíneo. 41 El balance hidromineral del cuerpo es dinámico, ya que continuamente se producen modificaciones del mismo que, mediante mecanismos de retroalimentación, activan respuestas compensatorias para mantener los valores en torno al valor de referencia44. Dado que las membranas celulares son semipermeables, un pequeño cambio en la osmolaridad de un compartimento modificará por ósmosis la cantidad de agua de los compartimentos colindantes, pudiendo alterar la funcionalidad celular43. Así, la regulación del balance de líquido tendrá una doble vertiente: 4.1. Regulación osmótica: Desviaciones de solo un 1-2% del valor de referencia para la regulación osmótica activan respuestas correctoras44. El electrolito más importante para la osmolaridad del organismo es el sodio (Na+), que se encuentra principalmente en el VEC41,45. De este modo, la regulación del Na+ será especialmente importante para mantener la osmolalidad del plasma, que es para la mayoría de los mamíferos de 290 mOsm/kg45. Cuando los osmorreceptores periféricos detectan una elevación en el Na+ plasmático se activan mecanismos que buscan diluirlo. Esto se conseguirá promoviendo la excreción renal de Na+, la retención de agua urinaria y la sensación de sed44, tal como se explicará más tarde. 4.2. Regulación volumétrica y de presión: La variación del volumen es detectada por los barorreceptores de la aurícula y de las venas mayores; y la de presión por barorreceptores del aparato yuxtaglomerular, el seno carotídeo y el arco aórtico. Los cambios que se detectan provocan respuestas compensatorias para devolver los valores al rango de referencia. Dichas respuestas pueden ser cardiovasculares (relacionadas con la activación del sistema nervioso simpático), hormonales (cambios en los niveles de hormonas) o de comportamiento (relacionadas con la ingesta de agua y sal)44, como se verá más adelante. 17 5. MECANISMOS IMPLICADOS EN LA REGULACIÓN DEL BALANCE HIDROMINERAL. 5.1. Regulación central del balance hidromineral. El balance hidromineral está controlado por el sistema nervioso. Al cerebro llega información sobre el volumen y presión sanguínea y sobre la osmolalidad del líquido corporal44. La información sobre la presión y volumen sanguíneos es detectada por los barorreceptores periféricos. Estos envían señales al núcleo del tracto solitario (NTS), situado en el rombencéfalo44,46. NTS proyecta terminaciones El sus nerviosas sobre la médula ventral lateral (MVL), la cual, a su vez, tiene proyecciones que conectan con las neuronas preganglionares columna estimula de la vertebral, y así el sistema Fig. 5: Esquema de las rutas de control neural del balance hidromineral44. nervioso simpático (SNS). Esto permite promover modificaciones vasomotoras (de vasoconstricción o de vasodilatación) y de frecuencia cardíaca, para compensar las alteraciones detectadas44. Además, el NTS está conectado con los núcleos paraventricular (NPV) y supraóptico (NSO) del hipotálamo, en los que la información se integra para promover respuestas neuroendocrinas de regulación de la secreción de vasopresina (VP) y oxitocina (OT), y de la sensación de sed y el apetito salino44,46. 18 La información sobre osmolalidad del líquido intersticial y el plasma sanguíneo es detectada por osmorreceptores situados en los órganos circumventriculares (OCVs). Los OCVs son áreas especializadas del sistema nervioso central (SNC) que carecen de barrera hematoencefálica, e incluyen el área postrema (AP, en el rombencéfalo), el órgano hipotalámico subfornical (OSF, en el prosencéfalo) y el órgano vasculoso de la lámina terminal (OVLT, en el prosencéfalo). Los OCVs integran su información en el núcleo preóptico medio (MnPO) y en el NPV y el NSO, desde los que se regulará la liberación de VP y OT y la sensación de sed44,46. (Ver fig. 5). 5.2. Rutas hormonales implicadas en la regulación del balance hidromineral 5.2.1. Sistema renina-angiotensina-aldosterona (SRAA) Se trata de un sistema hormonal que permite controlar el VEC y, por tanto, la presión arterial. Se activa ante disminuciones de la presión arterial o del VEC, que producen una disminución del filtrado glomerular y un aumento de la actividad del SNS, ambos estímulos de secreción de renina41,47. La renina es una proteasa de 406 aminoácidos, sintetizada por las células yuxtaglomerulares del riñón, que se libera a la circulación al disminuir el VEC. En sangre la renina actúa sobre en angiotensinógeno, una globulina plasmática de 14 aminoácidos que secreta el hígado de forma continua, y libera así angiotensina I (ANGI), de 10 aminoácidos. Sobre esta ANGI actuará la llamada enzima convertidora de angiotensina (ECA), presente en el endotelio vascular de los pulmones, para liberar angiotensina II (ANGII). La ANG II es un péptido de 8 aminoácidos con propiedades vasoconstrictoras muy fuertes y de 1-2 minutos de vida media41,47. Su liberación provoca una vasoconstricción intensa que eleva la presión arterial, y produce sensación de sed y apetito salino actuando sobre el AP y el OSF46. Además, también estimula la secreción de aldosterona (ALD) en las cápsulas suprarrenales 47, y de VP en el NPV y el NSO44. (Ver fig. 6) La ALD es una hormona esteroidea que actúa en el túbulo conector y en el túbulo colector del riñón, en los que incrementa la transcripción y traducción de bombas Na+/K+-ATPasa y de canales de Na+. De este modo, aumenta la reabsorción renal de Na+ y agua y, por tanto, también la presión arterial47. 19 Fig. 6: Esquema del SRAA en condiciones de alta presión arterial42. 5.2.2. Vasopresina y oxitocina La VP, también denominada hormona antidiurética (ADH), y la OT son neurohormonas de origen hipotalámico secretadas por la neurohipófisis44. La VP regula la permeabilidad al agua de los túbulos conector y colector del riñón. Su secreción es estimulada por incrementos en la osmolalidad del líquido extracelular o por la bajada de su volumen, así como por la disminución de la presión arterial. La secreción de ANGII también promueve la liberación de VP. El mecanismo por el cual la VP aumenta la reabsorción de agua es el transporte de acuaporina 2, una proteína exclusiva del túbulo colector, a la membrana de las células del mismo. A través de la acuaporina el agua filtrada por el riñón retorna a la circulación sanguínea41. (Ver fig. 7A). En cuanto a la OT, sus funciones principales tienen que ver con la reproducción (promueve la eyección mamaria de leche y las contracciones en el parto), aunque está bien establecido que también posee propiedades antidiuréticas en ratas48. 5.2.3. Péptido natriurético auricular (PNA) Este péptido es liberado por los miocardiocitos de la aurícula, ante la estimulación de los barorreceptores cuando esta se distiende, para tratar de reducir la presión arterial. El PNA actúa a varios niveles, entre los que destaca la inhibición de la liberación de ADH por el hipotálamo, y de renina y ALD por el aparato yuxtaglomerular y las cápsulas suprarrenales. Además, también promueve la vasodilatación de las arteriolas glomerulares para incrementar el filtrado glomerular41. (Ver fig. 7B). 20 Fig. 7: (A) Esquema de los mecanismos básicos de restauración de la presión arterial ante una bajada del VEC. (B) Esquema de los efectos del PNA ante un aumento del VEC y la distensión auricular. FG= filtrado glomerular41. 21 5.3. La sed La sed puede ser de dos tipos: osmótica e hipovolémica. La sed osmótica es la que se produce como consecuencia de una deshidratación intracelular. Un incremento de la tonicidad vascular (a consecuencia de un incremento del Na+ o de un descenso del agua circulantes) induce una salida del agua intracelular para tratar de diluir la concentración excesiva de sal. Los osmorreceptores de los OCVs son los encargados de detectar las variaciones de la osmolalidad que causan este tipo de sed, siguiendo las conexiones neuronales previamente mencionadas46. Un ejemplo típico de estímulo para la sed osmótica es la sobrecarga salina49. La sed hipovolémica se origina a causa de una deshidratación extracelular, típicamente por hemorragias, diarreas y vómitos, o por sudoración elevada46,49. Dicha deshidratación provoca un descenso del volumen vascular y de la presión sanguínea, que serán detectadas por los barorreceptores, que enviarán la información al NTS. Esto desencadenará las interacciones entre núcleos cerebrales previamente explicadas, activando el SRAA y generando la sensación de sed. Sin embargo, es importante destacar que, en este tipo de modificaciones del balance hidromineral, el organismo no solo pierde agua, sino también sales, de modo que la sensación de sed va acompañada de una aparición de apetito por la sal46. 5.4. Integración de los sistemas Todos los sistemas comentados hasta el momento se integran formando una red de interacciones que regula la ingesta y excreción de agua y sal y, por ende, la presión sanguínea. En el caso de una deshidratación intracelular, el aumento de la tonicidad estimula los osmorreceptores de los OCVs, que promueven la liberación de VP desde la hipófisis y la aparición de sensación de sed osmótica. Esto promoverá un aumento en la reabsorción renal de agua y sal, así como una mayor ingesta hídrica. En el caso de una deshidratación extracelular, el descenso de la presión arterial es detectado por los barorreceptores, que envían la información al SNC, donde se estimula el SNP y se libera VP. La activación simpática y la estimulación de los barorreceptores yuxtaglomerulares promoverá la liberación de renina y ANGII, que inducirán 22 vasoconstricción y liberación de ALD. Esto lleva, a su vez, a una mayor reabsorción renal de Na+ agua, y a una aparición de la sensación de sed y el apetito salino. Además, la falta de distensión de los barorreceptores auriculares inhibirá la liberación del PNA. (Ver fig. 8) Fig. 8: Esquema de la integración de los distintos sistemas de regulación del balance hidromineral. (Adaptado de ref. 46). 6. LOS ESTRÓGENOS Y LA REGULACIÓN DEL BALANCE HIDROMINERAL Los estrógenos interactúan con diversos componentes de las rutas de regulación del balance hidromineral, como los del SRAA y o la VP. Estas interacciones justificarían la protección frente a la elevación de la presión arterial que se observa en las mujeres en edad reproductiva, y la aparición de HT tras la menopausia. 23 6.1. Estrógenos y SRAA El estradiol controla distintos componentes del SRAA, de forma que podría regular la presión arterial. Estudios realizados en ratas ovariectomizadas (OVX) indican que la terapia de reemplazo con 17-β-estradiol (17-B-EST) reduce la expresión del receptor de ANGII de tipo 1 (AT1) en las células de músculo liso de los vasos sanguíneos, en el hipotálamo y en el riñón37,50. El 17-B-EST también parece reducir la expresión de la ECA51 (lo que llevaría a una disminución de la ANGII libre). Algunos estudios también apuntan a que el tratamiento con estradiol de ratas OVX previo a una privación de agua, a una carga salina o a un tratamiento con un agente deshidratante disminuye significativamente la ingesta de agua posterior promovida por la ANGII52,53. Este efecto reductor de la ingesta hídrica parece estar mediado por la unión del 17-BEST a receptores estrogénicos en la membrana de las neuronas del OSF, que modula su activación, y que a la vez reduciría la liberación de VP54. Otros estudios, ya en humanos, muestran que las mujeres postmenopáusicas a las que se les suministra un reemplazo hormonal con 17B-EST, ya sea oral o transdérmico, presentan un nivel de renina plasmática superior a la de mujeres premenopáusicas55, y un menor nivel de ACE. 56 6.2. Estrógenos y vasopresina: Los estrógenos parecen tener varios mecanismos de acción sobre la VP. Por una parte, bajan el límite de osmolalidad que promueve la liberación de VP en humanos, de modo que un mayor nivel de estrógenos tiende a elevar el nivel de VP libre44,57. Si bien no se conoce con exactitud el mecanismo por el que se produce esta regulación, lo más probable es que sea a través de los receptores estrogénicos (RE) presentes en el OSF y el OVLT57, y en las neuronas secretoras de VP de los NPV y NSO44. Por otro lado, los estrógenos afectan también a la respuesta periférica a la VP. En ratas hembra se produce una antidiuresis más fuerte durante el estro, cuando los niveles de estrógenos son más bajos, y la ovariectomía incrementa la antidiuresis. Ambos efectos podrían ser mediados por los RE del riñón57. En cuanto a la vasoconstricción arterial, la respuesta a la VP de los vasos se incrementa ante un mayor nivel de estrógenos, hecho que tal vez sea mediado por los RE de las células endoteliales o de las células de músculo liso vascular44,57. 24 Fig. 9: Posibles mecanismos de control de los estrógenos sobre las acciones de la VP57. 7. LA TERAPIA HORMONAL SUSTITUTIVA (THS) La THS, que consiste en el aporte exógeno de estrógenos, surgió como tratamiento para los síntomas vasomotores de la menopausia en la década de 1930. Sin embargo, no fue hasta 1942 cuando la Food and Drugs Administration (FDA) aprobó el primer preparado para la THS, los estrógenos equinos conjugados (EEC, bajo el nombre de “Premarin”). En la década de los 60 se sugirió el posible papel de la THS en la prevención de la osteoporosis y el envejecimiento cardiovascular. Su uso se generalizó rápido, aunque en 1975-1976 se observó una asociación entre la THS con estrógeno y el cáncer de endometrio en mujeres con útero, por lo que se comenzó a añadir un progestágeno al tratamiento para evitar este riego58,59. Hoy en día, la THS tiene un doble objetivo: por una parte, curativo, para aliviar los síntomas vasomotores y urogenitales de la menopausia; y por otra, preventivo, para tratar de evitar la aparición de la osteoporosis y las ECV. Comprende tanto la terapia de estrógenos solos (TE) como la combinada con progestágenos (TEP)60,61. Los estrógenos son la base de la THS62, y se clasifican según su origen, en: 25 ESTEROIDEOS Naturales NO ESTEROIDEOS Sintéticos Naturales Sintéticos (naturales (en desuso) esterificados) 17-B-EST Etinilestradiol Estriol Estrógenos equinos Estrona conjugados (EEC) Fitoestrógenos Dietilestilbestrol Hexestrol Tabla 2: Clasificación de los tipos de estrógenos y algunos ejemplos de los mismos (adaptado de refs. 59 y 62). En Estados Unidos tradicionalmente se han usado más los EEC y el 17-B-EST, mientras en Europa se han utilizado más el 17-B-EST y la estrona.63 Los estrógenos tienen distinta potencia, siendo superior la del estradiol natural, el 17-B-EST. La potencia y el efecto varían en cualquier caso en función de la dosis y vía de administración. Esta última puede ser oral o parenteral, que incluye inyecciones intramusculares mensuales, implantes subcutáneos, parches transdérmicos, nebulizadores intranasales, geles y cremas cutáneos, y anillos y comprimidos vaginales59. Algunos ejemplos de dosis aparecen en la siguiente tabla: ESTRÓGENOS ORALES ESTRÓGENOS PARENTERALES 17-B-EST: 1-2 mg/día Liberación de 17B-E de 25-100 μg/día EEC: 0,625-1,2 mg/día Tabla 3: Ejemplos de dosis para la THS en función del tipo de estrógeno y vía de administración59. 26 7.1. Efectividad y riesgos de la THS La efectividad de la THS en el alivio de síntomas perimenopáusicos (incluyendo los vasomotores, la sequedad vaginal o las alteraciones urogenitales) está bien establecida; así como para la prevención de la osteoporosis60. Sin embargo, el uso de la THS para la prevención de la ECV es muy debatido. Existen estudios observacionales que muestran menor incidencia de ECV en mujeres postmenopáusicas que reciben THS64,65. Sin embargo, existen también otros estudios observacionales que reportan incrementos en la tensión arterial a corto y largo plazo al usar THS66. Los estudios randomizados controlados (ERC) realizados hasta la fecha, o bien muestran un incremento del riesgo de ECV asociado a la THS (estudio Women’s Health Initiative, WHI67), o bien no encuentran un efecto protector en la misma (estudio Heart and Estrogen/Progestin Replacement Study, HERS I y II68–70). El ERC con mayor repercusión ha sido el WHI.67 Se trató de una serie de estudios iniciados en 1993, que buscaban conocer el efecto de la dieta, la THS y la administración de calcio y vitamina D sobre la salud de mujeres postmenopáusicas, a lo largo de 8 años y medio de seguimiento. Entre los ensayos con THS, incluyeron uno de TE (EEC en dosis de 0,625 mg/día) y otro de TEP (EEC en dosis de 0,625 mg/día y acetato de medroxiprogesterona en dosis de 2,5 mg/día), ambos en comparación con placebo. El estudio incluyó mujeres entre 50 y 79 años, que recibían TEP si tenían útero o TE si habían pasado una histerectomía. El ensayo del grupo TEP, que incluyó 8506 mujeres con TEP y 8102 con placebo, con una edad media de 63,3 años, tuvo que ser terminado tras solo 5.2 años (mayo de 2002) al detectarse un incremento de los infartos de miocardio y de las muertes por enfermedad coronaria71. En el grupo TE no se observó este incremento, por lo que se continuó el estudio hasta el final. No obstante, los datos obtenidos no reflejaron un efecto beneficioso global de la TE, y se observó un aumento de los accidentes cerebrovasculares respecto al grupo placebo72. (Ver tabla 4). 27 Tabla 4: Resumen de los resultados de WHI del riesgo de padecer diferentes afecciones en los grupos TEP y TE en comparación con el grupo placebo. HR = reemplazo hormonal. (Tomado de ref. 58, elaborado desde las refs. 73 y 74). La llamativa diferencia de los resultados entre ERC y estudios observacionales ha motivado un intenso debate sobre el grado de recomendación del uso de la THS. Hoy se asume que los resultados de los ERC WHI y HERS (los más importantes realizados hasta el momento) pueden no ser extrapolables. Esto se debe al hecho de que solo usaron EEC, en una dosis, vía y tiempo de administración concretos, y no otro tipo de estrógenos y regímenes. Además, la población de estudio incluía mujeres de edad avanzada (que superaron la menopausia hacía ya tiempo y que per sé tendrían mayor riesgo de ECV), lo que podría alterar los resultados60,61,64,73. No obstante, y aunque actualmente se cree que la THS iniciada cerca de la instauración de la menopausia y durante tiempos breves sí podría ser beneficiosa, su efecto positivo no está aún esclarecido a largo plazo64,73,74. Por otro lado, otra de las conclusiones extraídas en los ERC y otros estudios es la asociación entre la THS y algunos tipos de cáncer, y en especial, con el cáncer de mama58. El WHI comentado previamente demostró un incremento en el cáncer de mama en las pacientes que recibieron TEP (ver tabla 4). Además, un estudio previo de cohortes realizado en Reino Unido, el Million Women Study (MWS75), ya mostró un incremento del cáncer de mama con el uso de THS. El MWS se realizó entre 1996 y 2001, e incluyó a 1084110 mujeres a las que se les hacía un seguimiento de 2,6 años de duración media. Los resultados demostraron que el riesgo de cáncer de mama aumentaba en las mujeres que tomaban THS. El aumento era especialmente importante en mujeres que tomaban TEP (el doble respecto a las del grupo control), aunque 28 también significativo en las que tomaban TE. Además, el riesgo era tiempodependiente, aumentando con la duración de la THS (ver figura 9). Fig. 9: Incidencia acumulada estimada de cáncer de mama por cada 1000 mujeres que empiezan la THS a los 50 años según el MWS75. Estudios más recientes apoyan también la relación entre la THS y el cáncer de mama, que es especialmente importante en la TEP76. Sin embargo, nuevos planteamientos sugieren que quizás los estrógenos no generen nuevos tumores, sino que induzcan el desarrollo acelerado de tumores preexistentes pero clínicamente indetectables77. Todos los hallazgos en relación a posibles riesgos de la THS han llevado a que, recientemente, se publicara un consenso global suscrito por diversas asociaciones a nivel mundial con interés común en el tratamiento de los síntomas de la menopausia78. En él, se establece que no debería generalizarse el uso de la THS, sino decidir en cada caso individual si esta es aconsejable (en función de variables como la edad, el tiempo transcurrido desde el inicio de la menopausia o los factores de riesgo cardiovascular preexistentes). También se indica que la THS ya no debería iniciarse si se han superado los 10 años inmediatamente posteriores a la instauración de la menopausia. Por último, puesto que el riesgo de cáncer de mama parece estar relacionado con la duración del 29 tratamiento, se aconseja que si se aplica la THS sea siempre con dosis bajas y durante el menor tiempo posible para la consecución del alivio sintomático buscado. 8. EL EJERCICIO FÍSICO Y LA TENSIÓN ARTERIAL Se ha comprobado en diversos experimentos que la realización de ejercicio físico regularmente, ya sea aeróbico o anaeróbico, es capaz de descender la presión arterial, tanto en individuos con HT como en quienes no la padecen. Se estima que el ejercicio aeróbico es capaz de descender la tensión arterial sistólica en reposo entre 5 y 15 mmHg, y el anaeróbico en 5 mmHg. Este efecto puede observarse incluso cuando no se realice ejercicio todos los días (entre 3 y 5 sesiones semanales de ejercicio consiguen el 75% del efecto reductor de la presión arterial de 7 sesiones)79. La disminución de la presión sanguínea se produce por la adaptación del aparato cardiocirculatorio a la realización de ejercicio físico, gracias a modificaciones como la promoción de la angiogénesis, la reducción de la activación simpática, la hipertrofia cardíaca o la mejora de la contractilidad vascular80. Sin embargo, los efectos beneficiosos de la realización de ejercicio físico sobre la presión sanguínea no se observan solo a largo plazo. La llamada hipotensión post ejercicio es un fenómeno por el cual se produce un descenso en la presión sanguínea tras aproximadamente media hora desde la realización de una sesión única de ejercicio81, y que puede llegar a mantenerse hasta 22 horas tras la misma82. La hipotensión post ejercicio se ha observado incluso después de la realización de solo 15 minutos de ejercicio de resistencia83. El descenso de la presión sanguínea ocurre tanto en personas normotensas como en hipertensas, aunque en estas últimas es más acusado; motivo por el que se usa como parte del tratamiento no farmacológico de la HT81. La magnitud del descenso varía en función del estatus de la persona, siendo de 8/9 mmHg (presión sistólica/diastólica) en personas normotensas, de 14/9 en personas con valores de presión sanguínea limítrofes y de 10/7 en personas hipertensas83. El mecanismo principal responsable de esta hipotensión es la reducción de la resistencia arterial periférica total. Esta parece ser debida a una disminución de la actividad simpática tras el ejercicio, una disminución de los niveles circulantes de ANGII, un descenso de la 30 sensibilidad de los receptores adrenérgicos vasculares, y un incremento en la liberación del vasodilatador óxido nítrico79,83. La hipotensión post ejercicio se ha observado también en mujeres postmenopáusicas. Además, la realización de ejercicio continuado parece ayudar a aliviar otros síntomas de la menopausia, como los vasomotores (incluyendo los sofocos y la sudoración nocturna), los psicológicos (como depresión o ansiedad) 84,85 o la ganancia de peso 86. Algunos de los ejercicios aeróbicos que se pueden realizar son el atletismo, el ciclismo o la natación. La natación en concreto es un tipo de actividad física en la que la carga de peso es mínima, por lo que es fácilmente realizable por mujeres mayores, e incluso por aquellas con problemas ortopédicos o de obesidad, con un bajo riesgo de lesión87,88. Puesto que la hipotensión post ejercicio puede ayudar a prevenir la elevación de la presión arterial tras la menopausia, pero sin conllevar los graves efectos secundarios de la THS, cabe plantearse si esta última podría ser sustituida por el ejercicio en el control de la HT postmenopáusica. Dadas sus características, la natación es una actividad física cuya realización diaria a baja intensidad sería ideal para estandarizarla como tratamiento preventivo del incremento de la tensión arterial en la etapa postmenopáusica, ya que sería válido incluso en mujeres de edad muy elevada. 31 HIPÓTESIS Y OBJETIVOS 1. HIPOTÉSIS “La hipotensión post ejercicio generada por la realización de un ejercicio de intensidad baja podría ayudar a prevenir el incremento de presión sanguínea característico del periodo postmenopáusico. Así, evitaría la necesidad de usar una terapia hormonal sustitutiva (THS) con estrógenos”. 2. OBJETIVOS 1. Comparar, en un modelo murino ovariectomizado, los efectos de la THS con 17β-estradiol y del ejercicio de baja intensidad sobre las alteraciones del balance hidromineral, causadas por la depleción estrogénica. 2. Dilucidar si el ejercicio, como tratamiento a corto plazo para evitar la elevación de la tensión postmenopáusica, podría reducir en un futuro el uso de la THS y, por tanto, evitar los riesgos asociados a ella. 3. JUSTIFICACIÓN DEL TRABAJO Antes de la menopausia, la incidencia de hipertensión (HT) en las mujeres es muy baja. Tras ella, sin embargo, los niveles de estrógenos de la mujer disminuyen, lo cual acarrea una serie de síntomas no deseados, entre los que se encuentra la elevación de la presión arterial. Como consecuencia, la incidencia de la HT se eleva ampliamente entre las mujeres de más edad. Puesto que la HT es uno de los principales factores de riesgo para padecer enfermedades cardiovasculares (ECV), el riesgo de padecer una de ellas también incrementa tras la menopausia. Esto lleva a que las ECV se sitúen como causa principal de mortalidad para las mujeres a nivel mundial. La THS se prescribe para aliviar los síntomas adversos de la menopausia y, entre ellos, la HT y las ECV. Sin embargo, la THS ha sido asociada con incrementos en la incidencia de infartos y accidentes cerebrovasculares y con una mayor incidencia de cáncer de mama, con lo que su uso podría no ser recomendable. 32 Dado el incremento en la población mundial y en la esperanza de vida, el número de mujeres postmenopáusicas irá en aumento en los próximos años. Por tanto, se incrementará el porcentaje de población en riesgo de sufrir ECV. Por todo esto, es de innegable y general interés estudiar una alternativa a la THS que prevenga la aparición de la HT (y las ECV subsiguientes) sin acarrear los graves efectos adversos que la THS genera. Puesto que este trabajo se enfoca precisamente hacia el estudio del ejercicio como opción alternativa a la THS, considero que su realización está bien justificada. 33 MATERIALES Y METODOLOGÍAS 1. MATERIALES Animales de experimentación y grupos experimentales: Se utilizaron ratas Wistar hembra, nacidas el 17 de enero de 2014 (7 semanas de edad en el momento de inicio del experimento) suministradas por el Bioterio de la Universidad de Oviedo, con un peso de entre 130 y 200 g. Los animales se mantuvieron en condiciones estándar de luz (12 horas luz/12 horas oscuridad) y temperatura (22-24ºC). Los animales fueron divididos aleatoriamente en 4 grupos, siendo 3 el número total de individuos de cada uno. A cada Fig. 10: Jaulas de confinamiento. grupo se le asignó uno de los siguientes tratamientos: pseudoovariectomizado (PSE), ovariectomizado control (OVX-EST), ovariectomizado y tratado con estradiol (OVX-EST) u ovariectomizado que realiza ejercicio (OVXEXE). Tras el tiempo de recuperación de la cirugía, se procedió a la aplicación diaria de los tratamientos, durante un total de 7 días. En un primer momento, los animales se mantenían en las jaulas de confinamiento individuales y con acceso a comida y agua y disolución salina ad libitum. (Ver figura 10) Las últimas 24 horas, se trasladaban a jaulas metabólicas individuales, en las que tenían acceso a comida y agua dulce ad libitum. Alimentación: La alimentación consistió en el pienso 2914 Teklad Global 14% Protein Rodent Maintenance Diet, de Harlan laboratories; cuya composición (macronutriestes) es: 34 Proteína bruta 14,3 % Materia grasa bruta (extracción con éter) 4,0 % Fibra cruda 4,1 % Fibra neutral (celulosa, hemicelulosa y 18 % lignina) Densidad energética 2,9 kcal/g 12,1 kJ/g Humedad 12 % Tabla 5: Composición de la dieta suministrada a los animales. Las ratas ingerían la comida en forma prensada mientras se mantenían en jaulas de confinamiento habituales, y se les aportaba en polvo cuando eran colocadas en las jaulas metabólicas. Drogas: – 17-β-estradiol (SIGMA CHEMICAL CO, USA) disuelto en vehículo constituido por aceite de oliva y etanol absoluto (PANREAC QUÍMICA S.L.U.) en proporción 3:2 v/v. – Equitesina (mezcla anestésica compuesta por Propilenglicol, alcohol absoluto, pentobarbital sódico, hidrato de cloral y sulfato magnésico). – Heparina sódica (Heparina mayne 1 %, 1000 U.I/ml, MAYNE PHARMA ESPAÑA, S.L.) – Povidona yodada – Suero salino (1,8% de cloruro sódico). Equipos y material de laboratorio: – Equipos: o Centrífuga (para capilares) 35 o Centrífuga ( para tubos de 10 ml) o Centrífuga de sobremesa (para eppendorfs) o Osmómetro de presión de vapor (WESCOR, modelo 5500) o Balanza de precisión (METTLER TOLEDO, modelo PB1502-L) o Balanza analítica (METTLER TOLEDO, modelo MS104) o Jaulas metabólicas TECNIPLAST (LETICA, S.A.) o Refractómetro (ATAGO CO. LTD) o Piscina de plástico (63x25x36 cm) – Material: o Jeringuillas de 1 ml desechables de BD PLASTIPAK S.A. o Capilares desechables para hematocrito y plastilina o Seda trenzada para sutura, de LORCA MARIN S.A. o Micropipetas p1000, p200 y p 10 y puntas. o Pipetas pasteur o Tijeras y pinzas o Algodón o Eppendorfs, falcons y tubos de 10 ml o Termómetro de baño o Filtros para osmómetro 2. METODOLOGÍAS Ovariectomía: Se realizó 5 días antes de comenzar la terapia con estrógenos y el ejercicio. Se desempeñó bajo anestesia general con equitesina (0,4 ml/100g de peso corporal, intraperitoneal) y a través de una incisión ventral realizada a lo largo de la línea alba. Se retiraron los ovarios y se realizó una sutura en el cuerno uterino a fin de evitar el sangrado excesivo, utilizando povidona yodada para la desinfección. A continuación se suturaron el músculo y la piel independientemente. El tiempo de recuperación post cirugía fue de 5 días. 36 Control del peso y de la ingesta de comida y agua: Durante todo el experimento se controló el peso de los animales diariamente, utilizando una balanza analítica (Ver figura 11). La ingesta de comida fue controlada diariamente mediante la administración de cantidades conocidas de comida y el pesado de la comida restante 24 horas más tarde en una balanza analítica. Fig. 11: Control de peso de las ratas y la comida con balanza. El agua dulce o salada se suministraba en biberones independientes, y se controlaba el volumen ingerido cada día. En las jaulas de confinamiento habituales se utilizaron biberones de plástico graduados e invertidos, provistos de una espita de vidrio que se introducía entre las barras de la jaula, y se iba anotando la diferencia de volumen entre días consecutivos. En el caso de la jaula metabólica, se utilizaron biberones de vidrio no graduados, y se controló la ingesta pesando el agua al inicio y al final de las 24 horas con una balanza analítica. Tratamiento con estrógeno/vehículo: El tratamiento estrogénico, aplicado a las ratas del grupo OVX-EST y de un total de 7 días de duración, consistió en una inyección diaria de una dosis fisiológica de 17-βestradiol (17-B-EST, 1,4 μg/kg peso corporal/día, por vía subcutánea)89. Se realizaba con jeringuillas desechables de 1 ml, y siempre a la misma hora (aproximadamente 10.00 am). 37 Los animales de los otros grupos recibieron inyecciones diarias subcutáneas de 200 μl de vehículo durante los mismos 7 días que el grupo OVX-EST, para imitar el estrés generado por el tratamiento. Se utilizaban jeringuillas desechables de 1 ml, y se realizaba la inyección siempre a la misma hora (aproximadamente a las 10:00 am). Ejercicio: El ejercicio escogido fue la natación. Se llenaba la piscina con agua a 25ºC y se introducía una rata del grupo OVX-EXE. Se dejaba que el animal nadase espontáneamente durante 15 minutos al día. Cuando la rata trataba de flotar se utilizaba una varilla para estimular su movimiento De acuerdo con la literatura, este ejercicio es de intensidad baja90,91 (Ver figura 12). Las ratas pertenecientes a otros grupos permanecían en sus jaulas (sedentarismo), y solo se depositaban en la piscina durante 10 segundos Fig. 12: Rata realizando ejercicio. al día para mimetizar el estrés generado por el procedimiento. Recogida y preparación de muestras de orina: Las últimas 24 horas del experimento las ratas eran colocadas en jaulas metabólicas individuales para recoger una muestra de orina. Posteriormente, la muestra se centrifugaba durante 5 minutos a 1900 rpm para eliminar la suciedad, y se pasaba el sobrenadante a un eppendorf limpio. La orina se conservó en un frigorífico a 4ºC hasta que se obtuvieron las muestras de todos los grupos de animales, para efectuar su análisis a la vez. Recogida de muestras de sangre y obtención de plasma: Las muestras de sangre se tomaron con el animal sometido a anestesia general con equitesina (0,4 ml/100 g de peso corporal). Se practicó una incisión en el cuello y se utilizó cirugía roma para acceder al esternocleidomastoideo y la vena yugular. La sangre 38 se obtuvo usando jeringuillas desechables de 1 ml heparinizadas, con las que se incidía a través del esternocleidomastoideo para acceder a la yugular. Se extraía entre 0,6 y 1 ml de sangre de cada animal, y se depositaban en tubos heparinizados. Los tubos con sangre se centrifugaban durante 10 minutos a 1500 rpm para separar el plasma (sobrenadante), que se recogía con una pipeta pasteur y se pasaba a un tubo limpio. El plasma sanguíneo se conservó en un frigorífico a 4ºC hasta que se obtuvieron las muestras de todos los grupos de animales, para efectuar su análisis a la vez. Medida del hematocrito: Se utilizaron capilares de vidrio desechables, que se llenaban de sangre y se sellaban por ambos extremos con plastilina para evitar pérdidas. Los capilares se centrifugaban durante 5 minutos a 12000 rpm. Tras la centrifugación, se medía la altura de las células en el capilar respecto a la altura total de la columna, y se calculaba el porcentaje de células (hematocrito) de la sangre. Sacrificio: El último día del experimento, tras la recogida de las muestras de sangre, los animales se sacrificaron mediante sobredosis de equitesina. Medida de la concentración proteica en plasma sanguíneo y orina: La concentración de proteína se midió por refractometría (ver figura 13). Para ello, en primer lugar se centrifugaron las muestras de plasma y orina en una centrífuga de sobremesa a 11000 rpm durante 5 minutos, para eliminar las posibles impurezas. A continuación se colocaba una gota de 10 μl del sobrenadante del plasma o la orina en el refractómetro. Así obtenemos la concentración proteica en g/100ml. Medida de la osmolalidad del plasma sanguíneo y la orina: La osmolalidad se midió mediante un osmómetro de vapor (ver figura 13). Para ello, en primer lugar se centrifugaron las muestras de plasma y orina en una centrífuga de sobremesa a 11000 rpm durante 5 minutos, para eliminar las posibles impurezas. 39 A continuación se depositaba un filtro en el lector del osmómetro, y se empapaba con una gota de 10 μl del sobrenadante de la muestra de plasma u orina. El aparato devolvía entonces la osmolalidad, medida en mmoles/kg. Cada aproximadamente 10 medidas, se realizaba el protocolo de limpieza del osmómetro para asegurar la fiabilidad de los valores obtenidos. Fig. 13: Osmómetro de vapor (izquierda) y refractrómetro (derecha). Análisis estadístico de los datos: Los datos se analizaron mediante el software estadístico SPSS. Al tratarse de variables biológicas, se realizaron pruebas ANOVA de un factor para contraste de medias, seguidas del test post-hoc de Bonferroni para detectar diferencias entre pares de grupos específicos. Para cada variable estudiada, los datos que se desviaron más de 2 desviaciones estándar (DE) de la media de medidas fueron obviados. Se consideró significancia estadística cuando P≤0,05. En los casos en los que no se encontraron diferencias significativas, se realizó una prueba t-Student adicional para detectar diferencias entre parejas de tratamientos (solo se indicará en los casos en los que se encontraron diferencias significativas). En todos los casos, se indica el error estándar de la media (ESM) de los resultados. 40 RESULTADOS 1. EVOLUCIÓN DEL PESO La ganancia de peso acumulada para cada tratamiento se calculó como: Ganancia acumulada = ∑(Peso del animaldía– Peso del animaldía inicio tratamientos) Los resultados de la ganancia de peso acumulada para cada día son los siguientes: GANANCIA MEDIA DE PESO ACUMULADA ± ESM (g) DÍA/TRATAMIENTO 1 PSE 1,87±1,71 OVX** 5,63±2,67 EST 4,23±0,99 EXE* 6,7±0,42 2 3 4 5 6 7 2,33±1,64 4,47±1,84 9,9±2,3 11,27±0,96 11,87±2,38 12,73±1,36 5,47±1,96 14±1,61 20,07±1,91 25,87±2,03 30,07±2,48 31,57±2,98 5±1,21 6,4±1,27 6,07±4,8 11,87±1,77 15,37±2,05 15,5±2,75 10,17±1,49 13,37±2,94 16,8±4,02 18,2±3,85 24,13±5,32 22,9±5,68 Tabla 6: Datos medios diarios de la ganancia de peso acumulada ±ESM. **P≤0,001 vs. PSE; *P≤0,01 vs. PSE. Ganancia acumulada de peso (g)±ESM Ganancia de peso acumulada (g) 40 35 30 25 PSE 20 OVX 15 EST 10 EXE 5 0 1 2 3 4 5 6 7 Días Fig. 14: Evolución diaria de la ganancia media de peso acumulada (g)±ESM 41 En la gráfica puede verse que todos los grupos de animales incrementaron de peso, siendo los animales del grupo OVX los que más peso adquirieron, y los del grupo PSE los que menos. Esto indica que la ovariectomía provoca un aumento de la ganancia de peso. Este efecto se ve atenuado por el tratamiento EST, y la evolución del peso de los animales de este grupo es similar a la evolución del grupo PSE. El tratamiento EXE no logró compensar el aumento de peso de la ovariectomía, aunque se aprecia una cierta tendencia a que este no sea tan acentuado. El análisis ANOVA de un factor demostró que los grupos son significativamente diferentes (P≤0,001); y el análisis post hoc de Bonferroni mostró diferencias significativas entre los grupos OVX y PSE (P≤0,001), entre OVX y EST (P≤0,001), entre PSE y EXE (P≤0,01), y entre los grupos EST y EXE (P≤0,05). 42 2. INGESTA DE COMIDA Se calculó por diferencia de peso de la comida de cada día con respecto a la del día anterior, y se normalizó respecto al peso (ingesta por cada 100 g de peso corporal, p. c.) como: Ingesta comida normalizada = * 100 Los resultados de ingesta de comida normalizada son los siguientes: INGESTA MEDIA DIARIA (g/100 g p.c.) ± ESM PSE OVX EST EXE INGESTA 1 2 7,66±0,89 8,56±0,95 6,88±1,84 7,13±1,39 8,60±0,07 8,28±0,24 8,69±0,44 9,46±0,1 3 4 5 6 8,23±0,16 9,22±0,56 8,50±0,69 8,39±0,32 8,48±1,15 9,40±0,48 9,96±0,44 9,67±0,16 7,05±1,23 9,02±0,54 8,01±0,35 9,31±0,2 8,76±0,05 9,02±0,14 9,31±0,3 9,65±0,56 7 8,88±0,25 10,12±0,49 8,63±0,46 8,56±0,07 Tabla 7: Datos de ingesta media de comida en g/100 g p.c.±ESM Ingesta diaria de comida (g/100 g p.c.±ESM) 11 Ingesta (g/100 g p.c.) 10 9 PSE 8 OVX EST 7 EXE 6 5 1 2 3 4 5 6 7 Días Fig. 15: Evolución de la ingesta diaria media de comida en g/100 g p.c. ±ESM 43 En la gráfica superior se observa que la ingesta de comida fue muy similar entre todos los grupos. El análisis ANOVA de un factor no encontró diferencias significativas entre ellos. No obstante, la ingesta de comida del grupo OVX tiene una tendencia creciente muy marcada, mientras el resto de grupos muestran mayores oscilaciones en su ingesta. 44 3. INGESTA HÍDRICA Se calculó por diferencia del volumen diario de agua respecto al día anterior o, en el caso de las jaulas metabólicas, por diferencia de peso y a través de la densidad. A continuación, se normalizó respecto al peso (ingesta hídrica en ml/100 g p. c.) como: Ingesta hídrica diaria normalizada: * 100 Los resultados de la ingesta hídrica normalizada al peso son: INGESTA HÍDRICA MEDIA (ml/100 g p. c.)±ESM DÍA/TRATAMIENTO 1 PSE 9,48±1,01 OVX** 6,48±2,01 EST* 7,14±0,62 EXE 9,98±2,25 2 3 4 5 11,69±0,42 10,11±1,47 10,72±1,34 10,52±0,07 6,67±1,6 8,87±0,67 8,40±0,52 7,64±1,44 8,36±2,35 7,90±1,13 8,39±0,16 8,07±1,34 13,35±1,41 11,84±3,39 9,43±0,94 9,20±0,49 6 7 11,61±0,97 10,46±0 7,65±0,96 10,24±1,26 8,12±1,52 11,76±2,28 8,00±0,35 12,78±1,08 Tabla 8: Datos de la ingesta hídrica media diaria en ml/100 g p.c.± ESM **P≤0,01 vs. PSE o EXE; *P≤0,05 vs. PSE o EXE. Ingesta hídrica normalizada (ml/100 g p.c.) Ingesta hídrica (ml/100 g p.c.)±ESM 16 14 12 10 PSE 8 OVX 6 EST 4 EXE 2 0 1 2 3 4 5 6 7 Días Fig. 16: Evolución de la ingesta hídrica media diaria en ml/100 g p.c.±ESM 45 La ingesta hídrica del grupo PSE se mantiene elevada y constante. En el gráfico se ve cómo la ovariectomía afecta a la ingesta hídrica, disminuyéndola en comparación con el grupo PSE. El tratamiento EXE atenúa dicho descenso, y en algunos puntos (días 1, 2, 3 y 7) consigue incluso hacer que se supere la ingesta del grupo PSE. El tratamiento EST es menos eficaz compensando el efecto de la ovariectomía, haciendo que la ingesta hídrica sea casi tan baja como en el grupo OVX. El análisis de los datos mediante el test ANOVA de un factor demostró diferencias significativas entre los grupos (P≤0,001). El análisis post-hoc de Bonferroni encontró diferencias significativas entre los grupos PSE y OVX (P≤0,01), PSE y EST (P≤0,05), EXE y OVX (P≤0,01) y EXE y EST (P≤0,05). 46 4. INGESTA SALINA La ingesta salina diaria se calculó de la misma forma indicada para la ingesta hídrica, y se normalizó respecto al peso (ingesta salina en ml/100 g p. c.) como: Ingesta salina diaria normalizada: * 100 Los resultados de la ingesta salina normalizada al peso son: INGESTA SALINA MEDIA (ml/100 g p. c.)±ESM DÍAS/TRATAMIENTO 1 PSE 2,14±1,55 OVX* 0,33±0,33 EST 3,31±1,75 EXE 3,67±2,4 2 3 4 5 6 7,99±2,28 3,09±1,02 5,41±2,57 2,28±1,22 3,00±1,54 3,60±1,67 1,25±0,66 2,09±0,38 2,65±2,65 2,85±1,22 5,31±1,31 3,42±2,28 1,33±1,05 1,80±0,65 4,00±1,9 6,09±3,12 3,62±1,08 5,86±0,61 5,76±3,15 6,38±1,79 Tabla 9: Datos de la ingesta salina media diaria en ml/100 g p.c. ± ESM *P≤0,05 vs. EXE. Ingesta salina normalizada (ml/100 g p.c.)±ESM Ingesta salina (ml/100 g p.c.) 12 10 8 PSE 6 OVX 4 EST 2 EXE 0 1 2 3 4 5 6 Días Fig. 17: Evolución de la ingesta salina media diaria en ml/100 g p.c.±ESM 47 La ingesta salina se ve afectada por la ovariectomía, como se ilustra en el gráfico superior. El grupo OVX es el que menos volumen salino ingiere a lo largo del experimento. La ingesta del grupo PSE sufre fluctuaciones importantes, y aunque al final del experimento tiende a equipararse con las ingestas de los grupos OVX y EST, la mayor parte del mismo es superior a ellas. La ingesta salina del grupo EXE se mantiene elevada, y es la más alta de entre los grupos experimentales (su ingesta salina total es 2,46 veces superior a la del grupo OVX). El análisis mediante ANOVA de un factor de los datos de ingesta salina mostró diferencias significativas (P≤0,05). El análisis post-hoc de Bonferroni únicamente detectó diferencias significativas entre los grupos OVX y EXE (P≤0,05). 48 5. HEMATOCRITO Los datos medios del hematocrito tras una semana de cada tratamiento se muestran a continuación: MEDIA HEMATOCRITO (%)±ESM PSE 34,33±2,85 OVX 34,67±0,67 EST 38±1,53 EXE 41,67±5,36 Tabla 10: Datos medios de hematocrito (%)±ESM tras 1 semana de tratamiento. Hematocrito (%) tras 1 semana de tratamiento±ESM 50 45 Hematocrito (%) 40 35 30 PSE 25 OVX 20 EST 15 EXE 10 5 0 34,33 34,67 38 41,67 Tratamiento Fig. 17: Hematocrito (%)±ESM al cabo de una semana para cada tratamiento. Los valores del hematocrito fueron muy similares entre grupos. El análisis ANOVA de los resultados no consiguió encontrar diferencias significativas entre ellos. Sin embargo, en la Fig. 17 puede observarse una clara tendencia a que el tratamiento EXE incremente el porcentaje de hematocrito 49 6. OSMOLALIDAD EN PLASMA La osmolalidad media en plasma en mmol/kg para cada tratamiento es: TRATAMIENTO OSMOLALIDAD DEL PLASMA (mmol/kg) ± ESM PSE 332,83±11,09 OVX 319,78±5,28 EST 358±30,26 EXE 329,56±16,41 Tabla 11: Datos medios de osmolalidad en plasma (mmol/kg) ± ESM Osmolalidad plasma (mmol/kg)±ESM 450 Osmolalidad plasma (mmol/kg) 400 350 300 PSE 250 OVX 200 EST 150 EXE 100 50 0 332,83 319,78 358 329,56 Tratamiento Fig. 18: Osmolalidad en plasma (mmol/kg) para cada tratamiento±ESM. Los datos de osmolalidad en plasma son muy homogéneos entre los distintos grupos, y su análisis estadístico mediante ANOVA de un factor no encontró diferencias significativas. Tal como se aprecia en la Fig. 18 ni la ovariectomía ni el tratamiento EXE afectaron notoriamente a la osmolalidad plasmática, ya que su valor es muy similar al del grupo PSE. El tratamiento EST, por su parte, muestra una tendencia a incrementar la osmolalidad, que llega a superar el valor del grupo PSE. 50 7. OSMOLALIDAD EN ORINA La osmolalidad media en orina en mmol/kg para cada tratamiento es: TRATAMIENTO OSMOLALIDAD EN ORINA (mmol/kg)± ESM PSE OVX 1209,67±701,33 1409,83±220,32 EST** EXE 1604,5±109,5 847,22±65,25 Tabla 12: Datos medios de osmolalidad en orina (mmol/kg)± ESM ** P≤0,01 respecto a grupo EST (t-Student). Osmolalidad orina (mmol/kg)±ESM 2500 Osmolalidad orina (mmol/kg) 2000 1500 PSE OVX 1000 ** EST EXE 500 0 1209,67 1409,83 1604,5 847,22 Tratamiento Fig. 19: Osmolalidad en orina (mmol/kg)±ESM para cada tratamiento. ** P≤0,01 respecto a grupo EST (t-Student). 51 En la gráfica superior se observa cómo la ovariectomía afecta al valor de la osmolalidad en orina, incrementándolo. Sin embargo, el error estándar que presentan los datos de los grupos PSE es muy elevado, por lo que resulta complicado establecer comparaciones consistentes. El análisis estadístico de los resultados mediante ANOVA de un factor no demostró diferencias significativas entre ninguno de los grupos. No obstante, puede apreciarse con facilidad que los tratamientos EST y EXE tienen efectos opuestos sobre la osmolalidad en orina. Un análisis mediante t-Student por parejas de tratamientos (t=6,456; g.l.=3) encontró diferencias significativas entre los grupos EST y EXE (P≤0,05). El tratamiento EST eleva mucho el valor de la osmolalidad, y llega incluso a duplicar el incremento provocado por la ovariectomía. El tratamiento EXE, por el contrario, reduce drásticamente el valor de la osmolalidad en orina, que pasa a ser de solo el 70% del que presenta como media el grupo PSE. 52 8. PROTEÍNA EN PLASMA Los datos de medios de proteína en plasma en g/100 ml para cada tratamiento son: TRATAMIENTO PROTEÍNA EN PLASMA (g/100ml)±ESM PSE OVX 6,23±0,52 6,08±0,61 EST EXE 6,39±0,16 6,15±0,64 Tabla 13: Datos medios de proteína en plasma (g/100 ml)±ET Concentración proteica plasma (g/100 ml)±ESM Concentración proteica plasma (g/100ml) 8 7 6 5 PSE OVX 4 EST 3 EXE 2 1 0 6,23 6,08 6,39 6,15 Tratamiento Fig. 20: Proteína en plasma (g/100 ml)±ESM para cada tratamiento. Los valores de concentración proteica plasmática son muy similares entre sí, sin apreciarse diferencias entre grupos. El análisis de los datos mediante ANOVA de un factor no encontró diferencias significativas. 53 9. PROTEÍNA EN ORINA Los datos de medios de proteína en orina en g/100 ml para cada tratamiento son: TRATAMIENTO PSE OVX PROTEíNA EN ORINA (g/100 ml)±ESM 7,27±4,33 8,83±1,2 EST** EXE 10,08±0,73 5,33±0,47 Tabla 14: Datos medios de proteína en orina (g/100 ml)±ESM ** P≤0,01 respecto a grupo EST (t-Student). Concentración proteica orina (g/100 ml)±ESM Concentración proteica orina (g/100 ml) 14 12 10 PSE 8 ** 6 OVX EST EXE 4 2 0 7,27 8,83 10,08 5,33 Tratamiento Fig. 21: Proteína en orina (g/100 ml)±ESM para cada tratamiento. ** P≤0,01 respecto a grupo EST (t-Student). 54 La cirugía provoca un detrimento del valor medio de concentración proteica en orina, aunque el análisis de los resultados mediante ANOVA de un factor no encontró diferencias significativas. Sin embargo, el error típico del grupo PSE es muy grande, por lo que la observación que puede realizarse con los grupos PSE y OVX no es fiable. Sí puede apreciarse que los tratamientos EST y EXE tienen efectos opuestos, elevando el primero el valor de proteína en orina y bajándolo el segundo. Un análisis mediante tStudent por parejas de tratamientos (t=5,859; g.l.=3) encontró diferencias significativas entre los grupos EST y EXE (P≤0,01). 55 DISCUSIÓN La menopausia está asociada con la aparición de una serie de síntomas adversos, entre los que se encuentra la elevación de la presión sanguínea. Esto lleva a que entre las mujeres de más edad la incidencia de hipertensión (HT) sea más elevada y, consecuentemente, también el riesgo de mortalidad por ECV23,27,29. Dado que el tratamiento de estos síntomas con terapia hormonal sustitutiva (THS) puede atañer graves efectos secundarios58,66–72,75,76, la búsqueda de terapias alternativas para la prevención de la subida de la presión sanguínea cobra una enorme importancia27,35. En este trabajo se ha tratado de comparar en ratas ovariectomizadas (que son un modelo experimental para el estudio de los efectos de la depleción estrogénica de la menopausia90,92) el efecto a corto plazo de la THS y el ejercicio sobre las alteraciones del equilibrio hidromineral causadas por la pérdida de estrógenos. Así se ha buscado esclarecer si el ejercicio podría suplir a la THS en la prevención a corto plazo de la elevación de la presión sanguínea. Para ello, se sometió a un grupo de ratas ovariectomizadas a inyecciones diarias de 17-β-estradiol (17-B-EST, tratamiento EST) y a otro a un protocolo de ejercicio diario de intensidad baja (tratamiento EXE), durante una semana. El ejercicio escogido fue la natación, ya que por sus características es fácilmente realizable por las personas de más edad87,88. Otros dos grupos de ratas, uno con ratas pseudoovariectomizadas (PSE) y otro con ovariectomizadas (OVX) se utilizaron como controles. La diferencia en la ingesta de comida entre los grupos no fue estadísticamente significativa. Esto entraría en conflicto con estudios previos que demuestran que el estradiol reduce eficazmente la ingesta de comida (al modular, mediante su unión a receptores en el núcleo del tracto solitario y el núcleo paraventricular, el efecto de algunos péptidos orexigénicos), y que la ovariectomía produce hiperfagia93–95. No obstante, a pesar de que en este trabajo no hubiera diferencias de ingesta significativas, sí pudo apreciarse una tendencia creciente en la ingesta de comida del grupo OVX. Por tanto, es probable que la no significancia de los resultados solo indique que el tiempo 56 del experimento no fue suficiente para poder detectar el incremento de ingesta en toda su magnitud. En cuanto al aumento de peso, tal como cabía esperar, las ratas de todos los grupos experimentales ganaron peso. Ello se debe al sedentarismo al que estaban sometidas y, probablemente, también al hecho de que nuestro modelo está formado por animales jóvenes que aún debían crecer un poco más para llegar a su tamaño adulto definitivo. Sin embargo, la ovariectomía incrementó la ganancia de peso de forma muy significativa (P≤0,001), en consonancia con otros estudios previos que también mostraron este efecto92,94,96. El tratamiento EST pudo evitar dicho incremento de peso, pero no fue así con el tratamiento EXE. Este resultado entra en conflicto con otros estudios que indican que la ganancia de peso generada por la ovariectomía revierte al realizar ejercicio aeróbico96,97. Probablemente la discrepancia se deba a que el ejercicio escogido en este experimento es de intensidad baja, y puede por tanto no ser suficiente para compensar el efecto del sedentarismo. El resultado más importante de este estudio es que para las ingestas hídrica y salina normalizadas hubo diferencias estadísticamente significativas entre grupos (P≤0,001 y P≤0,05, respectivamente). Una posible crítica a este estudio es el hecho de que las ratas ingieren líquido de forma postpandrial44, de modo que la ingesta hídrica podría variar en función de la comida ingerida, alterando así los resultados. Sin embargo, dado que no hubo diferencias significativas en la cantidad de comida ingerida, las variaciones en la ingesta hídrica deben ser atribuidas a los tratamientos aplicados a cada grupo experimental. La ovariectomía produjo en el grupo OVX un importante descenso de la ingesta de agua normalizada respecto al grupo PSE (P≤0,05). El tratamiento con 17-B-EST no compensó el descenso de ingesta hídrica causado por la ovariectomía (P≤0,05 respecto al grupo PSE), lo cual confirma lo observado en estudios previos que indican que la administración de estrógenos disminuye la ingesta hídrica en ratas ovariectomizadas98 u ovariectomizadas y tratadas con ANGII44,99,100. Por contra, tal y como se esperaba con la deshidratación causada por el ejercicio46, en el grupo EXE no hubo variación significativa en la cantidad de agua ingerida. 57 En la ingesta salina se observó un descenso en el grupo OVX respecto al grupo PSE, aunque éste no fue significativo. El tratamiento con 17-B-EST también generó un cierto descenso, que aunque no fue significativo, se adecúa a lo descrito en 1980 por Danielsen y Buggy101, quienes comprobaron que la hembra de rata ingería una menor cantidad de una solución al 1,8% de NaCl durante el proestro (momento del ciclo con alto nivel de estrógenos). Este menor apetito por la sal ante aumentos estrogénicos en el ciclo, parece no concordar con el efecto promotor del apetito salino generado por el incremento del estradiol durante la gestación y la lactancia en humanos y ratas102, o durante la administración de dosis elevadas de estrógenos a ratas ovariectomizadas103. Actualmente las causas de estas observaciones, aparentemente contradictorias, no están esclarecidas44. Por su parte, el tratamiento EXE incrementó ligeramente y de forma no significativa la ingesta salina con respecto al grupo PSE, aunque dicha elevación es suficiente para que se aprecien diferencias significativas con el grupo OVX (P≤0,05). Este mayor apetito salino encaja con la esperada deshidratación extracelular que sufrirían los animales al realizar ejercicio. Respecto a los parámetros sanguíneos, el hematocrito no se vio afectado por la ovariectomía ni los tratamientos, siendo la diferencia entre grupos no significativa. Solo se observa una leve tendencia al aumento en el tratamiento EXE, lo cual podría deberse simplemente a la deshidratación extracelular causada por el ejercicio: la reducción del VEC hace que proporcionalmente el porcentaje de plasma sanguíneo sea menor, aún sin variaciones en el número de glóbulos rojos28. En cuanto a las mediciones de la osmolalidad y proteína en plasma sanguíneo, las diferencias entre grupos no fueron significativas en ningún caso. No obstante, en la osmolalidad plasmática se aprecia una clara tendencia al aumento en el grupo EST, hecho que va en consonancia con la reducción en la ingesta salina observada en estos animales (la disminución del apetito salino supondría un mecanismo compensatorio). En el grupo EXE la osmolalidad en plasma apenas sufrió variación, indicando que la ingesta hídrica y salina compensó eficazmente la deshidratación post ejercicio. Las mediciones de la función renal realizadas, osmolalidad y concentración proteica en orina, tampoco mostraron diferencias significativas entre grupos. Sin embargo, ambos parámetros muestran una tendencia al aumento a causa de la 58 ovariectomía. Esa elevación está conforme a lo esperado dadas las mediciones previas en nuestro estudio, como la menor ingesta salina en este grupo. Por su parte, el aumento de la proteína en orina está considerado como un marcador pronóstico de la disfunción renal, y está relacionado con aumentos de presión arterial104. En cuanto a los tratamientos, el efecto que tuvo el 17-B-EST fue contrario al del ejercicio en ambos parámetros, y la diferencia entre los resultados de los dos grupos fue significativa al analizarlos mediante t-Student (P≤0,01 en ambos casos). El aumento de osmolalidad en orina del grupo EST supera incluso al del grupo OVX y confirma lo observado en las mediciones previas del estudio: el grupo EST muestra menor ingesta salina e hídrica, ya que tiene una osmolalidad plasmática algo elevada y esto lleva a que el riñón concentre más la orina, a través de una mayor excreción de sal y, probablemente, mayor reabsorción de agua (aunque esto último no se midió en el presente estudio). El grupo EXE ingiere más agua y sales para compensar la deshidratación causada por el ejercicio, y genera una orina más diluida. Posiblemente, la dilución de urinaria se deba a una mayor excreción de agua a causa de un exceso de ingesta de la misma que incremente la filtración glomerular, aunque de nuevo el volumen de orina no fue medido. Tal como se explicó en la introducción, la cantidad de agua y sal ingerida y excretada se correlaciona indirectamente con la presión sanguínea del organismo. Los mecanismos que promueven la sed y el apetito salino se activan o inactivan para compensar las variaciones de dicha presión. De este modo, un animal con baja ingesta hídrica y salina, y con alta excreción de sal en un reducido volumen de orina, tendrá una presión sanguínea alta. Mientras tanto, aquel animal con mayor ingesta hídrica y salina y una orina muy diluida en sales, tendrá una presión sanguínea menor46,49. Debido a las limitaciones técnicas de este estudio, el volumen de orina no fue medido. Por tanto, no es posible conocer la cantidad concreta de sales que excretaron los animales, y esto no permite realizar una correlación exacta con la presión sanguínea. Sin embargo, en base a la ingesta hídrica y salina y a la osmolalidad de la orina, puede estimarse un incremento o descenso de la presión. En conjunto, los resultados de este trabajo sugieren que la ovariectomía provocaría un incremento de la presión sanguínea, ya que se observa una menor ingesta hídrica y salina, una tendencia al aumento de la osmolalidad plasmática y una tendencia 59 a tener mayor osmolalidad y proteinuria en orina. Esto sería acorde con lo observado en estudios previos que midieron la presión sanguínea de forma directa en ratas ovariectomizadas y constataron su incremento105–108. En dichos estudios, la elevación de la presión se produjo tras un tiempo de al menos tres semanas107, un periodo más largo que en el presente trabajo. Los datos obtenidos sobre el efecto de la THS con dosis fisiológicas de 17-B-EST indican una disminución de la ingesta hídrica y salina, una tendencia al incremento de la osmolalidad en plasma y un aumento de la osmolalidad de la orina de ratas ovariectomizadas. Así, apuntan hacia una elevación de la presión arterial. Consecuentemente, la THS incrementaría el riesgo de ECV a largo plazo. Este resultado contradice lo descrito en estudios previos, que indican que el 17-B-EST es capaz de revertir el incremento de presión sanguínea causado por la depleción estrogénica de la ovariectomía105,106. Sin embargo, dado que las dosis que utilizaron en tales estudios fueron suprafisiológicas (15 μg/kg/día en el primer caso, y una dosis de depósito equivalente a 26,8 μg/día en el segundo), la falta de efecto del reemplazo hormonal puede ser debida a que una dosis fisiológica de 1,4μg/kg/día no sea suficiente. Por contra, se ha observado que la realización diaria de 15 minutos de natación (ejercicio de intensidad muy baja) por ratas ovariectomizadas ha sido capaz de mantener invariables la ingesta hídrica y salina y la osmolalidad plasmática, y ha reducido la osmolalidad en orina. Por tanto, los resultados indican que el ejercicio es capaz de mantener la presión sanguínea a niveles semejantes a los de ratas pseudoovariectomizadas. Así, consigue evitar un posible incremento de dicha presión a causa de la carencia de estrógenos. En cualquier caso, se sabe que la hipotensión post ejercicio en roedores puede ser hasta un 50% mayor que en los seres humanos83, de modo que la efectividad del ejercicio en las mujeres podría no ser tan alta como se muestra en este estudio. Dado que en el presente trabajo no se han medido concentraciones plasmáticas de hormona, es difícil hacer una afirmación acerca de los mecanismos que están mediando los efectos observados. Sin embargo, los resultados obtenidos en el tratamiento EST podrían ser ocasionadas por la disminución de la expresión de ECA51 y la aparente interacción a nivel central entre el 17-B-EST y la ANGII44,52–54. Esto reduciría tanto la 60 disponibilidad, como el efecto de la ANGII, justificando la menor ingesta de agua y sal y la menor reabsorción de sales en el riñón. Además, de acuerdo con el trabajo publicado en 2008 por Sladek y Somponpun57, el estradiol disminuye el umbral de osmolalidad plasmática para la liberación de VP. Esto, junto al hecho de que en este estudio no se han imitado las fluctuaciones estrogénicas del ciclo estral, podría motivar que en el grupo EST la concentración de VP plasmática se mantuviera a niveles mayores de forma permanente, causando reabsorción hídrica renal y concentrando la orina. En el caso del ejercicio la disminución de la activación simpática causaría una menor liberación de ANGII79,83, lo que evitaría la reabsorción de sales y agua a nivel renal. Además, la vasodilatación causada por la liberación de óxido nítrico79,83 incrementaría el flujo arterial al riñón, lo que podría aumentar la tasa de filtración glomerular y llevaría a la observada dilución urinaria. En síntesis, los resultados obtenidos en el presente trabajo sugieren que en ratas ovariectomizadas la realización diaria de natación a intensidad baja es más efectiva que la THS con 17-B-EST evitando el desequilibrio hidromineral que genera la depleción estrogénica. Por tanto, el ejercicio sería más efectivo en la prevención del incremento de la presión sanguínea causada por la privación de estrógenos. Sin embargo, sería necesario realizar más estudios que avalaran estas conclusiones, ya que este trabajo tiene limitaciones, como el escaso número de animales empleados, la falta de medición de los niveles hormonales o la ausencia de mediciones directas de la presión sanguínea. Finalmente, vale la pena mencionar que en este estudio únicamente se están observando los efectos de la THS y el ejercicio a corto plazo. No obstante, el estudio Million Women Study (MWS)75 indicaba que el riesgo de ECV se incrementaba cuanto mayor era el tiempo de administración de THS. Contrariamente, se esperaría que ocurriera lo opuesto en el caso del ejercicio, ya que se sabe que sus beneficios se incrementan con su realización continuada79,80. Por tanto, es probable que el efecto beneficioso del ejercicio fuese aún mayor con un incremento en la duración de los tratamientos; de modo que sería interesante realizar estudios futuros que comprobasen esta hipótesis. 61 CONCLUSIONES 1. La ovariectomía en la rata provoca un descenso de la ingesta hídrica y salina respecto al grupo pseudoovariectomizado (P≤0,01 y P≤0,05, respectivamente). 2. Nuestros resultados han mostrado que el ejercicio de intensidad baja ha tenido una mayor capacidad de amortiguar dicho descenso, comparado con una dosis fisiológica diaria de 17-β-estradiol. 3. Dicho ejercicio ha tenido un efecto reductor de la osmolalidad y proteína en orina, contrario al de la terapia hormonal, (P≤0,01 para ambos parámetros, con respecto al grupo tratado con hormona). 4. Dada su mayor capacidad de amortiguación, nuestras observaciones indican que el ejercicio resulta más efectivo que la terapia hormonal sustitutiva, manteniendo la homeostasis hidromineral tras la ovariectomía. Puesto que la alteración del equilibrio hidromineral suele provocar una subida de la tensión arterial, cabe esperar que en el futuro el uso de la terapia hormonal sustitutiva descienda en favor del ejercicio físico. 62 BIBLIOGRAFÍA 1. Solomon, E., Perg, L. & Martin, D. Biología. (McGraw-Hill Interamericana, 2001). 2. Moore, K. L., Persaud, T. V. N. & Torchia, M. G. Embriología clínica. (ELSEVIER Saunders, 2013). 3. Silverthorn, U. Fisiología humana: un enfoque integrado. (Editorial médica panamericana, 2008). 4. De la Cruz, R. & Pásaro, R. Control endocrino del ciclo reproductor en la rata: una experiencia docente utilizando un método de caracterización citológico. Rev. Enseñ. Univ. Extraordinario 1998, 545–554 (1998). 5. Urbina, M. T. & Lerner Biber, J. Fertilidad y reproducción asistida. (Editorial médica panamericana, 2008). 6. Gal Iglesias, B., López Gallardo, M., Martín Velasco, A. I. & Prieto Montalvo, J. Bases de la fisiología. (Tébar, 2007). 7. Vantman, D. & Vega, M. Fisiología reproductiva y cambios evolutivos con la edad de la mujer. Rev Med Clin Condes 21, 348–362 (2010). 8. Campo, S., Bergadá, I. & Barañao, L. Inhibina y función ovárica. Rev. Argent. Endocrinol. Metab. 42, 36–38 (2005). 9. Goodman, H. M. Basic Medical Endocrinology. (ELSEVIER Science, 2003). 10. Taketani, Y., Yano, T. & Kugu, K. The climateric as a crucial stage of female life. JMAJ 47, 166–170 (2004). 11. Palacios, S., Henderson, V. W., Siseles, N., Tan, D. & Villaseca, P. Age of menopause and impact of climacteric symptoms by geographical region. Climateric 13, 419–428 (2010). 12. Hansen, K. R. et al. A newmodel of reproductive aging: the decline in ovarian nongrowing follicle number from birth to menopause. Hum. Reprod. 23, 699–708 (2008). 13. Broekmans, F. J., Soules, M. R. & Fauser, B. C. Ovarian aging: mechanisms and clinical consequences. Endocr. Rev. 30, 465–493 (2009). 14. Lambalk, C. B., van Disseldorp, J., Koning, C. H. & Broekmans, F. J. Testing ovarian reserve to predict age at menopause. Maturitas 63, 280–291 (2009). 15. De Bruin, J. P. et al. The role of genetic factors in age at natural menopause. Hum. Reprod. 19, 2014–2018 (2001). 63 16. Bajo Arenas, J. M., Lailla Vicens, J. M. & Xercavins Montosa, J. Fundamentos de Ginecología. (Editorial médica panamericana, 2009). 17. Brockie, J. Managing menopausal symptoms: hot flushes and night sweats. Nurs Stand 28, 48–53 (2013). 18. Nisar, N. & Ahmed Sohoo, N. Frequency of menopausial shynthoms and their impact on the quality of life of women: a hospital based study. JPMA 59, 752–756 (2009). 19. Ferrer, J. & García, J. B. Climaterio: aspectos ginecológicos, psicológicos y psiquiátricos. (Upjohn Farmoquímica, 1993). 20. Márquez-Celedonio, F. G. & Texón-Fernández, O. Calidad de vida en mujeres climatéricas con y sin terapia hormnal de reemplazo. Rev Med Inst Mex Seguro Soc 44, 541–545 (2006). 21. Maric-Bilkan, C., Gilbert, E. L. & Ryan, M. J. Impact of ovarian function on cardiovascular health in women: focus on hypertension. Int. J. Womens Health 6, 131–139 (2014). 22. Coylewright, M., Reckelhoff, J. F. & Ouyang, P. Menopause and hypertension: an age-old debate. Hypertension 51, 952–959 (2008). 23. Dubey, R. K., Oparil, S., Imthurn, E. & Jackson, E. K. Sex hormones and hypertension. Cardiovasc. Res. 53, 688–708 (2002). 24. Yanes, L. L. et al. Postmenopausal Hypertension: Role of the renin-angiotensin system. Hypertension 56, 359–353 (2010). 25. Pechere-Bertschi, A. & Burnier, M. Female sex hormones, salt, and blood pressure regulation. Am. J. Hypertens. 17, 994–1001 (2004). 26. Wenner, M. M. & Stachenfeld, N. S. Blood pressure and water regulation: understanding sex hormone effects within and between men and women. J. Physiol. 590, 5949–5961 (2012). 27. Barton, M. & Meyer, M. R. Postmenopausal Hypertension: Mechanisms and therapy. Hypertension 54, 11–48 (2009). 28. Chicharro, J. L. & Fernández-Vaquero, A. Fisiología del ejercicio. (Editorial médica panamericana, 2006). 29. Izumi, Y. et al. Effect of age at menopause on blood pressure in postmenopausal women. Am. J. Hypertens. 20, 1045–1050 (2007). 64 30. Gorgui, J., Gorshkov, M. K., Khan, N. & Daskalopoulou, S. S. Hypertension as a Risk Factor for Ischemic Stroke in Women. Can. J. Cardiol. (2014). doi:10.1016/ j.cjca.2014.01.007 31. Lisabeth,, L. & Bushnell, C. Stroke risk in women: the role of menopause and hormone therapy. Lancet Neurol. 11, 82–91 (2012). 32. Llisterri, J. L. et al. Blood Pressure Control in Hypertensive Women Aged 65 Years or Older in a Primary Care Setting. MERICAP Study. Rev. Esp. Cardiol. 64, 654– 660 (2011). 33. Schenck-Gustafsson, K. et al. EMAS position statement: Managing the menopause in the context of coronary heart disease. Maturitas 68, 94–97 (2011). 34. Schenck-Gustafsson, K. Risk factors for cardiovascular disease in women. Maturitas 63, 186–190 (2009). 35. Palacios, S., Sanchez Borrego, R. & Forteza, A. Te importance of preventive health care in post menopausal women. Maturitas 25S, S53–S60 (2005). 36. Creatsas, G., Christodoulakos, G. & Lambrinoudaki, I. Cardiovascular disease: screening and management of the asymptomatic high-risk post-menopausal women. Maturitas 52S, S32–S37 (2005). 37. Harrison-Bernard, L. M., Hernandez Schulman, I. & Raij, L. Postovariectomy Hypertension Is Linked to Increased Renal AT1 Receptor and Salt Sensitivity. Hypertension 42, 1157–1163 (2003). 38. Siamopoulos, K. C. et al. Ambulatory blood pressure monitoring in normotensive prenant women. J. Hum. Hypertens. 10, S51–S54 (1996). 39. Rosano, G. M. C., Sarais, C., Zoncu, S. & Mercuro, G. The relative effect of progesterone and progestins in hormone replacement therapy. Hum. Reprod. 15, 60– 73 (2000). 40. Adams, M. R., Register, T. C., Golden, D. L. & Wagner, J. D. Medroxyprogesterone acetate antagonizes inhibitory effects of conjugated equine estrogens on coronary artery atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 17, 217–221 (1997). 41. Gil, A. Bases fisiológicas y bioquímicas de la nutrición. (Editorial médica panamericana, 2010). 65 42. Flàvio Silveira, P., Irazusta, J., Gil, J., Agirregoitia, N. & Casis, L. Interactions among challenges of hydromineral balance, angiotensin-converting enzyme and cystine aminopeptidase. Peptides 22, 2137–2144 (2001). 43. Fitzsimons, J. T. Thirst and sodium apetite. Physiol. Rev. 78, 583–686 (1998). 44. Curtis, K. S. Estrogen and the central control of body fluid balance. Physiol. Behav. 97, 180–192 (2009). 45. Hinchcliff, K. W., Kaneps, A., Hinchcliff, K., Geor, R. & Kaneps, A. Equine Sports Medicine and Surgery. (Saunders Ltd., 2005). 46. Arai, S., Stotts, N. & Puntillo, K. Thirst in critically III patients: from physiology to sensation. Am. J. Crit. Care 22, 328–335 (2013). 47. Guyton, A. C. & Hall, J. E. Tratado de fisiología médica. (ELSEVIER Saunders, 2007). 48. Li, C. et al. Molecular Mechanisms of Antidiuretic Effect of Oxytocin. J. Am. Soc. Nephrol. 19, (2008). 49. Stricker, E. M. & Sved, A. F. Thirst. Nutrition 16, 821–826 (2000). 50. Nickening, G. et al. Estrogen modulates AT1 receptor gene expression in vitro and in vivo. Circulation 97, 2197–2201 (1998). 51. Gallagher, P. E., Li, P., Lenhart, J. R., Chappell, M. C. & Brosnihan, K. B. Estrogen regulation of angiotensin-converting ezyme mRNA. Hypertension 33, 323–328 (1999). 52. Krause, E., Curtis, K., Davis, L. M., Stowe, J. R. & Contreras, R. J. Estrogen influences estimulated water intake by ovariectomized female rats. Physiol. Behav. 79, 267–274 (2003). 53. Jones, A. B. & Curtis, K. Differential effects of estradiol on drinking by ovariectomized rats in response to hypertonic NaCl or isoproterenol: Implications for hyper- vs. hypo-osmotic stimuli for water intakate. Physiol. Behav. 98, 421–426 (2009). 54. Ciriello, J. & Roder, S. 17β-Estradiol alters the response of subfornical organ neurons that project to supraoptic nucleus to plasma angiotensin II and hypernatremia. Brain Res. 1526, 54–64 (2013). 55. Schunkert, H. et al. Effects of estrogen replacement therapy on the reninangiotensin system in postmenopausal women. Circulation 95, 39–45 (1997). 66 56. Umeda, M., Ichikawa, S., Kanda, T., Sumino, H. & Kobayashi, I. Hormone replacement therapy increases plasma level of angiotensin II in postmenopausal hypertensive women. Am. J. Hypertens. 14, 206–211 (2001). 57. Sladek, C. D. & Somponpun, S. S. Estrogen receptors: Their roles in regulation of vasopressin release for maintenance of fluid and electrolyte homeostasis. Front. Neuroendocrinol. 29, 114–127 (2008). 58. Cuzick, J. Hormone replacement therapy and the risk of breast cancer. Eur. J. Cancer 44, 2344–2349 (2008). 59. Servicio de Ginecología y Obstetricia & Servicio de ginecología y obstetricia del Hospital Severo Ochoa de Madrid. Ginecología y atención primaria. Problemas clínicos. (Schering España S. A., 2001). 60. Warren, M. & Halpert, S. Hormone replacement therapy: controversies, pros and cons. Best Pract. Res. Clin. Endocrinol. Metab. 18, 317–332 (2004). 61. Lee, W. L. et al. Hormone therapy for postmenopausal women-an unanswered issue. Gynecol. Minim. Invasive Ther. 2, 13–17 (2013). 62. Lorenzo, P. et al. Velázquez. Farmacología Básica y Clínica. (Ed. Médica Panamericana, 2008). 63. Ringa, V. Menopause and treatments. Qual. Life Res. 9, 695–707 (2000). 64. Yang, X. & Reckelhoff, J. F. Estrogen, hormonal replacement therapy and cardiovascular disease. Curr. Opin. Nephrol. Hypertens. 20, 133–138 (2011). 65. Grodstein, F., Manson, J. E. & Colditz, G. A. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann. Intern. Med. 133, 933–941 (2000). 66. Chiu, C. L. et al. Menopausal hormone therapy is associated with having high blood pressure in postmenopausal women: observational cohort study. PloS ONE 7, (2012). 67. Manson, J. E. et al. Estrogen plus Progestin and the Risk of Coronary Heart Disease. N. Engl. J. Med. 349, 523–534 (2003). 68. Hulley, S. et al. Heart and Estrogen/Progestin Replacement Study (HERS). Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. J. Am. Med. Assoc. 280, 605–6132 (1998). 67 69. Grady, D. et al. Cardiovascular disease outcomes during 6.8 years of hormone therapy. Heart and Estrogen/Progestin Replacement Study Follow-up (HERS II). J. Am. Med. Assoc. 288, 49–57 (2002). 70. Hulley, S. et al. Noncardiovascular disease outcomes during 6.8 years of hormone therapy. Heart and Estrogen/Progestin Replacement Study Follow-up (HERS II). J. Am. Med. Assoc. 288, 58–66 (2002). 71. Writing group for the Women’s Health Initiative Investigation. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the women’s health initiative randomized controlled trial. J. Am. Med. Assoc. 288, 321–333 (2002). 72. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women With hysterectomy. The Women’s Health Initiative Randomized Controlled Trial. J. Am. Soc. Nephrol. 291, 1701–1712 (2004). 73. Stevenson, J., Hodis, H. N., Pickar, J. H. & Lobo, R. A. Coronary heart disease and menopause management: the swinging pendulum of HRT. Atherosclerosis 207, 336–340 (2009). 74. Gompel, A., Rozenberg, S. & Barlow, D. H. The EMAS 2008 update on clinical recommendations on postmenopausal hormone replacement therapy. Maturitas 61, 227–232 (2008). 75. Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 362, 419–427 (2003). 76. Beral, V., Reeves, G., Bull, D. & Green, J. Breast cancer risk in relation to the interval between menopause and starting hormone therapy. J. Natl. Cancer Inst. 103, 296–305 (2011). 77. Dietel, M. Hormone replacement therapy (HRT), breast cancer and tumor pathology. Maturitas 65, 183–189 (2010). 78. Villiers, T. J. et al. Global consensus statement on menopausal hormone therapy. Climateric 16, 203–204 (2013). 79. Ruivo, J. & Alcantara, P. Hypertension and exercise. Port. J. Cardiol. 31, 151–158 (2012). 68 80. Gielen, S., Schuler, G. & Adams, V. Cardiovascular effects of exercise training. Molecular mechanisms. Circulation 122, 1221–1238 (2010). 81. Lee, S. K. et al. Endothelial nitric oxide synthase activation contributes to postexercise hypotension in spontaneously hypertensive rats. Biochem. Biophys. Res. Commun. 382, 711–714 (2009). 82. Urbana, M. et al. Postexercise blood pressure reduction in elderly hypertensive patients. J. Am. Coll. Cardiol. 39, 676–682 (2002). 83. MacDonald, J. R. Potential causes, mechanisms, and implications of post exercise hypotension. J. Hum. Hypertens. 16, 225–236 (2002). 84. Coutinho, A. & Baptista, F. Influence of habitual physical activity on the symptoms of climacterium/menopause and the quality of life of middle-aged women. Int. J. Women’s Health 3, 318–328 (2011). 85. Stojanovska, L., Apostolopoulos, V., Polman, R. & Borkoles, E. To exercise or not to exercise during menopause and beyond. Maturitas 77, 328–323 (2014). 86. Dubnov, G., Brzezinski, A. & Berry, E. Weight control and the management of obesity after menopause: the role of physical activity. Maturitas 44, 89–101 (2003). 87. Mohr, M. et al. High-intensity intermittent swimming improves cardiovascular health status for women with mild hypertension. BioMed Res. Int. 2014, 1–9 (2014). 88. Nualnim, N. et al. Effects of swimming training on blood pressure and vascular function in adults >50 years of age. Am. J. Cardiol. 109, 1005–1010 (2012). 89. Morán, J., Garrido, P., Alonso, A., Cabello, E. & González, C. 17β-Estradiol and genistein acute treatments improve some cerebral cortex homeostasis aspects deteriorated by aging in female rats. Exp. Gerontol. 48, 414–418 (2013). 90. Velloso Heeren, M. et al. Exercise improves cardiovascular control in a model of dislipidemia and menopause. Maturitas 62, 200–204 (2009). 91. Claudio, E. R. G. et al. Effects of chronic swimming training and oestrogen therapy on coronary vascular reactivity and expression of antioxidant enzymes in ovariectomized rats. PloS One 8, e64806 (2013). 92. Sanchez-Mateos, S. et al. Melatonin and estradiol effects on food intake, body weight, and leptin in ovariectomized rats. Maturitas 58, 91–101 (2007). 93. Eckel, L. A. The ovarian hormone estradiol plays a crucial role in the control of food intake in females. Physiol. Behav. 104, 517–524 (2011). 69 94. Pantaleão, T. U. et al. Effect of serum estradiol and leptin levels on thyroid function, food intake and body weight gain in female Wistar rats. Steroids 75, 638– 642 (2010). 95. Butera, P. C. Estradiol and the control of food intake. Physiol. Behav. 99, 175–180 (2010). 96. Zoth, N. et al. Metabolic effects of estrogen substitution in combination with targeted exercise training on the therapy of obesity in ovariectomized Wistar rats. J. Steroid Biochem. Mol. Biol. 130, 64–72 (2012). 97. Pighon, A., Paquette, A., Basalani, R., Chapados, N. A. & Rabasa-Lhoret, R. Resistance training attenuates fat mass regain after weight loss in ovariectomized rats. Maturitas 64, 52–57 (2009). 98. Santollo, J., Marshall, A. & Daniels, E. Activation of membrane-associated estrogen receptors decreases food and water intake in ovariectomized rats. Neuroendocrinology 154, 320–329 (2013). 99. Fujisawa, S., Tanaka, J. & Nomura, M. Estrogen attenuates the drinking response induced by activation of angiotensinergic pathways from the lateral hypothalamic area to the subfornical organ in female rats. Behav. Brain Res. 122, 33–41 (2001). 100. Kisley, L., Sakai, R., Ma, L. & Fluharty, J. Ovarian steroid regulation of angiotensin II-induced water intake in the rat. Am. J. Physiol. Heart Circ. Physiol. 276, R90–R96 (1999). 101. Danielsen, J. & Buggy, J. Depression of ad lib and angiotensin-induced sodium intake at oestrus. Brain Res. Bull. 5, 501–504 (1980). 102. Denton, D. The hunger for salt. (Springer-Verlag, 1982). 103. Kensicki, E., Dunphy, G. & Ely, D. Estradiol increases salt intake in female normotensive and hypertensive rats. J. Appl. Physiol. 93, 479–483 (2002). 104. Liébana Cañada, A., Nieto Iglesias, J. & Robles Pérez-Monteoliva, N. R. Hipertensión y proteinuria. Estrategias actuales de tratamiento. Nefología Supl. Extraordin. 2, 57–66 (2011). 105. Xu, X. et al. Effects of ovariectomy and 17-β-estradiol treatment on the renin– angiotensin system, blood pressure, and endothelial ultrastructure. Int. J. Cardiol. 130, 196–204 (2008). 70 106. Hernández, I. et al. 17β-Estradiol prevents oxidative stress and decreases blood pressure in ovariectomized rats. Am. J. Os Physiol. 279, 1599–1605 (2000). 107. Patki, G. et al. Grape powder intake prevents ovariectomy-induced anxiety-like behavior, memory impairment and high blood pressure in female Wistar rats. PloS ONE 8, e74522 108. Tezini, G. C., Dias, D. P. & Souza, H. Aerobic physical training has little effect on cardiovascular autonomic control in aging rats subjected to early menopause. Exp. Gerontol. 48, 147–153 (2013). 71