SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE
Anuncio
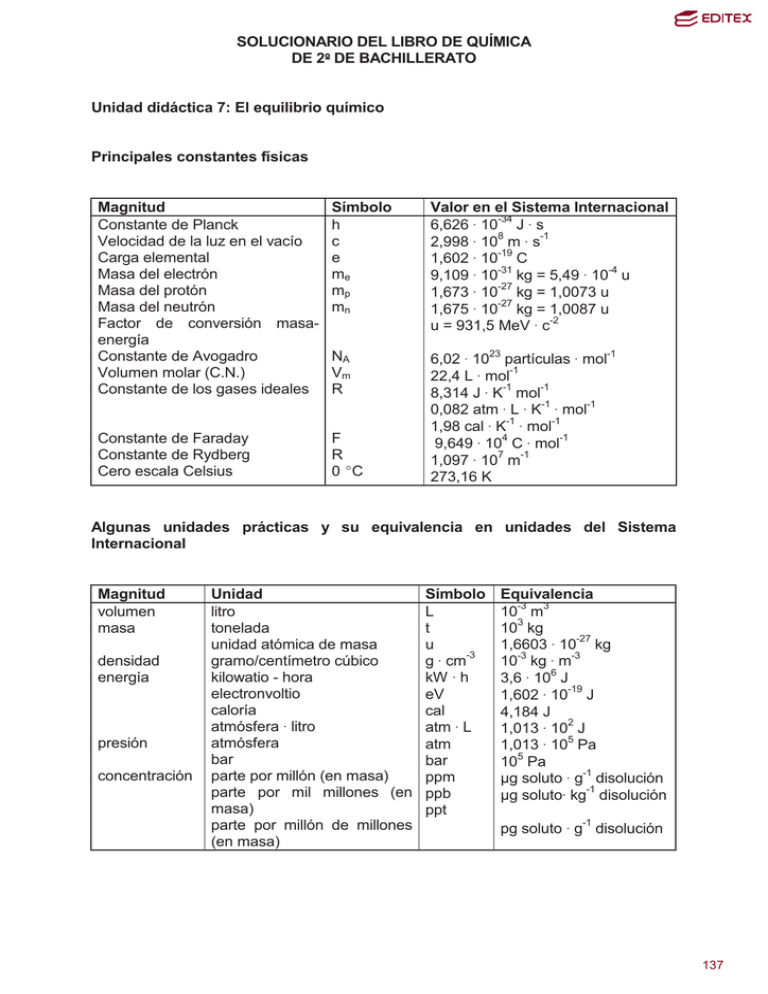
SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE BACHILLERATO Unidad didáctica 7: El equilibrio químico Principales constantes físicas Magnitud Constante de Planck Velocidad de la luz en el vacío Carga elemental Masa del electrón Masa del protón Masa del neutrón Factor de conversión masaenergía Constante de Avogadro Volumen molar (C.N.) Constante de los gases ideales Símbolo h c e me mp mn Valor en el Sistema Internacional 6,626 $ 10-34 J $ s 8 -1 2,998 $ 10 m $ s 1,602 $ 10-19 C -31 -4 9,109 $ 10 kg = 5,49 $ 10 u 1,673 $ 10-27 kg = 1,0073 u 1,675 $ 10-27 kg = 1,0087 u u = 931,5 MeV $ c-2 NA Vm R Constante de Faraday Constante de Rydberg Cero escala Celsius F R 0 (C 6,02 $ 1023 partículas $ mol-1 22,4 L $ mol-1 8,314 J $ K-1 mol-1 0,082 atm $ L $ K-1 $ mol-1 1,98 cal $ K-1 $ mol-1 9,649 $ 104 C $ mol-1 1,097 $ 107 m-1 273,16 K Algunas unidades prácticas y su equivalencia en unidades del Sistema Internacional Magnitud volumen masa densidad energía presión concentración Unidad litro tonelada unidad atómica de masa gramo/centímetro cúbico kilowatio - hora electronvoltio caloría atmósfera $ litro atmósfera bar parte por millón (en masa) parte por mil millones (en masa) parte por millón de millones (en masa) Símbolo L t u -3 g $ cm kW $ h eV cal atm $ L atm bar ppm ppb ppt Equivalencia 10-3 m3 103 kg 1,6603 $ 10-27 kg 10-3 kg $ m-3 3,6 $ 106 J 1,602 $ 10-19 J 4,184 J 1,013 $ 102 J 1,013 $ 105 Pa 105 Pa ȝg soluto $ g-1 disolución ȝg soluto$ kg-1 disolución pg soluto $ g-1 disolución 1 137 Z 89 13 51 18 33 85 16 56 4 83 5 35 48 20 6 58 55 30 40 17 27 29 36 24 21 50 38 9 15 87 31 32 72 2 1 26 49 77 57 Elementos químicos más utilizados y sus masas atómicas en u Símbolo Nombre masa Z Símbolo Nombre masa Ac Actinio 227 3 Li Litio 6,491 Al Aluminio 26,98 12 Mg Magnesio 24,31 Sb Antimonio 121,8 25 Mn Manganeso 54,94 Ar Argón 39,95 80 Hg Mercurio 200,6 As Arsénico 74,92 42 Mo Molibdeno 95,94 At Astato 210 60 Nd Neodimio 144,2 S Azufre 32,07 10 Ne Neón 20,18 Ba Bario 137,3 28 Ni Níquel 58,69 Be Berilio 9,012 7 N Nitrógeno 14,01 Bi Bismuto 209,0 102 No Nobelio 253 B Boro 10,81 79 Au Oro 197,0 Br Bromo 79,90 76 Os Osmio 190,2 Cd Cadmio 112,4 8 O Oxígeno 16,00 Ca Calcio 40,08 46 Pd Paladio 106,4 C Carbono 12,01 47 Ag Plata 107,9 Ce Cerio 140,1 78 Pt Platino 195,1 Cs Cesio 132,9 82 Pb Plomo 207,2 Zn Cinc 65,39 94 Pu Plutonio 242 Zr Circonio 91,22 84 Po Polonio 210 Cl Cloro 35,45 19 K Potasio 39,10 Co Cobalto 58,93 59 Pr Praseodimio 140,9 Cu Cobre 63,55 91 Pa Protoactinio 231 Kr Criptón 83,80 88 Ra Radio 226 Cr Cromo 52,00 86 Rn Radón 222 Sc Escandio 44,96 45 Rh Rodio 102,9 Sn Estaño 118,7 37 Rb Rubidio 85,47 Sr Estroncio 87,62 34 Se Selenio 78,96 F Flúor 19,00 14 Si Silicio 28,09 P Fósforo 30,97 11 Na Sodio 22,99 Fr Francio 223 81 Tl Talio 204,4 Ga Galio 69,72 43 Tc Tecnecio 99 Ge Germanio 72,59 52 Te Telurio 127,6 Hf Hafnio 178,5 22 Ti Titanio 47,88 He Helio 4,003 90 Th Torio 232,0 H Hidrógeno 1,008 74 W Volframio 183,9 Fe Hierro 55,85 92 U Uranio 238 In Indio 114,8 23 V Vanadio 50,94 Ir Iridio 192,2 54 Xe Xenón 131,3 La Lantano 138,9 53 I Yodo 126,9 2 138 Cuestiones iniciales 1. Por qué en muy contadas ocasiones los rendimientos de las reacciones químicas llegan a ser del 100 %? Entre las diversas causas por lo que el rendimiento de muchas reacciones químicas no es del 100 % es porque muchas de ellas son reacciones químicas reversibles, lo que origina que no toda la cantidad de reactivos se convierta íntegramente en productos de reacción. 2. Es posible llevar a cabo una reacción química no espontánea? En una reacción química no espontánea se cumple que ǻG > 0 y por tanto es una reacción química que está termodinámicamente prohibida. No obstante, hay reacciones químicas que están prohibidas a una determinada temperatura y son posibles a otra temperatura diferente. Así las reacciones endotérmicas, ǻH > 0, que van acompañadas de una gran variación de la entropía, ǻS > 0, pueden ser espontáneas a temperaturas elevadas, siempre que se cumpla que: ǻH < T $ ǻS. 3. Qué diferencia hay entre las siguientes ecuaciones químicas: a) H2 (g) + I2 (g) :2 HI (g) y b) H2 (g) + I2 (g) → 2 HI (g)? La ecuación química: H2 (g) + I2 (g) :2 HI (g) representa la reacción química reversible entre los reactivos y los productos y si la velocidad de formación del yoduro de hidrógeno es la misma que la de su descomposición se alcanza el equilibrio químico. El proceso debe realizarse en un recipiente cerrado. La ecuación química: H2 (g) + I2 (g) → 2 HI (g) representa el proceso de formación irreversible del yoduro de hidrógeno. Este proceso debe realizarse en un recipiente abierto del que se retira el producto y transcurre hasta que se agote alguno de los reactivos. INVESTIGA Consulta en una hemeroteca o en el buscador www.google.es el significado y las diferencias entre una planta química piloto y otra comercial y contesta las preguntas: 1. Pon el pie adecuado a las fotografías de la parte superior, diferenciando entre un laboratorio, planta piloto y planta química comercial. 2. Indica las diferencias entre el trabajo de un químico y el de un ingeniero químico. 3. Explica por qué se utiliza tanto la producción en régimen continuo en una planta química industrial. 3 139 1. Pon el pie adecuado a las fotografías de la parte superior, diferenciando entre un laboratorio, planta piloto y planta química comercial. Planta piloto. Planta comercial. química Laboratorio. 2. Indica las diferencias entre el trabajo de un químico y el de un ingeniero químico. Un químico trabaja en el laboratorio y desde el punto de vista industrial lo que hace fundamentalmente es diseñar en el laboratorio el proceso de obtención de un nuevo producto o sustancia nueva, teniendo en cuenta las características físico-químicas de la misma y a escala de laboratorio. Además trata de averiguar las propiedades de la nueva sustancia y de realizar posteriormente los controles de calidad, análisis químico de la misma, etc. La industria química actual suele trabajar con procesos en régimen continuo a través de la formalización del concepto de operaciones unitarias, fragmentando el proceso en distintas fases: la preparación de materias primas, la reacción química, la filtración, la destilación o la evaporación, entre otras muchas más, lo que permite dar un paso adelante en la productividad de la industria química. De esta forma, aparece una nueva profesión: la del ingeniero químico, encargado de coordinar todos estos procesos. El químico piensa en términos de reacciones de combustión, hidrólisis o reducción y concede un segundo lugar a cómo filtrar, destilar, secar o transportar las sustancias, todos ellos son fenómenos físicos o, a lo sumo, fisicoquímicos, mientras que el ingeniero químico trata de optimizar el proceso industrial, mediante el estudio de los fenómenos de transporte (materia y energía), las variables de que depende el proceso y de los mejores equipos para llevarlo a cabo. Todo ello además es debido porque se ha dejado de pensar que si una reacción 4 140 química se podía hacer en el laboratorio se reproducía igual o mejor en la planta industrial. Mientras que en el laboratorio es fácil aplicar las leyes físicas o químicas que afectan a un proceso, cuando las mismas se quieren utilizar con grandes sistemas surgen graves dificultades de escala, pues dichas leyes quedan enmascaradas por diversos problemas, como los ocasionados por la resistencia al flujo de grandes volúmenes de fluidos o los de transferencia de calor en el sistema, por ello hay una gran diferencia entre el trabajo del químico en el laboratorio y el de ingeniero químico en la planta industrial. 3. Explica por qué se utiliza tanto la producción en régimen continuo en una planta química industrial. En una planta industrial que opere en régimen continuo fragmenta sus procesos a través de distintas operaciones: filtración, la reacción, la destilación, etc, hace que aumente notablemente la productividad de la fabricación por dos razones principales: a) Al cabo de un tiempo se llega a un equilibrio en las condiciones del proceso. Se alcanza el estado estacionario o de régimen permanente, lo que produce un mejor control sobre un flujo grande de los fluidos del proceso. b) Permite combinar la reacción y la separación de productos con un manejo óptimo de las instalaciones y reduce las necesidades de equipo y de personal para operarlo, lo que se traduce en la disponibilidad de unas instalaciones menos voluminosas para producir una misma cantidad de producto que en una planta química que opere en régimen discontinuo. Test de evaluación 1. Rellena los huecos en la siguiente frase: Un equilibrio ______ es aquel en el que la velocidad del proceso _____ y su _____ son ______. La respuesta correcta es: Un equilibrio dinámico es aquel en el que la velocidad del proceso directo y su inverso son iguales. 2. Marca como V (verdadera) o F (falsa) cada afirmación sobre: La solubilidad de CO2 (g) en agua no está influida por: a) Presión. b) Temperatura. c) Velocidad con que pasa el flujo del gas. d) La reacción química del gas con el agua. La solubilidad de CO2 (g) en agua no está influida por: a) Presión: falsa. Sí que influye la presión en la solubilidad del CO2 (g) en agua. b) Temperatura: falsa. Sí que influye la temperatura en la solubilidad del CO2 (g) en agua. c) Velocidad con que pasa el flujo del gas es la correcta, pues no influye en la solubilidad del CO2 gaseoso. d) La reacción química del gas con el agua: falsa, pues sí que influye en la solubilidad. 5 141 3. Qué cambio no afecta a la descomposición térmica del CaCO3: a) El aumento de la temperatura. b) La disminución de la presión. c) La variación de la concentración de CO2. d) Un aumento en la cantidad inicial de CaCO3. a) El aumento de la temperatura sí que afecta a la descomposición térmica del CaCO3. b) La disminución de la presión sí que afecta a la descomposición térmica del CaCO3. c) La variación de la concentración de CO2 sí que afecta a la descomposición térmica del CaCO3. d) Un aumento en la cantidad inicial de CaCO3 no afecta a la descomposición térmica del CaCO3. 4. Un recipiente de 2 L tiene 0,6 mol de la sustancia gaseosa A. Una vez alcanzado el equilibrio hay 0,2 mol de A. El valor numérico de la constante KC de la reacción: A (g) : 2 B (g) + C (g) es: a) 0,16. b) 0,32. c) 1,28. d) 0,64. La concentración inicial de A es: 0,6 mol = 0,3 mol/L 2L Reacción química A (g) : 2 B (g) + C (g) Relación estequiométrica 1 mol 2 mol 1 mol Concentraciones iniciales (en mol/L) 0,3 0 0 Concentraciones en el equilibrio (en mol/L) 0,3 – x 2x x Como 0,3 – x = entonces: K c = 0,2 mol = 0,1 mol / L x = 0,2 mol/L 2L [B] 2 · [C] (2 · 0,2)2 mol 2 /L2 · 0,2 mol/L mol 2 = = 0,32 [A] 0,1 mol/L L2 Luego la respuesta correcta es la: b). 5. Un matraz tiene agua líquida y vapor a 100 ºC y 1 atm en equilibrio. Si se mantiene constante la temperatura y aumenta la presión: a) Crece el vapor. b) Aumenta el líquido. c) No se desplaza el equilibrio. d) Solidifica el vapor. a) Crece el vapor es falso. b) Aumenta el líquido es la respuesta correcta. c) No se desplaza el equilibrio es falso. d) Solidifica el vapor es falso. 6 142 6. Rellena los huecos en la definición: Cociente de ______ es la expresión que resulta de aplicar la ley de _____ de masas a una reacción ______ que __ alcanza el equilibrio. La respuesta correcta es: Cociente de reacción es la expresión que resulta de aplicar la ley de acción de masas a una reacción reversible que no alcanza el equilibrio. 7. Las unidades de la constante de equilibrio KC de la reacción: I2 (g) + H2 (g) : 2 HI (g) son: a) mol · L-1. b) No tiene unidades. c) L · mol-1. d) mol · L. [HI] 2 (mol / L ) 2 , luego sus unidades son: = sin unidades Kc = [I 2 ] · [H 2 ] mol / L · mol / L Luego la respuesta correcta es la: b). 8. Marca como V (verdadera) o F (falsa) cada respuesta a lo que ocurre cuando se añade un catalizador en una reacción en equilibrio: a) Disminuye la energía de activación de la reacción directa. b) Disminuye la energía de activación de la reacción inversa. c) Conduce a más cantidad de productos. d) No afecta a las concentraciones del sistema. a) Disminuye la energía de activación de la reacción directa es falsa, pues afecta tanto a la energía de activación de la reacción directa como a la reacción inversa. b) Disminuye la energía de activación de la reacción inversa es falsa, pues afecta tanto a la energía de activación de la reacción directa como a la reacción inversa. c) Conduce a más cantidad de productos es falsa d) No afecta a las concentraciones del sistema es verdadera. 9. Dados los equilibrios gaseosos: SO2 + ½ O2 :SO3 con K1 y 2 SO3 : 2 SO2 + O2 con K2. ¿Qué relación es verdadera?: a) K2 = K1. b) K2 = (1/K1)2. c) K22 = K1. d) K2 = 1/K1. SO2 + ½ O2 :SO3 con K 1 = [SO3 ] [SO2 ] · [O2 ]1/ 2 2 SO3 : 2 SO2 + O2 con K 2 = Como: [SO2I] 2 · [O2 ] [SO3 ] 2 [SO3 ] 2 1 1 2 = , se puede observar que se cumple que: = K1 2 K2 K 2 [SO2 ] · [O2 ] Luego: ( 1 2 ) = K 2 . Por tanto la respuesta correcta es: la b). K1 7 143 10. En la reacción gaseosa: N2 + 3 H2 : 2 NH3 (∆ ∆H < 0), el equilibrio se desplaza hacia la derecha por: a) Aumento de la presión. b) La adición de un catalizador. c) Aumento de la temperatura. d) La adición de NH3. a) Aumento de la presión es correcta. b) La adición de un catalizador es falsa. c) Aumento de la temperatura es falsa. d) La adición de NH3 es falsa. Actividades finales: 1. Dadas las siguientes ecuaciones químicas: 2 H2 (g) + O2 (g) : 2 H2O (g); H2 (g) + ½ O2 (g) : H2O (g); 2 H2O (g) : 2 H2 (g) + O2 (g), si las correspondientes constantes de equilibrio, KC, son, respectivamente, K1, K2 y K3, ¿cuál es la relación entre K1 y K2?, ¿y entre K2 y K3? K1 = [H 2O ] 2 [H 2 ] 2 · [O2 ] ; K2 = [H 2O ] [H 2 ] · [O2 ]1/ 2 ; K3 = [H 2 ] 2 · [O2 ] [H 2 O ] 2 De acuerdo a estas expresiones resulta que: K1 = K22 Asimismo se cumple: K 1 = 1 1 , luego también: K 1 = K3 K3 2. En la reacción directa N2 + 3 H2 → 2 NH3, el N2 reacciona a una velocidad de -1 -1 0,3 mol · L · min . a) ¿Cuál es la velocidad a la que está despareciendo el H2 y cuál es la velocidad a las que se está formado el NH3? ¿Se podrá con estos datos proponer valores adecuados para α y β en la expresión: v = k · [N2]α · [H2]β, o se necesitaría alguna otra información? b) A 500 K la constante de equilibrio de dicha reacción es 0,9 L2 · mol-2. Si en un recipiente de 2 L hay 1 mol de N2, 3 mol de H2 y 1 mol de NH3, ¿está el sistema en equilibrio? a) Con la estequiometría de la ecuación química: v N 2 = 1 1 v H 2 = v NH 3 3 2 Luego: v H2 = 3 · v N2 = 3 · 0,3 mol · L-1 · min-1 = 0,9 mol · L-1 · min-1 v NH3= 2 · v N2 = 2 · 0,3 mol · L-1 · min-1 = 0,6 mol · L-1 · min-1 Como: v = k · [N2]α · [H2]β, no se puede hallar α y β con los datos suministrados. Hace falta conocer las velocidades de reacción para determinadas concentraciones de los reactivos y comparando datos de dos experiencias cuando la concentración de un reactivo es constante se puede hallar el orden de reacción respecto al segundo reactivo. Repitiendo la comparación cuando la concentración del segundo reactivo permanece constante, se puede hallar el orden de reacción respecto al primero. 8 144 1 mol 2 ) [NH 3 ] 2L L2 b) Q = 0 , 148 = = [N 2 ] · [H 2 ] 3 ( 1 mol ) · ( 3 mol ) 3 mol 2 2L 2L ( 2 2 -2 Como Q es menor que K = 0,9 L · mol , el sistema no está en equilibrio y se desplaza hacia la derecha. 3. Para la ecuación química sin ajustar: NH3 (g) + O2 (g) : N2O4 (g) + H2O (g), halla la constante de equilibrio KC, sabiendo que al inicio de la reacción [N2O4] = -1 -1 [H2O] = 0,9 mol · L y en el equilibrio [H2O] = 0, 6 mol · L . El ajuste de la ecuación química es inmediato, de forma que es: 2 NH3 (g) + 7/2 O2 (g) : N2O4 (g) + 3 H2O (g) De esta forma: Ecuación de la reacción 2 NH3 + 7/2 O2 : N2O4 Concentraciones iniciales (mol/L) Concentraciones en el equilibrio (mol/L) 0 2x -1 Como: 0,9 – 3 x = 0,6 mol · L x = Kc = [N 2O4 ] · [H 2O ] 3 [NH 3 ] 2 · [O2 ] = 7/2 0 7/2 x + 0,9 0,9 - x 3 H2O 0,9 0,9 – 3 x 0,9 mol · L−1 − 0,6 mol · L−1 = 0,1 mol · L−1 3 ( 0,8 mol · L−1 ) · ( 0,6 mol · L−1 )3 ( 0,2 mol · L−1 )2 · ( 0,35 mol · L−1 )7 / 2 = 170,3 mol −3 / 2 · L3 / 2 4. A 2000 (C, en la reacción: 2 H2O (g) : 2 H2 (g) + O2 (g, la presión parcial del agua en el equilibrio es 0,976 atm y la presión total de la mezcla en el equilibrio es 1 atm. Calcula: a) La presión de vapor inicial del agua. b) Los valores de las constantes KP y KC. a) Reacción química 2 H2O (g) : 2 H2 (g) + O2 (g) Relación estequiométrica 2 mol 2 mol 1 mol Presiones iniciales (en atm) p0 0 0 Presiones el equilibrio (en atm) p0 – 2 p 2p p p0 – 2 p = 0,976 atm Por tanto: 0,976 atm + 2 p + p = 1 atm p = 0,008 atm Igualmente: p0 – 2 · 0,008 atm = 0,976 atm p0 = 0,992 atm 9 145 b) K P = ( p H 2 ) 2 · p O2 ( p H 2O ) 2 = (2 p ) 2 · p (0,976 atm ) 2 = 4 · (0,08 atm ) 3 (0,976 atm ) 2 = 2,15 · 10 −6 atm K P = K C · (R T ) ∆n , como: ∆n = 3 – 2 = 1, entonces: 2,15 · 10 − 6 atm = K C · (0,082 atm · L · 2273 K )1 K C = 1,15 · 10 −8 mol · L−1 mol · K 5. El compuesto químico gaseoso NOBr se descompone de acuerdo con la reacción: NOBr (g) : NO (g) + ½ Br 2 (g). A la temperatura de 350 K, la constante 1/2 de equilibrio KP es 0,15 atm . Si las presiones parciales de dichas sustancias a la citada temperatura dada y en un instante dado son 0,5 atm de NOBr, 0,4 atm de NO y 0,2 atm de Br2, qué ocurre en la transformación. b) Calcula la constante de equilibrio KC. a) QP = p NO · ( p Br 2 )1/ 2 0,4 atm · (0,2 atm )1/ 2 = = 0,358 atm 1/ 2 > 0,15 atm 1/ 2 p NOBr 0,5 atm El sistema no está en equilibrio, al ser QP > KP, desplazándose el mismo hacia la izquierda, consumiéndose NO y Br2. b) K P = K C · (R T ) ∆n , como: ∆n = 1 + ½ - 1 = ½, entonces: 0,15 atm 1/ 2 = K C · (0,082 atm · L · 350 K )1/ 2 K C = 0,028 mol 1/ 2 · L−1/ 2 mol · K 6. En un recipiente de 10 L se introducen 2 mol de A y 1 mol de B. Se calienta a 300 (C y se establece el siguiente equilibrio: A (g) + 3 B (g) : 2 C (g). Cuando se alcanza el equilibrio, la cantidad en mol de B es igual a la de C. Calcula la cantidad de cada sustancia en el equilibrio, KC y KP y la presión parcial de la sustancia B en el equilibrio. Reacción química A (g) + 3 B (g) : 2 C (g) Relación estequiométrica 1 mol 3 mol 2 mol Cantidades iniciales (en mol) 2 1 0 Cantidades en el equilibrio (en mol) 2-x 1–3x 2x Como en el equilibrio: 1 – 3 x = 2 x x = 0, 2 mol Luego hay: A: 2 – 0,2 mol = 1,8 mol; B = 1 – 3 · 0,2 mol = 0,4 mol; C = 2 · 0,2 mol = 0, 4 mol 0,4 mol 2 ) 10 L [C ] L2 KC = = = 138 , 9 [ A] · [B ] 3 ( 1,8 mol ) · ( 0,4 mol ) 3 mol 2 10 L 10 L 2 ( 10 146 K P = K C · (R T ) ∆n , como: ∆n = 2 – (1 + 3) = - 2, entonces: K P = 138,9 L2 · mol − 2 · (0,082 atm · L · 573 K ) −2 = 0,063 atm −2 mol · K Para hallar PB se aplica la ecuación de los gases ideales, de forma que: PB · 10 L = 0,4 mol · 0,082 atm · L · 573 K PB = 1,88 atm mol · K 7. A 25 (C, el valor de KP para el equilibrio: 2 CO (g) : C (s) + CO2 (g) es 2,046 -1 atm . Halla: a) El valor de KC. b) Las concentraciones en el equilibrio si se mezclan 3 mol de CO y 2 mol de CO2 en un recipiente de 1 L. a) K P = K C · (R T ) ∆n , como ∆n = 1 - 2 = - 1, entonces: 2,046 atm −1 = K C · (0,082 atm · L · 298 K ) −1 K C = 50 L · mol −1 mol · K b) Es un equilibrio heterogéneo, luego: Reacción química 2 CO (g) : Relación estequiométrica 2 mol 1 mol Cantidades iniciales (en mol) 3 2 Cantidades en el equilibrio (en mol) 3- 2x 2+x C (s) + CO2 (g) 2 mol [CO2 ] L 1L Inicialmente: QC = = = 0,22 2 3 mol 2 mol [CO] ( ) 1L Como QC es menor que KC el equilibrio se desplaza hacia la derecha hasta que QC sea igual a KC. Por tanto: 50 [CO2 ] L = mol [CO] 2 2 + x mol 1 L = 3 − 2 x mol 2 ( ) 1L L Al operar se obtiene la siguiente ecuación de segundo grado: 200 x2 – 601 x + 448 = 0, cuyas soluciones son: x1 = 1,63 mol y x2 = 1,37 mol La solución x1 = 1,63 mol es absurda porque: 3 - 2 · 1,63 es un número negativo, luego la solución es: x = 1,37 mol. Por tanto: 11 147 [CO ] = 3 − 2 · 1,37 mol 2 + 1,37 mol mol mol y [CO2 ] = = 0,26 = 3,37 1 L L 1 L L 8. A 1000 (C, KP = 1,65 atm para la reacción: CO2 (g) + C (s) : 2 CO (g). Si en el equilibrio la presión total es 5 atm, calcula el % de dióxido de carbono que ha reaccionado. Es un equilibrio heterogéneo, luego: C (s) : Reacción química CO2 (g) + 2 CO (g) Relación estequiométrica 1 mol 2 mol Presiones iniciales (en atm) p0 0 Presiones en el equilibrio (en atm) p0 - p 2p p0 – p + 2 p = 5 atm p0 = 5 atm - p p CO2 en el equilibrio es: 5 atm - p – p = 5 atm – 2 p KP = ( p CO ) 2 (2 · p) 2 2 = = 1,65 atm 4 p + 3,30 p – 8,25 = 0 p CO2 5 atm − 2 p cuyas soluciones son: p1 = - 1,91 atm (absurda) y p2 = 1,08 atm. Por tanto: Luego en el equilibrio: p CO2 = 5 atm - 2 · 1,08 atm = 2,84 atm p CO = 2 p = 2 · 1,08 atm = 2,16 atm Y la presión inicial del CO2 es: p0 = 5 atm – 1,08 atm = 3,92 atm Ahora, teniendo en cuenta que: pi · V = ni · R · T pi = [i] · R · T, resulta que las concentraciones correspondientes a dichas presiones son: En el equilibrio: 2,16 atm = [CO] · 0,082 atm · L · 1273 K [CO] = 0,0207 mol · L-1 mol · K 2,84 atm = [CO2] · 0,082 atm · L · 1273 K [CO2] = 0,0272 mol · L-1 mol · K Y la concentración inicial del CO2 es: 3,92 atm = [CO2]0 · 0,082 atm · L · 1273 K [CO2]0 = 0,0376 mol · L-1 mol · K -1 -1 -1 Luego de CO2 ha reaccionado: 0,0376 mol · L - 0,0272 mol · L = 0,0104 mol · L Por tanto: α = 0,0104 mol · L−1 0,0376 mol · L−1 · 100 = 27,56 % 12 148 9. A 800 (C, la KC de la reacción: 2 HI (g) : H2 (g) + I2 (g) es 0,016. Calcula, en el equilibrio: a) La concentración de HI, cuando las concentraciones de H2 e I2 son iguales y la presión del sistema 1 atm. b) Las concentraciones de todas las sustancias cuando la presión del sistema es 2 atm. a) Como: K P = K C · (R T ) ∆n , y: ∆n = 2 -2 = 0, entonces: KP = KC = 0,016 Reacción química 2 HI (g) : H2 (g) + I2 (g) Relación estequiométrica 2 mol 1 mol 1 mol Presiones iniciales (en atm) p0 Presiones en el equilibrio (en atm) p0 - 2 p 0 p p Resulta que: p0 – 2p + p + p = 1 atm p0 = 1 atm Luego: K P = p H2 · p I2 ( p HI ) = 2 p·p (1 atm − 2 p ) 2 = 0,016 p = 0,101 atm Por tanto: p H2 = p I2 = 0,101 atm y p HI = 1 atm - 2 · 0,101 atm = 0,798 atm Ahora, teniendo en cuenta que: pi · V = ni · R · T pi = [i] · R · T, resulta que las concentraciones correspondientes a dichas presiones son: En el equilibrio: 0,101 atm = [H2] · 0,082 atm · L -3 -1 · 1073 K [H2] = 1,15 · 10 mol · L mol · K [I2] = 1,15 · 10-3 mol · L-1 0,798 atm = [HI] · 0,082 atm · L · 1073 K [HI] = 9,07 · 10-3 mol · L-1 mol · K b) Ahora: p0 – 2p + p + p = 2 atm p0 = 2 atm KP = p H2 · p I2 ( p HI ) 2 = p·p (2 atm − 2 p ) 2 = 0,016 p = 0,202 atm Por tanto: p H2 = p I2 = 0,202 atm y p HI = 2 atm - 2 · 0,202 atm = 1,596 atm En el equilibrio: 0,202 atm = [H2] · 0,082 atm · L · 1073 K [H2] = 2,23 · 10-3 mol · L-1 mol · K [I2] = 2,23 · 10-3 mol · L-1 1,596 atm = [HI] · 0,082 atm · L · 1073 K [HI] = 0,0181 mol · L-1 mol · K 13 149 10. En un matraz de 1 L de capacidad se colocan 6 g de PCl5 (s). Se cierra el matraz y se calienta a 250 (C. El PCl5 pasa al estado de vapor y se disocia en parte en PCl3 y Cl2. La presión total en el equilibrio es 2,078 atm. Calcula el grado de disociación del PCl5 y la constante de equilibrio KP a dicha temperatura. La masa molar del PCl5 es 208,5 g · mol-1 La cantidad inicial de PCl5 es: n 0 = m 6g = = 0,0288 mol M 208,5 g · mol −1 Reacción química PCl5 (g) : PCl3 (g) + Cl2 (g) Relación estequiométrica 1 mol 1 mol 1 mol Cantidades iniciales (en mol) 0,0288 0 0 Cantidades en el equilibrio (en mol) 0,0288 (1– α) 0,0288 α 0,0288 α En el equilibrio, la cantidad total en mol es: nT = 0,0288 (1 - α) + 0,0288 α + 0,0288 α = 0,0288 (1 + α) Ahora: 2,078 atm · 1 L = 0,0288 (1 + α) · 0,082 atm · L · 523 K α = 0,68 mol · K Recordando la ley de Dalton: pi = p · xi, entonces: KP = p PCl 3 · p Cl 2 = p PCl 5 Luego: K P = p · p· 0,0288 α 0,0288 α ·p · 0,0288 (1 + α ) 0,0288 (1 + α ) α2 =p· 0,0288 (1 − α ) 1− α2 p· 0,0288 (1 + α ) (0,68 ) 2 α2 = 2 , 078 atm · = 1,8 atm 1− α2 1 − (0,68 ) 2 11. En un recipiente cerrado de 400 mL hay 2,032 g de I2 y 1,280 g de Br2. Se eleva la temperatura hasta 150 (C y se alcanza el equilibrio: I2 (g) + Br2 (g) : 2 IBr (g) y la constante de equilibrio KC es 280. Calcula: a) Las concentraciones molares y la presión total en el equilibrio. b) El valor de KP. a) La masa molar del I2 es 253,8 g · mol-1 y la del Br2 159,8 g · mol-1. Por tanto: 2,032 g 1,280 g m m −1 −1 253,8 g · mol −1 M = 159,8 g · mol = 0,020 mol · L−1 [I 2 ] 0 = M = = 0, 020 mol · L y [ Br = ] 2 0 V V 400 · 10 −3 L 400 · 10 −3 L 14 150 : Reacción química I2 (g) + Br2 (g) Relación estequiométrica 1 mol 1 mol 2 mol 0,020 0,020 0 0,020 - x 2x -1 Concentraciones iniciales (mol · L ) -1 Concentraciones en el equilibrio (mol · L ) 0,020 – x KC = 2 IBr (g) [IBr ] 2 (2 x ) 2 = = 280 [I 2 ] · [Br 2 ] (0,020 − x )) · (0,20 − x ) La resolución de dicha ecuación proporciona una ecuación de segundo grado, de la que una solución es negativa (absurda) y la otra es: x = 17,865 · 10-3 mol · L-1. Por tanto: [I2] = [Br2] = 0,020 mol · L-1 – 17,865 · 10-3 mol · L-1 = 2,15 · 10-3 mol · L-1. -3 -1 -3 -1 [IBr] = 2 · 17,865 · 10 mol · L = 35,7 · 10 mol · L Para hallar la presión total en el equilibrio resulta que: n0 I 2 = 2,032 g 1,280 g m m = = 8 · 10 −3 mol y n 0 Br 2 = = = 8 · 10 −3 mol −1 M 253,8 g · mol M 159,8 g · mol −1 Por lo que en el equilibrio la cantidad en mol total es: nT = 8 · 10-3 mol – x + 8 · 10-3 mol – x + 2 x = 0,016 mol Y ahora: p · 0,4 L = 0,016 mol) · 0,082 atm · L · 423 K p = 1,4 atm mol · K b) K P = K C · (R T ) ∆n , como: ∆n = 2 - 2 = 0, entonces: Kp = KC = 280 12. A una determinada temperatura, el producto de solubilidad del Ag3PO4 en agua es 2,8 · 10-18 mol4 · L-4. a) ¿Cuál es su solubilidad en g· L-1? b) ¿Qué cantidad de Ag3PO4 (s) se disolverá en una disolución de AgNO3 de concentración 0,2 molar? a) Ecuación de la reacción para el fosfato Ag3PO4 (s) : 3 Ag+ (aq) + de plata PO43- (aq) Concentraciones en el equilibrio (mol/L) s 3s Kps = [Ag +]3 · [PO 43 -] = (3 s)3 $ s , luego: mol K ps 4 2,8 · 10 - 18 mol 4 / L4 s= = = 1,8 ·10 - 5 27 27 L 4 -1 Como la masa molar del Ag3PO4 es 419 g · mol , entonces: 15 151 -5 -1 -1 -3 -1 s = 1,8 · 10 mol · L · 419 g · mol = 7,5 · 10 g L b) Como el AgNO3 está totalmente disociado: AgNO3 (aq) → Ag+ (aq) + NO3- (aq), resulta que [Ag+] = [AgNO3] = 0,2 mol · L-1. Por lo que ahora se cumple que: Ecuación de la reacción para el fosfato Ag3PO4 (s) : 3 Ag+ (aq) + de plata PO43- (aq) Concentraciones en el equilibrio (mol/L) s +3 3 s + 0,2 3 -1 -1 Kps = [Ag ] · [PO 43 -] = (3 s + 0,2) $ s , pero: (3 s + 0,2) mol · L ≅ 0,2 mol · L , luego: Kps = (0,2 mol · L-1)3 $ s s = 2,8 · 10 −18 mol 4 · L−4 = 3,5 · 10 −16 mol · L−1 −1 3 (0,2 mol · L ) -16 -1 -1 -13 -1 Y también: s = 3,5 · 10 mol · L · 419 g · mol = 1,5 · 10 g L , luego la solubilidad + disminuye mucho debido al efecto del ión común Ag . -12 3 -3 13. El producto de solubilidad del cromato de plata es 1,9 · 10 mol · L . Halla la concentración mínima necesaria para que empiece a precipitar cromato de plata en una disolución de cromato de potasio de concentración 0,005 mol L-1. Como el K2CrO4 está totalmente disociado: K2CrO4 (aq) → 2 K+ (aq) + CrO42- (aq) 2-1 Por lo que resulta que [CrO4 ] = [K2CrO4] = 0,005 mol · L . Entonces: Ecuación de la cromato de plata reacción para + el Ag2CrO4 (s) : 2 Ag (aq) + Concentraciones en el equilibrio (mol/L) 2s CrO42- (aq) s + 0,05 Kps = [Ag +]2 · [CrO 42 -] = (2 s)2 $ (s + 0,05) ≅ (4 s2 · 0,05), por tanto: s= 1,9 · 10 - 12 mol 3 / L3 mol K ps = = 3,01 · 10 - 6 4 · 0,05 mol / L 4 · 0,05 mol / L L Luego: [Ag+] = 2 s = 2 · 3,01 · 10-6 mol · L-1 = 6,02· 10-6 mol · L-1 14. ¿Cuál es la solubilidad del CaF2 en agua pura a 25 (C, si el producto de solubilidad de dicha sal es 3,9 · 10-11 mol3 · L-3? b) ¿Qué masa, en g, de CaCl2 debe añadirse a 100 mL de una disolución 0,0050 mol · L-1 de NaF para que empiece a precipitar CaF2? 16 152 a) 2+ Ecuación de la reacción para el fluoruro CaF2 (s) : de calcio Ca Concentraciones en el equilibrio (mol/L) s 2+ -2 - (aq) + 2 F (aq) 2s 2 Kps = [Ca ] · [F ] = s · (2 s) , por tanto: s=3 3,9 · 10 - 11 mol 3 / L3 mol K ps = = 2,14 · 10 - 4 4 4 L + - b) Como el NaF está totalmente disociado: NaF (aq) → Na (aq) + F (aq), resulta que -1 [F ] = [NaF] = 0,0050 mol · L . Para que empiece a precipitar CaF2 debe cumplirse que: Ecuación de la reacción para el fluoruro CaF2 (s) : de calcio Ca2+ (aq) + 2 F- (aq) Concentraciones en el equilibrio (mol/L) S 2 s + 0,0050 Kps = [Ca2+] · [F-]2 = s · (2 s + 0,0050)2 ≅ s · (0,005)2, por tanto: s = [Ca 2+ ] = 3,9 · 10 −11 mol 3 · L−3 mol = = 1,56 · 10 - 6 2 2 −2 L (0,0050 ) mol · L 2+ Como el CaCl2 está totalmente disociado: CaCl2 (aq) → Ca que tiene que ocurrir que: 2+ -6 - (aq) + 2 Cl (aq), resulta -1 [Ca ] = [CaCl2]= 1,56 · 10 mol · L . La masa molar del CaCl2 es 111 g , luego a 100 mL se debe añadir: mol m 1,56 · 10 −6 g 111 mol mol m = 1,73 · 10-5 g de CaCl = 2 L 0,100 L 15. Para una determinada reacción química 1 se sabe que ∆G1( = 0, para la reacción química 2 resulta ∆G2( < 0 y para la reacción química 3 que ∆G3( > 0. Si K1, K2 y K3 son, respectivamente, las correspondientes constantes de equilibrio termodinámicas de las citadas reacciones químicas. a) ¿Qué se puede afirmar respecto de los valores numéricos de K1, K2 y K3? b) Ordena de mayor a menor K1, K2 y K3. a) ∆G( = - R T ln Keq y aplicándola a los tres casos: ∆G1( = - R T ln K1 = 0 ln K1 = 0 K1 = 1 y en el equilibrio no hay desplazamiento 17 153 ni hacia los reactivos ni hacia los productos de reacción. ∆G2( = - R T ln K2 < 0 ln K 2 = ∆G $ > 0 K2 > 1, la reacción directa es espontánea RT y en el equilibrio predominan los productos de reacción. ∆G3( = - R T ln K3 > 0 ln K 3 = ∆G $ < 0 K3 < 1, la reacción inversa es la RT espontánea y en el equilibrio predominan los reactivos. b) K2 > K1 > K3. 16. A la temperatura de 25 (C, calcule la constante de equilibrio termodinámica + 2+ de la reacción: Mg(OH)2 (s) + 2 H (aq) : Mg (aq) + 2 H2O (l), a partir de las kJ ; siguientes energías libres de Gibbs estándar: ǻGf0[H2O (l)] = - 237,1 mol 2+ + 0 0 0 kJ kJ kJ ǻGf [Mg (aq)] = - 454,8 mol ; ǻGf [Mg(OH)2 (s)] = - 833,5 mol ; ǻGf [H (aq)] = 0 mol ǻG0 = Ȉ νpro · ǻGf0 (productos) – Ȉ νrea · ǻGf0 (reactivos), por lo teniendo en cuenta que: Mg(OH)2 (s) + 2 H+ (aq) : Mg2+ (aq) + 2 H2O (l), resulta: 0 ǻG = 2 mol · (- 237,1 = - 95,5 kJ kJ mol kJ kJ kJ ) + 1 mol · (- 454,8 mol ) - [1 mol · (- 833,5 mol ) + 2 mol · 0 mol ] En el equilibrio, se cumple: ǻG0 = - RT ln Keq, y puesto que: ǻG0 = - 95,5 kJ, y teniendo en cuenta la estequiometría de la reacción también es - 95,5 kJ/mol, pues los cálculos se han realizado por mol de Mg(OH)2 descompuesto. K eq = e- ∆G 0 RT = e- − 95,5 · 10 3 J mol - 1 8,314 J · mol - 1 · K - 1 · 298 K = 5 · 1016 17. En la formación del NOCl (g) según la reacción: 2 NO (g) + Cl2 (g) : 2 NOCl (g), la constante de equilibrio termodinámica es Keq = 103, sabiendo que dicha reacción tiene los siguientes datos termodinámicos: ∆H( ( = - 77,1 kJ · mol-1 y ∆S( ( -1 -1 = - 12,3 J · mol · K , halla la temperatura a la que se verifica dicha reacción de equilibrio. ǻG0 = ∆H( - T · ∆S( = - RT ln Keq T = Luego: T = ∆H $ ∆S $ − R · ln K eq − 77,1 · 10 3 J · mol −1 = 431 K J −1 −1 3 − 12,3 J · mol · K − 8,314 · ln 10 mol · K 18. En la reacción: 2 SO2 (g) + O2 (g) : 2 SO3 (g) la constante de equilibrio 2 termodinámica a 800 K es 9,1 · 10 , halla la temperatura de reacción en la que su 6 constante de equilibrio termodinámica es 10 , admitiendo que en dicho intervalo 5 -1 de temperaturas ∆H( ( = - 1,8 · 10 J · mol . 18 154 Se verifica la siguiente ecuación: ln ln K eq 2 K eq 1 = - ∆H $ 1 1 ( − ) , luego: R T2 T1 − 1,8 · 10 5 J · mol −1 1 9,1 · 10 2 1 = − ) T1 = 637 K ( 6 −1 −1 800 T1 10 8,314 J mol · K 19. El yoduro de hidrógeno se descompone según: 2 HI (g) : H2 (g) + I2 (g). Dentro de un recipiente cerrado hay en equilibrio 0,38 mol de I2 (g), 0,08 mol de H2 (g) y 1,24 mol de HI (g). Se añaden 0,30 mol de H2 (g) y se establece de nuevo el equilibrio. Calcula la cantidad, en mol, de cada gas en el equilibrio que se establece después de dicha adición. 0,08 mol 0,38 mol · [H 2 ] · [I 2 ] V V 2 HI (g) : H2 (g) + I2 (g) y K C = = = 0,02 2 1,24 mol 2 [HI ] ( ) V Ahora, el equilibrio se desplaza a la izquierda, luego: Reacción química 2 HI (g) : H2 (g) + I2 (g) Relación estequiométrica 2 mol 1 mol 1 mol Cantidades iniciales (en mol) 1,24 0,08 + 0,30 0,38 Cantidades en el equilibrio (en mol) 1,24 + 2 x 0,38 - x 0,38 - x 0,38 − x 0,38 − x · V V 0,02 = x = 0,16 mol 1,24 + 2 x 2 ( ) V Por tanto: n H2 = n I2 = 0,38 mol – 0,16 mol = 0,22 mol n HI = 1,24 mol + 2 · 0,16 mol = 1,56 mol 20. El NO2 y el SO2 reaccionan según: NO2 (g) + SO2 (g) : NO (g) + SO3 (g). Una vez alcanzado el equilibrio, la composición de la mezcla contenida en un recipiente de 1 L de capacidad es: 0,6 mol de SO3, 0,4 mol de NO, 0,1 mol de NO2 y 0,8 mol de SO2. Calcula: a) El valor de KP. b) La cantidad, en mol, de NO que habría que añadir al recipiente, en las mismas condiciones, para que la cantidad de NO2 fuera 0,3 mol. a) Como: K P = K C · (R T ) ∆n , y: ∆n = 2 -2 = 0, entonces: KP = KC 19 155 0,4 mol 0,6 mol · [ NO] · [ SO3 ] 1L 1L KC = = =3 [ NO2 ] · [ SO2 ] 0,1 mol 0,8 mol · 1L 1L Por tanto: KP = KC = 3 b) Ahora al añadir x mol/L de NO, el equilibrio se desplaza a la izquierda, luego: Ecuación de la reacción NO2 (g) + SO2 (g) Concentraciones iniciales (mol/L) Concentraciones en el equilibrio (mol/L) 0,1 0,1 + y 0,8 0,8 + y : NO (g) + SO3 (g) 0,4 + x 0,6 0,4 + x - y 0,6 – y Como: [NO2] en el equilibrio es 0,3 mol/L = 0,1 + y y = 0,2 mol/L Luego: (0,4 + x − 0,2) mol (0,6 − 0,2) mol · [ NO] · [ SO3 ] 1L 1L 3= = x = 2,05 mol/L, luego la 0,3 mol (0,8 + 0,2) mol [ NO2 ] · [ SO2 ] · 1L 1L cantidad que hay que añadir de NO al recipiente es 2,05 mol. 21. Basándose en el principio de Le Châtelier, explica cuál de las dos reacciones + siguientes se produce con mayor facilidad en un recipiente abierto: a) 2 H (aq) + CaCO3 (s) : Ca2+ (aq) + CO2 (g) + H2O (l) y b) 2 H+ (aq) + CaSiO3 (s) : Ca2+ (aq) + SiO2 (s) + H2O (l). La a) se desplaza hacia la derecha con mayor facilidad, puesto que se elimina el CO2 g) del sistema. 22. El hidrógeno, bromo y bromuro de hidrógeno, todos ellos en estado gaseoso, se encuentran en un matriz de 1 L y a una temperatura dada, y en equilibrio correspondiente a la reacción: H2 (g) + Br2 (g) : 2 HBr (g); ∆H = - 68 kJ. Indica como afectarían los siguientes cambios a la situación de equilibrio: a) Un aumento de temperatura. b) El aumento de la presión parcial de HBr. c) El aumento del volumen del recipiente. a) H2 (g) + Br2 (g) : 2 HBr (g); ∆H = - 68 kJ es una reacción química reversible exotérmica hacia la derecha. Al aumentar la temperatura se favorece la endotérmica, por tanto el equilibrio se desplaza hacia la izquierda. b) Al aumentar la presión parcial de un componente es como aumentar su concentración, en este caso de [HBr], luego el equilibrio se desplaza hacia la izquierda. c) Los cambios de volumen no afectan al equilibrio, pues en la ecuación química 20 156 desde el punto de vista estequiométrico la variación de los coeficientes estequiométricos es cero. 23. En un recipiente a volumen constante ocurre la reacción: SO2 (g) + ½ O2 (g) : SO3 (g); ∆H = - 49,1 kJ · mol-1 y está en equilibrio. a) Explica tres formas de aumentar la cantidad de SO3. b) Calcula el valor de KP a 900 K para la reacción anterior escrita en la forma en la que estequoiométricamente se obtienen 2 mol -1 de SO3, sabiendo que en este caso KC es 13 L · mol . a) K C = [SO3 ] [SO 2 ] · [O 2 ]1/ 2 y son las siguientes: 1. La reacción directa es exotérmica y si se disminuye la temperatura se favorece la reacción directa o de formación de SO3. 2. Estequiométricamente la cantidad en mol de productos, SO3, es menor que la de reactivos, por lo que interesa reducir el volumen de reacción para favorecer la reacción directa. 3. Aumentar la concentración de cualquiera de los reactivos, por lo que el equilibrio se desplazará hacia la derecha. b) En este caso la ecuación química se escribe en la forma: -1 2 SO2 (g) + O2 (g) : 2 SO3 (g); ∆H = 2 mol · (- 49,1 kJ · mol ) = - 98,2 kJ K P = K C · (R T ) ∆n siendo: K C = [SO3 ] 2 [SO2 ] 2 · [O2 ] ∆n = 2 - (2 + 1) = -1, luego: K P = 13 L · mol −1 · (0,082 atm · L · 900 K ) −1 = 0,176 atm −1 mol · K 24. En un recipiente de 20 L a 25 °C se hallan en equilibrio 0,5 mol de NO2 y 2,14 mol de N2O4 según: 2 NO2 (g) :N2O4 (g). Calcula: KP y KC a esa temperatura. b) La concentración de NO2 cuando se restablezca el equilibrio si se introduce en el recipiente 2 mol de N2O4. c) Qué ocurre con el valor de KC si se introduce en el recipiente de 20 L de capacidad a temperatura constante 2 mol del gas helio. a) Reacción química 2 NO2 (g) : N2O4 (g) Relación estequiométrica 2 mol 1 mol Cantidades en el equilibro inicial (mol) 0,5 2,14 Concentraciones en el equilibrio inicial (en 0,50 mol/L) 20 2,14 20 21 157 2,14 mol [ N 2 O4 ] L KC = = 20 L = 171,2 2 0,50 mol 2 mol [ NO2 ] ( ) 20 L Como: K P = K C · (R T ) ∆n , y ∆n = 1 -2 = - 1, entonces: K P = 171,2 atm · L L · (0,082 · 298 K ) −1 = 7,00 atm −1 mol mol · K b) Al añadir 2 mol de N2O4 el equilibrio se desplaza hacia la izquierda y entonces: Reacción química 2 NO2 (g) : N2O4 (g) Relación estequiométrica 2 mol 1 mol Cantidades iniciales (mol/L) 0,5 2,14 + 2 Cantidades en el nuevo equilibrio (mol) 0,5 + 2 x 4,14 – x 4,14 − x mol [ N 2 O4 ] L 20 L KC = = = 171,2 x = 0,0925 mol, por ser la única 2 0,50 + 2 x mol 2 mol [ NO2 ] ( ) 20 L solución que tiene sentido físico. Por tanto: n de NO2 = 0,5 + 2 · 0,0925 mol = 0,69 mol y [NO2] = 0,69 mol mol = 0,0345 20 L L n N 2 O4 [ N 2 O4 ] n N 2 O4 V c) K C = = = ·V 2 n NO2 2 [ NO2 ] (n NO 2 ) 2 ( ) V El helio es un gas inerte y como la adición transcurre a V = cte, el equilibrio no se altera y tampoco varía la relación molar entre el N2O4 y el NO2. 22 158








