Brugmansia
Anuncio

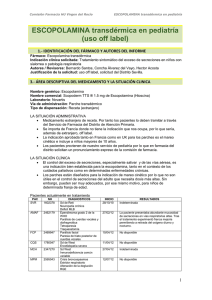
UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS QUÍMICO FARMACÉUTICO BIÓLOGO TRABAJO RECEPCIONAL COMPILACIÓN BIBLIOGRÁFICA Brugmansia spp PRESENTA Miguel Ángel Flores Hernández DIRECTOR DEL TRABAJO RECEPCIONAL M.C. Miriam C. Pastelín Solano ORIZABA, VER. OCTUBRE 2011 Agradecimientos A Dios. Quien es la fuente de mi vida. Que me ha sostenido hasta el final y siempre ha sido fiel. A mi Familia. Papá y Mamá, por su infinito apoyo. Los mejores padres que Dios pudo haberme dado. A mi hermano porque siempre ha estado allí. Los amo entrañablemente. A Vania, Nohemí y Mariana. Porque siempre han tenido una palabra de ánimo en el momento preciso. ¡Las quiero mamis! A Caro. Por su apoyo y amistad incondicional, que a pesar de todo, está allí dispuesta a escuchar. Te quiero. No cabría el espacio para mencionar a mis amigos: Gustavo, Daxtha, Fer, Juan, Jenny, Poncho, Laudett y todos los demás (la lista es larga); porque directa o indirectamente han bendecido y marcado mi vida. Gracias. Resumen La Brugmansia spp, mejor conocida como floripondio, borrachero, trompeta de ángel, cacao sabanero, flor de campana, pertenece a la familia de las solanáceas. Presenta unas hojas muy vistosas, grandes y coloridas; sus frutos son parecidos a los del cacao, de ahí que se le conozca como cacao sabanero. Es una planta silvestre de fácil cultivo, crece en cualquier terreno que cuente con condiciones favorables para su reproducción; se le puede encontrar hasta en terrenos baldíos, sin necesidad de un cuidado especial. Esta planta se ocupa principalmente como planta de ornamento, ya que sus flores están llenas de colores llamativos y hermosos. Existen al menos 8 especies distribuidas principalmente en Centroamérica y Sudamérica. En algunas comunidades de nuestro país se utiliza como una planta medicinal, gracias a su alto contenido de alcaloides, especialmente la escopolamina. Tradicionalmente, la Brugmansia se puede ocupar para aliviar los síntomas de un resfriado común, dolores de cabeza, para desinflamar paperas, contra el asma y dolores reumatoides. Es importante destacar que, por su alto contenido de escopolamina, también es usada con fines ilícitos, como una droga personal, o para drogar a un tercer individuo y atentar contra su salud física y moral. Ya que la escopolamina, alcaloide presente en la Brugmansia, afecta el sistema nervioso central, ejerce un efecto sedante en el organismo de una persona y provoca amnesia, es utilizada altamente como sedante para robar órganos humanos. Sin embargo en la actualidad, existen diversas formas farmacéuticas que contienen escopolamina en baja cantidad para tratar patologías por espasmos gastrointestinales, uterinos, en las vías biliares y urinarias, y en el aparato genital femenino, gracias a su efecto sedante. El estudio de los alcaloides en las plantas es importante, ya que muchos de estos causan intoxicaciones tanto en humanos como en animales; ya que estos se encuentran distribuidos ampliamente en el reino vegetal. Una de las formas más fáciles de intoxicación es el consumo de infusiones con hierbas con fines terapéuticos. ÍNDICE GENERAL Página RESUMEN i ÍNDICE DE FIGURAS iv ÍNDICE DE TABLAS v INTRODUCCIÓN 1 1.1 Objetivos 2 1.1.1 Objetivo General 2 1.1.2 Objetivos Específicos 2 GENERALIDADES DE Brugmansia spp 3 2.1 Características de Brugmansia spp 3 2.2 Clasificación taxonómica 3 2.3 Descripción botánica 4 2.4 Especies de Brugmansia 5 2.5 Importancia económica 10 2.6 Origen y distribución de Brugmansia 12 METABOLISMO CELULAR 13 3.1 Metabolismo primario y secundario 14 3.2 Generalidades y síntesis de alcaloides 19 3.2.1 Clasificación y aplicaciones 22 3.3 Importancia de los alcaloides 25 3.4 Nomenclatura 25 3.5 Alcaloides en Brugmansia spp 25 ESCOPOLAMINA 26 4.1 Producción de escopolamina por cultivo in vitro en raíces 26 4.2 Formulaciones de escopolamina 28 1 2 3 4 4.3 Mecanismos de acción 30 4.4 Farmacocinética 30 4.4.1 Vías de absorción 31 4.4.2 Metabolismo y excreción 31 4.5 Cuadro clínico 31 4.6 Medios de diagnóstico 32 4.7 Diagnóstico diferencial 33 4.8 Interacciones 33 4.9 Análisis clínicos 34 4.10 Reacciones adversas 35 4.11 Sobredosis 36 4.12 Tratamiento 37 5 COMENTARIOS 39 6 REFERENCIAS BIBLIOGRÁFICAS 40 Índice de Figuras Figura Página 1 Brugmansia arbórea (L) Lagerh. 5 2 Brugmansia candida Pers. 6 3 Brugmansia aurea Lagerh. 7 4 Brugmansia sanguínea (Ruiz & Pav.) D. Don. 7 5 Brugmansia suaveolens (Humb & Bonpl. Ex Langer Willd.) Berchit & 8 K. Presl. 6 Brugmansia versicolor 9 7 Brugmansia insignis (Barb. Rodr.) R.E. Schult. 9 8 Brugmansia amesianum (R.E. Schult) D’Arc. 10 9 Elementos básicos del metabolismo primario y en relación con el 16 metabolismo secundario de plantas. 10 Origen de algunos metabolitos secundarios (alcaloides, fenilpropanoides 17 y terpenos) en el metabolismo primario 11 Similitud en la estructura química de prolina y ácido kaurenoico con los 18 ácidos abiótico y pipecólico, ambos productos secundarios. 12 Elementos del metabolismo del carbono en relación con las rutas de 19 síntesis de metabolitos secundarios 13 Estructura química de la heroína 21 14 Estructura química de la escopolamina 21 15 Estructura química de la solanina 22 iv Índice de Tablas Tabla 1 Página Comparación de las principales características del catabolismo y 14 anabolismo 2 Tabla de aplicaciones de alcaloides 24 3 Formulaciones de escopolamina 29 v 1. Introducción La Brugmansia spp es una solanacea conocida comúnmente como borrachero, floripondio, cacao sabanero, trompeta de ángel; estas denominaciones están asociadas a los usos o a la forma de la planta. Sus flores son grandes y vistosas, sus frutos son similares por su forma a los del cacao, viven siempre en lugares despejados y, en huertos y jardines, se considera una planta permitida. Existen al menos ocho especies, distribuidas naturalmente en Centroamérica y especialmente en Sudamérica: B. arbórea, B. candida, B. aurea, B. sanguínea, B. suaveolens, B. versicolor, B. insignis y B. amesianum. A pesar de ser famosa la Brugmansia spp por su composición de alcaloides, la escopolamina comercialmente se extrae de otras especies. Es necesario realizar una revisión de los usos de este grupo de especies, que en algunos casos va desde ornamental, hasta medicinal en forma tópica. La revisión de los aspectos etnobotánicos debe involucrar lo relacionado con cambios genéticos de las poblaciones con los asociados a sus usos, los ambientes donde crece y las formas de dispersión y biota asociadas, lo mismo que la revisión desde la perspectiva médica, farmacológica, biogeográfica y sociojurídica; ya que la planta ha sido usada tanto con fines terapéuticos (aliviar dolores corporales, cólicos intestinales, contra el asma, para aliviar la gripe común, entre otras enfermedades), como con fines ilícitos (sedante, paralizador del sistema nervioso, narcótico y droga). La escopolamina es un alcaloide que se encuentra en las plantas como el beleño (Hyoscyamus albus), la burladora o borrachero (Brugmansia arborea), la mandrágora (Mandragora autumnalis), la escopolia (Scopolia carniolica) y otras plantas similares de la familia de las Solanáceas. La escopolamina es una sustancia afin a la atropina, que se encuentra en la belladona (Atropa belladona). Tiene un efecto anticolinérgico actuando como depresor de las terminaciones nerviosas y del cerebro. La escopolamina es peligrosa ya que a una dosis muy elevada causa convulsiones, taquicardias, colapso cardiaco y hasta la muerte. Por todo lo anterior, el presente trabajo pretende recopilar información bibliográfica de Brugmansia spp. 1 1.1 Objetivos 1.1.1 Objetivo general Recopilar información bibliográfica del cultivo de Brugmansia spp que nos permita conocer la importancia de los alcaloides presentes en ella y sus usos. 1.1.2 Objetivos Específicos. Definir la importancia de la Brugmansia spp y sus diversas especies. Investigar y analizar la importancia de los alcaloides dentro del metabolismo celular de Brugmansia spp. Determinar los usos de la escopolamina en la Brugmansia spp y su función en el organismo humano. 2 2. Generalidades de Brugmansia spp 2.1 Características de Brugmansia spp A las Brugmansia se las conoce como borracheros, denominación relacionada con los usos de la planta que, en general, se asocian con su alto contenido de alcaloides y, en particular, de escopolamina. Es frecuente la intoxicación inducida con fines delictivos, cuando se utiliza con depresores del sistema nervioso central en una mezcla conocida como burundanga (Álvarez, 2008). Las denominaciones de floripondio y trompeta de ángel se asocian con la belleza de sus flores péndulas de colores vistosos. Se le llama también cacao sabanero por sus frutos parecidos a los del cacao y porque se desarrolla generalmente en ambientes despejados, como bordes de caminos, cañadas y bordes de las praderas.[1] Algunas de ellas se han constituido en arvenses, como D. ferox L., que presenta fuertes restricciones, porque su semilla suele mezclarse con cultivos de grano y son fuertemente tóxicas, incluso cuando se elaboran concentrados para animales (Álvarez, 2008). Se le conoce también como campana, flor de campana, floripondio, floripondio blanco, toloache, trombita, tulipán. En Chiapas como: kampana, kampana te (tzeltal/tzotzil), kampana jomol, kampana pox (tzotzil), kampana nichim (tzeltal); en Hidalgo: xochicamapana. En Michoacán: trompetilla (purhépecha); en Morelos: tecomaxochitl (náhuatl), peleguntia; en Puebla: kalapus, tonxui. Y en San Luis Potosí: kampaana huitz (tenek).[2] 2.2 Clasificación taxonómica Inicialmente este grupo se incluyó dentro del género Datura L., del cual se diferencia por las flores péndulas, la condición de plantas arbustivas o arbóreas pequeñas y los frutos no armados e indehiscentes en Brugmansia, mientras que Datura, también rico en escopolamina, es una planta herbácea o subarbustiva, con flores blancas o de color violeta, erectas y frutos armados (Álvarez, 2008). Comúnmente se la conoce como chamico, estramonio, espino del diablo, borrachero, burladora, hierba hedionda, higuera del infierno, con unas ocho especies americanas en su mayoría de Centroamérica y dos del viejo mundo (Fontquer, 2001). 3 El género Brugmansia spp se encuentra clasificada taxonómicamente dentro del reino Plantae; phylum Magnoliophyta; la clase Magnoliopsida; el orden Solanales; y la familia Solanaceae; la subfamilia Solanoideae. 2.3 Descripción botánica Las solanáceas (Solanaceae juss.) son una familia de plantas herbáceas o leñosas con las hojas alternas, simples y sin estípulas pertenecientes al orden Solanales, de las dicotiledóneas (Magnoliopsida). La familia es cosmopolita, distribuyéndose por todo el globo con la excepción de la Antártida. La mayor diversidad de especies se halla en América del Sur y América Central. En esta familia se incluyen especies alimenticias tan importantes como la papa o patata (Solanu tuberosum), el tomate (Solanum lycopersicum), la berenjena (Solanum melongena) y los ajíes o pimientos (Capsicum). Muchas plantas ornamentales muy populares pertenecen a las solanáceas, como Petunia, Schizanthus, Salpiglossis y Datura. Ciertas especies son mundialmente conocidas por sus usos medicinales, sus efectos psicotrópicos o por ser ponzoñosas. Finalmente, pero no menos importante, las solanáceas incluyen muchos organismos modelo para investigar cuestiones biológicas fundamentales a nivel celular, molecular y genético, tales como el tabaco y la petunia (Álvarez, 2008). Las solanáceas comprenden 98 géneros y unas 2700 especies. No obstante, esa inmensa riqueza de especies no está uniformemente distribuida entre todos los géneros. Así, los 8 géneros más importantes de la familia concentran más del 60% de las especies. Brugmansia pers. es un género de plantas perteneciente a la familia Solanaceae, teniendo como especie tipo a Brugmansia candida Pers. y que agrupa al menos ocho especies, distribuidas de manera natural en Centro y Suramérica, especialmente en Venezuela, Colombia, Ecuador y Perú. Este grupo de plantas, dentro de cual se registran al menos nueve nombres específicos, se caracteriza porque sus miembros son bastante ramificados, de madera blanda y de uno a tres metros de altura, con hojas alternas, enteras, generalmente oval-lanceoladas, de 4 a 20 cm de ancho y de 10 a 30 cm de largo, con aroma característico y generalmente con el margen cubierto de pequeños pelitos. (Álvarez, 2008) La flor en general presenta forma de trompeta, pentámera, con cáliz tubular, generalmente de color verde, la corola varía de colores como blanco, anaranjado, amarillo, rosa y rojo, 4 algunas veces con combinaciones de éstos. Además, los lóbulos de la corola presentan prolongaciones, el fruto de color verde es una cápsula bicarpelar, con cáliz persistente y semillas de color negro o café oscuro, embebidas en un mesocarpo fibroso del mismo color.[1] 2.4 Especies de Brugmansia Brugmansia arborea (L.) Lagerh. (Figura 1) Es una de las especies más comunes en Colombia, con registros en Venezuela, Ecuador, Perú y Bolivia, donde ha sido realizado el mayor número de colectas. Respecto a su nomenclatura, Brugmansia arborea (L.) Lagerh es el nombre aceptado para nuestro borrachero, sinónimo de Datura arborea L. Por otra parte, Brugmansia candida Pers. tiene como sinónimo Brugmansia arborea (L.) Steud., lo cual puede causar confusiones en el uso de la bibliografía. Por esta razón, es necesario siempre tener en cuenta la autoridad botánica asociada al nombre, como también la descripción de la planta. Esta planta se distingue por sus flores blancas grandes, de hasta 20 cm de largo, con prolongaciones caudiculares en la corola de hasta 5 cm y fruto ovalado.[1] Es un arbusto de 2 a 5 metros de altura, perennifolio, originario de América del Sur y que se cultiva en regiones subtropicales y templadas de México (Niembro, 1986). Figura 1. Brugmansia arbórea (L) Lagerh 5 Brugmansia candida Pers. (Figura 2) Con amplia distribución mundial, que se encuentra enunciado también como Brugmansia candida Pers., cuenta con registros en Costa Rica, El Salvador, Guatemala, Honduras, México, Panamá, Colombia, Ecuador, Perú, Venezuela, Archipiélago de Bahamas y Madagascar. En México se le encuentra en el estado de Oaxaca, a una elevación de 900m. sobre el nivel del mar.[12] Cuenta con sinónimos como Brugmansia arborea (L.) Steud., Datura arborea L. y Datura candida (Pers.) Safford; se diferencia por sus flores péndulas de hasta 30 cm de largo, con colores que van desde el blanco hasta el amarillo y el rosado, con prolongaciones de la corola de hasta 6 cm de longitud, su fruto es ovoide o fusiforme (Álvarez, 2008). Figura 2. Brugmansia candida Pers. Brugmansia aurea Lagerh. (Figura 3) Tiene como sinónimos Datura affinis Saff., Brugmansia affinis (Saff.) Moldenke y Datura aurea (Lagerh.) Saff. Se distingue por sus flores blancas o amarillo-doradas; las flores más pequeñas, de 4 a 8 cm de largo, tienen anteras libres. Se ha registrado en Colombia, Ecuador, Perú y Venezuela..[1] 6 Figura 3. Brugmansia aurea Lagerh Brugmansia sanguinea (Ruiz & Pav.) D. Don. (Figura 4) Con sus flores tubulares, amarillas o verde amarillentas en la base, que se tornan rojas hacia el extremo abierto de la corola, con las prolongaciones de la corola más cortas que las anteriores, ha sido también denominada Datura sanguinea Ruiz & Pav. y Brugmansia bicolor Pers., las cuales se han establecido como sinónimos del primer nombre (Álvarez, 2008). Contiene alcaloides tropánicos. Las hojas contienen alrededor de un 0.8% de alcaloides totales, el mayoritario es la escopolamina (Lagerheim, 1895). Figura 4. Brugmansia sanguínea (Ruiz & Pav.) D. Don Brugmansia suaveolens (Humb. & Bonpl. ex Willd.) Bercht. & K. Presl. (Figura 5) Tiene como sinónimos los nombres Datura suaveolens (Humb. & Bonpl. ex Willd.), Brugmansia 7 suaveolens (Willd.) Bercht. & C. Presl, y Datura suaveolens (Willd). También de flores grandes, que pueden alcanzar hasta 35 cm de longitud, las prolongaciones de los lóbulos de la corola están entre 1 y 3 cm; con anteras basifijas, la corola es de color salmón o rosado hacia los bordes y amarilla hacia la base del tubo. Es una especie de amplia distribución, con registro en Costa Rica, El Salvador, Honduras, México, Nicaragua, Panamá, Argentina, Bolivia, Brasil, Colombia, Ecuador, Guyana, Paraguay, Perú, Venezuela, Cuba, República Dominicana, Haití, Jamaica, Islas Leeward, Puerto Rico y Madagascar (Álvarez, 2008). Figura 5. Brugmansia suaveolens (Humb. & Bonpl. Ex Lager Willd.) Bercht. & K. Presl. Brugmansia versicolor Lagerh. (Figura 6) Posee flores generalmente muy grandes, de hasta 50 cm de longitud, de color inicialmente blanco que en posantesis se torna salmón o rosado, el tubo de la corola es muy estrecho hacia la base y se ensancha bruscamente a partir del primer tercio, hasta conformar la copa abierta en la cual cada uno de los lóbulos termina en una prolongación de hasta 5 cm. (Álvarez, 2008). El nombre Brugmansia versicolor Lagerh, registrado en Colombia, Ecuador y Perú, corresponde a un arbusto que puede crecer hasta 5 m, con flores de hasta 50 cm de largo, inicialmente blancas, que se tornan luego de color salmón, rosado y durazno, cambio que al parecer se asocia con la antesis; por su parte, la corola se estrecha notablemente en el área cercana al cáliz, cuyo tubo no se ajusta a la primera (Álvarez, 2008). Brugmansia versicolor Lagerh tiene como sinónimos Datura versicolor (Lagerh.) Saff., Brugmansia dolichocarpa Lagerh., Datura mollis Saff. y Lycium andersonii A. Gray.[1] 8 Figura 6. Brugmansia versicolor Brugmansia insignis (Barb. Rodr.) R.E. Schult. (Figura 7) Se diferencia por su cáliz rizado, con la corola de hasta de 40 cm de largo, de color blanco o rosado, estambres con anteras libres o unidas. Ha sido registrada en la zona de frontera colombo-ecuatoriana y en Perú (Álvarez, 2008). Figura 7. Brugmansia insignis (Barb. Rodr.) R.E. Schult. Brugmansia amesianum (R.E. Schult.) D’Arc. (Figura 8) Inicialmente el ejemplar colectado por Shultes y Cabrera en 1953, fue denominado Methysticodendron amesianum R.E. Schult., nombre que fue llevado en 1986 a la categoría de sinónimo.[1] 9 Figura 8. Brugmansia amesianum (R.E. Schult.) D’Arc, 2.5 Importancia Económica Varias especies arbóreas o arbustivas de solanáceas se cultivan como ornamentales. Algunos ejemplos son Brugmansia x candida (trompeta del ángel), cultivada por sus grandes flores péndulas con forma de trompeta, Brunfelsia latifolia, cuyas flores muy fragantes cambian de color desde el violeta al blanco en un período de 3 días. Otras especies arbustivas cultivadas por sus atractivas flores son Lycianthes rantonnetii (jazmín del Paraguay) de flores azul-violeta, Nicotiana glauca (tabaco silvestre) de flores amarillas. Otras especies y géneros ornamentales de solanáceas son la petunia (Petunia × hybrida), Lycium, Solanum, Cestrum, Calibrachoa × hybriday Solandra. Inclusive se ha obtenido un híbrido entre Petunia y Calibrachoa (el cual constituye un nuevo notogénero denominado por Petchoa G. Boker & J. Shaw) que se comercializa como ornamental. Muchas otras especies, en particular las que producen alcaloides, se utilizan en farmacología y medicina (Nicotiana, Hyoscyamus, y Datura) (Álvarez, 2008). Por otra parte, existen muchas formas de aprovechamiento de la Brugmansia, pues se emplean como plantas ornamentales, gracias a la abundante y casi permanente floración de varias de las especies del grupo, y como plantas medicinales por parte de las diversas comunidades; así, por ejemplo, se hacen emplastos para las várices y baños para limpiar llagas. Estas plantas, por lo general más que cultivadas, están permitidas y de alguna manera llegan a los huertos y antejardines, o se encuentran silvestres en los bordes de los 10 bosques, a la vereda de los caminos o de las corrientes hídricas, en los más diversos ambientes.[1] El principal uso que se le da a Brugmansia arbórea es como planta de ornato en parques y jardines por la belleza de sus flores blancas. Contiene atropina, un alcaloide venenoso que actúa en el sistema nervioso, el corazón, los pulmones, los ojos y el tracto digestivo (Niembro, 1986). Las hojas del floripondio se utilizan vulgarmente para combatir los dolores, sobre todo los cólicos intestinales. Las hojas también se usan como emolientes aplicadas en cataplasmas (Niembro, 1986). En los estados de Chiapas, Puebla y Veracruz es común el uso de ésta planta para quitar el dolor corporal.[2] Se le emplea también contra diversos padecimientos en los que se hace uso de la hoja. Cuando se tiene dolor de cabeza, se aplican en las sienes, cataplasmas pequeños de hojas frescas untadas con ungüento o grasa, o se pone la hoja o la mitad de la flor en alcohol, para dar friegas con esta mezcla en el momento del dolor. Para aliviar las postemillas o úlceras de las encías, se cuecen las hojas y machacadas se aplican en la parte afectada. Para desinflamar las paperas (nombre que se le da a la parotiditis, enfermedad contagiosa que consiste en la inflamación de las glándulas parótidas) se usan las hojas solas o asadas ligeramente en aceite, se aplican tópicamente.[2] Contra el asma (respiración fatigosa, acelerada y superficial debida a la contracción de los músculos bronquiales), se fuman las hojas. Para aliviar la tos, se hace un tamalito con las hojas, éste se asa ligeramente y se coloca en el pecho y la espalda, lo más caliente posible. Para curar el catarro se ingiere el cocimiento elaborado con floripondio, ocote (Pinus sp.) y canela (Cinnamomum zeylanicum); si el catarro es constipado, entonces en una hoja de floripondio se colocan otras hojas de venenillo (Asclepias curassavica L.) al que se agrega aceite de almendras, ya envueltas como tamal se asan en el comal; cuando está caliente se caldean la frente y la nariz y se aplica una gota del jugo de las hojas en cada fosa nasal. Para curar los bronquios se untan en la espalda las flores maceradas, esta afección se presenta en personas que andan descalzas, que salieron calientes al aire, o por mojarse los pies y la espalda con agua de lluvia, lo cual trae como consecuencia un dolor que atraviesa del pecho a la espalda, dolor de garganta y tos.[2] 11 Diversos híbridos y numerosos cultivares se han desarrollado para su uso como ornamentales. B x candida es un híbrido entre B. aurea y B. versicolor; B. x flava resulta de B. arbórea y B. sanguínea, y B. x cubensis es el resultado de tres especies: B. suaveolens, B. versicolor y B. aurea (Van de Donck, et al., 2004) También existen cultivares con flores dobles y algunos con hojas variegadas (Van der Donck, et al., 2004). 2.6 Origen y distribución de la Brugmansia. La mayoría de las especies de Brugmansia tienen su hábitat en zonas húmedas o secas, en alturas entre 1.500 y 3.200 msnm.[1] La Brugmansia candida Pers. es originaria de Ecuador, Chile y Perú. Habita en climas cálido, semicálido y templado entre los 200 y los 2600msnm.[2] La Brugmansia candida Pers es originaria de Perú; Brugmansia x candida Pers es originaria de Ecuador, es un híbrido entre B. aurea Lagerh y B. versicolor Lagerh; la Brugmansia versicolor es originaria de Ecuador.[11] El género crece fácilmente en climas sin heladas, sobre suelos húmedos y fértiles bien drenados, a pleno sol o a media sombra. La floración comienza a mediados o finales de la primavera en climas cálidos y continúa hasta el otoño, a menudo se puede alargar hasta principios del invierno en condiciones cálidas. En inviernos fríos, las plantas cultivadas a la intemperie pueden necesitar protección pero la raíz es resistente y rebrotará en primavera. Las especies de regiones altas, como B. Sphaerocarpium, prefieren temperaturas moderadas y noches frescas, y pueden no florecer si las temperaturas son muy elevadas. La propagación de la mayoría de las especies se logra fácilmente por cortes de esqueje de 10 a 20 cm tomados del final de una rama y sembrándolos durante el verano (Van der Donck, et al., 2004). 12 3. Metabolismo Celular El metabolismo celular puede definirse como la suma de todas las reacciones químicas que ocurren en el organismo viviente. Por tanto, el metabolismo es un tema muy amplio: tan sólo el número de reacciones es pasmoso, pues los diferentes organismos, según su complejidad, se caracterizan por poseer de cientos a miles de ellas. En forma colectiva, tales reacciones se encargan de mantener la viabilidad del organismo (Bohinski, 1991). El metabolismo, entonces, es el conjunto de todas las reacciones químicas que se producen en el interior de las células de un organismo. Mediante esas reacciones se transforman las moléculas nutritivas que, digeridas y transportadas por la sangre, llegan a ellas.[3] Aunque cada reacción es importante en sí misma, el funcionamiento del organismo entero se debe a la integración de las reacciones individuales para formar una compleja maraña, controlada por una hueste de sensibles mecanismo regulatorios de verificación y equilibrio. En general, el mantenimiento y el control de esta organización preserva el metabolismo normal, mientras que su alteración se traduce en un metabolismo anormal (Bohinski, 1991). El metabolismo tiene principalmente dos finalidades: 1) obtener energía química utilizable por la célula, que se almacena en forma de ATP (adenosín trifostato). Esta energía se obtiene por degradación de los nutrientes que se toman directamente del exterior o bien por degradación de otros compuestos que se han fabricado con esos nutrientes y que se almacenan como reserva, y 2) fabricar sus propios compuestos a partir de los nutrientes, que serán utilizados para crear sus estructuras o para almacenarlos como reserva.[3] El metabolismo se divide en catabolismo y anabolismo. Catabolismo (del griego katá, “abajo”) se refiere a las secuencias de reacciones de degradación; anabolismo (del griego aná, “arriba”) se refiere a las secuencias de reacciones sintéticas. El término vía se utiliza por lo común para indicar una serie de reacciones consecutivas que efectúan una conversión global específica. Por ejemplo, la secuencia consecutiva de A B C D E F G tiene el mismo efecto neto que A G. las sustancias que se producen en la vía (B, C, D, E, y F) se denominan intermediarios metabólicos (Bohinski, 1991). Clasificarlas según su función de degradación o de síntesis no es la única manera de distinguir las reacciones que ocurren en una célula viva. En la tabla 1 se presentan otras formas de compararlas en términos de sus efectos de reducción o de oxidación, de la 13 energética de la secuencia de reacciones, y de la naturaleza de los materiales iniciales y los productos finales (Bohinski, 1991). Tabla 1. Comparación de las principales características del catabolismo y anabolismo. Catabolismo Anabolismo Degradante Sintético Generador de energía De índole reductora Variedad de materiales iniciales, pero Materiales iniciales bien definidos y productos finales bien definidos variedad en los productos finales Aunque las vías catabólica y anabólica son distintas en esos aspectos, se parecen mucho entre sí. Más aún, las relaciones se dan en términos de las propias características que constituyen sus diferencias. Es decir: Respecto a la oxidación y la reducción: no todos los pasos de una vía catabólica implican la oxidación de un intermediario metabólico; ni tampoco todos los pasos de una vía anabólica consisten en la reducción de un intermediario. Sin embargo, en las reacciones que se caracterizan de ese modo, las coenzimas de nicotinamida adenindinucleótido son participantes comunes. De manera más específica, en el catabolismo se usan las formas oxidadas (NAD+ y NADP+) y se producen las reducidas (NADH y NADPH), mientras que en el anabolismo se necesitan las formas reducidas y se producen las oxidadas. La variante de este esquema consiste en que las reacciones anabólicas utilizan sobre todo NADPH para producir NADP+. No obstante, la participación general de los nicotinamida adenindinucleótidos en ambos procesos es un denominador común muy claro (Cunningham, 1978). Respecto a la energética: el catabolismo es exergónico (generador de energía), de modo que tiene una necesidad neta de ADP y una producción neta de ATP. Luego el ATP, sirve como fuente de energía para las reacciones endergónicas (consumidoras de energía) del anabolismo, con formación de ADP (Cunningham, 1978). 14 Respecto a los materiales iniciales, los productos finales y los metabolitos intermediarios: los productos finales y los metabolitos intermediarios que se generan en el catabolismo sirven, por lo general, como materiales iniciales en el anabolismo. También puede decirse lo contrario (Cunningham, 1978). Así, puede afirmarse que el catabolismo y anabolismo son procesos complementarios integrados. Estas relaciones permiten lograr un nivel óptimo de eficiencia metabólica en los organismos (Cunningham, 1978). 3.1 Metabolismo Primario y Secundario. Las plantas poseen rutas metabólicas por las cuales sintetizan y utilizan ciertos compuestos orgánicos: azúcares, aminoácidos, ácidos grasos comunes, nucleótidos y polímeros derivados de ellos (polisacáridos, proteínas, lípidos, DNA, RNA, etc). Estas rutas constituyen su metabolismo primario, y los compuestos indicados, esenciales para la supervivencia de los organismos vegetales, son los metabolitos primarios (Azcon y Talon, 1993). Se denominan metabolitos primarios a la mayor parte del carbono, del nitrógeno y de la energía que termina en moléculas comunes a todas las células, necesarias para su funcionamiento y el de los organismos. Se trata de aminoácidos, nucleótidos, azúcares y lípidos, presentes en todas las plantas y desempeñando las mismas funciones. (Figura 9) (Ávalos y Pérez-Urria, 2009). 15 Figura 9. Elementos básicos del metabolismo primario y en relación con el metabolismo secundario de plantas. Además de las rutas del metabolismo primario, idénticas o similares en todos los organismos vivos, las plantas pueden seguir otras rutas metabólicas que lleven a la formación de compuestos usualmente peculiares de un grupo taxonómico determinado (especie, género, familia o grupo estrechamente relacionado de familias). Estas rutas constituyen el metabolismo secundario y sus productos se denominan metabolitos secundarios. La biosíntesis de estos compuestos suele estar restringida a estados específicos del desarrollo, respectivamente del organismo y de células especializadas, y a períodos de estrés causados por la deficiencia de nutrientes o el ataque por microorganismos. Este fenómeno se debe a la formación, dependiente de fase, de la correspondiente enzima, lo que significa que la expresión del metabolismo secundario se basa en un proceso de diferenciación (Azcon y Talon, 1993). 16 A diferencia de otros organismos, las plantas destinan una cantidad significativa del carbono asimilado y de la energía a la síntesis de una amplia variedad de moléculas orgánicas que no parecen tener una función directa en procesos fotosintéticos, respiratorios, asimilación de nutrientes, transporte de solutos o síntesis de proteínas, carbohidratos o lípidos, y que se denominan metabolitos secundarios (también denominados productos secundarios, productos naturales) (Figura 10).[5] Figura 10. Origen de algunos metabolitos secundarios (alcaloides, fenilpropanoides y terpenos) en el metabolismo primario. Los metabolitos secundarios además de no presentar una función definida en los procesos mencionados, difieren también de los metabolitos primarios en que ciertos grupos presentan una distribución restringida en el reino vegetal, es decir, no todos los metabolitos secundarios se encuentran en todos los grupos de plantas. Se sintetizan en pequeñas cantidades y no de forma generalizada, estando a menudo su producción restringida a un determinado género de plantas, a una familia, o incluso a algunas especies (Segler, 2001). Algunos productos del metabolismo secundario tienen funciones ecológicas específicas como atrayentes o repelentes de animales. Muchos son pigmentos que proporcionan color a 17 flores y frutos, jugando un papel esencial en la reproducción atrayendo a insectos polinizadores, o atrayendo a animales que van a utilizar los frutos como fuente de alimento, contribuyendo de esta forma a la dispersión de semillas (Ávalos y Pérez-Urria, 2009). Otros compuestos tienen función protectora frente a predadores, actuando como repelentes, proporcionando a la planta sabores amargos, haciéndolas indigestas o venenosas. También intervienen en los mecanismos de defensa de las plantas frente a diferentes patógenos, actuando como pesticidas naturales.[4] La estructura química entre unos y otros a veces es muy parecida. Es el caso del ácido kaurenoico y la prolina, metabolitos primarios, mientras que los ácidos abiético y pipecólico, compuestos muy relacionados estructuralmente con ellos, son metabolitos secundarios (Figura 11) (Ávalos y Pérez-Urria, 2009). Figura 11. Similitud en la estructura química de prolina y ácido kaurenoico con los ácidos abiótico y pipecólico, ambos productos secundarios. Por otro lado, la distinción entre ambos tipos es difusa en ocasiones si tenemos en cuenta que la biosíntesis de muchos de ellos comparten numerosos intermediarios que derivan de 18 las mismas rutas metabólicas. Por lo tanto, la diferenciación entre metabolitos primarios y secundarios puede no ser del todo adecuada (Ávalos y Pérez-Urria, 2009). Las principales rutas de biosíntesis de metabolitos secundarios derivan del metabolismo primario del carbono (Figura 12). [4] Figura 12. Elementos del metabolismo del carbono en relación con las rutas de metabolitos secundarios. Es importante destacar que también reciben la denominación de productos naturales y tienen un importante y significativo valor medicinal y económico, derivado éste último de su uso en la industria cosmética, alimentaria, farmacéutica. Un gran número de estos productos naturales, que ya se usaban en la medicina antigua como remedios para combatir enfermedades, se utilizan en la actualidad como medicamentos, resinas, gomas, potenciadores de sabor, aromas, colorantes, etc.[4] 19 Según Ávalos y Pérez-Urria (2009), los alcaloides se agrupan en cuatro clases principales: Terpenos. Entre los que se encuentran hormonas, pigmentos o aceites esenciales. Compuestos fenólicos. Cumarinas, flavonoides, lignina y taninos. Glicósidos. Saponinas, glicósidos cardiacos, glicósidos cianogénicos y glucosinolatos. Alcaloides. 3.2 Generalidades y síntesis de Alcaloides. Los alcaloides son una gran familia de más de 15.000 metabolitos secundarios que tienen en común tres características: son solubles en agua, contienen al menos un átomo de nitrógeno en la molécula, y exhiben actividad biológica. La mayoría son heterocíclicos aunque algunos son compuestos nitrogenados alifáticos (no cíclicos) como la mescalina o la colchicina, por ejemplo. Se encuentran en el 20% aproximadamente de las plantas vasculares, la mayoría dicotiledóneas herbáceas.[4] Muchos alcaloides, pero no todos, tienen importancia farmacológica, lo que ha servido de incentivo para su estudio químico-biológico. Hasta el momento se han aislado unos 10,000 alcaloides de las plantas y se ha determinado su estructura utilizando la clásica degradación química y las modernas técnicas analíticas (espectrometría de masas, resonancia magnética nuclear, cristalografía de rayos X) (Azcon y Talon, 1993). Contienen nitrógeno, por lo general derivan de un aminoácido. Son de sabor amargo, sólidos generalmente de color blanco (a excepción de la nicotina, que es un líquido de color marrón). Dan un precipitado con yoduros de metales pesados.[6] La mayoría de los alcaloides se precipitan de una solución neutra o ligeramente ácida por el reactivo de Mayer, dando un precipitado color crema. El reactivo de Dragendorff da un precipitado de color naranja en los alcaloides.[6] A los valores normales de pH del citosol (7.2) y de la vacuola (de 5 a 6), el nitrógeno está protonado lo cual confiere el carácter básico o alcalino de estos compuestos en solución. [6] En humanos, los alcaloides generan respuestas fisiológicas y psicológicas la mayoría de ellas consecuencia de su interacción con neurotransmisores. A dosis altas, casi todos los alcaloides son muy tóxicos. Sin embargo, a dosis bajas tienen un alto valor terapéutico como relajantes musculares, tranquilizantes, antitusivos o analgésicos. [6] 20 Se sintetizan normalmente a partir de lisina, tirosina y triptófano, aunque algunos como la nicotina y compuestos relacionados derivan de la ornitina (Ávalos y Pérez-Urria, 2009). El opio es quizá uno de los primeros alcaloides conocidos, el exudado (látex) de la cápsula inmadura de Papaver somniferon. Este exudado contiene una mezcla de más de 20 alcaloides diferentes entre los que se encuentran la morfina y la codeína. Ambos alcaloides pertenecen a un grupo denominado alcaloides isoquinolínicos que sintetizan a partir de la reticulina.[4] La heroína es un alcaloide semisintético formado por acetilación de la morfina (Figura 13) (Kuklinski, 2000). Figura 13. Estructura química de la heroína Algunas solanáceas (los géneros Datura, Hyoscyamus, Atropa y Brugmansia spp) contienen alcaloides tóxicos como la escopolamina (Figura 14) presente en Datura stramonium y Brugmansia candida Pers. (floripondio) o la atropina de Hyoscyamus niger (Tabla 1) (Ávalos y Pérez-Urria, 2009). Figura 14. Estructura química de la escopolamina La patata contiene el alcaloide solanina (Figura 15), un inhibidor de colinesterasa que interfiere en la transmisión nerviosa. Los tubérculos sometidos a alta intensidad de luz pueden llegar a sintetizar niveles tóxicos de solanina (Kuklinski, 2000). 21 Figura 15. Estructura química de la solanina. En la biosíntesis de los alcaloides se han reconocido tres tipos generales de reacción que determinan su estructura principal: 1) la formación de bases de Schiff; 2) la reacción de Mannich, y 3) el acoplamiento oxidativo de los fenoles. Debido a la significación de estas reacciones para el estudio de la biosíntesis de los alcaloides, se consideran seguidamente: Formación de bases de Schiff. Los compuestos con grupos amino primarios, a veces, pueden reaccionar de manera espontánea con el grupo carbonilo de un aldehído o una cetona para formar bases de Schiff. Reacción de Mannich. En una reacción tipo Mannich, una amina primaria o secundaria y un aldehído (probablemente por medio de una base de Schiff), reaccionan con un compuesto que puede originar un carbanión. Acoplamiento oxidativo de fenoles. Por la actuación de agentes oxidantes, el hidrógeno del grupo hidroxilo de un fenol se separa fácilmente, originando así radicales fenolato libres muy reactivos (Schütte, 1986). 3.2.1 Clasificación y aplicaciones. Según Azcon Bieto y Talon (1993), los alcaloides se dividen en 3 grupos: 1) alcaloides derivados de ornitina y lisina, 2) alcaloides derivados de fenilalanina y tirosina y 3) alcaloides biosintetizados de triptófano, indólicos y derivados. Alcaloides derivados de ortinina y lisina. 1) Alcaloides tropánicos: Se caracterizan por poseer el sistema anillado bicíclico. Se conocen más de 150 alcaloides tropánicos. Ejemplos de alcaloides tropánicos son la hiosciamina, la escopolamina, usadas en medicina como anticolinérgicos; la atropina y la cocaína. 2) Alcaloides de Nicotiana. Los alcaloides más importantes de Nicotiana son la nicotina, la nornicotina y la abasina. Los dos primeros son 22 los principales alcaloides de N. tabacum, y la abasina de N. glauca. Son piridinas 3sustituidas enlazadas, respectivamente, a un anillo de piridina. 3) Alcaloides de quinolizidina. Poseen uno o dos sistemas de quinolizidina. Se encuentran particularmente en especies del género Lupinus. Los alcaloides más representativos de este grupo son la lupinina y la esparteína. Esta última es utilizada en medicina como antiarrítmico. Alcaloides derivados de fenilalanina y tirosina. 1) Alcaloides de bencilisoquinolina. El aminoácido L-tirosina es el material de partida para la biosíntesis de los alcaloides de bencilisoquinolina. Entre ellos se encuentran los principales alcaloides del género Papaver. 2) Alcaloides de las Amaryllidaceae. La L-tirosina y la L-fenilalanina con los precursores de los alcaloides característicos de la familia Amaryllidaceae. Experimentos han demostrado que la o-metil-norbelladina es, a su vez, un precursor común de estos alcaloides. Alcaloides biosintetizados de triptófano. Alcaloides indólicos y derivados. 1) Alcaloides indólicos simples. Se ha demostrado la incorporación de L-triptófano marcado radiactivamente en alcaloides indólicos de estructura simple. Estos alcaloides difieren principalmente en la posición de hidroxilación y en las modificaciones químicas de la cadena lateral. El alcaloide fisostigmina de las habas del Calabar (Physostigma venenosum), es representativo de esta clase de alcaloides indólicos. 2) Alcaloides indólicos complejos. Muchos alcaloides incorporan en su estructura una unidad derivada del Ltriptófano y otra derivada del ácido mevalónico. Entre ellos, figuran los alcaloides del cornezuelo y de Catharantus, y compuestos como la estricnina de especies del género Strychnos y la quinina, presente en especies de Chinchona. A continuación se muestra un resumen de las aplicaciones de algunos alcaloides (Tabla 2) (Bruneton, 2001). 23 Tabla 2. Aplicaciones de alcaloides Alcaloide Planta Uso Ajmalina Rauwolfia serpentina Antiarrítmico, inhibidor captura de glucosa por la mitocondria del tejido cardiaco Atropina Hyoscyamus niger Anticolinérgico, antídoto del gas nervioso Cafeína Coffea arabica Estimulante del sistema nerviosos central Camptotecina Camptotheca acuminata Agente anticanceroso Cocaína Erythroxylon coca Anestésico tópico, estimulante del sistema nervioso central, bloqueante adrenérgico, droga de abuso Codeína Papaver somniferum Analgésico y antitusivo Coiína Conium maculatum Parálisis del sistema nervioso motor Emetina Uragoga ipecacuanhua Emético Morfina Papaver somniferum Analgésico, narcótico, droga de abuso Nicotina Nicotiana tabacum Tóxico, insecticida en horticultura, droga de abuso Pilocarpina Pilocarpus jaborandi Estimulante del sistema parasimpático Quinina Cinchona officinalis Tratamiento de la malaria Sanguinarina Eschscholzia califórnica Antibacteriano (dentríficos) Escopolamina Hyoscyamus niger Brugmansia candida Pers. Narcótico, sedante Estricnina Strychnos nux-vomica Veneno Vinblastina Catharanthus roseus Antineoplásico 24 3.3 Importancia de los alcaloides. Sus actividades biológicas son importantes por su mimetismo hormonal y su intervención en las reacciones principales del metabolismo celular. A pesar de ser sustancias poco similares entre ellas desde el punto de vista estructural, poseen propiedades fisiológicas análogas (Kuklinski, 2000). Estos compuestos están ampliamente distribuidos en el reino vegetal (25% de las plantas contienen alcaloides) y en algunas especies su concentración puede alcanzar el 10%. Muchos alcaloides son la causa de intoxicaciones en humanos y animales. La forma más común es la intoxicación por infusiones con hierbas con fines medicinales, siendo esta una causa importante de muerte sobre todo en niños (Kuklinski, 2000). Su presencia en vegetales hace posible su incorporación accidental en alimentos, creando una vía fácil de intoxicación (Kuklinski, 2000). 3.4 Nomenclatura. No existe una sistematización. Tiene una terminación en “-ina”. Son denominados siguiendo algunos criterios: De acuerdo a la especie que los contiene. De acuerdo al nombre vulgar de la especie que produce. De acuerdo al género a partir del cual se ha obtenido. De acuerdo a la actividad farmacológica. Raramente se le da el nombre de algún investigador. [7] 3.5 Alcaloides en Brugmansia spp. La Brugmansia spp es más conocida mundialmente por la presencia de alcaloides tropánicos, como atropina y especialmente escopolamina, en cantidades y calidades variables y aún por caracterizar adecuadamente, por lo cual sus efectos en la mayoría de los casos son impredecibles de manera precisa, pudiendo ser fatales (Álvarez, 2008). 25 4. Escopolamina La escopolamina es un alcaloide común en numerosas especies de la familia Solanaceae, la cual reúne más de 2.800 especies cercanas a los 85 géneros, muchos de los cuales podrían contener este alcaloide. Entre ellas, de la flora colombiana, además de Brugmansia y Datura, son candidatas para estudios detallados varias especies de Solanum, Cestrum y Brunfelsia, entre otras. La fuente más antigua de escopolanima registrada es el Beleño negro o Hyoscyamus níger L., empleado en la antigüedad y en la Edad Media como ingrediente de brebajes y ungüentos de hechiceros. Actualmente, el Beleño negro sigue siendo la fuente de escopolamina más empleada por las empresas farmacológicas, además, al parecer, es posible obtenerla de manera sintética (Álvarez, 2008). Es un alcaloide cuaternario que actúa como antagonista competitivo de la acetilcolina en los receptores muscarínicos. Es soluble en agua y entra al organismo por vía oral con rápida absorción. Es un antagonista competido de la acetilcolina en la terminal posganglionar del sistema nervioso parasimpático. No tiene ningún efecto sobre los receptores nicotínicos. Cruza la barrera hematoencefálica, por lo cual puede producir manifestaciones del sistema nervioso central (Bruneton, 2000). El efecto de esta sustancia es bastante marcado en el músculo liso del sistema gastrointestinal. Los síntomas ocurren entre los 30 y los 60 minutos después de la ingesta y pueden continuar por 24 ó 48 horas, debido a que la escopolamina retarda el vaciamiento gástrico. Tales incluyen: mucosas y piel secas, disfagia, fotofobia, visión borrosa, taquicardia, retención urinaria. También puede encontrarse hipertermia, confusión, agitación, convulsiones y coma. Es común la amnesia de los eventos sucedidos después de la ingesta de la escopolamina.[1] 4.1 Producción de escopolamina por cultivo in vitro en raíces. En el caso particular de este alcaloide, es importante mencionar que los sitios de síntesis y acumulación de la escopolamina varían dependiendo de factores como: el tipo de especies usadas, el material vegetal disponible para la extracción (hojas, segmentos de tallo, raíces, células, etc.), edad del material vegetal, tipo de cultivo (agronómico, in vitro), entre otros.[10] 26 Puesto que este alcaloide es sintetizado en las raíces de especies como la Brugmansia candida, se han desarrollo estudios sobre su producción tratando de obtener líneas altamente productoras de escopolamina. Los cultivos de tejidos diferenciados de algunas Solanaceae producen escopolamina en concentraciones similares, o, mayores que en otros órganos de la planta completa.[10] Sin embargo, el cultivo in vitro de raíces convencional, presenta algunas desventajas cuando es usado para este fin, entre ellas se encuentran: 1) la velocidad de producción de biomasa es lenta; 2) requiere de auxinas para su crecimiento, lo cual en algunos casos provoca una disminución en el contenido de alcaloides; 3) dificultad para mantener la estabilidad en cultivo; 4) la baja estabilidad en la producción de metabolitos secundarios.[10] Para superar estos inconvenientes, se ha reconocido el potencial que representa el cultivo de raíces transformadas, como herramienta para la obtención de productos vegetales que son sintetizados en la raíz.[10] Esta transformación se logra al infectar células de una planta con la bacteria Agrobacterium rhizogenes. En el proceso de infección se transfiere al genoma de la planta un segmento del plásmido Ri (Root inducing) contenido en la bacteria. Este proceso origina la formación de raíces pilosas en el sitio de la infección (Flores y Filner, 1985). García (1986) realizó algunos experimentos que le permitieron obtener extractos de callos de diferentes especies de Brugmansia, cultivados durante 7 semanas encontrando en ellos un contenido total de alcaloides entre 0.001% y 0.01 % con su método de extracción. Continuando con estos experimentos, Trujillo y Berdugo (1989) concluyeron que la mejor condición para inducir la producción de callo a partir de explantes de B. arborea, B. candida y B. sanguinea, incluía oscuridad, medio M&S adicionado con 0.5 mg/l de 2,4 D y 2 mg/l de Kinetina. Además reportaron que no se lograba la inducción de raíces en explantes de hojas ni en callos de B. arborea, B. candida y B. sanguinea cultivados en luz y oscuridad y con diferentes concentraciones de reguladores. Estos investigadores identificaron en sus cultivos la presencia de atropina, escopolamina y otros dos alcaloides no identificados. Reportaron un contenido de escopolamina entre diez y cuarenta veces mayor que el de atropina, variando entre 0.0052% y 0.084%. 27 Ramírez y Suárez (1993), estudiaron la producción de escopolamina en plantas del genero Brugmansia de diferente procedencia y definieron el medio de cultivo para generar la mayor cantidad de alcaloides. Encontraron, que el medio ambiente donde se desarrollan las plantas, ecotopo, determina la producción de alcaloides en la raíz. Establecieron que de los lugares evaluados, las plantas provenientes de Choachí, Cundinamarca, eran las que poseían una mayor cantidad de alcaloides. Así mismo, sugirieron que el medio de cultivo que más favorecía la producción de éstos era el de White y Bonner (W&B). La cantidad de escopolamina liberada al medio fue de 6.79 mg/g de raíz seca. Sobre la producción de escopolamina por cultivo de raíces normales de Brugmansia candida, se ha estudiado la aplicación de ANA (ácido naftalenacético), en cultivos desarrollados en Erlenmeyer, observando que esta estrategia permite alcanzar una producción máxima de escopolamina al día 24 con un valor igual a 3,94 ±0,01 mg/g de raíz seca.[10] Piñeros (2005), realizó estudios sobre la producción in vitro de escopolamina en cultivos de raíces de Brugmansia candida concluyendo que: 1) El protocolo más adecuado para la desinfección del material vegetal para el cultivo de raíces consiste en: sumergir los frutos en hipoclorito de sodio al 5% por 5 minutos y luego las semillas sin la cubierta en hipoclorito de sodio al 1% por 10 minutos, y por último sumergirlas en etanol al 70% por 10 minutos. 2) Es posible obtener escopolamina mediante el cultivo de raíces de B. candida empleando medio B5 (Gamborg), suplementado con 20 g de 45sacarosa/l y en condiciones de oscuridad. Con una velocidad de agitación orbital de 70 rpm y una temperatura de 20 ºC. 3) La aplicación de ANA (ácido naftalénacético) como auxina, en el mediodonde se desarrollan los embriones zigóticos, no favorece el crecimiento de las raíces ocasionando la atrofia de las mismas. 4) La aplicación de elicitores (ácido jasmónico, ácido salicílico y sulfato de cobre) favorece la liberación al medio de cultivo de los alcaloides. De las sustancias probadas, el sulfato de cobre 0.2 mM, aplicado durante 24 horas sobre las raíces a los 24 días de cultivo, fue el que mejor resultados presentó. 5) En este trabajo se alcanzó una productividad de 7.582 mg de escopolamina / g de raíces secas por medio de la aplicación de elicitor. 4.2 Formulaciones de escopolamina. 28 Las formulaciones de escopolamina más conocidas que se encuentran en el mercado aparecen en la tabla 3. Tabla 3. Formulaciones de escopolamina. Medicamento N-Butil bromuro de Escopolamina Colidesan Dolcopin NButilbromuro + Metamizol sódico Laboratorio BIOSANO DRAG PHARMA PASTEUR BIOSANO Presentación farmacéutica Composición Envase conteniendo 100 ampollas Cada ampolla de 1mL contiene: Nbutilbromuro de escopolamina 20mg. Frasco gotero de 15mL. Frasco gotero de 15mL Envase conteniendo 100 ampollas Novalona Andromaco Envase conteniendo 20 cápsulas Gotas de escopolamina y Paracetamol DRAG PHARMA Envase conteniendo 10mL. Cada 100mL de solución contienen: NButilbromuro de escopolamina 0.0667g., Dipirona 3.334g. Cada 1mL de solución contiene: Metamizol sódico 333.4mg., NButilescopola mina 6.67mg Cada ampolla con 5mL contiene: Nbutilbromuro de Escopolamina 20mg; Metamizol sódico 2.5g. Cada cápsula contiene. Escopolamina 10mg; Oxazepam 10mg Cada 1mL contiene: NButil bromuro de Escopolamina 6.67mg.; Paracetamol 100mg. Acción terapéutica Indicaciones Antiespasmódico Patologías por espasmos dolorosos del tracto gastrointestinal, vías biliares, urinarias y aparato genital femenino. Antiespasmódico Analgésico Afecciones por espasmos de los órganos del tracto digestivo, vías viliares, aparato genitourinario. Antiespasmódico Patologías por espasmos pilóricos y espasmos intestinales de cualquier tipo. Antiespasmódico Indicado en pacientes con dolores cólicos intensos, como cólicos biliares, urinarios y dismenorrea. Antiespasmódico Tranquilizante Antiespasmódico Patología abdominal y ginecológica. Colon irritable. Úlcera gastroduodenal. Patologías del tracto gastrointestinal. Recomendado para el tratamiento de los espasmos de colon irritable. 29 4.3 Mecanismos de acción Es antagonista competitivo de los esteres de la colina o de las sustancias parasimpaticomiméticas a nivel de sistema nervioso central y periférico produciendo un cuadro anticolinérgico.[8] Antagoniza de forma competitiva los receptores colinérgicos muscarínicos tanto en las células que tienen inervación colinérgica como en las que no la tienen pero que poseen dicho tipo de receptores. Estos receptores están presentes en las células efectoras autónomas del músculo liso, músculo cardíaco, nódulos senoauricular y aurículoventricular y glándulas exocrinas. El antagonismo es competitivo, por lo que se puede revertir si se produce un incremento suficiente de la concentración de acetilcolina en los receptores de los órganos efectores.[8] La escopolamina posee acciones centrales y periféricas. A nivel periférico es un potente supresor de la secreción de las glándulas salivares y bronquiales, aunque su efecto sobre las secreciones bronquiales es menos marcado. También produce inhibición de la secreción de las glándulas sudoríparas, dilatación de la pupila (midriasis) y parálisis de la acomodación (cicloplegia), aumenta la frecuecia cardiaca, inhibe la micción, reduce el tono gastrointestinal e inhibe la secreción de ácido gástrico. A dosis bajas, disminuye la frecuencia cardiaca.[9] A nivel central, la escopolamina deprime la corteza cerebral y ejerce un efecto sedante, produciendo somnolencia y amnesia.[9] 4.4 Farmacocinética La escopolamina pertenece a los alcaloides de la belladona (Atropa bedallonna) y del floripondio (Brugmansia candida Pers). Es un éster, fácilmente soluble en agua, formado por la unión del ácido trópico y una amina terciaria, la escopina.[9] Absorción: La escopolamina bromhidrato se absorbe rápidamente tras la inyección intramuscular o subcutánea.[9] Distribución: La distribución de la escopolamina no está completamente caracterizada. Parece que se une de forma reversible a las proteínas plasmáticas en un porcentaje bajo y se distribuye ampliamente por todo el organismo. Aparentemente atraviesa con facilidad la 30 barrera hematoencefálica ya que produce efectos sobre el sistema Nervioso Central (SNC). La escopolamina atraviesa también la barrera placentaria.[9] Metabolismo: Aunque el metabolismo y excreción de escopolamina no se ha descrito totalmente, parece que se metaboliza casi completamente a nivel hepático, principalmente por conjugación. Sólo una pequeña proporción de la dosis administrada se halla en la orina sin metabolizar.[9] Eliminación: La escopolamina y metabolitos se eliminan por vía renal. La semivida de eliminación es de alrededor de 8 h.[9] 4.4.1 Vías de absorción Los alcaloides se absorben rápidamente en el tracto gastrointestinal y es por vía oral como más frecuentemente se administra a las víctimas en dulces, chocolatines; bebidas como gaseosa, café y licor. [8] Es factible el ingreso por vía inhalatoria a través de cigarrillo o por la piel con la aplicación de linimentos. [8] 4.4.2 Metabolismo y excreción El efecto máximo se alcanza durante una a dos horas y cede paulatinamente; tiene una vida promedio de dos y media horas y se metaboliza en hígado por hidrólisis enzimática, en ácido trópico y escopina y sólo 10% se excreta en riñón sin metabolizarse. Aparecen trazas en el sudor y la leche materna. Atraviesa la barrera placentaria y puede actuar sobre el feto. Dosis tóxica: Niños: 10 mg Adultos: 100 mg[8] 4.5 Cuadro clínico Sistema nervioso central: la escopolamina al ser absorbida ocasiona un estado de pasividad completa de la víctima con actitud de automatismo, recibe y ejecuta órdenes sin oposición, desapareciendo los actos inteligentes de la voluntad y la memorización de hechos, lo cual es aprovechado por los delincuentes. Bloquea las funciones colinérgicas en el sistema límbico y corteza asociada, relacionados con aprendizaje y memorización. En algunas personas puede causar desorientación, excitación psicomotriz, alucinaciones, delirio y 31 agresividad. En dosis muy altas causa convulsiones, depresión severa, coma y aún la muerte.[8] Síntomas periféricos: hay disminución de secreción glandular, la producción de saliva se suspende produciendo sequedad de boca, sed, dificultad para deglutir y hablar, pupilas dilatadas con reacción lenta a la luz, visión borrosa para objetos cercanos y puede existir ceguera transitoria; taquicardia acompañada, a veces, de hipertensión, enrojecimiento de la piel por vasodilatación cutánea y disminución de la sudoración, brote escarlatiniforme en cara y tronco e hipertermia que puede llegar hasta 42°C.[8] Causa dilatación vesical con espasmo del esfinter retención urinaria. Dosis muy altas desencadenan arritmias cardíacas, taquicardia severa, fibrilación, insuficiencia respiratoria, colapso vascular y muerte.[8] 4.6 Medios de diagnóstico La base es el cuidadoso interrogatorio al paciente o informantes; el examen físico minucioso, y el análisis de las circunstancias previas al ingreso del paciente al servicio de urgencias (robo, violación, ingesta de drogas, uso de gotas oftálmicas, etc). En los niños es importante precisar la ingesta de plantas desconocidas y de drogas con fin terapéutico o accidental (Ardila y Moreno, 1991). Es necesaria la práctica de pruebas de laboratorio de análisis toxicológico para determinación de alcaloides en material biológico. Se detectan en sangre, orina y contenido gástrico los cuales se deben recoger desde el ingreso del paciente antes de instalar otras sustancias para el manejo (Ardila y Moreno, 1991). La sangre, (no suero), se envía al laboratorio, en tubo seco, sin anticoagulante (10 mL). Es importante enviar el tubo bien tapado, puesto que es necesario el análisis de alcoholes como ayuda diagnóstica y se pueden evaporar durante su traslado. Un segundo tubo con anticoagulante (citrato de sodio) es también útil. Se recoge la orina, mínimo 50 mL, en frasco limpio y bien tapado (Ardila y Moreno, 1991). Se envía el contenido gástrico obtenido inmediatamente después de colocar la sonda nasogástrica, sin diluir con agua, en un frasco limpio y tapado (Ardila y Moreno, 1991). 32 Si fuese posible obtener productos farmacéuticos (tabletas, cápsulas, jarabes, colirios, etc) o restos de plantas (tallos, hojas, semillas, etc.) deben llevarse al laboratorio para el análisis (Ardila y Moreno, 1991). La escopolamina puede encontrarse en orina o sangre. Es necesario recoger la sangre en tubo sin anticoagulante. La muestra sin orina debe ser mínimo de 50mL (Gutierrez M. 1996). La mayoría de los alcaloides son removidos rápidamente a la sangre. Por ello la orina es la muestra de elección para su determinación. Si las muestras de sangre son tomadas en un tiempo mayor de 6 horas después de la administración de la escopolamina es muy probable que el reporte sea negativo (Ardila y Moreno, 1991). La prueba más importante es la de orina debido a que la escopolamina se puede detectar hasta seis horas después de la intoxicación (Gutierrez M. 1996). En el laboratorio se utilizan diversos métodos para su identificación como las reacciones de precipitación o reacciones de color y más frecuentemente, cromatografía de capa fina, con cromatoplacas revaladas a la luz ultravioleta (Ardila y Moreno, 1991). 4.7 Diagnóstico diferencial Se hace con intoxicación por bloqueadores histaminérgicos H1, fenotiazinas, antidepresivos tricíclicos, los cuales tienen actividad antimuscarínica; enfermedades exantémicas como escarlatina o sarampión; enfermedad mental orgánica por encefalopatía (psicosis orgánica). esquizofrenia o delirium tremens; intoxicación por alcoholes, especialmente el metílico que produce midriasis y alteraciones del sistema nervioso central; trauma craneoencefálico.[8] 4.8 Interacciones Metoclopramida: debido a su acción anticolinérgica, la escopolamina puede inhibir el efecto procinético de la metoclopramida cuando ambos fármacos se administran concomitantemente.[9] Depresores del SNC: el uso simultáneo de escopolamina con depresores del SNC puede potenciar los efectos sedantes de estos medicamentos.[9] Ketoconazol: la escopolamina puede incrementar el pH gástrico y disminuir la absorción gastrointestinal de ketoconazol. Si fuera necesario administrar ambos fármacos 33 simultáneamente, la escopolamina debería ser administrada al menos 2 horas después del ketoconazol.[9] IMAO (furazolidona, pargilina y procarbacina): el uso simultáneo de inhibidores de la monoamino-oxidasa (IMAO), incluyendo furazolidona, pargilina y procarbacina, puede incrementar los efectos antimuscarínicos de la escopolamina.[9] Antiácidos con calcio y/o magnesio, inhibidores de la anhidrasa carbónica, citratos o bicarbonato sódico: la excreción urinaria de la escopolamina puede verse retrasada cuando se administran simultáneamente alcalinizantes urinarios, potenciándose los efectos terapéuticos y/o secundarios de la escopolamina.[9] Fenotiazinas, amantadina, antiparkinsonianos, glutemida, meperidina, antidepresivos tricíclicos, antiarrítmicos como quinidina, disopiramida, procainamida, algunos antihistamínicos y analgésicos narcóticos: la administración concomitante de escopolamina con otros fármacos anticolinérgicos puede producir efectos adversos de carácter aditivo como resultado del bloqueo colinérgico (xerostomia, visión borrosa, retención urinaria, trastornos gastrointestinales -íleo paralítico-).[9] Levopromazina: se han observado reacciones extrapiramidales en pacientes que han recibido como premedicación escopolamina y levopromazina simultáneamente.[9] 4.9 Análisis clínicos Prueba de secreción ácida gástrica. El uso simultáneo de la escopolamina puede antagonizar el efecto de la pentagastrina y la histamina en la evaluación de la función de secreción ácida gástrica. No se recomienda su administración durante las 24 horas anteriores a la prueba.[9] Estudios de vaciado gástrico: el uso de escopolamina puede dar como resultado un retraso en el vaciado gástrico.[9] Estudios realizados en ratas y conejos con escopolamina intravenosa a dosis que produjeron concentraciones plasmáticas 100 veces mayores de la que se consiguen en humanos tras la administración transdérmica de la escopolamina, demostraron un efecto embriotóxico marginal en los conejos, sin que se observaran efectos teratogénicos en ratas. No obstante, los estudios en animales son insuficientes con respecto a los efectos de la escopolamina sobre el embarazo y/o desarrollo embrional/fetal y/o parto y/o desarrollo postnatal. Aunque 34 no existen estudios adecuados y bien controlados en humanos, se sabe que la escopolamina atraviesa la barrera placentaria, por lo que su administración antes del parto puede producir depresión del SNC y hemorragia neonatal por déficit de factores de coagulación dependientes de la vitamina K. El uso de escopolamina durante el embarazo sólo se acepta en caso de ausencia de alternativas terapéuticas más seguras.[9] La escopolamina se excreta en la leche materna, no obstante, no se han descrito efectos adversos atribuibles a la escopolamina secretada en la leche. La Academia Americana de Pediatría considera el uso de escopolamina compatible con la lactancia materna, no obstante, se recomienda precaución en su uso.[9] 4.10 Reacciones adversas Los lactantes y niños pequeños son especialmente sensibles a los efectos adversos de los anticolinérgicos, sobre todo aquellos con parálisis espástica o lesión cerebral. Existe riesgo de un rápido aumento de la temperatura corporal cuando se administra a niños en lugares muy cálidos. Dosis elevadas pueden producir hiperexcitabilidad. Uso precautorio. Los ancianos pueden responder a las dosis habituales de anticolinérgicos con excitación, agitación, somnolencia o confusión. Además, son especialmente sensibles a los efectos secundarios (estreñimiento, sequedad de boca, retención urinaria y precipitación de glaucoma no diagnosticado). El uso continuado puede alterar la memoria. Uso precautorio.[9] Las reacciones adversas asociadas con el uso de escopolamina a dosis terapéuticas pueden ser atribuidas en la mayoría de casos a una prolongación de sus acciones farmacológicas fundamentales, parecen estar relacionadas con la dosis y, normalmente ceden cuando se interrumpe la terapia.[9] Las reacciones adversas más frecuentes son: 1) Alteraciones gastrointestinales: sequedad de boca, disfagia y estreñimiento; 2) Alteraciones del SNC: somnolencia, y 3) Alteraciones dermatológicas: disminución de la sudoración (anhidrosis).[9] Reacciones adversas menos frecuentes: 1) Alteraciones oculares: dificultad en la acomodación (presbicia), incluyendo midriasis y visión borrosa, aumento de la fotosensibilidad; 2) Alteraciones renales y urinarias: micción dificultosa y retención urinaria (especialmente en hombres mayores); 3) Alteraciones endocrinológicas: 35 disminución de la secreción de leche; 4) Alteraciones cardiovasculares: cambios transitorios en la frecuencia cardiaca, palpitaciones; 5) Alteraciones del SNC: sensación de mareo (transitoria tras la administración parenteral), y 6) Alteraciones dermatológicas: enrojecimiento u otros signos de irritación en el lugar de inyección.[9] Reacciones adversas raras: 1) Alteraciones del SNC: desorientación, amnesia, mareos, nerviosismo y confusión, (especialmente en ancianos), cefalea; 2) Alteraciones oculares: dolor ocular (por glaucoma); 3) Alteraciones dermatológicas: urticaria o erupciones exantemáticas; 4) Alteraciones gastrointestinales: sensación de distensión abdominal, y 5) Alteraciones generales: falsa sensación de bienestar, cansancio o debilidad no habitual. Se han descrito algunos casos de psicosis en pacientes que reciben anticolinérgicos. Los síntomas y signos más comunes en estos pacientes son confusión, desorientación, pérdida de memoria reciente, alucinaciones, disartria, ataxia, coma, euforia, ansiedad, insomnio, agitación. Estos síntomas generalmente desaparecen a las 12-48 horas de suspender el tratamiento. Algunos pacientes pueden presentar una susceptibilidad excesiva a los efectos de escopolamina y pueden experimentar reacciones idiosincráticas a dosis terapéuticas. Después de suspender la medicación se puede producir un fenómeno de rebote con ansiedad, irritabilidad, pesadillas, problemas para dormir y reducción de la fase REM del sueño. La solución de escopolamina contiene como excipiente metabisulfito sódico que puede causar reacciones alérgicas incluyendo síntomas anafilácticos, como por ejemplo urticaria, escozor, etc. En cierta población susceptible. La prevalencia de la sensibilidad a los sulfitos es desconocida y probablemente baja. Dicha sensibilidad es más frecuente en la población asmática que en los individuos no-asmáticos. 4.11 Sobredosis Los signos y síntomas de la sobredosis de escopolamina son cefalea, náuseas, vómitos, visión borrosa, confusión, desorientación, inquietud, pérdida de memoria y alucinaciones (auditivas y visuales).[9] En caso de intoxicación, se debe administrar fisostigmina intravenosa a dosis de 1-4 mg (0,5 a 1 mg en niños, hasta una dosis total de 2 mg), a una velocidad no superior a 1 mg por 36 minuto, con el fin de revertir los síntomas anticolinérgicos. La utilización de fisostigmina debe realizarse con precaución y únicamente bajo monitorización cardiaca. Si el paciente está muy agitado se puede administrar un barbitúrico de acción corta, una 37enzodiacepina (diazepam) o una infusión rectal de solución de hidrato de cloral al 2%. Para mantener la presión arterial se puede administrar una infusión de bitartrato de norepinefrina. Si se produjera parálisis de la musculatura respiratoria, se instaurará ventilación mecánica que se mantendrá hasta que se reanuden los movimientos respiratorios espontáneos efectivos. Siempre debe mantenerse al paciente bien hidratado y administrar tratamiento sintomático.[9] La dosis letal en adultos es alrededor de 100 mg, pero pueden aparecer síntomas de intoxicación con dosis de 2 a 5 mg. En niños 10 mg o menos pueden ser letales.[9] 4.12 Tratamiento Es importante que la vía aérea esté permeable y exista una adecuada oxigenación, hidratación y un control de hipertermia con medios físicos (bolsas de hielo, compresas frías, etc.), la cama debería estar acolchonada para evitar lesiones. Para evitar estímulos en el paciente el cuarto debe estar a media luz.[8] Es benéfico disminuir la absorción con lavado gástrico, preferible con carbón activado y catártico salino, lo cual debe iniciarse sin demora si el veneno se ha ingerido oralmente. Si se observa recuperación progresiva del paciente y mejoría satisfactoria del cuadro clínico, se continúan las medidas generales y la observación será permanente hasta darle de alta. Si presenta delirio y coma, causado por grandes dosis de tóxico, la fisostigmina (Antilirium), es el tratamiento indicado. Esta droga inhibidora de la acetilcolinesterasa, corrige los efectos centrales y los efectos periféricos.[8] Se consiguen ampollas de 1 mg en 5cc. La dosis terapéutica es de 0.5 - 2.0 mg IV lentos en adultos. Si el diagnóstico es correcto, se observa una respuesta rápida (diagnóstico terapéutico). Como la fisostigmina se metaboliza rápidamente, el paciente puede caer otra vez en coma en una o dos horas, necesitando nuevas dosis.[8] La dosis podrá repetirse a los 15 minutos, siempre y cuando sea muy lentamente; ya que si se aplica rápidamente produce convulsiones, salivación excesiva o vómito que obliga a suspenderla.[8] 37 Está contraindicada su aplicación en hipotensión. Es una sustancia peligrosa por lo cual su uso debe limitarse en pacientes con manifestaciones anticolinérgicas severas. El diazepam, es muy conveniente para la sedación y el control de convulsiones. Debe evitarse las grandes dosis porque la acción depresiva central puede coincidir con la depresión producida por el envenenamiento escopolamínico.[8] La neostigmina (prostigmine), sólo corrige los efectos periféricos pues no atraviesa la barrera hematoencefálica; en niños por la deficiencia fisiológica de dicha barrera, podría mejorar algunas manifestaciones centrales. Se consiguen en ampollas de 1.2000 y comprimidos de 15 mg. En niños no se usa y en adultos sólo si los efectos periféricos del tóxico son notorios. Se debe usar con precaución ya que puede desencadenar crisis asmática, hipotensión arterial o colapso circulatorio.[8] La vitamina C es útil para aumentar la eliminación de los alcaloides por el mecanismo de acidificación de la orina. En dosis de 1 gr IV cada 8 ó 12 horas en adultos ó 200 mg/kg día dividido en tres dosis, en niños se mantiene el pH urinario en 4. Además si es necesario utilizar fisostigmina retarda su hidrólisis favoreciendo su acción a nivel central.[8] Las fenotiazinas no deben usarse porque su acción antimuscarínica puede intensificar la toxicidad. Hospitalizar según criterio médico.[8] Antídoto: el antídoto es la fisostigmina, un medicamento inhibidor de la acetilcolinesterasa. Puede revertir todos los síntomas anticolinérgicos asociados a esta intoxicación. La dosis de fisostigmina es de 0.5 a mg. via intravenosa. Cuando el diagnóstico es correcto se observa una rápida respuesta. La dosis puede repetirse cada 15 minutos si no hay disminución marcada de los síntomas. La fisostigmina es capaz de producir una crisis colinérgica (convulsiones, depresión respiratoria, asistolia) con la posibilidad de llevar al paciente a muerte (Ziskind, 1988). 38 5. Comentarios De acuerdo a la revisión bibliográfica de la Brugmansia spp realizado en el presente trabajo se concluye lo siguiente: La Brugmansia spp es conocida por su alto contenido de alcaloides tropánicos como atropina y escopolamina. La Brugmansia se suele conocer o confundir con Datura. Los alcaloides generan respuestas fisiológicas, debido a la interacción con neurotransmisores. La escopolamina es un antagonista competitivo de la acetilcolina en los receptores muscarínicos. 39 6. Referencias bibliográficas Álvarez Mejía, Luis Miguel. (2008). Borrachero, Cacao sabanero o floripondio (Brugmansia spp.) un grupo de plantas por redescubrir en la biodiversidad Lationamericana, 77-93 Ardila, A. & Moreno, C. (1991). Scopolamine intoxication as a model of transient global amnesia.Brain.Cogn, 15: 236. Ávalos García, Adolfo. Pérez-Urria Carril, Elena. 2009. Reduca (Biología). Serie Fisiología Vegetal 2, 119-145. Azcon Bieto, J. & Talon, M. (1993). Fisiología y Bioquímica Vegetal. Interamericana McGraw-Hill. 237-281 Bohinski, Robert C. 1991. Bioquímica. Quinta edición, pp 490-537 Bruneton, J. 2001. Farmacognosia, Fitoquímica, Plantas Medicinales. Segunda Edición. Acribia. Zaragoza. Bruneton, J. 2000. Plantas Tóxicas. Acribia. Zaragoza. Cunningham, E. B., 1978. Biochemistry: Mechanisms of Metabolism. McGraw-hill, New York Flores, H. E., and Filner, P. (1985) Metabolic relationships of putrescine, GABA and alkaloids in cell and root cultures of Solanaceae, Primary and secondary metabolism of plant cell cultures, 174 - 185. Fontquer, P. (2001). Plantas Medicinales, El Dioscórides Renovado. 3 ed. Barcelona: Ediciones Península. 1033 p. García. (1986) Estudio comparativo de la producción de alcaloides en tres especies del género Brugmansia, mediante el cultivo de tejidos vegetales in vitro, in Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia, Bogotá. Gutierrez M. 1996. Intoxicación por burundanga. Guías de manejo de urgencias. Ministerio de Salud. Federación Panamericana de Asociaciones de Facultades de Medicina. Bogotá. 40 Hunziker, Armando T. 2001. The Genera of Solanaceae. A.R.G. Gantner Verlag K.G., Ruggell, Liechtenstein. ISBN 3-904144-77-4. Kuklinski, C. 2000. Farmacognosia: estudio de las drogas y sustancias medicamentosas de origen natural. Omega. Barcelona. Lagerheim, G. 1895. Monographie der Ecuadorianischen Arten der Gattung Brugmansia Pers. Niembro Rocas, Aníbal. 1986. Árboles y arbustos útiles en México. Edit. Limusa. 82pp Piñeros, Y. (2005) Producción de escopolamina e hiosciamina mediante cultivo in vitro de raíces de Brugmansia candida, in Departamento de Ingeniería Química, Universidad Nacional de Colombia, Bogotá. Ramírez, Y. y Suarez, W. (1993) Contribución al estudio del genero Brugmansia mediante el cultivo de tejidos vegetales in vitro II, in Facultad 167 de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia, Bogotá. Segler, D.S. 2001. Plant Secondary Metabolism. Kluwer. Nueva York. Schütte, H.R., 1986. Secondary plant substances: Monoterpenoid indole alkaloids. Pp 149166. Trujillo, M., and Berdugo, M. (1986) Contribución al estudio del género Brugmansia mediante el cultivo de tejidos vegetales in vitro I, in Química Farmaceutica, Universidad Nacional de Colombia, Bogotá. Van der Donck, I.; Mulliez, E.; Blanckaert, J. (2004). «Angel's Trumpet (Brugmansia arborea) and mydriasis in a child - A case report». Bulletin de la Societe Belge d'Ophtalmologie 292: pp. 53–56. Willians, C.A. y Grayer, R.J. 2004. Anthocyanins and other flavonoids. Natural Products Reports 21: 539-573. Ziskind AA. 1988. Transdermal scopolamine-induced psychosis.73-76 41 Referencias Electrónicas 1 http://200.21.104.25/culturaydroga/downloads/culturaydroga13(15)_6.pdf 2 http://www.medicinatradicionalmexicana.unam.mx/monografia.php?l=3&t=&id=7956 3 http://www.profesorenlinea.cl/Ciencias/Metabolismo_celular.html 4 http://eprints.ucm.es/9603/1/Metabolismo_secundario_de_plantas.pdf 5 http://www.biologie.uni-hamburg.de/b-online/e20/20.htm 6 http://www.friedli.com/herbs/phytochem/phyto_tutorial.html 7 http://es.scribd.com/doc/499723/ALCALOIDES-por-QF-Marilu-Roxana-SotoVasquez 8 http://www.aibarra.org/Guias/10-12.htm 9 http://www.salud.es/principio/escopolamina 10 http://www.bdigital.unal.edu.co/2609/1/299022.2009.pdf 11 http://www.iecan.org/_archivos/anuarios/publicadosweb/anuarioLII_2008.pdf#page=6 1 12 http://unibio.unam.mx/collections/specimens/urn/IBUNAM:MEXU:OAX1203714 42