Mezclas
Anuncio

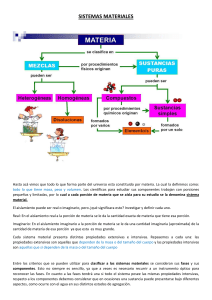
Mezclas Las diversas formas en que se presenta la materia se conocen como materiales. En la naturaleza podemos encontrar los materiales en forma pura, pero la gran mayoría se encuentra en combinación, formando mezclas. Los materiales se clasifican en: Sustancias Puras Mezclas Sustancias Puras: son materiales que tiene la misma composición definida e invariable y cuyas propiedades físicas, permiten la identificación de sustancias, y las químicas son siempre las mismas y permiten conocer como se combinan con otras sustancias. Se clasifican en: Simples: compuestas por un tipo único de átomos o elementos. Poseen propiedades únicas que permiten caracterizarlos. Compuestas: están formados por lo menos por dos o más tipos de átomos unidos químicamente en proporciones fijas de masa. Por ejemplo: el Agua (H2O), el Cloruro de Sodio (NaCl), Amoníaco (NH3), Dióxido de Carbono (CO2). Mezclas: son materiales formados por la unión de dos o más sustancias en proporciones variables, como azúcar y agua, merengadas, batidos, limonadas, medicamentos, cosméticos, detergentes, limaduras de hierro y granzón, etc. Sus componentes se pueden separar por métodos mecánicos. Se clasifican en: Heterogéneas: sus componentes se pueden observar a simple vista, con una lupa o microscopio. La mezcla no es uniforme. Pueden ser Liquido-liquido, solido-solido y líquido solido. Ejemplo: aceite/agua, S con limaduras de Fe, arena/agua. Características de las mezclas Heterogéneas 1. Los componentes no presentan una distribución regular de sus propiedades 2. Están formadas por dos o más fases. 3. El tamaño de estas partículas es superior a 10-5 cm. Las mezclas heterogéneas pueden ser: o o o Groseras: las partículas se distinguen fácilmente. Ej: granito (feldespato, cuarzo y mica), grava Suspensiones: Las partículas tienden a depositarse con el paso del tiempo. El tamaño de partícula está entre 0.001mm y Ej. agua, arena, jarabes, pinturas. Coloides: dispersan la luz y poseen un tamaño de partícula entre 10-7 y 10-5 cm. No se sedimentan. Poseen una fase dispersante que es la disolvente y una fase dispersa que se disuelve. Entre ellos tenemos: geles y emulsiones Homogéneas: sus componentes no se pueden observar a simple vista o con el microscopio. La mezcla es uniforme. Ej.: las soluciones. Características de las mezclas Homogéneas 1. Su composición varía dentro de ciertos límites 2. Las propiedades de la mezcla dependen de la naturaleza de los componentes. 3. El tamaño de estas partículas es inferior a 10-5 cm. Estas mezclas pueden ser de dos tipos: o o Soluciones, que contienen partículas menores de 10-8 cm; sus componentes se conocen como soluto y disolvente: el soluto se disuelve en el disolvente y se encuentra generalmente en menor proporción. Pueden existir soluciones en cualquiera de los tres estados (aire), las más comunes son la liquidas. La concentración es la relación que existe entre la cantidad de soluto y solvente. De acuerdo a la concentración las soluciones se pueden clasificar en: Diluidas: aquellas que contienen poco soluto Saturadas: contienen todo el soluto que el solvente puede disolver Sobresaturadas: contienen mas soluto del que el solvente es capaz de disolver Aleaciones (soluciones sólidas): son mezclas formadas por sustancias que presentan propiedades metálicas. Algunos ejemplos son el oro de joyería (plata, oro y cobre), el acero (hierro y carbón), el latón ( cobre y zinc), el bronce (cobre, zinc y estaño) y las amalgamas (mercurio y plata). Las técnicas que se utilizan para separar las mezclas heterogéneas son: Tamización: consiste en la separación de los componentes por diferencia en tamaño de las partículas utilizando un tamiz. Filtración: esta técnica permite la separación de aquellas mezclas que están compuestas por líquidos y sólidos no solubles, es decir que los sólidos no se disuelven en el líquido. Para separar estas mezclas, se utiliza un embudo con un papel de filtro (material poroso). Imantación o Separación magnética: esta técnica sólo es útil a la hora de separar sustancias con propiedades magnéticas de aquellas que no las poseen. Para esto, se utilizan imanes que atraen a las sustancias magnéticas y así se logra separarlas de las que no lo son. Decantación: Esta técnica sirve para la separación de líquidos que tienen diferentes densidades y no son solubles entre sí. Se requiere un embudo de decantación que contiene una llave para la regulación del líquido. Una vez decantada la mezcla (dejar en reposo) el elemento más denso irá al fondo y por medio del embudo de decantación, cuando se abre la llave se permite el paso del líquido más denso hacia un recipiente ubicado en la base, quedando el líquido con menor densidad en la parte de arriba del embudo. Centrifugación: consiste en la separación por diferencia de densidades o masas. Se utiliza la centrifuga que rota a alta velocidad haciendo que los materiales más densos se depositen en el fondo del envase. Las técnicas que se utilizan para separar las mezclas homogéneas son: Destilación: consiste en la separación de los componentes utilizando las diferencias en puntos de ebullición. Evaporación: Se utiliza para separar un sólido disuelto en un liquido por evaporación del solvente. Extracción: permite separar los diferentes componentes de acuerdo a la solubilidad en diferentes solventes. se utiliza para extraer comúnmente pigmentos de la hojas de las plantas para obtener café o te. Cromatografia: es la técnica más compleja basada en que las distintas sustancias que forman los componentes de una mezcla se dejan arrastrar a diferentes velocidades sobre un soporte(adsorción). El soporte puede ser papel, un gas, otro líquido, etc. Es un método físico de separación de componentes. Cristalización y precipitación: esta permite la separación de un soluto sólido de que se encuentra disuelto en un disolvente. Se calienta la disolución para concentrarla, luego se la filtra y se la coloca en un cristalizador hasta que se evapore el líquido, quedando el sólido en forma de cristal.