apuntes tema orgánica parte 2 isomería
Anuncio

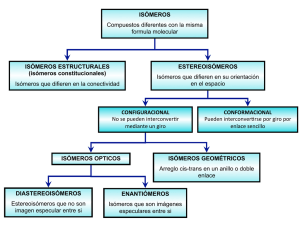
1 ISOMERÍA ISOMERÍA La isomería consiste en el hecho de que dos o más compuestos tienen la misma fórmula molecular, pero diferente estructura molecular; en consecuencia poseen diferentes propiedades físicas y químicas. Se denominan isómeros a los compuestos que tienen la misma fórmula molecular, (tienen el mismo número de átomos de cada tipo, tienen la misma composición química y el mismo peso molecular), pero tienen diferente estructura química (diferente formula estructural). Los isómeros tienen diferentes propiedades físicas y/o químicas. Los isómeros no son superponibles, CLASIFICACIÓN DE LOS ISÓMEROS: Isómeros Estructurales: Los isómeros estructurales son los compuestos que a pesar de tener la misma fórmula molecular difieren en su estructura, bien por la conectividad de la cadena hidrocarbonada o de las funciones o por poseer funciones diferentes; por tanto sus propiedades físicas y químicas son diferentes. La isomería estructural se clasifica en: Isómeros de cadena: Difieren en la forma en que están unidos los átomos de carbono entre sí para formar una cadena. Por ejemplo: Butano, Isopropano. Las propiedades químicas apenas varían y las propiedades físicas varían gradualmente. QUIMICA ORGÁNICA Página 1 2 Butano Isobutano (metilpropano) H3 C CH3 H C C H H o-metilfenol H3 C CH3 H H H C C C H H H m-metilfenol p-metilfenol CH3 CH3 H3 C CH3 C CH3 CH3 CH3 CH3 CH3 Isómeros de posición: Son compuestos que difieren en las posiciones que ocupan sus grupos funcionales en la estructura carbonada, (tienen las mismas funciones químicas, pero sobre átomos de carbono con números localizadores diferentes). Sus propiedades químicas son muy parecidas y las diferencias en las propiedades físicas son mayores. . Ejemplo 1-Butanol; 2Butanol. H H3 C C H CH2 Br H 2-Butanona 1-butanol CH3CH2CH2CH2OH QUIMICA ORGÁNICA H3 C C CH3 Br 3-Butanona 2-butanol CH3CH2CHOHCH3 Página 2 3 Isómeros de función: Son compuestos de igual fórmula molecular, pero la forma en que están unidos los heteroátomos da lugar a que difieran en sus grupos funcionales (presentan funciones químicas diferentes). Sus propiedades físicas y químicas son muy diferentes. Ejemplo. CH3 Propanona, Propanal H3 C H H C C H H3 C H OH C C O H3 C H H3 C C OH CH3 H C H3 C C CH3 O propanona CH3COCH3 ESTEREOQUIMICA: C OH O H H OCH3 propanal CH3CH2CHO Es la parte de la química que se ocupa del estudio de la disposición espacial de los átomos que componen las moléculas y de cómo afecta esto a las propiedades y reactividad de dichas moléculas. ISOMERÍA EN EL ESPACIO O ESTEREOISOMERÍA Es la isomería que presentan los compuestos que se diferencian únicamente en la disposición de sus átomos en el espacio. Moléculas con fórmulas moleculares idénticas pueden presentar estructuras espaciales diferentes y se denominan estereoisómeros (moléculas isómeras, que aun teniendo los mismos enlaces y ordenación entre sus átomos difieren en el modo en que estos átomos están dispuestos en el espacio). Se clasifican por sus propiedades de simetría. QUIMICA ORGÁNICA Página 3 4 Veamos en primer lugar el concepto de quiralidad: Estereoisomero quiral Es aquel estereoisómero que no es superponible con su imagen en el espejo. La molécula no tiene elementos de simetría, es ópticamente activa y desvía el plano de la luz polarizada, hacia la derecha: dextrógiros o hacia la izquierda: levógiros Una molécula puede ser quiral debido a que posee: • Con centro quiral: 1 átomo quiral, Hay varias circunstancias que posibilitan que un átomo de C sea quiral, el caso que nos interesa es el de un átomo de C tetraédrico (hibridación sp3) con 4 sustituyentes diferentes; también la estructura del adamantano, los átomos piramidales QUIMICA ORGÁNICA Página 4 5 con 3 sustituyentes diferentes, los complejos octaédricos convenientemente sustituidospresentan centro quiral. • Sin centro quiral pero con plano quiral (compuestos sándwich) • Sin centro quiral pero con eje quiral (planos disimétricos perpendiculares)… • Con dos o más centros quirales Moléculas quirales (no superponibles) Carbono tetraédrico con 4 sustituyentes diferentes Estereoisomero aquiral o no quiral Es aquel que es superponible con su imagen en el espejo (tiene elementos de simetría). Cuando una molécula es superponible con su imagen especular se dice que no es ópticamente activa y, por tanto, es incapaz de desviar el plano de la luz polarizada. Moléculas no quirales (superponibles) En resumen: Cada centro quiral en una molécula es responsable de la existencia de estereosómeros, da lugar a dos moléculas isómeras especulares o enantiómeros. El número de estereoisómeros está relacionado con el número de carbonos asimétricos mediante la expresión 2n siendo n el número de C quirales. Una molécula con 2 centros quirales puede tener 4 estereoisómeros (22 esteroisómeros, 2 parejas de enantiómeros); una con 3 centros quirales puede tener 8 estereoisómeros (23 esteroisómeros, 4 parejas de enantiómeros); y así sucesivamente. QUIMICA ORGÁNICA Página 5 6 Las moléculas que contienen sólo un átomo de carbono asimétrico son siempre quirales. Las moléculas con más de un átomo de carbono asimétrico no son necesariamente quirales, éste es el caso de las formas m eso. Estereoisómeros conformacionales: Son estereoisómeros que se caracterizan por poder modificar su orientación espacial, por rotación en torno a enlaces simples (los c tienen hibridación sp3) convirtiéndose en otro isómero de la misma molécula; existen conformaciones: anti, eclipsada o alternada. Los estereoisómeros conformacionales o confórmeros de un compuesto se interconvierten rápidamente a temperatura ambiente debido a que la barrera energética que hay que superar para la interconversión es muy baja; por esta razón resulta imposible mantenerlos aislados por separado. Estereoisómeros configuracionales: Son estereoisómeros que tienen la misma forma estructural y diferente disposición de sus átomos en el espacio pero son estructuralmente estables, se pueden aislar, por separado a temperatura ambiente. En la mayor parte de los casos para transformar uno en otro no basta con realizar giros alrededor de enlaces sencillos sino que es necesario romper y formar enlaces teniendo que vencer una barrera energética alta). QUIMICA ORGÁNICA Página 6 7 Estereoisomeros geométricos: Difieren en la ordenación de los grupos en el plano. La isomería geométrica es característica de los compuestos orgánicos que poseen dos átomos de carbonos unidos por un doble enlace y que a su vez poseen dos sustituyentes idénticos, aunque esto último no es obligatorio) Los sustituyentes iguales pueden estar situados al mismo lado del doble enlace (cis) o en lados opuestos (trans). No se presenta isomería geométrica si tiene tres o los cuatro sustituyentes iguales. Tampoco puede presentarse con triples enlaces. La primera estructura es cis- porque los grupos isopropilo y metilo quedan al mismo lado del plano que contiene al orbital molecular π, en la segunda estructura quedan a lados opuestos , razón por la que esta ultima estructura es trans-. Los estereoisómeros geométricos no pueden convertirse uno en otro sin que se rompa un enlace químico. El doble enlace C=C no permite el giro cuyo eje sea dicho enlace. QUIMICA ORGÁNICA Página 7 8 Supongamos un doble enlace C=C, disustituido, siendo ambos sustituyentes idénticos, por ejemplo, el 2- buteno, CH3CH=CHCH3, éste presenta 2 isómeros geométricos. Si los dos sustituyentes están del mismo lado del plano que contiene a la nube π el compuesto es CIS. Si están en distinto lado es TRANS. Los isómeros cis, trans no son convertibles el uno en el otro porque carecen de libre rotación en torno al doble enlace Esta isomería puede aparecer también en compuestos cíclicos. Isomería cis-trans en ciclos: Los cicloalcanos tienen dos “caras” o lados debido al plano que contiene el esqueleto carbonado; cuando en el ciclo hay dos sustituyentes en átomos de carbono distintos, existen dos isómeros. Si los sustituyentes se encuentran del mismo lado del plano es el isómero cis, y si están en lados opuestos es el isómero trans.Las reglas de Can-Ingold y prelog permiten la notación Z si los sustituyentes de mayor prioridad están al mismo lado y E si los sustituyentes prioritarios están alados opuestos. QUIMICA ORGÁNICA Página 8 9 Estereoisomeria óptica: La isomería óptica (estereoisomería óptica) es característica de aquellos compuestos orgánicos que poseen uno o más átomos de carbono asimétricos. Un carbono asimétrico o quiral es aquel que posee los cuatro sustituyentes distintos. Las moléculas que presentan este tipo de isomería de diferencian únicamente en el efecto QUIMICA ORGÁNICA Página 9 10 que tienen sobre la luz. Recibe el nombre de molécula quiral aquella que no se puede superponer con su imagen especular. Toda molécula no quiral recibe el nombre de aquiral. Si una molécula posee un plano de simetría es aquiral. Una molécula quiral puede presentar, al menos, dos configuraciones diferentes, una imagen especular de la otra, que constituyen una pareja de enantiómeros o isómeros ópticos, cuyas propiedades físicas y químicas son casi idénticas. En general, una molécula con n carbonos asimétricos hace posibles 2n estereoisómeros. Uno de ellos gira el plano de polarización de la luz hacia la derecha (dextrógiro, (+)) y se identifica con la letra R el otro gira el plano de polarización de la luz hacia la izquierda (levógiro, (-)) y se identifica con la letra S. Isómeros ópticos: ¿Porqué los isómeros ópticos desvían el plano de polarización de la luz? Las moléculas de los isómeros ópticos son quirales, carecen de simetría, y puede ser debido a diferentes causas, la más frecuente de ellas es la presencia de, al menos, un carbono quiral o carbono asimétrico, átomo de C unido a cuatro sustituyentes diferentes; las moléculas quirales existen en dos formas que son entre sí imágenes especulares, no superponibles, se dicen que son enantioméricas. Enantiómeros : Son moléculas quirales. Dos compuestos son entre sí enantiómeros si la imagen especular de uno no puede ser superpuesta con la del otro. Dicho de otra forma: un enantiómero es una imagen especular no superponible de sí mismo. Los compuestos enantioméricos tienen las mismas propiedades físicas y químicas, en condiciones aquirales, excepto por la interacción con el plano de la luz polarizada o por la reacción con otras moléculas quirales. Dos enantiómeros desvían el plano de la luz polarizada en la misma magnitud pero en sentidos opuestos. QUIMICA ORGÁNICA Página 10 11 Al enantiómero que rota el plano de vibración de la luz polarizada en el sentido de las agujas del reloj, (hacia la derecha), se le denomina isómero dextro- y se nombra anteponiendo al nombre del compuesto el signo (+) o también la letra d minúscula; y análogamente, al enantiómero que rota el plano de vibración de la luz polarizada en sentido contrario a las agujas del reloj, (hacia la izquierda), se le denomina isómero levo-- y se nombra anteponiendo al nombre del compuesto el signo (-) o también la letra l minúscula. QUIMICA ORGÁNICA Página 11 12 Características de los enantiómeros: • • • • Los enantiómeros tienen las mismas propiedades químicas y físicas, a excepción de su respuesta ante la luz polarizada (actividad óptica). Por ello se les denomina isómeros ópticos. Los enantiómeros se interconvierten a temperatura ambiente por efecto de sombrilla. Un enantiómero que rota el plano de la luz polarizada, al pasar a su través, en el sentido de las agujas del reloj, se dice que es dextrorrotatorio o dextrógiro. Si lo hace al contrario, es levorrotatorio o levógiro. La rotación específica de la luz polarizada, se mide por medio de un polarímetro, es una propiedad física característica de la estructura de cada enantiómero, de su concentración y del disolvente empleado en la medición. QUIMICA ORGÁNICA Página 12 13 La mezcla equimolecular de enantiómeros se denomina mezcla racémica o racemato. Una mezcla racémica no rota el plano de vibración de la luz polarizada. En una mezcla racémica las propiedades no son siempre las mismas que las de los enantiomeros por separado, depende del estado de agregación.Se denomina resolución del racemato a la separación de los componentes de un racémico Diastereoisómeros Son estereoisómeros configuracionales que no son imágenes especulares entre si QUIMICA ORGÁNICA Página 13 14 Flechas horizontales: enantiómeros Flechas verticales y oblicuas: diastereoisómeros Características de los diastereoisómeros: Los diastereoisómeros difieren en sus propiedades físicas y químicas, razón por la que pueden separarse mediante procedimientos de destilación, cristalización o cromatografía. Dentro del grupo de los diasterómeros se encuentran los isómeros cis-trans (antes conocido como Isómeros Geométricos), los confórmeros o isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros. Si una molécula tiene varios centros quirales obtendremos diastereómeros cambiando la configuración absoluta de uno de los centros quirales y manteniendo la del resto. QUIMICA ORGÁNICA Página 14 15 PROYECCIONES DE FISCHER Las proyecciones de Fischer son utilizadas en química orgánica para representar en dos dimensiones la disposición espacial de moléculas tridimensionales en las que uno o más átomos de carbono están unidos a 4 sustituyentes diferentes. En una proyección de Fischer, un átomo de carbono tetraédrico se representa por dos líneas cruzadas. Por convenio, las líneas horizontales representan enlaces que salen de la página hacia el lector, y las líneas verticales representan enlaces que entran en la página y se alejan del lector. El esquema anterior representa un compuesto con un átomo tetraédrico, asimétrico, (hibridación sp3 y 4 sustituyentes diferentes dirigidos hacia los vértices de un tetraedro). Giramos el compuesto de forma que dos de sus enlaces queden en un plano vertical y hacia atrás y los otros dos en un plano horizontal y hacia delante. Proyectamos la molécula sobre el plano del papel como si la aplastásemos. Cuando la molécula tiene dos carbonos asimétricos, para realizar la proyección de Fischer hacemos que los enlaces contenidos en el plano del papel queden hacia atrás y los carbonos quirales C*-C*queden en línea. Nomenclatura de los estereoisómeros (R, S) QUIMICA ORGÁNICA Página 15 16 La Nomenclatura R, S se utiliza para determinar la configuración absoluta de los carbonos quirales. - Para determinar si una molécula es R ó S se actúa de la siguiente forma: 1. Se observan los átomos que están directamente unidos a cada carbono del doble enlace y se establece un orden de prioridad siguiendo las reglas de Cahn, Ingold y Prelog. El átomo de mayor número atómico recibe la prioridad más alta. 2. Si no es posible tomar una decisión considerando los primeros átomos del sustituyente, se recurre a los segundos, terceros, y así sucesivamente hasta encontrar un punto de discordancia. 3. Se considera que los átomos unidos con enlaces múltiples son equivalentes al mismo número de átomos unidos con enlace sencillo. 4. Cuando la única diferencia entre los sustituyentes sea isotópica tendrá prioridad el átomo de mayor masa atómica. 5. Una vez determinadas las prioridades, se recorren los átomos por orden de prioridad (de mayor a menor) sin tener en cuenta el de menor prioridad. El sentido de las agujas del reloj es R, el sentido contrario a las agujas de reloj es S. 6. Si el átomo de menor prioridad se encuentra hacia atrás (posición vertical en la proyección de Fisher) se mantiene el sentido, es decir, si el sentido de recorrido de los átomos era R la molécula será R, y si el sentido de recorrido de los átomos era S la molécula será S. 7. Si el átomo de menor prioridad se encuentra hacia adelante (posición horizontal en la proyección de Fisher) se invierte el sentido, es decir, si el sentido de recorrido de los átomos era R la molécula será S, y si el sentido de recorrido de los átomos era S la molécula será R. QUIMICA ORGÁNICA Página 16 17 - - QUIMICA ORGÁNICA Página 17 18 QUIMICA ORGÁNICA Página 18 19 - Proyección de Newman Fischer - QUIMICA ORGÁNICA Página 19 20 ¿Tienen los compuestos la misma fórmula molecular? NO No Isómeros SI Isómeros NO ¿Tienen los compuestos la misma conectividad? SI Estereoisómeros NO ¿Son interconvertibles por rotación en torno a enlaces simples C-C? SI Configuracional ¿Es producida por un doble enlace? SI NO Óptica NO QUIMICA ORGÁNICA ¿Son los compuestos imágenes especulares no superponibles? SI Página 20