9 - Universidad de Puerto Rico Humacao
Anuncio

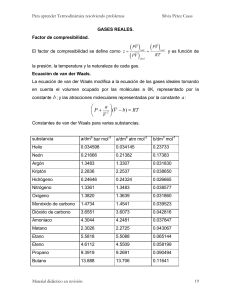
UNIVERSIDAD DE PUERTO RICO EN HUMACAO DEPARTAMENTO DE QUÍMICA QUÍMICA FÍSICA I Profesora Ileana Nieves TERMODINÁMICA ASIGNACIÓN 9 1. El factor de compresibilidad (Z) para un gas ideal obedece la ecuación de Van der Waals y se expresa por: donde a y b son las constantes que aparecen en la ecuación de Van der Waals. a. Expr ese la fugacidad de este gas en términos de a, b, T y P. b. Para agua en estado gaseoso, la constantes a y b en la ecuación de Van der Waals son 5.72 L2 atm/ mol2 y 0.0319 L/mol, respectivamente. Determine el ) G para la compresión de un mol de vapor de agua desde un atm a 50 atm durante un proceso isotermal a 298 K. 2. El punto de fusión de azufre monoclínico a 1 atm es 119.3°C. El cambio en volumen durante la fusión es 41 cm3 /kg y ) Hf,m es 422 cal/mol. Determine la temperatura de fusión de azufre cuando la presión sobr e éste es 1000 atm. 3. Cierto líquido tiene un punto de ebullición normal a 760 torr de 65°C. Usando la Regla de Trouton: a. Estime la tensión de vapor a 52°C b. Estime la temperatura del punto de ebullición a una presión de 200 torr. c. Determine la ecuación para la varia ción de la presión de vapor del líquido como función de temperatura. 4. El ingerir o inhalar mercurio produce envenenamiento que a la larga puede resultar en un daño irreparable a los riñones. Las agencias gubernamentales reguladoras han fijado como límite permitido, o sea, de seguridad una concentración de 0.1 mg de mercurio por metro cúbico de aire. Supongamos que en un laboratorio ha ocurrido un derrame de mercurio y aún luego de recogerlo, todavía queda mercurio en las grietas del piso o área s poco accesibles. Estos residuos de mercurio introducen sólo un 10% de presión de vapor de aire del salón debido a la ventilación del salón. Determine si a 25°C la concentración del mercurio en el aire estaría dentro de los límites permitidos. Asuma que el punto de ebullición de mercurio es 357°C y su entalpía molar de evaporación es 14.56 kcal/mol. 5. De los siguientes datos, trace el diagrama de fases de nitrógeno a temperaturas bajas: a. Nitrógeno existe en tres formas cristalinas que co existen en equilibrio a 4650 atm y 44.5 K. b. En este punto triple al cambiar condiciones de T y P ocurren las siguientes transformaciones: Transición ) V, cm3 /mol ) S J/mol-gra do "º( 0.165 1.25 $º( 0.208 5.88 $º" 0.043 4.59 A un atm y 36 K, $ se transforma en " con ) V = 0.22 cm3 /mol y ) S = 6.25 J/mol-grado.