SERIE 1 ESTADO GASEOSO Conocimientos previos:
Anuncio

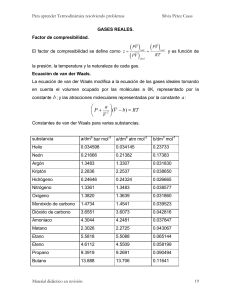
SERIE 1 ESTADO GASEOSO Conocimientos previos: - Gases ideales. Ecuación fundamental de la Teoría Cinética. Ley de difusión de Graham. Gases reales. Ecuación de van der Waals. 1) Se coloca 1 g de helio en el matraz A y 1 g de oxígeno en el matraz B. Ambos matraces son iguales y se mantienen a 25°C. Responder justificando en todos los casos su respuesta: a) En qué matraz hay más moléculas, calcule la relación entre ambos números. b) ¿Cuál es la relación entre las presiones de ambos matraces? c) ¿En qué matraz se mueven más rápido las moléculas? d) ¿En qué frasco hay mayor energía cinética? Realizar el cálculo. Rta: a) A, 8:1; b) 8:1; c) A; d) A=B, 3714,5 J/mol. 2) Un litro de oxígeno difunde a través de un agujero del tamaño de una cabeza de alfiler en 20,0 minutos. El tiempo necesario para que un litro de etano difunda a la misma temperatura a través del mismo agujero es 19,4 minutos. Calcular la masa molar del etano. Rta: 30,1 g/mol. 3) Una sala de conferencias contiene 36 hileras de asientos. Si un profesor libera gas hilarante (N2O) en la fila anterior y gas lacrimógeno (C6H11OBr) en el extremo posterior al mismo tiempo, ¿en qué hilera empezarán los alumnos a reír y llorar simultáneamente? Rta: 24. 4) Calcular la presión ejercida por 2,50 moles de CH4 (g) que a 273 K ocupan un volumen de 439,0 cm3 empleando: a) la ecuación general de los gases ideales. b) la ecuación de van der Waals. (a=2,25 atm L2 / mol2 b= 0,0428 L /mol) Rta: a) 127,5 atm; b) 95,5 atm. 5) A 0°C y 1 atm, el cociente z= PV / RT de cierto gas (1mol) es 1,00054. a) Calcular el valor de b para ese gas. b) Indicar si el cociente V / V-b es mayor, igual o menor que el cociente a / VRT. Rta: a) 0,01 dm3/mol; b) mayor. 6) Ordene las siguientes sustancias gaseosas según el orden creciente de valores del coeficiente a de van der Waals, basándose en razones estructurales: HCl, CH4, He, H2O. Compare luego con los datos que figuran tablas.